1 Introduction
Dans les agrosystèmes, les monocultures sont fréquemment envahies par des bioagresseurs, des adventices, ou encore des maladies parasitaires. Burdon et Chilvers [1] et Woolhouse et Harmsen [2] montrent que la variabilité de l'abondance des populations d'arthropodes est plus élevée dans les agrosystèmes que dans les écosystèmes naturels. La diversité réduit l'importance des pullulations dans un peuplement végétal. En effet, ces pullulations sont proportionnelles à l'abondance de leur hôte [1]. Lorsque la diversité est élevée, la plupart des espèces ont une moindre abondance. Une autre hypothèse avancée par Odum, dès 1958, est que l'augmentation de la biodiversité accroît la richesse en espèces des niveaux trophiques de rang élevé. Puisque beaucoup d'insectes sont spécialisés sur une ou un petit nombre d'espèces végétales, l'augmentation de la diversité végétale entraîne une augmentation de la diversité des phytophages et, en conséquence, de leurs prédateurs et parasites [3,4].
De nombreuses études écologiques ou agronomiques, considérant les haies comme des écosystèmes plus naturels, se sont intéressées à leurs peuplements en arthropodes [5,6]. Ces études des relations entre environnement végétal des cultures et communautés animales vont de l'échelle de la parcelle à celle du paysage [7,8]. La plupart de ces travaux montrent qu'il existe une relation croissante entre la complexité structurale des haies et la diversité spécifique de leur peuplement et qu'ainsi, la stabilité de leurs communautés pourrait être liée à la diversité des espèces [9–11]. Une des hypothèses quant à leur efficacité est que, plus il y a d'auxiliaires hébergés par les haies, plus la capacité de régulation des ravageurs des cultures est augmentée [12] ; le maintien d'une diversité végétale aux abords des vergers est donc jugé favorable pour lutter contre les ravageurs [13].
Dans le cadre de la protection intégrée des vergers, les haies composites jouent un rôle de réservoir de biodiversité pour renforcer le peuplement des auxiliaires des monocultures adjacentes [14–22]. La plantation de haies composites, réservoirs d'auxiliaires, en bordure des vergers pourrait donc être une méthode de lutte contre les ravageurs des cultures dite par « conservation » de la biodiversité. Cette méthode, si elle s'avérait efficace, répondrait à la fois aux attentes de certains professionnels et consommateurs désireux de limiter les intrants ou soucieux des effets non intentionnels des pesticides sur la santé humaine. La plupart des travaux étudiant les déplacements d'arthropodes entre les haies et les agrosystèmes ont été réalisées sur la faune des carabes, principalement actifs au sol [7,23–25] et bons indicateurs de milieu [26]. Peu d'études ont été réalisées sur la faune des frondaisons [27], malgré leur apparente richesse faunistique [28,29]. Le rôle corridor des haies a fait l'objet de nombreuses études [30–32]. Il est maintenant largement reconnu, mais peu de travaux ont montré l'influence des haies comme « source » d'auxiliaires capables de s'attaquer aux ravageurs des frondaisons. L'une des raisons qui peut être avancée est la difficulté à suivre leurs déplacements.
Cependant, si l'hypothèse d'un rôle source des haies était confirmée, ce serait une avancée supplémentaire s'agissant de leur possible utilisation dans la régulation des effectifs des populations d'insectes ravageurs des agrosystèmes arboricoles, en particulier pour ce qui concerne les vergers de poiriers, où l'importance des auxiliaires sur le contrôle du psylle est confirmée par l'existence de corrélations significatives entre les effectifs de C. pyri au printemps et la diversité des auxiliaires [33]. Dans ces vergers intensifs de poiriers du Sud-Est de la France, il peut donc se révéler très utile, dans la mise en place de la production fruitière intégrée, de vérifier l'hypothèse selon laquelle des déplacements de prédateurs ont lieu entre les haies et les vergers.
Le présent travail s'inscrit dans la continuité des recherches conduites sur la mise en place d'une agriculture durable, respectueuse de l'environnement et de la santé des consommateurs, et est réalisé au travers du suivi des déplacements de deux espèces d'arthropodes prédateurs, Forficula auricularia L. et F. pubescens Gené. La première, dont l'aire de répartition est vaste, est bien connue comme prédateur généraliste, et présente un intérêt économique certain depuis qu'elle est considérée, notamment par son impact sur les populations de pucerons, comme une espèce auxiliaire en arboriculture fruitière (pommes, poires) [34–37]. La seconde, dont la biologie est moins étudiée, est localisée dans les régions méditerranéennes, et on la trouve aussi dans le Sud de la France.
L'intérêt des forficules dans la lutte contre les ravageurs des cultures est dû entre autre à leur large gamme de proies et à leur efficacité sur certains ravageurs clés, Eriosoma lanigerum (Hausmann) « puceron lanigère », C. pyri, « psylle du poirier » et les œufs de certains lépidoptères tel Cydia pomonella (L.), « carpocapse » [38–41]. Les forficules possèdent, en outre, plusieurs atouts contribuant à la possibilité de les utiliser dans la lutte contre les ravageurs des cultures. Ainsi, leur importante population d'individus à grande mobilité, au comportement de recherche efficace [42], associé à une phéromone d'agrégation [43,44], peut laisser espérer une utilisation optimale de ce groupe dans la gestion des populations de ravageurs.
Dans cette étude, nous avons suivi le déplacement des deux espèces de forficules par la méthode du piégeage, avec marquage traumatique pour tenter de mettre en évidence un rôle « source » de la haie. Bien que l'activité nocturne des forficules rende leur suivi difficile et que certains auteurs proposent d'utiliser les déjections de forficules comme indicateur de leur présence [45], l'originalité de ce travail réside dans la méthode utilisée pour le suivi des déplacements.
2 Matériel et méthodes
2.1 Le site d'étude
Les observations ont lieu dans le domaine de l'Inra d'Avignon, et sont réalisées dans une parcelle expérimentale bordée par une haie composite. La haie a été mise en place en même temps que le verger en 1985. Irriguée au goutte à goutte, elle se compose d'essences arbustives ayant différentes propriétés vis-à-vis de l'entomofaune, Fraxinus excelsior L., Cercis siliquastrum L., Arbutus unedo L., Sambucus nigra L., Viburnum tinus L., Laurus nobilisi L., Corylus avellana L., Ligustrum vulgare L. [46]. On note aussi la présence spontanée du lierre (Hedera helix L.) qui, avec une floraison tardive et un feuillage persistant, héberge un puceron spécifique (Aphis hederae Kaltenbach) et attire une abondante faune auxiliaire avant et pendant l'hiver. Le verger expérimental, d'une superficie de 0,5 ha est constitué de 10 rangées de 21 poiriers, espacés de 4 m entre chaque pied et de 5 m d'inter-rangs (Fig. 1). Il est planté de poiriers de cultivar Général-Leclerc (variété sensible au psylle) greffés sur cognassier de Provence BA-29. Il est bordé, au nord, par une haie brise-vent composite et, au sud, par un chemin et une haie de cyprès servant de brise-vent à la culture suivante. L'irrigation se fait par micro-aspersion sous frondaisons et aspersion sur frondaisons. Depuis 1997, il n'y a plus aucun traitement insecticide dans cette parcelle.
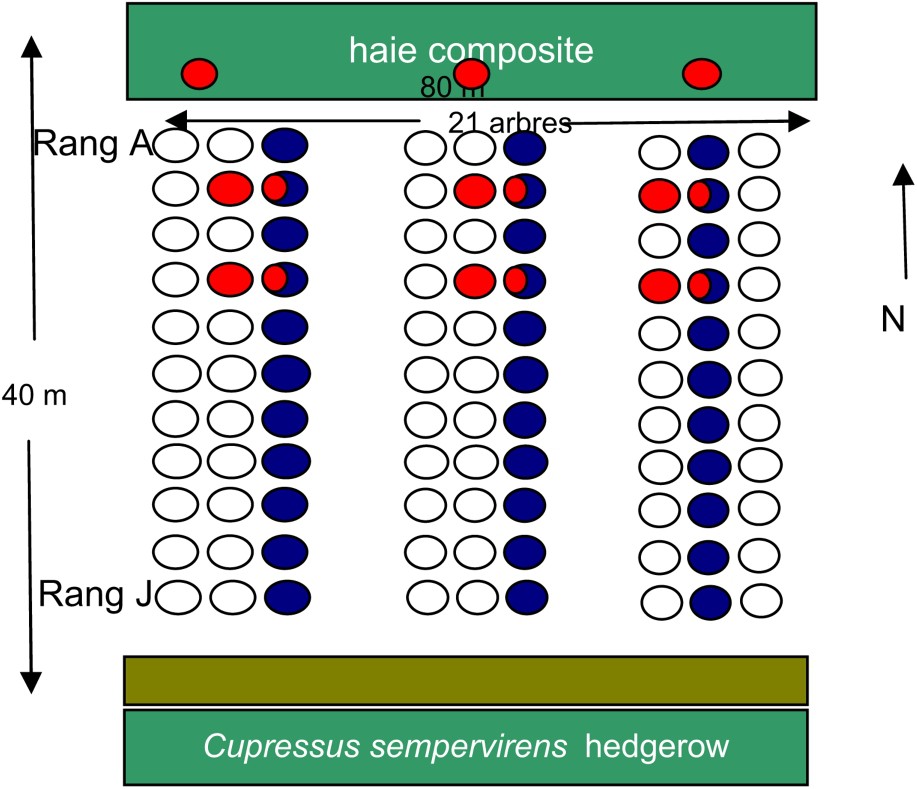
Disposition des rangs de poiriers et de la haie composite du dispositif expérimental situé sur le domaine Inra à Avignon, Sud-Est de la France. La position des pièges à forficules est en rouge (16 pièges par rang), les arbres où sont effectués les contrôles visuels de psylles sont représentés en bleu. (Le lecteur est renvoyé à la version electronique cet article pour l'interpretation des références à la couleur dans cette légende de figure.)
2.2 Le psylle commun du poirier : Cacopsylla pyri L.
Les psylles appartiennent à l'ordre des hémiptères et sont parmi les ravageurs clés en verger de poirier. Ils sont bien connus des arboriculteurs pour les dégâts qu'ils peuvent engendrer sur les parcelles. L'adulte, de forme massive, ressemble à une minuscule cigale. Il possède une tête large, avec des antennes à dix articles, un thorax bien développé, des ailes membraneuses et inégales qui sont tenues en toit sur le dos lorsque l'insecte est au repos. L'abdomen se termine par des armatures génitales dont les caractères sont utiles à l'identification. L'adulte de C. pyri présente deux types morphologiques saisonniers : une forme d'hiver plus grande, de teinte foncée, et une forme d'été plus petite, de couleur claire. Le psylle, C. pyri, est présent dans une grande partie de la France. Comme tous les psylles, il est étroitement inféodé à sa plante hôte, le poirier. Les psylles sont phytophages, ils possèdent à l'extrémité de leur rostre des organes permettant de reconnaître leurs plantes hôtes, sans recourir aux piqûres. Ils se nourrissent principalement de phloème, mais il a été montré, en particulier chez l'adulte, qu'ils étaient capables de se nourrir de toutes les catégories de tissus ; en outre, ils sont vecteurs d'une maladie à phytoplasme, le pear decline [47].
2.3 Les forficules : Forficula auricularia L. et Forficula pubescens Gené
Les forficules « perce-oreilles » constituent un petit ordre d'insectes (Dermaptères), qui compte environ 1800 espèces dans le monde. Dans les vergers du Sud de la France, nous rencontrons principalement deux espèces, F. auricularia et F. pubescens. L'espèce la plus commune en France est F. auricularia ; on la trouve dans de très nombreux milieux. Espèce plus ou moins commensale de l'homme, elle se rencontre dans les jardins et, parfois, dans les habitations. Son activité est généralement nocturne, F. auricularia se réfugiant sous les pierres, les écorces, les feuilles et les crevasses pendant la journée. Omnivore, il se nourrit de végétaux inférieurs (mousse, lichen), ainsi que de diverses parties des végétaux supérieurs (bourgeons, feuilles, fleurs, fruits). Il peut également consommer de petits arthropodes vivants ou morts, et exerce ainsi un rôle de prédateur actif sur certains ravageurs des cultures, notamment en verger de poirier, où il consomme des pucerons et des psylles.
Forficula pubescens est localisé dans les régions méditerranéennes et son activité est également nocturne ; on le trouve sur les arbustes, dans les zones herbacées, dans les jardins, sous les pierres et les débris divers durant la journée. En revanche, il n'existe que très peu de données sur son mode d'alimentation.
Les forficules sécrètent des phéromones d'agrégation grâce à leurs glandes tibiales ; la présence de cette phéromone entraîne un regroupement important des individus sous certains de leurs abris [48].
2.4 Suivi des populations et marquage traumatique des forficules
2.4.1 Les psylles
Le suivi des psylles a été réalisé de façon hebdomadaire, du 24 avril au 10 juillet 2006, selon la méthode du contrôle visuel et à raison de trois rameaux poussant par arbre et trois arbres par rang, soit 90 rameaux au total. Chaque rameau est marqué avec de la rubalise. Les rangs du verger sont notés de A à J, le rang proche de la haie composite étant A. Les larves sont dénombrées chaque semaine à l'aide d'une loupe (×10) directement sur l'arbre en partant du haut du rameau jusqu'à sa base. On différencie les larves jeunes (stades 1, 2 et 3) des larves âgées (stade 4 et 5).
2.4.2 Les forficules
Le suivi des populations est réalisé par piégeage. Le piège se compose d'une bande de carton ondulé de 15 cm de largeur et d'une longueur qui varie en fonction de la largeur du tronc de l'arbre [49] (photographie 1). Cette bande de carton, enroulée de 2 à 3 fois autour du tronc, est maintenue avec du fil de fer. Les forficules qui sont montés dans l'arbre durant la nuit se réfugient sous et dans les bandes de cartons durant la journée. Les pièges sont installés sur tous les arbres de chacun des rangs moins les deux arbres de bordures, soit un total de 16 pièges par rang. Au total, il y a 48 pièges installés, qui se répartissent de la façon suivante : 16 dans la haie, 16 dans les rangs B et D du verger. Les pièges sont relevés deux fois par semaine et sont remplacés s'ils sont trop abîmés. Le marquage des forficules est traumatique et s'effectue à l'aide d'une paire de ciseaux fins, avec lesquels on coupe l'extrémité des cerques des individus récoltés. Les deux cerques sont coupées chez les individus présents dans la haie, la cerque gauche est coupée chez les individus récoltés sur le rang B et la cerque droite est coupée chez les individus présents dans le rang D (photographie 2). Le marquage a été effectué entre le 31 mai et le 6 juin 2006. Le bilan des déplacements des forficules est réalisé pour la haie, en faisant la différence entre les individus marqués, retrouvés dans la haie, en provenance des rangs B et D (immigrants) et les individus marqués dans la haie que l'on retrouve dans le verger (émigrants). On utilise le même principe pour les rangs B et D.

Piège disposé autour des troncs d'arbres dans la haie et les rangs du verger entre le 24 avril et le 10 juillet pour étudier les mouvements de populations des deux espèces de forficules entre la haie et le verger après marquage traumatique.

Marquage traumatique des forficules piégés dans la haie et dans le verger entre le 31 mai et le 6 juin afin d'établir un bilan des déplacements des deux espèces entre la haie et le verger.
2.5 Étude du comportement alimentaire de F. pubescens
Pour en préciser le caractère omnivore, nous avons isolé 20 larves de F. pubescens dans 20 tubes contenant chacun 10 pucerons mauves, Dysaphis pyri L. et 10 larves de C. pyri. Le contrôle est journalier, le renouvellement des forficules, pucerons et psylles étant hebdomadaire, l'expérimentation conduite pendant quatre semaines. Pour connaître le preferendum alimentaire, nous avons effectué en parallèle une deuxième expérimentation, qui consiste à mettre 20 forficules dans 20 cages () dans lesquels sont introduits des jeunes rameaux infestés de psylles (œufs et larves) et de pucerons mauves (Fig. 2). Le contrôle est journalier, toutes les semaines et, pendant 4 semaines, on renouvelle les rameaux ainsi que les forficules.

Montage pour l'observation de la nutrition chez F. pubescens afin d'en étudier le preferendum alimentaire ; dans chacune des cages, 20 forficules sont introduits sur de jeunes rameaux de poirier infestés de psylles (œufs et larves) et de pucerons mauves.
3 Résultats et analyse
3.1 Suivi des populations
Pendant la durée de l'expérimentation, 20 273 larves de psylles ont été comptées, dont 13 838 larves jeunes et 6435 larves âgées. La population augmente régulièrement et le pic de pullulation des psylles est atteint le 17 mai. À partir du 23 mai et jusqu'au 7 juin 2006, la région d'Avignon subit un épisode de mistral violent, qui décime les populations larvaires. En effet, durant cette période, qui dure une quinzaine de jours, la température et l'humidité relative chutent à tel point que le miellat des psylles cristallise, entraînant une forte mortalité des larves.
Un test effectué sur la répartition des larves des psylles dans les rangs du verger montre que la population est répartie de façon significativement non homogène dans le verger. Les trois premiers rangs, proches de la haie, et le rang J sont moins peuplés que ceux du reste du verger.
Cinq mille quatre vingt-six forficules ont été piégés, dont 2191 F. auricularia et 2895 F. pubescens. La population augmente régulièrement à partir du 1er mai. Il y a une chute de la population du 28 mai au 2 juin, qui correspond à l'épisode de mistral de 15 jours. Le pic des effectifs de F. auricularia survient le 29 mai, celui de F. pubescens le 22 mai.
Les deux populations chutent après l'épisode de mistral (Figs. 3 et 4). Par la suite, F. pubescens reste présent dans le verger, avec un deuxième pic le 9 juin, alors que F. auricularia disparaît presque totalement du verger. Au total, 1894 forficules sont piégés dans le rang B, 1749 forficules dans le rang D, et 1443 dans la haie (Figs. 5 et 6). Le test effectué sur la répartition des effectifs montre une population répartie de façon non homogène dans la haie et le verger, pour les deux espèces.

Évolution globale des populations de larves âgées de psylles et de F. auricularia échantillonnés dans le verger de poiriers entre le 24 avril et le 10 juillet 2006.

Évolution globale des populations de larves jeunes de psylles et de F. pubescens échantillonnés dans le verger de poiriers entre le 24 avril et le 10 juillet 2006.

Évolution des populations de F. auricularia dans la haie et dans le verger de poiriers entre le 24 avril et le 10 juillet.
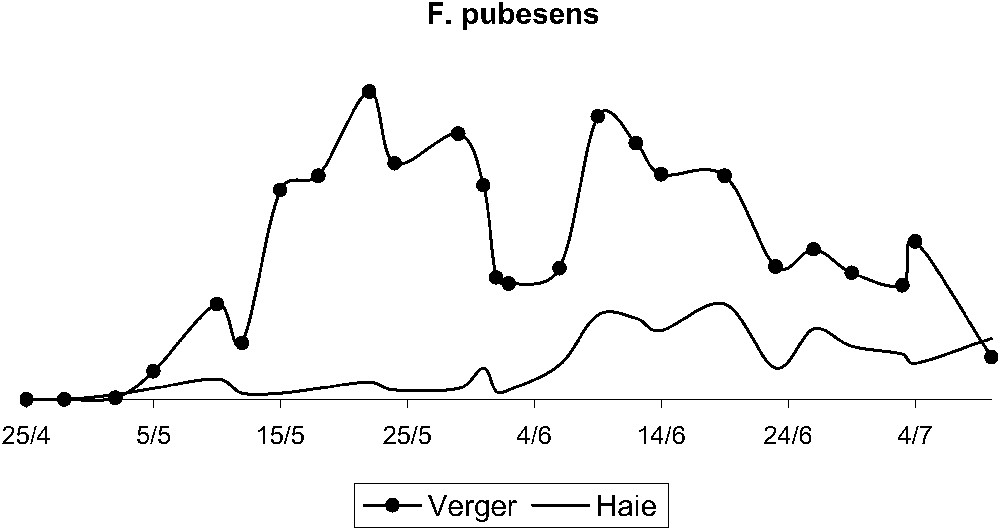
Évolution des populations de F. pubescens dans la haie et dans le verger de poiriers entre le 24 avril et le 10 juillet.
3.2 Caractère omnivore de F. pubescens
Lors de la première expérience en laboratoire, toutes les larves de C. pyri et de D. pyri ont été consommées. Lors de la seconde expérience sur le preferendum, les larves F. pubescens ont consommé 89% des pucerons, 95% des œufs de psylles et 75% des jeunes larves de psylles (stade 1 à 3), seul 10% des larves âgées sont consommées. En revanche, aucun dégât n'est constaté sur les rameaux.
3.3 Étude des déplacements
3.3.1 Déplacements globaux
À partir du 31 mai et jusqu'au 6 juin, 754 forficules sont capturés, marqués et relâchés. Par la suite, 460 seront capturés à nouveau, soit 60% du total des individus marqués et plus de 9% de la population totale piégée. D'une façon globale, le rang D cède des forficules au profit de la haie, alors que les effectifs dans le rang B ne varient pas.
3.3.2 Déplacements espèce par espèce
Un effectif de 452 F. auricularia a été marqué et relâché, 241 étant à nouveau capturés, soit 53% des effectifs marqués et 11% des effectifs totaux piégés. Pour F. pubescens, 219 individus sur les 302 marqués sont capturés à nouveau, soit 73% des effectifs marqués et 7,6% des effectifs totaux.
Un test de conformité de moyenne effectué sur les effectifs re-capturés de chaque espèce dans la haie montre que les déplacements, espèce par espèce, ne sont pas nuls : F. auricularia, P-value < 0,0001 ; F. pubescens : P-value < 0,001. Le test d'homogénéité de moyenne effectué sur les effectifs des deux espèces re-capturées dans la haie montre qu'il y a bien une différence significative entre les mouvements de F. auricularia et ceux de F. pubescens, P-value < 0,0001. Les deux espèces ont des déplacements en sens contraires. Les déplacements de F. auricularia s'effectuent du verger vers la haie (Fig. 7), alors que les déplacements F. pubescens s'effectuent de la haie vers le verger (Fig. 8).

Bilan global des déplacements de F. auricularia, en pourcentage des effectifs, entre la haie et le verger de poiriers du 24 avril au 10 juillet.

Bilan global des déplacements de F. pubescens, en pourcentage des effectifs, entre la haie et le verger de poiriers du 24 avril au 10 juillet.
Les tests d'homogénéité effectués sur les effectifs des deux espèces dans le verger montrent que, quelle que soit l'espèce considérée, les déplacements effectués à partir de chaque rang sont identiques entre eux, F. auricularia ; P-value = 0,927 et F. pubescens ; P-value = 0,703. Autrement dit, aucun des rangs ne cède ou ne récupère plus d'effectif. Ces mouvements sont également observables grâce à l'évolution de la répartition des deux espèces dans le verger et la haie. F. auricularia est présent majoritairement dans le verger du 25 avril au 6 juin. Après le pic de pullulation, sa répartition change et F. auricularia est principalement capturé dans la haie du 9 juin au 3 juillet, alors que, pour F. pubescens, la répartition ne varie pas, il y a toujours un effectif plus élevé capturé dans le verger que dans la haie.
4 Discussion
Les populations de psylles et de forficules présentent des caractéristiques spécifiques dans leur répartition. Pour les psylles, les résultats obtenus montrent un gradient croissant des effectifs, allant des rangs proches de la haie vers les rangs les plus éloignés.
S'il y a action de la faune auxiliaire, elle agit plus facilement dans les rangs proches de la haie, puis chacun des rangs du verger parallèles à la haie agirait comme une barrière qui freinerait la dispersion des prédateurs, et donc la régulation des effectifs de psylles.
Le dernier rang est peu peuplé, mais ce déficit d'effectif peut s'expliquer, d'une part, par la présence du chemin à proximité : les engins agricoles, passant en moyenne deux fois par jour sur ce chemin, soulèvent de fines particules d'argile, qui se déposent sur les poiriers et agissent comme une barrière physique en protégeant les feuilles des phytophages [50,51]. Par ailleurs, la haie de cyprès peut, localement, occasionner des changements microclimatiques (écran au rayonnement, ombre portée), qui entraînent une baisse de la densité de feuillage des poiriers dans ce rang [52]. Or, les effectifs de psylles sont dépendants de l'état de leurs plantes hôtes. Les poiriers présentant un feuillage moins important sont délaissés par le ravageur [53].
L'évolution des effectifs de psylles est marquée, dans cette étude, par une perturbation climatique. Une chute importante de la population de psylle s'est produite à partir du 30 mai ; elle correspond à un fort épisode de mistral qui a duré 15 jours, du 23 mai au 7 juin.
Durant cette période, le miellat des psylles s'est cristallisé et les larves sont mortes à l'intérieur. La population de larves âgées est alors pratiquement détruite ; elle passe de 3187 individus durant le pic à 36 individus le 7 juin, soit une perte de 99%. La population de jeunes larves subit moins de perte ; elle passe de 3756 individus durant le pic à 660 individus le 7 juin, soit une perte de 82%. Cette différence s'explique par la présence toujours importante des adultes durant cette période. Les adultes toujours présents dans le verger ont continué à pondre. Les nouvelles larves qui éclosent après cette période reconstituent un effectif de jeunes larves.
Les effectifs de forficules capturés dans la haie sont plus faibles que ceux capturés dans le verger (Figs. 5 et 6). Cela traduit en fait une plus grande complexité de la haie, qui offre plus de micro-habitats que le verger. En conséquence, la probabilité pour qu'un forficule y soit piégé est moindre dans la haie que dans le verger. Dans des études similaires, certains auteurs ayant utilisé la même méthode de piégeage font état d'une interaction compétitive entre les abris et l'habitat environnant. Ils trouvent des effectifs de forficules inférieurs dans les vergers enherbés que dans ceux désherbés à l'aide d'herbicides chimiques [42,54,55].
Dans cette étude, F. auricularia et F. pubescens sont présents tous les deux dans le verger, les deux espèces pouvant donc entrer en compétition. Cependant, le pic de F. auricularia concorde avec celui des larves âgées de psylle, alors que le pic de F. pubescens concorde avec celui des jeunes larves de psylle. Ainsi, il y aurait une spécialisation du régime alimentaire des deux espèces, confirmée en laboratoire pour F. pubescens, cette spécialisation leur permettrait de cohabiter sans entrer en compétition lorsqu'elles sont présentes en même temps dans le verger. Plus qu'une spécialisation, on peut penser que F. pubescens restreint la niche écologique de F. auricularia aux larves âgées de psylles. Diverses hypothèses peuvent être avancées pour expliquer ce phénomène, entre autre un comportement de prédation journalier, décalé et plus précoce pour F. pubescens que pour F. auricularia. La constatation d'une spécialisation alimentaire est aussi appuyée par le comportement de F. auricularia durant la période de mistral qui a provoqué une chute importante de la population larvaire des psylles. En effet, cette chute des effectifs a surtout affecté le comportement de F. auricularia, F. pubescens restant en revanche bien présent dans le verger, avec un deuxième pic en date du 9 juin. Ce pic ne semble cependant pas lié aux psylles, dont les effectifs sont en phase de régression à cette date, mais plutôt à la présence de pucerons sur les plantes de l'inter-rang. Durant cette période, nous observons des effectifs importants de pucerons Aphis fabae Scopoli et Brachycaudus spp., bien visibles sur diverses composées, principalement le cirse (Cirsium arvense L.), le crepis (Crepis foetida L.) et les picris (Picris echioides L., Picris hieracioides L.).
Une étude récente menée à la fois sur l'herbe de Guinée Panicum maximum Jacquemin, graminée pérenne touffue et vigoureuse et le ravageur Chilo partellus Swinhoe a montré le double rôle de cette plante en bordure de culture, d'abord comme réservoir d'auxiliaires, mais aussi puits pour le ravageur [56]. Des allers-retours entre la « plante piège » et la culture ont lieu. Dans notre étude, les déplacements de F. auricularia et de F. pubescens ne s'effectuent pas dans le même sens et à la même période. Pour F. auricularia, on constate qu'ils s'effectuent majoritairement du verger vers la haie, et que le sens de ce mouvement est en relation avec la chute, dans le verger, des effectifs de larves âgées de psylles. Le verger est déserté par F. auricularia, qui n'aurait plus assez de proies. Par ailleurs, si dans la haie, nous avons retrouvé des individus marqués dans le verger, nous en avons aussi retrouvé dans un verger d'abricotiers distant de 150 m du verger de poiriers (43 F. auricularia marqués dans les rangs B et D ont ainsi été retrouvés dans ce verger d'abricotiers). L'augmentation des effectifs de F. auricularia piégés dans la haie durant cette période témoigne du fait que l'espèce quitte le verger à cette période. On peut concevoir que la haie et ses alentours, qui abritent de nombreux autres phytophages, sont à nouveau explorés par le prédateur quand le verger n'offre plus assez de proies, la haie retrouvant alors sa fonction de réservoir. S'agissant de F. pubescens, le mouvement s'effectue surtout de la haie vers le verger et s'explique par la présence constante de larves jeunes de psylles, puis par la présence des pucerons observées sur les adventices. Le verger reste un milieu attractif pour F. pubescens, qui y trouve sa nourriture, et c'est cette fois la fonction de « source » qui est jouée par la haie.
5 Conclusions
L'application de la méthode de marquage traumatique expérimentée ici montre que les deux espèces sont inféodées aux psylles du poirier. Elle confirme le caractère entomophage de F. pubescens et met en évidence une spécialisation alimentaire. Les deux espèces peuvent ainsi coloniser le verger et cohabiter sans entrer en compétition. Cette étude souligne un rôle important de la haie, non seulement celui déjà connu de maintien, près du verger de poiriers, de prédateurs tels que les forficules, mais aussi celui de « source » d'auxiliaires pour le verger. La haie permet aux forficules de « coloniser » le verger lorsqu'il offre des effectifs de proies suffisants. Elle peut servir aussi d'abri, si les conditions dans le verger deviennent défavorables. Cette expérimentation devra être reconduite sur un nombre plus important de parcelles afin de confirmer les premiers résultats obtenus.


