La version française de l’article est disponible à la suite de la version anglaise
Plant adaptation to a terrestrial lifestyle around 450 million years shaped our planet ecosystems [1]. The macroscopic life that was restricted to aquatic environments before was able to expand to emerged habitats thanks to this first level of a trophic food web.
This adaptation to a new niche happened in a single lineage among streptophytes algae and gave rise to all extant land plants (Figure 1A). Those plants gained multiple new traits to survive in their new environment including desiccation resistance, UV resistance, respiration and the ability to access the water and minerals necessary for their growth and reproduction [2]. Understanding the processes by which the first land plants were able to accumulate those adaptations is an ongoing topic in plant research and more and more studies contribute to fill this gap in our knowledge on earth history.
Arbuscular mycorrhiza symbiosis is conserved across land plants. (A) Simplified phylogenetic tree of the main land plant families. Plants can be divided in two groups. Vascular plants contain flowering plants (angiosperms), gymnosperms, ferns (monilophytes) and lycophytes. Non-vascular plants or bryophytes contain mosses, liverworts and hornworts. Plant adaptation to terrestrial lifestyle preceded the diversification of those families. To understand this adaptation, it is possible to reconstruct the traits of the last common ancestor of land plants to compare those traits in distant extant lineages such as flowering plants and liverworts. (B,C) Symbiotic structures are similar in phylogenetically distant plants.During the interaction with the mycorrhizal fungi Rhizophagus irregularis, fungal structures called arbuscules contained in plant cells are forms. The fungus here dyed with ink formed arbuscules in the root of the flowering plant Medicago truncatula (B) and in the thalli of the liverwort Marchantia paleacea (C). (D) Orthologous genes are upregulated during AMS across land plants. Heatmap (left panel) of the gene expression of a selection of genes in Marchantia paleacea at 3, 5 and 8 weeks post inoculation compared to control. Induction of orthologous genes during AMS in flowering plants is shown in grey (right panel). Marpal: Marchantia paleacea. Medtru: Medicago truncatula. Poptri: Populus trichocarpa. Helann: Helianthus anuus. Pethyb: Petunia hybrida. Orysat: Oryza sativa. Credits: Morgane Le Marquer, Mélanie Rich.
Around 40 years ago, scientists proposed that one of the secrets to land adaptation by plants was their ability to establish mutually beneficial symbiotic relationships with fungi [3]. Most extant plants species establish a specific interaction, the arbuscular mycorrhiza symbiosis (AMS) with belowground fungi of the Glomeromycota family [4]. During this interaction, plants and fungi exchange nutrients in structures called arbuscules. Plants take advantage of their ability to fix atmospheric carbon to produce a carbon source for the fungi. In exchange, the fungi use their hyphal networks to gather water and minerals, sometimes at great distances from the plants.
Therefore, the AMS observed in extant plants could have, if indeed it was present, helped overcome two of the obstacles met by the first land plants: find the water and minerals necessary for their growth. If this hypothesis was raised several decades ago, the tools necessary to test it had only been developed recently.
1. Pinpointing the origin of AMS
How can we determine if a specific trait was present in organisms that disappeared several million years ago? Some fossil evidence going as far back as 407 million years show structures resembling arbuscules in plant tissues, but neither the date, nor the morphology of those plants (closer to the vascular plants) suggest that those could be close to the first land plants [5].
To study the biology of an extinct organism, it is possible to reconstruct certain traits by comparing them in the descendants of this organism. Using the parsimony principle and comparing distant plant lineages such as the flowering plants and the liverworts (Figure 1A), we can define that the shared features of those lineages were evolutionarily conserved and inherited from their common ancestor.
More than 20 years of genetic studies of the AMS revealed several molecular mechanisms participating in the establishment and function of this symbiosis is flowering plants [6]. Genes involved in plant/fungus communication, accommodation of the fungi inside the plant cells and the transport of nutrients between host and symbiont have been described in species such as Medicago and rice.
To determine if those mechanisms already existed in the last common ancestor of land plants, we set out to determine if they exist in lineages phylogenetically distant from the flowering plants. A model for genetics in liverworts, Marchantia polymorpha, was already developed for evolution studies [7] but this species has the particularity of being the only one from the Marchantia genus unable to engage in AMS [8]. We therefore established a new model plant, Marchantia paleacea, and developed genetic and genomic tools to study the AMS in liverworts.
2. Comparing symbiosis across land plants
In flowering plants, AMS induces an extensive reprogrammation of gene expression in the roots hosting the arbuscules. In Marchantia thalli, we observed that the symbiosis initiate a similar transcriptional response with a growing number of genes induced in mycorrhized plants across time and more than 1200 genes induced after 8 weeks of interaction with the fungi [9].
To compare the transciptomic response to AMS across land plants, we collected available data in Medicago truncatula, Helianthus annuus (sunflower), Petunia hybrida, Oryza sativa (rice) and Populus trichocarpa (poplar). Using the bioinformatics tool Orthofinder [10], we determined the orthology relationships of the genes of those angiosperm species and Marchantia. Genes of those different species sharing a common origin were sorted in orthogroups and we found that some orthogroups contain genes upregulated during AMS in all the plants of our sampling. Notably, we found 46 orthogroups (with a total of 68 M. paleacea genes) upregulated in M. paleacea and at least 3 of the 5 angiosperms (Figure 1D). Some of those genes have known functions during the symbiosis in flowering plants and together they encompass all the steps leading to a functional symbiosis. Finding genes with a common origin expressed in similar condition across several lineages suggest that their function is conserved.
3. Plant/fungus lipid exchanges are an ancient and conserved feature of the AMS
To confirm the function of some of those genes in the symbiosis of M. paleacea, we explored some symbiotic mechanisms in more details. It had been shown in Medicago truncatula that plants deliver lipids to the fungus [11, 12]. In addition, genomic studies of the arbuscular mycorrhizal fungus clade, the Glomeromycota showed that the genome of those organisms lacked key genes involved in fatty acid biosynthesis [13], possibly explaining the status of those fungi as obligate biotrophes. From this, we expected lipid transfer from plant to fungi to be an ancient and conserved feature of the symbiosis.
We were indeed able to show transfer of lipids from M. paleacea to its symbiotic fungi using a specific fatty acid thioesterase (FatB) producing unusual 12 carbons fatty acids. Fungi grown in contact to plants expressing this gene in arbuscule containing cells accumulated C12 fatty acids, showing direct transfer of this compound.
From our transcriptomic analysis of AMS in M. paleacea, we identified candidate genes for lipid biosynthesis (RAM2C), lipid transporters (STR, STR2) and a transcription factor (WRI) potentially regulating this process during AMS (Figure 1D). By inactivating the transcription factor WRINKLE (WRI) using the CRISPR/Cas9 molecular scissors, we were able to prevent the formation of mature arbuscules and rendered the symbiosis non-functional [9]. We also showed that overexpression of this transcription factor activates genes of the lipid metabolism in Marchantia and that WRI directly binds to the promoter of RAM2C, similarly to what had been described in the flowering plant Medicago truncatula [14, 15, 16]. We can therefore determine that both lipid transfer from plant to fungi and the regulation of this process is conserved in those two species.
We can also suggest that this had been inherited from the last common ancestor of land plants and conserved in in all mycorrhizal land plants.
4. How conserved is AMS in land plants?
The conservation of symbiotic mechanisms across land plants is not restricted to lipid transfer. Genes of the signaling module allowing plant cells to recognize the fungi are conserved specifically in species able to establish such symbiosis and lost in species that lost symbiosis [17]. This suggests that their role in AMS is also conserved across land plants.
In addition, we recently demonstrated that plant chemical communication with the fungi had also been present since the last common ancestor of land plants. Strigolactones act as a chemical signal around roots of flowering plants that is necessary to the initiation of the symbiosis [18]. The inactivation of CAROTENOID CLEAVAGE DIOXYGENASE8 (CCD8), a key enzyme in the production of strigolactones in M. paleacea prevents the production of this compound by the plant and the recruitment of the fungi present in their growing substrate. This effect can be reverted by applying GR24, a synthetic strigolactone, in the medium (Figure 2) [8]. In flowering plants, strigolactones have a dual function in symbiosis and as a plant hormone controlling the plant architecture. Interestingly, we showed that in liverworts, the role of strigolactones is strictly symbiotic [8] and that these molecules acquired their role as interkingdom signals first and became plant hormones later in plant evolution and only in some plant lineages.
The symbiotic function of some genes is conserved across land plants. Fluorescent microscopy of Marchantia paleacea thalli sections showing the mycorrhizal fungi in green (WGA-alexa488 staining) and the chlorophyll in red. The wild type plant (WT) is colonized by the fungi that form arbuscules in the cells below the photosynthetic layer. The fungi do not colonize the ccd8ab mutant that does not produce strigolactones. Exogenous treatment with GR24, a synthetic strigolactone analog restores the symbiosis in this mutant.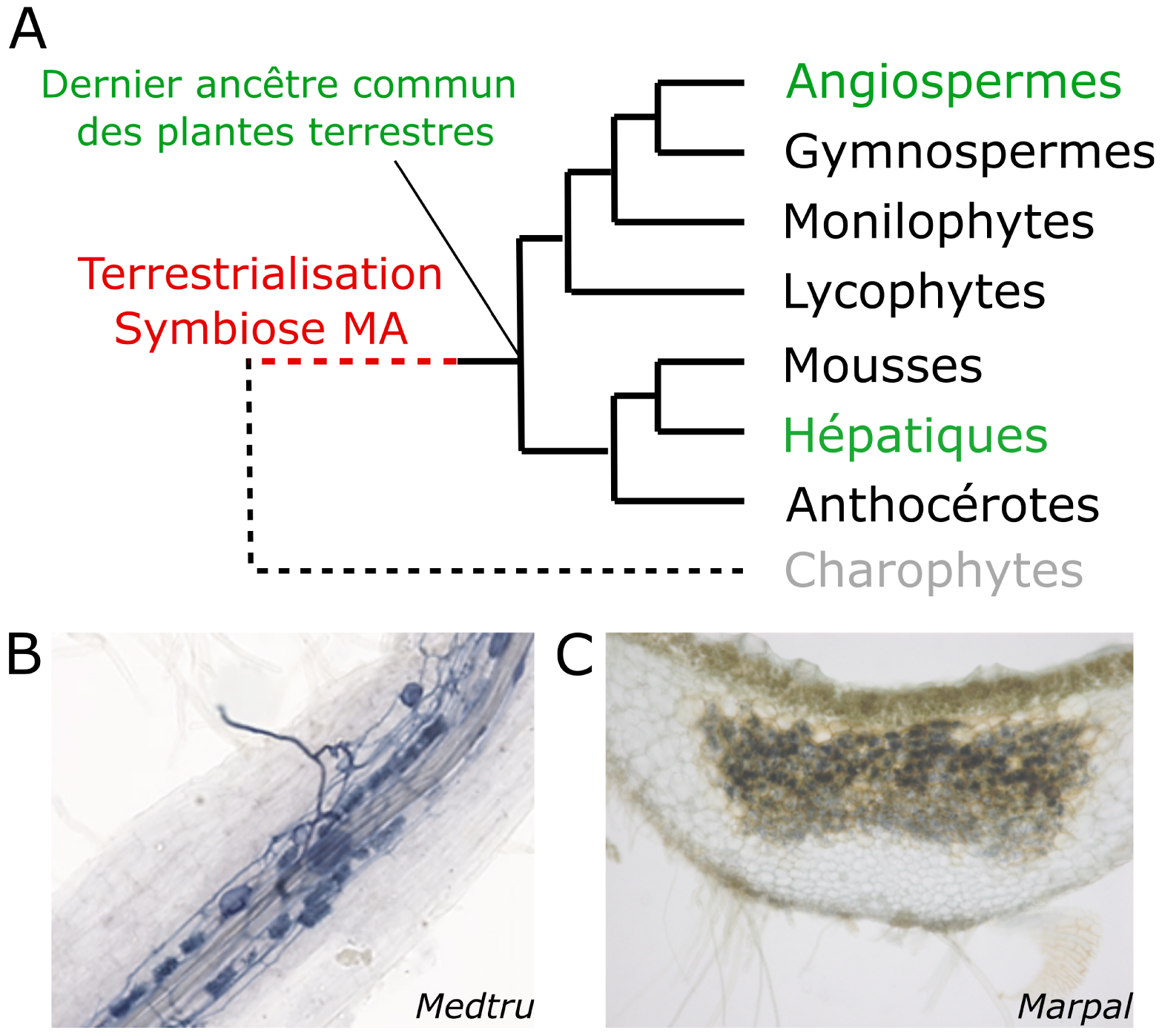
If the full extent of which the AMS is conserved in land plants is still unknown, we already know of some complex mechanisms that have been inherited from the last common ancestor of land plants. Whether some other features such as cell colonization mechanisms, arbuscule turnover and regulation of the symbiosis by environmental conditions are also conserved remain to be discovered.
This ancestral symbiosis that we are reconstructing most probably played a significant role in the success of this particular plant lineage that diversified to give rise to all extant land plants. It also was so mutually beneficial for the two symbionts that it still exists some 450 million years later in the vast majority of plants.
Conflicts of interest
The author has no conflict of interest to declare.
Version française
L’adaptation des plantes à un mode de vie terrestre vers 450 millions d’années a façonné les écosystèmes de notre planète [1]. La vie macroscopique qui était auparavant limitée aux environnements aquatiques a pu s’étendre aux habitats émergés grâce à ce premier niveau d’un réseau trophique alimentaire.
Cette adaptation à une nouvelle niche s’est produite dans une seule lignée d’algues streptophytes et a donné naissance à toutes les plantes terrestres actuelles (Figure 1A). Ces plantes ont acquis de multiples nouvelles caractéristiques pour survivre dans leur nouvel environnement, notamment la résistance à la dessiccation, la résistance aux UV, la respiration et la capacité d’accéder à l’eau et aux minéraux nécessaires à leur croissance et à leur reproduction [2]. Comprendre les processus par lesquels les premières plantes terrestres ont pu accumuler ces adaptations est un sujet d’actualité dans la recherche sur les plantes et de plus en plus d’études contribuent à combler cette lacune dans nos connaissances sur l’histoire de la Terre.
La symbiose mycorhizienne à arbuscules est conservée chez les plantes terrestres. (A) Un arbre phylogénétique simplifié des principales familles de plantes terrestres. Les plantes peuvent être divisées en deux groupes. Les plantes vasculaires comprennent les plantes à fleurs (angiospermes), les gymnospermes, les fougères (monilophytes) et les lycophytes. Les plantes non vasculaires ou bryophytes comprennent les mousses, les hépatiques et les anthocérotes. L’adaptation des plantes au mode de vie terrestre a précédé la diversification de ces familles. Pour comprendre cette adaptation, il est possible de reconstituer les caractères du dernier ancêtre commun des plantes terrestres pour les comparer à ceux de lignées extensives éloignées comme les plantes à fleurs et les hépatiques. (B,C) Les structures symbiotiques sont similaires chez des plantes phylogénétiquement éloignées. Lors de l’interaction avec le champignon mycorhizien Rhizophagus irregularis, des structures fongiques appelées arbuscules contenues dans les cellules végétales se forment. Le champignon ici teinté à l’encre a formé des arbuscules dans la racine de la plante à fleurs Medicago truncatula (B) et dans les thalles de l’hépatique Marchantia paleacea (C). (D) Les gènes orthologues sont régulés à la hausse pendant l’AMS chez les plantes terrestres. Carte thermique (panneau de gauche) de l’expression génétique d’une sélection de gènes chez Marchantia paleacea à 3, 5 et 8 semaines après l’inoculation par rapport au contrôle. L’induction de gènes orthologues pendant la MSA chez les plantes à fleurs est indiquée en gris (panneau de droite). Marpal : Marchantia paleacea. Medtru : Medicago truncatula. Poptri : Populus trichocarpa. Helann : Helianthus anuus. Pethyb : Petunia hybrida. Orysat : Oryza sativa. Crédits : Morgane Le Marquer, Mélanie Rich.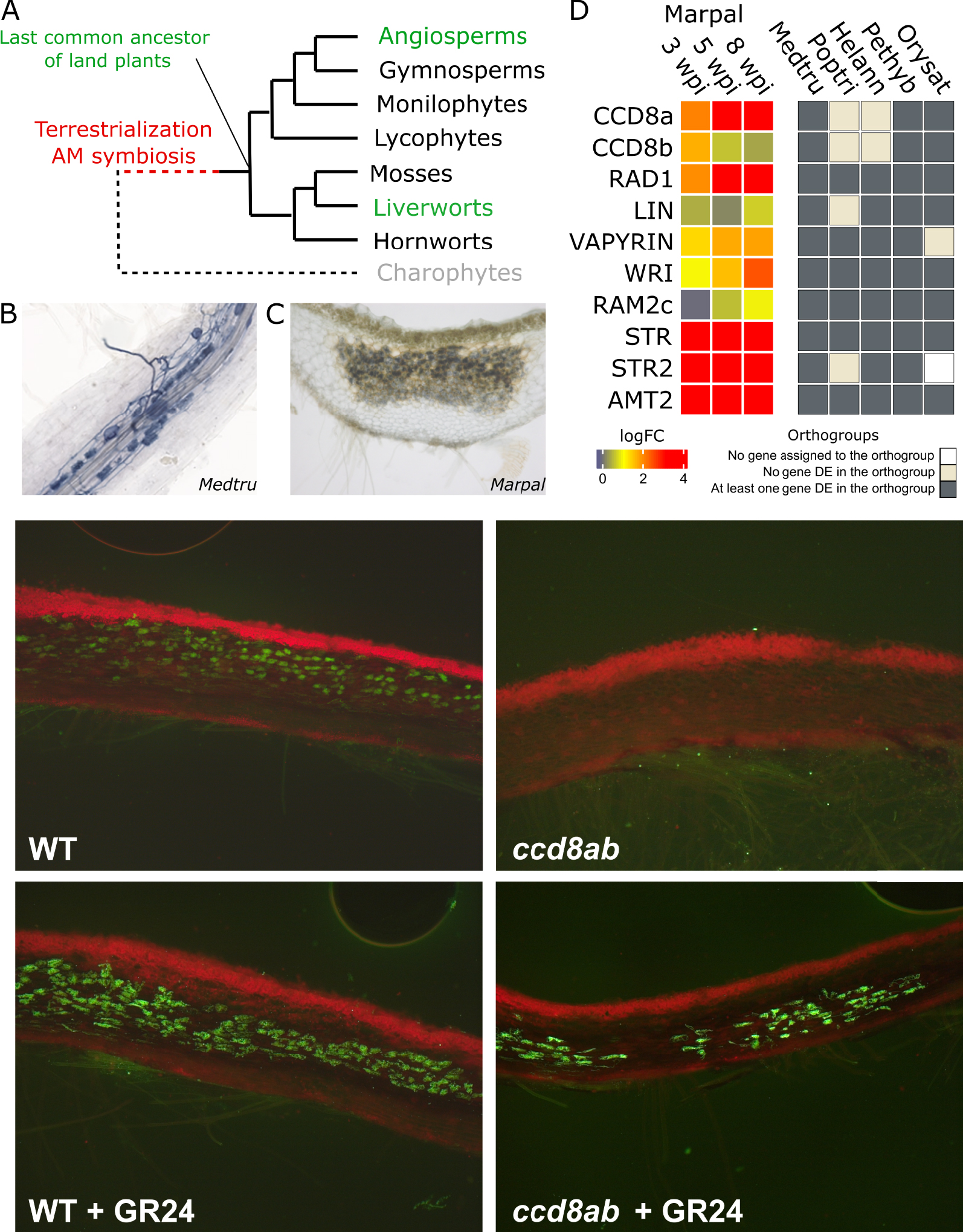
Il y a environ 40 ans, les scientifiques ont proposé que l’un des secrets de l’adaptation des plantes à la terre fût leur capacité à établir des relations symbiotiques mutuellement bénéfiques avec des champignons [3]. La plupart des espèces végétales existantes établissent une interaction spécifique, la symbiose mycorhize à arbuscules (SMA), avec des champignons souterrains de la famille des Glomeromycota [4]. Au cours de cette interaction, les plantes et les champignons échangent des nutriments dans des structures appelées arbuscules. Les plantes tirent parti de leur capacité à fixer le carbone atmosphérique pour produire une source de carbone pour les champignons. En échange, les champignons utilisent leurs réseaux d’hyphes pour recueillir de l’eau et des minéraux, parfois à de grandes distances des plantes.
Ainsi, la SMA observée chez les plantes existantes aurait pu, si elle était effectivement présente, aider à surmonter deux des obstacles rencontrés par les premières plantes terrestres : trouver l’eau et les minéraux nécessaires à leur croissance. Si cette hypothèse a été soulevée il y a plusieurs décennies, les outils nécessaires pour la tester n’ont été développés que récemment.
1. Déterminer l’origine de la SMA
Comment déterminer si un trait spécifique était présent dans des organismes qui ont disparu il y a plusieurs millions d’années ? Certaines preuves fossiles remontant jusqu’à 407 millions d’années montrent des structures ressemblant à des arbuscules dans des tissus végétaux, mais ni la date ni la morphologie de ces plantes (plus proches des plantes vasculaires) ne suggèrent que celles-ci pourraient être proches des premières plantes terrestres [5].
Pour étudier la biologie d’un organisme éteint, il est possible de reconstruire certains traits en les comparant chez les descendants de cet organisme. En utilisant le principe de parcimonie et en comparant des lignées végétales éloignées telles que les plantes à fleurs et les hépatiques (Figure 1A), nous pouvons définir que les caractéristiques communes de ces lignées ont été conservées au cours de l’évolution et héritées de leur ancêtre commun.
Plus de 20 ans d’études génétiques de la SMA ont révélé plusieurs mécanismes moléculaires participant à l’établissement et au fonctionnement de cette symbiose chez les plantes à fleurs [6]. Des gènes impliqués dans la communication plante/champignon, l’accommodation des champignons à l’intérieur des cellules de la plante et le transport des nutriments entre l’hôte et le symbiote ont été décrits chez des espèces telles que Medicago et le riz.
Pour déterminer si ces mécanismes existaient déjà chez le dernier ancêtre commun des plantes terrestres, nous avons cherché à savoir s’ils existent dans des lignées phylogénétiquement éloignées des plantes à fleurs. Un modèle de génétique chez les hépatiques, Marchantia polymorpha, avait déjà été développé pour l’étude de l’évolution [7] mais cette espèce a la particularité d’être la seule du genre Marchantia à ne pas pouvoir s’engager dans la SMA [8]. Nous avons donc établi une nouvelle plante modèle, Marchantia paleacea, et développé des outils génétiques et génomiques pour étudier la symbiose mycorhizienne chez les hépatiques.
2. Comparaison de la symbiose chez les plantes terrestres
Chez les plantes à fleurs, la SMA induit une reprogrammation importante de l’expression des gènes dans les racines accueillant les arbuscules. Chez les thalles de Marchantia, nous avons observé que la symbiose initie une réponse transcriptionnelle similaire avec un nombre croissant de gènes induits dans les plantes mycorhizées à travers le temps et plus de 1200 gènes induits après 8 semaines d’interaction avec les champignons [9].
Pour comparer la réponse transciptomique à la SMA chez les plantes terrestres, nous avons rassemblé les données disponibles chez Medicago truncatula, Helianthus annuus (tournesol), Petunia hybrida, Oryza sativa (riz) et Populus trichocarpa (peuplier). En utilisant l’outil bioinformatique Orthofinder [10], nous avons déterminé les relations d’orthologie des gènes de ces espèces d’angiospermes et de Marchantia. Les gènes de ces différentes espèces partageant une origine commune ont été triés en orthogroupes et nous avons constaté que certains orthogroupes contiennent des gènes régulés pendant la SMA dans toutes les plantes de notre échantillon. Notamment, nous avons trouvé 46 orthogroupes (avec un total de 68 gènes de M. paleacea) régulés dans M. paleacea et au moins 3 des 5 angiospermes (Figure 1D). Certains de ces gènes ont des fonctions connues pendant la symbiose chez les plantes à fleurs et, ensemble, ils englobent toutes les étapes menant à une symbiose fonctionnelle. La découverte de gènes ayant une origine commune et exprimés dans des conditions similaires dans plusieurs lignées suggère que leur fonction est conservée.
3. Les échanges lipidiques plante/champignon sont une caractéristique ancienne et conservée de la SMA
Pour confirmer la fonction de certains de ces gènes dans la symbiose de M. paleacea, nous avons exploré plus en détail certains mécanismes symbiotiques. Il avait été montré chez Medicago truncatula que les plantes délivrent des lipides au champignon [11, 12]. En outre, des études génomiques du clade des champignons mycorhiziens à arbuscules, les Glomeromycota, ont montré que le génome de ces organismes était dépourvu de gènes clés impliqués dans la biosynthèse des acides gras [13], ce qui pourrait expliquer le statut de ces champignons en tant que biotrophes obligatoires. Nous nous attendions donc à ce que le transfert de lipides de la plante au champignon soit une caractéristique ancienne et conservée de la symbiose.
Nous avons en effet pu montrer le transfert de lipides de M. paleacea vers ses champignons symbiotiques en utilisant une thioestérase d’acide gras spécifique (FatB) produisant des acides gras inhabituels à 12 carbones. Les champignons cultivés en contact avec des plantes exprimant ce gène dans des cellules contenant des arbuscules ont accumulé des acides gras C12, montrant le transfert direct de ce composé.
A partir de notre analyse transcriptomique de la SMA chez M. paleacea, nous avons identifié des gènes candidats pour la biosynthèse des lipides (RAM2C), des transporteurs de lipides (STR, STR2) et un facteur de transcription (WRI) candidat à la régulation de ce processus pendant la SMA (Figure 1D). En inactivant le facteur de transcription WRINKLE (WRI) à l’aide des ciseaux moléculaires CRISPR/Cas9, nous avons pu empêcher la formation d’arbuscules matures et rendre la symbiose non fonctionnelle [9]. Nous avons également montré que la surexpression de ce facteur de transcription active les gènes du métabolisme lipidique chez Marchantia et que WRI se lie directement au promoteur de RAM2C, de façon similaire à ce qui avait été décrit chez la plante à fleurs Medicago truncatula [14, 15, 16]. Nous pouvons donc déterminer que tant le transfert de lipides de la plante vers les champignons que la régulation de ce processus sont conservés chez ces deux espèces.
Nous pouvons ainsi suggérer que ce processus a été hérité du dernier ancêtre commun des plantes terrestres et qu’il est conservé chez toutes les plantes terrestres mycorhizées.
4. Quel est le degré de conservation de la SMA chez les plantes terrestres ?
La conservation des mécanismes symbiotiques chez les plantes terrestres ne se limite pas au transfert de lipides. Les gènes du module de signalisation permettant aux cellules végétales de reconnaître les champignons sont conservés spécifiquement chez les espèces capables d’établir une telle symbiose et perdus chez les espèces qui ont perdu la symbiose [17]. Cela suggère que leur rôle dans le SMA est également conservé chez les plantes terrestres.
En outre, nous avons récemment démontré que la communication chimique des plantes avec les champignons était également présente depuis le dernier ancêtre commun des plantes terrestres. Les strigolactones agissent comme un signal chimique autour des racines des plantes à fleurs qui est nécessaire à l’initiation de la symbiose [18]. L’inactivation du gène CAROTENOID CLEAVAGE DIOXYGENASE8 (CCD8), codant pour une enzyme clé dans la production de strigolactones chez M. paleacea empêche la production de ce composé par la plante et le recrutement des champignons présents dans leur substrat de croissance. Cet effet peut être inversé en appliquant du GR24, une strigolactone synthétique, dans le milieu (Figure 2) [8]. Chez les plantes à fleurs, les strigolactones ont une double fonction dans la symbiose et comme hormone végétale contrôlant l’architecture de la plante. De manière intéressante, nous avons montré que chez les hépatiques, le rôle des strigolactones est strictement symbiotique [8] et que ces molécules ont donc d’abord acquis leur rôle de signaux inter-règne et sont devenues des hormones végétales plus tard dans l’évolution des plantes et seulement dans certaines lignées végétales.
La fonction symbiotique de certains gènes est conservée chez les plantes terrestres. Microscopie fluorescente de sections de thalles de Marchantia paleacea montrant les champignons mycorhiziens en vert (coloration WGA-alexa488) et la chlorophylle en rouge. La plante de type sauvage (WT) est colonisée par les champignons qui forment des arbuscules dans les cellules situées sous la couche photosynthétique. Les champignons ne colonisent pas le mutant ccd8ab qui ne produit pas de strigolactones. Un traitement exogène avec GR24, un analogue synthétique de la strigolactone, restaure la symbiose chez ce mutant.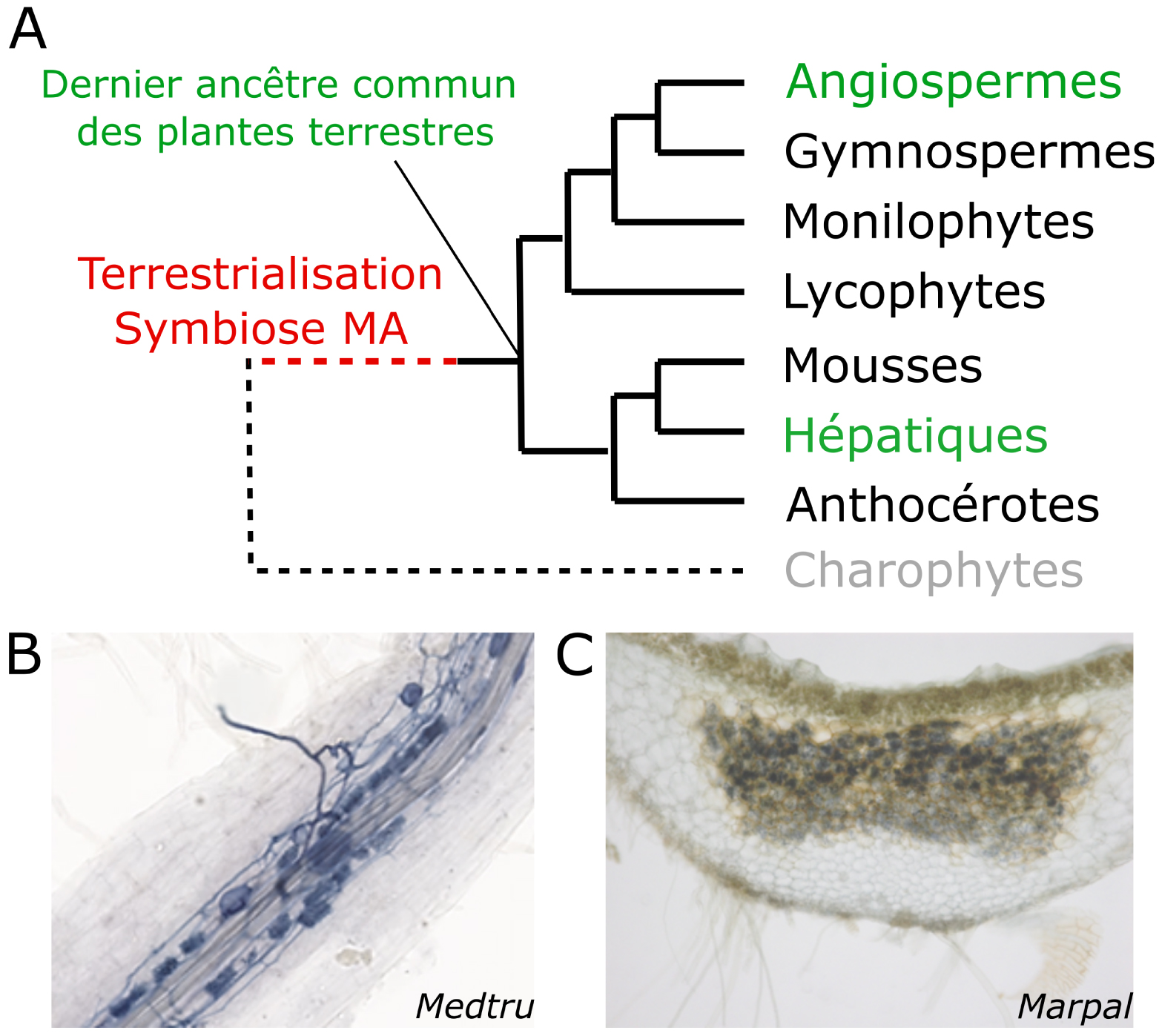
Si l’on ignore encore dans quelle mesure le SMA est conservé chez les plantes terrestres, nous savons déjà que certains de ses mécanismes complexes qui ont été hérités du dernier ancêtre commun des plantes terrestres. Il reste à découvrir si d’autres caractéristiques telles que les mécanismes de colonisation cellulaire, le renouvellement des arbuscules et la régulation de la symbiose par les conditions environnementales sont également conservées.
Cette symbiose ancestrale que nous reconstituons a très probablement joué un rôle important dans le succès de cette lignée végétale particulière qui s’est diversifiée pour donner naissance à toutes les plantes terrestres actuelles. Elle a résulté en une interaction si mutuellement bénéfique pour les deux symbiotes qu’elle existe encore quelque 450 millions d’années plus tard dans la grande majorité des plantes.
Conflit d’intérêt
L’auteur n’a aucun conflit d’intérêt à déclarer.




 CC-BY 4.0
CC-BY 4.0