1. Introduction
The COVID-19 epidemic has led to a focus on repositioning older drugs that have already received marketing authorization (MA) for other therapeutic indications. Understandably, the context of an unpredictable epidemic against which no drug existed, needed adapting certain procedures to speed up the clinical trials. Unfortunately, too many trials, often redundant and with significant methodological biases, were published prematurely and often in haste. Many non-randomized trials conducted without a placebo group and with too few patients or with questionable endpoints have failed to conclude with certainty on the efficacy of the tested treatments. An opinion of the French National Academies of Medicine and Pharmacy, as well as, of the French Academy of Sciences recalled that a therapeutic trial meets methodological rules, as well as, deontological and ethical imperatives and that the transgression of these principles do not accelerate treatment discovery [1].
The objective of this article is to discuss the different approaches that have been followed in the attempt to discover effective drugs against SARS-CoV-2 infection. To inhibit virus multiplication, it is needed to understand the cellular and molecular mechanisms of the viral cycle, allowing to identify key pharmacological targets. Apart from the viral infection the most severe stage of the disease is also characterized by a paradoxical inflammation (“cytokine storm”) with respiratory distress that may be associated with an endothelial disease, incl. vascular thrombosis. Therapeutic strategies are therefore based (i) on the search for antiviral drugs that aim to disrupt the intracellular entry or transport of the virus and the replication of its genome, and (ii) on the treatment of uncontrolled inflammation produced by an excessive immune response.
2. Viral cell cycle and potential pharmacological targets
SARS-CoV-2 is a single-stranded RNA enveloped virus. These viruses use the molecular machinery of cells for viral multiplication. Infection usually occurs in three stages: (i) entry of the virus, (ii) release of the viral genome into the cell cytoplasm where the viral RNA will be copied to form new viral particles, and (iii) exit from the cell (Figure 1). Each of these steps may constitute a therapeutic target that can disrupt the infection cycle [2].
Entry into the cell usually occurs via a mechanism of membrane fusion or endocytosis, mediated by a receptor present on the cell surface. In the case of SARS-CoV-2, the Angiotensin Converting Enzyme Receptor (ACE2) is the primary route of entry for the virus. This receptor is expressed for 80% in type II pulmonary alveolar cells, but also in the nasal mucosa, upper respiratory tract, vascular endothelium, cardiac, renal and digestive tissues. The serine protease TMPRSS2, which is highly expressed by endothelial cells in the respiratory and digestive tracts, also appears to play an important role as a co-receptor for the virus. After internalization, the viral particle is found in an intracellular vacuole (endosome) that will progressively become acidified by a proton pump. In general, internalized viruses therefore transit through these acidic compartments (pH 6.0 to 4.5), before exiting via complex mechanisms such as the fusion of the viral envelope membrane with the endosomal membrane, followed by the expulsion of the viral capsid into the cell cytoplasm.
The viral RNA will then replicate and produce the proteins necessary to reconstitute the viral nucleocapsid proteins, spicule and lipid envelope. The maturation of the viral proteins will take place through proteases, while the viral RNA will be produced through the intervention of an RNA polymerase. The assembly of viral proteins and viral RNA will result in the formation of mature virions that will leave the cell by exocytosis before infecting other cells. Coronaviruses typically use vesicles of the biosynthetic secretion pathway to exit the cell. However, a very recent study [3] suggests that this classical pathway is not followed by SARS-CoV-2 and that, on the contrary, it uses a non-lytic and non-conventional lysosomal pathway for exocytosis. This mechanism takes place through the inactivation of lysosomal enzymes associated with the inhibition of the acidification of these vesicles. This hypothesis, which needs, however, to be confirmed, illustrates the complexity of the mechanisms implemented during the viral cycle.
Diagram representing the cycle of viral multiplication with the biological targets and different drug candidates (in red). The different stages of the viral cycle involve complex phenomena of membrane fusion and self-assembly with envelope proteins and viral RNA. The above schematic layout is a very simplified summary of the viral cycle.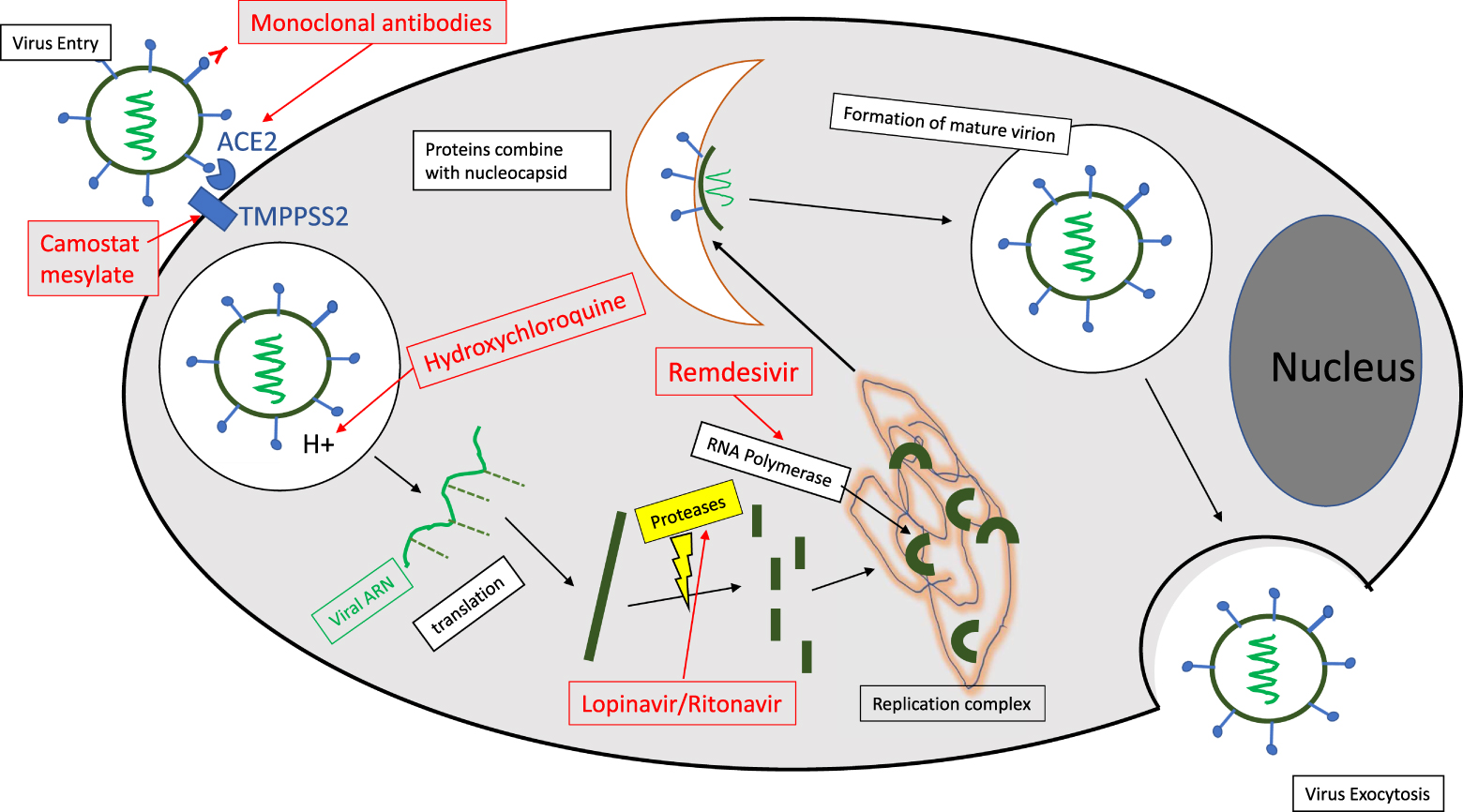
Several therapeutic approaches have been considered: (i) inhibiting the entry of the virus using monoclonal antibodies, or small molecules directed against the ACE2 receptor or the TMPPSS2 co-receptor, (ii) blocking the acidification of the endosomes and thus preventing the transfer of the genetic material into the cell cytoplasm (Hydroxychloroquine), although this strategy would be counterproductive if the above-mentioned lysosomal exocytosis pathway was confirmed and (iii) inhibiting viral particle reconstruction by antiproteases or anti RNA polymerases (Lopinavir/Ritonavir and Remdesevir). The results obtained will be detailed at a later stage but none of these approaches seems to have led to validated therapeutic results to date.
3. Paradoxical inflammation
While in the majority of cases, COVID-19 remains a benign disease, more serious forms may nevertheless appear with severe pulmonary damage, leading to respiratory distress requiring patients to be placed on oxygen therapy or even resuscitation, possibly with intubation. These more severe forms of the disease are associated with uncontrolled, “paradoxical” inflammation, at the heart of which cytokines play a major role. While type I interferon (IFN) and interleukin-7 are essential for triggering an effective immune response against the infection, others appear to be very damaging, such as interleukin-6, interleukin-1β and TNF-α, which trigger the cytokine storm. In addition, a defective response of IFN type I can lead to immunodeficiency, while IL-7 is necessary to restore the lymphocyte repertoire [4]. In severe cases, the integrity of the epithelio-endothelial (blood-air) barrier is even disrupted (Figure 2). In addition to alveolar damage, it has been shown that the virus can also infect the endothelial cells of the pulmonary capillaries. A large amount of exudate will then leak into the pulmonary alveoli and activate the release of pro-inflammatory cytokines and chemokines from the alveolar macrophages and epithelial cells. Due to lymphocyte dysfunction, the adaptive immune response cannot be properly established. While viral infection often results in excessive macrophage infiltration with worsening lung injury, the damage can also spread to other organs, such as heart tissue, kidneys or the digestive system [5]. The vascular attack by SARS- CoV-2 can then induce thromboembolic disorders in these organs.
The steps of Covid-19. On the left, the benign disease is overcome by adaptive immunity. On the right, the severe form of the disease is associated with the cytokinic storm, the rupture of the epithelio-endothelial barrier at the pulmonary level and the endothelial attack leading to microcirculation dysfunctions. Adapted from Li et al. [5].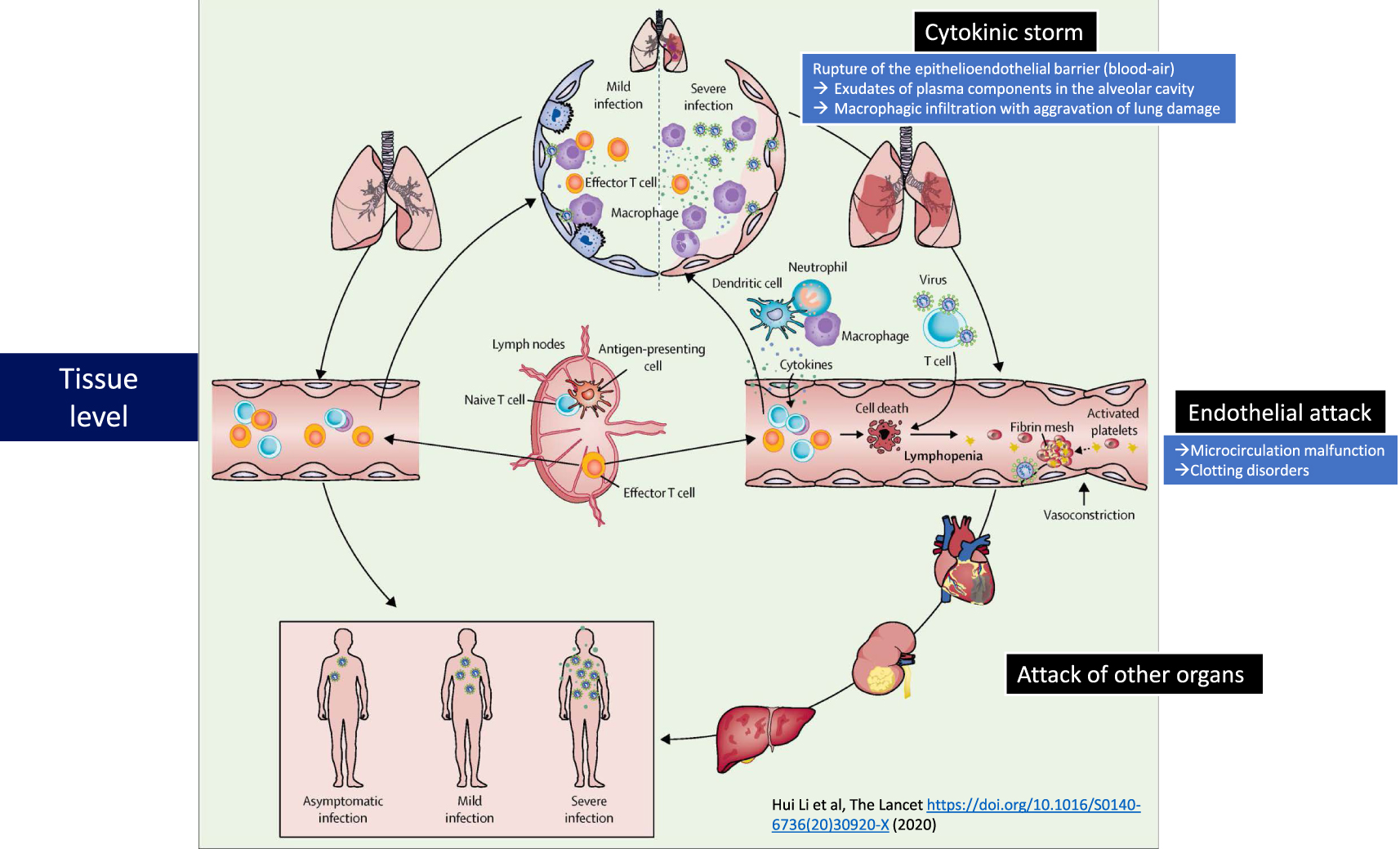
All the mechanisms underlying the vicious circle related to the excessive production of pro-inflammatory cytokines and the resulting cellular and tissue damage, are unfortunately not yet fully elucidated. And the polyphasic nature of the disease still makes therapeutic approaches difficult, in particular to identify the stage of the disease and the optimal time for treatment.
However, alongside antiviral approaches, the control of the inflammation using certain anti-inflammatory cytokines, anticytokine antibodies, or small molecules with anti-inflammatory activity, such as corticosteroids, clearly constitutes the second pillar of the fight against the disease, which will be discussed below.
4. Anti-Covid-19 drugs
4.1. Preliminary remark
In addition to the fact that many people are healthy and asymptomatic carriers of the virus, the disease usually begins with atypical symptoms (dry cough, fever to a greater or lesser extent). In general, SARS-CoV-2 infected patients (about 85%) will see their situation to evolve favorably towards a spontaneous recovery without after-effects. Only a small proportion with respiratory insufficiency will be hospitalized, possibly in intensive care following the paradoxical inflammatory reaction discussed above. This quick clinical picture is useful to understand the difficulty of the pharmacological approach. In fact, at the beginning of the disease, patients with reduced symptomatology and a high chance of spontaneous recovery are addressed; it is therefore not recommended to administer antiviral drugs with possible important side effects. Similarly, drugs with anti-inflammatory activity may be counterproductive by reducing the body’s natural responses at the onset of the infection. It should also be taken into account that many elderly patients, with possible co-morbidities, are often multi-medicated and the possibility of drug interactions must therefore be taken into consideration. On the other hand, for patients who have had an unfavorable evolution and require emergency hospitalization, antiviral treatment may be too late, especially since the viral load is strongly reduced at this stage of the disease. Rather, it is the secondary inflammatory reaction and the cytokine storm that must be controlled. Finally, since the mortality rate represents only a small percentage of the infected population, clinical trials must benefit from patient cohorts that are sufficiently large to reach a statistical significance threshold allowing valid conclusions to be drawn.
4.2. Antiviral drugs
4.2.1. Antibodies and plasma from convalescent patients
Some studies have taken advantage of the affinity of the virus’s spike protein for ACE2 to develop antibodies capable of inhibiting the entry of the virus into the cell. This therapeutic approach must, therefore, be applied at the onset of the infection. For example, Wu et al. isolated two neutralizing antibodies from a convalescent patient (B38 and H4). These two antibodies have shown ability to hinder the binding of the viral spike protein to the ACE2 cell receptor, both antibodies acting at different sites of the spike protein. A preclinical study in a mouse model confirmed that these antibodies could reduce virus titers in infected lungs. It is expected that this pair of antibodies will be used together in future clinical applications [6]. Bamlanivimab, another antibody directed against an ACE2 receptor recognition protein [7], has been provisionally approved by the FDA for patients testing positive for COVID-19 and at risk of developing the most severe forms of the disease.
On the other hand, plasma from convalescent infected patients (CPP) was considered to neutralize SARS-CoV-2 as this approach had already been successfully used in other coronavirus epidemics. In addition to the direct neutralization of the virus, CPP was found to reduce the cytokine storm, the Th1/Th17 ratio, and the complement activation [8]. For example, a recent study of 10 patients with a severe form of the infection showed that one dose (200 ml) of convalescent patient plasma was well tolerated and allowed the maintenance of neutralizing antibodies at a high level with disappearance of viremia in 7 days and improvement of clinical symptoms in 3 days [9]. Other trials seem to confirm this observation.
4.2.2. Nucleoside analogues with anti-protease activity (Figure 3)
Remdesivir is a nucleoside analogue that has RNA polymerase inhibitory activity, thus disrupting the production of viral RNA. This compound has a phosphoramid prodrug-like activity because it has to be metabolized to become pharmacologically active. In vitro, Remdesivir has shown positive results with a broad spectrum of activity against SARS-CoV and MERS-CoV; it has also demonstrated activity in several in vivo pre-clinical models, notably in the MERS-CoV infected primate [10]. In human clinical trials, Remdesevir has been tested for the treatment of Ebola infection but with little efficacy. Initial information regarding the treatment of patients with COVID-19 has been published in the form of anecdotal case reports, often in compassionate use programs and with small numbers of patients. The first randomized clinical trial was carried out with patients recruited by about ten Chinese hospitals, notably in Wuhan [11]. A total of 158 patients were treated with Remdesevir, when 79 other patients received a placebo. The use of Remdesivir did not show any statistically significant clinical benefit and adverse events were even reported in 66% of cases. Even though the European Commission has given the green light for the conditional marketing of Remdesivir, the French High Authority for Health (HAS) considers now the medical service provided to be poor, because none of the randomized clinical trials published to date has shown a significant superiority of Remdesivir over standard medical care.
Lopinavir and Ritonavir are antivirals, originally developed to fight HIV infection. They act as protease inhibitors, which prevent the virus from producing the proteins and enzymes necessary for replication. Lopinavir is rapidly metabolized by cytochrome P450 and is therefore administered in combination with Ritonavir, an anti-protease agent that decreases Lopinavir’s metabolism. This allows reducing the doses of Lopinavir, a compound associated with significant side effects (mainly digestive and more rarely neurological). Noteworthy, this combination should be used with caution in patients with cardiac pathologies (arrhythmia, ischemia etc.). While preclinical trials have shown significant antiviral activity of the Lopinavir/Ritonavir combination, clinical trials conducted on patients infected with SARS and MERS were inconclusive, although one non-randomized trial on a very small number of patients showed a decrease in viral load [12]. The combination Lopinavir/Ritonavir has also been the subject of a clinical trial conducted on 199 patients with COVID-19, but no advantage over standard treatments could be demonstrated [13].
MK-4482/EIDD-2801 is a prodrug of a nucleoside analogue (N4-hydroxycytidine) with influenza virus activity, repositioned for the treatment of SARS-CoV-2. Compared to many other nucleoside analogues, this molecule has the advantage of an excellent oral bioavailability. Very recently, a study conducted in ferrets showed that the oral treatment with EIDD-2801 induced both a very significant attenuation of the infection and a strong inhibition of the virus transmission [14]. This is a particularly interesting result because of the similarities in the spread of the virus in ferrets and in humans. A double-blind, placebo-controlled Phase I/II clinical trial (NCT04405570 and NCT04405739) is currently ongoing [15].
4.2.3. Hydroxychloroquine (Figure 3)
As early as the 1960s, the antiviral activity of chloroquine (and hydroxychloroquine) was demonstrated in vitro in several studies, including in cellular models of coronavirus infection. Indeed, hydroxychloroquine was shown to prevent the acidification of lysosomes which, in theory, disrupts the transfer of viral genetic material to the cell cytoplasm. Very recently, it has been shown on Vero cells infected with COVID-19 that chloroquine and hydroxychloroquine significantly reduced the viral load, although with slightly different mechanisms [16]. Hydroxychloroquine alone or in combination with other active ingredients has resulted in more than 160 clinical trials to date (ClinicalTrials.gov). Some of them, conducted by Raoult et al. at the Marseille University Hospital [17], have shown a decrease in viral load in nasopharyngeal samples, particularly when hydroxychloroquine was administered orally in combination with Azithromycin, a macrolide antibiotic. These trials are, however, highly controversial because they do not meet the international criteria for a good clinical trial practice. The main reasons for this are as follows: (i) a very small number of patients, (ii) numerous statistical biases, (iii) the inclusion of non-randomized patients and/or (iv) the absence of placebo arms or control patients. In total, none of the trials conducted to date have demonstrated the efficacy of hydroxychloroquine. Moreover, the therapeutic doses of hydroxychloroquine used in many of these trials remained close to those that may lead to cardiovascular side effects, particularly in predisposed individuals (often elderly with co-morbidities).
Due to the lack of objective data, the WHO has terminated the SOLIDARITY study and the Agence Nationale de Sécurité des Médicaments in France (ANSM) considers “the benefit/risk of these treatments outside of clinical trials to be unfavorable”.
4.2.4. Interferon
Interferons alpha and beta (type I interferons) are recombinant glycoproteins with antiviral and immunoregulatory activity that activate NK cells and lymphocytes. According to a recent study [18], severe forms of SARS-CoV-2 infection, characterized by a persistent blood viral load and an exacerbated inflammatory response, appear to be directly related to a deficiency of type I interferons and caused by nuclear transcription factor-κB. Thus, a randomized, open-label Phase 2 trial has examined the effect of interferon beta-1b in combination with Lopinavir/Ritonavir treatment [19]. This triple therapy was associated with a significant reduction in the duration of the viral shedding (negative nasopharyngeal swab), as well as, with a reduction in symptoms and length of hospital stay. However, the patients included in this study had mild to moderate disease and no mortality was recorded in either the control or treated group. It remains uncertain whether similar results could be obtained in patient populations with severe COVID-19. Of note, interferon therapy is not without significant side effects. On the other hand, another recent study has shown that interferons can stimulate the expression of virus entry pathways (i.e., ACE2 and its co-factor TMPPSS2) and it cannot be excluded that SARS-CoV-2 may exploit this positive regulation of ACE2 to boost infection [20]. Interferon treatments should therefore be conducted with great caution and future clinical trials should be conducted with rigorous methodologies, especially since the mechanisms of action of type I interferons are not yet fully elucidated.
Chemical structure of antiviral (A) or anti-inflammatory (B) small molecules in clinical trials, alone or in combination.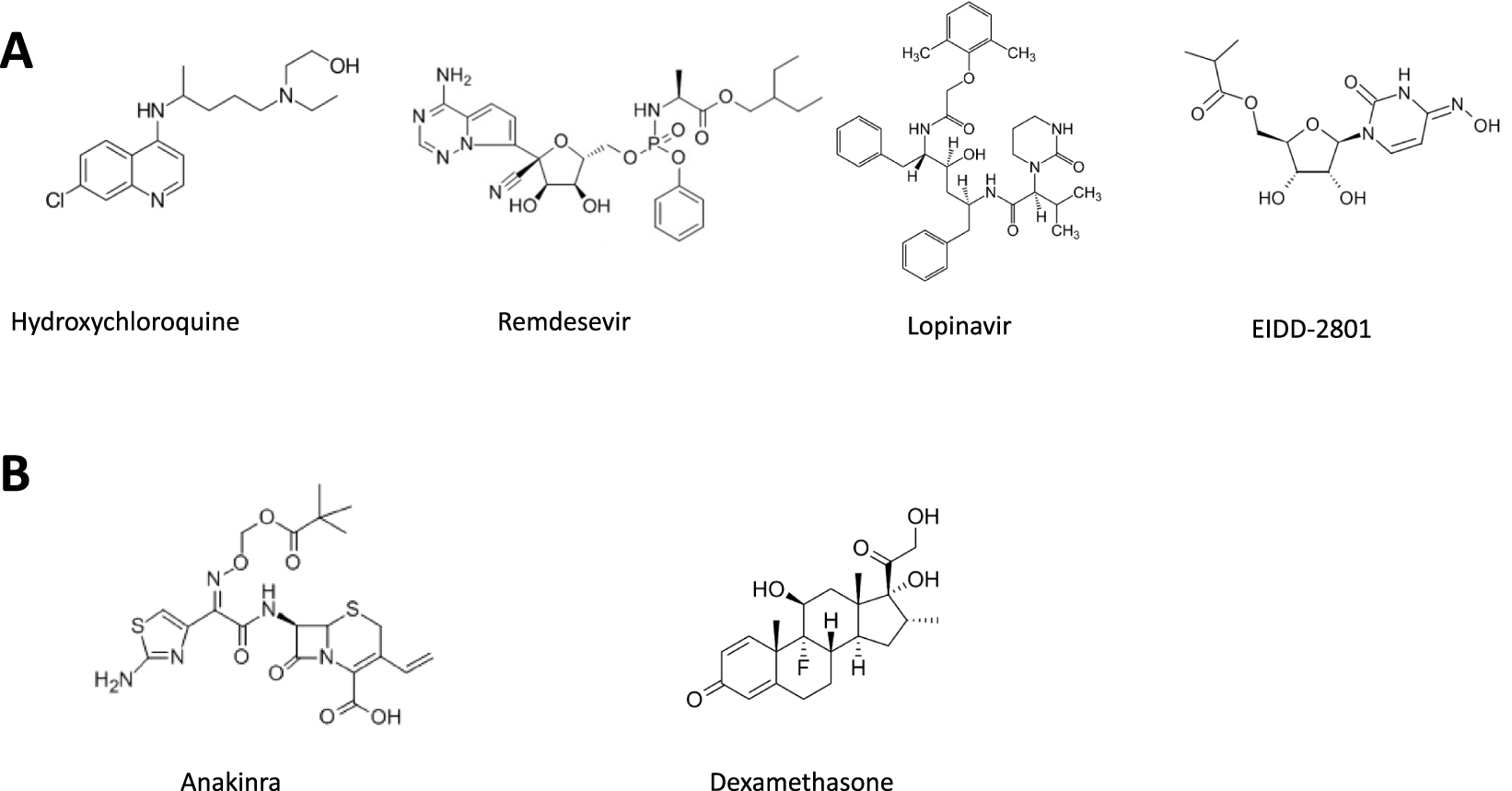
4.3. Anti-inflammatory medications
4.3.1. Dexamethasone and other synthetic corticosteroids (Figure 3)
Dexamethasone is a synthetic glucocorticoid with anti-inflammatory activity that can lead, at high doses, to a reduction in immune response and cytokine storm. Although early reports discouraged the use of corticosteroids because of the risk of diminishing the immune response to viral infection [21], subsequent publications showed, on the contrary, that these drugs could improve clinical signs and reduced patient mortality. Thus, a meta-analysis coordinated by the WHO and the University of Bristol included 7 international studies conducted in 12 countries with a total of 1703 patients [22]. And a 21% reduction in all-cause mortality was observed at 28 days when patients were treated with dexamethasone, hydrocortisone or methylprednisolone versus placebo and standard care. And the benefit appeared to be even greater in patients on mechanical ventilation (30% lower mortality). Other studies have confirmed the efficacy of dexamethasone in severe forms of the disease. No repositioned drug has so far shown such activity.
4.3.2. Anti-cytokine drugs: Tocilizumab and Anakinra (Figure 3)
Tocilizumab is an anti IL-6 monoclonal antibody and Anakirna a small molecule, antagonist of the IL-6 and IL-1 receptors, two major players in the cytokine storm. A multicenter, randomized, controlled trial using Tocilizumab has been authorized in China in patients undergoing cytokine storm and respiratory depression [23]. The results were as follows: 15 of 20 patients (75.0%) reduced their oxygen consumption and one patient no longer required oxygen therapy. Scans showed that the opacity of lung lesions was reduced in 19 patients (90.5%). The percentage of lymphocytes in peripheral blood returned to normal in 52.6% of patients by the fifth day after treatment. Finally, abnormally high levels of C-reactive protein were significantly reduced in 84.2% of patients [23]. The combination of Tocilizumab with synthetic glucocorticoids also improved the condition of patients with severe disease. Thus, a retrospective analysis was performed in patients subject to cytokine storm defined by specific inflammatory markers (i.e., ferritin > 700 ng/mL, C-reactive protein > 30 mg/dL or lactate dehydrogenase > 300 U/L). Groups of patients treated with corticosteroids in combination with Tocilizumab had superior survival rates, as compared to treatment with corticosteroids alone or even in combination with Anakinra [24]. Anakirna had already shown anticytokinic activity during septic shock secondary to infection [25]. Another retrospective study carried out on 1092 patients also demonstrated the clinical benefit of the treatment combining corticosteroids and Tocilizumab [26].
4.3.3. Anticoagulants
Nearly half of the patients with the most severe manifestations of COVID-19 experience bleeding disorders, of which pulmonary embolism is an important component [27]. The occurrence of thromboembolic events is attributed to the cytokine storm associated with an increase in angiotensin II [28]. Changes in coagulation parameters are mainly accompanied by an increase in D-Dimer [27]. Therefore, the French Interest Group in Perioperative Hemostasis and the French Study Group on Hemostasis and Thrombosis have recommended to treat the patients preventively with anticoagulants (low molecular weight heparin or Fondaparinux) with an attentive monitoring of their hemostasis. In addition to their anticoagulant properties, low molecular weight heparins also appear to reduce IL-6 production. However, the most effective doses are still debated.
5. Conclusion
The discovery and development of effective drugs against SARS-CoV-2 clearly represents a major medical challenge. At the time of writing this article, no new molecule has yet been approved to treat the infection or its clinical signs. Therapeutic approaches have so far converged towards the repositioning of old drugs (i.e., small synthetic molecules or biomolecules), already used for the treatment of other pathologies to make medications available more rapidly to patients, since their mode of action and biopharmaceutical and toxicological profiles are already well identified. Clinical trials, which are sometimes too numerous and contradictory, have received excessive media coverage despite obvious methodological shortcomings. Others have, fortunately, been conducted with greater rigor. They generally aim to directly disrupt the viral cycle or to fight against paradoxical inflammation and vascular disease. Although no drug currently makes it possible to completely eradicate the infection and cure all patients, less than a year after the beginning of the epidemic, undeniable therapeutic progresses have nevertheless been obtained, thanks to the use of molecules with anti-inflammatory activity (corticosteroids and/or anticytokines of biological origin) associated or not with the use of anticoagulants. In the future, the emergence of new drugs will certainly result from a better understanding of the molecular and cellular mechanisms of the infection, as well as, of the physiopathological mechanisms, both still poorly understood. This research must be encouraged to enable chemists and biologists to produce novel and more effective molecules.
French version
1. Introduction
L’épidémie de la COVID-19 a conduit à privilégier le repositionnement de médicaments anciens ayant déjà bénéficié d’une autorisation de mise sur le marché (AMM) pour d’autres indications thérapeutiques. On peut comprendre que le contexte d’une épidémie imprévisible contre laquelle aucun médicament n’existait, nécessitait d’adapter certaines procédures en vue d’accélérer les essais cliniques. Malheureusement, des essais trop nombreux, souvent redondants et avec d’importants biais méthodologiques ont été publiés de manière prématurée et souvent dans la précipitation. Beaucoup d’essais réalisés sans groupe placébo et avec un trop petit nombre de patients ou encore avec un critère de jugement discutable n’ont pas permis de conclure avec certitude sur l’efficacité de tel ou tel traitement. Un avis des Académies nationales de Médecine et de Pharmacie ainsi que de l’Académie des Sciences a rappelé qu’un essai thérapeutique répond à des règles méthodologiques ainsi qu’à des impératifs déontologiques et éthiques et que la transgression de ces principes ne favorise pas la découverte rapide d’un traitement [1].
Schéma représentant le cycle de la multiplication virale avec les cibles biologiques visées par différents candidats médicaments (en rouge). Les différentes étapes du cycle viral impliquent des phénomènes complexes de fusions membranaires et d’autoassemblage avec les protéines d’enveloppe et l’ARN viral. Le schéma ci-dessus est un résumé très simplifié du cycle viral.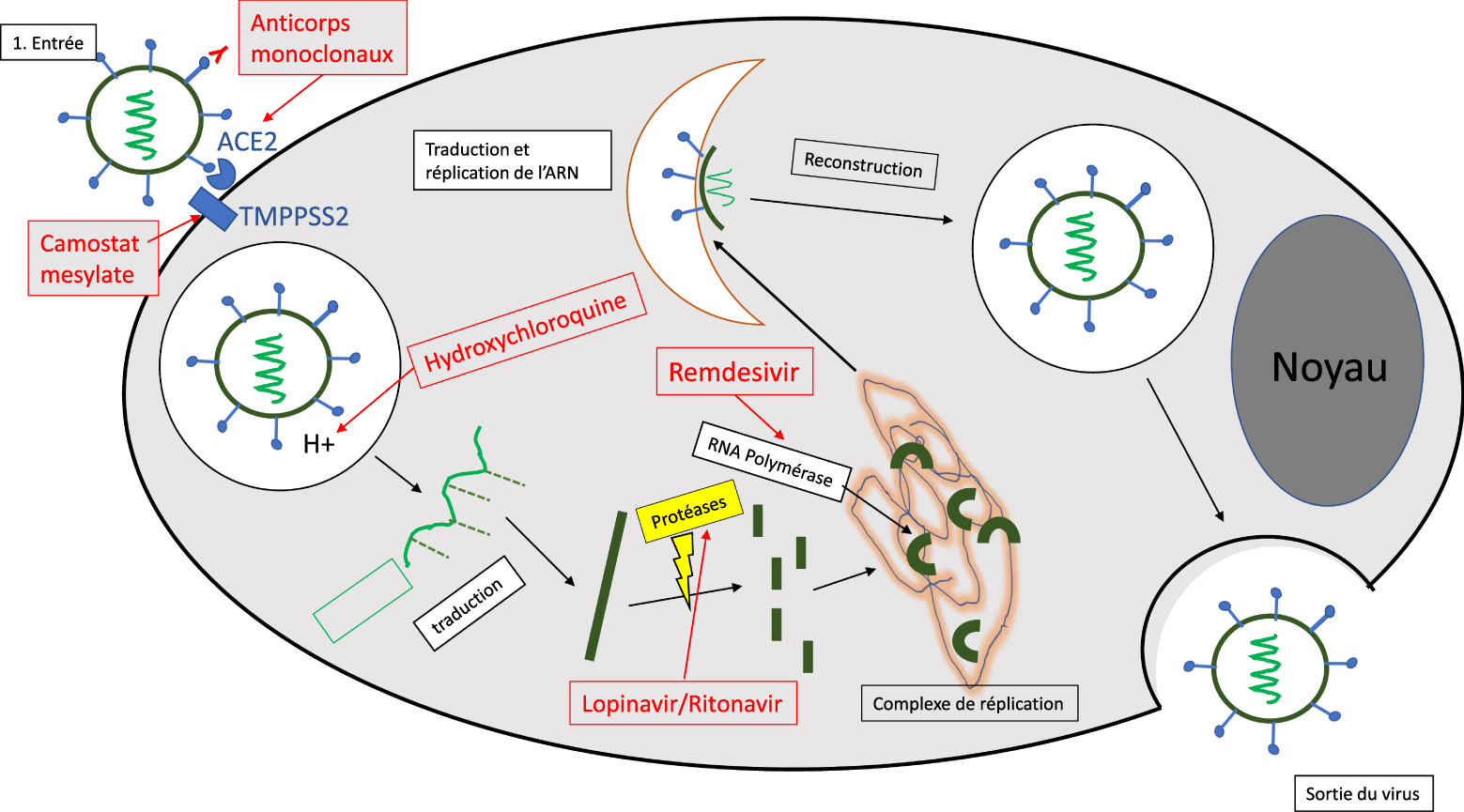
Le présent article a pour objectif de faire le point sur les différentes approches qui ont été suivies pour tenter de découvrir des médicaments efficaces contre l’infection à SARS-CoV-2. Pour agir sur l’infection par des virus à enveloppe, il est nécessaire de connaitre les mécanismes cellulaires et moléculaires du cycle viral. Mais les stades les plus graves de la maladie se caractérisent également par une inflammation paradoxale (« tempête cytokinique ») avec une détresse respiratoire qui peut être associée à une maladie endothéliale avec thromboses vasculaires. Les stratégies thérapeutiques s’appuient donc à la fois sur la recherche de médicaments antiviraux qui visent à perturber l’entrée ou le transport intracellulaire du virus et la réplication de son génome mais aussi sur le traitement de l’inflammation incontrôlée produite par une réponse immunitaire excessive.
2. Le cycle cellulaire viral et les cibles potentielles pour inhiber l’infection
Le SARS-CoV-2 est un virus enveloppé à ARN monobrin. Ces virus utilisent les machines moléculaires des cellules pour assurer la multiplication virale. L’infection se déroule généralement en trois étapes : (i) l’entrée du virus, (ii) la libération du génome viral dans le cytoplasme où l’ARN viral sera recopié afin de former de nouvelles particules virales et (iii) la sortie à l’extérieur de la cellule (Figure 1). Chacune de ces étapes peut constituer une cible thérapeutique susceptible de perturber l’infection [2].
L’entrée dans la cellule se fait généralement par un mécanisme de fusion membranaire ou d’endocytose, médiée par un récepteur présent à la surface de la cellule. Dans le cas du SARS-CoV-2, le récepteur de l’enzyme de conversion de l’angiotensine (ACE2) constitue la principale voie d’entrée du virus. Ce récepteur est exprimé pour 80% au niveau des cellules alvéolaires pulmonaires de type II, mais aussi au niveau des muqueuses nasales, de l’arbre respiratoire supérieur, de l’endothélium vasculaire, ainsi que des tissus cardiaques, rénaux et digestifs. La sérine protéase TMPRSS2, très exprimée par les cellules endothéliales des tractus respiratoires et digestifs, semble aussi jouer un rôle important comme co-récepteur du virus. Après internalisation, la particule virale se retrouve dans une vacuole intracellulaire (endosome) qui va progressivement s’acidifier grâce à une pompe à proton. En général, les virus internalisés transitent donc dans ces compartiments acides (pH 6,0 à 4,5) avant d’en sortir via des mécanismes complexes comme la fusion de la membrane de l’enveloppe virale avec la membrane endosomale, suivie de l’expulsion de la capside virale dans le cytoplasme cellulaire.
Les étapes de la Covid-19. A gauche, la maladie bénigne est surmontée par l’immunité adaptative. A droite, la forme grave de la maladie avec l’orage cytokinique, la rupture de la barrière épithélio-endothéliale au niveau pulmonaire et l’attaque endothéliale conduisant à des dysfonctionnements de la microcirculation. Adapté de Li et al. [5].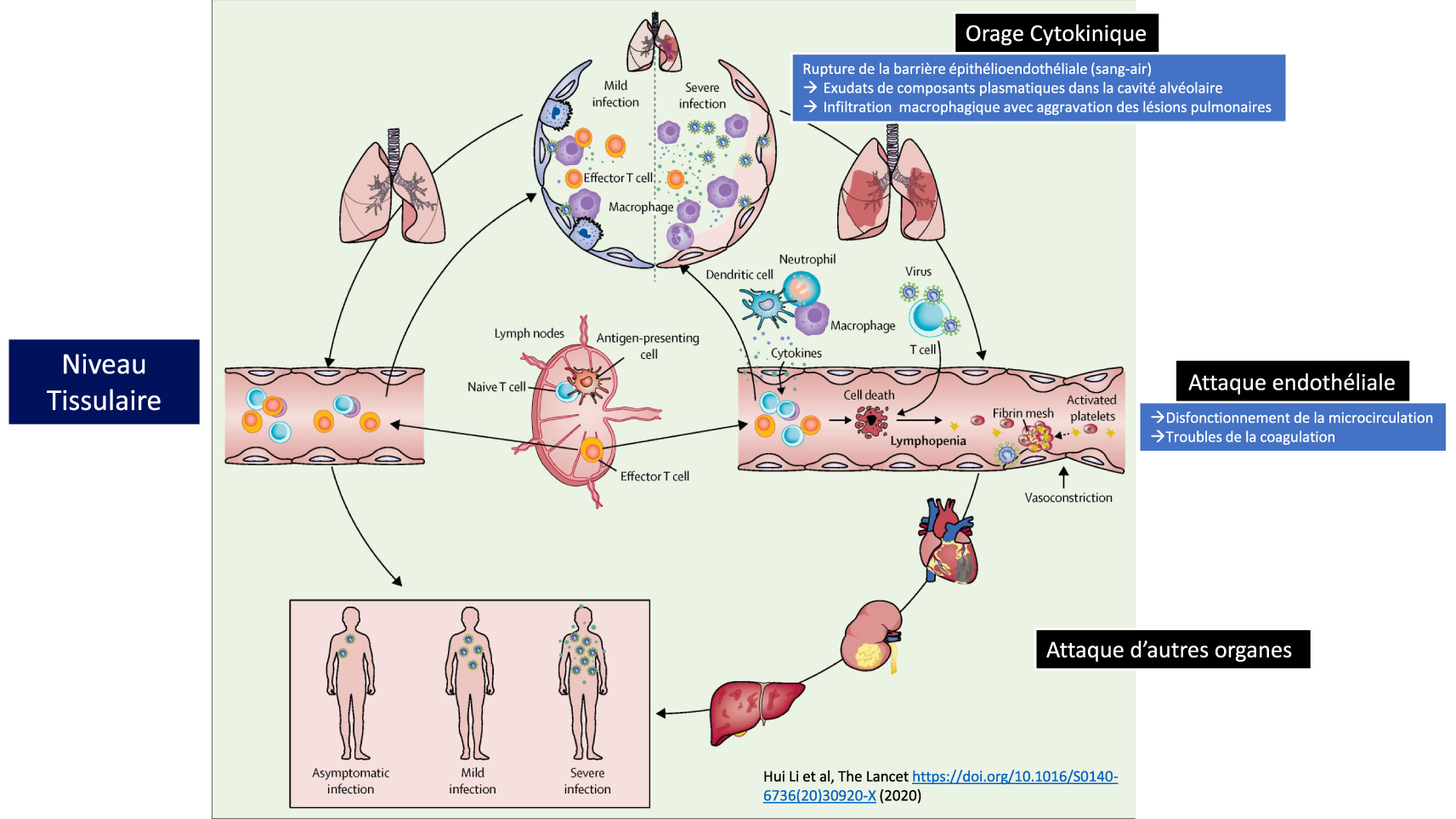
L’ARN viral va alors se répliquer et produire les protéines nécessaires à la reconstitution des protéines virales de nucléocapside, de spicule et de l’enveloppe lipidique. La maturation des protéines virales se fera grâce à des protéases, tandis que l’ARN viral sera produit grâce à l’intervention d’une ARN polymérase. L’assemblage des protéines virales et de l’ARN viral donnera lieu à la formation de virions matures qui quitteront la cellule par exocytose avant d’infecter d’autres cellules. Les coronavirus utilisent généralement des vésicules de la voie de sécrétion biosynthétique pour sortir de la cellule. Cependant, des travaux très récents [3] suggèrent que cette voie classique n’est pas suivie par SARS-CoV-2 et qu’il emprunte, au contraire, une voie lysosomiale non lytique et non conventionnelle pour l’exocytose. Ce mécanisme a lieu grâce à l’inactivation des enzymes lysosomiaux associée à l’inhibition de l’acidification de ces vésicules. Cette hypothèse qui nécessite, toutefois, d’être confirmée illustre la complexité des mécanismes mis en œuvre au cours du cycle viral.
Plusieurs approches thérapeutiques ont été envisagées : (i) inhiber l’entrée du virus à l’aide d’anticorps monoclonaux, ou de petites molécules dirigées contre le récepteur ACE2 ou le co-récepteur TMPPSS2, (ii) bloquer l’acidification des endosomes et empêcher ainsi le transfert du matériel génétique dans le cytoplasme cellulaire (Hydroxychloroquine), bien que cette stratégie soit contre-productive si la voie de l’exocytose lysosomiale mentionnée précédemment devait être confirmée et (iii) inhiber la reconstruction des particules virales par des antiprotéases (Lopinavir, Ritonavir). Les résultats obtenus seront détaillés ultérieurement mais aucune de ces approches ne semble, à ce jour, avoir abouti à des résultats thérapeutiques validés.
3. L’inflammation paradoxale
Si dans la majorité des cas, la COVID-19 reste une maladie bénigne, des formes plus graves peuvent toutefois apparaître avec des atteintes pulmonaires sévères, conduisant à une détresse respiratoire nécessitant de placer les patients sous oxygénothérapie, voire en réanimation, en procédant éventuellement à l’intubation. Ces formes les plus sévères de la maladie sont associées à une inflammation incontrôlée dite « paradoxale », au cœur de laquelle les cytokines jouent un rôle majeur. Si l’interféron (IFN) de type I et l’interleukine-7 sont indispensables pour déclencher une réaction immunitaire efficace contre l’infection, d’autres semblent au contraire très préjudiciables, comme l’interleukine-6, l’interleukine-1β et le TNF-α qui déclenchent la tempête cytokinique. Par ailleurs, une réponse défectueuse de l’IFN de type I, peut aboutir parallèlement à une immunodéficience, tandis que l’IL-7 est nécessaire à la restauration du répertoire lymphocytaire [4]. Dans les cas graves, l’intégrité de la barrière épithélio-endothéliale (sang-air) est même rompue (Figure 2). En plus de l’atteinte alvéolaire, il a été montré que le virus pouvait aussi infecter les cellules endothéliales des capillaires pulmonaires. Une grande quantité d’exsudats va alors se déverser dans les alvéoles pulmonaires et activer la libération des cytokines et chimiokines pro-inflammatoires par les macrophages alvéolaires et les cellules épithéliales. En raison du dysfonctionnement lymphocytaire, la réponse immunitaire adaptative ne peut alors pas se mettre en place correctement. Si l’infection virale entraine souvent une infiltration macrophagique excessive avec une aggravation des lésions pulmonaires, les lésions peuvent aussi s’étendre à d’autres organes comme le tissu cardiaque, les reins ou le système digestif [5]. L’attaque vasculaire par le SARS-CoV-2 peut alors induire des troubles thrombo-emboliques au niveau de ces organes.
Tous les mécanismes à la base du cercle vicieux lié à la production excessive de cytokines pro-inflammatoires et des dommages cellulaires et tissulaires qu’elle engendre ne sont malheureusement pas encore totalement élucidés, et le caractère polyphasique de la maladie rend les approches thérapeutiques encore difficiles, en particulier pour identifier le stade de la maladie et le moment optimal pour le traitement.
Cependant, à côté des approches antivirales, le contrôle de l’inflammation à l’aide de certaines cytokines anti-inflammatoires, d’anticorps anticytokines, ou de petites molécules à activité anti-inflammatoire, comme les corticostéroïdes, constitue de toute évidence le second pilier de la lutte contre la maladie qui sera discuté plus loin.
4. Les médicaments contre la Covid-19
4.1. Remarque préliminaire
Outre que de nombreuses personnes sont des porteurs sains et asymptomatiques du virus, la maladie débute généralement par des symptômes atypiques (toux sèche, fièvre plus ou moins importante). La majorité de ces patients (environ 85%) vont voir leur situation évoluer favorablement vers une guérison spontanée et sans séquelles. Seule une petite proportion atteinte d’insuffisance respiratoire va être hospitalisée, éventuellement en réanimation à la suite de la réaction inflammatoire paradoxale discutée plus haut. Ce rapide tableau clinique est utile pour comprendre la difficulté de l’approche pharmacologique. En effet, en début de maladie, on s’adresse à des patients avec une symptomatologie réduite et une chance de guérison spontanée élevée ; il n’est donc pas recommandé de leur administrer des médicaments à activité antivirale présentant de possibles effets secondaires importants. De même les médicaments à activité anti-inflammatoire peuvent s’avérer contre-productifs en réduisant les réponses naturelles de l’organisme lors du départ de l’infection. Il convient également de tenir compte du fait que beaucoup de patients âgés, avec d’éventuelles comorbidités, sont souvent poly-médiqués et les possibilités d’interactions médicamenteuses doivent donc être prises en considération. D’un autre côté, pour les patients ayant évolué défavorablement et nécessitant une hospitalisation d’urgence, le traitement antiviral peut être trop tardif, d’autant plus que la charge virale est fortement réduite à ce stade de la maladie. C’est plutôt la réaction inflammatoire secondaire et l’orage cytokinique qui doivent être maîtrisés. Enfin, le taux de mortalité ne représentant qu’un faible pourcentage de la population infectée, les essais cliniques doivent bénéficier de cohortes de patients suffisamment étoffées pour atteindre un seuil de significativité statistique permettant de tirer des conclusions valides.
4.2. Les médicaments antiviraux
4.2.1. Les anticorps et plasma de patients convalescents
Certains travaux ont tiré parti de l’affinité de la protéine de pointe du virus pour l’ACE2 pour développer des anticorps susceptibles de bloquer l’entrée du virus dans la cellule. Cette approche thérapeutique doit donc être appliquée au début de l’infection. Par exemple Wu et al. ont isolé deux anticorps neutralisants chez un patient convalescent (B38 et H4). Il a été démontré que ces deux anticorps sont capables de bloquer la liaison de la protéine de pointe virale au récepteur cellulaire de l’ACE2 et que les deux anticorps peuvent se lier simultanément sur des sites différents. Une étude préclinique sur un modèle de souris a confirmé que ces anticorps peuvent réduire les titres de virus dans les poumons infectés. Cette paire d’anticorps pourrait donc être utilisée conjointement dans de futures applications cliniques [6]. Le Bamlanivimab, un autre anticorps orienté contre une protéine de reconnaissance du récepteur ACE2 [7] a été approuvé à titre provisoire par la FDA pour les patients testés positifs au COVID-19 et présentant un risque de développer les formes les plus sévères de la maladie.
D’autre part, le plasma de patients infectés convalescents (PPC) a été envisagé pour neutraliser SARS-CoV-2 car cette approche avait déjà été utilisée avec succès dans d’autres épidémies à coronavirus. Outre la neutralisation directe du virus, il apparaît que le PPC permet aussi de réduire la tempête de cytokinique, le rapport Th1/Th17, ainsi que l’activation du complément [8]. Ainsi, une étude récente menée auprès de 10 patients atteints d’une forme grave de l’infection a montré qu’une dose (200 ml) de plasma de patient convalescent était bien tolérée et permettait le maintien d’anticorps neutralisants à un niveau élevé avec disparition de la virémie en 7 jours et amélioration des symptômes cliniques en 3 jours [9]. D’autres essais semblent confirmer cette observation.
4.2.2. Les analogues nucléosidiques à activité antiprotéases (Figure 3)
Le Remdesivir est un analogue nucléosidique qui a une activité inhibitrice de l’ARN polymérase et perturbe ainsi la production d’ARN viral. Il a une activité de type prodrogue phosphoramidique car il doit être métabolisé pour donner lieu à la forme pharmacologiquement active. In vitro, le Remdesivir a montré des résultats positifs avec un large spectre d’activité contre SARS-CoV et MERS-CoV ; il a aussi démontré une activité sur plusieurs modèles pré-cliniques in vivo, notamment chez le primate infecté par MERS-CoV [10]. En clinique humaine, le Remdesevir a été testé pour traiter l’infection par le virus Ebola mais avec une efficacité peu convaincante. Les premières informations concernant le traitement de patients atteints de COVID-19 ont été publiées sous la forme de rapports de cas ponctuels, souvent dans le cadre de programmes d’utilisation compassionnelle et avec un petit nombre de patients. Le premier essai clinique randomisé a été réalisé avec des patients recrutés par une dizaine d’hôpitaux chinois, notamment à Wuhan [11]. Au total, l’essai a porté sur 158 patients traités par le Remdesevir tandis que 79 autres étaient traités par le placébo. L’utilisation du Remdesivir n’a pas montré de bénéfice clinique statistiquement significatif et des effets indésirables ont même été signalés dans 66% des cas. Même si la Commission européenne a donné son feu vert pour la mise sur le marché conditionnelle du Remdesivir, la Haute Autorité de Santé (HAS) considère le service médical rendu comme faible car aucun des essais cliniques randomisés publiés à ce jour n’a montré une supériorité significative du Remdesivir par rapport aux soins médicaux standards.
Le Lopinavir et Ritonavir ont été développés à l’origine pour lutter contre l’infection à HIV. Ils agissent comme inhibiteurs de protéases, ce qui empêche le virus de produire les protéines et enzymes nécessaires à sa réplication. Le Lopinavir est rapidement métabolisé par le cytochrome P450 et c’est la raison pour laquelle il est administré en association avec le ritonavir, une antiprotéase qui en diminue la métabolisation. Cela permet aussi de réduire les doses de Lopinavir qui n’est pas dépourvu d’effets secondaires (principalement digestifs et plus rarement neurologiques). A noter que cette association doit être utilisée avec prudence chez les patients ayant des pathologies cardiaques (arythmie, ischémie etc.). Si des essais précliniques ont montré une activité antivirale significative de l’association Lopinavir/Ritonavir, les essais cliniques réalisés sur des patients infectés par SARS et MERS sont peu convaincants, bien que l’un d’eux, non randomisé et sur un très petit nombre de patients, ait montré une diminution de la charge virale [12]. L’association Lopinavir/Ritonavir a également fait l’objet d’un essai clinique réalisé sur 199 patients atteints de la COVID-19 mais aucun avantage n’a pu être mis en évidence par rapport aux traitements standards [13].
Le MK-4482/EIDD-2801 est une prodrogue d’un analogue nucléosidique (la N4-hydroxycytidine) dont l’activité contre le virus de la grippe a été repositionnée pour le traitement de SARS-CoV-2. Par rapport à beaucoup d’autres analogues nucléosidiques, cette molécule présente l’avantage d’une excellente biodisponibilité par voie orale. Très récemment, une étude menée chez le furet a montré que le traitement oral par EIDD-2801 induisait une atténuation très significative de l’infection et une inhibition de la transmission [14]. Il s’agit d’un résultat particulièrement intéressant en raison des similitudes de la propagation du virus chez le furet et chez l’homme. Un essai clinique de phase I/II en double aveugle et contre placébo (NCT04405570 et NCT04405739) est actuellement en cours [15].
4.2.3. L’hydroxychloroquine (Figure 3)
Dès les années 1960, l’effet antiviral de la chloroquine (et de l’hydroxychloroquine) a été démontré in vitro dans de très nombreuses études, y compris dans des modèles cellulaires d’infection à coronavirus. L’hydroxychloroquine a, en effet, la capacité d’empêcher l’acidification des lysosomes ce qui perturbe, en théorie, le transfert du matériel génétique viral au niveau du cytoplasme cellulaire. Très récemment, il a été montré sur cellules Vero infectées par COVID-19 que la chloroquine et l’hydroxychloroquine réduisaient significativement la charge virale, bien qu’avec des mécanismes un peu différents [16]. L’hydroxychloroquine seule ou en association avec d’autres principes actifs a donné lieu à plus de 160 essais cliniques à ce jour (ClinicalTrials.gov). Certains d’entre eux réalisés par Raoult et al. au CHU de Marseille [17], ont montré une diminution de la charge virale sur des prélèvements nasopharyngés, notamment lorsque l’hydroxychloroquine est administrée par voie orale en association avec l’Azithromycine, un antibiotique de la famille des macrolides. Ces essais sont, cependant, très controversés car ils n’obéissent pas aux critères internationaux de bonne pratique des essais cliniques. Les principales raisons en sont les suivantes : (i) un très faible nombre de patients, (ii) de nombreux biais statistiques, (iii) l’inclusion de patients non randomisés et/ou (iv) l’absence de bras placébo ou de patients contrôles. Au total, aucun des essais réalisés à ce jour n’a fait la preuve de l’efficacité de l’hydroxychloroquine. De plus, les doses thérapeutiques d’hydroxychloroquine utilisées dans beaucoup de ces essais restent proches de celles qui peuvent conduire à des effets secondaires cardiovasculaires, en particulier chez les personnes prédisposées (souvent âgées avec des comorbidités).
En raison de l’absence de données objectivables, l’OMS a mis un terme à l’étude Solidarity et l’ANSM considère « le bénéfice/risque de ces traitements hors essais cliniques comme défavorable ».
Structure chimique de petites molécules antivirales (A) ou anti-inflammatoires (B) ayant fait l’objet d’essais cliniques, seules ou en association.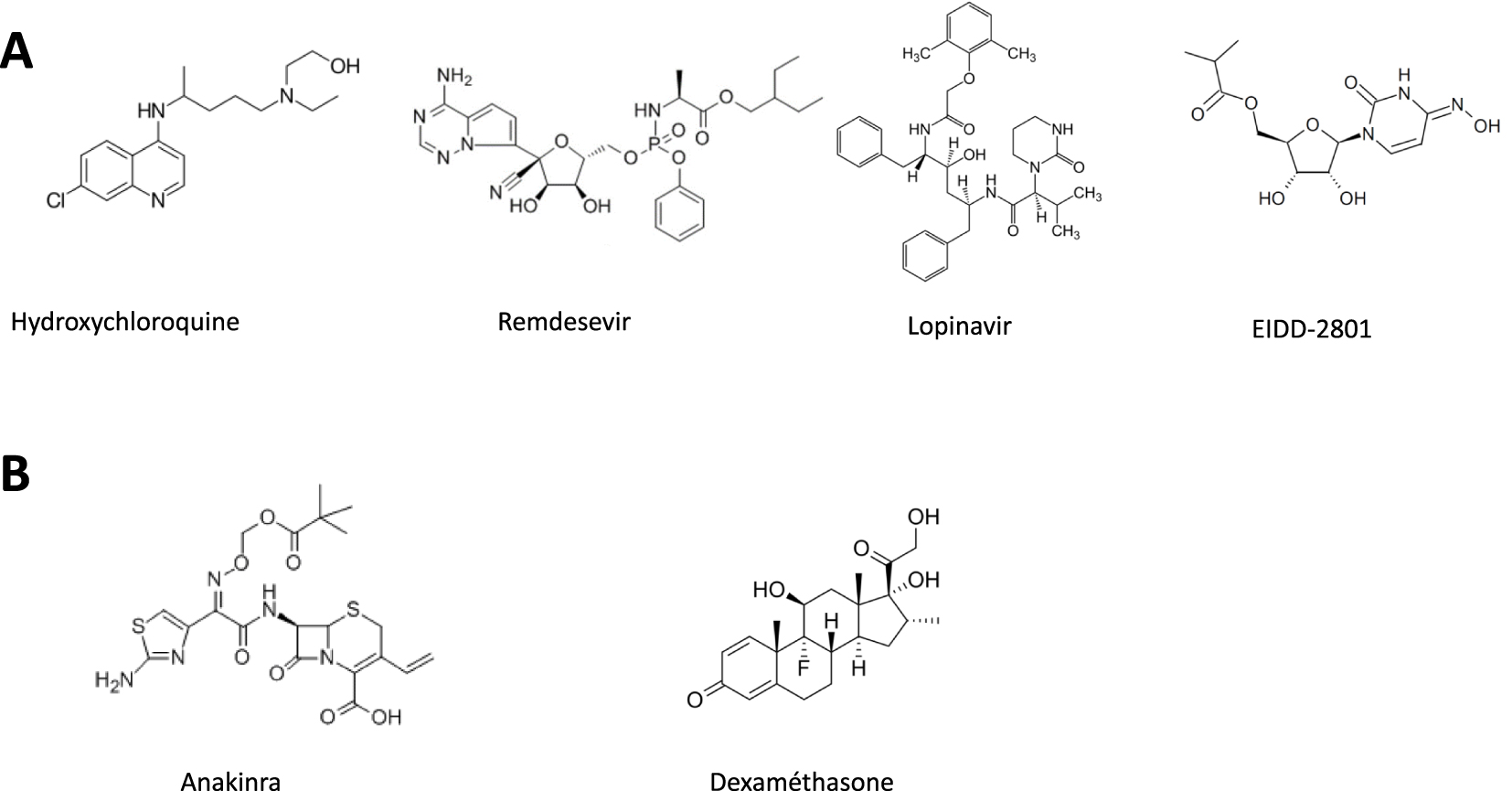
4.2.4. L’interféron
Les interférons alpha et bêta (interférons de type I) sont des glycoprotéines recombinantes à activité antivirale et immunorégulatrice qui activent les cellules NK et les lymphocytes. D’après une étude récente [18], les formes graves de l’infection à SARS-CoV-2, caractérisées par une charge virale sanguine persistante et une réponse inflammatoire exacerbée, semblent être directement liées à un déficit d’interférons de type I et provoquées par le facteur nucléaire transcriptionnel-κB. Un essai ouvert, randomisé, de phase 2 a examiné l’effet de l’interféron bêta-1b associé au traitement par Lopinavir/Ritonavir [19]. La trithérapie a été associée à une réduction significative de la durée de l’excrétion virale (prélèvement nasopharyngé négatif) ainsi qu’à l’atténuation des symptômes et de la durée du séjour à l’hôpital. Cependant, les patients inclus dans l’étude étaient atteints d’une forme légère à modérée de la maladie et aucune mortalité n’a été enregistrée, ni dans le groupe témoin, ni dans le groupe traité et il n’est pas sûr que des résultats similaires puissent être obtenus dans les populations de patients présentant une COVID-19 grave. Par ailleurs, le traitement par interférons n’est pas dépourvu d’effets secondaires importants. D’autre part, une autre étude a montré que les interférons pouvaient stimuler l’expression des voies d’entrée du virus (i.e., ACE2 et son co-facteur TMPPSS2) et il n’est donc pas exclu que le SRAS-CoV-2 puisse exploiter cette régulation positive de l’ACE2 pour renforcer l’infection [20]. Les traitements par interférons doivent donc être menés avec beaucoup de prudence et les futurs essais cliniques menés avec des méthodologies rigoureuses, d’autant plus que les mécanismes d’action des interférons de type I ne sont pas encore totalement élucidés.
4.3. Les médicaments à visée anti-inflammatoire
4.3.1. La dexaméthasone et les autres corticoïdes de synthèse (Figure 3)
La dexaméthasone est un glucocorticoïde de synthèse à activité anti-inflammatoire qui peut conduire, à forte dose, à une réduction de la réponse immunitaire et de l’orage cytokinique. Bien que les premiers rapports aient découragé l’utilisation des corticostéroïdes en raison du risque de diminuer la réponse immunitaire à l’infection virale [21], des publications ultérieures ont démontré que ces médicaments amélioraient les signes cliniques et réduisaient la mortalité des patients. Ainsi, une méta-analyse coordonnée par l’OMS et l’université de Bristol a regroupé 7 études internationales menées au sein de 12 pays avec un total de 1.703 patients [22]. Elle a montré une diminution de la mortalité de 21%, à 28 jours et toutes causes confondues, lorsque les patients sont traités par la dexaméthasone, l’hydrocortisone ou la méthylprednisolone versus placebo et soins standards. Et le bénéfice semble plus important encore chez les patients sous ventilation mécanique (mortalité diminuée de 30%). D’autres études ont confirmé l’efficacité de la dexaméthasone dans les formes sévères de la maladie. Aucun médicament repositionné n’a montré jusqu’ici une telle activité.
4.3.2. Les médicaments anti-cytokines : Tocilizumab et Anakinra (Figure 3)
Le Tocilizumab est un anticorps monoclonal anti IL-6, et l’Anakirna un antagoniste des récepteurs des IL-6 et IL-1, deux acteurs majeurs de la tempête cytokinique. Un essai contrôlé, randomisé et multicentrique utilisant le Tocilizumab a été autorisé en Chine chez des patients sous tempête cytokinique et en dépression respiratoire [23]. Les résultats sont les suivants : 15 des 20 patients (75,0%) ont réduit leur consommation d’oxygène et un patient n’a plus eu besoin d’oxygénothérapie. Les scanners ont montré que l’opacité des lésions pulmonaires avait été réduite chez 19 patients (90,5%). Le pourcentage de lymphocytes dans le sang périphérique est revenu à la normale chez 52,6% des patients au cinquième jour après traitement. Enfin, le taux anormalement élevé de protéine C-réactive a diminué de façon significative chez 84,2% des patients [23]. L’association du Tocilizumab avec un traitement anti-inflammatoire aux glucocorticoïdes de synthèse a également amélioré l’état de patients atteints par la phase sévère de la maladie. Ainsi, une analyse rétrospective a été réalisée auprès de patients sujets à la tempête cytokinique définie par des marqueurs inflammatoires précis (i.e., ferritine > 700 ng/mL, protéine C-réactive > 30 mg/dL ou lactate déshydrogénase > 300 U/L). Les groupes de patients traités avec des corticostéroïdes associés au Tocilizumab ont eu des taux de survie supérieurs par rapport au traitement par les corticostéroïdes seuls ou même en combinaison avec l’Anakinra [24]. A noter que l’Anakirna avait déjà montré une activité anticytokinique lors de chocs septiques secondaires à une infection [25]. Une autre étude rétrospective menée auprès de 1092 patients a également mis en évidence le bénéfice d’un traitement associant corticostéroïdes et Tocilizumab [26].
4.3.3. Les anti-coagulants
Près de la moitié des patients atteints des manifestations les plus graves de la COVID-19 présentent des troubles de la coagulation, parmi lesquels l’embolie pulmonaire occupe une place importante [27]. La survenue d’évènements thrombo-emboliques est attribuée à la tempête cytokinique associée notamment à une augmentation de l’angiotensin II [28]. La modification des paramètres de la coagulation s’accompagne surtout d’une augmentation du D-Dimère [27]. C’est la raison pour laquelle il est recommandé par le Groupe d’intérêt en Hémostase Péri-opératoire et par le Groupe Français d’Etude sur l’Hémostase et la Thrombose de traiter les patients à titre préventif à l’aide d’anticoagulants (héparine de bas poids moléculaires ou Fondaparinux) avec une surveillance de l’hémostase. A côté de ses propriétés anticoagulantes, les héparines de bas poids moléculaire semblent aussi réduire la production d’IL-6. Cependant, les doses les plus efficaces font encore débat.
5. Conclusion
La découverte et le développement de médicaments efficaces contre le SRAS-CoV-2 représentent, à l’évidence, un défi médical majeur. Au moment de l’écriture de cet article, aucune molécule nouvelle n’a encore été approuvée pour traiter l’infection ou ses signes cliniques. Les approches thérapeutiques ont jusqu’ici convergé vers le repositionnement de médicaments anciens, petites molécules de synthèse ou biomolécules, déjà utilisés pour le traitement d’autres pathologies et pouvant être mis plus rapidement à disposition des patients, en raison d’un mode d’action et d’un profil biopharmaceutique et toxicologique déjà identifiés. Des essais cliniques, parfois trop nombreux et contradictoires, ont été médiatisés à l’excès en dépit de lacunes méthodologiques évidentes. D’autres ont, heureusement, été menés avec une plus grande rigueur. Ils visent, en général, à perturber directement le cycle viral ou à lutter contre l’inflammation paradoxale et la maladie vasculaire. Si aucun médicament ne permet actuellement d’éradiquer totalement l’infection et de guérir les patients, moins d’une année après le début de l’épidémie, des progrès thérapeutiques incontestables ont quand même été obtenus, grâce à l’utilisation de molécules à activité anti-inflammatoire (corticostéroïdes et/ou anticytokines d’origine biologique) associés ou non à l’utilisation d’anticoagulants. A l’avenir, l’émergence de nouveaux médicaments résultera certainement d’une meilleure connaissance des mécanismes moléculaires et cellulaires de l’infection ainsi que des mécanismes physiopathologiques d’une maladie encore mal connue. Ces recherches doivent être encouragées pour permettre aux chimistes et aux biologistes de produire des molécules inédites et plus efficaces.



 CC-BY 4.0
CC-BY 4.0