Living organisms must constantly adapt to changes in their environment. The intestinal epithelium represents one of the main interfaces between our organism and the environment, representing about 200 square meters if we develop the villi and micro-villi on a plane. The content of the intestine is very variable, not only in the quantity and nature of nutrients, but also in potentially dangerous compounds (toxic substances, mutagens, allergens), microbes and parasites, often ingested with food. The importance of the intestinal epithelium as a site of entry for many compounds and microorganisms is well illustrated by the means implemented to ensure its defense: 70% of our immunocytes are located in the intestine. However, although the intestinal epithelium is on the front line, in direct contact with the contents of the intestinal lumen, its role in the identification of potential hazards and the dialogue with the immune system is still only partially understood.
1. Morphology and cellular composition of the intestinal epithelium
The intestinal epithelium is the most rapidly renewing structure of our organism, with a complete renewal time of about one week and a daily production of several grams of cells. This epithelium, made up of a cell monolayer, is organized into two compartments called crypts and villi. The crypt is the proliferative compartment of the epithelium. It is composed of cells that proliferate rapidly in order to produce the quantity of cells necessary to renew the structure. Crypts contain at their base stem cells expressing the Lgr5 marker [1], and these cells are interspersed with other cells, called Paneth cells. The latter participate in the stem cell niche by producing growth factors, and are also important in regulating the bacterial populations present in the gut and collectively constituting the gut microbiota [2]. Thus, the stem cells proliferate, and their progeny migrate to the adjacent villi continuing their proliferation to amplify the cell population until they reach the base of the villi. The cells then stop proliferating but continue to migrate along the villi until they reach the end of the villi and end their journey by delaminating into the intestinal lumen.
Several specialized cell types make up the intestinal epithelium, in addition to stem cells and Paneth cells. Enterocytes provide nutrient absorption and are the most abundant cell type in the small intestinal epithelium. Other cells, called goblet cells because of their goblet-like morphology, produce a protective mucus layer separating the epithelial monolayer from the luminal contents. Enteroendocrine cells secrete an array of hormones regulating the physiology of the gut and the digestive process, while M (microfold) cells cover the lymphoid follicles of the gut and play important roles in antigenic sampling (for a review, see [3]). Finally, tuft cells are the focus of this synthesis.
2. Discovery and cellular characterization of intestinal tuft cells
More than half a century ago, electron microscopy first allowed the identification of the atypical morphology of tuft cells in the epithelia of the trachea [4] or the gastrointestinal tract of rodents [5]. Indeed, these cells are characterized by an apical tuft of long microvilli projecting into the lumen, as well as radicles rich in actin, fimbrin and villin extending from the tips of the microvilli in a basal direction [6], and a tubulovesicular system consisting of multiple apical vesicles [7]. Nevertheless, the lack of markers that allow the identification of tuft cells by routine methods as well as the rarity of these cells, representing only about 0.5% of the cells of the mouse small intestinal epithelium, have probably contributed to the longevity of the mystery surrounding the function of these cells. The first combinations of markers to unambiguously identify intestinal tuft cells were published a dozen years ago, including Dclk1 (Doublecortin-like kinase 1), Gfi1b (Growth factor independent 1b), Sox9 (Sex-determining region Y-box 9), Ptgs1 (prostaglandin-endoperoxide synthase 1), Ptgs2 (prostaglandin-endoperoxide synthase 2) and acetylated tubulin [8, 9, 10, 11] (Figure 1).
Tuft cells are a minority population of the intestinal epithelium. Intestinal villus (apex at top) with a tuft cell identified by immunofluorescence using Dclk1 protein (white) as a marker. Cell nuclei are highlighted by DAPI staining (blue). Scale bar: 10 μm.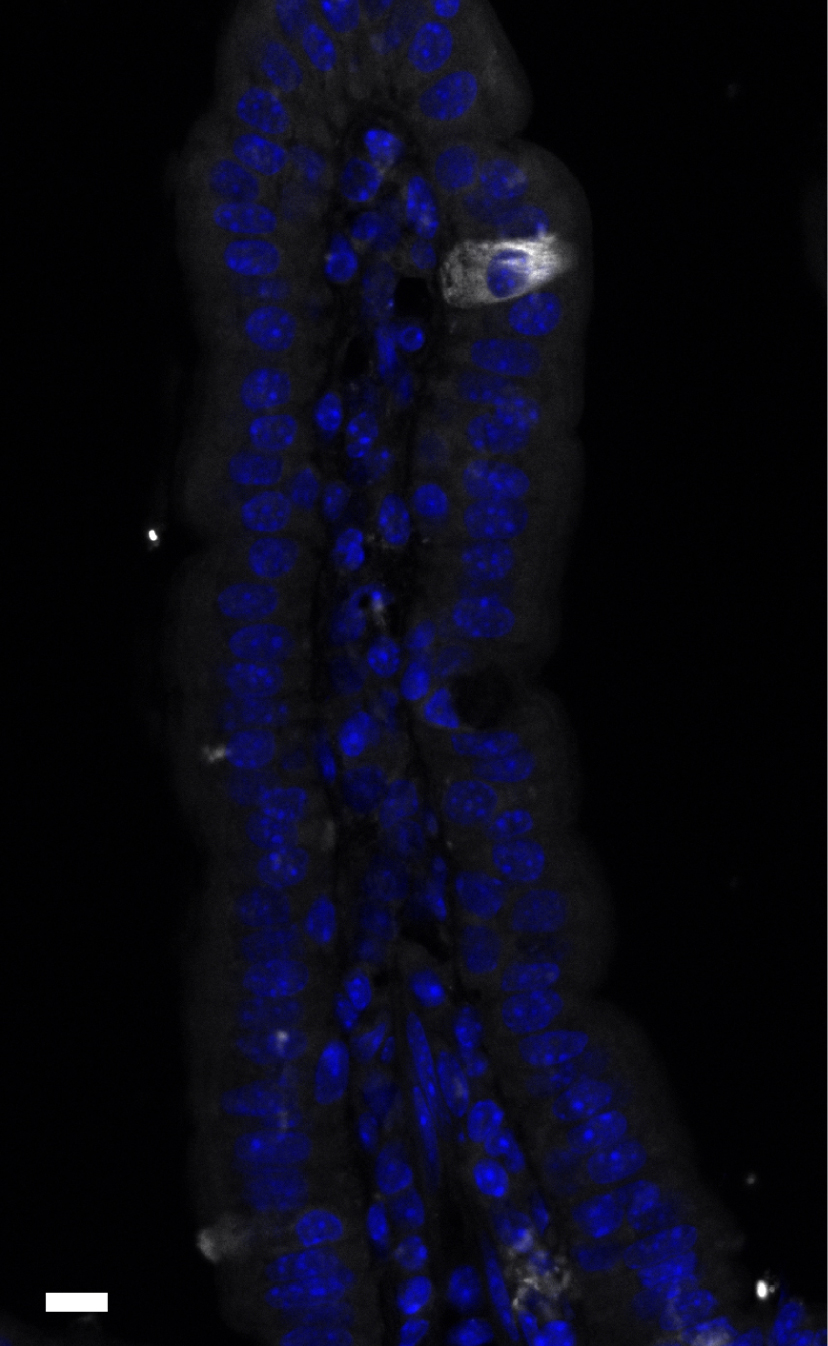
Despite their morphological and molecular originality, tuft cells are unsurprisingly part of the progeny of intestinal stem cells [1], as shown by cell tracing experiments using stem cells expressing the leucine rich repeat containing G protein coupled receptor 5 (Lgr5) marker [9]. The differentiation pathway of tuft cells then diverges from those of other differentiated cell types such as enteroendocrin cells, goblet cells and Paneth cells because their presence is not affected by the deletion of, respectively, Neurog3 (Neurogenin 3), Spedef (SAM-pointed domain-containing ETS transcription factor) and Sox9 (sex-determining region Y-box 9) [9, 11]. It is only more recently that the first transcription factor specifically required for tuft cell differentiation, Pou2f3 (POU domain, class 2, transcription factor 3), was identified. Its absence leads to an apparently normal intestinal epithelium in which tuft cells are absent [12].
3. Tuft cells: sentinels of the intestinal mucosa
While the function of intestinal tuft cells remained mysterious for a long time, it is quite remarkable that three teams discovered their first function almost simultaneously, independently and with different approaches. In a first study, it was the exploitation of a mouse model without tuft cells that allowed to prove the involvement of tuft cells in the initiation of type 2 immune responses against infections by intestinal helminths such as Nippotrongylus brasiliensis. Indeed, while parasitic infection is accompanied by a dramatic expansion of tuft cell numbers in the intestinal epithelium, the absence of these cells in Pou2f3-deficient mice causes a significant delay in the initiation of an immune response and in the expulsion of worms. In addition, this study found that intestinal tuft cells are the source of the epithelial production of the cytokine IL-25, known as an alarmin involved in the initiation of type 2 responses [13, 14]. Finally, this study demonstrated the involvement of tuft cells in the initiation of type 2 responses via the role of IL-25 by treating tuft cell-deficient mice (Pou2f3−∕−) with recombinant IL-25, restoring an effective type 2 response leading to worm expulsion within the same time frame as in mice with a normal genotype. Thus, infection with N. brasiliensis leads to the activation of tuft cells and the production of IL-25. The latter activates innate lymphoid cells type 2 (ILC2), located in the lamina propria of the intestinal mucosa, and results in the production of other type 2 interleukins, notably IL-13 by ILC2. IL-13, in turn, causes remodeling of the intestinal epithelium, with hyperplasia of mucus cells, which underlies the so-called “weep and sweep” response that facilitates worm expulsion [15], but also hyperplasia of tuft cells. The latter can be interpreted as a positive reinforcement loop, with increased IL-25 production and reinforcement of the type 2 response until worm expulsion [12]. In the absence of tuft cells, this loop is not efficiently initiated (Figure 2).
Establishment of a type 2 immune response following helminthic infection. Molecules produced directly or indirectly by parasites located in the intestinal lumen activate rare tuft cells present in the intestinal epithelium. Tuft cells respond by producing a cytokine called alarmin, IL-25, which activates innate lymphoid cells type 2 (ILC2) in the lamina propria. The latter initiate the type 2 response, notably via the secretion of IL-13, one of the consequences of which is an increase in the number of tuft cells in the intestinal epithelium, thus inducing an amplification of the response until the expulsion of the parasite (here: Nippostrongylus brasiliensis).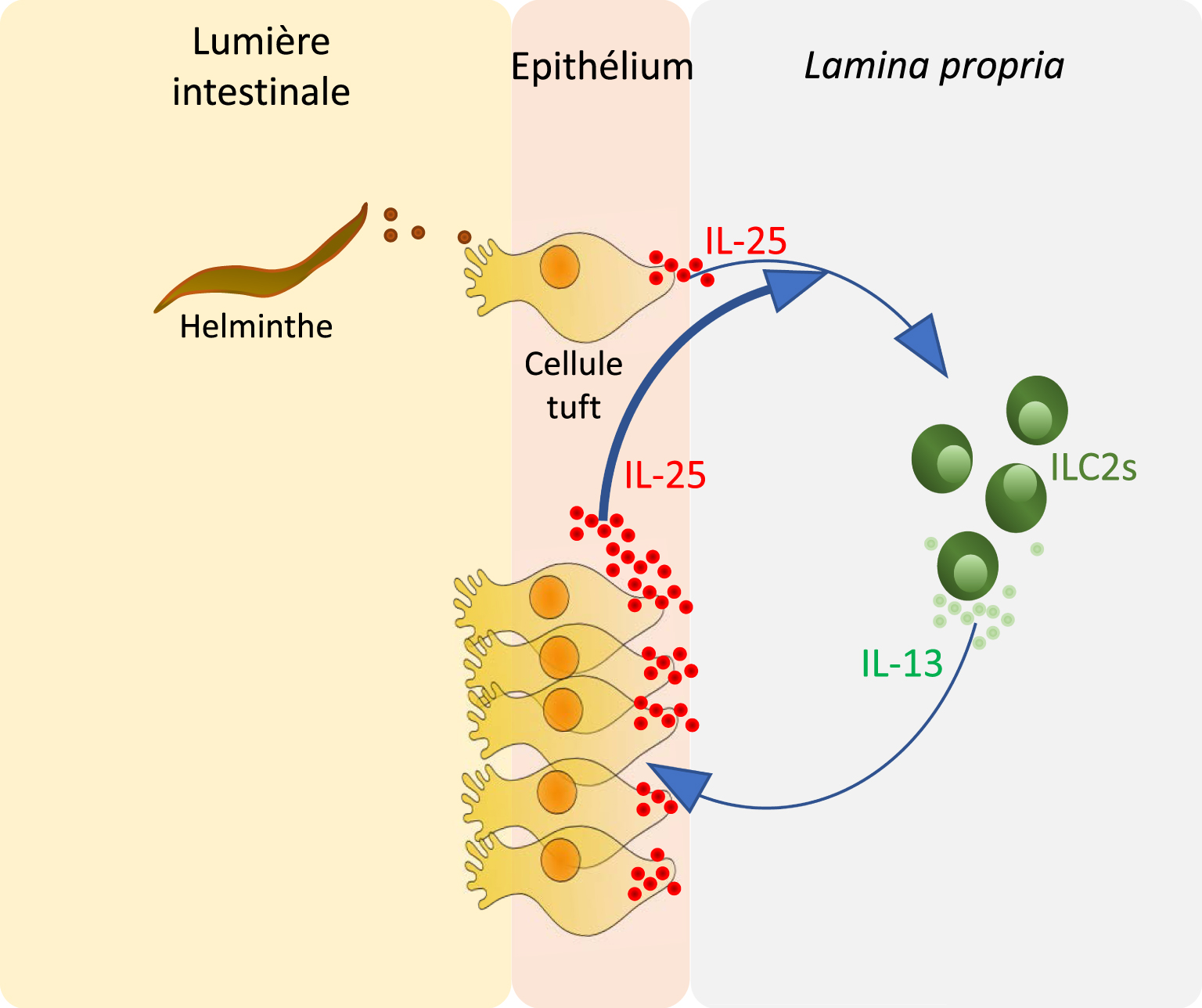
Another independent study was carried out by a team working specifically on type 2 immune responses, using a transgenic mouse model (called Flare25) that not only invalidates the gene coding for IL-25, but also reveals the cells expressing IL-25. These authors demonstrated the co-expression of IL-25 in cells expressing the Dclk1 marker, i.e. tuft cells, and the amplification of these cells during the type 2 response following N. Brasiliensis infection, under the control of the ILC2-IL-13 loop [16] as in the previous study.
The authors of a third study used a different approach, noting that infection with different helminths (N. Brasiliensis, Heligmosomoides Polygyrus) or with the symbiotic protozoa Tritrichomonas muris had in common to cause amplification of the tuft cell lineage. They then builded on previous work that proposed a chemosensory role for tuft cells, including the expression of taste receptors and components involved in their signaling such as the G protein gustducin-α [17], phospholipase β2 [18] and the transient receptor potential cation channel, subfamily M, member 5 (TRPM5) [19, 20], as well as calcium signaling stimulated by treatment with denatonium, a bitter substance [21]. Thus, using mice deficient for gustducin-α or for the Trpm5 channel, the authors found a delay in the expulsion of H. polygyrus as well as a decrease in the amplification of the number of tuft cells and a decrease in the expression of IL-25 after colonization by T. muris. Conversely, injection of recombinant IL-25 into Trpm5-deficient mice restored tuft cell abundance in a manner dependent on IL-13 signaling. In conclusion, this study proposed that intestinal tuft cells and taste receptor-related chemosensation constitute a parasite signal recognition system [22].
4. What are the signals that activate tuft cells?
At the same time, the presence of taste receptors on tuft cells is not unanimously accepted. Some recent transcriptomic studies have indeed failed to demonstrate the expression of taste receptors in intestinal tuft cells [23, 24].
However, other studies have identified the expression of the Tas1r3 receptor, responsible for the detection of sweet and umami tastes by the taste buds, in the distal part of the mouse small intestine. Furthermore, mice deficient for this receptor do not respond to tuft cell-activating signals such as succinate or the protozoan Tritrichomonas muris, and have reduced tuft cell numbers in their distal small intestine [25]. Further targeted analyses using PCR detected increased expression of 3 Tas2rs family receptors (Tas2r117, Tas2r136, and Tas2r143) in organoids [26] from interleukin-13 (IL-13)-treated mice, and co-expression of these receptors with Dclk1, a tuft cell marker, was validated by in situ hybridization [27].
While the role of taste receptors in tuft cell activation is still controversial, several studies have focused on other G-protein coupled receptors expressed by tuft cells. Short-chain fatty acid (Ffar3) and succinate (Sucnr1) receptors, for example, are specifically expressed by tuft cells in the intestinal epithelium [28], and could constitute a relay between the presence of metabolites produced by the commensal flora and tuft cell activation. Indeed, treatment of mice with succinate in drinking water is sufficient to induce marked proliferation of ILC2 and production of IL-13 by these same cells, as well as hyperplasia of the tuft cell lineage [28] and mucus cells, in a gustducin- and Trpm5-dependent manner [29]. Other short-chain fatty acids such as acetate, butyrate or propionate do not have the same activating properties, pointing to some specificity of succinate as a metabolite capable of activating tuft cells and, consequently, initiating a type 2 immune response. Moreover, the activation of ILC2s by succinate requires the presence of tuft cells and IL-25, and is significantly reduced in the absence of Trpm5, supporting the presence of a functional succinate-tuft cells-Trpm5-IL-25-ILC2s axis. It remained to identify luminal organisms capable of producing succinate. This property has been well demonstrated for Tritrichomonas, since monoinfection of axenic mice with this protozoan causes an increase in succinate levels [28]. Interestingly, succinate is also a metabolite that can be produced (and metabolized) by the gut microbiota. Thus, it has been shown that changes in the microbiota, for example following antibiotic treatment with streptomycin, or altered intestinal motility caused by treatment with polyethylene glycol, can cause an increase in luminal succinate concentration [30]. The role of the succinate receptor (Sucnr1 or Gpr91), specifically expressed by tuft cells within the intestinal epithelium, has been well demonstrated with mice deficient for this receptor (Sucnr1−∕−) that have a diminished immune response following treatment with streptomycin or polyethylene glycol [29]. However, the relationship between succinate, the Sucnr1 receptor, and the initiation of a type 2 response does not yet seem to be fully understood as Sucnr1-deficient mice respond normally to infection by the helminth Nippostrongylus brasiliensis, which also produces succinate [29].
5. Conclusion and perspectives
After being remarkably ignored for half a century, tuft cells are the objects of increasing attention. The last five years have seen dramatic advances, including the identification of the first function of intestinal tuft cells as sentinels of this mucosa. Using a range of tools in mouse genetics, we are beginning to identify the signaling circuits that are activated in tuft cells, as well as some of the signals produced by luminal microorganisms that enable this activation. However, the understanding of the multiplicity of signals activating tuft cells, as well as the resulting signaling cascades in tuft cells and their physiological consequences is still in its infancy and the coming years will undoubtedly allow a more comprehensive appreciation of the role of these cells that are as rare in the intestinal mucosa as they are essential for the regulation of its homeostasis.
French version
Les organismes vivants doivent sans cesse s’adapter aux changements de leur environnement. L’épithélium intestinal représente une des principales interfaces entre notre organisme et l’environnement, représentant environ 200 mètres carrés si l’on développe les villosités et micro-villosités sur un plan. Le contenu de l’intestin est très variable, non seulement dans la quantité et nature des nutriments, mais aussi en composés potentiellement dangereux (substances toxiques, mutagènes, allergènes), microbes et parasites, souvent ingérés avec l’alimentation. L’importance de l’épithélium intestinal comme site d’entrée pour de nombreux composés et microorganismes est bien illustrée par les moyens mis en œuvre pour assurer sa défense : 70% de nos immunocytes sont localisés dans l’intestin. Cependant, bien que l’épithélium intestinal soit en première ligne, en contact direct avec le contenu de la lumière intestinale, son rôle dans l’identification des dangers potentiels et le dialogue avec le système immunitaire n’est encore que partiellement compris.
1. Morphologie et composition cellulaire de l’épithélium intestinal
L’épithélium intestinal est la structure de notre organisme se renouvelant le plus rapidement, avec un renouvellement complet de l’ordre d’une semaine et la production quotidienne de plusieurs grammes de cellules. Cet épithélium, constitué d’une monocouche cellulaire, est organisé en deux compartiments appelés cryptes et villosités. La crypte constitue le compartiment prolifératif de l’épithélium. Elle est composée de cellules proliférant rapidement afin de produire la quantité de cellules nécessaires au renouvellement de la structure. Les cryptes contiennent à leur base des cellules souches exprimant le marqueur Lgr5 [1], et ces cellules sont intercalées entre d’autres cellules, appelées cellules de Paneth. Ces dernières participent à la niche des cellules souches en produisant des facteurs de croissance, et sont aussi importantes pour réguler les populations bactériennes présentes dans l’intestin et constituant collectivement le microbiote intestinal [2]. Ainsi, les cellules souches prolifèrent, et leur progéniture migre vers les villosités attenantes en continuant leur prolifération afin d’amplifier la population cellulaire jusqu’à atteindre la base des villosités. Les cellules cessent alors de proliférer tout en continuant leur migration le long de la villosité, jusqu’à en atteindre l’extrémité et terminer leur périple en délaminant dans la lumière intestinale.
Plusieurs types cellulaires spécialisés composent l’épithélium intestinal, en plus des cellules souches et des cellules de Paneth. Les entérocytes assurent l’absorption des nutriments et constituent le type cellulaire le plus abondant de l’épithélium de l’intestin grêle. D’autres cellules, appelées caliciformes à cause de leur morphologie en calice, produisent une couche de mucus protecteur séparant la monocouche épithéliale du contenu luminal. Les cellules entéroendocrines sécrètent une panoplie d’hormones régulant la physiologie de l’intestin et le processus de digestion, alors que les cellules M (microfold) recouvrent les ilots lymphoïdes de l’intestin et jouent des rôles importants dans l’échantillonnage antigénique (pour une revue, voir [3]). Finalement, les cellules tuft font l’objet de cette synthèse.
2. Découverte et caractérisation cellulaire des cellules tuft intestinales
C’est d’abord la microscopie électronique qui a permis, il y a plus d’un demi-siècle, d’identifier la morphologie atypique des cellules tuft dans les epithelia de la trachée [4] ou du tractus gastro-intestinal de rongeurs [5]. En effet, ces cellules se distinguent notamment par une touffe (tuft) apicale de longues microvillosités se projetant dans la lumière, ainsi que par des radicelles riches en actine, fimbrine et villine s’étendant à partir de l’extrémité des microvillosités en direction basale [6], et d’un système tubulovésiculaire constitué de multiples vésicules apicales [7]. Néanmoins, l’absence de marqueurs permettant l’identification des cellules tuft par des méthodes de routine ainsi que la rareté de ces cellules, ne représentant qu’environ 0.5% des cellules de l’épithélium de l’intestin grêle de souris, ont probablement contribué à la longévité du mystère entourant la fonction de ces cellules. Les premières combinaisons de marqueurs permettant d’identifier les cellules tuft intestinales de façon non ambigüe furent publiées il y a une douzaine d’années avec, notamment, Dclk1 (Doublecortin-like kinase 1), Gfi1b (Growth factor independent 1b), Sox9 (Sex-determining region Y-box 9), Ptgs1 (prostaglandin-endoperoxide synthase 1), Ptgs2 (prostaglandin-endoperoxide synthase 2) et la tubuline acétylée [8, 9, 10, 11] (Figure 1).
Les cellules tuft sont une population minoritaire de l’épithélium intestinal. Villosité intestinale (apex en haut) avec une cellule tuft identifiée par immunofluorescence en utilisant la protéine Dclk1 (blanc) comme marqueur. Les noyaux des cellules sont mis en évidence par une coloration au DAPI (bleu). Barre d’échelle : 10 μm.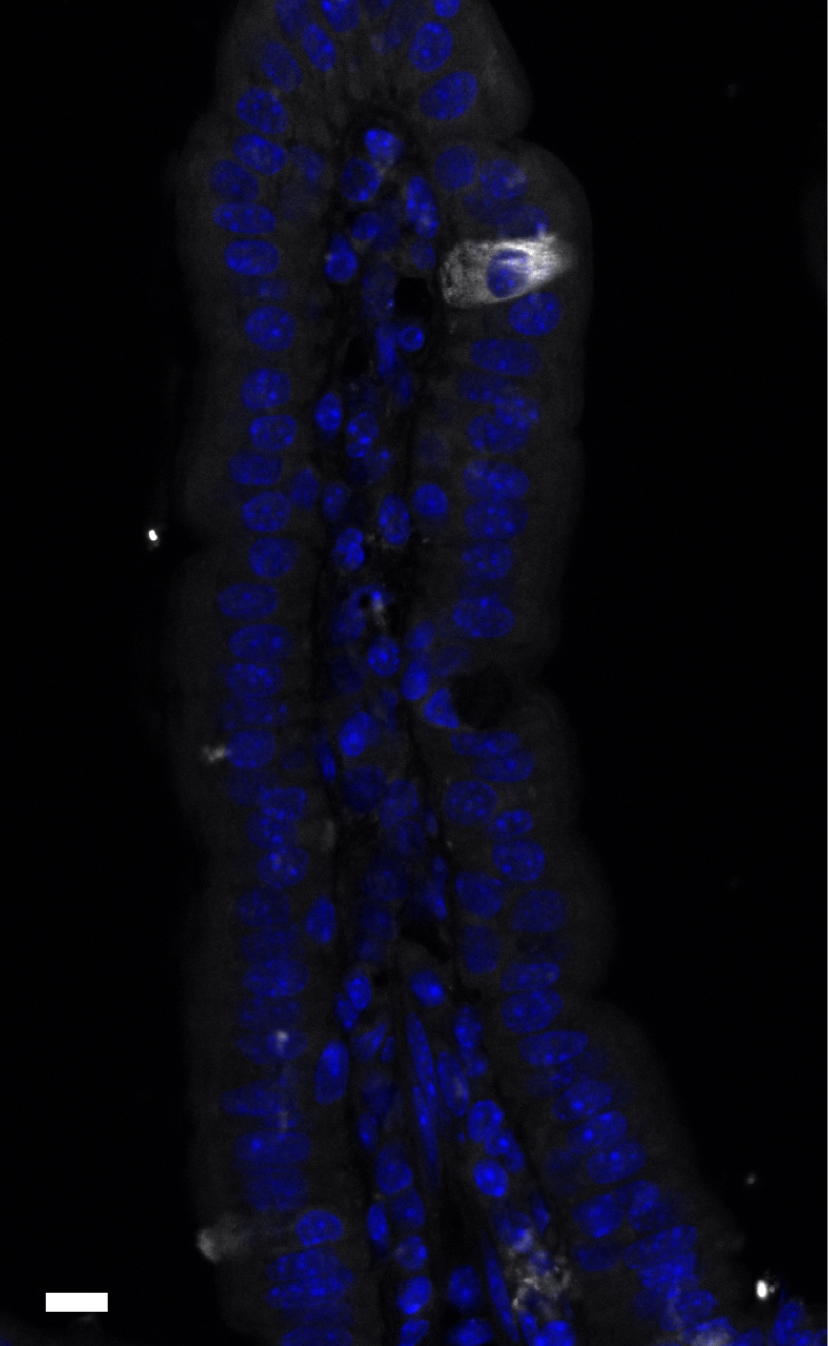
Malgré leur originalité morphologique et moléculaire, les cellules tuft font sans surprise partie de la descendance des cellules souches intestinales [1], comme l’ont montré des expériences de traçage cellulaire à partir des cellules souches exprimant le marqueur Lgr5 (leucine rich repeat containing G protein coupled receptor 5) [9]. La voie de différenciation des cellules tuft diverge ensuite de celles d’autres types cellulaires différenciés comme les cellules entéroencrines, les cellules caliciformes et les cellules de Paneth car leur présence n’est pas affectée par la délétion de, respectivement, Neurog3 (Neurogenin 3), Spedef (SAM-pointed domain-containing ETS transcription factor) et Sox9 (sex-determining region Y-box 9) [9, 11]. Ce n’est que plus récemment que le premier facteur de transcription spécifiquement requis pour la différenciation des cellules tuft, Pou2f3 (POU domain, class 2, transcription factor 3), fut identifié. Son absence conduit à un épithélium intestinal apparemment normal mais dans lequel les cellules tuft sont inexistantes [12].
3. Les cellules tuft : des sentinelles de la muqueuse intestinale
Alors que la fonction des cellules tuft intestinales est restée longtemps mystérieuse, il est assez remarquable que leur première fonction ait été découverte quasi-simultanément pas trois équipes, de façon indépendante et avec des approches différentes. Dans une première étude, c’est l’exploitation d’un modèle murin dépourvu de cellules tuft qui a permis de prouver l’implication des cellules tuft dans l’initiation de réponses immunes de type 2 contre des infections par des helminthes intestinaux tels que Nippotrongylus brasiliensis. En effet, alors que l’infection parasitaire est accompagnée par une expansion spectaculaire du nombre de cellules tuft dans l’épithélium intestinal, l’absence de ces cellules dans des souris déficientes en Pou2f3 cause un important retard dans la mise en place d’une réponse immunitaire et dans l’expulsion des vers. De plus, cette étude a trouvé que les cellules tuft intestinales sont la source de la production épithéliale de la cytokine IL-25, connue comme une alarmine impliquée dans l’initiation de réponses de type 2 [13, 14]. Finalement, cette étude a démontré l’implication des cellules tuft dans l’initiation de réponses de type 2 via le rôle de l’IL-25 grâce à une expérience de traitement de souris déficientes en cellules tuft (Pou2f3−∕−) traitées avec de l’IL-25 recombinante, ce qui permit de restaurer une réponse de type 2 efficace conduisant à une expulsion des vers dans les mêmes délais que dans des souris de génotype normal. Ainsi, l’infection par N. brasiliensis conduit à l’activation des cellules tuft et la production d’IL-25. Cette dernière active les cellules lymphoides innées de type 2 (ILC2), situées dans la lamina propria de la muqueuse intestinale, et résulte en la production d’autres interleukines de type 2, notamment l’IL-13 par les ILC2. L’IL-13, à son tour, cause un remodelage de l’épithélium intestinal, avec une hyperplasie des cellules à mucus, à la base de la réponse appelée « weep and sweep » qui facilite l’expulsion des vers [15], mais aussi une hyperplasie des cellules tuft. Cette dernière peut être interprétée comme une boucle de renforcement positive, avec une plus grande production d’IL-25 et un renforcement de la réponse de type 2 jusqu’à expulsion des vers [12]. En l’absence de cellules tuft, cette boucle n’est pas efficacement initiée (Figure 2).
Mise en place d’une réponse immune de type 2 suite à une infection helminthique. De rares cellules tuft présentes dans l’épithélium intestinal sont activées par des molécules produites directement ou indirectement par les parasites situés dans la lumière intestinale. Les cellules tuft répondent en produisant une cytokine appelée alarmine, l’IL-25, qui active les cellules lymphoides innées de type 2 (ILC2) dans la lamina propria. Ces dernières mettent en place la réponse de type 2, notamment via la sécrétion d’IL-13, dont une des conséquences est l’augmentation du nombre des cellules tuft au niveau de l’épithélium intestinal, induisant ainsi une amplification de la réponse jusqu’à l’expulsion du parasite (ici : Nippostrongylus brasiliensis).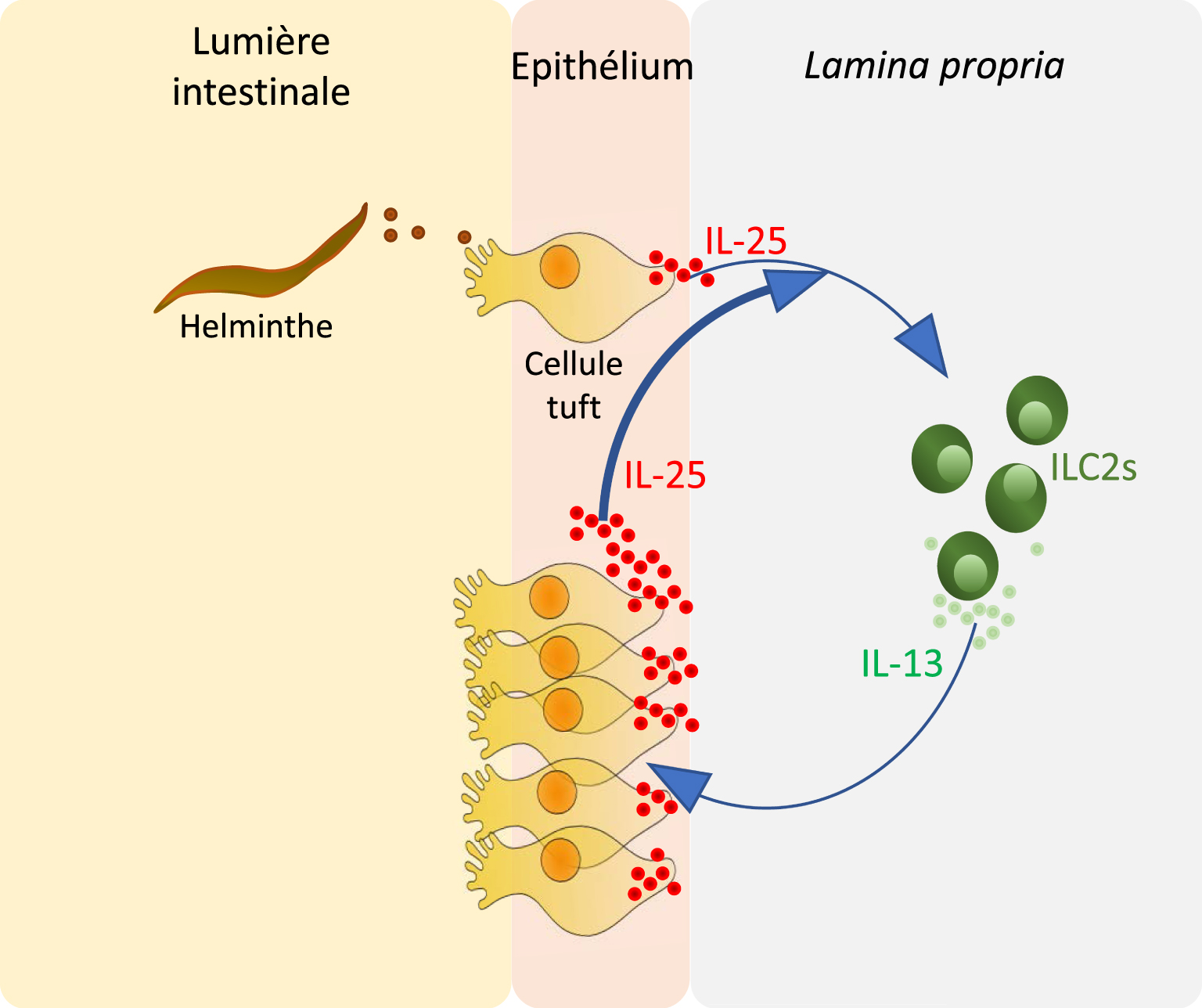
De façon tout à fait indépendante, une autre étude a été réalisée par une équipe travaillant spécifiquement sur les réponses immunes de type 2, grâce à un modèle de souris transgénique (appelé Flare25) permettant à la fois d’invalider le gène codant pour l’IL-25, mais aussi de révéler les cellules exprimant l’IL-25. Ces auteurs ont ainsi démontré la co-expression de l’IL-25 dans les cellules exprimant le marqueur Dclk1, c’est-à-dire les cellules tuft, puis l’amplification de ces cellules au cours de la réponse de type 2 suite à une infection par N. Brasiliensis, sous le contrôle de la boucle ILC2-IL-13 [16] comme dans l’étude précédente.
Les auteurs d’une troisième étude ont utilisé une approche différente, remarquant que l’infection par différents helminthes (N. Brasiliensis, Heligmosomoides Polygyrus) ou protozoaires symbiotiques Tritrichomonas muris avaient en commun de causer une amplification du lignage des cellules tuft. Se basant ensuite sur des travaux antérieurs ayant proposé un rôle de chemo-sensation pour les cellules tuft, notamment avec l’expression de récepteurs du goût et des composants impliqués dans leur signalisation tels que la protéine G gustducin-α [17], la phospholipase β2 [18] et le canal transient receptor potential cation channel, subfamily M, member 5 (TRPM5) [19, 20], ainsi qu’une signalisation calcique stimulée par un traitement avec du dénatonium, une substance amère [21]. Ainsi, utilisant des souris déficientes pour la gustducin-α ou pour le canal Trpm5, les auteurs ont trouvé un retard dans l’expulsion d’H. Polygyrus ainsi qu’une diminution de l’amplification du nombre des cellules tuft et une baisse de l’expression d’IL-25 après colonization par T. muris. A l’inverse, l’injection d’IL-25 recombinante dans des souris déficientes en Trpm5 permet de restaurer l’abondance des cellules tuft, d’une façon dépendante de la signalisation par IL-13. En conclusion, cette étude propose que les cellules tuft intestinales et la chemosensation liée aux récepteurs du goût constituent un système de reconnaissance de signaux parasitaires [22].
4. Quels sont les signaux activant les cellules tuft ?
En même temps, la présence de récepteurs du goût sur les cellules tuft ne fait pas l’unanimité. Certaines études transcriptomiques récentes n’ont en effet pas réussi à mettre en évidence d’expression de récepteurs du goût dans les cellules tuft intestinales [23, 24].
Cependant, d’autres études ont identifié l’expression du récepteur Tas1r3, responsable de la détection des goûts sucré et umami par les papilles gustatives, dans la partie distale de l’intestin grêle de souris. De plus, les souris déficientes pour ce récepteur ne répondent pas aux signaux activateurs de cellules tuft comme le succinate ou le protozoaire Tritrichomonas muris, et ont un effectif réduit de cellules tuft dans leur intestin grêle distal [25]. D’autres analyses ciblées, utilisant la PCR, ont détecté une augmentation d’expression de 3 récepteurs de la famille Tas2rs (Tas2r117, Tas2r136 et Tas2r143) dans des organoides [26] de souris traités par l’interleukine-13 (IL-13) et la co-expression de ces récepteurs avec Dclk1, un marqueur de cellules tuft, a été validée par hybridation in situ [27].
Alors que le rôle des récepteurs du goût dans l’activation des cellules tuft reste encore controversé, plusieurs études se sont intéressées à d’autres récepteurs couplés aux protéines G exprimés par les cellules tuft. Les récepteurs des acides gras à chaine courte (Ffar3) et du succinate (Sucnr1), par exemple, sont exprimés spécifiquement par les cellules tuft dans l’épithélium intestinal [28], et pourraient constituer un relai entre la présence de métabolites produits par la flore commensale et l’activation des cellules tuft. En effet, le traitement de souris par du succinate dans l’eau de boisson suffit à induire une prolifération marquée des ILC2 et la production d’IL-13 par ces mêmes cellules, ainsi que l’hyperplasie des lignages des cellules tuft [28] et des cellules à mucus, de façon dépendante de la gustducin et de Trpm5 [29]. D’autres acides gras à chaine courte comme l’acétate, le butyrate ou le propionate n’ont pas les mêmes propriétés activatrices, pointant vers une certaine spécificité du succinate comme un métabolite capable d’activer les cellules tuft et, en conséquence, initier une réponse immune de type 2. De plus, l’activation des ILC2s par le succinate requiert la présence de cellules tuft et d’IL-25, et se retrouve significativement réduite en absence de Trpm5, confortant la présence d’un axe fonctionnel succinate-cellules tuft-Trpm5-IL-25-ILC2s. Restait à identifier des organismes luminaux capables de produire du succinate. Cette propriété a été bien démontrée pour Tritrichomonas, puisque la mono-infection de souris axéniques avec ce protozoaire cause une augmentation du niveau de succinate [28]. Il est intéressant de noter que le succinate est aussi un métabolite pouvant être produit (et métabolisé) par le microbiote intestinal. Il a ainsi été démontré que des modifications du microbiote, par exemple suite à un traitement antibiotique avec de la streptomycine, ou une altération de la motilité intestinale causée par un traitement avec du polyethylène glycol, peuvent causer une élévation de la concentration luminale en succinate [30]. Le rôle du récepteur au succinate (Sucnr1 ou Gpr91), spécifiquement exprimé par les cellules tuft au sein de l’épithélium intestinal, a bien été démontré avec des souris déficientes pour ce récepteur (Sucnr1−∕−) qui ont une réponse immunitaire diminuée suite à des traitements avec de la streptomycine ou du polyethylène glycol [29]. Pour autant, la relation entre le succinate, le récepteur Sucnr1, et l’initiation d’une réponse de type 2 ne semble pas encore complètement comprise car des souris déficientes en Sucnr1 répondent normalement à l’infection par l’helminthe Nippostrongylus brasiliensis, qui produit aussi du succinate [29].
5. Conclusion et perspectives
Après avoir été remarquablement ignorées pendant un demi-siècle, les cellules tuft sont l’objet d’une attention croissante. Ces cinq dernières années ont permis des avancées spectaculaires, notamment l’identification de la première fonction des cellules tuft intestinales comme sentinelles de cette muqueuse. Grâce à une palette d’outil en génétique de souris, nous commençons à identifier les circuits de signalisation qui sont activés dans les cellules tuft, ainsi que certains des signaux produits par les microorganismes luminaux permettant cette activation. Pour autant, la compréhension de la multiplicité des signaux activant les cellules tuft, ainsi que des cascades de signalisation résultantes dans les cellules tuft et leurs conséquences physiologiques n’en est qu’à ses balbutiements et les années à venir permettront sans doute d’apprécier plus pleinement le rôle de ces cellules aussi rares dans la muqueuse intestinale qu’essentielles pour la régulation de son homéostasie.




 CC-BY 4.0
CC-BY 4.0