La version française de l’article est disponible à la suite de la version anglaise
1. Introduction
Shoot apical meristems (SAMs) are population of stem cells which initiate all the aerial parts of higher plants, including leaves, reproductive organs, stems and branches. We will discuss here also floral meristems (FMs), which are specialized forms of the SAM and share many of the regulatory components and principles (for reviews see e.g. [1, 2, 3]). Where appropriate, we will refer to these two meristems as shoot meristems. In view of their central role in plant development, shoot meristems have received considerable attention over the last centuries. They were first extensively studied from a geometrical and histological perspective (see [1] for review). This led to the view of the shoot meristem as a complex structure composed of distinct domains with specific functions. In higher plants one can distinguish the central zone at the meristem summit, where the undifferentiated stem cells are maintained and the surrounding peripheral zone, where new lateral organs and, in the SAM, new meristems are initiated in very stereotyped positions through a process called phyllotaxis (Figure 1). Depending on the species, the SAM can maintain itself for an indeterminate time or stop after having produced a limited number of organs. FMs usually terminate after the production of the floral organs which in many species occurs after the re-specification of the central zone in organ primordia. Below the central and peripheral domains, the rib meristem produces inner tissues, including the vascular system. Superimposed on this organization into zones one can observe, depending on the species, one, two or sometimes even more cell layers, which form the so-called tunica and which remain separated from the inner cell populations also termed the corpus.
Meristem structure and core molecular regulatory network. (A) A three-dimensional surface reconstruction of an inflorescence meristem visualized using the Morphonet interface, an online tool that allows for the visualization and analysis of this type of data [4]. The original meristem was visualized in a confocal microscope and then segmented using MARS software (for technical details see [5]). (B) Schematized cross-section through the same inflorescence meristem following the dotted line in A, showing the different zones in different shades of green. Superimposed is the core molecular network discussed in the text. The color codes of the elements of the network correspond to the zones where they are active (except auxin, which has a reduced activity in the meristem itself). Cytokinin promotes peripheral and central zone identity, but the precise chain of interactions is not known. A non-exhaustive set of interactions is presented in the form of black arrows (positive regulation) and red arrows (negative regulation).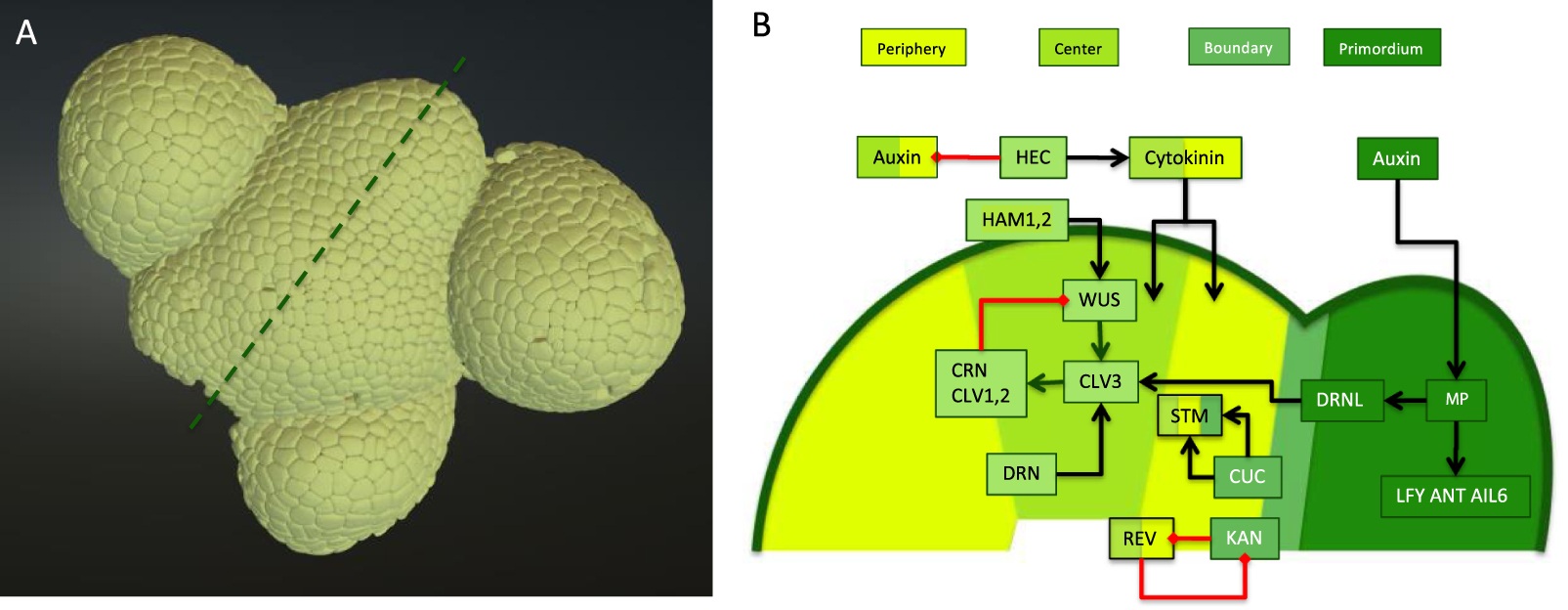
During the last decades this structural analysis has been enriched with the identification and characterization of a dense molecular regulatory network involved in shoot meristem function [6, 7, 8, 9, 10, 5]. Extensive molecular genetics combined with gene and protein expression studies and in vivo analysis have placed SAMs and FMs amongst the best studied systems in (plant) developmental biology.
The loss of function of many regulatory genes causes important perturbations in organ numbers, arrangements and shape. This suggests that these genes somehow must affect local growth parameters at the meristem, but how they control morphogenesis is not well understood. As a result, we are often forced to express gene function in a relatively abstract and qualitative manner. In this review, we will present some of the main conclusions coming from previous studies while discussing existing and possible approaches to address this extremely challenging issue. Unless stated otherwise, this review concerns work on Arabidopsis thaliana.
2. The molecular network
A number of transcription factors have been associated with the different functional zones in shoot meristems (Figure 1), which will be briefly discussed in the paragraphs below.
2.1. The core transcriptional network
A major player is the homeobox gene SHOOTMERISTEMLESS (STM), which is expressed in both the central and peripheral zones of the SAM but is excluded from the young organ primordia in Arabidopsis [11, 12]. In FMs, STM is initially inactivated, but rapidly reactivates when the flower primordium starts to grow out. STM is necessary for meristem formation and maintenance, and loss of function mutants are devoid of a functional SAM. Although STM has been widely studied, its precise function has not been established and is described as being required for meristem identity, a term which has remained relatively vague.
A well-known regulatory loop involving transcriptional regulation and cellular signaling is necessary for meristem maintenance at the meristem summit ([13, 14], for reviews [15, 16]). The small signaling peptide CLAVATA3 is produced in the outer two or three cell layers of the central zone. It is under control of a transcription factor, WUSCHEL, expressed in a zone partially overlapping with and just below the CLV3 expressing domain. CLV3 itself diffuses beyond its own expression domain to the inner layers of the meristem where the receptor kinase CLV1 is expressed. Together with a co-receptor, CLV2, the kinase inhibits the expression of WUS upon binding with CLV3. This negative regulatory loop is essential in controlling meristem size. If the CLV complex is inactive, the central population of stem cells increases gradually in size, while the absence of WUS results in meristem arrest.
Although at a low rate, the cells at the central zone are growing and dividing and sooner or later some of their descendants will leave the zone controlled by WUS and the CLV complex. These will enter the peripheral zone, maintaining expression of STM. Even further away from the meristem center, some of the peripheral zone cells will be selected to form organ initials. As will be described further below, the initiation of new organs occurs at sites where the plant hormone auxin accumulates [17, 18, 19]. Auxin then activates a network of transcription factors, which will promote outgrowth [20]. An important role is played by the auxin response factor MONOPTEROS (MP). Full loss-of-function mutations in MP show a reduced capacity to form organs [21]. In particular the inflorescence has a striking phenotype, as knock-out mutants form a naked, pin-like inflorescence stems which only form a few or no flowers at all. The network operating downstream of MP has been mainly characterized in the inflorescence meristem. Three transcription factors, LEAFY (LFY, a direct target), AINTEGUMENTA (ANT), and AINTEGUMENTA LIKE 6 (AIL6) are operating directly downstream of MP [20, 22]. The triple ant ail6 lfy knockout is severely impaired in organ formation at the inflorescence SAM, showing that all three genes are required for flower initiation and outgrowth. Besides the genes controlling meristem formation and organ outgrowth, a number of transcription factors are involved in separating the individual organs from the rest of the meristem. The best characterized of these genes, strongly expressed at the so-called organ boundary domains, are CUP SHAPED COTYLEDON (CUC) 1–3 [23, 24, 25]. Although again their precise molecular function has not been identified, there is strong evidence that they inhibit growth at organ boundaries. In addition, they are associated with meristem function as there are indications that they activate STM, which is expressed in boundary domains as well [26].
2.2. Towards a more comprehensive view of molecular regulation
While the factors discussed above all play important roles at the shoot apex and are often considered as the core network controlling shoot meristem function, further studies have revealed even more complex regulatory interactions. An exhaustive presentation would be beyond the scope of this review, but the examples given below illustrate the complexity of the system.
Certain transcription factors such as CORYNE (CRN) and HAIRY MERISTEM (HAM) stabilize the WUS/CLV feedback loop [27, 28]. Others are involved in the more general coordination of shoot meristems. For example, HECATE (HEC) genes encoding a group of bHLH transcription factors modulate meristem organization by promoting central zone identity and inhibiting cell differentiation at the periphery via hormonal signaling [29]. DORNRÖSCHEN (DRN) and DORNRÖSCHEN-LIKE (DRNL), two transcription factors of the APETALA2 family, synergistically act to control CLV3 expression [30, 31] see also [32]. There is good evidence, that DRN directly binds the CLV3 promoter inducing expression of the latter. DRN-expression, in turn, is inhibited by MP at the meristem periphery. Indeed at least in the SAM, MP expression occurs along a gradient: RNA-levels are low at the meristem centre and high at the periphery [30, 33], thus indirectly restricting the activation of CLV3 to the meristem centre. In this manner, MP is also important in controlling the balance between meristem maintenance and organ formation at the periphery. Whereas DRN fits quite well in the picture, this is less the case for DRNL, which, like MP, is mostly expressed at the meristem periphery in the organ founder cells and it remains unclear how the gene affects CLV3 expression.
In addition to MP and its downstream targets, two transcription factors with opposing function, KANADI (KAN) and REVOLUTA (REV) play a role in defining leaf positioning. Mutants for KANADI can produce ectopic leaves on different organs while plants mutant for REV, PHABULOSA and PHAVOLUTA, all members of the HD-ZIPIII family, are severely perturbed in meristem formation [34]. A recent study by [35] showed that the REV promoter was active in the meristem proper, while the KAN promoter was mostly active at and around organ boundaries. Interestingly, new organs are centred on the region located between the expression domains of REV and KAN genes. The authors suggested that both genes repress organogenesis where they are expressed.
Upon the transition to flowering, the transcription factor LFY becomes activated in the lateral meristems, which then turn into flowers, producing different types of organs. As indicated earlier, LFY is involved in organ outgrowth and profoundly influences organ shape, together with ANT and AIL6. LFY acts in part via other regulators, as it activates an extensive network of transcription factors which controls floral organ identity and architecture (e.g. [5, 36, 37]), which we will not discuss in detail here. Additional genes, including KAN and REV, define abaxial/adaxial polarity of leaves and floral organs (e.g. [34, 38]).
Extensive analysis by many research groups has led to a relatively detailed view of the genetic interactions and expression patterns of the gene network discussed above. In a recent study, Refahi et al. [5] produced an integrated view of the available data in the FM, which, as mentioned earlier, shares many of the regulatory principles found in the SAM. They projected the expression patterns of 28 regulatory genes on the different stages of a 3D reconstruction of a growing floral meristem. Using a simplified version of the expression patterns, where genes are either on or off, their analysis suggests the existence of at least 31 different domains in the first two layers of the developing meristem, where cells express specific combinations of these transcription factors. If we take into account that gene expression occurs often in gradients of one or two cells wide, we can safely propose that every single cell has its own identity in terms of gene expression combinations.
2.3. The coordination of molecular regulation in time and space
How do these patterns arise and how are they coordinated in time and space? Two major processes play a role. Since they are not the main topic of this review, we will only briefly discuss them for the sake of completeness and the reader is referred to a number of reviews for further reading. First, the local interactions, including inhibitions and activations through transcriptional or posttranscriptional control are essential. This can involve the movement of transcription factors between cells, while several meristem regulators, are controlled via miRNA pathways, which can also operate in gradients (see for example [39]). Second, plant hormones, and in particular auxin and cytokinins are central in patterning (for review see [18]). Cytokinins play an important role in the control of meristem identity and in particular their role in meristem maintenance has been studied. The role of auxin in shoot meristem function has also been documented extensively. Auxin is transported from cell to cell via membrane localized transporters of the AUX (import) and PIN-FORMED (PIN) (export) families [40, 41]. In Arabidopsis meristems, this transport mainly occurs in the outer layer (L1) and pro-vascular strands where it leads to the patterned formation of auxin maxima and minima [17, 19]. This is then translated by the auxin response pathway. We already mentioned the auxin response factor MP which is central in organ initiation and activated at auxin maxima. Other genes, in particular CUCs but also KAN are mainly active at low auxin concentrations, in particular at organ boundaries. How the patterns of auxin distribution are regulated is not precisely known, but a mechanism where auxin is systematically transported towards regions with higher concentrations (i.e. against a gradient) is theoretically sufficient to explain the accumulation of auxin at specific positions [35, 42]. Alternative models propose mechanisms where the cells do not measure local auxin concentration, but auxin fluxes [43]. Besides transport, auxin synthesis and auxin sensitivity are of course important. The central zone of the meristem under control of the WUS/CLV pathway, has low auxin sensitivity, which might prevent the formation of organs there [44]. Reduced sensitivity is correlated with low expression levels of a range of auxin response factors [33]. Other hormones have been associated with meristematic activity as well, in particular brassinosteroids [45] and gibberellic acid (mainly with the control of flowering, e.g. [46]), but these will not be discussed here.
3. Integrating molecular information and geometry
A major role of the molecular regulatory network is to coordinate the patterns of growth. Morphogenesis involves many players and processes operating at multiple scales with multiple feedbacks. Therefore, it has been difficult to address. For many years the approach has been to look at the effects of individual genes on growth and development. This is often achieved in a qualitative manner and as a result gene function is usually expressed in general terms such as organ identity or organ polarity, referring to their main mutant phenotype. A first step towards a better understanding is to obtain detailed, quantitative information on morphogenetic patterns in the form of growth rates and growth directions. Gene function can then be correlated with these quantitative outputs [47]. For the SAM and floral meristems, which are embedded in more mature tissues, this has required the development of live imaging methods, allowing the direct visualization of living meristems using confocal microscopy [48, 49]. These studies have provided a wealth of information on the growth patterns at the shoot apex. A very detailed quantitative analysis of the growing floral meristem was carried out by Refahi et al. [5], including a full lineage analysis of the two outer layers of the flower from initiation to stage (5), when the sepals start to cover the meristem. These studies show that growth at the meristems is reduced at the central zones and in organ boundaries when compared to the peripheral zone. Organ initiation is also characterized by an increase in growth rate. Absolute values can vary during development, as well as relative growth rates of cells at a particular stage. Typically, growth rates varied between 0.01 and 0.12 mm3∕h in one of the young FMs observed. Cells in young organ primordia grew twice as fast as those in the peripheral zone of the FM. The results also point at a certain level of stochasticity, where each cell has its own growth rate.
Quantitative analysis of growth is a first step, the next question is how the morphogenetic patterns relate to gene expression. An apparently straightforward approach is to correlate gene expression patterns with the growth patterns, the idea being that growth promoting genes will be expressed in more rapidly expanding domains. The problem here is that many genes are active in a particular domain and that the growth of a particular group of cells might be the result of both growth promoting and growth inhibiting activities. This problem was addressed by Refahi et al. [5] in the floral meristem. They found that only a limited number of individual genes can be consistently connected to low or high relative growth rates just based on their expression patterns. Indeed, most genes are expressed in domains with very broad distributions of growth rates suggesting no direct interference with growth control. Therefore, correlations were investigated starting from pairwise comparisons of genes with partial overlapping expression patterns. The idea was to see if the cells expressing gene A were growing more slowly or more rapidly in the sub-set of cells where they were co-expressed with another gene B. This would identify gene B as having potentially a growth-inhibiting or promoting activity within the cell population where A is expressed. Interestingly, a systematic pairwise analysis showed that LFY and ANT, both expressed in the young flower primordium, were systematically expressed in the more rapidly growing subregions. This could already be predicted from previous genetic and phenotypic studies [20, 50]. However, this was not the case for MP, which was found expressed mainly in slowly growing subpopulations, although the phenotype of mp mutants (reduced flower outgrowth) suggested it rather promoted growth. This points at a broader and more indirect role of MP in growth control. A second approach to clarify the precise role of molecular regulators in morphogenesis is to analyze the behavior of mutants and to compare them quantitatively with the wild type. This is again very challenging, as differences between wild type and mutants might be quite dramatic and can be due to indirect effects. Mechanical interactions between cells, in particular between slowly and rapidly growing cells are also involved, making interpretations in terms of the local specification of growth rates by regulators even more complex [47]. For this purpose, mechanical models in the form of virtual tissues have been used to help in the interpretation. More qualitatively oriented studies in this direction have been successfully carried out for flower development in different species. Sauret-Gueto et al. [51] looked at growth patterns in the young petal of Arabidopsis. To interpret the quantified patterns of growth they used a modelling framework for tissue growth, termed the Growing Polarized Tissue (GPT) framework. The model can capture overall growth rates and directions of tissues in three dimensions, and takes into account mechanical interactions between different regions. By testing different scenarios, optimal parameter values for growth rates and anisotropy were determined that semi-quantitatively reproduced the geometrical changes observed in vivo, both in wild type and mutant plants. An even more detailed quantitative analysis was used to compare growth patterns in the early flower primordia of both wild type and lfy mutants [5]. This revealed that the difference in growth rate between the organs and their boundaries was reduced in the mutant. In wild type, the primordia cells grew 2 times as faster than their neighbors in organ boundaries. In the lfy mutant this was reduced to 1.6 times. This reduction might seem relatively modest, but cumulated over several days it will likely have a substantial impact. This led to the hypothesis that LFY is involved in coordinating cell expansion rates within specific subdomains, in particular to maintain sufficient growth rate differences between the sepals and sepal boundaries.
At this moment these two approaches, (i) quantitatively correlating gene expression with growth patterns and (ii) comparing growth between mutants and wild type, seem the most promising ways forward, although they are very labor intensive.
4. The next challenge: towards a more mechanistic insight
We have so far focused on the link between gene regulation and the changes in geometry that occur during growth. This relationship is, however, indirect and for a more profound understanding of morphogenesis we also need to analyze the processes that operate in the black box that links genetics and shape (Figure 2). These processes not only include biochemical regulation but also the physical properties of the cells. Plant cells are under high internal turgor pressure and prevented from bursting by the surrounding cell wall (for reviews see [52, 53]). Composed of rigid cellulose microfibrils embedded in a viscous matrix of pectin and hemicellulose polymers, the wall can be considered as a fiber-reinforced gel. This gel is maintained under constant tension and it is generally thought that growth occurs when the walls yield to the pressure (e.g. [54] and for further discussion [55]). Above a certain pressure threshold, bonds between the polymers are broken causing the wall to expand. The resulting loss in wall thickness and stiffness is compensated by a constant synthesis and insertion of new wall polymers in the growing wall. The cellulose microfibrils have a particular function in the whole process. They are deposited in the wall in specific arrangements, which determine the growth-directions of the cell. If they are randomly oriented, the cell will tend to grow isotropically. They can, however also be synthesized in highly oriented arrays, restricting cell expansion along their direction thus inducing anisotropic growth. The orientation of newly deposited cellulose polymers depends on the microtubular cytoskeleton, which guides the cellulose synthesizing complexes in the plasma membrane. Although cellulose is considered as the main determinant of growth anisotropy, pectin polymers are also involved [56], but their precise role is less well documented. The different parameters of the process such as the level of turgor pressure, wall stiffness, yielding threshold or orientation of the cellulose microfibrils depend on the activity of multiple enzymes. Thus, many proteins are directly involved in the modification and synthesis of specific wall components in the meristem [57, 58]. In the face of this almost unfathomable complexity, it is absolutely necessary to take a step back and to simplify. In simple terms, the genetic network controlling morphogenesis can target three pathways: it can act on the stiffness of the cell wall (i), it can act on its mechanical anisotropy (mainly via the orientation of the cellulose microfibrils) (ii) and it can influence turgor pressure (iii). A first step towards a more mechanistic understanding of growth control might therefore be to study and, if possible, quantify these three different parameters. Instead of expressing gene activity in terms of geometry, we can then correlate local molecular regulation with mechanical properties. While this approach is conceptually attractive and logical, it poses a number of technical challenges, which the field has been trying to tackle in the meristem, as we will briefly review in the next paragraphs.
Major outstanding questions regarding meristem function. The meristem is a multiscale system. At the molecular scale, transcription factors, hormones and other elements organize into a regulatory network. One type of targets of this network are the cell wall modifying enzymes. At the cellular level, molecular activity translates into specific wall composition, turgor pressure and mechanical properties. At the level of the tissue, this is translated into local growth rates and directions. Multiple feedbacks exist between these scales. This system needs to be analyzed at multiple scales, using multidisciplinary approaches.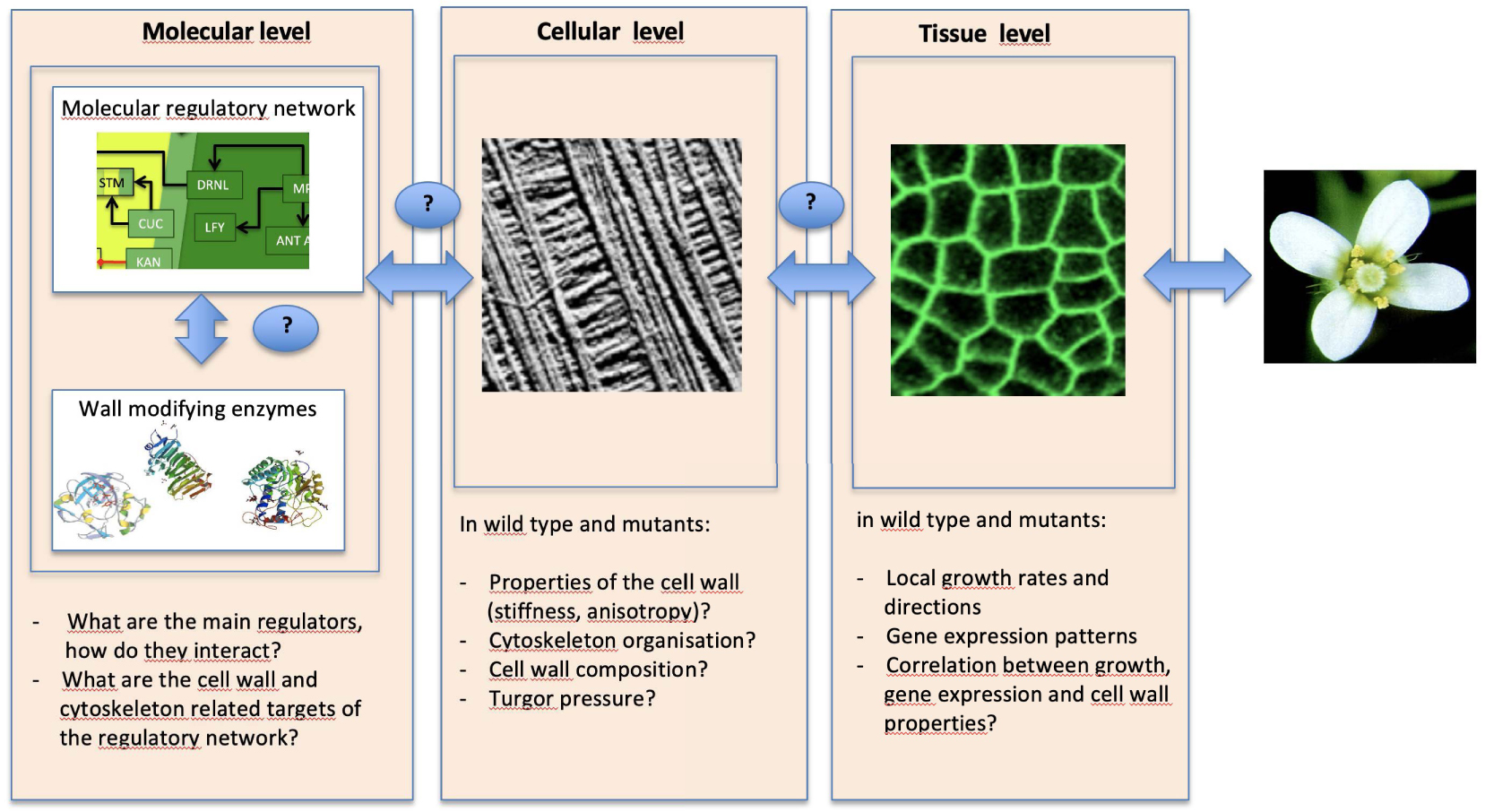
4.1. Wall stiffness
Wall stiffness or elasticity of meristematic cells has been mainly analyzed using atomic force microscopy (AFM, for discussion see [59]). A small tip at subcellular scale is used to push on the cell surface using a cantilever. The deformation of the cantilever is then a measure for the stiffness of the wall. Although the method is elegant and direct, it can be difficult to interpret the results. Small tips (tens of nanometers wide) provide only very local information, equivalent to pushing on the surface of a car tire with a screwdriver. In addition, the mechanical properties are mainly probed perpendicular to the wall surface and it is not clear how this refers to the properties within the plane of the wall. This is relevant in a situation where the cellulose fibers can impose anisotropic mechanical properties in this plane. Bigger tips can be used for deeper indentations, but in that case the measurements will also include information on the mechanical properties beyond the cell wall (see also next paragraph). Finally, the method does not give much information on internal cell walls. Kierzkowski et al. [60] have used a more indirect method to probe the mechanical characteristics of the cell walls at the meristem. They treated meristems with an osmolyte to plasmolyse the cells and subsequently looked at how the cells shrank, which provided information on the level of elastic deformation. This method has its own shortcomings. The changes in cell size after plasmolysis can be extremely small, at the limits of what can be detected with a light microscope. The study nevertheless revealed differences in properties between the central zone and the periphery of the meristem in tomato, pointing at the presence of cell walls stressed beyond their linear range (strain stiffening).
4.2. Wall anisotropy
Since microtubules are guiding the deposition of cellulose microfibrils, the control of wall anisotropy has been very extensively analyzed by visualizing the dynamics of the microtubular arrays at the meristem. This has revealed domains with a coherent organization of microtubules in neighboring cells [61, 62]. Cells that are isotropically growing at the meristem summit show random microtubule arrays. By contrast, cells towards the periphery, in particular those at organ boundaries, have highly ordered microtubules. Quantitative analysis combined with mechanical modelling has led to the hypothesis that the cytoskeleton is aligning itself along the principal direction of force at the meristem surface using a yet unknown mechanism [61]. The method remains indirect, however, and other methods have been aimed at visualizing the cellulose microfibrils directly. High resolution scanning EM (FESEM) was used to look at cellulose in the young growing flower [63]. Although this method is still in its infancy, it confirmed that cellulose microfibrils at organ boundaries were organized in highly anisotropic arrays, while those at the top of the meristematic dome were less well aligned. Alternatively, staining methods can be used. Fluorescent cellulose stains exist, but since microfibril thickness is far below the resolution of light microscopes and the fibers are tightly packed it is not sure if these staining methods are reliable to study the meristem [63].
4.3. Turgor pressure
Several methods to directly or indirectly measure turgor pressure have been developed since the late 19th century (reviewed in [59]). However, well established methods using for example pressure probes or ball tonometry have not (yet) been adapted to analyze the small meristematic cells. Recently, AFM based methods have been most successful. This requires deeper indentations with bigger tips, which are sensitive to both cell wall mechanics and turgor. To distinguish the effects of both parameters, the osmolality of the external medium is varied. The final interpretation and estimations of the turgor pressure are then obtained using computational models [64].
The approaches described above have resulted in a coarse map of the mechanical properties of the meristematic cells. Ideally, we should be able to express gene function in terms of these different parameters. Based on the available data, a number of hypotheses can already be proposed. The CUC genes, strongly associated with the organ boundaries are expressed in cells with stiff and highly anisotropic walls. Genes expressed in rapidly growing organ primordia are active in cells with more elastic walls. This provides some indications, but a much more detailed view on the mechanics in time and space is required to propose causal relationships, for example to find out if changes in gene expression precede changes in mechanics or not. Milani et al. [65] combined AFM and confocal microscopy to visualize the mechanical properties of cells in the central zone of single FMs (Quantitative Tandem Epifluorescence and Nanoindentation or qTEN). Their results indicated that an increase in wall stiffness is strictly correlated with the activation of the WUS/CLV pathway in the FM, which is in line with this pathway interfering with wall mechanics.
In parallel, many studies have taken the field even further downstream of hormonal or transcriptional regulation, looking at expression patterns of cell wall regulating genes at the meristem [57, 58], or identifying cell wall related targets of important regulators (e.g. [66]). These studies have also revealed that regulation is not only top-down, but that feedback regulations at the level of cell wall or cytoskeleton itself are also important. Local sensing of wall integrity involving local receptors can play a role in the coordination of growth for example [67, 68]. There is also evidence that mechanical forces are directly sensed by the wall and cytoskeleton, causing microtubules to align themselves along stress fields without the direct directional instruction by transcriptional regulation or chemical gradients [61]. The challenge will be to integrate this information as well in our efforts to span the entire chain between molecular regulation and tissue geometry (Figure 2).
5. Conclusion
Conceptually the idea of a network of transcriptional regulators controlling morphogenesis via the local modulation of wall synthesis and turgor pressure might seem straightforward. However, the number of molecular players, the existence of multiple feedback mechanisms and thus the complexity of the whole process make it a problem that is still difficult to tackle. Fortunately, a number of technical advances are cause for optimism. There have been continuous developments of novel quantitative imaging techniques. Novel probes and marker-lines have been generated. Methods to investigate the mechanical properties of cells and tissues are becoming available. In parallel, genetic analysis has continued. The wealth of information coming from these approaches needs to be integrated and interpreted. This should be greatly facilitated by computational models, which are becoming more and more sophisticated. Taking into account that morphogenesis involves probably thousands of genes, the task seems daunting. However, even if a full inventory is hard to achieve, the approaches described here should generate optimal conditions for novel insight and an increased understanding of morphogenesis.
Conflicts of interest
The author has no conflict of interest to declare.
Acknowledgements
This article is dedicated to the memory Michel Caboche who encouraged me to study shoot apical meristem function almost 30 years ago. I also would like to thank Christophe Godin for helpful discussions.
Version française
1. Introduction
Les méristèmes apicaux caulinaires (MACs) sont des populations de cellules souches qui initient toutes les parties aériennes des plantes supérieures, y compris les feuilles, les organes reproducteurs, les tiges et les branches. Nous aborderons également ici les méristèmes floraux (MF), qui sont des formes spécialisées des MACs et partagent de nombreux composants et principes de régulation (pour des études, voir par exemple [1, 2, 3]). Le cas échéant, nous nous référerons à ces deux méristèmes comme des méristèmes caulinaires. En raison de leur rôle central dans le développement des plantes, les méristèmes caulinaires ont fait l’objet d’une attention considérable au cours des derniers siècles. Ils ont d’abord été largement étudiés d’un point de vue géométrique et histologique (voir [1] pour une revue). Cela a conduit à considérer le méristème apical caulinaire comme une structure complexe composée de domaines distincts ayant des fonctions spécifiques. Chez les plantes supérieures, on peut distinguer la zone centrale au sommet du méristème, où les cellules souches indifférenciées sont maintenues et la zone périphérique environnante, où de nouveaux organes latéraux et, dans le MAC, de nouveaux méristèmes sont initiés dans des positions très stéréotypées par un processus appelé phyllotaxie (Figure 1). Selon l’espèce, le MAC peut se maintenir pendant un temps indéterminé ou s’arrêter après avoir produit un nombre limité d’organes. Les méristèmes floraux se terminent généralement après la production des organes floraux, ce qui, chez de nombreuses espèces, se produit après la re-spécification de la zone centrale en primordia. Sous la zone centrale et la zone périphérique, le méristème médullaire produit les tissus internes, y compris le système vasculaire. En superposition à cette organisation en zones, on peut observer, selon les espèces, une, deux ou parfois même plusieurs couches cellulaires, qui forment ce que l’on appelle la tunique et qui restent séparées des populations cellulaires internes également appelées corpus.
Structure du méristème et réseau central de régulation moléculaire. (A) Reconstruction tridimensionnelle de la surface d’un méristème d’inflorescence visualisé à l’aide de l’interface Morphonet, un outil en ligne qui permet la visualisation et l’analyse de ce type de données [68]. Le méristème original a été visualisé dans un microscope confocal puis segmenté à l’aide du logiciel MARS (pour les détails techniques, voir [5]). (B) Coupe transversale schématisée à travers le même méristème d’inflorescence suivant la ligne pointillée en A, montrant les différentes zones dans différentes nuances de vert. Le réseau moléculaire central discuté dans le texte est superposé. Les codes de couleur des éléments du réseau correspondent aux zones où ils sont actifs (sauf l’auxine, dont l’activité est réduite dans le méristème lui-même). La cytokinine favorise l’identité des zones périphériques et centrales, mais la chaîne précise des interactions n’est pas connue. Un ensemble non exhaustif d’interactions est présenté sous forme de flèches noires (régulation positive) et de flèches rouges (régulation négative).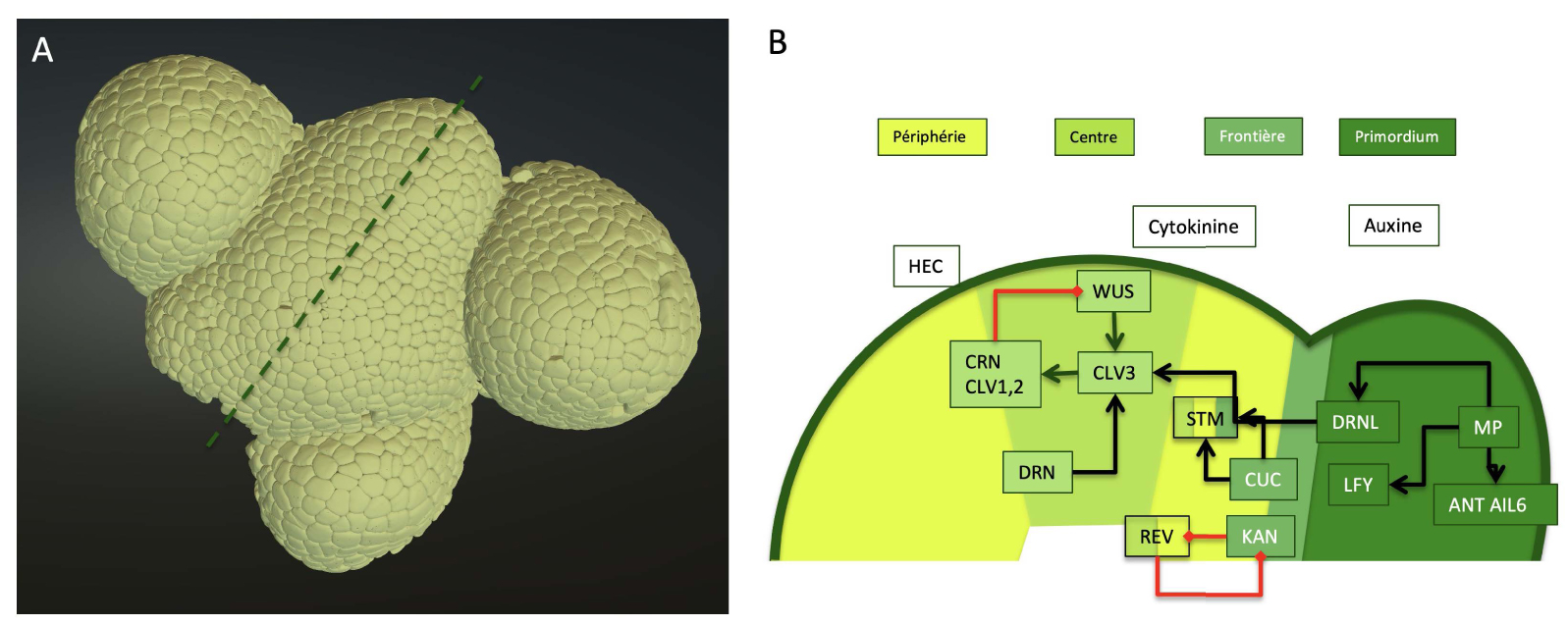
Au cours des dernières décennies, cette analyse structurelle a été enrichie par l’identification et la caractérisation d’un réseau dense de régulation moléculaire impliqué dans la fonction du méristème apical [6, 7, 8, 9, 10, 5]. Une analyse génétique moléculaire détaillée, combinée à des études d’expression des gènes et des protéines et à des analyses in vivo ont placé les MACs et les MFs parmi les systèmes les mieux étudiés en biologie du développement (des plantes).
La perte de fonction de nombreux gènes régulateurs provoque d’importantes perturbations dans le nombre, la disposition et la forme des organes. Cela suggère que ces gènes doivent d’une manière ou d’une autre affecter les paramètres de croissance locaux au niveau du méristème, mais la manière dont ils contrôlent la morphogenèse n’est pas bien comprise. Par conséquent, nous sommes souvent contraints d’exprimer la fonction des gènes d’une manière relativement abstraite et qualitative. Dans cette revue, nous présenterons quelques-unes des principales conclusions tirées d’études antérieures tout en discutant des approches existantes et possibles pour aborder cette question extrêmement difficile. Sauf indication contraire, cette revue concerne les travaux sur Arabidopsis thaliana.
2. Le réseau moléculaire
Un certain nombre de facteurs de transcription ont été associés aux différentes zones fonctionnelles des méristèmes caulinaires (Figure 1), qui seront brièvement discutés dans les paragraphes ci-dessous.
2.1. Le réseau transcriptionnel central
Un acteur majeur est le gène homéobox SHOOTMERISTEMLESS (STM), qui est exprimé à la fois dans les zones centrales et périphériques du MAC mais est exclu des primordia des jeunes organes chez Arabidopsis [11, 12]. Dans les MFs, STM est initialement inactivée, mais se réactive rapidement lorsque le primordium de la fleur commence à se développer. STM est nécessaire pour la formation et le maintien du méristème, et les mutants de perte de fonction sont dépourvus d’un SAM fonctionnel. Bien que STM ait été largement étudiée, sa fonction précise n’a pas été établie et elle est décrite comme étant nécessaire à l’identité méristématique, un terme qui est resté relativement vague.
Une boucle de régulation bien connue impliquant la régulation transcriptionnelle et la signalisation cellulaire est nécessaire pour le maintien du méristème ([13, 14], pour des revues [15, 16]). Le petit peptide de signalisation CLAVATA3 est produit dans les deux ou trois couches cellulaires extérieures de la zone centrale. Il est sous le contrôle d’un facteur de transcription, WUSCHEL, exprimé dans une zone recouvrant partiellement et juste en dessous du domaine ou CLV3 est exprimé. CLV3 lui-même diffuse au-delà de son propre domaine d’expression vers les couches internes du méristème où le récepteur kinase CLV1 est exprimé. Avec un co-récepteur, CLV2, la kinase inhibe l’expression de WUS en se liant à CLV3. Cette boucle de régulation négative est essentielle pour contrôler la taille du méristème. Si le complexe CLV est inactif, la population centrale de cellules souches augmente progressivement de taille, tandis que l’absence de WUS entraîne l’arrêt du méristème.
Bien qu’à un faible taux, les cellules de la zone centrale croissent et se divisent et, tôt ou tard, certains de leurs descendants quitteront la zone contrôlée par WUS et le complexe CLV. Elles entreront dans la zone périphérique, en maintenant l’expression de STM. Encore plus loin du centre du méristème, certaines des cellules de la zone périphérique seront sélectionnées pour former les initia des organes. Comme nous le verrons plus loin, l’initiation de nouveaux organes se produit dans des sites où l’hormone végétale auxine s’accumule [17, 18, 19]. L’auxine active alors un réseau de facteurs de transcription, qui va favoriser la croissance [20]. Un rôle important est joué par le facteur de réponse à l’auxine MONOPTEROS (MP). Les mutants de perte de fonction complète de MP montrent une capacité réduite à former des organes [21]. En particulier, l’inflorescence présente un phénotype frappant, car les mutants « knock-out » forment des tiges d’inflorescence nues, en forme d’épingle, qui ne produisent que quelques fleurs ou pas de fleurs du tout. Le réseau opérant en aval de MP a été principalement caractérisé dans le méristème de l’inflorescence. Trois facteurs de transcription, LEAFY (LFY, une cible directe), AINTEGUMENTA (ANT), et AINTEGUMENTA LIKE 6 (AIL6) opèrent directement en aval de MP [20, 22]. Le triple mutant ant ail6 lfy est sévèrement altéré dans la formation d’organes au niveau de l’inflorescence, montrant que les trois gènes sont requis pour l’initiation et la croissance de la fleur. Outre les gènes contrôlant la formation du méristème et la croissance des organes, un certain nombre de facteurs de transcription sont impliqués dans la séparation des organes individuels du reste du méristème. Les mieux caractérisés de ces gènes, fortement exprimés dans les zones frontières qui entourent les organes, sont CUP SHAPED COTYLEDON (CUC) 1–3 [23, 24, 25]. Bien que leur fonction moléculaire précise n’ait pas encore été identifiée, il existe des preuves solides qu’ils inhibent la croissance aux limites des organes. En outre, ils sont associés à la fonction du méristème car il existe des indications qu’ils activent STM, qui est également exprimée dans les domaines frontières [26].
2.2. Vers une vision plus complète de la régulation moléculaire
Alors que les facteurs discutés ci-dessus jouent tous un rôle important et sont souvent considérés comme le réseau central contrôlant la fonction du méristème caulinaire, d’autres études ont révélé des interactions régulatrices encore plus complexes. Une présentation exhaustive dépasserait le cadre de cette revue, mais les exemples donnés ci-dessous illustrent la complexité du système.
Certains facteurs de transcription tels que CORYNE (CRN) et HAIRY MERISTEM (HAM) stabilisent la boucle de rétroaction WUS/CLV [4, 27]. D’autres sont impliqués dans la coordination plus générale des méristèmes. Par exemple, les gènes HECATE (HEC) codant pour un groupe de facteurs de transcription bHLH modulent l’organisation du méristème en favorisant l’identité de la zone centrale et en inhibant la différenciation cellulaire à la périphérie via une signalisation hormonale [28]. DORNRÖSCHEN (DRN) et DORNRÖSCHEN-LIKE (DRNL), deux facteurs de transcription de la famille APETALA2, agissent en synergie pour contrôler l’expression de CLV3 ([29, 30] voir aussi [31]). Il existe de bonnes preuves que DRN se lie directement au promoteur de CLV3, induisant l’expression de ce dernier. L’expression de DRN, à son tour, est inhibée par MP à la périphérie du méristème. En effet, au moins dans le MAC, l’expression de MP se produit selon un gradient : Les niveaux d’ARN sont faibles au centre du méristème et élevés à la périphérie [29, 32], ce qui limite indirectement l’activation de CLV3 au centre du méristème. De cette manière, MP est également importante pour contrôler l’équilibre entre le maintien du méristème et la formation des organes à la périphérie. Alors que DRN s’intègre assez bien dans le tableau, c’est moins le cas pour DRNL qui, comme MP, est principalement exprimé à la périphérie du méristème dans les cellules fondatrices de l’organe et la façon dont le gène affecte l’expression de CLV3 n’est toujours pas claire.
En plus de MP et de ses cibles, deux facteurs de transcription aux fonctions opposées, KANADI (KAN) et REVOLUTA (REV) jouent un rôle dans la définition du positionnement des feuilles. Les mutants pour KANADI peuvent produire des feuilles ectopiques sur différents organes tandis que les plantes mutantes pour REV, PHABULOSA et PHAVOLUTA, tous membres de la famille HD-ZIPIII, sont sévèrement perturbées dans la formation du méristème [33]. Une étude récente [34] a montré que le promoteur de REV était actif dans le méristème proprement dit, tandis que le promoteur de KAN était surtout actif aux frontières des organes et autour de celles-ci. Il est intéressant de noter que les nouveaux organes sont centrés sur la région située entre les domaines d’expression des gènes REV et KAN. Les auteurs ont suggéré que les deux gènes répriment l’organogenèse là où ils sont exprimés.
Lors de la transition vers la floraison, le facteur de transcription LFY est activé dans les méristèmes latéraux, qui se transforment ensuite en méristèmes floraux, produisant différents types d’organes. Comme indiqué précédemment, LFY est impliqué dans la croissance des organes et influence profondément leur forme, avec ANT et AIL6. LFY agit en partie par l’intermédiaire d’autres régulateurs, car il active un vaste réseau de facteurs de transcription qui contrôle l’identité et l’architecture des organes floraux (par exemple [5, 35, 36]), que nous ne discuterons pas en détail ici. D’autres gènes, dont KAN et REV, définissent la polarité abaxiale/adaxiale des feuilles et des organes floraux (par exemple [33, 37]).
Des analyses approfondies menées par de nombreux groupes de recherche ont permis d’obtenir une vision relativement détaillée des interactions génétiques et des profils d’expression du réseau de gènes évoqué ci-dessus. Dans une étude récente, Refahi et al. [5] ont produit une vue intégrée des données disponibles dans le MF, qui, comme mentionné précédemment, partage de nombreux principes de régulation trouvés dans le MAC. Ils ont projeté les profils d’expression de 28 gènes régulateurs sur les différentes étapes d’une reconstruction 3D d’un méristème floral en croissance. En utilisant une version simplifiée des schémas d’expression, où les gènes sont soit activés soit désactivés, leur analyse suggère l’existence d’au moins 31 domaines différents dans les deux premières couches du méristème en développement, où les cellules expriment des combinaisons spécifiques de ces facteurs de transcription. Si l’on tient compte du fait que l’expression des gènes se produit souvent dans des gradients d’une ou deux cellules de large, on peut avancer sans risque que chaque cellule a sa propre identité en termes de combinaisons d’expression génétique.
2.3. La coordination de la régulation moléculaire dans le temps et l’espace
Comment ces patrons d’expression apparaissent-ils et comment sont-ils coordonnés dans le temps et l’espace ? Deux processus majeurs jouent un rôle. Comme ils ne constituent pas le sujet principal de cette revue, nous n’en parlerons que brièvement par souci d’exhaustivité et nous renvoyons le lecteur à un certain nombre d’articles pour une lecture plus approfondie. Tout d’abord, les interactions locales, y compris les inhibitions et les activations par contrôle transcriptionnel ou post-transcriptionnel, sont essentielles. Cela peut impliquer le mouvement des facteurs de transcription entre les cellules, tandis que plusieurs régulateurs du méristème sont contrôlés par les voies des miARN, qui peuvent également fonctionner en gradients (voir par exemple [38]). Deuxièmement, les hormones végétales, et en particulier l’auxine et les cytokinines, jouent un rôle central dans la coordination entre cellules (pour une revue, voir [18]). Les cytokinines jouent un rôle important dans le contrôle de l’identité du méristème et leur rôle dans la maintenance du méristème a été particulièrement étudié. Le rôle de l’auxine dans la fonction du méristème a également été largement documenté. L’auxine est transportée de cellule à cellule par des transporteurs localisés dans la membrane des familles AUX (importation) et PIN-FORMED (PIN) (exportation) [39, 40]. Dans les méristèmes d’Arabidopsis, ce transport se produit principalement dans la couche externe (L1) et les cellules pro-vasculaires où il conduit à la formation structurée de maxima et minima d’auxine [17, 19]. Ceci est ensuite traduit par la voie de la réponse auxine. Nous avons déjà mentionné le facteur de réponse auxine MP qui est central dans l’initiation des organes et activé au niveau des maxima d’auxine. D’autres gènes, en particulier CUCs mais aussi KAN sont principalement actifs à de faibles concentrations d’auxine, en particulier aux frontières des organes. La manière dont la distribution de l’auxine est régulée n’est pas précisément connue, mais un mécanisme dans lequel l’auxine est systématiquement transportée vers des régions à plus fortes concentrations (c’est-à-dire contre un gradient) est théoriquement suffisant pour expliquer l’accumulation d’auxine à des positions spécifiques [34, 41]. D’autres modèles proposent des mécanismes dans lesquels les cellules ne mesurent pas la concentration locale d’auxine, mais les flux d’auxine [42]. Outre le transport, la synthèse de l’auxine et la sensibilité à l’auxine sont bien sûr importantes. La zone centrale du méristème, sous le contrôle de la voie WUS/CLV, présente une faible sensibilité à l’auxine, ce qui pourrait empêcher la formation d’organes à cet endroit [43]. Une sensibilité réduite est corrélée à de faibles niveaux d’expression d’une série de facteurs de réponse auxine [32]. D’autres hormones ont également été associées à l’activité méristématique, en particulier les brassinostéroïdes [44] et l’acide gibbérellique (principalement pour le contrôle de la floraison, par exemple [45]), mais nous ne les aborderons pas ici.
3. Intégration de l’information moléculaire et de la géométrie
L’un des rôles majeurs du réseau de régulation moléculaire est de coordonner la croissance. La morphogenèse implique de nombreux acteurs et processus opérant à plusieurs échelles avec de multiples rétroactions. Elle a donc été difficile à aborder. Pendant de nombreuses années, l’approche a consisté à examiner les effets de gènes individuels sur la croissance et le développement. Cela se fait souvent de manière qualitative et, par conséquent, la fonction des gènes est généralement exprimée en termes généraux tels que l’identité ou la polarité des organes, en référence à leur phénotype mutant. Une première étape vers une meilleure compréhension consiste à obtenir des informations détaillées et quantitatives sur les taux directions de croissance. La fonction des gènes peut alors être corrélée à ces résultats quantitatifs [46]. Pour les méristèmes caulinaires, cela a nécessité le développement de méthodes d’imagerie in vivo, permettant la visualisation directe de méristèmes vivants en utilisant la microscopie confocale [47, 48]. Ces études ont fourni une grande quantité d’informations sur la croissance. Une analyse quantitative très détaillée du méristème floral a été réalisée par Refahi et al. [5], y compris une analyse complète des lignées cellulaires des deux couches externes de la fleur depuis l’initiation jusqu’au stade 5, lorsque les sépales commencent à couvrir le méristème. Ces études montrent que la croissance des méristèmes est réduite dans les zones centrales et aux frontières des organes par rapport à la zone périphérique. L’initiation des organes est également caractérisée par une augmentation du taux de croissance. Les valeurs absolues peuvent varier au cours du développement, de même que les taux de croissance relatifs des cellules à un stade particulier. Typiquement, les taux de croissance varient entre 0,01 et 0,12 mm3/heure dans l’un des jeunes FM observés. Les cellules des primordia d’organes jeunes grandissaient deux fois plus vite que celles de la zone périphérique du FM. Les résultats indiquent également un certain niveau de stochasticité où chaque cellule a son propre taux de croissance.
L’analyse quantitative de la croissance est une première étape, la question suivante est de savoir le lien entre les taux et directions de croissance et l’expression des gènes. Une approche apparemment simple consiste à corréler quantitativement le niveau d’expression des gènes avec la croissance, l’idée étant que les gènes favorisant la croissance seront exprimés dans les domaines qui se développent plus rapidement. Le problème ici est que de nombreux gènes sont actifs dans un domaine particulier et que la croissance d’un groupe particulier de cellules peut être le résultat d’activités favorisant et inhibant la croissance. Ce problème a été abordé par Refahi et al. [5] dans le méristème floral. Ils ont constaté que seul un nombre limité de gènes individuels peut être associé de manière cohérente à des taux de croissance relatifs faibles ou élevés sur la seule base de leurs profils d’expression. En effet, la plupart des gènes sont exprimés dans des domaines où la distribution des taux de croissance est très large, ce qui suggère qu’ils ne contrôlent pas directement de la croissance. Pour aller plus loin, les corrélations ont été étudiées à partir de comparaisons par paires de gènes dont les profils d’expression se chevauchent partiellement. L’idée était de voir si les cellules exprimant le gène A croissaient plus lentement ou plus rapidement dans le sous-ensemble de cellules où ce gène était co-exprimé avec un autre gène B. Cela permettrait d’identifier le gène B comme ayant potentiellement une activité inhibitrice ou promotrice de la croissance au sein de la population cellulaire où A est exprimé. Il est intéressant de noter qu’une analyse systématique par paire a montré que LFY et ANT, tous deux exprimés dans le jeune primordium de la fleur, étaient systématiquement exprimés dans les sous-régions à croissance plus rapide. Ceci pouvait déjà être prédit par des études génétiques et phénotypiques [20, 49]. Cependant, ce n’était pas le cas pour MP, qui est exprimé principalement dans les sous-populations à croissance lente, bien que le phénotype des mutants mp (croissance réduite des fleurs) suggère qu’il favorise plutôt la croissance. Ceci indique un rôle plus large et plus indirect de MP dans le contrôle de la croissance. Une deuxième approche pour clarifier le rôle précis des régulateurs moléculaires dans la morphogenèse consiste à analyser le comportement des mutants et à les comparer quantitativement avec le type sauvage. Il s’agit là encore d’un véritable défi, car les différences entre le type sauvage et les mutants peuvent être très importantes et peuvent être dues à des effets indirects. Des interactions mécaniques entre les cellules, en particulier entre les cellules à croissance lente et rapide, sont également impliquées, ce qui rend les interprétations en termes de spécification locale des taux de croissance par les régulateurs encore plus complexes [46]. À cette fin, des modèles mécaniques sous forme de tissus virtuels ont été utilisés pour faciliter l’interprétation. Des études plus qualitatives dans cette direction ont été menées avec succès pour le développement des fleurs chez différentes espèces. Sauret-Gueto et al. [50] ont étudié les modèles de croissance dans le jeune pétale d’Arabidopsis. Pour interpréter les modèles de croissance quantifiés, ils ont utilisé un logiciel de modélisation, appelé « Growing Polarized Tissue (GPT) ». Le modèle peut capturer les taux et les directions de croissance globale des tissus en trois dimensions, et prend en compte les interactions mécaniques entre les différentes régions. En testant différents scénarios, on a déterminé les valeurs optimales des paramètres pour les taux de croissance et l’anisotropie qui reproduisent de manière semi-quantitative les changements géométriques observés in vivo, tant chez les plantes de type sauvage que chez les plantes mutantes. Une analyse quantitative encore plus détaillée a été utilisée pour comparer la croissance dans les primordia de fleurs de plantes sauvages et de mutants lfy [5]. Cette analyse a révélé que la différence de vitesse de croissance entre les organes et leurs frontières était réduite chez le mutant. Dans le type sauvage, les cellules des primordia se développent deux fois plus vite que leurs voisines dans les limites des organes. Chez le mutant lfy, cette vitesse est réduite à 1,6 fois. Cette réduction peut sembler relativement modeste, mais cumulée sur plusieurs jours, elle aura probablement un impact substantiel. Ceci a conduit à l’hypothèse que LFY est impliqué dans la coordination des taux d’expansion cellulaire au sein de sous-domaines spécifiques, en particulier pour maintenir des différences de taux de croissance suffisantes entre les sépales et leurs frontières.
Pour l’instant, ces deux approches, (i) la corrélation quantitative de l’expression des gènes avec la croissance et (ii) la comparaison de la croissance entre les mutants et le type sauvage, semblent les voies les plus prometteuses, bien qu’elles demandent beaucoup de travail.
4. Le prochain défi : vers une vision plus mécaniste
Jusqu’à présent, nous nous sommes concentrés sur le lien entre la régulation des gènes et les changements de géométrie pendant la croissance. Cette relation est toutefois indirecte et pour une compréhension plus approfondie de la morphogenèse, nous devons également analyser les processus qui opèrent dans la boîte noire qui relie la génétique et la forme (Figure 2). Ces processus comprennent non seulement la régulation biochimique mais aussi les propriétés physiques des cellules. Les cellules végétales sont soumises à une forte pression de turgescence interne et la paroi cellulaire qui les entoure les empêche d’éclater (pour des études, voir [51, 52]). Composée de microfibrilles rigides de cellulose dans une matrice visqueuse de pectine et de polymères d’hémicellulose, la paroi peut être considérée comme un gel renforcé par des fibres. Ce gel est maintenu sous une tension constante et on pense généralement que la croissance se produit lorsque les parois cèdent à la pression (par exemple [53] et pour une discussion plus approfondie [54]). Au-delà d’un certain seuil de pression, les liaisons entre les polymères sont rompues, ce qui provoque l’expansion de la paroi. La perte d’épaisseur et de rigidité de la paroi qui en résulte est compensée par une synthèse et une insertion constantes de nouveaux polymères dans la paroi en expansion. Les microfibrilles de cellulose ont une fonction particulière dans l’ensemble du processus. Elles sont déposées dans la paroi dans des dispositions spécifiques, qui déterminent les directions de croissance de la cellule. Si elles sont orientées de manière aléatoire, la cellule aura tendance à croître de manière isotrope. Cependant, elles peuvent également être synthétisées en réseaux hautement orientés, limitant l’expansion cellulaire dans leur direction et induisant ainsi une croissance anisotrope. L’orientation des polymères de cellulose nouvellement déposés dépend du cytosquelette microtubulaire, qui guide les complexes de synthèse de la cellulose dans la membrane plasmique. Bien que la cellulose soit considérée comme le principal déterminant de l’anisotropie de la croissance, les polymères de pectine sont également impliqués [55], mais leur rôle précis est moins bien documenté. Les différents paramètres du processus tels que le niveau de pression turgescente, la rigidité de la paroi, le seuil d’élasticité ou l’orientation des microfibrilles de cellulose dépendent de l’activité de multiples enzymes. Ainsi, de nombreuses protéines sont directement impliquées dans la modification et la synthèse de composants spécifiques de la paroi dans le méristème [56, 57]. Face à cette complexité, il est absolument nécessaire de prendre du recul et de simplifier. En termes simples, le réseau génétique contrôlant la morphogenèse peut cibler trois voies : il peut agir sur la rigidité de la paroi cellulaire (i), il peut agir sur son anisotropie mécanique (principalement via l’orientation des microfibrilles de cellulose) (ii) et il peut influencer la pression de turgescence (iii). Une première étape vers une compréhension plus mécaniste du contrôle de la croissance pourrait donc consister à étudier et, si possible, à quantifier ces trois paramètres différents. Au lieu d’exprimer l’activité des gènes en termes de géométrie, nous pourrons alors corréler la régulation moléculaire locale avec les propriétés mécaniques. Bien que cette approche soit conceptuellement attrayante et logique, elle pose un certain nombre de défis techniques, comme nous le verrons brièvement dans les paragraphes suivants.
Principales questions en suspens concernant la fonction du méristème. Le méristème est un système à plusieurs échelles. À l’échelle moléculaire, les facteurs de transcription, les hormones et d’autres éléments s’organisent en un réseau de régulation. Un type de cibles de ce réseau sont les enzymes de modification de la paroi cellulaire. Au niveau cellulaire, l’activité moléculaire se traduit par une composition spécifique de la paroi, une pression de turgescence et des propriétés mécaniques. Au niveau du tissu, cela se traduit par des taux et des directions de croissance locale. De multiples rétroactions existent entre ces échelles. Ce système doit être analysé à de multiples échelles, en utilisant des approches multidisciplinaires.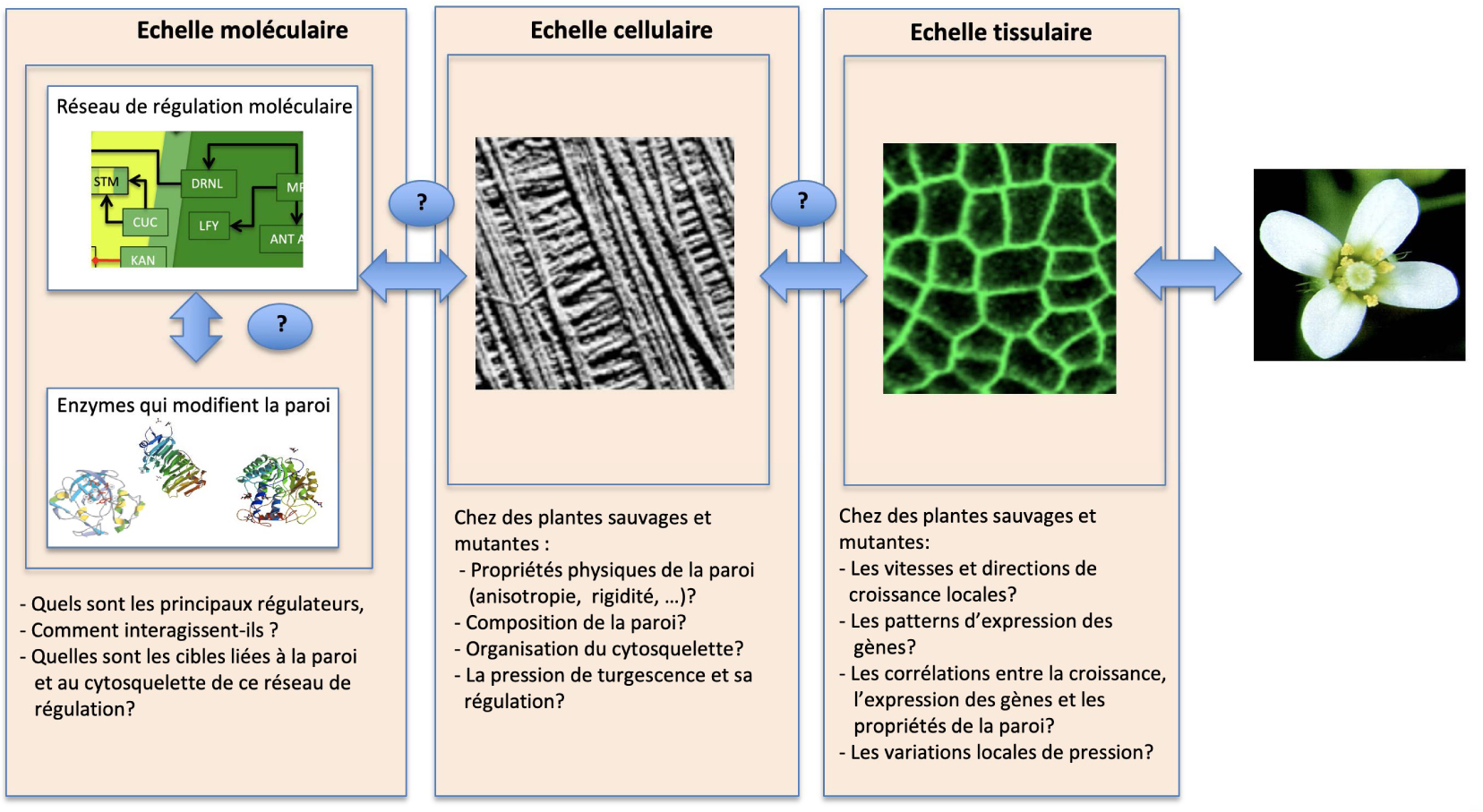
4.1. Rigidité de la paroi
La rigidité ou l’élasticité de la paroi des cellules méristématiques a été principalement analysée en utilisant la microscopie à force atomique (AFM, pour la discussion voir [58]). Une petite pointe à l’échelle subcellulaire montée sur un levier est utilisée pour pousser sur la surface de la cellule. La déformation du levier est alors une mesure de la rigidité de la paroi. Bien que la méthode soit élégante et directe, il peut être difficile d’interpréter les résultats. Les petites pointes (de quelques dizaines de nanomètres de large) ne fournissent que des informations très locales, équivalentes à la pression exercée sur la surface d’un pneu de voiture avec un tournevis. En outre, les propriétés mécaniques sont principalement sondées perpendiculairement à la surface de la paroi et il n’est pas clair comment cela se rapporte aux propriétés dans le plan de la paroi. Le problème se pose surtout dans une situation où les fibres de cellulose peuvent imposer des propriétés mécaniques anisotropes dans ce plan. Des pointes plus grandes peuvent être utilisées pour des indentations plus profondes, mais dans ce cas les mesures comprendront également des informations sur les propriétés mécaniques au-delà de la paroi cellulaire (voir également le paragraphe suivant). Enfin, la méthode ne donne pas beaucoup d’informations sur les parois cellulaires internes. Kierzkowski et al. [59] ont utilisé une méthode plus indirecte pour sonder les caractéristiques mécaniques des parois cellulaires au niveau du méristème. Ils ont traité les méristèmes avec un osmolyte pour plasmolyser les cellules et ont ensuite observé le rétrécissement des parois, ce qui a fourni des informations sur le niveau de déformation élastique. Cette méthode a ses propres inconvénients. Les changements de taille des cellules après la plasmolyse peuvent être extrêmement faibles, à la limite de ce qui peut être détecté avec un microscope optique. L’étude a néanmoins révélé des différences de propriétés entre la zone centrale et la périphérie du méristème de la tomate, mettant en évidence la présence de parois cellulaires sollicitées au-delà de leur plage linéaire (raidissement par déformation).
4.2. Anisotropie de la paroi
Comme les microtubules guident le dépôt des microfibrilles de cellulose, le contrôle de l’anisotropie de la paroi a été très largement analysé en visualisant la dynamique des réseaux microtubulaires au niveau du méristème. Cela a révélé des domaines avec une organisation cohérente des microtubules dans les cellules voisines [60, 61]. Les cellules qui ont une croissance isotrope au sommet du méristème présentent des réseaux de microtubules aléatoires. En revanche, les cellules situées à la périphérie, en particulier celles situées aux frontières des organes, présentent des microtubules hautement ordonnés. L’analyse quantitative combinée à la modélisation mécanique a conduit à l’hypothèse que le cytosquelette s’aligne le long de la direction principale de la force à la surface du méristème en utilisant un mécanisme encore inconnu [60]. Cette méthode reste cependant indirecte et d’autres méthodes ont été mises au point pour visualiser directement les microfibrilles de cellulose. La FESEM (Field Emission Scanning Electron Microscopy) a été utilisée pour observer la cellulose dans la jeune fleur en croissance [62]. Bien que cette méthode n’en soit qu’à ses débuts, elle a confirmé que les microfibrilles de cellulose situées aux frontières des organes étaient organisées en réseaux hautement anisotropes, tandis que celles situées au sommet du dôme méristématique étaient moins bien alignées. D’autres méthodes ont été être utilisées. Il existe des colorants fluorescents pour la cellulose, mais comme l’épaisseur des microfibrilles est bien inférieure à la résolution des microscopes optiques et que les fibres sont très serrées, il n’est pas certain que ces méthodes de coloration soient fiables pour étudier le méristème [62].
4.3. Pression de turgescence
Plusieurs méthodes pour mesurer directement ou indirectement la pression de turgescence ont été développées depuis la fin du 19e siècle (revue dans [58]). Cependant, les méthodes bien établies utilisant par exemple des sondes de pression ou la tonométrie à bille n’ont pas (encore) été adaptées pour analyser les petites cellules méristématiques. Récemment, les méthodes basées sur l’AFM ont été les plus efficaces. Cela nécessite des indentations plus profondes avec des pointes plus grandes, qui sont sensibles à la fois à la mécanique de la paroi cellulaire et à la turgescence. Pour distinguer les effets de ces deux paramètres, on fait varier l’osmolalité du milieu extérieur. L’interprétation finale et les estimations de la pression de turgescence sont ensuite obtenues à l’aide de modèles computationnels [63].
Les approches décrites ci-dessus ont permis d’établir une carte grossière des propriétés mécaniques des cellules méristématiques. Idéalement, nous devrions être en mesure d’exprimer la fonction des gènes en fonction de ces différents paramètres. Sur la base des données disponibles, un certain nombre d’hypothèses peuvent déjà être proposées. Les gènes CUC, fortement associés aux frontières des organes, sont exprimés dans des cellules aux parois rigides et fortement anisotropes. Les gènes exprimés dans les primordia d’organes à croissance rapide sont actifs dans les cellules aux parois plus élastiques. Cela fournit quelques indications, mais une vue beaucoup plus détaillée de la mécanique dans le temps et l’espace est nécessaire pour proposer des relations causales, par exemple pour savoir si les changements dans l’expression des gènes précèdent les changements dans la mécanique ou non. Milani et al. [64] ont combiné l’AFM et la microscopie confocale pour visualiser les propriétés mécaniques des cellules dans la zone centrale de MFs (Quantitative Tandem Epifluorescence and Nanoindentation ou qTEN). Leurs résultats indiquent qu’une augmentation de la rigidité de la paroi est strictement corrélée à l’activation de la voie WUS/CLV dans le MF, ce qui est en accord avec le fait que cette voie interfère avec la mécanique de la paroi.
En parallèle, de nombreuses études ont poussé le champ encore plus loin en aval de la régulation hormonale ou transcriptionnelle, en examinant l’expression des gènes impliqués dans la synthèse de la paroi cellulaire [56, 57], ou en identifiant les cibles de facteurs de transcription liées à la paroi cellulaire (par exemple [65]). Ces études ont également révélé que la régulation n’est pas seulement descendante, mais que les régulations en rétro-action sont également importantes. La détection locale de l’intégrité de la paroi impliquant des récepteurs locaux peut jouer un rôle dans la coordination de la croissance par exemple [66, 67]. Il existe également des preuves que les forces mécaniques sont directement détectées par la paroi et le cytosquelette, ce qui amène les microtubules à s’aligner le long des champs de contrainte sans instruction directionnelle directe par la régulation transcriptionnelle ou les gradients chimiques [60]. Il faudra également tenir compte de ces informations si nous voulons comprendre toute la chaine de régulation qui lie l’activité moléculaire à la géométrie des tissus (Figure 2).
5. Conclusion
Conceptuellement, l’idée d’un réseau de régulateurs transcriptionnels contrôlant la morphogenèse via la modulation locale de la synthèse de la paroi et de la pression de turgescence peut sembler simple. Cependant, le nombre d’acteurs moléculaires, l’existence de multiples mécanismes de rétroaction et donc la complexité de l’ensemble du processus en font un problème encore difficile à aborder. Heureusement, un certain nombre d’avancées techniques incitent à l’optimisme. De nouvelles méthodes d’imagerie quantitative ont été développées. De nouvelles sondes et lignes de marquage ont été générées. Des méthodes permettant d’étudier les propriétés mécaniques des cellules et des tissus deviennent disponibles. En parallèle, l’analyse génétique s’est poursuivie. La richesse des informations provenant de ces approches doit être intégrée et interprétée. Cette tâche devrait être grandement facilitée par les modèles informatiques, qui deviennent de plus en plus sophistiqués. Si l’on tient compte du fait que la morphogenèse implique probablement des milliers de gènes, la tâche semble colossale. Cependant, même si un inventaire complet est difficile à réaliser, les approches décrites ici devraient générer des conditions optimales pour augmenter de façon significative notre compréhension de la morphogenèse.
Conflit d’intérêt
L’auteur n’a aucun conflit d’intérêt à déclarer.
Remerciements
Cet article est dédié à la mémoire de Michel Caboche qui m’a encouragé à étudier la fonction du méristème apical caulinaire il y a presque 30 ans. Je tiens également à remercier Christophe Godin pour les discussions utiles.




 CC-BY 4.0
CC-BY 4.0