1. Introduction
The gut is a unique environment that is continuously exposed to food antigens but also to a rich community of micro-organisms. Its function, essential to the body, relies on the efficient absorption of nutrients and electrolytes, which is one reason why the intestinal barrier is relatively thin. However, this can become problematic for the host if toxic substances from the lumen reach the bloodstream [1]. A disruption of the intestinal barrier can therefore lead to pathological situations, ranging from nutrient deprivation [2], to inflammatory bowel disease [3], or sepsis [4], to multi-organ failure [1].
Depending on the region of the intestine, the epithelial barrier faces different challenges. The colon, in particular, the epithelium is exposed to the extreme osmotic pressure, that can reach 10 atm and is required to absorb water and solidify the feaces [5], but at the same time, distal colon hosts enriched microbial communities, consisting of bacteria, fungi, archaea and viruses [6]. Fungi, which are particularly abundant in the distal colon [7], can produce metabolites that trigger apoptosis of intestinal epithelial cells [8], thereby potentially compromising the integrity of the intestinal barrier. This is one of the reasons why the intestinal barrier is the main target of many fungal toxins, such as gliotoxin, aflatoxin [9], trichothecenes or candidalysin.
The colonic mucosa therefore tightly regulates fluid absorption while limiting the entry of toxic fungal metabolites into the epithelial cells or even into the bloodstream. Currently, the regulatory mechanisms responsible for this balance remain unknown.
Under homeostatic conditions, macrophages are the most abundant immune population in the gut. They mainly differentiate from monocytes in response to local signals. Intestinal macrophages reside in the lamina propria, or in the muscular part of the intestinal wall where they participate in various biological processes such as the degradation of microorganisms [10], the silent elimination of apoptotic bodies [11], tissue repair [12] and gastrointestinal motility [13]. In addition, intestinal macrophages limit inflammation [14], facilitating food tolerance [15]. Their function is closely linked to the presence of microbiota [16] and explains why they are found in greater numbers in the colon than in the small intestine [17].
Interestingly, in the colon, macrophages are found in close association with epithelial cells [18] and their mislocalization of is involved in the loss of intestinal barrier integrity, which is observed in inflammatory bowel diseases such as ulcerative colitis and Crohn disease [19]. Macrophages are therefore ideally positioned to orchestrate the interactions between epithelial cells and the microbiota, and thus maintain colonic homeostasis.
The main question of our work was to identify the role of colonic macrophages in the integrity and function of the intestinal epithelial barrier in homeostasis [20].
In summary, we have described a mechanism by which the innate immune system allows rapid and effective control of the quality of absorbed fluids to avoid colonocyte intoxication [20]. This mechanism relies on a population of macrophages in the distal colon equipped with “balloon” like protrusions (BLPs) inserted into the epithelium to sample absorbed fluids. In the absence of macrophages or BLPs, epithelial cells continue to take up fluids containing fungal products, resulting in their death and subsequent loss of epithelial barrier integrity.
These results [20] revealed for the first time an unexpected and essential role for macrophages in maintaining interactions between the colonic epithelial barrier and the microbiota, playing a key role in the maintenance of intestinal homeostasis.
Macrophages are required for the survival of epithelial cells in the distal colon and form “balloon-like” protrusions inserted between epithelial cells [20]. (A) Experimental scheme of Mϕ removal in the CD64DTR mouse model. (B) Proximal and distal colon 44 h after the first DT injection, 50 μm scale. (C) Number of apoptotic epithelial cells per crypt in the distal or proximal colon of CD64WT or CD64DTR mice. Results are presented as mean ± SEM, Kruskal–Wallis multiple comparison test, ∗ P < 0.05. (D) Serum fluorescence intensities of CD64WT or CD64DTR littermates 5–10 min after intra-rectal administration of a hypotonic Hydrazide-AlexaFluor633 solution. (E) Morphological differences of Mϕ in the proximal and distal colon. Complete staining of the distal and proximal colon of CD11c: Cre/R26mTmG mice. Arrows indicate BLPs, epithelial-stromal boundary is indicated by the dashed line, scale bars—50 μm. (F) Single Mϕ forming BLPs (left) or thin extensions (right). The yellow star indicates cell bodies, BLPs with green arrows, extensions with green arrowheads, scale bar—2 μm. (G) Number of PLBs, normalized by crypt (left) or by Mϕ (right) in the distal and proximal colon. (H) Amount of Mϕ in the proximal and distal colon, analysed by imaging and flow cytometry. (I) Number of extensions, normalized by Mϕ in the distal and proximal colon.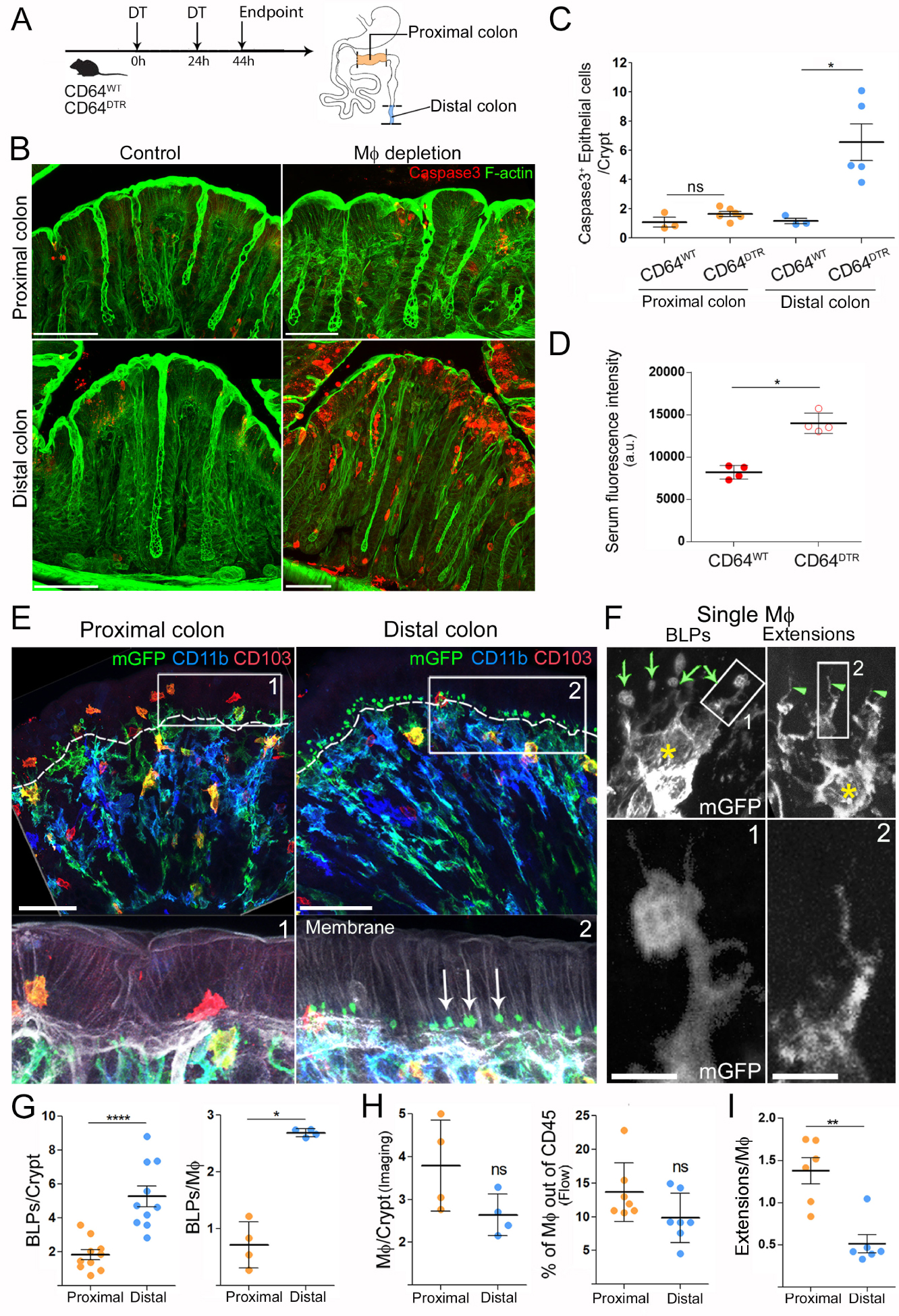
2. Results
2.1. Macrophages control epithelial cell survival and barrier integrity in the distal colon
The intestinal immune system is highly compartmentalized, with different cell populations distributed in a gradient along the intestine. This is particularly true for macrophages (Mϕs), which are present in greater numbers in the colon compared to the small intestine. Mϕs in the colon contribute to the maintenance of the epithelial integrity and their absence is correlated with the development of ulcerative colitis and Crohn disease [21]. However, the mechanism(s) by which Mϕs perform this homeostatic function in vivo remain unknown. To address this question, we depleted Mϕs using the CD64DTR mouse model [22] and then assessed the status of the epithelium (Figure 1A, [20]). We analyzed the proximal and distal colon as these two areas are known to have many differences in terms of physiology and microbial composition [23]. The absence of colonic Mϕs in our model was verified by flow cytometry and imaging in both colonic segments. Unexpectedly, we found that Mϕ depletion led to massive apoptosis of epithelial cells in the distal but not proximal colon (Figure 1B,C, [20]). Our results therefore suggest that Mϕs promote epithelial cell survival particularly in the distal colon.
To assess the impact of epithelial cell death on intestinal permeability, we perfused CD64WT and CD64DTR mice intra-rectally with a hypotonic solution containing a small fluorescent molecule hydrazide and then measured its appearance in the blood. We found that hydrazide was more abundant in the blood of Mϕ-depleted mice compared to control animals (Figure 1D, [20]), indicating a loss of barrier integrity in these animals. Overall, these results show that Mϕ are required for epithelial cell survival and intestinal barrier integrity in the distal colon.
2.2. Distal colonic macrophages insert “balloon-like” protrusions between epithelial cells
These results prompted us to investigate the tissue distribution of Mϕs and/or their physical interaction with epithelial cells in the proximal and distal colon. To address this question, we performed immunostaining of the proximal and distal colon isolated from CD11c-Cre/R26mTmG mice [24]. In this mouse model, all cells that express CD11c throughout their differentiation, which include intestinal Mϕs (and dendritic cells), switch from membrane-tomato to membrane-GFP expression, allowing better visualization of these cells in the tissue. Using these animals, we observed a population of phagocytes in the distal colon that physically interacted with epithelial cells through balloon-like membrane protrusions (Figure 1E,F, [20]), hereafter referred to as “balloon-like protrusions” or BLPs. The cell bodies of these cells were located around the opening of the crypts. Immunostaining showed that BLPs+ cells were formed by bona fide intestinal Mϕs (CD11b+ MHCII+ F4/80+ CX3CR1+ CD64+ CD103− CX3CR1− GFP+) and as a result they were lost in toxin-injected CD64DTR mice [25]. Strikingly, a reduced number of BLPs was observed in the proximal colon (Figure 1E,G), although the crypts of the proximal and distal colon contained a similar number of Mϕs (determined by flow cytometry and imaging, Figure 1H, [20]). We conclude that the distal colon is enriched in Mϕs equipped with balloon-like membrane protrusions inserted at the base of the epithelial cells.
2.3. Intestinal fungi increase BLPs formation of macrophages
These results led us to evaluate the impact of microbiota on BLP+ Mϕs [20]. The colon harbors the largest amount of microorganisms in the body, including bacteria and fungi [6]. To assess the potential effect of bacteria and fungi on BLPs formation, we targeted each population with a cocktail of broad-spectrum antibiotics or antifungal agents respectively. No effect of antibiotics on BLPs formation was observed (Figure 2A, [20]). In contrast, two antifungal agents, fluconazole and amphotericin B, significantly decreased the number of protrusions (Figure 2A,B, [20]) without changing the total number of Mϕs, as shown by flow cytometry. We have previously shown that these drugs efficiently reduce the amount of intestinal fungi in mice [26] but by different mechanisms [27]. TOf note, the combination of fluconazole or amphotericin B with antibiotics showed no additive effect (Figure 2C, [20]), suggesting that these two antifungal agents do not act indirectly on BLPs, i.e. by stimulating the expansion of colonic bacteria. These results therefore suggest that fungi residing in the distal colon may promote PLB formation in the subepithelial Mϕ.
Intestinal fungi stimulate PLB formation and account for epithelial death in the absence of Mϕ [20]. (A) Number of BLPs in the distal colon of mice treated with an antibiotic cocktail (AB) or an antifungal agent (fluconazole, fluc). (B) Number of PLBs, normalized per crypt in the distal colon of mice treated with an antifungal agent (amphotericin B, AmphB). (C) Number of BLPs in the distal colon of mice treated with antibiotic cocktail, fluconazole, amphotericin B or a combination of antibacterial and antifungal agents (antibiotics + fluconazole, antibiotics + amphotericin B). (D) Number of BLPs, normalized per crypt, in germ-free mice colonized by bacteria (Schaedler flora, ASF) or fungi (C. albicans). (A–D) Mϕ were visualized by F4/80 staining (cyan) and crypt—with laminin (purple), scale bars—10 μm. (E) N number of apoptotic epithelial cells (cleaved caspase 3) per crypt in the distal colon of germ-free mice colonized with bacteria or fungi. (F) CD64WT or CD64DTR mice were treated with antifungal agents (fluconazole or amphotericin B) or a cocktail of antibiotics before Mϕ depletion. Overall tissue architecture was visualised with F-actin staining (green) and apoptotic cells were revealed with cleaved caspase 3 staining (red), scale bars—20 μm.
To directly assess the role of fungi in the induction of BLPs, we colonized germ-free mice with modified Schaedler flora (ASF), a well-defined community of eight bacterial species [28] or with the intestinal fungal pathobiont Candida albicans. Notably, fungal colonization induced strong BLPs formation in the distal colon of germ-free mice that were otherwise devoid of these structures, whereas bacterial colonization did not have this effect (Figure 2D, [20]). No change in the number of subepithelial macrophages was observed. While colonization of germ-free mice with the pathobiont, Candida albicans, led to epithelial cell death, the bacteria had no effect (Figure 2E, [20]). Overall, these results support a role for the mycobiota in BLPs formation in the distal colon, where these microorganisms are particularly abundant. Nevertheless, although we obtained no evidence for the involvement of bacteria in the formation of BLPs, we cannot exclude that specific bacterial species that are not present in the ASF and are resistant to the antibiotics used may also influence these protrusions.
2.4. Intestinal fungi are responsible for epithelial cell death in the distal colon of macrophage-depleted mice
So far, our results suggest that in the distal colon there is a population of CD11chigh Mϕs that form BLPs in response to local fungi. On the other hand, we found that Mϕs depletion was associated with massive epithelial cell apoptosis in the distal colon but not in the proximal colon (Figure 1, [20]). We therefore hypothesized that, by forming BLPs, Mϕs might protect epithelial cells from fungis-induced death. Indeed, fungi have been shown to produce many deleterious to the host, including toxins and metabolites [8]. To test this hypothesis, we pre-treated CD64DTR mice with antifungal agents prior to Mϕs depletion and assessed the impact of such treatment on epithelial cell survival. Strikingly, we found that antifungal treatment rescued epithelial cells from death in animals without Mϕs (Figure 2F, [20]). The number of apoptotic colonocytes in mice treated with fluconazole or amphotericin B before Mϕs depletion was comparable to those observed in mice containing Mϕ. In contrast, epithelial cell death was not rescued when Mϕ-depleted mice were treated with antibiotics (Figure 2F, [20]). We conclude that fungi are most likely responsible for the epithelial cell death observed in the distal colon of Mϕ-depleted mice. These results further suggest that Mϕs protect epithelial cells from fungus-induced cell death.
2.5. BLP+ macrophages sample fluids absorbed by epithelial cells
How do Mϕ detect fungi in the distal colon? Structural characterization of BLPs showed that they were filled with epithelial cell membranes and enriched in endo-lysosomal compartments. We therefore hypothesized that BLPs could sample fungal metabolites/toxins indirectly, through the fluids absorbed by the epithelial cells. Indeed, the epithelial cells of the distal colon have specific mechanisms to optimize water absorption and facilitate stool dehydration [29]. Such mechanisms could allow BLP+ Mϕs to sample the environment in the absence of direct contact with the local microbiota. To assess whether BLP+ Mϕs respond to fluid uptake by epithelial cells, we infused CD11c-Cre/R26mTmG mice intrarectally with a hypotonic solution. We found that such treatment increased the number of BLPs as quickly as 10 min after infusion (Figure 3A, adapted from [20]) and returned to steady state within 30 min. This increase was also observed when fluid uptake was stimulated by injection of aldosterone, the corticosteroid hormone that increases sodium and thus water absorption specifically in the distal colon. In contrast, laxative treatment (Bisacodyl) inhibited water absorption; we observed a significant decrease in the number of BLPs (Figure 3B, adapted from [20]). Notably, this decrease was abrogated when the mice were pre-treated with indomethacin, which inhibits the action of bisacodyl [30]. Strikingly, monitoring of fluid absorbed by epithelial cells using Alexa-633-labelled hydrazide (a low molecular weight compound of 0.5–1.5 kDa) showed significant accumulation of the dye within the BLP+s as quickly as 5 min after infusion (Figure 3C, adapted from [20]). These results show that fluid absorbed through the distal colonic epithelium stimulates BLPs formation in the associated Mϕs in which this fluid accumulates. Most importantly, we found that BLP formation during fluid uptake was increased when fungi were present while the efficiency of epithelial fluid uptake was unchanged, supporting our hypothesis that BLPs sample fluids for the presence of fungal products.
Adapted from [20]. (A–C) BLP numbers after stimulation/inhibition of intestinal fluid absorption. (A) Mice (CD11c: Cre/R26mTmG) were infused intrarectally with hypotonic solution (1:1 H2O/PBS) and sacrificed 5, 10, 20 or 30 min later. (B) Mice (C57BL/6J) were force-fed a laxative (bisacodyl) and sacrificed 5 h later. Injection of indomethacin (IMC) 15 min before gavage was used as an inhibitor of bisacodyl. (C) Maximum z-projection of distal colonic Mϕ 5 min after intra-rectal infusion of hydrazide in hypotonic solution (1:1 H2O/PBS + hydrazide), a polar low molecular weight membrane impermeable dye, coupled to Alexa633, which was used as a water tracer, green—GFP membrane, red—hydrazide, scale bar—10 μm. (D) Mice were treated with an antifungal agent (fluconazole) and received an intra-rectal infusion of hypotonic solution with or without gliotoxin. Hydrazide was used as a water tracer. (E) Number of BLPs in mice pretreated with an antifungal agent and infused with hypotonic solution with or without gliotoxin. The control (non-perfused) group is indicated by “NI”. (F) Number of Hydrazide+ epithelial cells in mice pretreated with antifungal agent and perfused with hypotonic solution with or without gliotoxin. (G) Number of BLPs in mice pretreated with an antifungal agent (fluconazole, fluc) and perfused with hypotonic solution containing DMSO (H2O infused control group), candidalysin or T-2 toxin. “NI” indicates non-infused control groups. (H) CD64WT or CD64DTR littermates were treated with an antifungal agent (fluconazole) before Mϕ depletion. 20 h after the first injection of DT, mice received an intra-rectal infusion of gliotoxin. (I) BLP numbers in Mϕ-depleted mice 6 h after gliotoxin infusion. (J) Apoptotic cells were revealed with cleaved caspase 3 staining.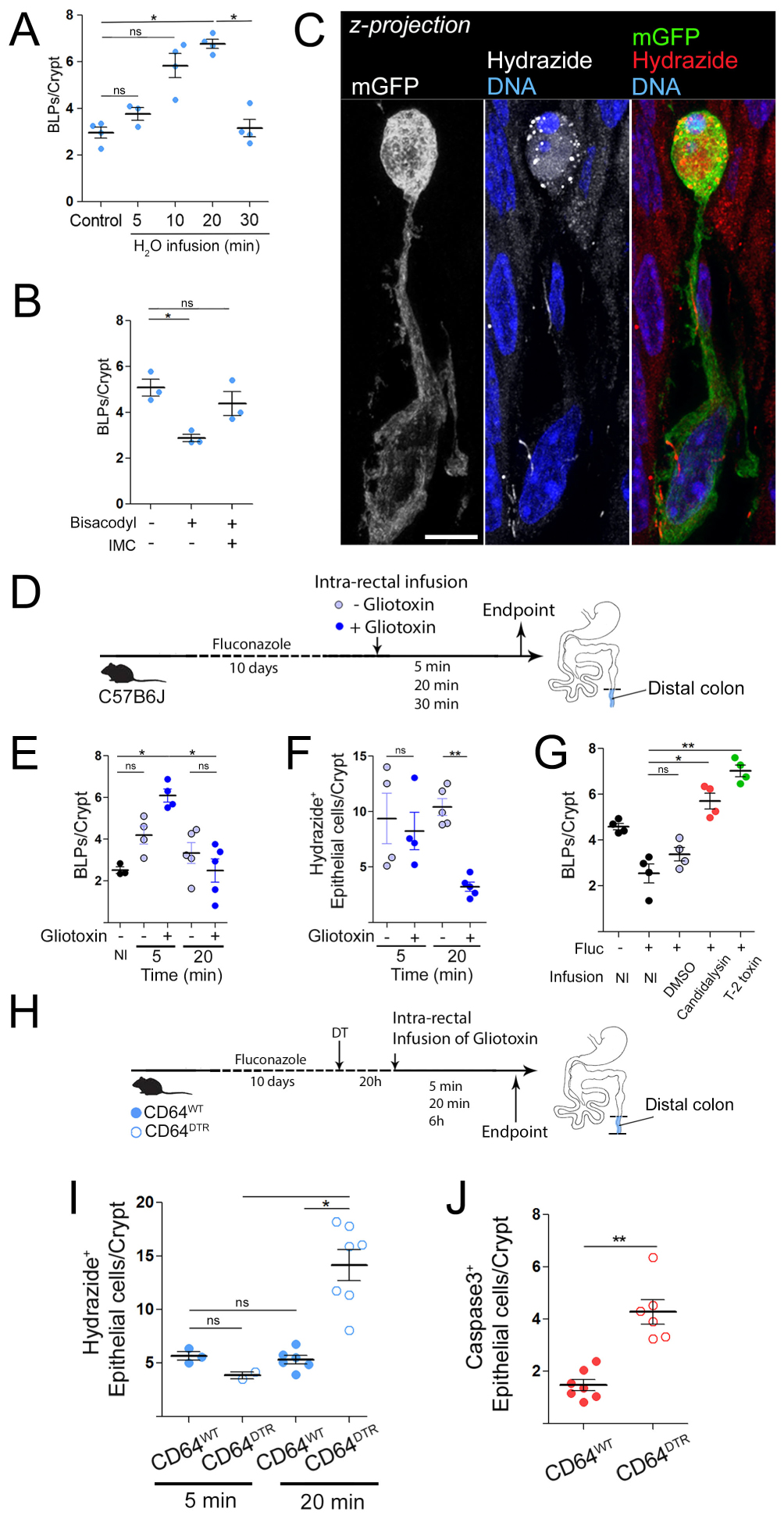
2.6. M𝜙s protect epithelial cells from poisoning by fungal toxins
To directly test this hypothesis, we searched for a molecule to use as a generic fungal metabolite, toxic to epithelial cells when concentrated. We turned our attention to gliotoxin. Indeed, this fungal metabolite has been shown to induce apoptosis of epithelial cells [8] and can be produced by both pathobionts and food spoilage fungi such as Penicillium chrysogenum [31], which is abundant in the murine intestinal tract [26]. It should be noted that gliotoxin was also produced by Candida spp. including Candida albicans, although there are conflicting studies on this [32, 33]. To determine whether Mϕs can detect fungal metabolites in fluids taken up by epithelial cells, we infused fungus-depleted C57BL/6J mice with a hypotonic solution containing or not gliotoxin (Figure 3D, adapted from [20]). We found that the gliotoxin-containing solution stimulated BLPs formation as early as 5 min after infusion (Figure 3E, adapted from [20]). While the epithelium continued to absorb the hypotonic solution without gliotoxin, it stopped absorbing the gliotoxin-containing solution 20 min after infusion (Figure 3F, adapted from [20]). Similar results were obtained using two other fungal toxins: candidalysin from the pathobiont Candida albicans and T2 toxin from the commensal Fusarium sporotrichoioides [26] (Figure 3G, adapted from [20]). These data show that epithelial cells detect and stop absorbing fluids poisoned by fungal toxins.
To determine whether this is an intrinsic ability of epithelial cells or relies on the presence of Mϕ BLP+, we performed a similar experiment with CD64WT or CD64DTR mice injected with diphtheria toxin (DT) and perfused with the hypotonic solution containing gliotoxin (Figure 3H, adapted from [20]). Remarkably, we found that while DT-injected CD64WT mice stopped absorbing the gliotoxin-containing solution, Mϕ-depleted CD64DTR mice continued to absorb (Figure 3I, adapted from [20]). To assess whether this uncontrolled uptake of gliotoxin had long-term effects on epithelial homeostasis, we perfused CD64WT and CD64DTR mice with the hypotonic gliotoxin-containing solution and sacrificed them 6 h later. In these experiments, epithelial cells of the distal colon underwent massive apoptosis in the absence of Mϕs, confirming that these phagocytes protect epithelial cells against poisoning by fungal toxins (Figure 3J, adapted from [20]). We conclude that in the distal colon, Mϕs confer on epithelial cells the ability to recognize toxic fluids and stop absorption, maintaining epithelial integrity and local homeostasis.
3. Discussion
The intestinal barrier separates the intestinal lumen from the internal environment. It acts as a selectively permeable filter that allows the absorption of nutrients, electrolytes and water, which can then reach the systemic circulation. On the other hand, as the intestinal lumen also contains many toxic substances produced by the microbiota, absorption must be tightly regulated to avoid intoxication and host disease. Indeed, disregulation of intestinal barrier permeability is a major cause of sepsis-related mortality in critically ill patients and in inflammatory bowel disease. While the mechanisms of intestinal permeability regulation have been extensively studied in the small intestine, little is known about the colon, where the main physiological function is to absorb fluids but which also contains a very high load of microorganisms.
We have described a mechanism where a particular population of subepithelial macrophages, which rapidly control the quality of absorbed fluids, maintains the integrity of the intestinal barrier.
To do this, the Mϕs use BLPs inserted at the base of the epithelium, which sample the fluids absorbed by colonocytes. If the fluids are overloaded with fungal metabolites/toxins, the Mϕs instruct the epithelial cells to stop the uptake, preventing epithelial cell poisoning and death. This could, for example, occur through the secretion of prostaglandin 2 (PGE2) by Mϕs, which decreases the alical localization of aquaporin of epithelial cells in vitro [30]. In the absence of Mϕs or BLPs, epithelial cells absorb fluids irrespectively of their fungal toxin/metabolite load and undergo apoptosis, thus compromising barrier integrity.
These results suggest that in homeostasis, intestinal barrier permeability is differentially regulated depending on the local physiological roles of the specific gut segment and its microbial content. Mϕs thus emerge as key players in orchestrating such regulation. In the small intestine, Mϕs form transient transepithelial dendrites visible by live imaging. In response to microbial signals, these projections extend between epithelial cells and reach the intestinal lumen where they capture bacteria or food antigens. They express tight junction proteins to form adhesions with epithelial cells when crossing the barrier, thus maintaining the integrity of the epithelium. They therefore appear to be different from the colonic BLPs described here. Although BLPs also penetrate the basement membrane and occupy the intercellular space of the epithelium, they do not directly contact the colonic lumen. These differences are consistent with the distinct properties of the epithelia in the small and large intestine. While paracellular permeability is high in the small intestine epithelium, reflecting its physiological role in nutrient absorption and the establishment of food tolerance, the colonic epithelium has limited paracellular permeability. This helps the colonic epithelium to withstand the local mechanical stresses imposed by high osmotic pressure and stool solidification, preventing loss of barrier integrity. Mϕs could therefore have developed an alternative sampling strategy in the context of such tightly sealed colonic epithelium. They form BLPs, which sample absorbed fluids through or between epithelial cells, rather than directly engulfing the contents of the colonic lumen, which contains a large number of microorganisms. Although the paracellular pathway allows sampling of absorbed fluid across the epithelium, a process necessary for stool formation, the transcellular pathway could detect transient barrier leakage events resulting from mechanical stress by stretching and shearing. These results suggest that the sampling mechanisms by the peripheral immune system are adapted to both local signals and physiological functions of the intestinal segment. Unexpectedly, we found that BLP+ Mϕs in the distal colon respond to fungal products. Similar results were observed with two different antifungal agents, fluconazole and amphotericin B, which target distinct fungal species by different mechanisms [34]. These results are consistent with fungi being particularly enriched in this intestinal segment [7]. We obtained no evidence that bacterial compounds stimulate BLPs formation. However, we cannot exclude the possibility that bacteria insensitive to the antibiotics used or absent from the ASF flora may still stimulate BLP formation. How do subepithelial Mϕs BLP+ detect fungal products?
The distal colon contains a thick layer of mucus that physically separates the microbiota from the epithelial cells; the inner part of the mucus is sterile [35]. Therefore, in homeostasis, there is no contact between the subepithelial Mϕs and the colonic lumen, and Mϕs use BLPs to sample the fluids taken up by the epithelial cells, which carry the full spectrum of fungal metabolites, providing a complete picture of the local composition of the mycobiota. Whether BLP+ Mϕs directly detect fungal products absorbed by the epithelium or detect stress compounds released from poisoned epithelial cells requires further investigation. This is in sticking contrast to what happens in response to barrier disruption or in the presence of invasive fungal species: in this case, Mϕs physically come into contact with fungi and use Dectin-1 to mount effective anti-fungal immune responses [7, 36]. Similar results were obtained using three different fungal toxins: gliotoxin, which is produced by both pathobionts and commensals, Candidalysin, from the pathobiont Candida albicans, and T-2 toxin, from commensals of Fusarium sporotrichoioides. In all cases, the number of BLPs increased upon toxin inoculation in fungus-free mice, indicating that BLP+Mϕs recognise all three fungal metabolites. These results suggest that BLPs respond not only to fungal compounds produced by pathogenic species, but to a wide variety of fungal metabolites. The BLPs response may therefore be critical not only for detecting potentially dangerous fungal species, but also for detecting the overgrowth of commensal fungi, whose metabolites could compromise the survival of epithelial cells if they are too abundant. As a result, we found that commensal fungi are indeed responsible for the apoptosis of epithelial cells in Mϕs-depleted mice. Defining the precise nature of the commensal fungi involved will require further investigation. An interesting candidate is the commensal species Fusarium sporotrichoioides, as it is targeted by both fluconazole and amphotericin B and produces T-2 toxin. How do BLP+ Mϕs resist the toxins remains an open question; it could be envisaged that BLPs keep the toxins away from the cell body of these cells. In conclusion, we describe here a previously unknown homeostatic function of CD11chigh subepithelial Mϕs in the distal colon: they help the epithelium to maintain its integrity in an environment subjected to high physical and chemical stresses resulting from osmotic pressure, faecal solidification and a high microbial load. How do BLP+ Mϕs instruct epithelial cells to take up or not take up fluids in homeostasis and whether alterations in these mechanisms lead to pathologies such as inflammatory bowel disease and cancer shall next be addressed.
Conflicts of interest
Authors have no conflict of interest to declare.
French version
1. Introduction
L’intestin est un environnement unique qui est continuellement exposé à des antigènes alimentaires mais aussi largement exposé à une flore intestinale riche en micro-organismes. Sa fonction, essentielle à notre corps, repose sur l’absorption efficace de nutriment et d’électrolytes, c’est notamment la raison pour laquelle la barrière intestinale est relativement mince, favorisant ainsi les échanges. Néanmoins, ceci peut devenir problématique pour l’hôte si des substances toxiques se trouvant dans la cavité luminale parviennent à atteindre la circulation sanguine [1]. Une perturbation de la barrière intestinale peut donc aboutir à des situations pathologiques plus ou moins graves allant de la privation de nutriments [2], à des maladies intestinales inflammatoires [3], ou la septicémie [4] ou encore des défaillances au niveau de plusieurs organes [1].
Selon la région de l’intestin, la barrière épithéliale du côlon distal est confrontée à des défis importants. D’une part, l’épithélium du côlon distal est exposé à l’extrême pression osmotique de 10 atm nécessaire pour absorber l’eau et solidifier les selles [5] mais d’autre part aussi car le microbiote, constitué de bactéries, de champignons, d’archées et de virus, est très dense dans cette région de l’intestin [6]. Or, les champignons, particulièrement abondants dans le côlon distal [7], peuvent produire des métabolites qui déclenchent l’apoptose des cellules épithéliales intestinales [8], compromettant ainsi l’intégrité de la barrière intestinale. C’est une des raisons pour lesquelles la barrière intestinale est la principale cible de nombreuses toxines fongiques, telles que la gliotoxine, l’aflatoxine [9], les trichothécènes ou la candidalysine.
La muqueuse du côlon régule donc étroitement l’absorption des fluides tout en limitant l’entrée de métabolites fongiques toxiques dans les cellules épithéliales ou même au niveau de la circulation sanguine. Malheureusement, les mécanismes régulateurs responsables de cet équilibre restent à ce jour inconnus.
Dans des conditions homéostatiques, les macrophages représentent la population immunitaire la plus abondante de l’intestin. Ils se différencient principalement depuis des monocytes en réponse à des signaux locaux. Les macrophages intestinaux peuvent résider dans la lamina propria, ou dans la partie musculaire de la paroi intestinale où ils participent à divers processus biologiques tels que la dégradation des micro-organismes [10], l’élimination silencieuse des corps apoptotiques [11], la réparation des tissus [12] et la motilité gastro-intestinale [13]. Par ailleurs, les macrophages intestinaux limitent également l’inflammation [14], en facilitant la tolérance à la nourriture [15]. Leur fonction qui est étroitement liée à la présence du microbiote [16] explique qu’ils sont retrouvés en plus grand nombre dans le côlon par rapport à l’intestin grêle [17].
Il est intéressant de noter que dans le côlon, les macrophages peuvent être étroitement associés aux cellules épithéliales [18] et c’est ainsi qu’une relocalisation des macrophages en zone sous-épithéliale participe à la perte de l’intégrité de la barrière intestinale, qui peut être observée dans les maladies inflammatoires de l’intestin telles que la colite ulcéreuse et la maladie de Crohn [19]. Les macrophages occupent donc une localisation idéale pour orchestrer les interactions entre les cellules épithéliales et le microbiote, et maintenir ainsi l’homéostasie du côlon.
La principale question de notre travail était d’identifier le rôle des macrophages du côlon dans l’intégrité et la fonction de la barrière épithéliale intestinale dans l’homéostasie [20].
En résumé, nous avons décrit un mécanisme par lequel le système immunitaire inné permet un contrôle rapide et efficace de la qualité des fluides absorbés afin d’éviter l’intoxication des colonocytes [20]. Ce mécanisme repose sur une population de macrophages du côlon distal équipés de protubérances en forme de « ballons » (BLP) insérées dans l’épithélium pour prélever les fluides absorbés. En l’absence de macrophages ou de BLP, les cellules épithéliales continuent d’absorber des fluides contenant des produits fongiques, ce qui entraîne leur mort et la perte ultérieure de l’intégrité de la barrière épithéliale.
Ces résultats [20] ont révélé pour la première fois un rôle inattendu et essentiel des macrophages dans le maintien des interactions entre la barrière épithéliale du côlon et le microbiote, jouant un rôle clé dans le maintien de l’homéostasie intestinale.
2. Résultats
2.1. Les macrophages contrôlent la survie des cellules épithéliales et l’intégrité de la barrière dans le côlon distal
Le système immunitaire intestinal est très compartimenté, avec différentes populations cellulaires réparties en gradient tout le long de l’intestin. Cela concerne en particulier les macrophages (Mϕ), qui sont présents en plus grande quantité dans le côlon par rapport à l’intestin grêle. Les Mϕ du colon contribuent au maintien de l’intégrité de l’épithélium. En effet, leur absence est corrélée au développement de la colite ulcéreuse et de la maladie de Crohn [21]. Cependant, le ou les mécanismes par lesquels Mϕ atteint une telle fonction homéostatique in vivo restent inconnus. Pour répondre à cette question, nous avons éliminé les Mϕ à l’aide du modèle murin CD64DTR [22] puis évalué l’état de l’épithélium (Figure 1A, [20]). Nous avons analysé le côlon proximal et distal car ces deux zones sont connues pour présenter de nombreuses différences en termes de physiologie et de composition du microbiote [23]. L’absence de Mϕ du colon dans notre modèle a été vérifiée par cytométrie en flux et par imagerie dans les deux segments du côlon. De manière inattendue, nous avons constaté que la déplétion des Mϕ conduisait à une apoptose massive des cellules épithéliales dans le côlon distal mais pas proximal (Figure 1B,C, [20]). Nos résultats suggèrent donc que les Mϕ facilitent la survie des cellules épithéliales particulièrement dans le côlon distal.
Pour évaluer l’impact de la mort des cellules épithéliales sur la perméabilité de l’épithélium, nous avons perfusé des souris CD64WT et CD64DTR par voie intra-rectale avec une solution hypotonique contenant une petite molécule fluorescente hydrazide et puis nous avons mesuré son apparence dans le sang. Nous avons constaté que l’hydrazide était plus abondante dans le sang des souris appauvries en Mϕ par rapport aux animaux témoins (Figure 1D, [20]), indiquant une perte d’intégrité de la barrière chez ces animaux. Dans l’ensemble, ces résultats montrent que les Mϕ sont nécessaires pour la survie des cellules épithéliales et l’intégrité de la barrière intestinale dans le côlon distal.
Les macrophages sont nécessaires à la survie des cellules épithéliales dans le côlon distal et forment des protubérances « en forme de ballon » insérées entre les cellules épithéliales [20]. (A) Schéma experimental d’élimination des Mϕ basé sur le modèle de souris CD64DTR. (B) Côlon proximal et distal 44 h après la première injection DT, échelle de 50 μm. (C) Nombre de cellules épithéliales apoptotiques par crypte dans le côlon distal ou proximal de souris CD64WT ou CD64DTR. Les résultats sont présentés sous forme de moyenne ± SEM, test de Kruskal–Wallis à comparaison multiple, ∗ P < 0, 05. (D) Intensités de fluorescence sérique des compagnons de portée CD64WT ou CD64DTR 5 à 10 min après l’administration intra-rectale d’une solution hypotonique d’Hydrazide-AlexaFluor633. (E) Différences morphologiques de Mϕ dans le côlon proximal et distal. Coloration complète du côlon distal et proximal de souris CD11c: Cre / R26mTmG. Les BLP sont indiqués par des flèches, la frontière entre l’épithélium et le stroma est indiquée par la ligne pointillée, les barres d’échelle — 50 μm. (F) Mϕ simples formant des BLP (à gauche) ou des extensions minces (à droite). Les corps cellulaires sont indiqués par l’étoile jaune, les BLP avec des flèches vertes, les extensions avec des pointes de flèches vertes, la barre d’échelle — 2 μm. (G) Nombre de BLP, normalisés par crypte (à gauche) ou par Mϕ (à droite) dans le côlon distal et proximal. (H) Quantité de Mϕ dans le côlon proximal et distal, analysée par imagerie et par cytométrie en flux. (I) Nombre d’extensions, normalisé par Mϕ dans le côlon distal et proximal.
2.2. Les macrophages distaux du côlon insèrent des protrusions « en forme de ballon » entre les cellules épithéliales
Ces résultats nous ont incités à étudier la distribution tissulaire des Mϕ et / ou leur interaction physique avec les cellules épithéliales dans le côlon proximal et distal. Pour répondre à cette question, nous avons effectué une immunomarquage de sections entier du côlon proximal et distal isolées de souris CD11c-Cre / R26mTmG [24]. Dans ce modèle de souris, toutes les cellules qui expriment CD11c tout au long de leur différenciation, qui incluent Mϕ intestinale (et les cellules dendritiques), passent de l’expression membranaire-tomato à membranaire-GFP, permettant une meilleure visualisation de ces phagocytes dans le tissu. En utilisant ces animaux, nous avons observé une population de phagocytes dans le côlon distal qui interagissait physiquement avec les cellules épithéliales à travers de protubérance membranaire en forme de ballons (Figure 1E,F, [20]), que nous appellerons ci-après protubérances « en forme de ballon » ou BLP (de l’anglais Ballon Like Protusions). Les corps cellulaires de ces cellules étaient localisés autour de l’ouverture des cryptes. L’immunomarquage a montré que les cellules BLP+ ressemblaient à des Mϕ intestinaux bona fide (CD11b+ MHCII+ F4/80+ CX3CR1+ CD64+ CD103− CX3CR1−GFP+) et en conséquence, ils ont été perdus chez les souris CD64DTR injectées de toxine [25]. De manière frappante, un nombre réduit de BLP a été observé dans le côlon proximal (Figure 1E,G), même si les cryptes proximales contenaient un nombre similaire de Mϕ que leur homologue distal (déterminé par cytométrie en flux et par imagerie, Figure 1H, [20]). Nous concluons que le côlon distal est enrichi en Mϕ équipé de protrusions de membrane en forme de ballon particulière insérées à la base des cellules épithéliales.
2.3. Les champignons intestinaux augmentent la formation de BLP de macrophages
Ces résultats nous ont amenés à évaluer l’impact du microbiote sur BLP+ Mϕ [20]. Le côlon abrite la plus grande quantité de micro-organismes dans le corps, où les populations bactériennes et fongiques commensales partagent la niche intestinale [6]. Pour évaluer l’effet potentiel des bactéries et des champignons sur la formation des BLP, nous avons ciblé chaque population avec un cocktail d’antibiotiques à large spectre ou des agents antifongiques respectivement. Aucun effet des antibiotiques n’a été observé (Figure 2A, [20]). À l’opposé, deux agents antifongiques, le fluconazole et l’amphotéricine B, ont significativement diminué le nombre de BLP (Figure 2A,B, [20]) sans modifier le nombre total de Mϕ, comme le montre la cytométrie en flux. Nous avons précédemment souligné que ces médicaments réduisent efficacement la quantité de champignons intestinaux chez la souris [26] mais utilisent des mécanismes d’action distincts [27]. Le marquage des tissus a montré que le nombre de Mϕ sous-épithéliales était également inchangé chez les souris traitées avec des médicaments antifongiques, et que ces cellules présentaient de longues saillies minces au lieu de BLP, comme observé dans le côlon proximal. A noter, l’association du fluconazole ou de l’amphotéricine B avec des antibiotiques n’a montré aucun effet additif (Figure 2C, [20]), suggérant que ces deux agents antifongiques n’agissent pas indirectement sur les BLP, c’est-à-dire en conduisant à l’expansion des bactéries coliques. Ces résultats suggèrent donc que les champignons résidant dans le côlon distal pourraient favoriser la formation de BLP dans le Mϕ sous-épithélial.
Les champignons intestinaux stimulent la formation de BLP et expliquent la mort épithéliale en l’absence de Mϕ [20]. (A) Nombre de BLP dans le côlon distal de souris traitées avec un cocktail antibiotique (AB) ou un agent antifongique (fluconazole, fluc). (B) Nombre de BLP, normalisé par crypte dans le côlon distal de souris traitées avec un agent antifongique (amphotéricine B, AmphB). (C) Nombre de BLP dans le côlon distal de souris traitées par cocktail d’antibiotiques, fluconazole, amphotéricine B ou en association d’agents antibactériens et antifongiques (antibiotiques + fluconazole, antibiotiques + amphotéricine B). (D) Nombre de BLP, normalisé par crypte, chez des souris exemptes de germes colonisées par des bactéries (flore Schaedler, ASF) ou des champignons (C. albicans). (A–D) Mϕ ont été visualisés par coloration F4 / 80 (cyan) et cryptes — avec de la laminine (violet), barres d’échelle — 10 μm. (E) N nombre de cellules épithéliales apoptotiques (caspase clivée 3) par crypte dans le côlon distal de souris exemptes de germes colonisées par des bactéries ou des champignons. (F) Des souris CD64WT ou CD64DTR ont été traitées avec des agents antifongiques (fluconazole ou amphotéricine B) ou un cocktail d’antibiotiques avant l’épuisement de Mϕ. L’architecture globale du tissu a été visualisée avec une coloration F-actine (vert) et des cellules apoptotiques ont été révélées avec une coloration caspase 3 clivée (rouge), barres d’échelle — 20 μm.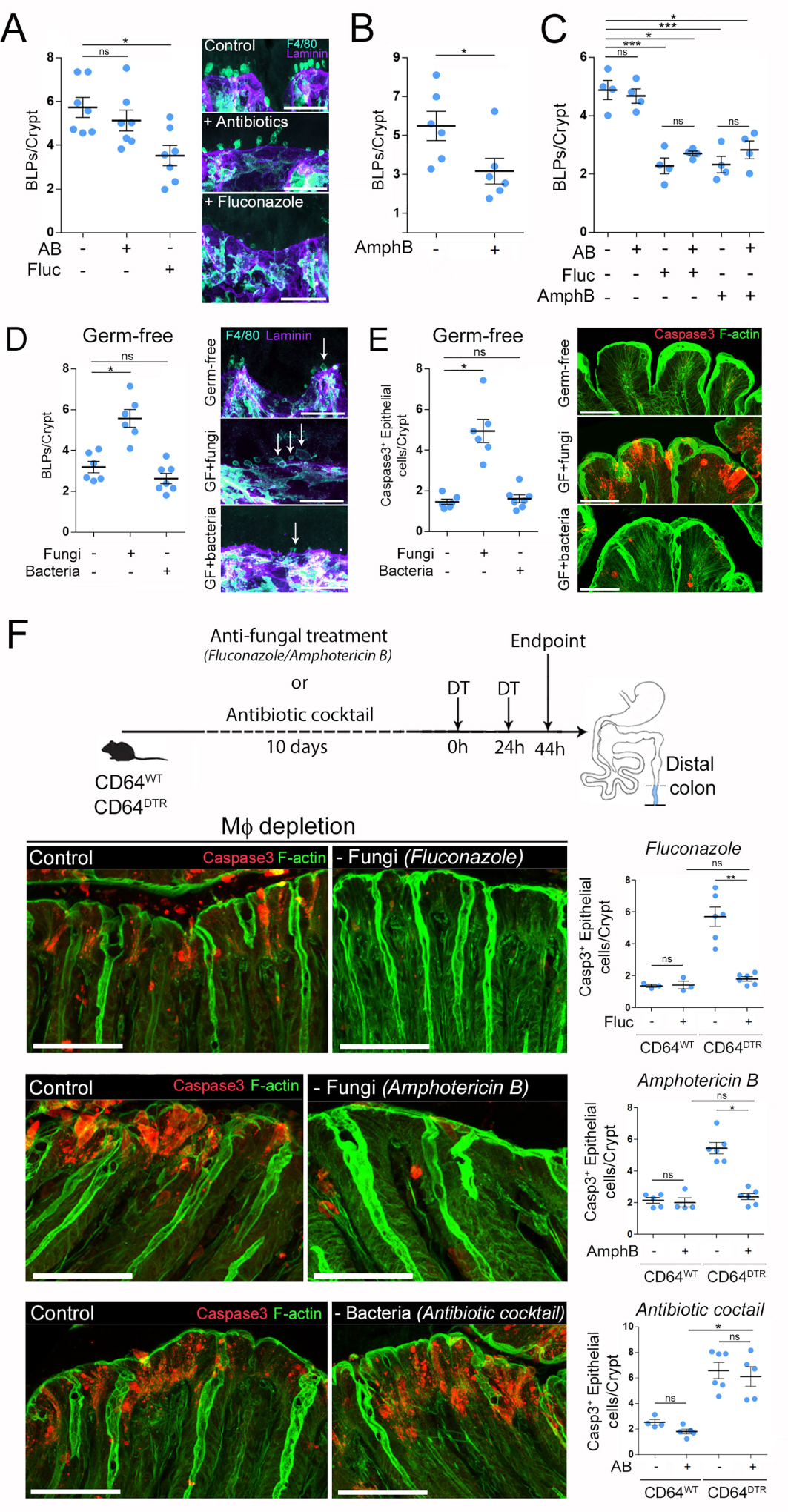
Pour évaluer directement le rôle des champignons dans l’induction des BLP, nous avons colonisé des souris sans germes avec une flore de Schaedler modifiée (ASF), une communauté bien définie de huit espèces bactériennes [28] ou avec le pathobionte fongique intestinal Candida albicans. Notamment, la colonisation fongique a induit une forte formation de BLP par Mϕ dans le côlon distal de souris sans germes qui étaient autrement dépourvues de ces structures, tandis que la colonisation bactérienne n’a pas influencé la formation de BLP (Figure 2D, [20]). Aucun changement du nombre de macrophages sous-épithéliaux n’a été observé. Alors que la colonisation de souris sans germes par le pathobionte, Candida albicans, a conduit à la mort des cellules épithéliales, les bactéries n’ont eu aucun effet (Figure 2E, [20]). Dans l’ensemble, ces résultats soutiennent le rôle du mycobiote dans la formation des BLP dans le côlon distal, où ces micro-organismes sont particulièrement abondants. Néanmoins, bien que nous n’ayons obtenu aucune preuve de l’implication des bactéries dans la formation des BLP, nous ne pouvons pas exclure que des espèces de bactéries spécifiques qui ne sont pas présentes dans la ASF et résistent aux antibiotiques utilisés puissent également influencer ces saillies.
2.4. Les champignons intestinaux sont responsables de la mort des cellules épithéliales dans le côlon distal des souris appauvries en macrophages
Jusqu’à présent, nos résultats suggèrent que dans le côlon distal, il existe une population de Mϕ CD11chigh qui forment des BLP en réponse aux champignons locaux. D’autre part, nous avons constaté que la déplétion des Mϕ était associée à une apoptose massive des cellules épithéliales dans le côlon distal mais pas dans le côlon proximal (Figure 1, [20]). Nous avons donc émis l’hypothèse qu’en formant des BLP, les Mϕ pourraient protéger les cellules épithéliales de la mort induite par les champignons. En effet, il a été démontré que les champignons produisent de nombreuses molécules toxiques, y compris des toxines et des métabolites qui peuvent être délétères pour l’hôte [8]. Pour tester cette hypothèse, nous avons prétraité des souris CD64DTR avec des agents antifongiques avant l’élimination des Mϕ et évalué l’impact d’un tel traitement sur la survie des cellules épithéliales. De manière frappante, nous avons constaté que le traitement antifongique a sauvé les cellules épithéliales de la mort chez les animaux sans Mϕ (Figure 2F, [20]). Le nombre de colonocytes apoptotiques chez les souris traitées avec du fluconazole ou de l’amphotéricine B avant la déplétion en Mϕ était comparable à ceux observés chez les souris contenant des Mϕ. En revanche, la mort des cellules épithéliales n’a pas été sauvée lorsque les souris appauvries en Mϕ ont été traitées avec des antibiotiques (Figure 2F, [20]). Nous concluons que les champignons sont très probablement responsables de la mort des cellules épithéliales observées dans le côlon distal de souris appauvries en Mϕ. Ces résultats suggèrent en outre que les Mϕ pourraient protéger les cellules épithéliales de la mort cellulaire induite par les champignons.
2.5. Les macrophages BLP+ échantillonnent les fluides absorbés par les cellules épithéliales
Comment les Mϕ détectent-ils les champignons dans le côlon distal ? La caractérisation des BLP a montré qu’ils étaient remplis de membranes de cellules épithéliales et enrichis en compartiments endolysosomaux. Nous avons donc émis l’hypothèse que les BLP pourraient échantillonner les métabolites / toxines fongiques indirectement, à travers les fluides absorbés par les cellules épithéliales avec lesquelles ils sont en contact. En effet, les cellules épithéliales du côlon distal possèdent des mécanismes spécifiques qui optimisent l’absorption de l’eau et facilitent la déshydratation des selles [29]. Un tel mécanisme pourrait permettre à BLP+ Mϕ d’échantillonner l’environnement en l’absence de contact direct avec le microbiote local. Pour évaluer si BLP+ Mϕ répond à l’absorption de liquide par les cellules épithéliales, nous avons perfusé des souris CD11c-Cre/R26mTmG par voie intra-rectale avec une solution hypotonique. Nous avons constaté qu’un tel traitement augmentait le nombre de BLP aussi rapidement que 10 min après la perfusion (Figure 3A, adapté de [20]) et revenait à l’état d’équilibre en 30 min. Cette augmentation a également été observée lorsque l’absorption liquidienne était stimulée par l’injection d’aldostérone, l’hormone corticostéroïde qui augmente le sodium et donc l’absorption d’eau spécifiquement dans le côlon distal. Au contraire, lors de l’inhibition de l’absorption d’eau en traitant les animaux avec le laxatif Bisacodyl, nous avons observé une diminution significative du nombre de BLP (Figure 3B, adapté de [20]). Notamment, cette diminution a été abrogée lorsque les souris ont été prétraitées avec de l’indométacine, qui inhibe l’action du bisacodyl [30]. De manière frappante, le suivi du fluide absorbé par les cellules épithéliales à l’aide de l’hydrazide marqué par Alexa-633 (un composé de faible poids moléculaire de 0,5 à 1,5 kDa) a montré une accumulation importante du colorant à l’intérieur du réseau des Mϕ BLP+ aussi rapidement que 5 min après la perfusion (Figure 3C, adapté de [20]). Ces résultats montrent que le fluide absorbé à travers l’épithélium du côlon distal stimule la formation de BLP dans le Mϕ associé dans lequel ce fluide s’accumule. Surtout, nous avons constaté que la formation de BLP lors de l’absorption de liquide était augmentée lorsque les champignons étaient présents alors que l’efficacité de l’absorption épithéliale du liquide était inchangée, ce qui confirme notre hypothèse selon laquelle les BLP échantillonnent les liquides pour la présence de produits fongiques.
Adapté de [20]. (A–C) Nombre de BLP après stimulation / inhibition de l’absorption intestinale du liquide. (A) Les souris (CD11c: Cre/R26mTmG) ont reçu une perfusion intra-rectale de solution hypotonique (1:1 H2O/PBS) et ont été sacrifiées 5, 10, 20 ou 30 min plus tard. (B) Les souris (C57BL / 6J) ont été nourries de force avec un laxatif (bisacodyl) et sacrifiées 5 h plus tard. L’injection d’indométacine (IMC) 15 min avant le gavage a été utilisée comme inhibiteur du bisacodyl. (C) Projection z maximale de Mϕ colique distal 5 min après perfusion intra-rectale d’hydrazide dans une solution hypotonique (1:1 H2O / PBS + hydrazide), un colorant imperméable à la membrane de faible poids moléculaire polaire, couplé à Alexa633, qui était utilisé comme traceur d’eau, vert — membrane GFP, rouge — hydrazide, barre d’échelle — 10 μm. (D) Les souris ont été traitées avec un agent antifongique (fluconazole) et ont reçu une perfusion intra-rectale de solution hypotonique avec ou sans gliotoxine. L’hydrazide a été utilisé comme traceur d’eau. (E) Nombre de BLP chez les souris prétraitées avec un agent antifongique et perfusées avec une solution hypotonique avec ou sans gliotoxine. Le groupe témoin (non perfusé) est indiqué par « NI ». (F) Nombre de cellules épithéliales Hydrazide+ chez les souris prétraitées avec un agent antifongique et perfusées avec une solution hypotonique avec ou sans gliotoxine. (G) Nombre de BLP chez les souris prétraitées avec un agent antifongique (fluconazole, fluc) et perfusées avec une solution hypotonique contenant du DMSO (groupe témoin infusé H2O), de la candidalysine ou de la toxine T-2. Les groupes témoins non perfusés sont indiqués par « NI ». (H) Les compagnons de portée CD64WT ou CD64DTR ont été traités avec un agent antifongique (fluconazole) avant l’épuisement de Mϕ. 20 h après la première injection de DT, les souris ont reçu une perfusion intra-rectale de gliotoxine. (I) Nombre de BLP chez les souris appauvris en Mϕ 6 h après la perfusion de gliotoxine. (J) Les cellules apoptotiques ont été révélées avec une coloration caspase 3 clivée.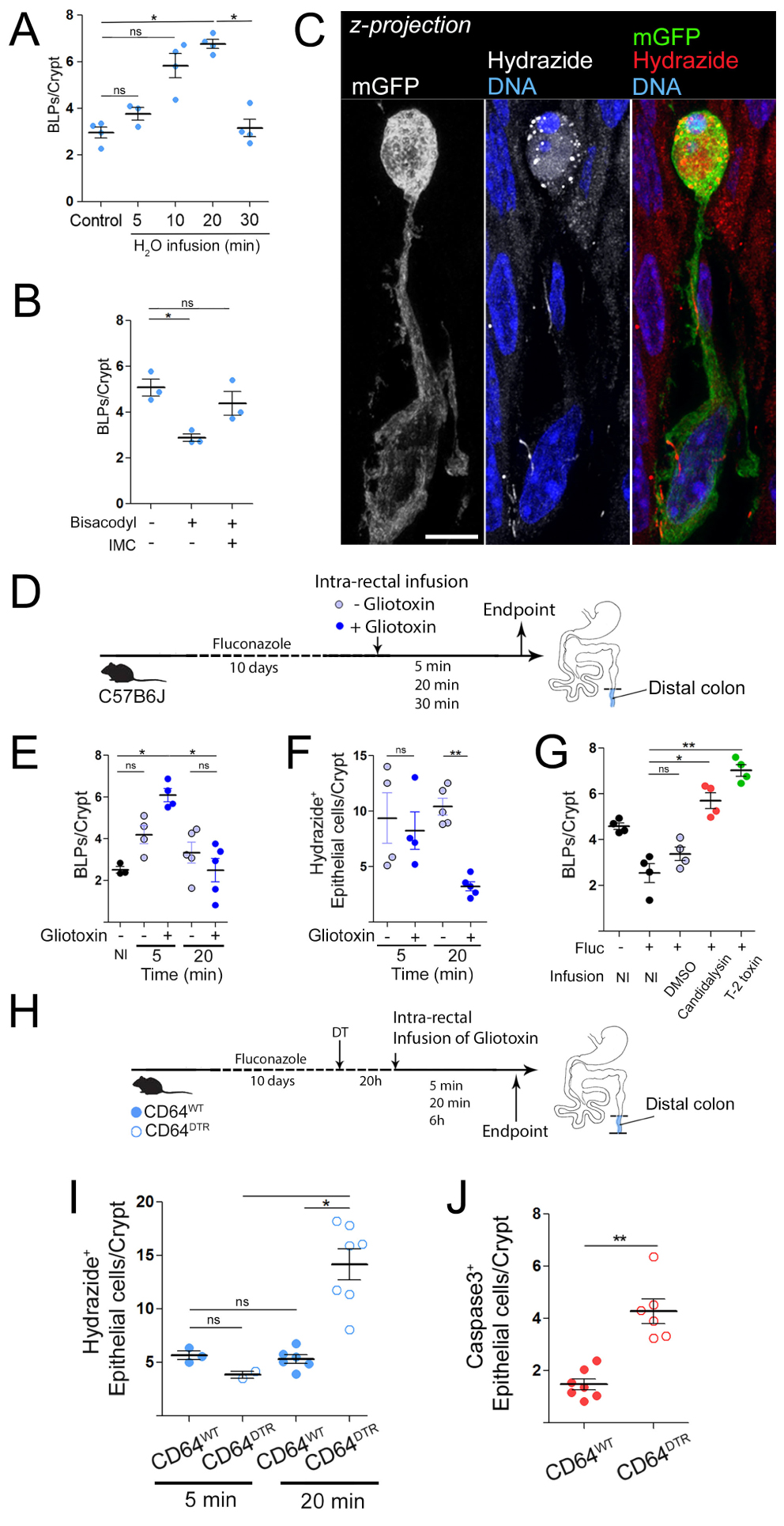
2.6. Les M𝜙 protègent les cellules épithéliales contre l’empoisonnement par les toxines fongiques
Pour tester directement cette hypothèse, nous avons recherché une molécule à utiliser comme métabolite fongique générique, toxique pour les cellules épithéliales une fois concentrées. Nous avons tourné notre attention vers la gliotoxine. En effet, il a été démontré que ce métabolite fongique induisait l’apoptose des cellules épithéliales [8] et pouvait être produit à la fois par des pathobiontes et des champignons d’altération des aliments tels que Penicillium chrysogenum [31], qui est abondant dans le tractus intestinal murin [26]. Il convient de noter que la gliotoxine était également produite par Candida spp., y compris Candida albicans, même s’il existe des études contradictoires à ce sujet [32, 33]. Pour déterminer si les Mϕ peuvent détecter les métabolites fongiques présents dans les fluides absorbés par les cellules épithéliales, nous avons infusé des souris C57BL/6J appauvries en champignons avec une solution hypotonique contenant ou non de la gliotoxine (Figure 3D, adapted from [20]). Nous avons constaté que la solution contenant de la gliotoxine stimulait la formation de BLP dès 5 min après la perfusion (Figure 3E, adapté de [20]). Alors que l’épithélium continuait à absorber la solution hypotonique sans gliotoxine, il a arrêté l’absorption de celle contenant de la gliotoxine 20 min après la perfusion (Figure 3F, adapté de [20]). Des résultats similaires ont été obtenus en utilisant deux autres toxines fongiques: la candidalysine du pathobionte Candida albicans et la toxine T2 du commensal Fusarium sporotrichoioides [26] (Figure 3G, adapted from [20]). Ces données montrent que les cellules épithéliales détectent et cessent d’absorber les fluides empoisonnés par des toxines fongiques.
Pour déterminer s’il s’agit d’une capacité intrinsèque des cellules épithéliales ou si elle repose sur la présence des Mϕ BLP+, nous avons effectué une expérience similaire avec des souris CD64WT ou CD64DTR injectées avec la toxine diphtérique (DT) et perfusées avec la solution hypotonique contenant de la gliotoxine (Figure 3H, adapté de [20]). De manière remarquable, nous avons constaté que tandis que les souris CD64WT injectées par DT arrêtaient l’absorption de la solution contenant de la gliotoxine, les souris CD64DTR appauvries en Mϕ continuaient à l’absorber (Figure 3I, adapté de [20]). Pour évaluer si cette absorption incontrôlée de la gliotoxine avait des effets à long terme sur l’homéostasie de l’épithélium, nous avons perfusé des souris CD64WT et CD64DTR avec la solution hypotonique contenant de la gliotoxine et les avons sacrifiés 6 heures plus tard. Dans ces expériences, les cellules épithéliales du côlon distal ont subi une apoptose massive en cas d’absence des Mϕ, confirmant que ces phagocytes protègent les cellules épithéliales contre un empoisonnement par des toxines fongiques (Figure 3J, adapté de [20]). Nous concluons que dans le côlon distal, les Mϕ confèrent aux cellules épithéliales la capacité de reconnaître les fluides toxiques et d’arrêter l’absorption, en maintenant l’intégrité épithéliale et l’homéostasie locale.
3. Discussion
La barrière intestinale sépare la lumière intestinale du milieu interne. Elle agit comme un filtre sélectivement perméable qui permet l’absorption des nutriments, des électrolytes et de l’eau, qui peuvent ensuite atteindre la circulation sanguine pour l’irrigation des organes. Par ailleurs, comme la lumière intestinale contient également de nombreuses substances toxiques produites par le microbiote, l’absorption doit être étroitement régulée pour éviter l’intoxication et la maladie de l’hôte. En effet, la dérégulation de la perméabilité de la barrière intestinale est une cause majeure de mortalité liée à la septicémie chez les patients gravement malades et dans les maladies inflammatoires de l’intestin. Alors que les mécanismes de régulation de la perméabilité intestinale ont été largement étudiés dans l’intestin grêle, on sait peu de choses sur la façon dont le côlon, dont la fonction physiologique principale est l’absorption de liquide mais qui contient aussi une charge de micro-organismes très élevée, se protège des produits microbiens toxiques.
On a décrit un mécanisme entraîné par une population particulière de macrophages sous-épithéliaux, qui assurent un contrôle rapide de la qualité des fluides absorbés afin de maintenir l’intégrité de la barrière.
Pour cela, les Mϕ utilisent des BLP insérés à la base de l’épithélium, qui échantillonnent les fluides absorbés par les cellules épithéliales. Si les fluides sont surchargés de métabolites / toxines fongiques, les Mϕ ordonnent aux cellules épithéliales d’arrêter l’absorption, empêchant l’empoisonnement des cellules épithéliales et leur mort. Cela pourrait par exemple se produire par la sécrétion de prostaglandine 2 (PGE2) par les Mϕs, ce qui diminue la localisation de l’aquaporine au niveau de la membrane apicale des cellules épithéliales in vitro[30]. En l’absence de Mϕ ou de BLP, les cellules épithéliales absorbent les fluides indépendamment de leur charge fongique de toxine / métabolite et subissent une apoptose, compromettant l’intégrité de la barrière.
Ces résultats suggèrent qu’en homéostasie, la perméabilité de la barrière intestinale est régulée différentiellement en fonction de la fonction physiologique locale du segment spécifique de l’intestin et de son contenu microbien. Les Mϕs émergent ainsi comme des acteurs clés dans l’orchestration d’une telle régulation. Dans l’intestin grêle, les Mϕ forment des dendrites transépithéliales transitoires visibles par imagerie en direct. En réponse aux signaux microbiens, ces saillies s’étendent entre les cellules épithéliales et atteignent la lumière intestinale où elles capturent des bactéries ou des antigènes alimentaires. Ils expriment des protéines à jonction serrée pour former des adhérences avec les cellules épithéliales lors du franchissement de la barrière, ce qui assure le maintien de l’intégrité de l’épithélium. Ils apparaissent donc comme différents des BLP coliques décrits ici. Bien que les BLP pénètrent également dans la membrane basale et occupent l’espace intercellulaire de l’épithélium, ils n’entrent pas directement en contact avec la lumière du côlon. Ces différences sont en accord avec les propriétés distinctes des épithéliums dans le petit et le gros intestin. Alors que la perméabilité paracellulaire est élevée dans l’épithélium de l’intestin grêle, reflétant son rôle physiologique dans l’absorption des nutriments et l’établissement de la tolérance alimentaire, l’épithélium du côlon présente une perméabilité paracellulaire limitée. Cela aide l’épithélium du côlon à résister aux contraintes mécaniques locales imposées par une pression osmotique élevée et la solidification des selles, empêchant la perte d’intégrité de la barrière. Les Mϕs auraient donc pu développer une stratégie d’échantillonnage alternative dans le contexte d’un tel épithélium colique étroitement scellé. Ils forment des BLP, qui échantillonnent les fluides absorbés à travers ou entre les cellules épithéliales, plutôt que d’engloutir directement le contenu de la lumière du côlon, qui contient un grand nombre de micro-organismes. Bien que la voie paracellulaire permette l’échantillonnage du fluide absorbé à travers l’épithélium, un processus nécessaire à la formation des selles, la voie transcellulaire pourrait détecter des événements transitoires de fuite de barrière résultant d’une agression mécanique par étirement et cisaillement. Ces résultats suggèrent que les mécanismes d’échantillonnage par le système immunitaire périphérique sont adaptés à la fois aux signaux locaux et aux fonctions physiologiques du segment intestinal. Nous avons découvert de manière inattendue que les Mϕ BLP+ du côlon distal répondent à la présence de produits fongiques. Des résultats similaires ont été observés avec deux agents antifongiques différents, le fluconazole et l’amphotéricine B, qui ciblent des espèces fongiques distinctes par différents mécanismes [34]. Ces résultats sont cohérents avec des champignons particulièrement enrichis dans le côlon distal [7]. Nous n’avons obtenu aucune preuve que les composés bactériens stimulent la formation de BLP. Cependant, nous ne pouvons pas exclure la possibilité que des bactéries insensibles aux antibiotiques utilisés ou absentes de la flore de la PPA puissent encore stimuler la formation de BLP. Comment les Mϕ BLP+ sous-épithéliaux détectent-ils les produits fongiques?
Le côlon distal contient une épaisse couche de mucus qui sépare physiquement le microbiote des cellules épithéliales; les parties internes de ce mucus sont stériles [35]. Par conséquent, en homéostasie, il n’y a pas de contact entre les Mϕ sous-épithéliales et la lumière du côlon, et Mϕs utilise des BLP pour échantillonner les fluides absorbés par les cellules épithéliales, qui transportent tout le spectre des métabolites fongiques, fournissant une image complète de la composition locale du mycobiote. Le fait que les BLP+ Mϕ détectent directement les produits fongiques absorbés par l’épithélium ou détectent les composés de stress libérés par les cellules épithéliales empoisonnées nécessite des recherches supplémentaires. Ceci est en contraste frappant avec ce qui se passe en réponse à la rupture de la barrière ou en présence d’espèces fongiques envahissantes: dans ce cas, les Mϕs entrent physiquement en contact avec des champignons et utilisent la Dectine-1 pour monter des réponses immunitaires anti-fongiques efficaces [7, 36]. Des résultats similaires ont été obtenus en utilisant trois toxines fongiques différentes: la gliotoxine, qui est produite à la fois par les pathobiontes et les commensaux, la Candidalysine, à partir du pathobionte Candida albicans, et la toxine T-2, à partir des commensaux de Fusarium sporotrichoioides. Dans tous les cas, le nombre de BLP a augmenté lors de l’inoculation de la toxine chez les souris dépourvues de champignons, indiquant que les BLP+ Mϕs reconnaissent les trois métabolites de champignons. Ce résultat suggère que les BLP ne répondent pas seulement aux composés fongiques produits par des espèces pathogènes, mais à une grande variété de métabolites fongiques. La réponse BLP peut donc être critique non seulement pour détecter les espèces de champignons potentiellement dangereuses, mais aussi pour détecter la sur-croissance des champignons commensaux, dont les métabolites pourraient compromettre la survie des cellules épithéliales si elles sont trop abondantes. En conséquence, nous avons constaté que les champignons commensaux sont en effet responsables de l’apoptose des cellules épithéliales chez les souris appauvries en Mϕs. La définition de la nature précise des champignons commensaux impliqués nécessitera des investigations supplémentaires. Un candidat intéressant est l’espèce commensale Fusarium sporotrichoioides, car elle est ciblée à la fois par le fluconazole et l’amphotéricine B et produire la toxine T-2. La question de savoir comment les Mϕ BLP+ résistent aux toxines reste une question ouverte; on pourrait envisager que les BLP maintiennent les toxines à l’écart du corps cellulaire de ces cellules. En conclusion, nous soulignons ici une fonction homéostatique jusqu’ici inconnue de Mϕ sous-épithéliale CD11chigh dans le côlon distal : ils aident l’épithélium à maintenir son intégrité dans un environnement soumis à des agressions physiques et chimiques élevées résultant de la pression osmotique, de la solidification des matières fécales et d’une charge microbienne importante. Comment les Mϕs BLP+ ordonnent aux cellules épithéliales d’absorber ou non les fluides dans l’homéostasie et si des altérations de ces mécanismes conduisent à des pathologies telles que les maladies inflammatoires de l’intestin et le cancer fera l’objet de futures études.
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêt à déclarer.




 CC-BY 4.0
CC-BY 4.0