1 Introduction
Les catalyseurs à base de zéolithes modifiées sont très utilisés dans l’industrie, notamment en pétrochimie, en raffinage et même dans le traitement des effluents gazeux et liquides pour l’environnement. Les zéolithes de types faujasites Y restent jusqu’à nos jours les plus importantes et les plus utilisées dans la catalyse des réactions chimiques. Elles permettent une valorisation du toluène en vue de l’obtention de produits tels le benzène et les xylènes qui sont très demandés [1–5]. Selon Tsai et al. [6], l’utilisation de faujasite Y est une option et l’influence de sa porosité impacte sur la sélectivité des produits.
Parmi les procédés industriels qui donnent une meilleure valorisation du toluène, on peut citer celui de dismutation. Cette réaction industrielle a été largement décrite par Haag [7]. On admet généralement que la dismutation, en présence de zéolithes, découle selon un mécanisme ionique. Celui-ci fait intervenir l’attaque d’un carbocation sur le cycle aromatique selon deux mécanismes possibles, par l’intermédiaire de type diphénylméthane ou par la scission du groupement méthyle [3,8].
L’activité catalytique serait due aux groupements hydroxyles superficiels (sites de Brönsted) [9–10] et dépendrait de la nature du cation échangé dans la zéolithe et de la température de la réaction [11]. En effet, il existerait une certaine proportionnalité entre l’activité catalytique et l’un des trois paramètres suivants : l’acidité protonique, la nature du cation échangé et la température d’activation.
La réaction de dismutation en phase gazeuse a lieu, généralement, entre des températures allant de 350 à 500 °C. Dans ce domaine, l’activité catalytique est optimale. Une température assez élevée favorise les réactions secondaires et entraîne une diminution progressive de l’activité catalytique par empoisonnement du catalyseur [12–14] par du coke. Elle s’accompagne souvent de réactions secondaires comme celles de dismutation des xylènes, de transalkylation toluène-triméthylbenzène ou toluène-xylènes, de déméthylation, de pyrolyse et de réactions de polycondensation. Le nombre de réactions impliquées est fonction de l’activité et la sélectivité des catalyseurs [15].
Le déroulement du processus de dismutation du toluène peut être influencé par plusieurs paramètres à savoir, la température, la pression, la vitesse spatiale et la nature du cation échangé. La nature du cation échangé a une influence considérable sur l’activité. Selon la littérature [16–18], l’activité catalytique de catalyseurs à base de zéolithes varie selon la nature de l’élément introduit comme suit :
Cations de terres rares > H+ > cations divalents > cations monovalents.
L’activité de chaque catalyseur serait, essentiellement, liée au caractère plus ou moins polarisant de chaque cation introduit. Plus le cation est petit et fortement chargé et plus il est polarisant et confère à la zéolithe une acidité de surface élevée. Le degré d’hydratation du cation introduit joue, également, un rôle important en ce qui concerne l’activité catalytique.
Dans ce sens, des catalyseurs à base de faujasite Y ont été échangés par des cations de Ce3+, La3+, UO22+, Co2+, Sr2+, Pb2+, Tl+ et NH4+. Ces catalyseurs ont été utilisés dans la réaction de dismutation du toluène afin d’étudier leurs performances catalytiques et sélectives pour la formation des xylènes et particulièrement l’isomère para. Plusieurs effets liés à l’activité catalytique et à la composition d’équilibre du mélange des xylène en fonction de la nature du cation échangé, de la température, du rapport B/X et B/(T + 2TMB) ont été étudiés.
2 Matériel et méthode
2.1 Préparation des échantillons et procédure d’échange en batch
L’échange cationique des faujasites Y étudiés a permis l’obtention des catalyseurs présentés dans le Tableau 1. Trois faujasites synthétiques NaY1, NaY2 et NaY3 de différents rapports Si/Al ont été utilisées. Ces zéolithes ont fait l’objet de caractérisation par différentes techniques dans des travaux antérieurs [16–17].
Conditions opératoires en batch d’obtention de catalyseurs à base de faujasites Y échangées à différents cations à partir de solutions aqueuses.
| Échantillons | Conditions opératoires d’échange d’ions | Rapports molaires | |||||
| Temps (h) | [cations] (mg/L) | Nombre d’échange | TE(%)(d) | AT(e) | Si/Al (initial) | Si/Al (final) | |
| NaY1(a) | – | – | – | − | 0,08 | 1,62 | – |
| NaNH4Y11 | 48 | 100 | 2 | 95 | 1,8 | 1,62 | 1,65 |
| NaLaY11 | 24 | 100 | 1 | 65 | 1,60 | 1,62 | 1,62 |
| NaLaY13 | 48 | 100 | 2 | 79 | 1,65 | 1,62 | 1,62 |
| NaPbY1 | 48 | 100 | 2 | 89 | 2,4 | 1,62 | 1,62 |
| NaTlY1 | 48 | 100 | 2 | 94 | 1,3 | 1,62 | 1,62 |
| NaCeY11 | 48 | 100 | 2 | 77 | 1,70 | 1,62 | 1,70 |
| NaCeY12 | 48 | 75 | 2 | 87 | 1,75 | 1,62 | 1,62 |
| NaCeY13 | 48 | 50 | 2 | 86 | 1,75 | 1,62 | 1,62 |
| NaSrY1 | 48 | 100 | 2 | 86 | 2,2 | 1,62 | – |
| NaCoY11 | 48 | 100 | 2 | 70 | 1,8 | 1,62 | 1,62 |
| NaUO2Y11 | 24 | 10 | 1 | 51 | 1,7 | 1,62 | 1,62 |
| NaUO2Y12 | 24 | 10 | 2 | 90 | 2,2 | 1,62 | 1,67 |
| NaUO2Y13 | 24 | 10 | 3 | 95 | 2,4 | 1,62 | 1,84 |
| NaY2(b) | – | – | – | − | 0,06 | 2,31 | – |
| NaUO2Y21 | 24 | 10 | 1 | 51 | 1,8 | 2,31 | 2,31 |
| NaY3(c) | – | – | – | − | 0,03 | 1,64 | – |
| NaUO2Y31 | 24 | 10 | 1 | 29 | 1,01 | 1,64 | 1,64 |
Les expériences d’échange cationique sur les échantillons de faujasites Y ont été effectuées en batch à l’aide de solutions aqueuses de Ce(NO3)36H2O, La(NO3)36H2O, UO2(NO3)26H2O, Pb(NO3)2, Sr(NO3)2, Tl(NO3) et NH4(NO3). Des solutions de 100 ml de différentes concentrations ont été mises en contact avec 250 mg de zéolithe. Chaque échange a été effectué à pH où le cation (Ce3+, La3+, UO22+, Co2+, Sr2+, Pb2+, Tl+ ou NH4+) se trouve en solution aqueuse en son état de valence. Tous les essais d’échange ont été réalisés à une température de 25 °C et sous agitation durant 24 à 48 heures à l’aide d’une secoueuse (350 tr min-1). L’opération d’échange d’ions a été répétée pour certains échantillons deux à trois fois. Les deux phases solide et liquide sont séparées par centrifugation et les filtrats obtenus sont analysés par spectrophotométrie UV/Visible par la méthode Arsenazo-III concernant les ions uranyles. Les filtrats des autres cations sont analysés par absorption atomique à l’aide d’un spectrophotomètre de type Carl Zeiss modèle FMD.
Le taux d’échange des différents cations a été déterminé à partir de l’équation suivante :
Taux d’échange (%) = (Ci – Ceq) 100 /Ci (1)
où Ci et Ct (mg L-1) sont les concentrations initiale des cations et au temps t.
L’acidité de surface des faujasites Y échangées a été mesurée par dosage en retour par l’acide chlorhydrique de solutions contenant ces échantillons et de la butylamine en excès. Cette acidité de surface est exprimée par mmole butylamine adsorbée par gramme.
En ce qui concerne les analyses thermogravimétriques, les mesures ont été effectuées sur un thermoanalyseur Setaram-Labsys entre 20 et 700 °C sous air d’argon, à partir d’une masse d’échantillon de l’ordre de 20 mg et avec une vitesse de montée en température de 15 °C par minute.
2.2 Réaction de dismutation du toluène
La réaction de dismutation du toluène a eu lieu en phase gazeuse, à pression atmosphérique et dans un réacteur tubulaire en verre pyrex. Le Tableau 2 regroupe les conditions opératoires de cette réaction. La quantité de 5 g de catalyseur a été imposée par les contraintes de l’installation utilisée afin d’éviter les phénomènes de diffusion. Le catalyseur est aussi calciné à 500 °C avant chaque réaction de dismutation du toluène. Les produits de la réaction ont été analysés par chromatographie en phase gazeuse à l’aide d’un appareil de type VARIAN 3300 muni d’un détecteur FID. Une colonne de 6 m à base de 5 % Bentone 34 et 5 % dodécylphthalate déposés sur du Chromosorb W-HP (80/100 mesh) a été utilisée.
Conditions opératoires de la réaction catalytique.
| Réacteur | À lit fixe |
| Catalyseur | 5 g |
| Granulométrie | 2 × 0,5 mm−2 |
| WHSV (h-1) | 1 |
| Température (°C) | 300–550 |
| Temps de réaction (min) | 90–130 |
| Gaz vecteur | Hélium N60 |
| Débit (ml h-1) | 120 |
| Réactifs | Toluène, C6H5–CH3 |
| Toluène/He | 0,005 |
3 Résultats et discussions
3.1 Effet de la nature du cation échangé sur la surface des catalyseurs
Les techniques de caractérisation et d’analyse ont permis de déterminer le taux d’échange des catalyseurs obtenus et de suivre l’évolution du rapport molaire Si/Al avant et après échange (Tableau 1). Les résultats montrent que les cations de Ce3+, La3+, UO22+, Co2+, Sr2+, Pb2+, Tl+ et NH4+ ont été fixés sur la surface de la faujasite Y. Le rapport molaire Si/Al des échantillons NaNH4Y11, NaCeY11, NaUO2Y12 et NaUO2Y13 a subi une légère augmentation de 0,03, 0,08, 0,05 et 0,22 respectivement. En effet, des traces d’aluminium ont été détectées dans les solutions résiduelles d’échange d’ions. Ce phénomène aussi, était observé dans les échantillons contenant du cobalt, bien que le taux d’échange d’ions ne soit tellement élevé (70 %). Cette élimination de l’aluminium dans les échantillons à base d’ions ammonium, cérium et uranyle peut être due aux pH acides des solutions d’échange de 3, 3,5 et 2 respectivement. Elle peut être aussi due à la valeur élevée du rayon ionique (1,71 Å) dans le cas des ions uranyle ou au nombre d’échange répété deux à trois fois pour ces échantillons.
Les investigations menées à l’aide d’analyses thermiques différentielles et thermogravimétriques ont montré que l’échange d’ions a quelque peu modifié les interactions entre l’eau adsorbée et la surface catalytique. D’abord, du point de vue quantitatif, la capacité d’adsorption de l’eau a augmenté dans tous les supports modifiés comme le montre le Tableau 3. Ce phénomène est d’autant plus visible que le taux d’échange d’ions est élevé. L’échantillon contenant des ions NH4+ a libéré la plus grande quantité d’eau adsorbée de 28,55 % à 600 °C. Par ailleurs, du point de vue, qualitatif, ces analyses font ressortir que la modification par échange d’ions modifie aussi les profils thermiques des échantillons étudiés. Ainsi, en plus du processus endothermique de désorption d’eau de la faujasite NaY1 non modifiée (aux environs de 80), tous les échantillons présentent aux moins un pic endothermique supplémentaire correspondant à l’élimination de l’eau d’hydratation de chaque ion introduit. Les premiers pics de déshydratation correspondent à de l’eau adsorbée physiquement et qui se libère assez aisément jusqu’à une température de 120 °C. Les sites de Brönsted commencent à se former à des températures supérieures à 120 jusqu’à 450 °C. Ces populations de centres sont supérieures aux précédentes et nécessitent plus d’énergie pour se former. A partir de 450 à 550 °C c’est la déshydroxylation progressive de la surface qui augmente la prépondérance des sites de Brönsted [19–24]. Généralement, cette déshydroxylation nécessite plus d’énergie mais libère moins d’eau. Cette eau appartient à la surface zéolithique et non au complexe formé par le cation hydraté et la surface [21,25].
Pics endothermiques à différentes températures (T°C) et perte de masse à 600 °C des catalyseurs à base de NaY1 échangée à différents cations.
| Catalyseurs | Pics endothermiques à différentes températures (T°C) et perte de masse à 600 °C | Taux d’échange (%) | ||||
| 1 | 2 | 3 | 4 | % masse | ||
| NaY1 | 80 | – | – | – | 17,50 | – |
| NaLaY13 | 90 | 130 | 225 | 550 | 26,70 | 79 |
| NaCeY12 | 90 | 130 | 220 | 520 | 27,19 | 87 |
| NaSrY11 | 90 | 120 | 275 | 550 | 26,74 | 85 |
| NaUO2Y11 | 125 | 210 | 275 | 550 | 23,04 | 51 |
| NaUO2Y12 | 130 | 210 | 275 | 550 | 25,66 | 90 |
| NaNH4Y11 | 90 | 125 | 300 | 510 | 28,55 | 95 |
Les échantillons contenant aussi l’uranium présentent une multitude de niveaux énergétiques de désorption d’eau ce qui montre, a priori, que tous les cations fixés se déshydratent progressivement dans l’ordre décroissant de leur taux d’échange. Cela signifie que les pics à 130 et 210 °C correspondent vraisemblablement à des niveaux énergétiques de libération d’eau de l’ion UO22+. Cette observation pourrait être argumentée, par le fait, que l’ion uranyle en solution présente dans le domaine de température 50–200 °C [26] trois étapes de changements de degré d’hydratation. Les ions uranyles sont adsorbés sous la forme hydratée UO2 (NO3)2.6H2O à des températures de 25 à 70 °C. Quand la température augmente de 100 à 130 °C, la première étape de changement de degré d’hydratation apparaît sous la forme UO2 (NO3)2.3H2O. Quant à la deuxième étape, elle apparaît sous la forme UO2 (NO3)2.2H2O à des températures de 210 °C et toujours à l’état adsorbé. La dernière étape peut avoir lieu aussi sous la forme de UO3 à partir de températures de 184 °C mais en solution.
L’imprégnation de chaque catalyseur avec de la butylamine pendant 24 heures, permet la neutralisation de l’acidité totale de toute la surface catalytique accessible. Le dosage ultérieur de la butylamine restante sert à déterminer indirectement cette acidité qui, comme le montre la Fig. 1, semble dépendre du taux d’échange des cations. L’acidité totale produite par l’ion uranyle dans les faujasites Y est comparable à celle due aux autres cations.
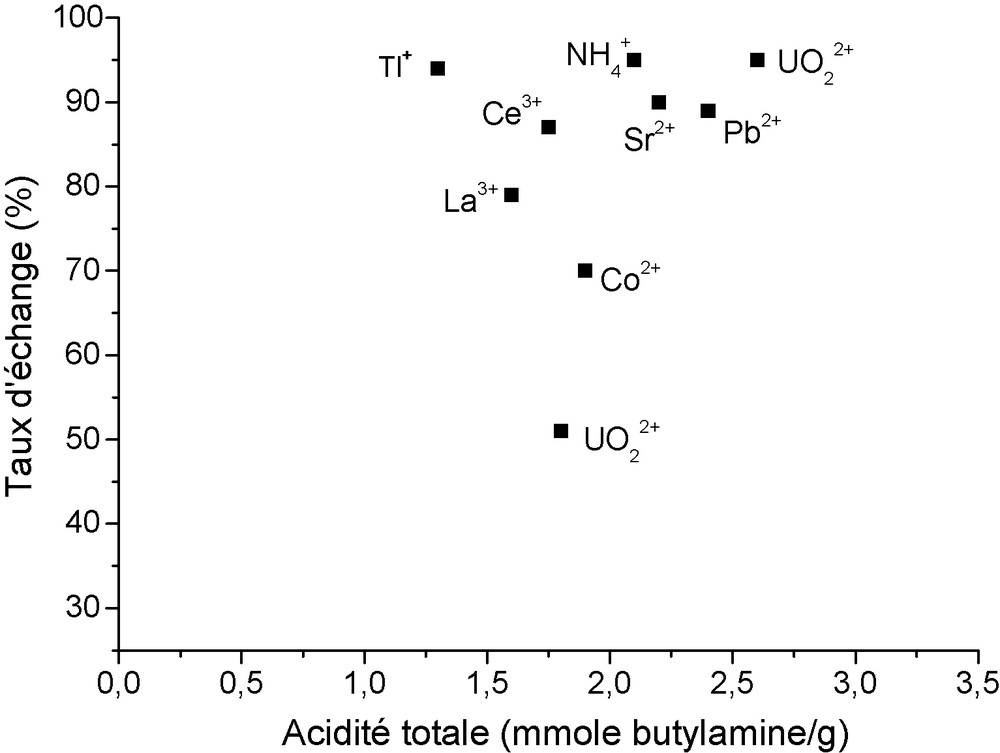
Influence du taux d’échange des cations sur l’acidité totale de surface des catalyseurs à base de faujasite NaY1.
3.2 Dismutation du toluène
Les performances catalytiques des échantillons de faujasites Y non échangés et échangés ont été étudiées dans la réaction de dismutation du toluène. Le Tableau 4 montre les faibles performances catalytiques des faujasites NaY1, NaY2 et NaY3 et le Tableau 5 regroupe celles des faujasites échangées par les cations de Ce3+, La3+, UO22+, Co2+, Sr2+, Pb2+, Tl+ et NH4+. Selon ces résultats, la conversion du toluène atteint des valeurs très appréciables de l’ordre de 49 à 60 % sauf dans le cas des échantillons NaTlY11 et NaUO2Y31. Effectivement pour ces échantillons, les valeurs de leurs acidités totales sont les plus faibles 1,3 et 1,01 par rapport aux autres (Tableau 1). La distribution des produits de la réaction est pratiquement du même ordre de grandeur dans tous les échantillons étudiés. Une distribution moyenne en benzène (27–30), toluène (40–43), xylènes (20–25), triméthylbenzènes (1–3,5) et coke (0,14–0,5 %) a été obtenue dans ces expériences.
Performances catalytiques des faujasites NaY1, NaY2 et NaY3 .
| T (%) | B | T | pX | mX | oX | TMB | % Coke | B/X | |
| NaY1 | 16,12 | 11,03 | 83,88 | 1,28 | 2,45 | 1,26 | – | 0,1 | 2,21 |
| NaY2 | 15,36 | 11,50 | 84,64 | 1,03 | 1,98 | 0,85 | – | 0,1 | 2,97 |
| NaY3 | 8,08 | 5,23 | 91,92 | 0,74 | 1,46 | 0,65 | – | 0,02 | 1,83 |
Influence de la nature des cations échangés sur les performances catalytiques des catalyseurs à base de faujasite Y.
| Cations | NH4+ | Tl+ | Pb2+ | Sr2+ | La3+ (a) | Ce3+ (b) | UO22+ (1) | UO22+ (2) | UO22+ (3) | UO22+ (4) | UO22+ (5) |
| Conversion T (%) | 57,53 | 21 | 58,48 | 53,87 | 55,48 | 52,84 | 49,9 | 60 | 58,72 | 55,56 | 10,26 |
| B | 32,45 | 11,48 | 37,24 | 30,60 | 32,39 | 27,69 | 30,76 | 32,88 | 31,13 | 28,86 | 3,71 |
| T | 42,47 | 79,00 | 41,52 | 46,13 | 44,52 | 47,16 | 50,10 | 40,00 | 41,28 | 44,44 | 89,74 |
| pX | 5,08 | 2,47 | 6,27 | 6,41 | 6,15 | 5,20 | 2,13 | 7,91 | 7,58 | 6,38 | 1,03 |
| mX | 11,32 | 4,45 | 9,20 | 10,22 | 10,40 | 10,37 | 11,3 | 13,03 | 8,47 | 10,42 | 1,4 |
| oX | 6,03 | 3,26 | 4,20 | 4,68 | 3,85 | 5,16 | 4,07 | 5,54 | 6,55 | 4,83 | 0,5 |
| TMB | 2,65 | – | 1,57 | 1,96 | 1,10 | 3,07 | 1,22 | 1,61 | 3,40 | 3,49 | – |
| % Coke | 0,51 | 0,5 | 0,5 | 0,52 | 0,19 | 0,14 | – | 0,21 | 0,4 | 0,3 | – |
| B/X | 1,45 | 1,13 | 1,89 | 1,44 | 1,59 | 1,34 | 2,09 | 1,24 | 1,38 | 1,72 | 1,26 |
| B/(X + 2TMB) | 1,17 | 1,13 | 1,63 | 1,20 | 1,43 | 1,03 | 1,72 | 1,11 | 1,06 | 1,21 | 1,26 |
Le rapport benzène/xylènes varie entre 1,13 et 2,09 alors que celui B/(X + 2TMB) varie entre1,03 et 1,72. La confrontation de ces deux résultats montre qu’une partie des xylènes est convertie essentiellement en trimétylbenzènes et en polyalkylbenzènes. Les échantillons à base d’ions uranyle présentent des performances catalytiques similaires à celles des autres catalyseurs. Les échantillons les plus sélectifs sont ceux qui ont les plus petits rapports B/X et B/(X + 2 TMB) comme dans le cas des échantillons à base de Tl+, NH4+, Cel3+, La3+et UO22+.
Selon la Fig. 2, la conversion du toluène des échantillons NaUO2Y12, NaUO2Y21, NaLaY13 et NaCeY12, varie dans le temps en fonction de la température. À 400 °C, la conversion est maximale pour les échantillons à base d’uranium au bout de 90 à 110 minutes. En revanche, la conversion du toluène est maximale à 450 et 500 °C et pendant 60 minutes dans le cas des échantillons à base de lanthane et de cérium respectivement. L’augmentation préalable de cette conversion est due à la saturation progressive de ces catalyseurs. Les sites les plus actifs favorisent beaucoup plus les réactions de cokéfaction et de pyrolyse que la réaction de dismutation du toluène qui nécessite des sites actifs moins acides [3,27]. Il s’ensuit un blocage progressif de tous les sites très acides qui se traduit par une diminution progressive de l’activité catalytique. Il ne reste donc que les sites actifs moins acides qui favorisent les réactions de déplacements et de réarrangements des groupes méthyles. Parmi ces réactions, on peut citer entre autres la dismutation du toluène en benzène et xylènes, l’isomérisation des xylènes et la dismutation des xylènes entre eux en toluène et triméthylbenzène.

Évolution dans le temps de l’activité catalytique des catalyseurs à différentes températures. (a) NaUO2Y12, (b) : NaUO2Y21, (c) NaLaY13 et (d) NaCeY12, WHSV = 1 h-1 et T/He = 0,005.
En comparant les conversions du toluène obtenues à 450 °C des échantillons de la Fig. 2 (a) et (b), il semble que celle de NaUO2Y12 est presque stable dans le temps et diminue rapidement à 500 °C. Pour les échantillons NaUO2Y12 et NaUO2Y21, les conversions maximales du toluène atteignent les valeurs de 8 et 30 % respectivement à 300 °C.
Par ailleurs, l’étude de l’évolution de la distribution des produits de réaction dans le temps et en fonction de la température a été réalisée pour les échantillons NaSrY11, NaCoY11, NaPbY11, NaTlY11, NaCeY12, NaLaY13, NaUO2Y12 et NaUO2Y21 comme le montrent les Fig. 3 et Fig. 4. La proportion du toluène décroît avec l’élévation de la température dans le domaine de températures étudiées. Cela s’explique par une augmentation de la conversion de celui-ci qui entraîne la production du benzène comme le montre la Fig. 4. dans le cas des catalyseurs NaCeY12, NaLaY13, NaUO2Y21 et NaUO2Y12. La proportion globale des xylènes diminue très légèrement alors que celle des trimétylbenzènes manifeste une croissance sensible. Ce qui se traduit par l’implication des xylènes dans la réaction de dismutation sauf dans le cas de l’échantillon à base de thallium où les trimétylbenzènes ne sont pas formés. Tous ces échantillons à l’exception de celui du thallium permettent l’obtention d’une proportion assez importante de xylènes pour des températures variant entre 400 et 450 °C de l’ordre de 20 à 25 %, ce qui consiste à un très bon rendement.

Variation dans le temps de la distribution des produits de la réaction. (a) NaSrY11, (b) NaCoY11, (c) NaPbY11 et (d) NaTlY11,WHSV = 1 h-1, T/He = 0,005 et T = 450 °C et 500 °C pour (c) et (d).

Variation de la distribution des produits de la réaction en fonction de la température des catalyseurs (a) NaCeY12, (b) NaLaY13, (c) NaUO2Y21 et (d) NaUO2Y12. WHSV = 1 h-1, T/He = 0,005 et t = 90 min.
La distribution des trois isomères du xylène varie aussi en fonction de la température. La Fig. 5 montre la variation de la composition d’équilibre des xylènes (o-, m- ou p-X/ X) en fonction de la température des catalyseurs NaTlY11, NaPbY11, NaCeY12 et NaUO2Y12. Dans le processus de dismutation du toluène, la formation de l’isomère para est légèrement favorisée par rapport à celle de l’ortho-xylène [28]. La fraction molaire de l’isomère méta-xylène diminue au profit des autres isomères. Cela se traduit par le fait que l’élévation de la température favorise les transformations de l’isomère méta en ortho et para-xylène. Le catalyseur à base de cérium donne une composition des fractions molaires des trois xylènes, pratiquement constante.

Variation de la composition d’équilibre des xylènes en fonction de la température des catalyseurs (a) NaTlY11, (b) NaPbY11, (c) NaCeY12 et (d) NaUO2Y12. t = 90 min, WHSV = 1 h-1 et T/He = 0,005.
L’étude de l’influence de la température a permis de mettre en évidence la conversion du toluène la plus élevée qui est de l’ordre de 60 % à une température variant entre 450 et 500 °C. La conversion du toluène augmente avec l’élévation de la température pour tous les échantillons (Fig. 6). Dans le cas des échantillons à base d’uranium, la conversion est importante dans le domaine 450 à 500 °C et elle est du même ordre de grandeur que celles des autres échantillons à base de Ce3+, La3+, Sr2+et Pb2+.
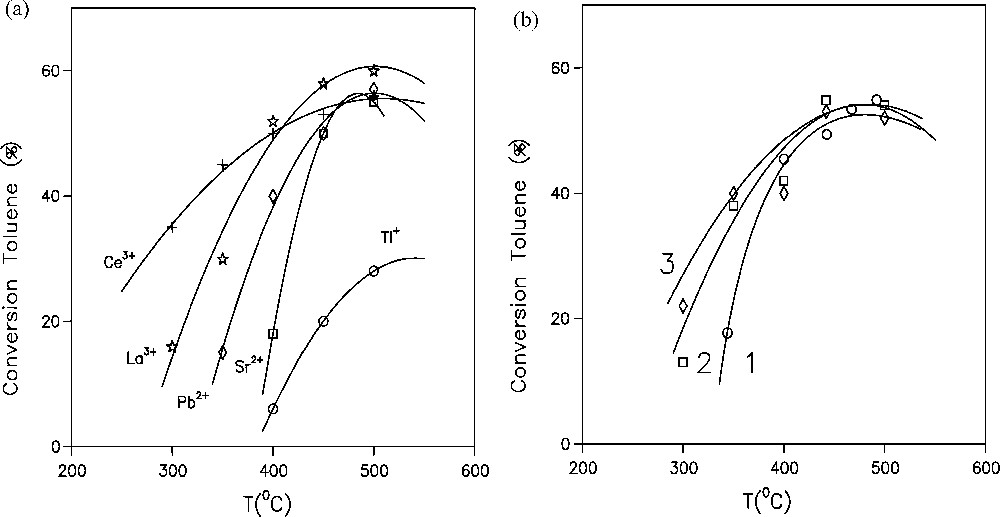
Variation de la conversion du toluène en fonction de la température des catalyseurs à base de (a) NaY1 échangée aux Ce3+, La3+, Pb2+, Sr2+ et Tl+ et (b) (1) : NaUO2Y13, (2) : NaUO2Y12, (3) : NaUO2Y21, t = 90 min, WHSV = 1 h-1 et T/He = 0,005.
La sélectivité d’un catalyseur vis-à-vis du processus de dismutation du toluène isomérisation de xylènes est présentée par le rapport benzène/xylènes (B/X). Ce dernier, met en évidence la contribution des réactions secondaires dans le processus globale. La Fig. 7 montre une diminution du rapport B/X dans le temps pour tous les échantillons utilisés. Ce rapport tend vers sa valeur minimale qui est égale à l’unité et qui correspond à une sélectivité maximale vis-à-vis de la réaction principale [29]. Il s’ensuit que la sélectivité augmente en fonction du temps. Cela peut s’interpréter, par le fait, que la sélectivité est inversement proportionnelle à la conversion du toluène. Or cette dernière diminue dans le temps à cause du blocage progressif par le coke des sites actifs très acides qui sont, eux, très peu sélectifs. Au bout de 90 à120 min, il ne reste que les sites très sélectifs pour la réaction de dismutation du toluène mais de plus faibles activités. Ce phénomène est observé pratiquement dans tous les échantillons étudiés.
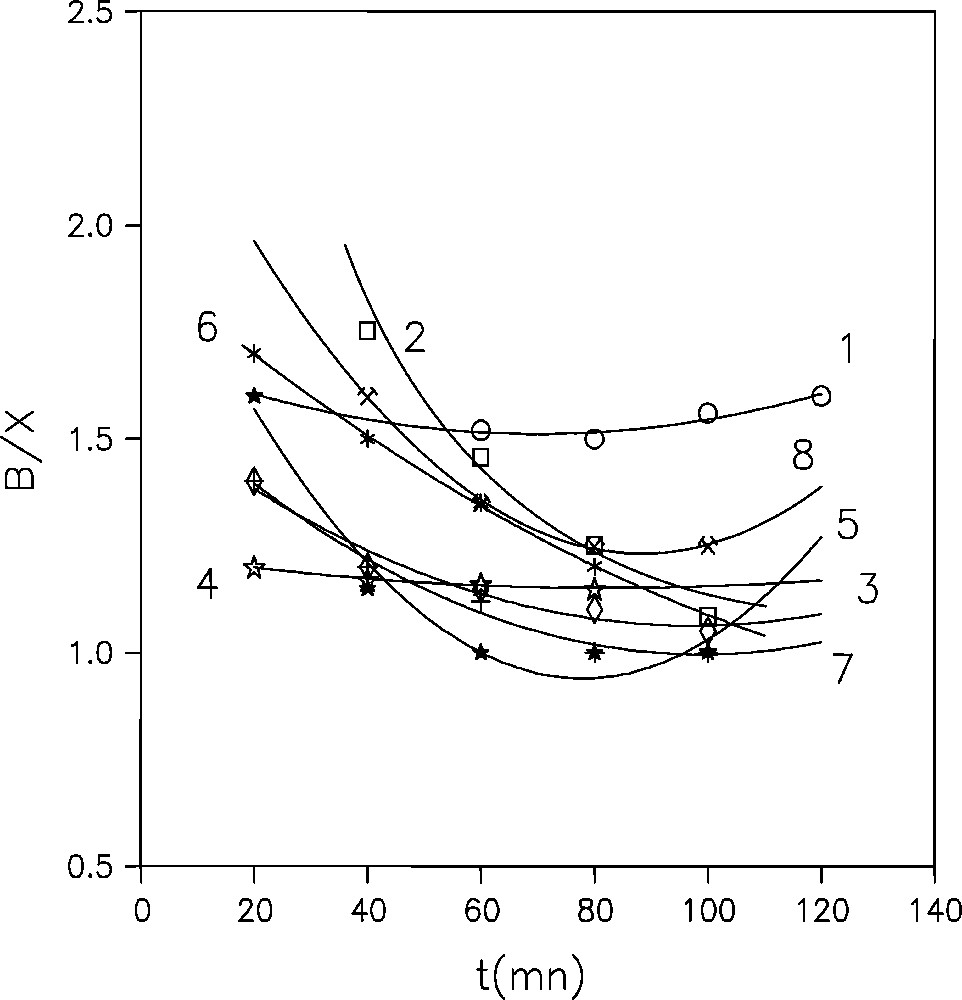
Évolution dans le temps du rapport B/X (T = 450 °C, WHSV = 1 h-1 et T/He = 0,005) des catalyseurs à base de (1) : NaNH4Y11, (2) : NaTlY11, (3) : NaPbY11, (4) : NaUO2Y12, (5) : NaUO2Y21, (6) : NaUO2Y13, (7) : NaLaY11, (8) : NaCeY12.
Le rapport B/X croît aussi avec l’élévation de la température comme le montre la Fig. 8. Il augmente de 1 jusqu’à 1,6 pour les échantillons à base d’ion uranyle, de cérium et de thallium et de 1,1 à 2,3 pour ceux à base de plomb et de lanthane. Ce phénomène est dû, au fait, que la température favorise autant la réaction de dismutation du toluène que les réactions secondaires [29]. Par conséquent, une augmentation de la conversion du toluène, comme le montrent la Fig. 9, entraîne une croissance du rapport B/X pour tous ces échantillons. Pour des températures inférieures à 360 °C, la conversion du toluène est inférieure à 40 % et le rapport molaire B/X tend vers l’unité. Cela est dû à l’absence des réactions secondaires d’où une sélectivité maximale, ce qui n’est pas le cas pour l’échantillon à base de thallium. Ainsi, les catalyseurs les plus sélectifs sont ceux à base d’uranium, de cérium et de lanthane, du fait, que le rapport molaire B/X ne dépasse pas la valeur de 1,5.
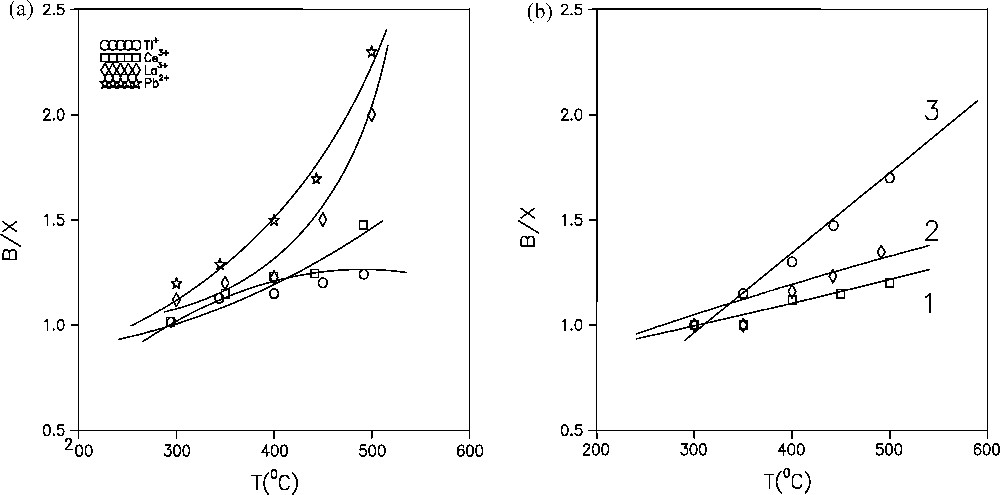
Variation du rapport B/X en fonction de la température des catalyseurs à base de (a) : NaY1 échangée aux Ce3+, La3+, Pb2+et Tl+ et (b) : (1) : NaUO2Y13, (2) : NaUO2Y12, (3) : NaUO2Y21. t = 90 min, WHSV = 1 h-1 et T/He = 0,005.

Évolution du rapport B/X en fonction de la conversion du toluène des catalyseurs à base de (a) : NaY1 échangée aux Ce3+, La3+, Pb2+et Sr2+ et (b) : (1) : NaUO2Y13, (2) : NaUO2Y12, (3) : NaUO2Y21. t = 90 min, WHSV = 1 h-1 , T/He = 0,005 et T = 450 °C.
Pour les températures supérieures ou égales à 450 °C, le phénomène de déshydroxylation des échantillons accroît le nombre de sites Lewis qui favorisent, par conséquent, les réactions de dissociation (déméthylation, craquage…). Cela favorise une augmentation du dépôt de coke sur la surface des catalyseurs ainsi que le rapport molaire B/X. Cela entraîne une diminution de la sélectivité vis-à-vis des réactions principales qui produisent le benzène et les xylènes.
Le rapport B/(X + 2TMB) représente une sélectivité vis-à-vis de la formation du benzène, xylènes et les trimétylbenzènes. La Fig. 10 montre une augmentation de ce rapport avec l’élévation de la température. La comparaison des échantillons les plus actifs, met en évidence la sélectivité de ceux à base de cérium et d’uranium, vu qu’ils présentent une valeur du rapport molaire B/(X + 2 TMB) proche de l’unité pour des températures variant entre 300 et 450 °C. La quantité de coke sur ces deux catalyseurs est, relativement, plus faible que celle déposée sur le catalyseur à base de lanthane.

Variation du rapport molaire B/(X + 2TMB) en fonction de la température des catalyseurs à base de NaY1 échangée aux Ce3+, La3+et UO22+. t = 90 min, WHSV = 1 h-1 et T/He = 0,005.
Dans le but de démontrer la dépendance entre l’acidité de surface et la conversion du toluène dans la réaction de dismutation, la même méthode de dosage de l’acidité totale a permis de montrer que son augmentation entraîne un accroissement de la conversion comme le montre la Fig. 11. Il en résulte que les cations échangés par les faujasites NaY1, NaY2 et NaY3 génèrent une acidité totale responsable de ces performances catalytiques des échantillons étudiés.
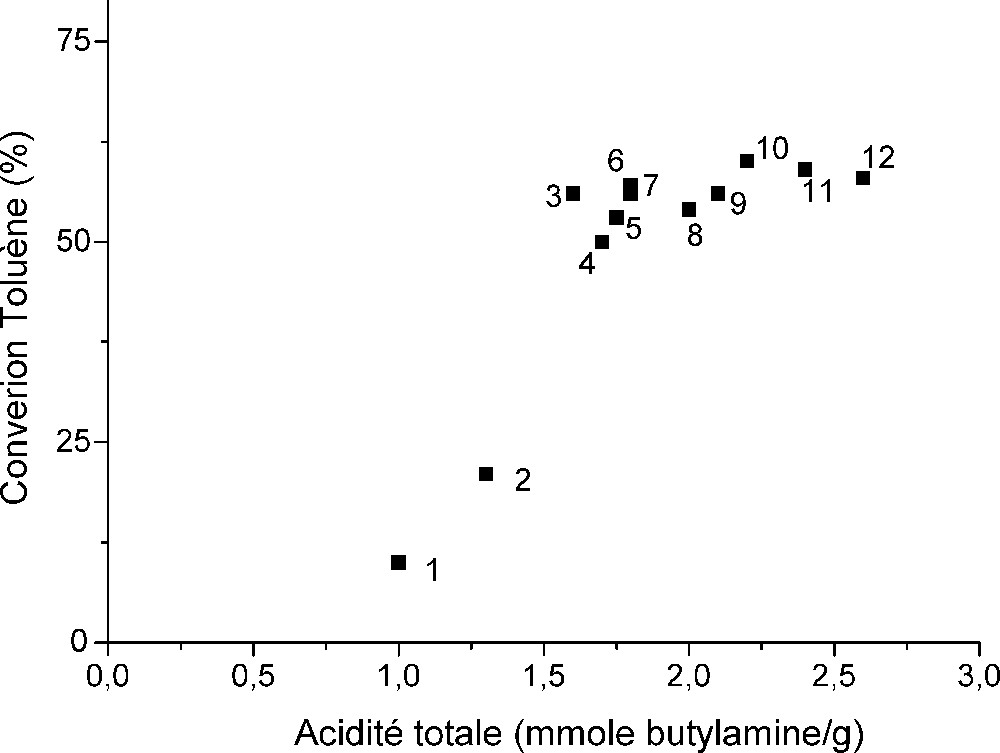
Dépendance entre l’acidité de surface et l’activité catalytique des catalyseurs. (1) : NaUO2Y61, (2) : NaTlY11, (3) : NaLaY13, (4) : NaUO2Y11, (5) : NaCeY12, (6) : NaCoY11, (7) : NaUO2Y21, (8) : NaSrY11, (9) : NaNH4Y11, (10) : NaUO2Y12, (11) NaPbY1 et (12) : NaUO2Y13, t = 90 min, WHSV = 1 h-1 , T/He = 0,005 et T = 450 °C.
4 Conclusion
Selon les résultats obtenus, une distribution moyenne typique des produits de la réaction de dismutation en benzène, toluène, xylène, triméthylbenzène et en coke a été obtenue. La proportion globale des xylènes diminue légèrement avec celle des trimétylbenzènes ce qui se traduit par l’implication des xylènes dans la réaction de dismutation. Les catalyseurs à base de cérium, lanthane et uranium manifestent des performances appréciables et permettent l’obtention de proportion assez importante en xylènes (25 % mol.) à des températures variant entre 400 et 450 °C, ce qui est considéré comme un très bon rendement.
L’acidité totale générée par l’ion uranyle est qualitativement et quantitativement identique à celle due aux autres cations. La comparaison des catalyseurs les plus actifs met en évidence la sélectivité de ceux à base de cérium et d’uranium vu qu’ils présentent une valeur du rapport molaire B/(X + 2 TMB) proche de l’unité à des températures variant entre 300 et 450 °C.


