1 Introduction
L’utilisation du chlore pour la désinfection de l’eau peut conduire, en présence de matières organiques, à la formation de sous-produits toxiques pour l’être humain, comme les trihalométhanes [1]. De nouvelles méthodes de désinfection, moins toxiques, comme l’ozonation, ont été récemment développées dans les pays industrialisés. Les technologies associées à ces méthodes sont relativement chères et difficiles à gérer pour des pays n’ayant pas les infrastructures nécessaires à leur mise en place. Dans ce contexte, la désinfection solaire pourrait être une alternative intéressante pour la potabilisation de l’eau dans les pays en voie de développement.
La désinfection de l’eau par le soleil est basée sur l’effet synergique entre la température de l’eau et la pénétration de la radiation UV-A (longueur d’onde : 320 – 400 nm). Comme l’intensité solaire de l’UV-A est sujette à des variations saisonnières et journalières, l’efficacité de cette méthode est mise en cause. Elle peut être améliorée par la production d’oxygène singulet, via la photodynamique avec un photosensibilisateur [2,3,4]. En effet, l’oxygène singulet endommage la plupart des biomolécules et entraîne ainsi la mort cellulaire et tissulaire.
Plusieurs auteurs signalent que les réactions des espèces réactives de l’oxygène (stress oxydatif) interviennent également dans le mode d’action de certaines drogues et médicaments [5,6]. Certaines plantes, notamment celles utilisées dans la pharmacopée traditionnelle pour soigner les infections microbiennes et parasitaires, contiennent des chromophores capables de générer l’oxygène singulet en présence de lumière [2,7].
Lors de l’étude de désinfection de l’eau par photosensibilisation avec les extraits de feuilles de plantes, Taba et al. [7] ont montré que les extraits aqueux de plantes de Cassia alata, Cassia occidentalis et Carica papaya avaient un effet photosensibilisateur. Cette observation a été confirmée quelques années plus tard par Sunda et al. [2], lors de l’étude de la désinfection de l’eau par photosensibilisation avec les extraits de ces trois mêmes plantes, auxquels sont venus s’ajouter les extraits de feuilles de Phyllantus niruri et Coleus Kilimandschari. L’activité photosensibilisatrice trouvée dans ces extraits est due à la présence des molécules photoactives capables de générer l’oxygène singulet [2,7]. Malheureusement, l’activité photosensibilisatrice remarquée dans ces plantes n’est accrue que lorsque le milieu est saturé en oxygène (barbotage).
D’autres plantes appartenant cette fois à la famille des Rutacées (Citrus bergamia, Citrus reticulata et Citrus limonum) ont été testées par Sunda et al. [8], qui ont remarqué que les huiles essentielles extraites de ces plantes étaient photosensibilisatrices. L’huile essentielle de Citrus bergamia inhibait les coliformes fécaux présents dans le milieu après une heure d’ensoleillement, tandis que les huiles essentielles de Citrus limonum et Citrus reticulata les inhibaient après deux heures d’ensoleillement. Cependant, lors de cette étude, plusieurs points n’ont pas été abordés, notamment la sensibilité des bactéries Gram+ vis-à-vis de ces huiles, le comportement des microorganismes après la désinfection de l’eau.
Dans le présent travail, nous poursuivrons l’étude de la désinfection de l’eau par photosensibilisation avec l’huile essentielle de Citrus bergamia. Les paramètres suivants ont été examinés :
- • la photoréactivité de l’huile essentielle de Citrus bergamia ;
- • la sensibilité des coliformes fécaux et entérocoques fécaux vis-à-vis de cette huile ;
- • le comportement des coliformes fécaux et entérocoques fécaux après la désinfection de l’eau
2 Matériel et méthodes
2.1 L’eau polluée
L’eau polluée provenait de la rivière Semois, en Belgique. Cette eau contenait 25.103 UFC coliformes fécaux/100 ml et 20.103 UFC entérocoques fécaux/100 ml.
2.2 Extraction de l’huile essentielle de Citrus bergamia
L’huile essentielle de Citrus bergamia a été extraite des zestes par la distillation par entrainement à la vapeur.
2.3 Analyse spectrométrique de l’huile essentielle de Citrus bergamia
L’analyse de l’huile essentielle de Citrus bergamia a été réalisée par spectrométrie de masse (SM) selon la méthode APCI+ (Atmospheric Pressure Chemical Ionisation, Positive mode) [9].
2.4 Préparation des échantillons d’eau avec l’huile essentielle
Les boites en verre Pyrex de 100 ml ont été utilisées comme réacteurs. La concentration de 0.05 ml/50 ml d’eau (1 ml d’huile essentielle/litre d’eau) d’huile essentielle de Citrus bergamia a été utilisée pour les expériences. Un lot constitué d’échantillons d’eau traités et un autre lot constitué d’échantillons non traités (blancs) ont été exposés à la lumière (lampe UV, marque B-100 AP, émettant entre 320–400 nm, avec un maximum à 365 nm). Cette lampe a été utilisée pour éviter les fluctuations de l’intensité lumineuse des rayons solaires. En outre, cette zone est contenue dans le spectre solaire qui touche la surface de la terre. La lampe a été positionnée à 25 cm des échantillons d’eau. Un autre lot constitué d’échantillons d’eau traitée avec l’huile essentielle de Citrus bergamia a été gardé à l’obscurité. À 0, 10, 20, 30, 60 et 120 minutes, des prélèvements ont été effectués dans chaque lot pour la mise en culture. Ces expériences ont été dupliquées trois fois. Les différents points repris dans chaque figure représentent la moyenne de trois mesures. Pour chaque série de données, l’erreur standard a été calculée (moyenne ± SD).
2.5 Analyses bactériologiques
Les analyses bactériologiques ont été réalisées par mise en culture sur milieux gélosé Rapid’E Coli et Bile esculine, respectivement pour les coliformes fécaux et entérocoques fécaux. Après la mise en culture, on incube à 44,5°C pendant 24 heures. Après incubation, les colonies sont dénombrées les unes après les autres.
3 Résultats et discussion
3.1 Sensibilité des coliformes fécaux (Gram -) vis-à-vis de l’huile essentielle de Citrus bergamia
3.1.1 Photosensibilisation
Les échantillons d’eau traités avec l’huile essentielle de Citrus bergamia ont été exposés à la lumière pendant deux heures, puis gardés à l’obscurité pendant 24 heures. Les résultats de cette étude sont repris dans la Fig. 1.

Abattement des coliformes fécaux en fonction du temps dans l’eau traitée avec 1 ml d’huile de Citrus bergamia/litre d’eau.
L’eau traitée avec l’huile essentielle de Citrus bergamia et exposée à la lumière montre des abattements importants de 4 unités logarithmiques (inhibition complète) après 60 minutes. Aucune inhibition significative n’est notée après 60 minutes pour l’eau non traitée et exposée à la lumière (témoin) ou pour l’eau traitée mais gardée à l’obscurité. (voir Fig. 1). L’action conjuguée de l’huile essentielle et de la lumière induit une photoréaction qui conduit à l’inhibition des coliformes fécaux. Cette photoréactivité est essentiellement due à la présence des molécules photoactivables, notamment le méthoxy-5 psoralène (voir Fig. 2, pic : 217). Cette molécule est de plus en plus utilisée pour soigner certaines maladies de la peau, notamment le psoriasis et le vitiligo. Elle est aussi utilisée, à cause de sa photoréactivité, en photothérapie PUVA (psoralène-UVA thérapie). Le traitement consiste à administrer par voie orale un médicament à base de méthoxy-5 psoralène et à exposer par la suite le patient à la lumière solaire ou ultraviolette. Le méthoxy-5 psoralène est capable de réagir avec l’ADN de la cellule bactérienne, avec lequel il forme un complexe à l’obscurité. Ce complexe n’a pas d’effet biologique significatif sur l’ADN. Mais, en présence des UVA, il se développe une réaction de photoaddition conduisant à la formation des liaisons covalentes entre le méthoxy-5 psoralène et les bases azotées, notamment la pyrimidine. Ceci aboutit à l’inhibition de la duplication de l’ADN et la transcription de l’ARN [10,11]. Ces perturbations entraînent par la suite la mort de la cellule bactérienne. Cette réaction, appelée photoréaction du type I, est favorisée dans les milieux anoxiques. En revanche, en présence d’oxygène, le méthoxy-5 psoralène conduit à une photoréaction du type II. Celle-ci consiste en un transfert de l’énergie emmagasinée par le méthoxy-5 psoralène à l’oxygène. Ce dernier subit une excitation et passe de l’état fondamental, triplet, à l’état excité, singulet. L’oxygène singulet généré dans le milieu inhibe les cellules bactériennes [12].
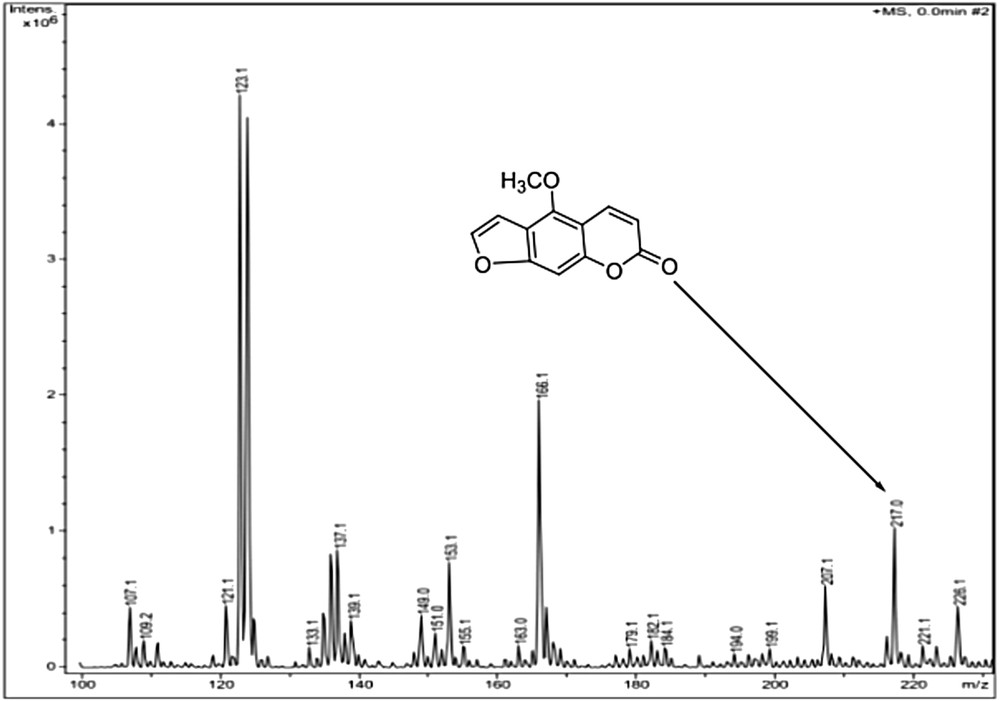
Spectre de masse de l’huile essentielle de Citrus bergamia (LC/MS) montrant la présence de méthoxy-5 psoralène
3.1.2 Post-photosensibilisation
Pour vérifier si, dès l’arrêt du processus, il n’y a pas de réactivation possible des coliformes fécaux, les échantillons d’eau traités avec l’huile de Citrus bergamia et exposés à la lumière pendant deux heures, puis gardés à l’obscurité pendant 24 heures, ont été analysés. Les résultats de ces analyses sont indiqués sur la Fig. 1.
Aucune réapparition des coliformes fécaux n’a été remarquée après la phase de photosensibilisation. Ceci laisse supposer que l’action conjuguée de lumière et de l’huile essentielle de Citrus bergamia conduit à une activité bactéricide (inhibition définitive).
3.2 Sensibilité des Entérocoques fécaux (Gram +) vis-à-vis de l’huile essentielle de Citrus bergamia
Quelques tests de désinfection de l’eau par photosensibilisation ont été réalisés en utilisant les entérocoques fécaux comme indicateurs de contamination. Les résultats sont reportés sur la Fig. 3.

Abattement des entérocoques fécaux en fonction du temps dans l’eau traitée avec 1 ml d’huile de Citrus bergamia/litre d’eau.
Une faible inhibition des entérocoques fécaux est notée du début à la fin des expériences dans l’eau non traitée et exposée à la lumière. L’eau traitée et gardée à l’obscurité ne montre aucune inhibition. Pour ce qui est de l’eau traitée et exposée à la lumière, l’inhibition d’entérocoques fécaux est complète après 30 minutes d’exposition. Sous la lumière, l’huile essentielle de Citrus bergamia induit une photoréaction qui conduit à l’inhibition des entérocoques fécaux (voir Fig. 3).
Ces résultats montrent que les entérocoques fécaux (Gram+) sont plus sensibles à la désinfection par photosensibilisation que les coliformes fécaux (Gram-). Cela pourrait s'expliquer par des différences au niveau de la constitution de leurs membranes cellulaires. En effet, la membrane cellulaire des bactéries Gram- présente une couche de lipopolysaccharides qui joue le rôle de barrière contre l’oxygène singulet. De plus, cette couche est constituée d’acides gras insaturés et de protéines, qui constituent à leur tour un piège pour l’oxygène singulet. La membrane des bactéries Gram+, dépourvue de cette couche, est facilement détruite par l’oxygène singulet. Après la destruction de la membrane, l’oxygène singulet pénètre dans la cellule et attaque les constituants cellulaires. Cela conduit à la mort cellulaire. Bien que résistante, la membrane cellulaire des bactéries Gram- finit toujours par être détruite par l’oxygène singulet. Il s’ensuit une mort certaine de la cellule bactérienne.
Les résultats de ce travail sont en accord avec ceux mentionnés par plusieurs auteurs. En effet, lors de l’étude de l’activité photodynamique du colorant curcumin vis-à-vis des bactéries Gram- et Gram+, Dahl et al. [13] ont remarqué que les bactéries (Gram+) étaient moins résistantes par rapport aux bactéries Gram-. Étudiant le pouvoir oxydant de l’oxygène singulet vis-à-vis des bactéries Gram- et Gram+, Dahl et al. [14] ont constaté que les bactéries Gram- sont plus résistantes que les bactéries Gram+.
4 Conclusion
Nos résultats montrent que l’huile essentielle de Citrus bergamia est photosensibilisatrice. Cette activité est liée à la présence des molécules photoactivables présentes dans celle-ci, notamment le méthoxy-5 psoralène. Nous avons défini les conditions d’inhibition totale des entérocoques fécaux et partielle des coliformes fécaux, qui in fine sont tous détruits, malgré leurs particularités membranaires.
D’autres études, allant dans le même sens que celles décrites sont nécessaires, pour connaître la sensibilité des virus et parasites vis-à-vis de l’huile essentielle de Citrus bergamia et leur comportement après la phase de photosensibilisation. L’étude de l’activité photosensibilisatrice de la forme libre et fixée sur un support solide (polymère ou verre) du méthoxy-5 psoralène est également programmée.


