1 Introduction
Lˈherbivorie nˈest pas une composante stable des lˈécosystèmes, comme le suggèrerait une lecture statique des réseaux trophiques, mais elle varie de façon spatiale et temporelle [1]. Ces variations ont souvent été étudiées le long de gradients complexes de lˈenvironnement, cˈest-à-dire de gradients le long desquels de nombreux facteurs directs (qualité et quantité de ressource végétale pour lˈherbivore, teneur du sol en azote, température de lˈair, etc.) varient de façon concomitante. Ce sont en général des gradients naturels qui intègrent différentes communautés végétales se succédant sur le terrain. Lˈapproche par gradients complexes apporte une meilleure connaissance des variations dˈherbivorie qui se produisent dans le milieu naturel, mais le grand nombre de facteurs impliqués dans ces gradients ne permet pas dˈavoir une approche déterministe fine de lˈherbivorie. Les gradients complexes les plus étudiés sont les gradients de succession végétale [2–4], de fertilité des sols [5,6] ou la conjonction des deux [7–9]. Ils sont assimilables aux gradients de biomasse végétale étudiés par Oksanen et al. [10], Belsky [11] et Bonser et Reader [12]. Dˈautres gradients complexes tels que des gradients de stress végétal [13,14], de microstructures de végétation [14] ou de topographie [15] ont également servi de base à des études de variations dˈherbivorie.
Des conclusions parfois contradictoires émergent de ces études. Rand [14] trouve une intensité dˈherbivorie maximale à faible niveau de biomasse végétale alors que Bonser et Reader [12] ainsi que Fraser et Grime [9] montrent lˈinverse. Par ailleurs, Oksanen et al. [10] ont proposé un modèle selon lequel lˈintensité dˈherbivorie est maximale à un niveau intermédiaire de biomasse végétale. Ce modèle est basé sur les réseaux trophiques, et plus particulièrement sur le contrôle ascendant ou descendant des populations dˈherbivores [16,17]. Le contrôle ascendant des populations dˈherbivores a lieu lorsque la ressource primaire, cˈest-à-dire la biomasse végétale, est trop limitée pour entretenir une population suffisante dˈherbivores. Le contrôle descendant des populations dˈherbivores intervient lorsque la quantité dˈherbivores est suffisante pour entretenir une population de prédateurs susceptible de réguler, en rétro-action, le nombre dˈherbivores. Par extension, le modèle dˈOksanen et al. [10] prédit une baisse dˈherbivorie dans les faibles niveaux de biomasse due à un manque de ressource végétale, et une baisse dˈherbivorie dans les forts niveaux de biomasse due à une forte pression de prédation sur les herbivores.
Dˈautres études se sont focalisées sur lˈinfluence de facteurs directs, tels que la concentration en CO2 atmosphérique [18,19] ou la quantité de nutriments du sol [20,21], sur lˈherbivorie. Ces approches expérimentales permettent une meilleure compréhension des mécanismes déterminant lˈherbivorie, mais la prédiction des variations dˈherbivorie dans les milieux naturels nécessite de relativiser lˈimportance de ces facteurs directs dans le fonctionnement de lˈécosystème. Une troisième approche, qui à notre connaissance a été peu ou pas explorée, consisterait à scinder des gradients complexes en une gamme étendue de facteurs directs abiotiques et biotiques et de les corréler aux variations dˈherbivorie observées dans le milieu naturel.
Lors dˈune expérimentation en pelouse calcicole [22], trois traitements expérimentaux simulant le fonctionnement de lˈécosystème ont été appliqués (lˈombrage, la sécheresse et la fauche) et ont induit un gradient complexe de biomasse. Ces milieux de pelouses sèches collinéennes sont inféodés à de fortes pressions dˈherbivorie de la part du bétail, de rongeurs, de mollusques ou dˈinsectes [18,19,23–25]. Les populations dˈOrthoptères, notamment, sont bien représentées [26] et sont susceptibles dˈinfliger des pertes importantes à la végétation [27]. A partir de ce système modèle, lˈobjectif est alors de 1) évaluer la pression dˈherbivorie exercée par la guilde des Orthoptères phytophages sur les espèces dominantes de la pelouse calcicole, 2) de mesurer les variations dˈherbivorie de ce groupe d’espèces en fonction de lˈombrage, de la sécheresse, de la fauche, 3) de caractériser ces variations d’herbivorie le long d’un gradient de biomasse végétale, et 4) de relier nos résultats avec les principales hypothèses de régulation de l’herbivorie.
2 Matériel et méthodes
2.1 Site dˈétude et espèces dominantes
La pelouse étudiée, Liche Petet (45°10’ N, 5°50’ E, 700 m dˈaltitude), se situe à 15 km à lˈest de Grenoble, sur les balcons de Belledonne (chaîne montagneuse des Alpes externes du nord françaises). Les précipitation annuelles à Grenoble (210 m dˈaltitude) sont importantes (1000 mm environ) et réparties régulièrement tout au long de lˈannée. La température annuelle moyenne y est de 10,9 °C [28]. La pelouse se rattache au Mesobromion [29] : elle est caractérisée par la dominance de deux Poacées pérennes, Bromus erectus et Brachypodium pinnatum (respectivement 55% et 15% de la densité végétale totale), et par la présence d’espèces telles que Plantago media, Salvia pratensis (Tableau 1). Le Brome érigé présente des feuilles plus appétentes pour le bétail que celles du Brachypode penné [25,30]. La dynamique du Mesobromion est guidée par trois processus principaux [31] : la colonisation par les ligneux (ici : Rosa sp., Juniperus communis, Pinus silvestris, Fraxinus excelsior), la sécheresse (due ici à une exposition sud-sud-ouest, une pente assez importante et un sol drainant contenant 38% de sable) et le pâturage extensif par les ovins (depuis 15 à 50 ans).
Composition floristique et pourcentage de recouvrement des principales espèces du site d’étude en l’absence de traitements expérimentaux (relevé linéaire 100 points)
| Espèces dominantes : | Bromus erectus Huds | 54,3% |
| Brachypodium pinnatum (L.) P. Beauv. | 14,5% | |
| Espèces fréquentes : | Carex flacca Schreb. | 7,3% |
| Origanum vulgare L. | 4,2% | |
| Medicago sativa L. | 3,6% | |
| Carex caryophyllea Latour. | 3,4% | |
| Espèces peu fréquentes : | Potentilla tabernaemontani Asch. | 2,3% |
| Dactylis glomerata L. | 1,8% | |
| Teucrium chamaedrys L. | 1,3% | |
| Thymus serpillum L. | 1,3% | |
| Espèces rares : | Clinopodium vulgare L. | 0,8% |
| Daucus carota L. | 0,8% | |
| Linum catharticum L. | 0,8% | |
| Lotus corniculatus L. | 0,8% | |
| Plantago media L. | 0,8% | |
| Festuca gr. ovina L. | 0,5% | |
| Arrhenatherum elatius (L.) P. Beauv. | 0,3% | |
| Hippocrepis comosa L. | 0,3% | |
| Poa pratensis L. | 0,3% | |
| Salvia pratensis L. | 0,3% | |
| Sanguisorba minor Scop. | 0,3% | |
| Verbena officinalis L. | 0,3% |
La caractérisation du peuplement d’Orthoptères phytophages de la pelouse (Acrididae, Tettigoniidae) a été réalisée lors de 9 journées de prélèvement en août 1999 au filet fauchoir sur six placettes de 1 m2 situées aléatoirement dans les lots de notre dispositif expérimental. En l’absence de traitements expérimentaux, le peuplement est fortement dominé par Euchorthippus declivus (50% des imago) et Chorthippus biguttulus (33% des imago). Chorthippus brunneus est plus rare (10% des imago) tandis que Metrioptera bicolor, Omocestus haemorrhoidalis, O. ventralis sont occasionnels (2,5% des imago pour chaque espèce). À Liche Petet, les dégâts dˈherbivorie sur le Brome et le Brachypode sont attribués essentiellement aux Orthoptères : ceux-ci constituent la population d’insectes phytophages dominante et les seules observations directes d’herbivorie sur les espèces cibles qui ont pu être faites ont concerné des Orthoptères (observations personnelles). De plus, les dégâts d’herbivorie sur le Brome et le Brachypode sont significativement corrélés à la densité d’Orthoptères dans les différentes lots expérimentaux (r = 0,92, P = 0,001 pour le Brome et r = 0,68, P = 0,031 pour le Brachypode ; test de corrélation de Pearson, n = 8). Contrairement à des études menées en Suisse ou en Angleterre sur des milieux similaires [18,19], aucun Gastéropode nˈa été détecté.
2.2 Dispositif expérimental
Au milieu de la pelouse, un enclos de 30 × 30 m a été mis en place, à lˈintérieur duquel huit lots de 32 m2 ont été délimités. Trois types de traitements expérimentaux, étroitement liés au fonctionnement de la pelouse, ont été combinés et appliqués pendant 2 saisons de végétation (1998 et 1999) sur les lots : lˈombrage simulant lˈembroussaillement, la sécheresse simulant les aléas climatiques, et la fauche simulant la gestion. La disposition des traitements au sein des lots a été étudiée afin dˈéviter toute interférence entre les traitements (Fig. 1). Lˈombrage a été réalisé du côté de la chaîne de Belledonne (à lˈest) qui capte la lumière rasante du matin et évite ainsi de projeter lˈombrage expérimental sur des lots voisins ne devant pas être ombrés. La sécheresse a été réalisée sur les lots les plus bas afin de ne pas affecter lˈhydrologie des lots non asséchés.
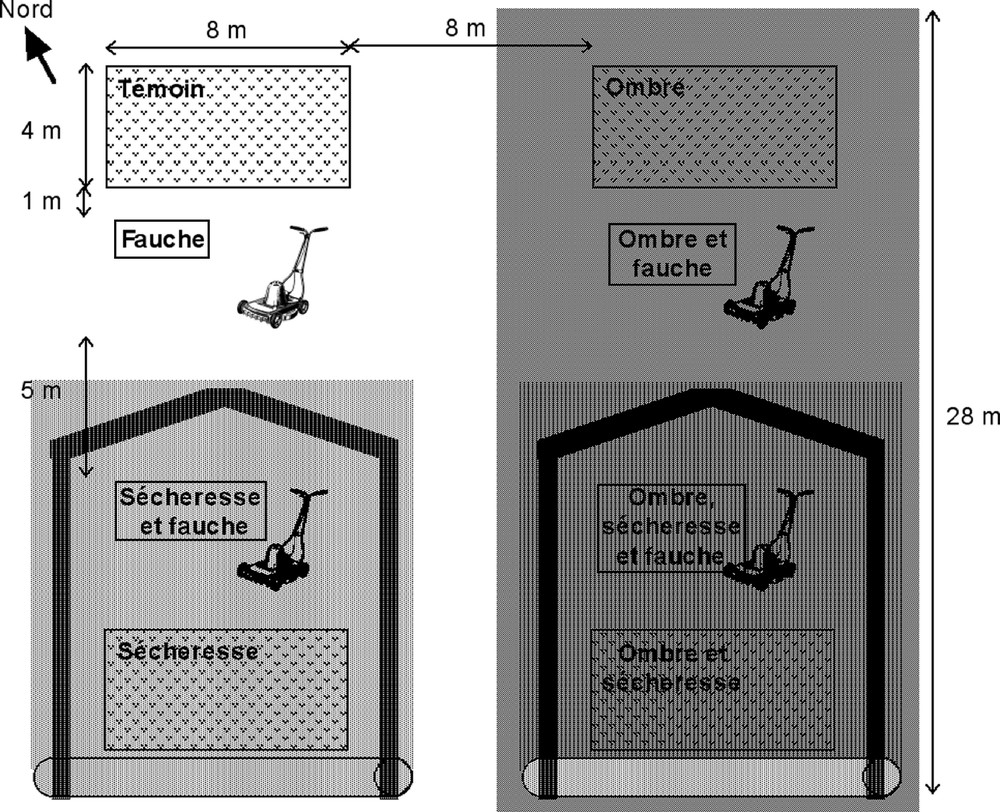
Schéma du dispositif expérimental.
Un filet dˈombrage dˈenviron 350 m2 a été installé à 1,70 m du sol, de fin avril à fin octobre 1998 et 1999, pour simuler une canopée décidue. Les mailles du filet captaient 50% de rayonnement lumineux et permettaient le passage de lˈeau de pluie. Le filet était interrompu à 50 cm au dessus du sol pour permettre la circulation dˈair et dˈanimaux de petite taille (dont les Orthoptères) entre lˈextérieur et lˈintérieur de lˈombrage. La sécheresse a été créée en déployant au dessus de la végétation une bâche plastique transparente de 15 × 13 m avant chaque averse. La bâche était repliée après lˈaverse pour éviter les effets dˈéchauffement avec le soleil. La sécheresse expérimentale a été appliquée de fin avril à fin juin 1998, et de début mai à fin septembre 1999. Des tranchées de 1 m de profondeur ont été creusées en amont des lots asséchés afin dˈintercepter les eaux de ruissellement (Fig. 1). Lˈétroitesse des tranchées (50 cm) permettait le passage des Orthoptères. Enfin, la fauche a été réalisée fin avril 1998 et mi-juillet 1999, réduisant la longueur de lˈappareil végétatif aérien des plantes cibles à environ 5 cm.
2.3 Paramètres environnementaux
Les effets des traitements expérimentaux sur les composantes abiotiques (microclimat, sol) et biotiques (végétation) de lˈenvironnement ont été mesurés pour chaque lot expérimental.
Au milieu de chaque lot, la température de lˈair, du sol, et lˈhumidité atmosphérique ont été mesurées heure par heure grâce à une station de mesure (Hydroemac, Seyssinet-Pariset, Isère, France) de mai à août 1999. Le capteur aérien a été placé à 30 cm au dessus du sol alors que le capteur thermique souterrain a été enterré à 10 cm de profondeur. Les données climatiques ont été moyennées sur toute la période de mesure au pas de temps horaire, et seuls les maxima ont été retenus pour les analyses (16 h pour lˈhumidité et la température de lˈair, 19 h pour la température du sol). Lˈhumidité de lˈair a été transformée en déficit de vapeur saturante [32]. Les teneurs en eau et en azote disponible (NO3– et NH4+) ont été quantifiées en juin 1999 à partir de 3 échantillons de 250 g de terre prélevés à 10–15 cm de profondeur [22]. Les moyennes dˈhumidité de sol et dˈazote total disponible ont été calculées à partir des trois échantillons prélevés.
Les densités de végétation ont été déterminées à lˈaide de relevés linéaires positionnés diagonalement au sein de chaque lot. Tous les 10 cm, le long de 88 à 93 points dˈéchantillonnage, le nombre de contacts avec les parties vivantes des différentes espèces végétales a été relevé. La densité de végétation a été calculée comme le nombre de contacts ramené à 100 points dˈéchantillonnage.
2.4 Biométries
Les mesures dˈintensité dˈherbivorie ont été effectuées sur des plantes en place au sein de chaque lot expérimental. 12 individus de chaque espèce par lot ont été suivis.
Les Orthoptères consomment le bord des limbes [33] et y laissent des impacts plus ou moins ovales ou allongés. Les traces les plus profondes peuvent dépasser la nervure centrale du limbe dˈune graminée, et les plus longues peuvent excéder 1 cm de longueur sur le bord du limbe. Les impacts dˈherbivorie sur les feuilles ont été mesurés lˈété 1999, avant et après la fauche expérimentale (respectivement début juillet et mi-août). Pour quantifier ces impacts variés, nous avons mis au point une échelle relative dˈherbivorie, graduée de 0 à 5 en fonction des conséquences prévisibles sur les plantes (Tableau 2). Quand les impacts dˈherbivorie sur une feuille sont suffisamment nombreux et quand le limbe est entaillé suffisamment profondément ou sur une longueur suffisante, les feuilles deviennent fragiles et peuvent se casser.
Echelle relative utilisée pour quantifier les dégâts causés par les Orthoptères sur les graminées
| Graduation | Dégâts associés |
| 0 | Aucun. |
| 1 | Quelques impacts sur lˈensemble de la plante. |
| 2 | 1 impact par feuille en moyenne, |
| ou 1–2 impacts de 1,5 cm de long, | |
| ou 1–2 impacts entaillant la feuille sur à la moitié de sa largeur. | |
| 3 | 2–4 impacts par feuille en moyenne, |
| ou plus de 3 impacts de 1,5 cm de long, | |
| ou plus de 3 impacts entaillant la feuille sur à la moitié de sa largeur, | |
| ou 1–2 impacts entaillant la feuille sur plus de la moitié de sa largeur. | |
| 4 | plus de 5 impacts par feuille en moyenne, |
| ou plus de 3 impacts entaillant la feuille sur plus de la moitié de sa largeur. | |
| 5 | Plus de la moitié de la surface foliaire estimée a été broutée. |
2.5 Analyses statistiques
Des analyses de variance à une voie sur les dégâts en juillet et en août permettent de tester les différences dˈherbivorie subie par le Brome et le Brachypode (effet espèce). Ensuite, des analyses de variance à 3 voies (ombrage × sécheresse × fauche) ont été réalisées sur les dégâts en juillet et en août pour chacune des deux espèces. La relation entre lˈintensité dˈherbivorie et les facteurs environnementaux a été analysée par corrélations (coefficient de Pearson) entre la moyenne des dégâts dˈherbivorie et les paramètres environnementaux des huit lots expérimentaux (déficit en vapeur saturante, températures de lˈair et du sol, humidité du sol, teneur en azote du sol, densité de végétation, de Brome, de Brachypode, dˈautres graminoïdes, de légumineuses et dˈautres Dicotylédones).
3 Résultats
Lˈherbivorie par les Orthoptères affecte dˈavantage le Brachypode que le Brome, avec des dégâts deux à trois fois supérieurs en juillet (F = 17,6, P < 0,001) et trois à quatre fois supérieurs en août (F = 31,0, P < 0,001) dans le cas du Brachypode.
Lˈherbivorie est fortement influencée par lˈombrage et de manière négative, que ce soit pour le Brome (F > 7) ou pour le Brachypode (F > 13 ; Tableaux 3 et 4). Quasiment aucune trace dˈherbivorie nˈest visible sur le Brome lorsquˈil est ombré, et lˈintensité dˈherbivorie mesurée sur le Brachypode par notre échelle relative diminue en général d’au moins de moitié avec lˈombrage (Figs. 2 et 3). La sécheresse influence aussi lˈherbivorie subit par les deux espèces (Tableaux 3 et 4), mais de façon plus différenciée que dans le cas de lˈombre ; l’herbivorie subie par le Brome augmente en juillet alors qu’elle diminue pour le Brachypode en août (Figs. 2 et 3). Le fauche n’influence pas le niveau d’herbivorie subie par le Brome (Tableau 3) alors qu’elle entraîne une diminution d’herbivorie très significative pour le Brachypode, surtout au mois d’août (Faoût = 18,8 ; Tableau 4, Fig. 3). Lorsqu’elle est appliquée sous l’ombrage, la fauche entraîne une diminution dˈherbivorie significativement plus importante que lorsqu’elle est appliquée en dehors de l’ombrage (interactions ombrage × fauche et ombrage × sécheresse × fauche significatives, Tableau 4), ce qui se traduit par une absence complète d’herbivorie en août sur le Brachypode dans les lots Ombré – Fauché et Ombré – Asséché – Fauché (Fig. 3). La sécheresse en juillet augmente significativement l’herbivorie subie par le Brachypode sous l’ombrage (ce qui corrobore l’augmentation d’herbivorie constatée pour le Brome asséché en juillet) mais pas à l’extérieur de l’ombrage (interaction ombrage × sécheresse × fauche significative ; Tableau 4, Fig. 3). Les espèces d’Orthoptères phytophages dominantes en situations témoin, séchée et fauchée sont avant tout Euchorthippus declivus et Chorthippus biguttulus. Seul l’ombrage engendre une composition différente avec la dominance secondaire de Homorocoryphus nitidulus.
Résultats des analyses de variance à 3 voies (ombrage, sécheresse, fauche) effectuées sur les dégâts mesurées en juillet et août 1999 sur le Brome
| Juillet | Août | |||
| Effets | dl | Valeurs de F | Valeurs de F | |
| Ombrage | 1 | 12,18 ** | 7,17 ** | |
| Sécheresse | 1 | 5,50 * | 1,12 | |
| Fauche | 1 | 1,25 | 1,63 | |
| Ombrage × sécheresse | 1 | 1,80 | 1,12 | |
| Ombrage × fauche | 1 | 0,01 | 1,63 | |
| Sécheresse × fauche | 1 | 0,18 | 0,54 | |
| Ombrage × sécheresse × fauche | 1 | 2,03 | 0,54 |
***, **, * significativités aux seuils respectifs de P < 0,001 ; 0,01 et 0,05.
Résultats des analyses de variances à 3 voies (ombrage, sécheresse, fauche) effectuées sur les dégâts mesurées en juillet et août 1999 sur le Brachypode
| Juillet | Août | |||
| Effets | dl | Valeurs de F | Valeurs de F | |
| Ombrage | 1 | 13,93 *** | 14,29 *** | |
| Sécheresse | 1 | 0,56 | 4,60 * | |
| Fauche | 1 | 4,88 * | 18,82 *** | |
| Ombrage × sécheresse | 1 | 2,21 | 0,63 | |
| Ombrage × fauche | 1 | 1,46 | 4,36 * | |
| Sécheresse × fauche | 1 | 2,90 | 2,06 | |
| Ombrage × sécheresse × fauche | 1 | 5,15 * | 0,01 |
***, **, * significativités aux seuils respectifs de P < 0,001 ; 0,01 et 0,05.
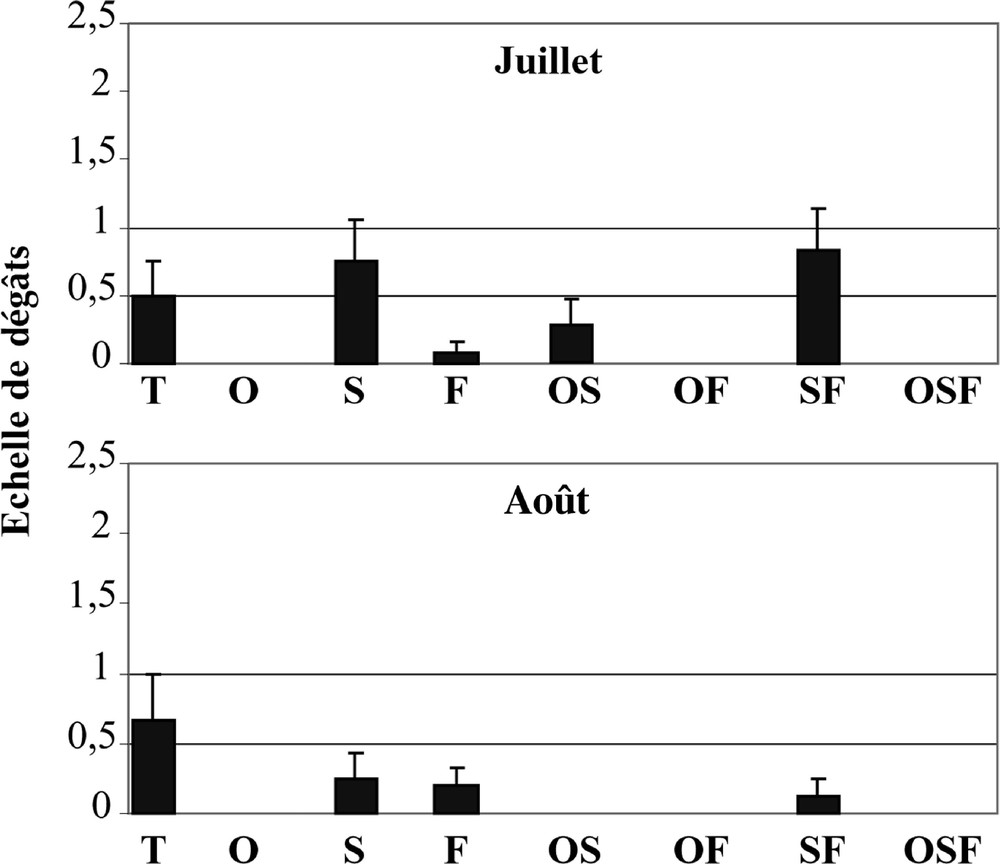
Dégâts moyens d'herbivorie (± erreur standard) sur Bromus erectus en juillet et août 1999 sur les différents lots expérimentaux. T : lot témoin, O : lot ombré, S : lot asséché, F : lot fauché, OS : lot ombré et asséché, OF : lot ombré et fauché, SF : lot asséché et fauché, OSF : lot ombré, asséché et fauché.

Dégâts moyens d'herbivorie (± erreur standard) sur Brachypodium pinnatum en juillet et août 1999 sur les différents lots expérimentaux. T : lot témoin, O : lot ombré, S : lot asséché, F : lot fauché, OS : lot ombré et asséché, OF : lot ombré et fauché, SF : lot asséché et fauché, OSF : lot ombré, asséché et fauché.
Les corrélations entre herbivorie et facteurs environnementaux sont très similaires pour les deux espèces, que ce soit au mois de juillet ou au mois d’août (Tableau 5). En juillet, les dégâts sur le Brome et le Brachypode sont positivement corrélés au microclimat (D.V.S., températures de lˈair et du sol) et négativement corrélés à la fois aux ressources du sol (eau et azote), à la densité de Brachypode et à la densité d’autres graminoïdes (telles que Dactylis glomerata, Holcus lanatus). En août, après la fauche, seule la densité de végétation est négativement corrélée aux dommages subis par le Brome. Aucune corrélation significative entre facteurs environnementaux et herbivorie nˈapparaît au mois d’août (Tableau 5), à lˈexception de la densité de végétation.
Relations entre herbivorie et facteurs environnementaux en juillet et août 1999. Résultats des corrélations (coefficient de Pearson) entre les dégâts subits par les plantes étudiées (Brome, Brachypode) et les facteurs abiotiques (a) ou biotiques (b)
| Juillet | Août | |||||
| Bromus | Brachypodium | Bromus | Brachypodium | |||
| n | r | r | r | r | ||
| a. Facteurs abiotiques | ||||||
| Déficit en vapeur saturante | 8 | 0,82 * | 0,82 * | 0,61 | 0,43 | |
| Température de lˈair | 8 | 0,85 ** | 0,87 ** | 0,65 | 0,54 | |
| Température du sol | 8 | 0,79 * | 0,85 ** | 0,62 | 0,46 | |
| Humidité du sol | 8 | –0,87 ** | –0,76 * | –0,06 | 0,05 | |
| Azote total disponible | 8 | –0,81 * | –0,93 ** | –0,47 | –0,26 | |
| b. Facteurs biotiques | ||||||
| Densité de végétation | 8 | –0,62 | –0,62 | –0,71 * | –0,60 | |
| Densité de Brome | 8 | 0,27 | 0,34 | –0,43 | –0,42 | |
| Densité de Brachypode | 8 | –0,79 * | –0,81 * | –0,53 | –0,37 | |
| Densité dˈautres graminoïdes | 8 | –0,81 * | –0,84 ** | –0,63 | –0,49 | |
| Densité de légumineuses | 8 | 0,15 | 0,02 | –0,01 | –0,06 | |
| Densité dˈautres dicotylédones | 8 | –0,31 | –0,33 | 0,12 | 0,01 |
***, **, * significativités aux seuils respectifs de P < 0,001 ; 0,01 et 0,05.
4 Discussion
4.1 Sélectivité de lˈherbivorie
Les Orthoptères consomment avant tout le Brachypode et montrent ainsi une préférence alimentaire, en cohérence avec Joern et Lawlor [34], Cottam [35] et Le Gall [36]. La préférence alimentaire chez les Orthoptères peut être liée à la dominance de l’espèce végétale dans le milieu : Cottam [35] a montré que le criquet Omocestus viridulus consommait de préférence la plante la plus abondante. Dans notre étude, l’herbivorie n’est pas fréquence-dépendante puisque la pression dˈherbivorie est maximale sur la graminée la moins dominante. La sélectivité alimentaire des Orthoptères pourrait alors s’expliquer soit par le développement de défenses physiques chez le Brome, soit par la présence de composés chimiques (métabolites secondaires, sucres, nutriments) susceptibles d’altérer l’appétence du Brome voire d’augmenter celle du Brachypode [36–39]. Quoique plus consommé par les Orthoptères, le Brachypode présente une appétence pour le bétail inférieure à celle du Brome [25,30]. Toutes les espèces du genre Brachypodium [40] ainsi que d’autres graminées parmi lesquelles ne figure pas le Brome érigé [41], possèdent des grains de silice dans leurs tissus foliaires, ce qui est souvent interprété comme une adaptation des plantes à l’herbivorie, notamment par les ongulés [42]. Contrairement au bétail, les Orthoptères sont peu affectés par la teneur des feuilles en silice du fait de leurs mandibules coriaces et des adaptations de leur tractus digestif ; ils consomment en outre préférentiellement les pousses de graminées matures cˈest-à-dire les plus riches en silice [36].
4.2 Déterminisme de lˈherbivorie
Les dégâts dˈherbivorie diminuent fortement avec lˈombrage pour les deux espèces, et avec la fauche pour le Brachypode. La sécheresse engendre une réponse en deux temps : lˈherbivorie augmente en juillet sur le Brome mais diminue en août sur le Brachypode. Les dégâts dˈherbivorie sont, pour les deux espèces, positivement corrélés au microclimat (D.V.S., températures de lˈair et du sol) mais négativement à la fertilité du sol et à la densité de Brachypode et dˈautres graminoïdes.
La relation entre herbivorie et microclimat a déjà été mentionnée, notamment par Coll et Bottrell [43] et Schoonhoven et al. [44], mais à notre connaissance, aucune étude ne l’avait quantifiée à la suite de manipulations environnementales en conditions naturelles. Nos résultats sont cohérents avec le fait que les Orthoptères soient habituellement associés à des environnements secs et chauds [45,46]. Sous lˈombrage, la diminution du déficit en vapeur saturante et de la température [22] engendre un microclimat défavorable aux Orthoptères, ce qui pourrait expliquer la diminution dˈherbivorie. Cette diminution dˈherbivorie avec lˈombrage est confirmé par Murcia [47], mais Meiners et al. [48] mettent en évidence une variation non linéaire de lˈherbivorie par les insectes sur Acer rubrum en fonction de lˈouverture forestière. Ainsi, lˈherbivorie augmente fortement de la forêt vers la lisière forestière, confirmant les résultats de Murcia [47], mais diminue de la lisière à la prairie. La forte herbivorie en lisière semble être davantage liée à un ‘effet bordure’ quˈà lˈeffet propre de la différence dˈouverture des milieux [48]. Ces deux études mentionnent lˈimportance des modifications microclimatiques engendrées par lˈouverture mais ne les relient pas explicitement aux variations dˈherbivorie observées. L’amélioration des conditions microclimatiques pour les Orthoptères, avec l’augmentation du déficit en vapeur saturante [22], permet également d’expliquer lˈaugmentation dˈherbivorie sur le Brome au mois de juillet dans les lots asséchés.
Le modèle de variation d’herbivorie proposé par Oksanen et al. [10] est avant tout basé sur la ressource primaire de l’écosystème. Les herbivores ne peuvent se maintenir que si la biomasse végétale est suffisamment abondante (contrôle ascendant de l’herbivorie), et l’abondance de ressource primaire permet la présence de fortes populations d’herbivores qui favorisent les prédateurs, responsables du contrôle descendant de l’herbivorie. Dans notre étude, la diminution dˈherbivorie du Brachypode dans les lots fauchés et asséchés peut sˈexpliquer par une régulation ascendante de lˈherbivorie et s’intègrent donc dans le modèle d’Oksanen et al. [10]. La fauche réduit fortement la ressource pour les herbivores et la diminution d’herbivorie qui en découle est particulièrement sensible sur le Brachypode car c’est l’espèce dominante la plus appétente pour les Orthoptères. L’influence de la fauche sur lˈintensité dˈherbivorie est dˈautre part suggérée par la disparition des corrélations entre herbivorie et microclimat au mois dˈaoût 1999 (c’est-à-dire après la fauche). L’effet négatif de la sécheresse au mois d’août sur l’herbivorie pourrait s’expliquer par une diminution qualitative et quantitative de la biomasse végétale due au déficit hydrique prolongé (depuis début mai). Cependant, la corrélation négative de l’herbivorie avec la densité de Brachypode, qui est pourtant la ressource préférentielle des Orthoptères, nous indique que la régulation trophique ne serait pas l’unique déterminisme des variations d’herbivorie. Dans le milieu le plus productif (lots ombrés), la prédation est plausible de par la présence importante dˈaraignées, susceptibles de causer de fortes mortalités dans les populations dˈOrthoptères [49,50]. Mais la prédation nˈest pas exclusive des lots ombrés puisque des prédateurs potentiels pour les Orthoptères, comme par exemple les oiseaux [46,51], agissent en dehors du voile dˈombrage. Des alternatives à lˈhypothèse trophique de régulation de lˈherbivorie sont à considérer. Notre étude suggère une régulation microclimatique de l’herbivorie, s’appuyant sur la corrélation positive de lˈherbivorie avec le déficit en vapeur saturante et la température. D’autres investigations [7] expliquent la diminution d’herbivorie dans les milieux productifs par une faible efficacité de prospection de petit vertébrés tels que les lièvres, les lapins et les oies sauvages et ne retiennent pas la prédation comme un élément régulateur de l’herbivorie dans les milieux à végétation haute.
4.3 Vers une approche plus fonctionnelle de lˈherbivorie
Dans la présentation de leur modèle, Oksanen et al. [10] reconnaissent une alternative à la régulation trophique de lˈherbivorie en invoquant la sensibilité des Arthropodes à la température. Ceci est confirmé par la corrélation positive de lˈherbivorie par les Orthoptères vis-à-vis de la température mais aussi du déficit en vapeur saturante qui ressort de notre étude et dˈautres travaux faisant état des exigences écologiques des populations dˈOrthoptères [45,46]. Par ailleurs, Coll et Bottrell [43] ont souligné l’hétérogénéité des résultats des études portant sur les interactions plante-herbivore qui semblent liés à la large gamme dˈherbivores impliqués dans les études. L’assimilation du niveau trophique « herbivore » à une entité écologique à part entière est sans doute trop réductionniste (Oksanen et al. [10]). Une approche fonctionnelle de lˈherbivorie, tenant compte des traits biologiques des espèces dˈherbivores, serait de nature à résoudre un certain nombre de contradictions apparentes. Ainsi, deux grands types dˈherbivores peuvent être distingués, en fonction de leur taille et de leur métabolisme énergétique. Les herbivores vertébrés, tels que le bétail [52–54], les grands mammifères sauvages [11,55] et les micromammifères [6,56–58] sont de plutôt de grande taille et sont homéothermes, alors que les herbivores invertébrés tels que les limaces [9,18,35,59] ou les insectes [18,60,61] sont de petite taille et sont ectothermes.
La grande taille des vertébrés implique un fort prélèvement de végétation, une sélectivité relativement faible (à lˈéchelle de la touffe dˈherbe) et des pertes de biomasse importante pour les plantes. Lˈherbivorie par les vertébrés dépend fortement de la quantité de biomasse végétale présente dans le milieu pour subvenir aux besoins de lˈherbivore. Ce type dˈherbivorie est susceptible dˈêtre dirigé ou au moins dˈêtre fortement influencée par les activités humaines (conduite de troupeaux, parcage de bétail, chasse). A l’intérieur du type « vertébrés », les herbivores tels que les rongeurs ou les oies doivent être distingués du fait de leur petite taille, réduisant leur efficacité dans les milieux productifs, et de leur plus grande spécialisation par rapport aux ongulés et au bétail [62].
La petite taille des invertébrés permet une herbivorie plus sélective (à lˈéchelle du brin dˈherbe), plus discrète et qui se manifeste par une quantité importante dˈimpacts sur la végétation. Les herbivores invertébrés sont relativement indépendants des activités humaines et constituent une des seules populations non domestiques agissant dans les milieux anthropisés, comme par exemple les pâtures. Les invertébrés sont essentiellement ectothermes et leur activité est particulièrement dépendante du microclimat, parfois de manière opposée : ainsi, les Acrididés sont liés aux habitats chauds et surtout secs et les mollusques terrestres (limaces, escargots) aux milieux humides.
Cette distinction entre types dˈherbivores permet dˈexpliquer les différents modèles de régulation d’herbivorie et certains résultats contradictoires. Ainsi, l’hypothèse de régulation descendante de l’herbivorie développée par Oksanen et al. [10] s’appuie essentiellement sur les vertébrés, notre hypothèse de régulation microclimatique sur les Arthropodes, et l’hypothèse de régulation par efficacité de prospection sur de petits vertébrés. En outre, lˈherbivorie due aux Arthropodes décroît lorsque la biomasse augmente ([14,63], nos résultats), alors que lˈherbivorie causée par les grands vertébrés augmente avec la biomasse [20]. Malgré leur faible prélèvement, en comparaison des grands mammifères, les Arthropodes peuvent cependant avoir de fortes répercussions sur la structure et la dynamique des communautés végétales de par leur sélectivité et les variabilités démographiques qui les affectent [27].
Abridged version
Herbivory in ecosystems is not a static phenomenon, but varies over space and time. Variation in herbivory intensity has generally been studied along natural gradients such as those created by variation in soil fertility, biomass, or productivity. These gradients are complex, i.e. they include changes in several components of ecosystems (such as soil and vegetation) and numerous abiotic factors (such as temperature and soil moisture) at the same time. Studies performed along complex gradients have improved our knowledge of how the intensity of herbivory varies, but the large number of correlated factors incorporated in natural gradients does not allow a clear mechanistic manipulations of processes driving herbivory. Studies along complex gradients have led to conflicting results, making generalisations about the patterns of herbivory variation difficult. However, some general models suggest that the intensity of herbivory along natural gradients (especially biomass) may be somewhat predictable. According to food web theory , herbivory should be limited in productive habitats by ‘top-down’ control, i.e. by predation on herbivores, and in low productive habitats by ‘bottom-up’ control, i.e. by a shortage in the primary resource supporting herbivores. In addition to studies involving complex gradients, other investigations have focused on changes in the intensity of herbivory with simple experimental factors, such as CO2 enrichment or nutrient addition. These studies have yielded insight into the influence of particular factors on herbivory, but our understanding of the relative importance of various factors in combination remains. We established three treatments in the field (shade, drought and mowing), by which particular abiotic factors were varied in order to create a complex experimental gradient of biomass. The aim of our work is to study variation in the intensity herbivory caused by grasshoppers (Orthoptera) on two perennial grasses, Bromus erectus and Brachypodium pinnatum. Specifically, we have 1) quantified herbivory experienced by Bromus and Brachypodium, 2) compared the intensity of herbivory in different treatments of shade, drought, mowing, 3) compared the intensity of herbivory with variation in plant biomass, and 4) considered our results in the context of the dominant hypotheses for how the importance of herbivory varies in natural communities. Shade, drought and mowing were manipulated in a calcareous grassland to simulate canopy effects of encroaching trees in grasslands, drought, and management for hay. These treatments were performed on eight 32-m2 plots (Control; Shade; Drought; Mowing; Shade and Drought; Shade and Mowing; Drought and Mowing; Shade, Drought and Mowing), following a fully factorial design. In each plot, we recorded a range of abiotic environmental changes that occurred with experimental treatments: vapour pressure deficit (VPD), air and soil temperature, soil moisture, soil nitrogen content. We also recorded variation in biotic factors among the treatment plots including the total density of all vegetation, and the density of Bromus erectus, Brachypodium pinnatum, and the main functional types of plants. Herbivory experienced by Bromus erectus and Brachypodium pinnatum was measured using a relative scale of damage graduated from 0 (no damage) to 5 (more than 50% of the leaf area were eaten). To assess mechanisms driving grasshopper herbivory in calcareous grasslands, damage by herbivory on target species were correlated with abiotic and biotic conditions that occurred in the different experimental plots.
Herbivory was selective and Brachypodium was 2–4 times more eaten than Bromus. Shade sharply decreased herbivory experience by both species (F-values > 7). Drought showed contrasting effects, increasing herbivory on Bromus in July but decreasing herbivory on Brachypodium in August. Herbivory experienced by Brachypodium decreased substantially with mowing (P < 0.001), whereas herbivory experienced by Bromus was not affected by mowing. When plots were not mowed, herbivory was positively related to VPD and temperature, and negatively related to soil nitrogen availability, density of Brachypodium, and density of other grasses (e.g. Dactylis glomerata, Holcus lanatus). After mowing, herbivory was only weakly related to total density of vegetation density and not correlated with any other environmental measurements.
The preference of grasshoppers for Brachypodium was not consistent with the frequency-dependence of herbivory by grasshoppers which states that the dominant plant species in communities is the more eaten, but suggest chemical or physical defences of the studied grasses. Unlike grasshoppers, cattle preferentially eat Bromus, especially when plants are mature, which may be due to silica inclusions in the leaves of Brachypodium.
The positive correlation between herbivory and microclimate is consistent with the ecological requirements of grasshoppers, which prefer warm and dry habitats. The decrease in herbivory in shaded plots may be explained by the decrease in VPD and temperature under the shade cloth, leading to an unfavourable microclimate for grasshoppers. However, the increase in herbivory with drought in July occurred with an increase in VPD. The decrease in herbivory in mowed and dry plots in August corresponds with the ‘bottom-up’ hypothesis for herbivory. Mowing, and the long drought in August, may have led to a decrease in the quality and quantity of vegetation available for herbivores.
Besides the trophic control hypothesis of herbivory, alternative hypothesis such as control of herbivory by microclimate or herbivores foraging have to be consider. These conflicting hypotheses for the importance of herbivory in plant communities may be explained by differences among herbivore species involved in studies. Large herbivores are not highly restricted by microclimate and damage large amounts of vegetation in a relatively indiscriminate manner. In contrast, small ectothermic herbivores such as grasshoppers are highly constrained by microclimate, and sometimes in opposite ways depending on the species: grasshoppers prefer warm, dry habitats, whereas slugs prefer wet habitats. Microclimate effects and species-specific effects may create conditions where herbivory is highly selective, therefore have great consequences on community composition. This perspective is apparent in the literature on herbivory intensity and hypotheses for how herbivory affects the composition of plant communities. In general, trophic hypotheses for herbivory are based on studies of large vertebrates herbivores, microclimate hypotheses are based on studies involving arthropods, and support for the importance of foraging strategies are based on studies of small vertebrate herbivores. Specific comparisons of herbivore identity and the functional traits of herbivores may help to explain contradictions in literature for how herbivory may control community structure and ecosystem function.



