Abridged English version
In Triticum turgidum subsp. durum (Desf.) Husn., the utilization of in vitro anther culture is hampered by the very high frequency of albinism of the regenerated plants, reaching in most cases 100%. Only in vitro ovary culture or intergeneric crosses with maize produce gynogenetic green haploid and doubled haploid plants. In vitro isolated microspore culture is the more recent method of doubled-haploid production. It has the considerable advantage to allow the separation of the microspore populations from the sporophytic tissues, leading to more true embryos and quick conversion of those into true haploid and doubled haploid plants with a lower rate of somaclonal variations compared to in vitro anther culture. This method has been extensively applied with success in crops such as rape seed, barley and more recently bread wheat, but not in Triticum durum.
Our laboratory has decided to study the effects of different pre-treatments on the behaviour of in vitro isolated microspores populations of durum wheat. In this publication, we used two durum wheat varieties (Triticum turgidum subsp. durum (Desf.) Husn.), tetraploid (
Our results clearly show that the microspore culture response varies within the species and depends also on the pre-treatment. The two durum cultivars showed a great difference in their embryogenic potentialities. The cv. Cham1 has a poor response in embryo formation for all pre-treatments. However, the cv. JK has shown a good embryogenesis for all pre-treatments, principally when mannitol 0.1 M is used for three days at 4 °C. Under this condition, we obtained 0.71% of embryo production, which exceeded the level of Pavon 76.
As far as green plant regeneration is concerned, the cold pre-treatment during 5 weeks at 4 °C was the best one. It gave a net improvement of microspore culture responses particularly for embryo production but also for green plant release. All pre-treatments and control taken together, a total of 16 490 embryos was obtained from
1 Introduction
Maîtriser l'obtention et l'utilisation de lignées haploïdes doublées chez une espèce de grande culture comme le blé dur est un enjeu important pour les programmes d'amélioration variétale de cette espèce. L'haplodiploïdisation est en effet une méthode de fixation rapide du matériel génétique après la méiose, permettant l'obtention de lignées homozygotes en une seule étape, alors que, dans les méthodes classiques, la fixation des lignées requiert plusieurs cycles d'autofécondation. Elle permet donc un gain de temps appréciable, également un gain en efficacité de la sélection et une diminution du coût de production des lignées pures [1]. Parmi toutes les méthodes possibles d'obtention de plantes haploïdes, la culture de microspores isolées in vitro s'est développée à partir des années 1990. Cette méthode est caractérisée notamment par la séparation des microspores des tissus sporophytiques de l'anthère avant ou dès le début de la culture in vitro, par l'obtention en général d'une embryogenèse plus rapide et plus conforme et, en ce qui concerne la production de plantes, par des variations induites par la culture in vitro moins nombreuses. En raison de ses avantages, cette méthode de culture de microspores isolées a donc été largement appliquée par les établissements de sélection chez les espèces où elle s'est révélée efficace tout de suite, telles que le colza, l'orge et, plus tard, le blé tendre pour l'obtention de nouvelles variétés [2–4]. Sur un plan plus fondamental, cette méthode permet une observation cytologique des stades de l'embryogenèse ex ovulo, l'étude moléculaire des gènes impliqués dans l'embryogenèse, la simulation de la gamétogenèse in vitro, la transformation génétique et l'analyse des produits de la méiose. Le blé dur est resté, en revanche, une espèce récalcitrante à l'androgenèse in vitro, y compris à la culture de microspores isolées, avec une faible production d'embryons, une régénération difficile et très faible en plantes chlorophylliennes, ainsi qu'un taux de production élevé de plantes albina [5,6]. On sait que cet albinisme correspond à une dégradation précoce de l'ADN des plastes, favorisant ainsi la formation exclusive de plantes albina chez les Poacées [7]. Seules les méthodes de croisement intergénérique avec le maïs [8] ou de culture in vitro d'ovaires immatures [9] permettent d'obtenir, chez cette espèce, des plantes vertes haploïdes et haploïdes doublées d'origine gynogénétique. Notre laboratoire a choisi, depuis plusieurs années, de mener des recherches pour diminuer le taux d'albinisme des plantes androgénétiques de blé dur en utilisant la culture de microspores isolées et en étudiant notamment l'effet des prétraitements. Quelques résultats prometteurs ont été ainsi obtenus [10,11]. La présente note relate l'étude comparative de l'effet de plusieurs prétraitements et montre, pour la première fois, comment il a été possible d'améliorer significativement l'obtention d'embryons et de plantes androgénétiques vertes chez le blé dur en utilisant de nouveaux prétraitements des microspores dans leurs épis avant leur isolement et leur mise en culture.
2 Matériels et méthodes
Cette étude a été menée sur deux variétés de blé dur (Triticum turgidum subsp. durum (Desf.) Husn.) tétraploïde (
Les plantes mères ont été cultivées dans une chambre climatisée de type Strader réglée à la température jour/nuit 20/15 °C, avec une photopériode de 16 h (1150 μE m−2 s−1). JK est vernalisée 15 jours à 4 °C au préalable. L'humidité relative y a été maintenue à 70 ± 5%. Les talles ont été prélevées lorsque la majorité des microspores étaient au stade uninucléé tardif et ont subi par la suite les prétraitements suivants, que nous avons choisi à la suite d'expériences préliminaires, non publiées, précédant celles que nous relatons ici :
- – aucun prétraitement ;
- – un prétraitement au froid pendant 3 j ou pendant cinq semaines ; les talles ont été mises dans des bocaux contenant de l'eau, puis placées dans un réfrigérateur à 4 °C et à l'obscurité ;
- – un prétraitement au mannitol à 0,1 M pendant 3 j à 4 °C ; les talles ont été mises dans un Erlenmeyer contenant une solution aqueuse de mannitol à 0,1 M, puis placées dans un réfrigérateur à 4 °C et à l'obscurité ;
- – un prétraitement combinant un prétraitement au froid en premier pendant cinq semaines suivi d'un prétraitement au mannitol à 0,1 M pendant 3 j ;
- – enfin, un prétraitement inverse du précédent : mannitol, suivi du froid.
Le protocole d'isolement des microspores utilisé ici est celui décrit par De Buyser et al. [12], sauf pour les prétraitements. Avant l'isolement des microspores, les épis ont été désinfectés par une solution d'hypochlorite de calcium à 4%. Après broyage des épillets, filtration et centrifugation, reprise du culot et deuxième centrifugation, les microspores extraites ont été cultivées dans le milieu d'induction liquide CHB3 (CHU additionné de 90 g l−1 de maltose) [13] dans des boîtes de Pétri de 35 mm de diamètre à raison de 1,5 ml par boîte et co-cultivées avec 5 à 10 ovaires par boîte de Pétri.
Après la phase d'incubation à l'obscurité dans une enceinte de culture régulée à 27 °C, les embryons formés ont été comptés puis pour une partie d'entre eux transférés sur le milieu de régénération solide de Murashige et Skoog [14] sans hormones (MS0). Suivant toujours le même protocole [12], après trois semaines de culture des embryons sur le milieu de régénération, les plantes vertes et albina ayant développé un système racinaire ainsi que les structures non régénérées en plantes ont été dénombrées.
L'observation cytologique des microspores avant extraction ou de leur évolution en cours de culture a été faite à l'aide d'un microscope inversé, soit en lumière transmise, soit en fluorescence après coloration d'échantillons au DAPI (di aminido phenyl indol). Celui-ci se fixe spécifiquement sur l'ADN. Éclairé en lumière ultraviolette (maximum 372 nm), il émet une fluorescence bleue (maximum 456 nm).
Les paramètres androgénétiques mesurés sont les suivants :
- – nombre d'embryons produits = somme totale d'embryons comptés pendant 15 j à partir des premiers apparus ;
- – taux de production d'embryons = (nombre d'embryons produits/nombre de microspores cultivées) ×100 ;
- – nombre d'embryons repiqués = nombre d'embryons, parmi les premiers apparus, mis en culture sur le milieu de régénération ;
- – nombre de plantes vertes (V) = nombre de plantes vertes obtenues à partir des embryons repiqués ;
- – taux de régénération des plantes vertes = (nombre de plantes vertes (V)/nombre d'embryons repiqués) ×100 ;
- – nombre de plantes albina (A) = nombre de plantes albina obtenues à partir de la même population d'embryons repiqués ;
- – taux de régénération des plantes albina = (nombre de plantes albina (A)/nombre d'embryons repiqués) ×100 ;
- – nombre d'embryons ne donnant aucune régénération = nombre d'embryons ne se convertissant ni en plantes vertes ni en plantes albina ou n'ayant développé qu'un début de système racinaire ;
- – taux d'embryons ne donnant aucune régénération = (nombre d'embryons ne donnant aucune régénération/nombre d'embryons repiqués) ×100 ;
- – rapport V/A = nombre de plantes vertes (V)/nombre de plantes albina (A) ;
- – rendement théorique en plantes vertes = (taux de production d'embryons) × (taux de régénération de plantes vertes) exprimé en pour mille ;
- – rendement théorique en plantes albina = (taux de production d'embryons) × (taux de régénération de plantes albina) exprimé en pour mille.
2.1 Tests statistiques
Pour ce qui concerne l'embryogenèse androgénétique, nous ne faisons aucun test statistique, puisqu'il s'agit d'un phénomène rare et ceci, même si nos résultats sont nettement supérieurs à ceux de la culture d'anthères. En effet, les pourcentages de microspores donnant des embryons étant de l'ordre de 1 à 70 microspores pour 10 000 donnant un embryon, il est difficile d'envisager d'effectuer des tests statistiques.
En ce qui concerne la régénération (ou la conversion) des embryons après leur repiquage sur MS0, un test de comparaison statistique de pourcentages par couple de génotypes, utilisant la formule ci-dessous, a été effectué afin d'évaluer la signification de l'effet des différents prétraitements sur l'obtention de plantes vertes, albina, ou l'absence de régénération.
Soient
Une partie des plantes androgénétiques obtenues a été suivie en chambre de culture pour confirmer, d'une part, les caractères morphologiques de type Triticum durum et, d'autre part, afin de contrôler leur niveau de ploïdie (haploïde ou haploïde doublé) par l'analyse de la fertilité des épis après ensachage de ceux-ci, qui a été en même temps confirmée par un comptage chromosomique.
3 Résultats
3.1 Production des embryons
Pour les blés durs, les embryons ont été obtenus en quantité et qualité variables, après quatre à cinq semaines d'incubation, à partir d'un total de 17,4 × 106 microspores des deux variétés de blé dur, dont les deux tiers venaient de Cham1 et un tiers de JK. Cette différence provient, d'une part, du fait que Cham1 produit plus d'épis et plus de microspores par anthère que JK et, d'autre part, du fait qu'un plus grand nombre d'infections a été observé chez JK, ce qui explique certaines grandes différences d'effectifs par prétraitements chez ce dernier. Morphologiquement, 10 à 20% de ces embryons sont identiques aux embryons zygotiques observés dans les caryopses, avec la présence d'un scutellum plus ou moins bien formé.
Chez le cv. Cham1 (Tableau 1), la formation d'embryons a été très faible. Ainsi, l'absence de prétraitement avant la culture in vitro n'a pas permis d'obtenir un seul embryon. Pour cette variété, un prétraitement s'avère nécessaire. Mais, même le prétraitement au froid à 4 °C pendant 3 j n'a donné aucun embryon chez ce cultivar de blé dur. Ce n'est qu'avec le prétraitement de cinq semaines à 4 °C que des embryons ont été obtenus, avec cependant une fréquence toujours faible. Quand on a utilisé seulement le prétraitement à 4 °C dans une solution aqueuse de mannitol, un faible nombre d'embryon a de nouveau été observé (34 embryons pour
Effet de différents prétraitements sur les principaux paramètres androgénétiques de culture in vitro de microspores isolées chez le blé dur. Cv. Cham1
| Prétraitement | Nombre de microspores extraites et cultivées | Nombre d'embryons produits (%) | Nombre d'embryons repiqués | Nombre de plantes vertes (%) | Nombre de plantes albina (%) | Nombre d'embryons ne donnant aucune régénération (%) | V/A |
| Aucun | 3 147 500 | 0 | – | – | – | – | – |
| (0) | |||||||
| Froid (3 j) | 1 425 000 | 0 | – | – | – | – | – |
| (0) | |||||||
| Froid (5 semaines) | 2 325 000 | 481 | 474 | 35 | 91 | 348 | 0,38 |
| (0,02) | (7,38) | (19,19) | (73,41) | ||||
| Man 0,1 M (3 j) | 1 350 000 | 34 | 26 | 0 | 5 | 21 | 0 |
| (0,002) | (0) | (19,23) | (80,76) | ||||
| Man 0,1 M (3 j) + Fr (5 semaines) | 1 200 000 | 539 | 215 | 2 | 9 | 204 | 0,22 |
| (0,04) | (0,93) | (4,18) | (94,88) | ||||
| Fr (5 semaines) + Man 0,1 M (3 j) | 1 275 000 | 1870 | 549 | 5 | 10 | 534 | 0,5 |
| (0,14) | (0,91) | (1,82) | (97,26) |
Dans le Tableau 2, qui résume les résultats pour le cv. JK, on constate que le prétraitement au froid pendant 3 j a donné un résultat sensiblement plus faible que celui de cinq semaines (0,14% contre 0,21%). Mais, contrairement à Cham1, le prétraitement au mannitol seul a donné, chez JK, le meilleur taux d'embryons (0,71%), c'est-à-dire 2695 embryons pour
Effet de différents prétraitements sur les principaux paramètres androgénétiques de culture in vitro de microspores isolées chez le blé dur. Cv. JK
| Prétraitement | Nombre de microspores extraites et cultivées | Nombre d'embryons produits (%) | Nombre d'embryons repiqués | Nombre de plantes vertes (%) | Nombre de plantes albina (%) | Nombre d'embryons ne donnant aucune régénération (%) | V/A |
| Aucun | 1 950 000 | 1911 | 1682 | 1 | 596 | 1085 | 0,001 |
| (0,09) | (0,06) | (35,43) | (64,5) | ||||
| Froid (3 j) | 750 000 | 1068 | 867 | 0 | 362 | 505 | 0 |
| (0,14) | (0) | (41,75) | (58,24) | ||||
| Froid (5 semaines) | 1 575 000 | 3316 | 2659 | 91 | 817 | 1751 | 0,11 |
| (0,21) | (3,42) | (30,72) | (65,85) | ||||
| Man 0,1 M (3 j) | 375 000 | 2695 | 583 | 2 | 247 | 334 | 0,008 |
| (0,71) | (0,34) | (42,36) | (57,28) | ||||
| Man 0,1 M (3 j) + Fr (5 semaines) | 775 000 | 2516 | 1804 | 10 | 594 | 1200 | 0,016 |
| (0,32) | (0,55) | (32,92) | (66,51) | ||||
| Fr (5 semaines) + Man 0,1 M (3 j) | 300 000 | 2060 | 460 | 3 | 298 | 159 | 0,01 |
| (0,68) | (0,65) | (64,78) | (34,56) |
Pour Pavon 76 (Tableau 3), l'absence de prétraitement ou le prétraitement au froid de 3 j a donné des résultats faibles pour la production d'embryons. En revanche, le prétraitement à 4 °C pendant cinq semaines a été plus favorable, permettant une formation de 6195 embryons pour
Effet de différents prétraitements sur les principaux paramètres androgénétiques de culture in vitro de microspores isolées chez le cultivar modèle Pavon 76
| Prétraitement | Nombre de microspores extraites et cultivées | Nombre d'embryons produits (%) | Nombre d'embryons repiqués | Nombre de plantes vertes (%) | Nombre de plantes albina (%) | Nombre d'embryons ne donnant aucune régénération (%) | V/A |
| Aucun | 900 000 | 453 | 433 | 137 | 55 | 241 | 2,49 |
| (0,05) | (31,63) | (12,70) | (55,65) | ||||
| Froid (3 j) | 525 000 | 200 | 169 | 15 | 113 | 41 | 0,13 |
| (0,038) | (8,87) | (66,86) | (24,26) | ||||
| Froid (5 semaines) | 3 150 000 | 6195 | 2467 | 525 | 1084 | 858 | 0,48 |
| (0,19) | (21,28) | (43,94) | (34,77) | ||||
| Man 0,1 M (3 j) | 3 225 000 | 5378 | 2062 | 1174 | 574 | 314 | 2,04 |
| (0,16) | (56,93) | (27,83) | (15,22) | ||||
| Man 0,1 M (3 j) + Fr (5 semaines) | 625 000 | 2199 | 1159 | 118 | 598 | 443 | 0,19 |
| (0,35) | (10,18) | (51,6) | (38,22) | ||||
| Fr (5 semaines) + Man 0,1 M (3 j) | 3 000 000 | 4994 | 2282 | 344 | 1198 | 740 | 0,28 |
| (0,16) | (15,07) | (52,49) | (32,42) |
En comparaison, le blé dur Cham1 a fourni des rendements en embryons inférieurs par rapport à ceux qui ont été obtenus chez le cultivar modèle Pavon 76, quel que soit le prétraitement appliqué. En revanche, pour le cv. JK, les rendements observés ont été équivalents, voire supérieurs, avec 0,71% et 0,68%, à ceux du cultivar modèle pour le choc osmotique mannitol 0,1 M pendant 3 j ou froid de cinq semaines suivi du choc osmotique.
3.2 Régénération des plantes
Pour l'ensemble des trois génotypes, nous avons observé, dans la plupart des cas, une conversion rapide des embryons en plantes plutôt qu'une régénération lente. Chez le cv. Cham1, le meilleur taux de régénération en plantes vertes a été obtenu par l'application du prétraitement au froid à 4 °C pendant cinq semaines (Tableau 1), donnant par ailleurs un taux de plantes albina relativement faible (115 plantes albina sur 1264 embryons repiqués au total) et, par différence, un taux très important d'embryons n'ayant pas régénéré. Toujours chez le cv. Cham1, le prétraitement au mannitol à 0,1 M n'a donné aucune plantule verte et un rapport V/A nul, contrairement à ce qui s'est passé chez le cv. Pavon 76. Pour les autres prétraitements appliqués, la situation a été pratiquement la même que celle observée pour le mannitol 0,1 M pendant 3 j à 4 °C.
Pour le cv. JK (Tableau 2), la régénération chlorophyllienne a été plus faible que celle enregistrée chez le cv. Cham1 (Figs. 1–4). Comme pour Cham1, la meilleure régénération chez le cv. JK a été obtenue après un choc thermique de cinq semaines à 4 °C, avec plus de trois plantes vertes régénérées sur 100 embryons repiqués (Tableau 2) et un rapport V/A de 0,1, valeur la plus élevée pour ce cultivar. En ce qui concerne la régénération de plantes albina, JK présente des taux de plantes albina plus élevés que Cham1, avec un total de 2914 plantes albina pour 8055 embryons repiqués (témoin et prétraitements confondus).
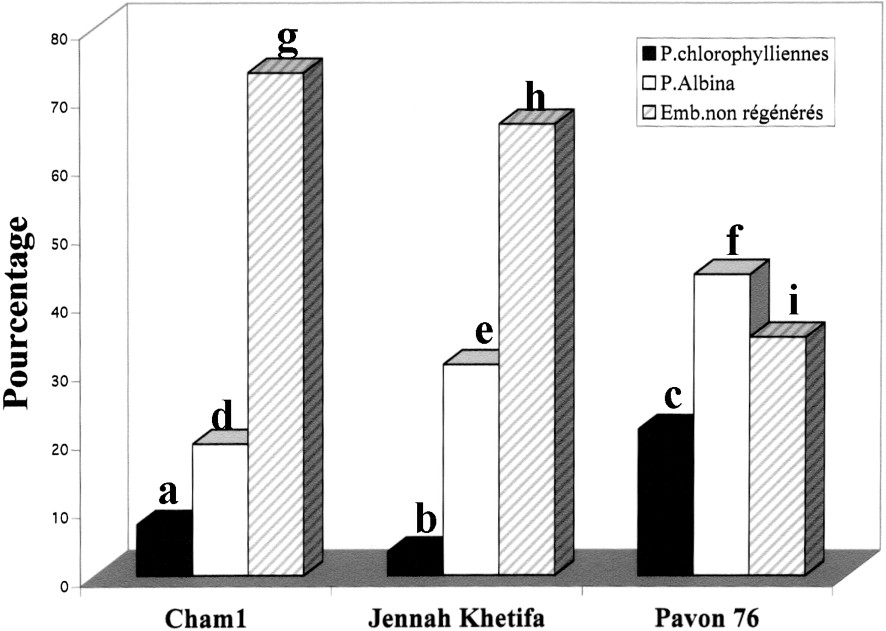
Effet du prétraitement au froid à 4 °C pendant cinq semaines sur l'obtention des plantes androgénétiques. Les barres des histogrammes surmontées de différentes lettres sont significativement différentes au seuil α de 5% et celles qui sont surmontées des mêmes lettres ne le sont pas : pourcentages de plantes vertes (a, b, c), albina (d, e, f) et des embryons non régénérés (g, h, i) chez les trois variétés de blé.
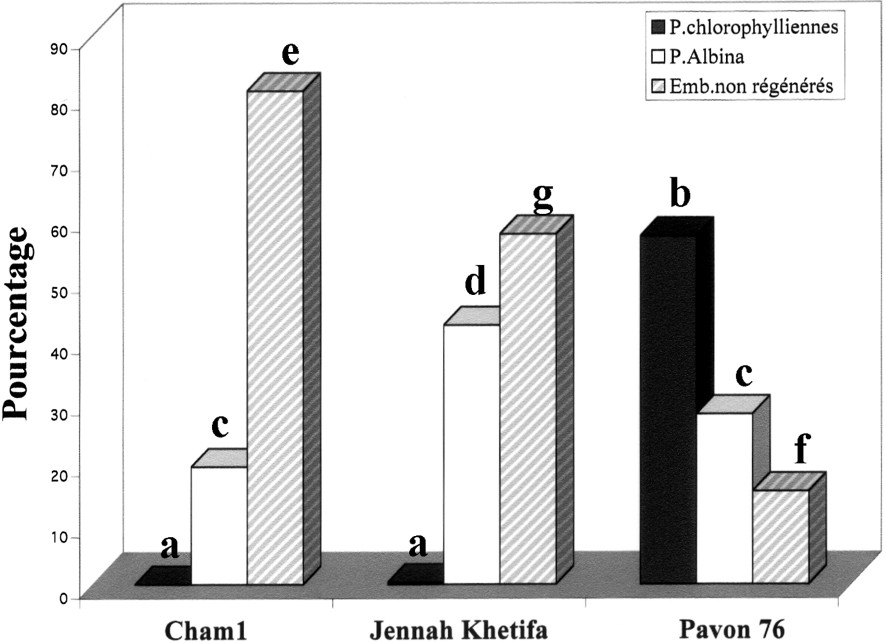
Effet du prétraitement au mannitol 0,1 M à 4 °C pendant 3 j sur l'obtention des plantes androgénétiques. Les barres des histogrammes surmontées de différentes lettres sont significativement différentes au seuil α de 5% et celles qui sont surmontées des mêmes lettres ne le sont pas : pourcentages de plantes vertes (a, a, b), albina (c, d, c) et des embryons non régénérés (e, g, f) chez les trois variétés de blé.
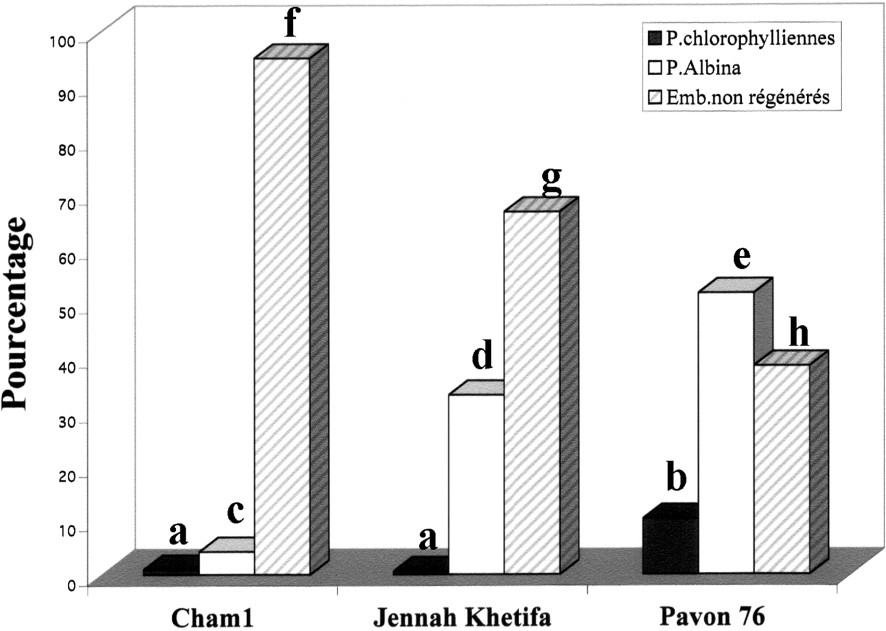
Effet du prétraitement au mannitol 0,1 M à 4 °C pendant 3 j suivi d'un séjour au froid de cinq semaines à 4 °C sur l'obtention des plantes androgénétiques. Les barres des histogrammes surmontées de différentes lettres sont significativement différentes au seuil α de 5% et celles qui sont surmontées des mêmes lettres ne le sont pas : pourcentages de plantes vertes (a, a, b), albina (c, d, e) et des embryons non régénérés (f, g, h) chez les trois variétés de blé. Masquer
Effet du prétraitement au mannitol 0,1 M à 4 °C pendant 3 j suivi d'un séjour au froid de cinq semaines à 4 °C sur l'obtention des plantes androgénétiques. Les barres des histogrammes surmontées de différentes lettres sont significativement différentes au seuil ... Lire la suite
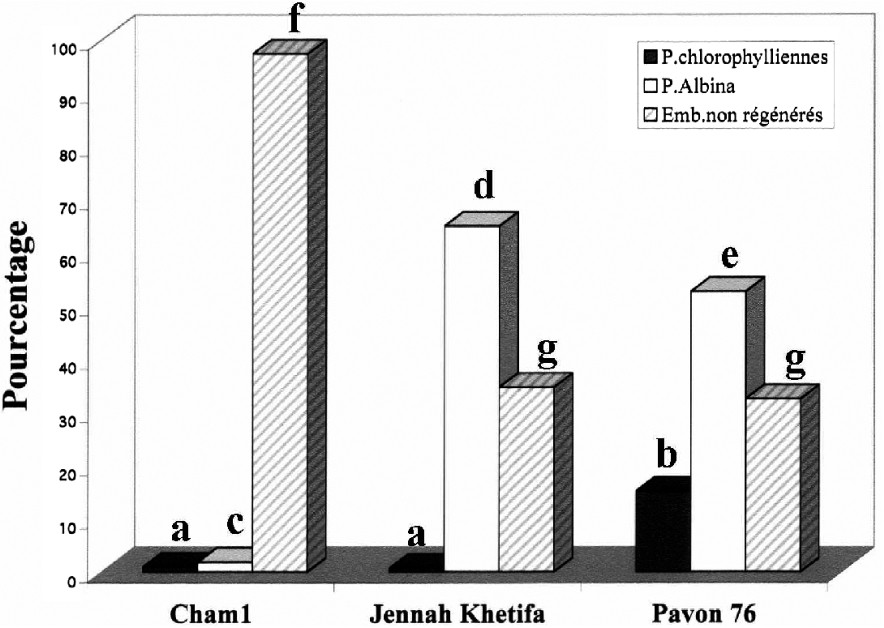
Effet du prétraitement au froid à 4 °C de cinq semaines suivi d'un séjour au Mannitol 0,1 M à 4 °C pendant 3 j sur l'obtention des plantes androgénétiques. Les barres des histogrammes surmontées de différentes lettres sont significativement différentes au seuil α de 5% et celles qui sont surmontées des mêmes lettres ne le sont pas : pourcentages de plantes vertes (a, a, b), albina (c, d, e) et des embryons non régénérés (f, g, g) chez les trois variétés de blé. Masquer
Effet du prétraitement au froid à 4 °C de cinq semaines suivi d'un séjour au Mannitol 0,1 M à 4 °C pendant 3 j sur l'obtention des plantes androgénétiques. Les barres des histogrammes surmontées de différentes lettres sont significativement différentes au seuil ... Lire la suite
Pour le cv. Pavon 76 (Tableau 3), le meilleur taux de régénération de plantes vertes (57%) a été obtenu à la suite du prétraitement de 3 j au mannitol à 4 °C, ce taux étant le double de celui obtenu chez le témoin sans aucun prétraitement et étant six fois plus important que celui obtenu avec le prétraitement de 3 j à 4 °C (8,87%). Ceci, combiné avec un taux de régénération albina égal à 27,8% et un rapport V/A égal à 2, est significativement supérieur au témoin « froid 3 j » (Tableau 3).
3.3 Fertilité en serre et niveau de ploïdie
L'étude d'un échantillon de 18 plantes chlorophylliennes de JK en chambre de culture a été menée. Parmi les 18 plantes, toutes présentaient les caractères morphologiques du blé dur, excluant ainsi toute possibilité de mélange notamment avec le témoin blé tendre. La fertilité pollinique a été analysée et également leur niveau de ploïdie. Parmi les 18 plantes, 14 étaient des haploïdes doublés (
3.4 Comportement des génotypes vis-à-vis des différents prétraitements appliqués
On remarque que les deux génotypes de blé dur testés ont donné des réponses différentes. Tout d'abord, en ce qui concerne le rendement en embryons, celui-ci a été très faible, voire nul, chez le cv. Cham1, tous prétraitements confondus, alors qu'il était plutôt élevé chez JK (Tableaux 1 et 2). Les Figs. 1 à 4 permettent de comparer les génotypes entre eux par rapport à la régénération haploïde dans les différentes conditions. Ainsi, c'est la variété Cham1 qui a donné le meilleur taux de régénération chlorophyllienne par rapport à JK. Cette dernière a, en revanche, présenté le taux de régénération de plantes albina le plus fort.
Enfin, quant au rendement global, c'est-à-dire le nombre de plantes vertes obtenues par microspore mise en culture (Fig. 5), le prétraitement le plus efficace pour les blés durs a été le choc thermique à 4 °C pendant cinq semaines. Finalement, c'est JK qui a présenté le rendement le plus élevé, puisqu'il a compensé son faible taux de régénération chlorophyllienne par une plus grande quantité d'embryons. Les prétraitements, et notamment celui au mannitol durant 3 j à 4 °C ont tous été nettement plus efficaces sur le blé tendre que sur les blés durs. Au regard des autres prétraitements, la combinaison du prétraitement au froid pendant cinq semaines, précédé ou suivi du prétraitement dans une solution de mannitol à 0,1 M, n'a pas amélioré la réponse androgénétique chez les trois variétés de blés étudiées. En effet, les résultats obtenus pour ces deux combinaisons de prétraitements ont été inférieurs à ceux qui sont obtenus avec le froid pendant cinq semaines pour les blés durs et avec le choc osmotique pour le blé tendre (Fig. 5).
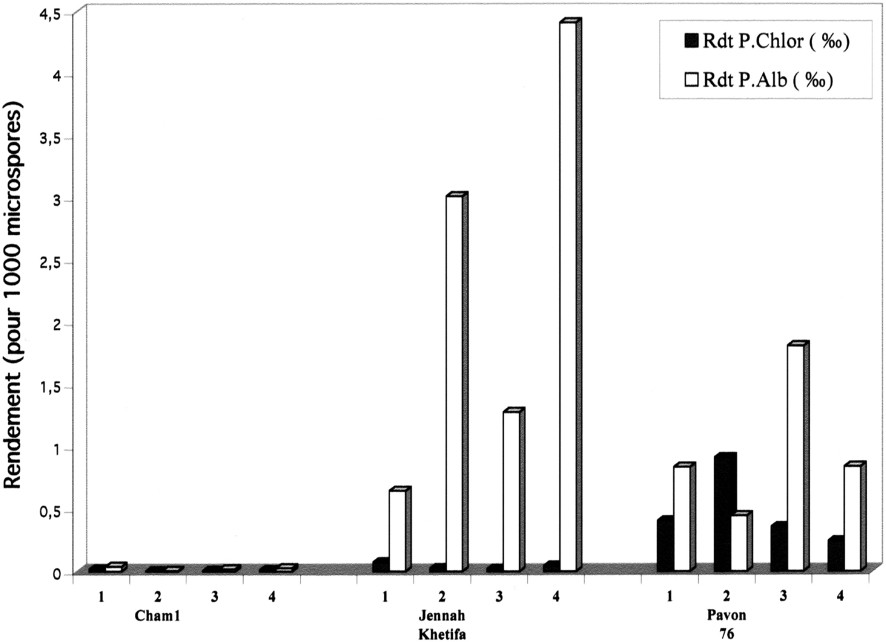
Effet des différents prétraitements sur le rendement (exprimé en pour mille) en plantes vertes et albina chez les trois variétés de blé étudiées. 1 : Prétraitement (froid pendant cinq semaines à 4 °C et à l'obscurité). 2 : Prétraitement : mannitol 0,1 M pendant 3 j à 4 °C et à l'obscurité. 3 : Combinaison de deux prétraitements : Mannitol (0,1 M à 4 °C pendant 3 j et à l'obscurité) + froid (cinq semaines à 4 °C et à l'obscurité). 4 : Combinaison de deux prétraitements : froid (cinq semaines à 4 °C et à l'obscurité) + mannitol (0,1 M à 4 °C pendant 3 j et à l'obscurité). Masquer
Effet des différents prétraitements sur le rendement (exprimé en pour mille) en plantes vertes et albina chez les trois variétés de blé étudiées. 1 : Prétraitement (froid pendant cinq semaines à 4 °C et à l'obscurité). 2 : Prétraitement : mannitol ... Lire la suite
3.5 Observations cytologiques
Nous avons réalisé des observations cytologiques en fluorescence au DAPI sur les microspores juste avant leur extraction. Les microspores témoins ou ayant été soumises à 3 j de froid ou de mannitol conservent leur état uninucléé tardif initial. En revanche, celles qui ont subi les prétraitements de longue durée étaient majoritairement (80%) binucléées, voire trinucléées, sans que l'on puisse distinguer si les parois cellulaires étaient reconstituées.
D'autres observations cytologiques en cours de culture des microspores nous ont permis de mettre en évidence une phase d'induction embryonnaire avec une évolution favorable des microspores de même ampleur chez Cham1 et chez JK. Cette phase est notamment caractérisée par un gonflement d'une partie des microspores et par une structuration rayonnante du cytoplasme autour de nombreuses vacuoles. Après la première semaine de culture, on aboutit à de nombreuses structures embryonnaires encore contenues dans l'exine. Mais, après deux semaines, alors que les embryons se forment chez JK en sortant de l'exine, la majorité de ces structures chez Cham1 n'évolue pas, les pro-embryons restant prisonniers de la paroi pollinique.
4 Discussion
Ces résultats montrent que la première phase de la culture de microspores isolées in vitro, c'est-à-dire la production d'embryons, ne devrait plus être un facteur limitant à l'utilisation pratique de cette méthode d'haplodiploïdisation chez le blé dur, au moins pour des variétés comme JK, pour autant que, par la suite, ces embryons donnent des plantes chlorophylliennes. En effet, nous avons pu obtenir chez JK, témoins et prétraitements confondus, 13 566 embryons pour
Concernant le plus faible rendement de Cham1, une des hypothèses que l'on peut avancer serait que les pro-embryons de Cham1 sortent beaucoup plus difficilement de l'exine. Il serait possible que, chez le cv. Cham1, l'exine soit beaucoup plus épaisse ou plus résistante que celle des autres génotypes de la même espèce, comme JK, empêchant ainsi la sortie des embryons, qui dégénéreraient avec le temps. D'autres hypothèses peuvent être avancées pour expliquer cet avortement des embryons : l'appauvrissement du milieu ou une pression osmotique mal adaptée.
Les deux cultivars de blé dur Cham1 et JK, donnant un total d'environ 150 plantes vertes, ont présenté tous les deux un faible rendement en régénération de plantes vertes, même si celui de Cham1 est significativement supérieur à celui de JK. En revanche, ils ont présenté un taux élevé en plantes albina, avec un total de 115 plantes albina chez Cham1 et surtout 2914 plantes albina chez JK. Ceci montre bien que l'aptitude globale à la conversion des embryons en plantes, qu'elles soient vertes ou bien albina, est forte.
Pour JK, l'utilisation du prétraitement au mannitol 0,1 M a permis une augmentation du nombre d'embryons formés par rapport aux témoins, alors qu'il n'a entraîné aucune amélioration quant à la régénération chlorophyllienne. Cette indépendance des deux phases de l'androgenèse, embryogenèse et régénération haploïde, confirme les résultats d'Agache et al. [15].
Nos résultats montrent à nouveau que ce sont des facteurs externes, et plus particulièrement des stress (froid, mannitol), qui, appliqués aux inflorescences avant l'isolement des microspores, sont les signaux déterminants de l'embryogenèse androgénétique. Notre travail a montré, pour les deux variétés de blés durs testées, une influence positive d'un prétraitement au froid sur le taux d'embryons obtenus, mais surtout sur le nombre de plantes vertes régénérées. Le pourcentage d'embryons donnant des plantes chlorophylliennes régénérées a pu atteindre la valeur de 7% pour Cham1 et de 3% pour JK (Fig. 1). Le choc osmotique, appliqué seul, semble ne pas être efficace pour la régénération chlorophyllienne. En effet, il donne un rapport V/A égal à 0 contre 0,1 et 0,38 lors d'un prétraitement au froid de cinq semaines à 4 °C, respectivement pour JK et Cham1.
Ces résultats sont en accord avec les travaux publiés chez l'orge [7], qui ont montré qu'au stade de prélèvement des épis pour la culture d'anthères, le contenu en ADN plastidial pouvait varier selon les génotypes et leur aptitude à fournir des plantes vertes ou albina. Cette observation suggère que l'origine de certaines plantes albina n'est pas liée à la culture in vitro elle-même, mais à l'état de la microspore au moment de la mise en culture. Les différents prétraitements sont ainsi susceptibles de modifier la fréquence de plantes vertes/albina en agissant sur le maintien fonctionnel des structures plastidiales des microspores. Chez le blé dur, dans les expériences relatées ici, ce serait plutôt le froid pendant cinq semaines qui agirait positivement et, chez le témoin blé tendre, le mannitol à 4 °C pendant 3 j. Une autre hypothèse serait d'avancer, comme cela a été étudié chez le tabac [16], que la concentration en sucres internes de la loge pollinique produirait un signal externe qui activerait/maintiendrait les facteurs de transcription propres à la cellule végétative. Toute carence (stress de privation, comme par exemple avec le mannitol) entraînerait alors une diminution de ces facteurs et une possibilité de retour ou de réorientation des microspores vers une embryogenèse androgénétique. De même, on peut supposer que le froid diminuerait les facteurs de transcription spécifiques de la cellule végétative. Les mécanismes fins restent cependant, à notre connaissance, encore aujourd'hui inconnus.
Notre travail, bien que concernant deux génotypes, a aussi montré combien l'effet génotypique était important, puisque ceux-ci ont présenté des comportements androgénétiques très différents. De tels résultats ont déjà été démontrés pour le blé tendre [17,18].
Enfin nous observons un taux élevé de diploïdes spontanés chez les plantes de blé dur régénérées. Au-delà du fait que ce phénomène pourrait présenter un avantage pour l'utilisation en sélection, puisqu'il éviterait le doublement chromosomique à la colchicine, comment l'expliquer ? Nous avons observé que les microspores évoluaient très doucement pendant le prétraitement au froid, et qu'après cinq semaines on observait des microspore bi- ou trinucléées, c'est-à-dire ayant déjà commencé, dans les épis, une androgenèse in vivo. On sait que le froid est un agent de doublement chromosomique au même titre que la colchicine. Il se pourrait alors qu'une partie des noyaux aient leurs chromatides bloquées en métaphase et qu'une synthèse d'ADN s'y produise à nouveau, ce qui donnerait à la reprise des divisions avec un niveau diploïde des noyaux.
5 Conclusion
Les résultats encourageants observés consécutivement au prétraitement au froid de longue durée pour le blé dur et au mannitol pour le témoin blé tendre indiquent que la méthode que nous avons adoptée est prometteuse et ouvre des perspectives intéressantes. Au-delà de l'effet génotypique, qui reste un facteur très important dans l'obtention des plantes albina, ces résultats montrent que la fréquence des plantes albina peut être réduite par l'action des prétraitements. La procédure développée ici, pour la culture de microspores isolées chez le blé dur, nous a permis d'obtenir avec succès des embryons et des plantes chlorophylliennes. Ainsi, les pourcentages d'embryons se convertissant en plantes chlorophylliennes chez Cham1 et JK sont les meilleurs jamais publiés jusqu'à présent chez cette espèce, dans ce domaine. Ainsi, en ajustant les prétraitements, on devrait pouvoir modifier significativement l'état initial des microspores et, par la suite, leur réponse in vitro, optimiser le nombre d'embryons produits et, par la suite, augmenter le nombre de plantes haploïdes chlorophylliennes. Nos travaux montrent en tout cas qu'on peut envisager, chez le blé dur, d'étudier, avec de meilleures chances de succès, de nouvelles combinaisons de prétraitements des microspores dans l'inflorescence avant leur isolement, permettant ainsi l'orientation d'une partie d'entre elles vers l'embryogenèse androgénétique. Il reste cependant à vérifier ces résultats sur de nouveaux génotypes de blé dur ce que le laboratoire a commencé à faire sur des variétés algériennes ou tunisinennes de blé dur.


