1 Introduction
Works on Atherina boyeri Risso, 1810, in the western Mediterranean Sea 〚1, 2〛 showed that the species includes two distinct groups of populations: on the one hand, an homogenous group of marine atherinids and, on the other hand, an heterogeneous group of atherinids populating lagoons, all of which have distinctive biometric characters. Based on comparable criterions, similar results have been reported in the eastern Mediterranean 〚3–6〛. Moreover, some authors 〚7–9〛 noticed clear divergences of parvalbumin isotypes (protein polymorphs of white muscle) in unpunctuated marine and lagoon atherinids.
Other investigations in the Mediterranean marine environment revealed atherinid species displaying a longitudinal line of black spots on the flanks below the silvery strip (punctuated atherinids) living with unpunctuated ones. Noticeable differences between these two types of atherinids have been described, based on meristic, metric and biochemical characters 〚10–13〛.
According to references cited above, the species Atherina boyeri might correspond to a specific complex that comprises three distinct groups of populations: two marine and a lagoon one.
In this study, characterisation of these three groups of atherinids is carried out by a multivariate analysis, computing simultaneously 16 samples and 87 meristic and metric parameters. In addition, molecular analyses (sequential study of a part of gene cytb structure) were also carried out 〚14〛 and results obtained are compared to morphological data presented below.
2 Materials and methods
In total 1600 specimen were sampled (Fig. 1). Three hundred ‘marine punctuated atherinids’, living essentially in rocky milieus, were collected in Tunisia at Cap Zebib (Z) and in Corsica at Pinarello (N) and Lavezzi (O), whereas 600 ‘unpuctuated marine atherinids’, inhabiting both sandy or rocky bottoms, were collected in Tunisia at Tabarka (R), Hergla (H) and Mahdia (F), in Corsica at Pinarello (I) and in Languedoc at Sète (S) and Palavas (A). Lagoon atherinids were picked in seven Mediterranean lagoons: in Tunisia, lagoons of Tunis (U), Bizerte (D) and Ichkeul (E); in Corsica: Biguglia (B); Lion Gulf: Thau (T), Mauguio and Camargue (C). In each sample station, 100 specimens were sampled and preserved in formalin at 10%. For each individual, we proceeded to the counting of the different anatomical pieces (Fig. 2) – number of dorsal (D1, D2), anal (AN) and pectoral (PE) fins rays, of longitudinal line scales (SC), of vertebrae (VE), of upper (UG) and lower (LG) gillrakers of the first left branchial arch (TG = UG + LG). We carried out five cephalic measurements (MZ = distance from the end of the muzzle to the beginning of the eye, OE = horizontal diameter of the eye, G–C = distance from the end of the eye to the opercula posterior edge, O–O = distance between two eyes and HD = distance from the end of the muzzle to the opercula posterior edge) and eight body measurements (SL = standard length of fish, MD1 = distance from the end of the muzzle to the beginning of the first dorsal fin location, MD2 = distance from the end of the muzzle to the beginning of the second dorsal fin location, MA = distance from the end of the muzzle to the beginning of the anal fin location, D1D2 = distance between two dorsal fins, BH = Height of the body taken at the level of the pectoral fins insertion, HPc = Height of the caudal peduncle at the level of the caudal fin insertion base, BD1 = length of the first dorsal fin insertion). From these measurements, we calculated:
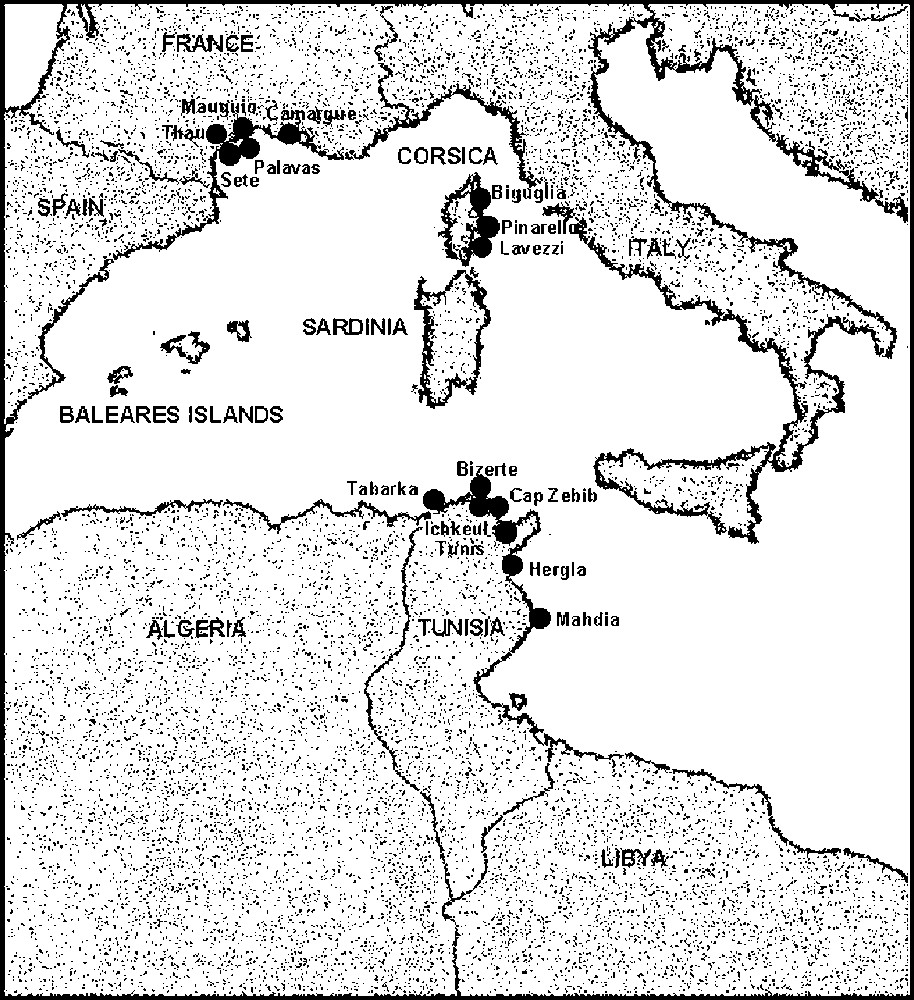
Geographical distribution of the different atherinid-harvesting stations.
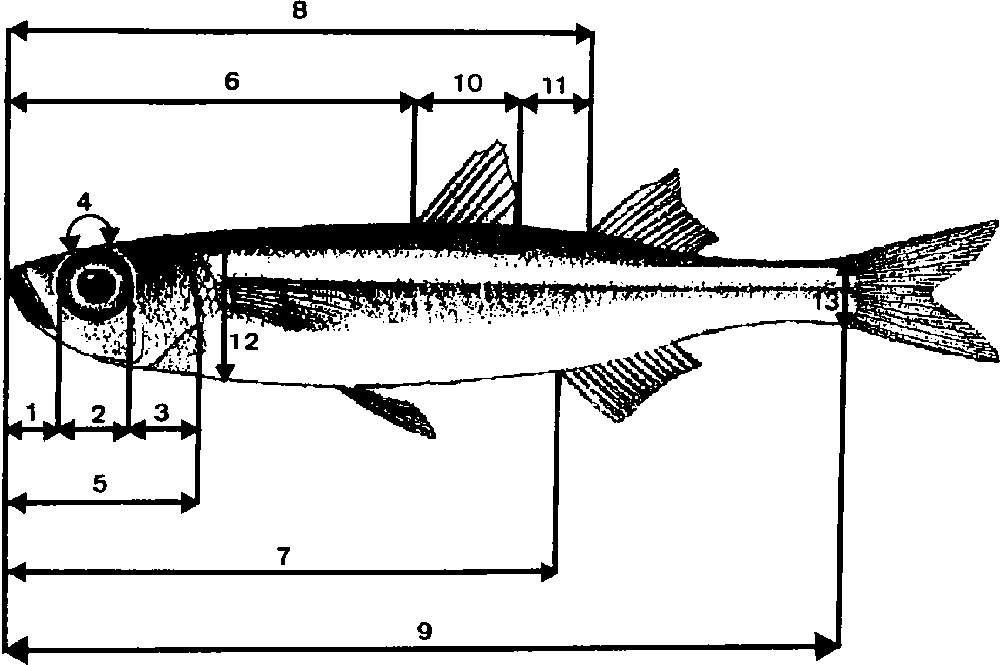
Cephalic and body measurements: 1 = muzzle (MZ); 2 = eye (OE); 3 = gill cover (G–C); 4 = eye inside (O–O); 5 = head (HD); 6 = dorsal1 meadow (MD1); 7 = anal meadow (MA); 8 = Dorsal2 meadow (MD2); 9 = standard length (SL); 10 = dorsal1 basis (BD1); 11 = dorsals inside (D1D2); 12 = body Height (BH); 13 = peduncle caudal Height (HPc).
- • 10 cephalic ratios: O–O/HD, O–O/G–C, O–O/OE, OE/HD, OE/G–C, MZ/O–O, MZ/OE, MZ/HD, G–C/HD, MZ/G–C;
- • 20 eight body ratios: BH/MD1, BH/MD2, BH/MA, BH/SL, HPc/MD1, HPc/MD2, HPc/MA, HPc/SL, HPc/D1D2, HPc/BH, MD1/MA, MD1/MD2, MA/MD2, MD1/SL, MD2/SL, MA/SL, BD1/MD1, BD1/MD2, BD1/MA, BD1/SL, BD1/BH, BD1/HPc, BD1/D1D2, D1D2/MD1, D1D2/MD2, D1D2/MA, D1D2/SL, D1D2/BH;
- • 40 body-cephalic ratios: O–O/SL, O–O/MD2, O–O/MA, O–O/MD1, O–O/D1D2, OE/MA, OE/SL, OE/MD2, OE/MD1, HD/SL, HD/MA, HD/MD2, G–C/SL, G–C/MD2, G–C/MA, HD/MD1, O–O/BH, HPc/MZ, G–C/MD1, BH/HD, G–C/D1D2, BD1/O–O, HPc/O–O, MZ/BH, BD1/OE, BD1/G–C, G–C/BH, BD1/HD, HPc/G–C, HPc/HD, OE/BH, OE/D1D2, MZ/D1D2, MZ/SL, MZ/MD2, MZ/MA, MZ/MD1, D1D2/HD, HPc/OE, BD1/MZ.
Multivariate analyses were applied in order to better discriminate samples studied, including the canonical discriminative procedure (CAN-DISC) of references 〚15, 16〛, which helps better discriminating samples of a same or of different species 〚17〛; it led to a graphic representation of the different samples in a plane defined by the various canonical components taken two by two 〚18〛. The table with the meristic and metric parameters is available upon request.
3 Results
Results obtained are reported in Table 1, and plotted in Fig. 3.
Definition of the first three axes of the discriminative canonical analysis by meristic and metric parameters. MZ = muzzle; OE = eye; G–C = gill cover; O–O = eye inside; HD = head; MD = dorsal1 meadow; MD2 = dorsal2 meadow; MA = anal meadow; SL = standard length; BD1 = dorsal1 basis; D1D2 = dorsals inside; BH = body Height; HPc = peduncle caudal Height.
| CAN 1 | CAN 2 | CAN 3 | CAN 1 | CAN 2 | CAN 3 | ||
| Vertebrae | 0.6909 | MZ/OE | 0.4716 | ||||
| Scales | 0.6880 | MZ/OP | 0.3824 | ||||
| U. Gillrakers | 0.6315 | MZ/O–O | 0.6323 | ||||
| L. Gillrakers | 0.7106 | MZ/T | 0.5037 | ||||
| T. Gillrakers | 0.7065 | OE/OP | 0.5918 | ||||
| Pectorals | 0.4913 | OE/T | 0.5583 | ||||
| Dorsal 1 | 0.3359 | OP/T | –0.5339 | ||||
| Dorsal 2 | 0.2869 | O–O/OE | –0.4626 | ||||
| Anal | 0.1301 | O–O/OP | 0.6664 | ||||
| O–O/T | –0.6250 | ||||||
| PD1/PD2 | 0.7086 | HC/LS | –0.6330 | ||||
| PD1/PA | 0.6118 | HPc/PD1 | –0.4619 | ||||
| PD1/LS | 0.7788 | HPc/PD2 | 0.5134 | ||||
| PD2/LS | 0.5103 | HPc/PA | 0.4775 | ||||
| PA/PD2 | 0.3503 | HPc/D1D2 | 0.5848 | ||||
| PA/LS | 0.5194 | HPc/HC | 0.5924 | ||||
| D1D2/PD1 | –0.3987 | HPc/LS | 0.5960 | ||||
| D1D2/PD2 | –0.3361 | BD1/PD1 | –0.6296 | ||||
| D1D2/PA | –0.3750 | BD1/PD2 | –0.5779 | ||||
| D1D2/HC | –0.5151 | BD1/PA | –0.5831 | ||||
| D1D2/LS | –0.2923 | BD1/D1D2 | –0.4136 | ||||
| HC/PD1 | –0.6561 | BD1/HC | –0.6427 | ||||
| HC/PD2 | –0.6530 | BD1/HPc | –0.7052 | ||||
| HC/PA | –0.6543 | BD1/LS | –0.5439 | ||||
| MZ/PD1 | 0.3377 | O–O/PA | 0.6671 | ||||
| MZ/PD2 | 0.5456 | O–O/D1D2 | 0.6851 | ||||
| MZ/PA | 0.5259 | O–O/HC | 0.5833 | ||||
| MZ/D1D2 | 0.4882 | O–O/LS | 0.7275 | ||||
| MZ/HC | 0.5783 | T/PD1 | 0.4233 | ||||
| MZ/LS | 0.6017 | T/PD2 | 0.6574 | ||||
| OE/PD1 | 0.6148 | T/PA | 0.6212 | ||||
| OE/PD2 | 0.7148 | T/LS | 0.7229 | ||||
| OE/PA | 0.6965 | BD1/MZ | –0.6794 | ||||
| OE/D1D2 | 0.6209 | BD1/OE | –0.7187 | ||||
| OE/HC | 0.5412 | BD1/OP | –0.6221 | ||||
| OE/LS | 0.7503 | BD1/O–O | –0.7375 | ||||
| OP/PD1 | –0.4168 | BD1/T | –0.6941 | ||||
| OP/PD2 | –0.4666 | D1D2/T | –0.5507 | ||||
| OP/PA | –0.4792 | HC/T | –0.6011 | ||||
| OP/D1D2 | 0.3935 | HPc/MZ | –0.5042 | ||||
| OP/HC | 0.4614 | HPc/OE | –0.2997 | ||||
| OP/LS | –0.4305 | HPc/OP | 0.4478 | ||||
| O–O/PD1 | –0.6761 | HPc/O–O | –0.4516 | ||||
| O–O/PD2 | 0.6892 | HPc/T | –0.2906 |
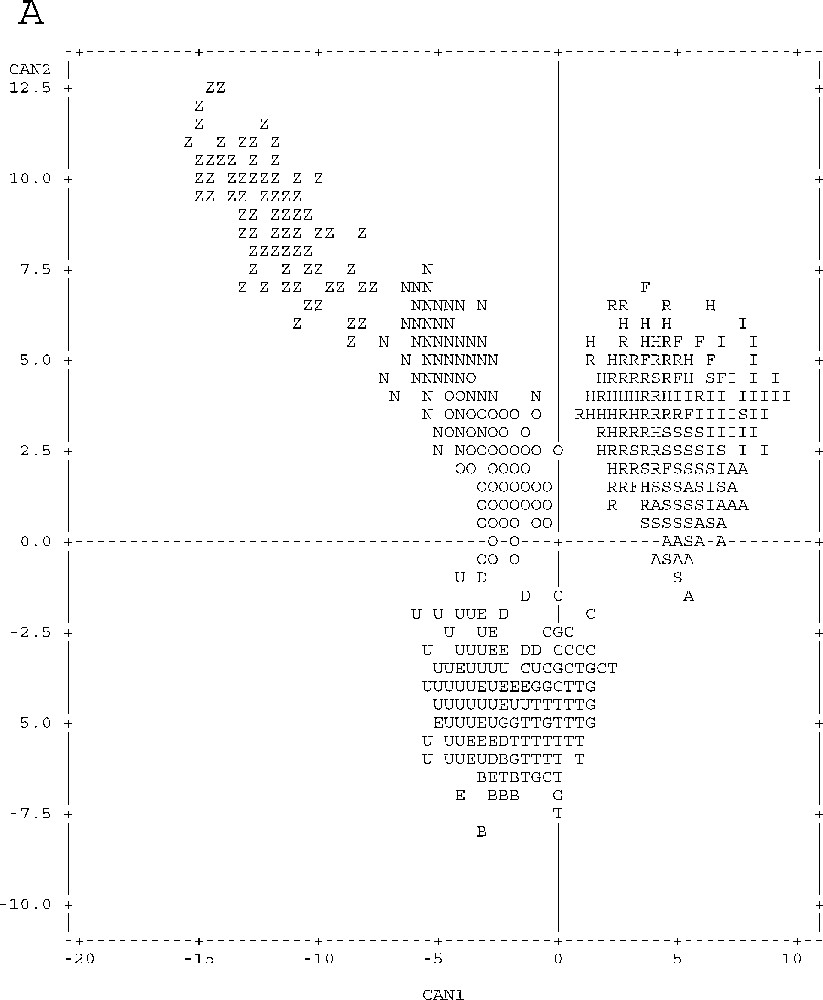
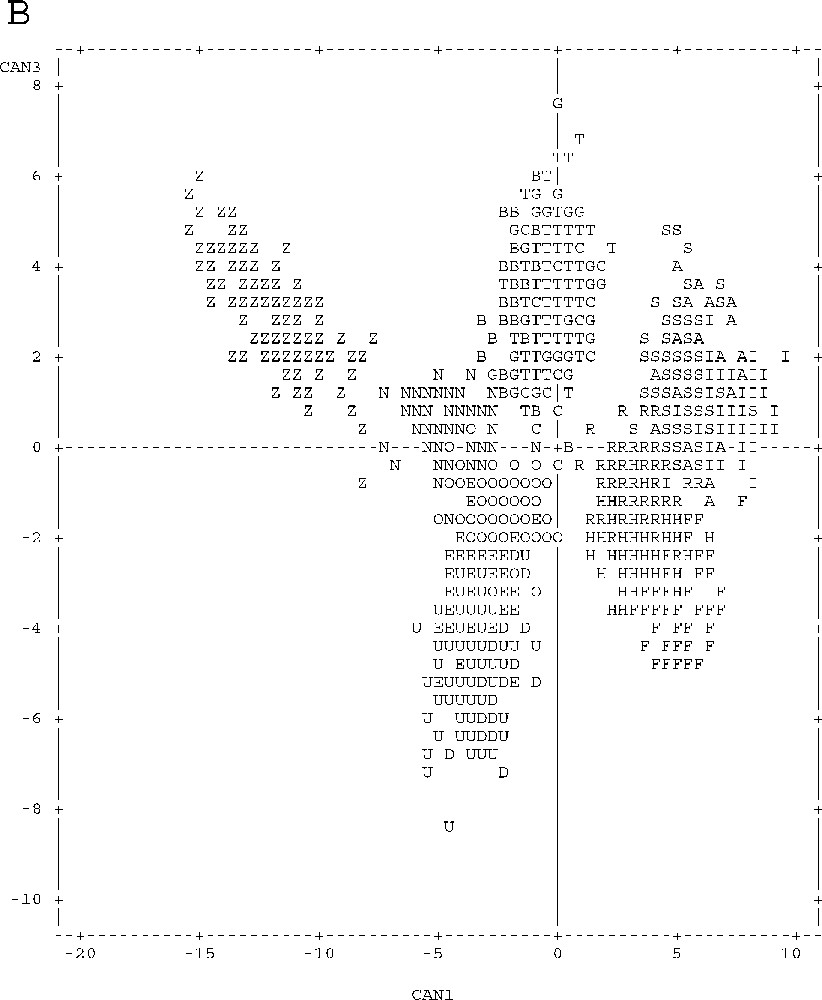
Graphical representation of point individuals in the discriminative canonical analysis of meristic and metric parameters according to axes 1 and 2 (Fig. 3A) and according to axes 1 and 3 (Fig. 3B). Unpunctuated atherinids: Sète (S), Palavas (A), Pinarello (I), Tabarka (R), Hergla (H) and Madhia (F). Punctuated atherinids: Pinarello (N), Lavezzi Islands (O) and Cap Zebib (Z). Lagoon atherinids: Thau (T), Mauguio (G), Camargue (C), Biguglia (B), Ichkeul (E), Bizerte (D) and Tunis (U).
The first three axes of the discriminative canonical analysis absorb 75.29% of the global variation:
- • the first canonical component, with 34.25% total inertia, is defined by 28 parameters: 14 of which are positively and 14, negatively positioned;
- • axis 2 (29.64%) is correlated with 51 characters, among which 33 contribute positively and 18 negatively, along with this component;
- • axis 3 (11.39%) is defined by eight variables (four contributing positively, and four negatively).
The projection of canonical variables on the plane defined by axes 1–2 and 1–3 (Fig. 3) helps drawing a clear distinction between marine punctuated atherinids (Z–N–O), unpunctuated marine atherinids (S–A–I–R–H–F) and lagoon atherinids (T–G–C–B–E–D–U) according to axis 1.
With respect to the remaining atherinid groups, punctuated marine atherinids (Z–N–O) have the peculiarity of relatively higher individual values of parameters that define the negative parts of axis 1 and positive parts of axes 2 and 3, and low values of parameters correlated with the opposite parts of these three axes (Table 1, Fig. 3).
Unpunctuated marine atherinids (S–A–I–R–H–F) gave specifically the highest values of individual parameters defining the positive part of axis 1, and the lowest values defining, negatively, this axis (Table 1, Fig. 3).
Lagoon atherinids (T–G–C–B–E–D–U) are characterised by high values of individual parameters that define the negative part of axis 2, and low values of parameters correlated with the opposite part of this axis (Table 1, Fig. 3).
A geographical segregation is observed for each of all of three groups (Table 1, Fig. 3):
- • Tunisia (Z) and Corsica (N–O) punctuated marine atherinids part according to axes 1, 2 and 3; Tunisian atherinids present, by comparison with the Corsica ones, the highest individual parameters defining the negative part of axis 1, and the positive parts of axes 2 and 3, and the lowest values for parameters correlated with the opposite parts of these three axes;
- • Tunisia unpunctuated marine atherinids (R–H–F) and those of Languedoc and Corsica (S–A–I) are different according the axis 3; the latter species presents the highest values of individual parameters accounting for the positive part of axis 3, and the lowest values are correlated with the negative part of this axis.
Lagoon atherinid (T–G–C–B–E–D–U) specimens also show geographical disparities similar to those noticed in marine unpunctuated atherinids (S–A–I–R–H–F). For atherinids from the Languedoc and Corsica (T–G–C–B), ratios defining the positive part of axis 3 show higher values, whereas ratios correlated with its negative part are higher in the Tunisian atherinids (E–D–U).
4 Discussion and conclusion
The study of atherinids from the Mediterranean marine and lagoon environments in eastern and northern coastal milieus of Tunisia, Corsica, and Languedoc, corroborates initial results of previous workers 〚1–5, 10, 11, 13〛. Three distinct groups of atherinids are clearly individualised, based on metric and meristic parameters, independently of the overall geographical distribution.
Previous works had already biochemically evidenced the originality of the atherinids populating lagoons, as compared to unpunctuated marine ones 〚7–9, 12〛.
In the marine environment, colour character suggests some disparities between sympatric and subsympatric specimens: presence of black spots on the longitudinal line, along the flanks, below the silvery strip. The use of meristic, metric and biochemical characters of specimen 〚10–13〛 confirmed the discriminant value of this chromatic character, with evidenced morphologic differences in the size of eyes and muzzle, interorbital space, position of dorsal fins, size of the first dorsal fin, Height of both body and caudal peduncle.
The study of the sequencing of a part of the cytochrome b gene 〚14〛 and the congruence of the results obtained by the study of metric and meristic parameters valid the existence of three distinct groups in the complex of ‘Atherina boyeri’. These results corroborate the suggestions of some authors 〚19, 20〛, who consider that A. boyeri is at the threshold of a speciation phenomenon. From our results, the three groups of atherinids described have overpassed the species stage ‘in statu nascendi’ with sufficiently marked, significant and highly divergent characters, which supports the idea that each one of these groups should be raised as the new species.
It is therefore clear that in the Mediterranean Sea, in addition to Atherina presbyter (rare and populating the far west of the western basin), A. hepsetus and A. boyeri, there exists two other species of atherinids, as we propose them to be baptised Atherina punctata and Atherina lagunae. The respective diagnoses of the new two species and A. boyeri, are as follows.
Atherina punctata
- • Vertebrae = (41) 43 (46).
- • Scales in longitudinal line = (41) 43 (46).
- • Gillrakers = Upper: (7) 8 (9). Lower: (19) 21 (24). Total: (26) 29 (33).
- • Pectorals = I + (13) 14 (17).
- • Dorsal 1 = (VI) VII (VIII).
- • Dorsal 2 = I + (10) 11 (12).
- • Anal = I + (11) 13 (15).
- • Muzzle (MZ) = (50) 67/100 (93) OE. (40) 67/100 (87) G–C. (57) 80/100 (104) O–O. (19) 25/100 (31) HD. (41) 50/100 (86) D1D2. (26) 33/100 (46) BH. (12) 15/100 (20) MD1. (9) 11/100 (15) MD2. (9) 11/100 (16) MA. (6) 8/100 (11) SL.
- • Eye (OE) = (55) 100/100 (146) G–C. (27) 33/100 (46) HD. (58) 75/100 (104) D1D2. (36) 50/100 (59) BH. (17) 20/100 (27) MD1. (12) 17/100 (20) MD2. (13) 17/100 (20) MA. (8) 10/100 (14) SL.
- • Gill–Cover (G–C) = (31) 40/100 (50) HD. (68) 83/100 (113) D1D2. (46) 50/100 (65) BH. (20) 22/100 (33) MD1. (14) 17/100 (25) MD2. (15) 17/100 (25) MA. (10) 11/100 (18) SL.
- • Eye–Inside (O–O) = (75) 100/100 (129) OE. (62) 80/100 (112) G–C. (27) 33/100 (43) HD. (53) 67/100 (92) D1D2. (36) 44/100 (59) BH. (15) 22/100 (28) MD1. (11) 13/100 (20) MD2. (11) 13/100 (22) MA. (8) 10/100 (15) SL.
- • Head (HD) = (51) 62/100 (70) MD1. (38) 40/100 (51) MD2. (39) 45/100 (55) MA. (26) 33/100 (37) SL.
- • Dorsal 1 Meadow (MD1) = (68) 73/100 (78) MD2. (71) 75/100 (83) MA. (48) 50/100 (56) SL.
- • Dorsal 2 Meadow (MD2) = (67) 70/100 (73) SL.
- • Anal Meadow (MA) = (92) 97/100 (99) MD2. (64) 67/100 (71) SL.
- • Dorsals–Inside (D1D2) = (21) 29/100 (35) MD1. (16) 20/100 (26) MD2. (16) 20/100 (27) MA. (49) 60/100 (76) BH. (11) 14/100 (18) SL. (33) 50/100 (58) HD.
- • Body Height (BH) = (38) 43/100 (54) MD1. (28) 33/100 (40) MD2. (29) 33/100 (41) MA. (20) 22/100 (28) SL. (62) 75/100 (86) HD.
- • Peduncle caudal Hight (HPc) = (12) 17/100 (19) MD1. (9) 11/100 (14) MD2. (9) 12/100 (15) MA. (45) 50/100 (75) D1D2. (31) 36/100 (42) BH. (6) 8/100 (10) SL. (83) 100/100 (134) MZ. (62) 77/100 (94) OE. (52) 67/100 (84) G–C. (59) 85/100 (96) O–O. (23) 27/100 (31) HD.
- • Dorsal 1–Basis (BD1) = (5) 11/100 (15) MD1. (4) 8/100 (11) MD2. (4) 8/100 (12) MA. (20) 40/100 (58) D1D2. (13) 25/100 (32) BH. (42) 67/100 (92) HPc. (3) (5/100) 8 SL. (42) 75/100 (104) MZ. (33) 45/100 (77) OE. (26) 50/100 (66) G–C. (36) 50/100 (77) O–O. (11) 20/100 (26) HD.
Atherina lagunae
- • Vertebrae = (39) 44 (47).
- • Scales in longitudinal line = (39) 45 (48).
- • Gillrakers = Upper: (6) 7 (9). Lower: (16) 19 (22). Total: (23) 26 (30).
- • Pectorals = I + (12) 14 (16).
- • Dorsal 1 = (V) VII (X).
- • Dorsal 2 = I + (9) 11 (14).
- • Anal = I + (11) 13 (16).
- • Muzzle (MZ) = (62) 80/100 (107) OE. (42) 60/100 (84) G–C. (64) 100/100 (136) O–O. (20) 25/100 (32) HD. (27) 50/100 (62) D1D2. (23) 33/100 (50) BH. (10) 14/100 (19) MD1. (7) 10/100 (13) MD2. (7) 10/100 (14) MA. (5) 7/100 (9) SL.
- • Eye (OE) = (54) 75/100 (90) G–C. (25) 33/100 (36) HD. (36) 50/100 (82) D1D2. (31) 50/100 (58) BH. (14) 17/100 (23) MD1. (9) 11/100 (16) MD2. (10) 12/100 (17) MA. (6) 8/100 (11) SL.
- • Gill–Cover (G–C) = (37) 43/100 (50) HD. (55) 80/100 (105) D1D2. (48) 67/100 (87) BH. (20) 25/100 (33) MD1. (13) 17/100 (22) MD2. (14) 17/100 (23) MA. (9) 11/100 (15) SL.
- • Eye–Inside (O–O) = (60) 100/100 (115) OE. (41) 67/100 (80) GC. (21) 25/100 (34) HD (32) 50/100 (71) D1D2. (27) 40/100 (50) BH. (10) 17/100 (20) MD1. (7) 11/100 (14) MD2. (7) 11/100 (15) MA. (4) 7/100 (10) SL.
- • Head (HD) = (48) 58/100 (70) MD1. (32) 40/100 (47) MD2. (33) 40/100 (51) MA. (22) 27/100 (33) SL.
- • Dorsal 1 Meadow (MD1) = (62) 67/100 (75) MD2. (64) 71/100 (81) MA. (43) 50/100 (54)SL.
- • Dorsal 2 Meadow (MD2) = (66) 70/100 (77) SL.
- • Anal Meadow (MA) = (90) 95/100 (100) MD2. (61) 67/100 (73) SL.
- • Dorsals–Inside (D1D2) = (23) 33/100 (45) MD1. (16) 20/100 (29) MD2. (17) 22/100 (30) MA. (56) 80/100 (111) BH. (11) 17/100 (20) SL. (40) 50/100 (79) HD.
- • Body Height (BH) = (32) 40/100 (53) MD1. (22) 27/100 (37) MD2. (23) 27/100 (39) MA. (15) 17/100 (25) SL. (55) 67/100 (92) HD.
- • Peduncle caudal Height (HPc) = (11) 14/100 (17) MD1. (8) 10/100 (12) MD2. (8) 10/100 (12) MA. (32) 50/100 (66) D1D2. (27) 33/100 (43) BH. (5) 7/100 (8) SL. (73) 100/100 (130) MZ. (64) 80/100 (100) OE. (44) 60/100 (74) G–C. (74) 100/100 (136) O–O. (20) 25/100 (31) HD.
- • Dorsal 1–Basis (BD1) = (9) 17/100 (29) MD1. (6) 10/100 (20) MD2. (6) 11/100 (22) MA. (28) 50/100 (106) D1D2. (21) 40/100 (82) BH. (68) 100/100 (206) HPc. (4) 8/100 (14) SL. (65) 100/100 (206) MZ. (55) 100/100 (163) OE. (38) 60/100 (122) G–C. (56) 100/100 (195) O–O. (17) 25/100 (52) HD.
Atherina boyeri
- • Vertebrae = (43) 45 (48).
- • Scales in longitudinal line = (43) 46 (48).
- • Gillrakers = Upper: (8) 9 (11). Lower: (24) 27 (30). Total: (32) 37 (41).
- • Pectorals = I + (13) 15 (17).
- • Dorsal 1 = (6) 8 (10).
- • Dorsal 2 = I + (9) 11 (13).
- • Anal = I + (12) 13 (16).
- • Muzzle (MZ) = (61) 83/100 (100) OE. (47) 67/100 (84) G–C. (64) 100/100 (135) O–O. (21) 25/100 (32) HD. (32) 50/100 (71) D1D2. (25) 40/100 (58) BH. (11) 17/100 (19) MD1. (7) 11/100 (14) MD2. (8) 11/100 (14) MA. (5) 8/100 (10) SL.
- • Eye (OE) = (59) 80/100 (96) G–C. (28) 33/100 (37) HD. (43) 60/100 (90) D1D2. (34) 50/100 (65) BH. (13) 20/100 (24) MD1. (9) 13/100 (17) MD2. (10) 13/100 (18) MA. (6) 8/100 (12) SL.
- • Gill–Cover (G–C) = (36) 40/100 (48) HD. (60) 80/100 (103) D1D2. (48) 60/100 (76) BH. (18) 23/100 (29) MD1. (13) 16/100 (20) MD2. (14) 16/100 (22) MA. (9) 11/100 (15) SL.
- • Eye Inside (O–O) = (67) 83/100 (119) OE. (56) 67/100 (87) G–C. (23) 25/100 (37) HD. (39) 50/100 (68) D1D2. (31) 40/100 (48) BH. (12) 17/100 (20) MD1. (8) 11/100 (14) MD2. (9) 12 /100 (15) MA. (6) 8/100 (10) SL.
- • Head (HD) = (45) 57/100 (68) MD1. (33) 40/100 (49) MD2. (34) 40/100 (50) MA. (23) 29/100 (34) SL.
- • Dorsal 1 Meadow (MD1) = (66) 71/100 (76) MD2. (70) 75/100 (79) MA. (45) 50/100 (54) SL.
- • Dorsal 2 Meadow (MD2) = (66) 70/100 (75) SL.
- • Anal Meadow (MA) = (90) 95/100 (100) MD2. (64) 67/100 (71) SL.
- • Dorsals–Inside (D1D2) = (22) 32/100 (37) MD1. (16) 20/100 (26) MD2. (16) 22/100 (27) MA. (58) 75/100 (100) BH. (11) 16/100 (19) SL. (38) 50/100 (71) HD.
- • Body Height (BH) = (30) 40/100 (48) MD1. (21) 26/100 (35) MD2. (23) 27/100 (36) MA. (15) 19/100 (25) SL. (51) 67/100 (88) HD.
- • Peduncle caudal Height (HPc) = (10) 13/100 (18) MD1. (7) 11/100 (13) MD2. (7) 11/100 (14) MA. (39) 50/100 (63) D1D2. (30) 36/100 (45) BH. (5) 8/100 (9) SL. (71) 100/100 (140) MZ. (60) 75/100 (108) OE. (51) 60/100 (76) G–C. (71) 100/100 (110) O–O. (20) 25/100 (32) HD.
- • Dorsal 1–Basis (BD1) = (7) 11/100 (20) MD1. (5) 10/100 (14) MD2. (6) 11/100 (15) MA. (27) 50/100 (77) D1D2. (22) 33/100 (49) BH. (61) 100/100 (128) HPc. (4) 7/100 (10) SL. (52) 100/100 (140) MZ. (39) 67/100 (107) OE. (36) 60/100 (83) G–C. (56) 100/100 (128) O–O. (13) 25/100 (33) HD.
Version abrégée
Atherina boyeri forme un complexe taxonomique, qui a été divisé par certains auteurs en diverses espèces et sous-espèces, ces confusions taxonomiques venant du fait que de grandes différences au niveau des caractères métriques et méristiques sont observées. Les travaux sur A. boyeri de Méditerranée occidentale ont montré que cette espèce forme des populations distinctes, qui peuvent être séparées en deux grands groupes homogènes, l’un étant constitué par les individus marins et l’autre par les individus lagunaires. L’identification de ces deux groupes était à ce jour essentiellement basée sur des caractères méristiques. De plus, des travaux récents ont montré que, sur les côtes de France (Languedoc, Camargue et Corse), d’Italie (Sardaigne et Sicile) et de Tunisie, le groupe marin se différencie en deux populations partiellement sympatriques. Cette distinction est basée sur la coloration, la morphologie et les caractéristiques biochimiques. Les individus de la nouvelle population se différencient des autres athérines marines précédentes par une ligne de points noirs située le long des flancs au-dessous de la bande argentée, des yeux remarquablement développés, un espace interorbitaire large, un museau court, un corps robuste et trapu, des nageoires dorsales rejetées à l’arrière, un nombre plus faible de vertèbres et de branchiospines, ainsi que par l’absence de parvalbumine V. L’analyse complète des données morphoanatomiques était donc indispensable avant d’affirmer le statut exact de ces trois groupes.
L’analyse canonique discriminante de 87 paramètres biométriques a été réalisée chez les athérines marines et lagunaires du complexe « Atherina boyeri » de Méditerranée, d’origines française et tunisienne. Au total, 1600 individus ont été récoltés, soit 100 par stations ; 300 athérines marines ponctuées provenant de Tunisie et de Corse ont été pêchées sur des fonds rocheux, 600 athérines marines non ponctuées ont été collectées en Tunisie et France (Corse et Languedoc) et 700 athérines ont été capturées dans sept lagunes tunisiennes ou françaises (Corse et Languedoc). Les trois premiers axes de l’analyse canonique discriminante absorbent 75,29% de la variation globale. La projection des variables canoniques sur les plans définis par les trois axes met en évidence une nette séparation entre les athérines marines ponctuées, les athérines marines non ponctuées et les athérines lagunaires. Les athérines marines non ponctuées se distinguent des athérines marines ponctuées et des athérines lagunaires par un nombre plus élevé de vertèbres, d’écailles en ligne longitudinale, de branchiospines, de rayons aux nageoires pectorales, dorsales et anale. Les athérines marines ponctuées diffèrent des deux précédentes par la présence d’une ligne de points noirs située le long des flancs au-dessous de la bande argentée. La prise en considération des caractères métriques et méristiques de ces spécimens a confirmé la valeur discriminante du caractère chromatique, en mettant en évidence des différences morphologiques concernant l’œil, l’espace interorbitaire, le préorbitaire, la position des nageoires dorsales, la taille de la première nageoire dorsale, la hauteur du corps et du pédoncule caudal. De plus, leur museau est court et leur corps robuste et trapu. Par ailleurs, une ségrégation géographique est observée au sein de chacun des trois groupes, dans lesquels les athérines tunisiennes se différencient des françaises, les différences les plus importantes étant observées chez les athérines lagunaires.
Les résultats de nos analyses au sein des populations d’A. boyeri sont en accord avec tous les autres travaux, qui ont démontré le fort taux de plasticité phénotypique au sein de ce complexe taxonomique. Les différences phénotypiques sont telles que de nombreux auteurs ont suggéré que ce complexe pourrait être constitué d’au moins une vingtaine d’espèces. Un important critère dans la reconnaissance d’espèce est l’isolement reproductif, ce qui semble confirmé par l’ensemble des données morphoanatomiques ; il est de plus intéressant de noter que cette barrière reproductive existe aussi au sein des populations marines ponctuées/non ponctuées, en dépit du fait qu’elles vivent en sympatrie. Donc, notre étude sur des athérines provenant de la mer et des lagunes des côtes nord et est de la Tunisie, de Corse et du Languedoc confirme les résultats partiels obtenus par de précédents travaux. Trois grands groupes s’individualisent nettement, tant par les caractères métriques que méristiques, quelle que soit la localisation géographique. De plus, des travaux antérieurs avaient déjà mis en évidence, sur le plan biochimique (parvalbumine), l’originalité des populations lagunaires par rapport aux athérines marines non ponctuées. Ce travail a par ailleurs été couplé à une autre étude portant sur l’analyse des variations de séquence d’une portion du gène mitochondrial codant le cytochrome b. Dans ce travail moléculaire, l’ensemble des résultats confirme la présence de trois groupes fortement individualisés au sein des athérines étudiées.
En conclusion, notre analyse des caractères métriques et méristiques, qui est confortée par un autre travail portant sur l’étude des variations au sein du gène mitochondrial codant le cytochrome b ainsi que par des travaux biochimiques (parvalbumine), suggère donc la présence de trois espèces, dont deux sont partiellement sympatriques. Certaines populations du complexe A. boyeri sont donc engagées dans des phénomènes de spéciation et les trois sous-groupes étudiés ont dépassé le stade d’espèce « in statu nascendi » ; les divergences sont suffisamment significatives pour admettre que chacun d’eux atteint le niveau spécifique. Donc, en Méditerranée, en plus de l’espèce Atherina presbyter (rare et certainement localisée à l’extrême ouest du bassin occidental) et d’A. hepsetus, le complexe A. boyeri peut être divisé en trois espèces. L’appellation A. boyeri est conservée uniquement pour les individus lagunaires non ponctués ; nous proposons de nommer les populations ponctuées Atherina punctata et Atherina laguna pour les individus lagunaires. Les diagnoses de ces espèces sont publiées dans cet article.



