1 Introduction
La cicadelle Psammotettix alienus (Dhb) est un homoptère ravageur des cultures céréalières. Cet insecte suceur de sève crée des nuisances du fait de son taux de multiplication et de la transmission du virus du nanisme du blé 〚1〛. Des observations de terrain ont montré que des populations denses de cette cicadelle ne coïncident jamais dans une même parcelle de céréales avec des populations importantes d’un autre ravageur et vecteur du virus de la jaunisse nanisante de l’orge : le puceron Rhopalosiphum padi (J.-P. Moreau, comm. pers.). Alla 〚2〛 a démontré au laboratoire que la cicadelle agissait à distance sur la physiologie du puceron. Une population artificielle (sept individus) de cicadelles séparées des pucerons par une fine gaze induit une diminution de production de juvéniles chez ces derniers. Le mode d’action à distance suggère l’intervention d’une substance sémiochimique. En effet, chez certaines espèces, il a été démontré qu’en condition de compétition, un insecte peut modifier ou inhiber la physiologie ou les comportements de l’autre insecte par le biais de substances sémiochimiques 〚3–5〛. L’hypothèse de l’émission par la cicadelle d’une substance volatile agissant à distance sur le puceron a été étudiée et les résultats présentés ci-après portent sur l’identification de composés originaux.
2 Matériel et méthodes
2.1 Technique d’élevage des insectes
Les cicadelles sont issues d’un élevage au laboratoire obtenu à partir de quelques individus collectés sur le terrain (Yvelines). L’élevage de masse est maintenu sur des plantules de blé (cv « Étoile de Choisy ») dans les conditions suivantes : 24 °C, 16 h de jour, 8 h de nuit et une humidité relative de 80%. Au stade coléoptile, trois à quatre plants sont déposés dans des pots en plastique (4,5 cm de diamètre et 10,5 cm de hauteur) contenant de la vermiculite, de l’eau et une solution nutritive. Un trou dans le couvercle du pot permet le passage des plants, sur lesquels sont installés cinq à huit individus. L’ensemble est recouvert par un sachet en cellophane. Les plants sont renouvelés toutes les semaines et sont conservés pendant 1 mois pour permettre l’éclosion des œufs.
2.2 Collecte des produits volatils
Les composés volatils produits par les cicadelles sont piégés par SPME (Solid Phase Micro-Extraction) dans un espace de tête statique. Cette technique, qui à l’origine permettait l’extraction de substances organiques à partir d’une solution aqueuse 〚6〛, a été adaptée à l’étude des médiateurs chimiques 〚7, 8〛. Des lots d’insectes constitués, soit de 80 juvéniles, soit de 40 adultes (mâles et femelles) sont placés dans des flacons de 2 ml (Ets Spiral). La fibre SPME (polydiméthylsiloxane 100 μm, Supelco) est introduite dans le flacon contenant les insectes en perçant un opercule en aluminium qui empêche la volatilisation des composés à l’extérieur du flacon. Après 5 h d’adsorption de l’espace de tête statique, les composés sont analysés par GC–MS (Gas Chromatography–Mass Spectrometry) par désorption de la fibre SPME dans l’injecteur.
2.3 Conditions d’analyse
Les conditions de la GC–MS sont les suivantes : un chromatographe Varian 3300 est couplé à un spectromètre de masse Nermag R30-10. Les conditions de la chromatographie sont les suivantes : le four est programmé de 75 à 320 °C à raison de 10 °C min–1. Il est équipé d’une colonne capillaire WCOT AT-5 ; 30 m ; 0,32 mm id ; 0,25 μm épaisseur de la phase (Alltech). L’injection se fait en mode Splitless à 260 °C ; le gaz vecteur est l’hélium (1 bar) ; le détecteur est chauffé à 260 °C. Les spectres de masse sont enregistrés en impact électronique (IE, 70 eV, 40–300 uma) et en ionisation chimique (IC–NH3 1,4 × 10–4 torr). Les composés sont identifiés par comparaison des spectres de masse des prélèvements SPME et ceux de la bibliothèque EPA\NIH. L’identification est ensuite confirmée pour les produits disponibles par comparaison des temps de rétention des produits de la SPME avec ceux de composés de synthèse. Un échantillon authentique de (2-hydroxypropoxy)-2-propan-1-ol a été synthétisé à partir du glycérol selon une séquence de sept étapes mise au point à l’ICOA (Cassel et al., comm. pers.).
3 Résultats
L’analyse par GC–MS donne un chromatogramme ionique total des produits volatils capturés par SPME à partir de l’espace de tête émanant des cicadelles (Fig. 1). Il met en évidence 13 composés, dont l’identification est récapitulée dans le Tableau 1. Si l’on compare les résultats obtenus en fonction du stade de l’insecte, les cinq produits identifiés suivants sont communs aux juvéniles et aux adultes : (2-hydroxypropoxy)-2-propan-1-ol (1), 3,3’-oxybis-butan-2-ol (2), Δ-pentadécène (8), acide hexadécanoïque (11) et dibutylphthalate (12). Quatre produits sont spécifiques des adultes mâles et femelles et ont été identifiés : anhydro-Mev (3), Mev (4), acide octadéca-9,12-diénoïque (13) et un autre acide dont la structure n’est pas établie (5). Quatre produits n’apparaissent que chez les juvéniles. Il s’agit du n-tridécane (6) ; du ΔΔ-pentadécadiène (7) ; du n-pentadécane (9) et du 2-(N-butylamino)décane (10).

Chromatogramme ionique total des produits émis par P. alienus et piégés dans l’espace de tête statique par la fibre SPME. Les conditions d’analyse sont indiquées dans le texte. Les chiffres au-dessus des pics, suivis de « mn » indiquent le temps de rétention en minutes.
Identification par GC–MS des produits volatils émis par les juvéniles (Juv.) et les adultes (Adu.) de la cicadelle Psammotettix alienus. Les produits sont piégés dans l’espace de tête statique par la fibre SPME (Solid phase micro-extraction).
| Composé | Formule chimique | Spectre de masse (m/z) | TR | Juv. | Adu. | |
| 1 | (2-hydroxypropoxy)-2-propan-1-ol | C6H14O3 | 45, 59 (100%), 103, (134 Mw) | 2,36 | + | + |
| 2 | 3,3’-oxybis-butan-2-ol | C8H18O3 | 45, 59 (100%), 103, (162 Mw) | 3,20 | + | + |
| 3 | anhydromévalonolactone | C6H8O2 | 54, 82 (100%), 112 (M+•) | 4,80 | + | |
| 4 | mévalonolactone | C6H10O3 | 43 (100%), 58, (130 Mw) | 6,04 | + | |
| 5 | acide* | non ident. | 43, 57, 60, 71, 73 (100%), 85,98, 115, 129 | 6,10 | + | |
| 6 | n-tridécane | C13H28 | 43, 57 (100%), 71, 85, 99, 184 (M+•) | 6,61 | + | |
| 7 | ΔΔ-pentadécadiène | C15H28 | 41, 65, 67 (100%), 81, 95, 110, 208 (M+•) | 8,99 | + | |
| 8 | Δ-pentadécène | C15H30 | 43, 55 (100%), 69, 83, 97, 111, 125, 210 (M+•) | 9,07 | + | + |
| 9 | n-pentadécane | C15H32 | 43, 57, 71, 212 (M+•) | 9,28 | + | |
| 10 | 2-(N-butylamino)décane | C14H31N | 70, 100 (100%), (213 Mw) | 13,86 | + | |
| 11 | acide hexadécanoïque | C16H32O2 | 43 (100%), 57, 60, 73, 83, 98, 111, 129, 157, 171, 213, 256 (M+•) | 14,59 | + | + |
| 12 | dibutylphthalate | C16H22O4 | 76, 93, 105, 121, 149 (100%), 205, 223, (278 Mw) | 14,64 | + | + |
| 13 | acide octadéca-9,12-diénoïque | C18H32O2 | 41, 55 (100%), 60, 67, 69, 73, 81, 96, 110, 122, 280 (M+•) | 16,40 | + |
Les structures chimiques des composés 3 et 4 sont confirmées par comparaison de leurs spectres de masse et de leurs temps de rétention avec ceux de la Mev commerciale (Mev racémique pure à 97%, SIGMA Aldrich). La Mev et le composé 4 présentent des temps de rétention et des spectres de masse (IE et IC) identiques. L’analyse de la Mev commerciale montre la présence d’un produit minoritaire (5%) qui possède le même temps de rétention que le produit 3, la même masse moléculaire (112 M+) et le même spectre de masse. Ce composé présente les caractéristiques spectrales de l’anhydro-Mev (Fig. 2).
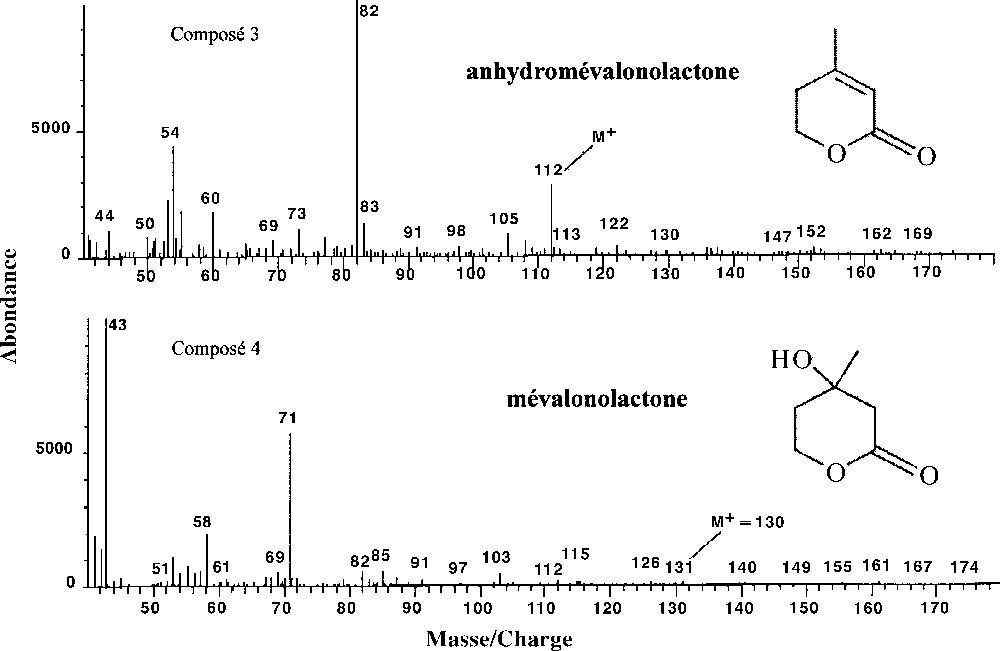
Spectres de masse en impact électronique de composés identifiés dans les volatils émis par la cicadelle P. alienus et piégés dans l’espace de tête statique par la fibre SPME.
Un échantillon synthétique de (2-hydroxypropoxy)-2-propan-1-ol (Cassel, comm. pers.) a permis de confirmer la structure du composé 1 sur la base de la comparaison des spectres de masse et, de ce fait, de valider sa présence dans le mélange de composés volatils produits par les cicadelles.
4 Discussion
La Mev a été identifiée sans ambiguïté d’après son spectre de masse et son temps de rétention. La littérature sur ce composé montre qu’il joue un rôle très important dans la physiologie des insectes, mais ne le cite jamais comme un composé excrété. Dans les cellules d’insectes, on ne trouve pas ce composé, mais on trouve le mévalonate, qui lui est apparenté et est un précurseur des hormones juvéniles. La Mev provient de la déshydratation formelle entre le groupe hydroxyle de la fonction acide et celui de la fonction alcool du mévalonate. L’apparentement chimique des deux composés fait que la Mev est souvent utilisée à la place du mévalonate pour des études sur la synthèse des hormones juvéniles. Elle conduit à une meilleure production de ces hormones, bien qu’il n’existe aucune preuve que cette molécule soit effectivement un précurseur de biosynthèse des hormones juvéniles (F. Couillaud, comm. pers.). Le métabolisme du mévalonate a fait l’objet de nombreuses études, du fait de son rôle clé dans la biosynthèse des isoprénoïdes, y compris les stéroïdes (hormones juvéniles des insectes et cholestérol des mammifères 〚9〛). Des analogues de la Mev, comme la fluoromévalonolactone (tetrahydro-4-fluorométhyl-4-hydroxy-2H-pyran-2-one, F-Mev) montrent des activités anti-hormones juvéniles chez certains lépidoptères. Il semble que la F-Mev inhibe la biosynthèse des hormones juvéniles au niveau de la phosphorylation enzymatique du mévalonate 〚10〛. Le mévalonate serait aussi impliqué dans la fabrication de nombreuses protéines (F. Couillaud, comm. pers.). L’inhibition de la synthèse du mévalonate par la fluvastatine a un effet létal chez les insectes. Le mévalonate ou ses dérivés tiennent donc dans la physiologie des insectes une place importante, dépassant le seul problème de la biosynthèse des hormones juvéniles 〚11〛.
L’anhydro-Mev n’a jamais été signalée comme composé volatil émis par des organismes vivants. Dans cette étude, un produit présentant les mêmes caractéristiques en GC–MS a été identifié dans les prélèvements SPME de l’espace de tête des cicadelles. Ce composé se retrouve dans le produit de synthèse utilisé comme référence pour identifier la Mev. L’anhydro-Mev et la Mev sont des composés chimiquement très proches. Il est possible que l’anhydro-Mev ne soit pas réellement émise par la cicadelle et qu’elle ne soit qu’un artéfact dû aux conditions d’analyse : en effet, l’injecteur étant chauffé à 260 °C, une déshydratation de la Mev en anhydro-Mev n’est pas à écarter. Les lactones – famille fonctionnelle à laquelle appartient la Mev – sont des médiateurs chimiques que l’on rencontre chez certaines espèces comme phéromones d’oviposition 〚12〛 ou comme phéromones sexuelles 〚13–16〛. Quoique assez peu courante, cette famille fonctionnelle joue un rôle dans la communication chimique chez les insectes. Dans notre étude, nous émettons l’hypothèse que la Mev pourrait être responsable des modifications physiologiques exercées par la cicadelle sur le puceron.
La confirmation de la structure du (2-hydroxypropoxy)-2-propan-1-ol a été apportée par la comparaison des spectres de masse du composé de synthèse et de celui contenu dans l’espace de tête de l’insecte, et celle du 3,3’-oxybis-butan-2-ol seulement par la consultation de la base de données de spectres de masse. Elle devra être confirmée par comparaison avec temps de rétention du composé standard. Une confirmation sera apportée dès que le produit de synthèse sera disponible. Les deux composés sont présents chez les juvéniles et les adultes de la cicadelle, mais n’ont jamais été signalés chez d’autres êtres vivants.
Concernant les autres composés émanant des cicadelles, le n-tridécane et le Δ-pentadécène, les acides hexadécanoïque et octadéca-9,12-diénoïque sont couramment identifiés dans la cuticule des insectes. Le n-tridécane est aussi caractéristique des sécrétions défensives des hétéroptères 〚17–19〛.
Divers composés (hydrocarbures saturés et insaturés, acides gras, alcools et lactones) sont piégés en utilisant la SPME pour échantillonner l’espace de tête produit par les cicadelles. Parmi ces composés, la Mev identifiée chez les adultes de la cicadelle n’a jamais été décrite comme un composé chimique émis à l’extérieur de l’organisme chez les insectes. D’après la littérature, ce composé peut jouer un rôle très important dans la physiologie des insectes. Nous faisons l’hypothèse que la Mev pourrait modifier la physiologie d’une autre espèce d’insecte, R. padi par exemple, se développant sur la même plante en agissant comme une véritable substance allélochimique modificatrice. Cette hypothèse est en accord avec les expériences de terrain de Moreau et al. 〚1〛 et de laboratoire de Alla 〚2〛.
Remerciements
Les auteurs remercient MM. G. Genestier, G. Laugé, J.-P. Moreau et F. Couillaud pour l’intérêt qu’ils ont porté à ce travail et pour leurs commentaires. Ils remercient aussi Mme C. Young pour sa révision de l’anglais.
Abridged version
The bird cherry-oat aphid Rhopalosiphum padi (L.) and the wheat leafhopper Psammotettix alienus (Dhb) are both serious pests of cereal crops. The interactions between these insects were studied under laboratory conditions and it was demonstrated that the aphid reduced offspring production when separated physically but not olfactively from a leafhopper population. To explain this result, we hypothesise the existence of either an acoustic or chemical communication by volatile compounds. Only the hypothesis of semiochemical communication was considered in this work. To trap volatile components released by the leafhopper, a static headspace method was used. A population of leafhoppers (40 adults or 80 nymphs) of all ages was enclosed in a vial into which was introduced a SPME (Solid Phase Micro-Extraction) fibre. After 5 h of headspace adsorption, the SPME fibre was directly desorbed into the injector and analysed by GC–MS.
The GC–MS analyses of the headspace showed the presence of numerous compounds: saturated or unsaturated hydrocarbons (C10, C13 and C15), free carboxylic acids (C16 and C18), an amine (C14), alcohols (C4 and C6) and cyclic compounds such as C6 lactones. Among those compounds, n-tridecane, ΔΔ-pentadecadiene and 2-(N-butylamino)decane were found to be specifically produced by nymphs. The adult specific compounds were the tetrahydro-4-hydroxy-4-methyl-2H-pyran-2-one – mevalonolactone (Mev) – and anhydromevalonolactone (anhydro-Mev). The closely related chemical structures of the latter compounds were ascertained by comparison of their mass spectra with those of authentic compounds. Anhydromevalonolactone most probably originated from Mev conversion during GC–MS analyses. Mev, which is identified for the first time in either an insect or any other living organism, is chemically related to mevalonate, a known compound produced in both animals and plants. Mevalonate is a well-known precursor of terpenoids, including juvenile hormones. Consequently, Mev can play a very important role in insect physiology and could be responsible for the effects on aphid reproduction. It would be interesting to test its biological activity, particularly on the aphid R. padi.
Other compounds were detected in the headspace of both leafhopper nymphs and adults and for the first time as volatile compounds released by insects: 3,3’-oxybis-2-butanol and 2-(2-hydroxypropoxy)-1-propanol. The identification of 3,3’-oxybis-2-butanol was only based on mass spectra and must be confirmed with synthetic compound.
In conclusion, leafhopper released numerous volatile compounds. Some of them, such as Mev, were found for the first time in the headspace of an insect. The importance of this compound in the biosynthesis of insect hormones lead us to hypothesise that it can be responsible for the depressive action on the aphid physiology. However, such a role as semiochemical requires confirmation through biological studies with the synthetic compound. Nevertheless, the first-time observation of the release of Mev outside the body of an insect leads us to publish this article and to point out that this opens a new prospect for studying mevalonate metabolism.



