Abridged English version
The response pattern of the stressful stimuli, depends upon the type of stress. The aim of our study was to investigate and to compare the impact of acute dehydration, starvation and their combination for 3 days. The variation of certain blood variables such as hematocrit, plasma osmolality, natremia, proteinemia, and glycaemia was determined. Corticosterone level and the activity of pituitary-thyroid and vasopressinergic axis were evaluated.
Plasma corticosterone level was measured by fluorimetry. The levels of FT4 and TSH were determined by immunoenzymatic assay, while AVP levels were determined by radioimmunoassay. All results were expressed as means ± SE. Data were tested by analysis of variance (ANOVA) for comparison between control and treated groups.
Our results reveal an elevation in the plasma corticosterone level in response to a three-day water deprivation, food deprivation and their combination. This elevation was potentiated in combined water- and food-deprived rats.
A significant decrease in FT4 level was shown in all three groups contrasted with a significant decrease in TSH level in food-deprived and combined water- and food-deprived rats and a slight and not significant decrease in TSH level in water-deprived rats. This suggests that nutritional stress modifies pituitary-thyroid axis through mechanisms different from those of osmotic stress. Indeed, it seems that water deprivation has a direct impact on the thyroid level and results in a primary hypothyroidism, whereas food deprivation may act at the central level and cause a secondary hypothyroidism. However, for more precision, a dosage of TRH (Thyroid-Releasing Hormone) was required and may allow us to situate the level of action of nutritional stress.
Furthermore, a significant increase in plasma AVP concentration and a depletion of AVP from pituitary and hypothalamus in response to hyperosmolality, hypovolemia and hypernatremia were shown in water-deprived rats. In contrast, the activity of the vasopressinergic axis was not affected in food-deprived rats, despite a significant hypovolemia. However, in combined water- and food-deprived rats, we note a significant increase in plasma AVP level concomitant with unchanged osmolality, hypovolemia and hypernatremia. It should be noted that, food deprivation may inhibit the stimulatory effect of water deprivation on vasopressinergic axis by restoration of the pituitary AVP content and a moderate increase of plasma AVP level.
1 Introduction
Pour garder son bien-être, l'organisme vivant doit conserver constamment un état d'équilibre interne, malgré un environnement variable. De nombreuses études se sont intéressées aux différentes perturbations qui peuvent menacer l'organisme et il a été démontré que les réponses aux agressions sont très variables d'un individu à un autre et dépendent du type, de l'intensité et de la nature de l'agent stressant [1]. Quel que soit le type d'agression, celui-ci entraîne une réponse physiologique hormonale caractérisée par la sécrétion immédiate ou différée d'un certain nombre d'hormones, parmi lesquelles dominent celles de l'axe corticotrope [2], qui assurent la défense de l'organisme et pallient aux faiblesses de certaines fonctions, tant sur le plan de la protection que sur le plan métabolique. Aux cours des travaux précédents, il a été démontré que la dénutrition [3] et la déshydratation [4] peuvent être considérées comme des agressions susceptibles de stimuler les défenses de l'organisme. Étant donné le rôle crucial des hormones thyroïdiennes dans la régulation des métabolismes glucidique, protidique, lipidique et phosphocalcique [5] et dans la croissance [6] et l'implication de la vasopressine (AVP) dans la régulation de l'axe corticotrope [7,8], nous nous sommes proposés dans le présent travail d'étudier les répercussions que peuvent avoir une privation hydrique et/ou alimentaire imposées aux rats sur quelques paramètres hématologiques, sur l'activité du cortex surrénalien, de l'axe hypophyso-thyroïdien et du système vasopressinergique.
2 Matériel et méthodes
2.1 Animaux
Les expériences de cette étude ont été effectuées sur des rats mâles de souche Wistar, dont le poids est compris entre 230 et 280 g acquis auprès de la Société des industries pharmaceutiques de Tunis (SIPHAT). Avant toute expérimentation, les animaux sont soumis à une période d'acclimatation sous des conditions contrôlées de température (
2.2 Protocole expérimental
Les animaux sont répartis en quatre groupes : (a) un groupe de rats témoins (
2.3 Prélèvement des échantillons et des organes
Le sang artério-veineux du cou est recueilli dans des tubes à hémolyse secs ou héparinés et centrifugé rapidement pendant 15 min à
2.4 Détermination des paramètres sanguins
Pour la détermination de l'hématocrite, le sang est prélevé dans des micro-tubes héparinés et centrifugés pendant 10 min à
2.5 Détermination de la corticostéronémie plasmatique
Le dosage de la corticostérone plasmatique a été effectué par la méthode fluorimétrique décrite par Silber et al. [10] et modifiée par Guillemin et al. [11]. La sensibilité du dosage est de 0,02 μg de corticostérone par tube.
2.6 Détermination des taux de la FT4 et de la TSH sériques
La mesure de la FT4 se fait par un immunodosage chimiluminescent par compétition séquentielle en phase solide, en utilisant la trousse Immulite (fabriqué par DPC, France). La sensibilité est de 2,6 à 77,2 pmol l−1. Le dosage de la TSH est réalisé au moyen d'un test immunométrique chimiluminescent de type sandwich en phase solide, à l'aide de la trousse Immulite (DPC, France). La sensibilité du dosage est de 0,002 à 75 μUI ml−1.
2.7 Détermination des taux de l'AVP plasmatique et tissulaire
Les tissus nerveux ont été broyés au polytron dans 1 ml d'eau distillée. Un aliquote de l'homogénat a servi au dosage des protéines totales par la méthode de Bradford [12]. Le reste du broyat a été centrifugé pendant 30 min à
2.8 Analyse statistique
Les résultats sont exprimés sous forme de moyenne± SE. La signification statistique des différences entre les groupes expérimentaux est déterminée par une analyse de la variance (Anova) suivie du test t de Student. Les différences sont jugées significatives dans le cas où
3 Résultats
3.1 Évolution pondérale, prise hydrique et prise alimentaire
Au bout de trois jours de traitement, la masse corporelle chute significativement chez les rats déshydratés (
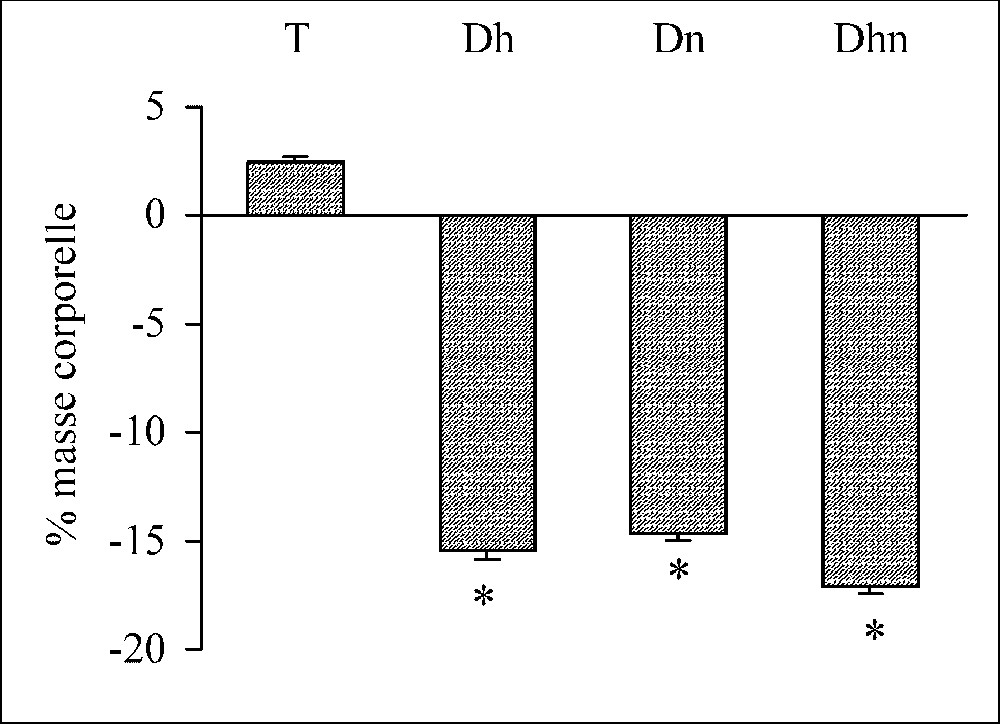
Variation de la masse corporelle exprimée en pourcentage chez les rats témoins (T), déshydratés (Dh), dénutris (Dn) et déshydratés et dénutris (Dhn) pendant 3 j. n=30 par groupe. ∗ : p<0,01 versus T.
3.2 Paramètres hématologiques
Au bout de trois jours de déshydratation, de dénutrition ou de leur association, les valeurs de l'hématocrite et de la natrémie augmentent significativement, parallèlement à une perte significative du volume plasmatique. L'osmolalité plasmatique augmente significativement au cours d'une déshydratation, alors qu'elle ne change pas après une dénutrition seule ou réunie à une déshydratation. La protéinémie n'est pas modifiée chez les trois groupes. Le taux du glucose sanguin baisse significativement chez les rats soumis à une dénutrition seule ou associée à une déshydratation, tout en restant dans les limites physiologiques par comparaison avec les valeurs de référence des rats témoins. En revanche, la glycémie des rats soumis à une déshydratation seule ne subit aucune modification (Tableau 1).
Modifications des paramètres hématologiques après une privation hydrique, une privation alimentaire et leur association pendant 3 j
| Témoins | Déshydratés | Dénutris | Déshydratés et dénutris | |
| Hématocrite (%) | 38,25 ± 0,49 | 48,25 ± 0,63⁎ | 44,74 ± 0,62⁎ | 47,48 ± 0,5⁎ |
| Variation du volume plasmatique (%) | 0 |
|
|
|
| Osmolalité plasmatique (mosm/kgH2O) | 286,75 ± 4,9 | 300,50 ± 2,9⁎ | 292,50 ± 3,5 | 293,12 ± 2,1 |
| Sodium plasmatique (mequiv l−1) | 138,3 ± 0,4 | 146,1 ± 0,5⁎ | 140,3 ± 0,3⁎ | 145,2 ± 1,1⁎ |
| Protéinémie (g l−1) | 40,01 ± 1,13 | 41,34 ± 0,86 | 39,23 ± 1,09 | 39,85 ± 0,93 |
| Glycémie (g l−1) | 1,38 ± 0,045 | 1,29 ± 0,042 | 1,05 ± 0,046⁎ | 1,05 ± 0,032⁎ |
⁎
3.3 Activité cortico-surrénalienne
La privation hydrique, la privation alimentaire ainsi que leur combinaison durant trois jours entraînent une augmentation significative des taux de la corticostérone plasmatique, qui sont de

Concentration de la corticostérone plasmatique chez les rats témoins (T), déshydratés (Dh), dénutris (Dn) et déshydratés et dénutris (Dhn) pendant 3 j. n=30 par groupe. ∗ : p<0,01 versus T.
3.4 Activité de l'axe hypophyso-thyroïdien
Les taux de la FT4 sérique diminuent significativement chez les trois groupes traités par rapport au groupe contrôle. Paradoxalement, les taux de la TSH sérique subissent une chute significative au cours d'une dénutrition seule ou associée à une déshydratation, et une baisse non significative au cours d'une déshydratation seule (Fig. 3).
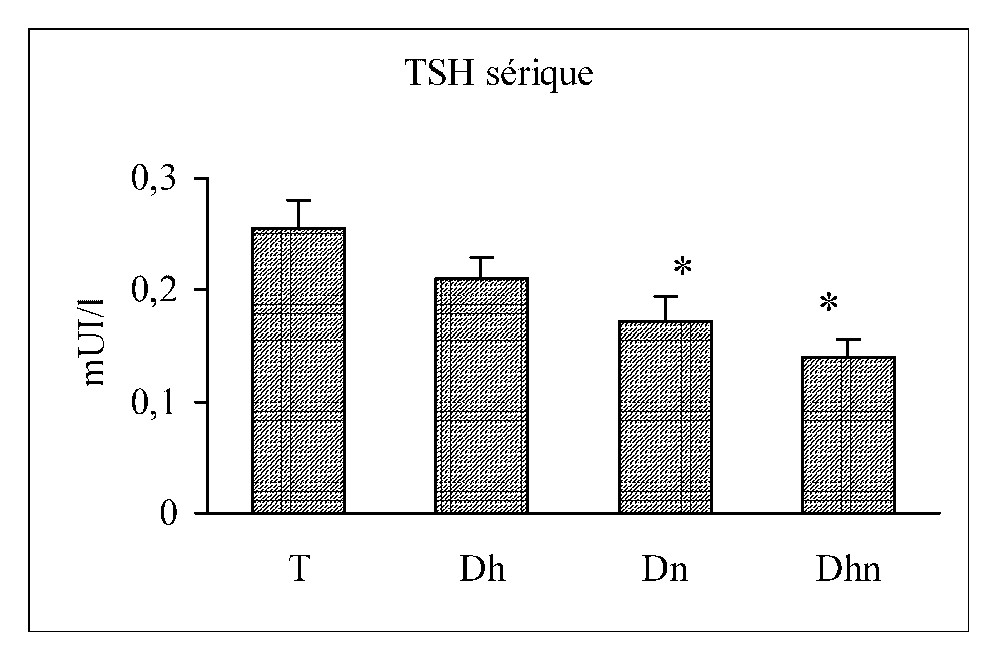
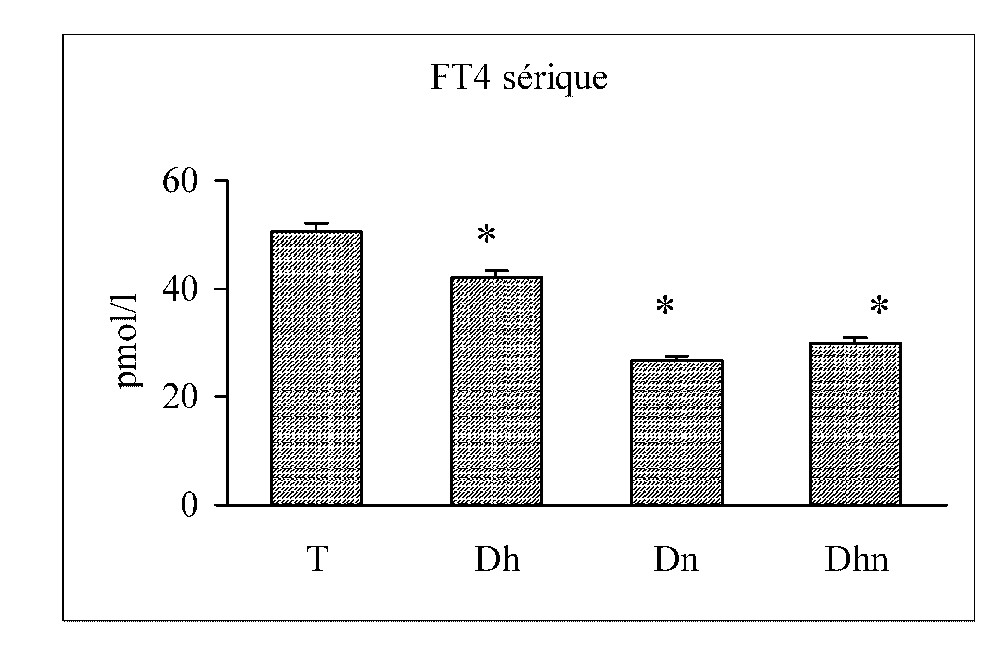
Concentrations de la FT4 et de la TSH sériques chez les rats témoins (T), déshydratés (Dh), dénutris (Dn) et déshydratés et dénutris (Dhn) pendant 3 j. n=30 par groupe. ∗ : p<0,01 versus T.
3.5 Activité de l'axe vasopressinergique
La stimulation osmotique par privation hydrique provoque une élévation significative du taux de l'AVP dans la circulation, parallèle à une diminution significative du taux de l'hormone au niveau de l'hypophyse et de l'hypothalamus. En revanche, une privation alimentaire seule n'a aucun effet sur les taux de l'AVP périphérique et centrale. Toutefois, si on associe les deux privations, hydrique et alimentaire, le taux de l'AVP plasmatique subit une augmentation significative, qui reste moins accentuée que celle notée au cours d'une privation hydrique seule, alors que les taux de l'AVP centrale demeurent inchangeables (Fig. 4).
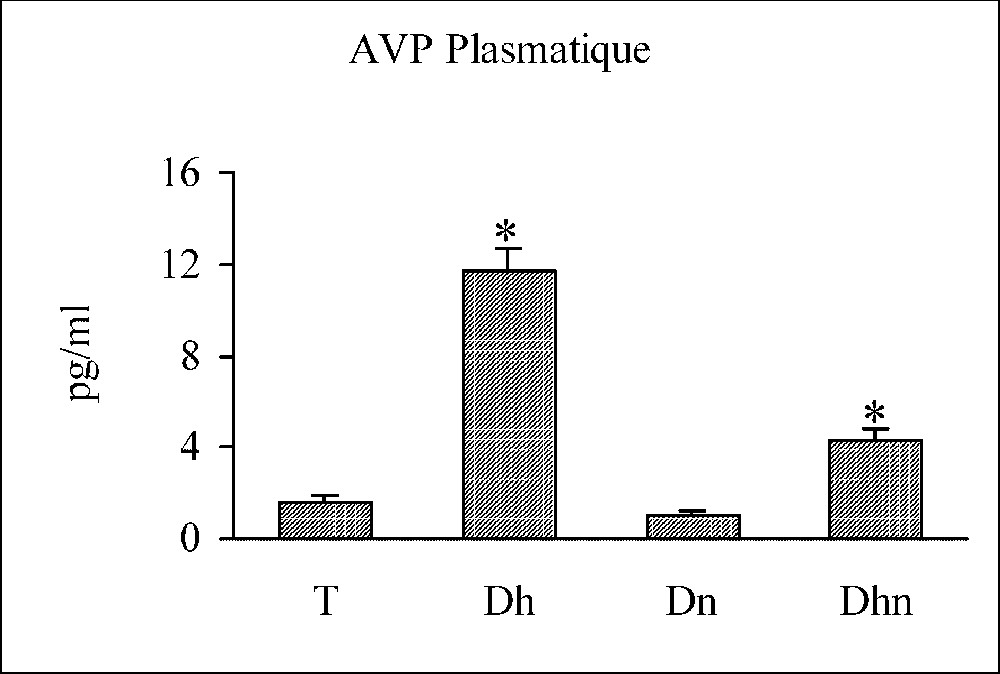
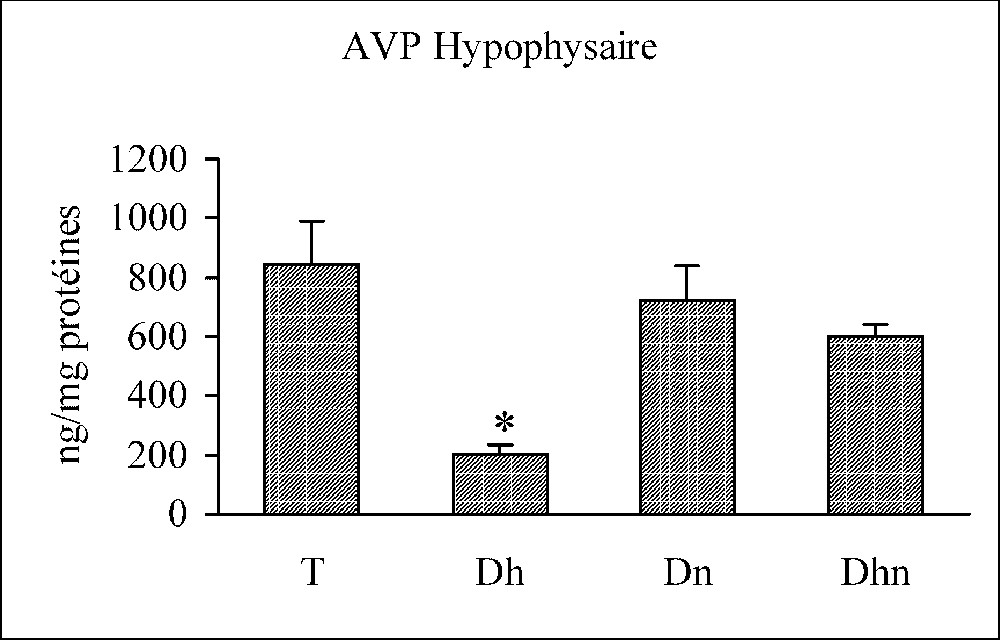
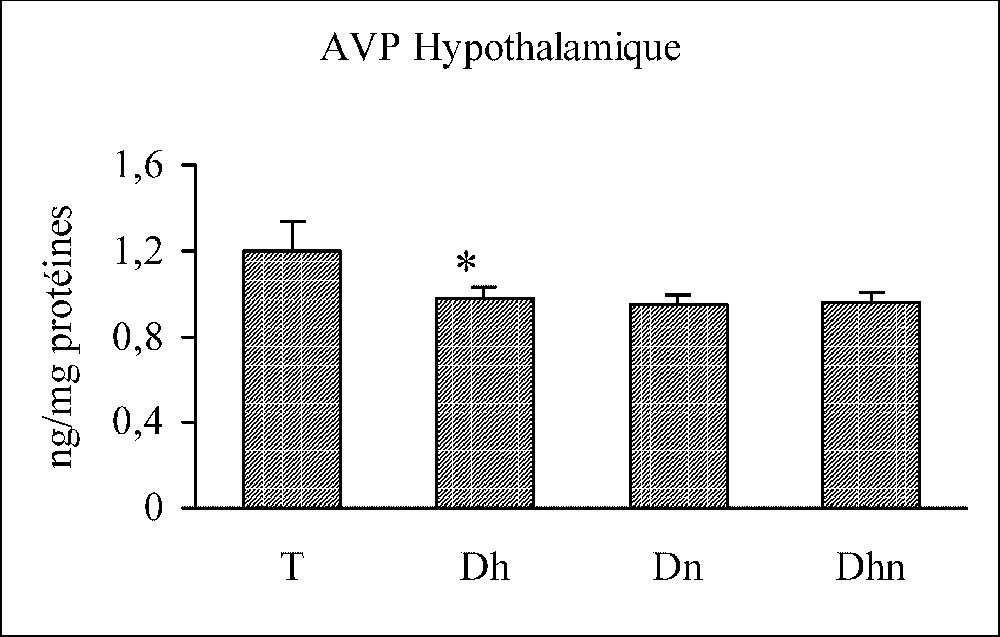
Variations des taux hypothalamique, hypophysaire et plasmatique de l'AVP chez les rats témoins (T), déshydratés (Dh), dénutris (Dn) et déshydratés et dénutris (Dhn) pendant 3 j. n=30 par groupe. ∗ : p<0,01 versus T.
4 Discussion
Notre étude met en évidence une réduction de la masse corporelle après une déshydratation, une dénutrition et leur association. Nous avons noté aussi une baisse de la prise alimentaire au cours de la déshydratation et une réduction de la prise hydrique au cours de la dénutrition. Des résultats similaires ont été enregistrés dans le cadre de travaux précédents [14]. Ceci pourrait expliquer les chutes pondérales semblables chez les trois groupes traités, malgré des régimes différents. Par ailleurs, nous avons noté que trois jours de privation alimentaire, seule ou associée à une privation hydrique, entraînent une baisse significative de la glycémie, mais sans dépasser les limites physiologiques, tandis que trois jours de privation hydrique seule n'ont aucun effet. Ceci prouve qu'au cours de trois jours de privation hydrique et/ou alimentaire, l'organisme est encore capable de maintenir une normoglycémie grâce à la néoglucogenèse [15,16], à une forte glycogénolyse hépatique [17,18] et musculaire [19] et à l'installation de l'oxydation des lipides [20]. Par ailleurs, le présent travail montre une élévation du taux de la corticostérone plasmatique chez les trois groupes traités, avec une hypercorticostéronémie plus sévère lorsque les deux privations, hydrique et alimentaire, sont associées. Ceci montre qu'une déshydratation ou une dénutrition, ou les deux conjointement, pendant trois jours peut déclencher un état d'alerte et constitue donc un état de stress pour l'organisme. De pareils résultats ont été signalés dans le cadre d'autres travaux [21]. L'augmentation de la corticostéronémie serait liée, d'une part, à une prolongation de la demi-vie de la corticostérone [14–22] corrélée à une baisse de son taux de clairance métabolique [23] et, d'autre part, à une élévation du taux de l'hormone corticotrope (ACTH) [24–27]. Cette hypercorticostéronémie, serait nécessaire aux ajustements métaboliques et hormonaux déclenchés au cours de telles situations de stress. D'un autre côté, comme le montrent les résultats de la présente étude, une déshydratation seule provoque un tableau d'hypothyroïdie primaire défini par une baisse du taux de la FT4, contrastant avec un taux normal de la TSH. Une dénutrition seule ou combinée à une déshydratation entraîne un tableau d'hypothyroïdie défini par des chutes parallèles des taux de la FT4 et de la TSH. Dans ce cas, l'hypothyroïdie pourrait être secondaire ou tertiaire, mais il est malaisé au niveau de cette étude de trancher entre les deux cas ; pour plus de précision, la mesure de la thyréostimuline (TRH) serait nécessaire et pourrait permettre de mieux situer le niveau d'action du stress alimentaire. Il a été rapporté que le contenu en glucides dans l'alimentation semble être l'ingrédient clé pour la synthèse des hormones thyroïdiennes, vu que moins de 50 g de glucose sont capables de rétablir les baisses de la thyroxinémie provoquées par le jeûne [28,29]. Il paraît donc que la baisse du taux du glucose sanguin chez les deux groupes soumis au jeûne pourrait être responsable de la baisse de la thyroxinémie observée.
Par ailleurs, il est bien établi que la libération de l'AVP dans la circulation systémique se fait en réponse à des variations de l'osmolalité plasmatique et du volume sanguin [30,31]. Nos résultats, qui sont en accord avec d'autres travaux [14–32], montrent qu'une privation alimentaire n'a aucun effet sur le système vasopressinergique. Les animaux présentent une osmolalité plasmatique normale, malgré une hypernatrémie et une hypovolémie. Ceci pourrait indiquer l'absence d'une relation directe entre la volémie et la libération de l'AVP au cours d'une dénutrition. L'élévation du bilan sodé chez les rats en dénutrition malgré la diminution de l'apport sodique par la ration alimentaire a été expliquée par une réduction de l'excrétion du sodium au cours du jeûne [33]. Ainsi, la filtration glomérulaire est-elle diminuée et le réabsorption tubulaire du sodium augmentée, dans le but d'épargne sodée en cas de diminution des entrées alimentaires du sodium. Contrairement à la dénutrition, nos résultats montrent que la privation hydrique provoque une stimulation de l'axe vasopressinergique. Les animaux sont hypernatrémiques et présentent une baisse aiguë du volume extracellulaire et une augmentation de l'osmolalité plasmatique. Cette situation serait à l'origine d'un mouvement d'eau depuis la cellule vers le secteur extracellulaire, visant à rétablir l'équilibre existant entre les deux compartiments. L'épuisement des réserves en AVP stockées dans la neurohypophyse serait, quant à elle, due à l'excès de la libération de l'hormone dans la circulation en réponse aux stimuli hyperosmotique et hypovolémique. Toutefois, la réduction remarquable de la concentration de l'AVP au niveau de l'hypothalamus montre que le taux de synthèse de l'hormone n'augmentait pas aussi vite que son taux de sécrétion. Par ailleurs, il est bien établi que l'AVP possède la propriété de stimuler la libération de l'ACTH [34] et de potentialiser l'effet de la CRH (corticotropin-releasing hormone) à libérer l'ACTH [8–35] à partir des cellules corticotropes, essentiellement en réponse à plusieurs modèles de stress. Il est donc probable que l'augmentation du taux de l'AVP plasmatique au cours d'une déshydratation est en partie impliquée, avec la CRH, dans la sécrétion de l'ACTH, pour stimuler le cortex surrénalien. Dans le cas où les animaux sont soumis à une privation concomitante d'eau et de nourriture, nous avons enregistré une augmentation du taux de l'AVP circulante alors que les taux de l'AVP centrale demeurent inchangeables. Cette augmentation reste, néanmoins, plus atténuée que celle notée au cours d'une déshydratation seule. Aussi, nous avons remarqué l'absence d'une élévation significative de l'osmolalité plasmatique, malgré une hypovolémie aiguë et un bilan sodé élevé. Ces résultats montrent que l'effet de la dénutrition semble amortir partiellement l'effet de la déshydratation. L'augmentation de L'AVP plasmatique au cours d'une déshydratation et une dénutrition simultanées s'oriente plus précisément vers la stimulation de l'axe corticotrope et, dans ce cas, le facteur stress représenté par la privation hydrique et alimentaire semble l'emporter sur les perturbations volémiques. En conclusion, la présente étude nous a permis de montrer que la déshydratation, la dénutrition et leur combinaison pendant trois jours sont des situations stressantes différentes, et semblent menaçantes pour l'équilibre hydrique, l'activité de l'axe hypophyso-thyroïdien et l'activité de l'axe vasopressinergique.



Vous devez vous connecter pour continuer.
S'authentifier