1 Introduction
Les espèces appartenant au genre Zygophyllum sont généralement des plantes caractérisées par leurs vertus thérapeutiques et sont largement utilisées dans la médecine traditionnelle. Z. coccineum est utilisée contre les rhumatismes, l’hypertension [1] et le diabète [2]. En Algérie, Z. album est utilisée pour le traitement du diabète, des spasmes et des dermatites [3]. En outre, Z. geslini est connue aussi par son action antidiabétique [4] et par son activité cytotoxique [5]. Au Maroc, Z. gaetulum (Tetraena gaetula) pousse exclusivement dans les régions désertiques, en zones arides à semi-arides. Elle est largement utilisée en médecine traditionnelle, surtout celle saharienne, pour des indications thérapeutiques très variées, comme les affections gastro-intestinales, hépatiques et antidiabétiques [6]. Plusieurs travaux scientifiques ont confirmé certaines activités de l’extrait de T. gaetula telles antidiabétique [7,8], antidiarrhérique et antispasmodique [9]. D’autres activités ont été mises en évidence comme l’effet anti-inflammatoire [10,11] et antipyrétique [12]. Alors que de très rares études phytochimiques ont été répertoriées pour le genre Zygophyllum. Ces études ont permis de noter la présence des saponines de types zygophiline, acide quinovique et glygosides [13].
L’objectif principal de ce travail est de réaliser un criblage pharmacologique primaire de T. gaetula, en explorant ses effets in vitro et ex vivo sur le système immunitaire ainsi qu’in vivo sur la dépression et la douleur.
2 Matériels et méthodes
2.1 Matériel
2.1.1 Matériel animal
Les investigations in vitro ont été réalisées sur des lapins mâles de race Zemmouri (Région Zemmour-Zaïr, Maroc) pesant en moyenne 2,5 kg. Les souris « Swiss » mâles, sont utilisées pour les investigations in vivo et ex vivo pèsent entre 30 et 40 g. Elles sont fournies par le centre ECWP « Emirates Center for Wildlife Propagation » de la région Missour au Maroc. L’eau et la nourriture leur sont fournies à volonté.
Les animaux ont été répartis au hasard, dans des cages standards en macrolon (30 × 15 × 30 cm). Ils sont placés quinze jours avant les tests dans une pièce expérimentale et soumis à une photopériode de 12 h d’éclairement et 12 h d’obscurité. Les études expérimentales sont réalisées durant la phase nocturne, correspondant à la phase active du cycle nycthéméral des animaux.
2.1.2 Matériel végétal
La partie aérienne de T. gaetula utilisée dans ce travail a été collectée dans la région Boudnib de la province d’Errachidia au Sud du Maroc, durant la saison de végétation 2007. Après identification, un échantillon a été déposé à l’Institut National des Plantes Médicinales et Aromatiques, Taounante (exciccata INP210).
2.1.3 Produits chimiques et substances de référence
Les produits sont les suivants :
- • Sertraline 50 mg, Laboratoires Pfizer (Eljadida-Maroc) ;
- • Chlorydrate de Tramadol 50 mg, Laboratoires Bottu (Casablanca-Maroc) ;
- • Prednisolone 1 mg/kg, Laboratoires Laprofan (Casablanca-Maroc) ;
- • Ciclosporine Sigma-Chemical ;
- • Phorbol Myristate Acétate (PMA), Sigma-Chemical ;
- • Albumine sérique bovine (SAB), Sigma-Chemical ;
- • Bromure de 3 (4,5-diméthylthiazol-2yl)-2,5-diphényltétrazolium (MTT), Sigma-Chemical ;
- • Dimethylsulfoxide (DMSO), Sigma-Chemical.
2.2 Méthodologie
2.2.1 Préparation de l’extrait aqueux de T. gaetula
Douze grammes de la plante sèche en poudre de T. gaetula sont mis en macération dans 100 mL du tampon phosphate salin (PBS, pH 7,4), suivi d’une agitation à froid pendant 2 h. L’ensemble est par la suite gardé une nuit à 4 °C. Ensuite, la solution est centrifugée à 2700 g durant 15 min, et le surnageant est filtré. L’extrait obtenu après filtration est conservé à −20 °C jusqu’à utilisation.
2.2.2 Préparation de l’extrait protéique et dosage des protéines
Les extraits protéiques sont obtenus par l’ajout de 0,226 g de sulfate d’ammonium à 1 mL de l’extrait aqueux de T. gaetula [14]. Après une incubation à froid pendant 12 h, les solutions sont centrifugées à 13 400 g à 4 °C pendant 20 min. Les surnageants obtenus sont éliminés et les culots resuspendus dans du PBS sont conservés à −20 °C.
Le taux des protéines est déterminé par le biais de la méthode de Lowry et al. [15] en comparaison à une courbe standard réalisée avec de l’albumine sérique bovine.
Les doses des extraits protéiques étudiées in vivo sont 0,3, 0,6 et 1 mg/kg, après précipitation des doses 160, 300 et 600 mg/kg de l’extrait aqueux par du sulfate d’ammonium.
2.2.3 Tri phytochimique
La révélation de certaines familles chimiques de l’extrait aqueux de T. gaetula a été réalisée grâce aux tests de détection chimique décrits précédemment [16,17]. La recherche des composés appartenant au groupe des polyphénols a été faite par le biais de la réaction au chlorure ferrique. La réaction de Stiasny a été utilisée pour révéler la présence des tanins galliques et catéchiques. En plus, les composés appartenant au groupe des flavonoïdes ont été mis en évidence par le biais de la réaction à la cyanidine. La recherche des saponosides est basée sur la propriété moussante des saponosides après une forte agitation de l’extrait. L’indice de mousse est calculé selon la formule décrite par la Pharmacopée Française [18]. Cette étude a été effectuée pour déterminer la présence des constituants chimiques susceptibles d’expliquer les effets de T. gaetula.
2.2.4 Étude de la toxicité aiguë
Dans l’objectif de définir le seuil infratoxique et l’intervalle d’efficacité de T. gaetula, nous avons étudié une gamme de doses de l’extrait aqueux par voie « i.p », à base de 160, 300, 600, 1200 mg/kg et 2400 mg/kg de P.C. Ces études de toxicité aiguë réalisées chez la souris consistent, d’une part, à rechercher les doses létales 100 % et 50 % (DL100) et (DL50) et, d’autre part, à observer le comportement général de l’animal (agitation, asthénie, aspect des yeux « lacrymaux, à moitié fermés »…) et l’aspect morphologique du foie et des reins, en comparaison avec le lot non traité.
2.2.5 Méthodes d’études des activités immunologiques in vitro et ex vivo
2.2.5.1 Culture cellulaire
Le thymus et la rate de lapins sont prélevés stérilement, puis dilacérés sur une grille [19]. Les cellules sont recueillies en milieu RPMI et centrifugées à 302 g pendant 5 min. Les hématies sont lysées par l’ajout du chlorure d’ammonium à 154 mM. Ensuite, les cellules sont lavées avec du RPMI et mises en suspension dans le même milieu de culture supplémenté « MCS » de 2 mM de glutamine, 1 mM de pyruvate de sodium, 10 % de Sérum de Veau Fœtal (SVF), la pénicilline à 100 μg/mL et la streptomycine à 100 μg/mL. Le dénombrement des cellules vivantes est réalisé par le biais de la cellule de Malassez en utilisant le test d’exclusion au bleu de Trypan.
2.2.5.2 Pouvoir phagocytaire des macrophages
Les effets des extraits de T. gaetula sur le pouvoir phagocytaire ont été évalués en utilisant le rouge neutre (R.N) à 0,75 mg de RN/ml de RPMI, comme indicateur de l’action phagocytaire des macrophages. En se basant sur la propriété adhésive des macrophages dans le plastique des microplaques à 96 puits, les cellules spléniques ajustées à 106 cellules/ml en MCS, sont mises en culture pendant 2 heures à 37 °C. La solution contenant le R.N et les extraits sont incubées une seconde fois. Ensuite la réaction est arrêtée, en solubilisant le rouge neutre, avec une solution contenant de l’acide acétique (1 M)/éthanol (1:1 v/v). Le profil phagocytaire a été évalué en mesurant l’absorbance à 540 nm.
2.2.5.3 Production des anticorps
L’effet de l’extrait de T. gaetula sur la réponse humorale in vitro a été déterminé en adoptant le protocole précédemment décrit par Cunningham [20]. Les lymphocytes des rates de lapins préalablement immunisés par des globules rouges de rats « GRR », sont préparés comme décrit dans le paragraphe 2.2.5.1. Ensuite, l’incubation des GRR et la suspension lymphocytaire pendant 2 h à 37̊C en présence ou en absence des extraits de la plante nous a permis à l’aide de l’observation microscopique, d’évaluer le nombre des plages de lyse formés. Les résultats sont exprimés en nombre de plages de lyse/cm2.
2.2.5.4 Test d’évaluation de la prolifération cellulaire
L’évaluation des effets des extraits de T. gaetula sur la prolifération cellulaire des splénocytes, des thymocytes et des macrophages a été réalisée par le test MTT (Bromure de 3 (4,5-diméthylthiazol-2yl)-2,5-diphényltétrazolium) selon la méthode décrite par Mosmann [21]. Les cellules ajustées à 2 × 106 cellules/mL sont mises en culture avec les extraits de T. gaetula et incubées pendant 72 heures à 37 °C à 5 % de CO2. Par la suite, le MTT a été additionné aux cellules à une concentration de 5 mg/ml. Après deux heures d’incubation à 37 °C, le dimethylsulfoxide (DMSO) a été ajouté. La densité optique est mesurée à 570 nm.
2.2.5.5 Cytométrie en flux
Vingt quatre heures après le traitement avec des extraits aqueux et protéique de T. gaetula, les animaux sont anesthésiés par voie « i.p » par du pentobarbital sodique à raison de 30 mg/kg. Le sang est récupéré dans des tubes héparinés, puis soumis à l’analyse par CMF (cytomètre en flux de type Epics-XL MCL). La cytométrie en flux a été utilisée pour suivre la proportion des populations leucocytaires particulièrement, des lymphocytes et des monocytes. Ceci en se basant sur la morphologie cellulaire, la taille et la structure.
2.2.6 Méthode d’étude de l’activité antidépresseur
Pour étudier cet effet, nous avons utilisé le modèle de la nage forcée décrit par Porsolt et al. [22]. Cette partie a été réalisée sur des souris forcées à la nage. Trente minutes après l’administration par voie « i.p » de nos extraits, chaque animal est individuellement testé pendant six minutes dans une cage en Plexiglas (30 × 15 × 30 cm), contenant de l’eau et maintenue à 25 °C [23]. La durée d’immobilité est chronométrée pendant les 4 dernières minutes de la période du test. Les animaux sont considérés immobiles lorsqu’ils flottent dans une position verticale et ne réalisent que des petits mouvements visant à garder leur tête au-dessus du niveau de l’eau afin d’éviter la noyade.
2.2.7 Méthode d’étude de l’activité analgésique
Nous avons utilisé la méthode décrite antérieurement par Woolfe et MacDonald [24]. Les animaux sont placés individuellement sur une plaque chaude maintenue à 55 ± 1 °C pendant 30 secondes afin d’exclure ceux qui ne répondent pas à la douleur. Une fois notre lot d’animaux à tester est sélectionné, nous procédons à l’administration par voie « i.p » de nos extraits. Trente minutes après, nous relevons les réactions nociceptives de l’animal.
La classification de la réponse douloureuse est basée sur un score d’algie :
1 : Adaptation, 2 : Redressement, 3 : Saut, 4 : Immobilisation.L’indice d’analgésie est calculé selon la formule suivante :
MARSI Tr : Moyenne du score d’algie du lot traité.
2.3 Analyse statistique
Les résultats sont exprimés en moyenne ± SEM. La comparaison des moyennes a été réalisée en utilisant le test « t » de Student. Un résultat est considéré statistiquement significatif si p < 0,05.
3 Résultats
3.1 Étude du tri phytochimique
Les études phytochimiques de l’extrait aqueux de T. gaetula ont permis de déceler la présence de flavonoïdes de types flavones à toutes les doses étudiées et de saponosides aux doses 300 et 600 mg/kg P.C (Tableau 1).
Révélation chimique des trois doses étudiées de l’extrait aqueux de T. gaetula.
| Constituants chimiques | Extrait aqueux de T. gaetula | ||
| 160 mg/kg P.C | 300 mg/kg P.C | 600 mg/kg P.C | |
| Flavonoïdes (flavones) | + | ++ | +++ |
| Saponosides | – | ++ | +++ |
| Indice de mousse | – | 500 | 1000 |
| Tanins | |||
| Galliques | – | – | – |
| Catéchiques | – | – | – |
3.2 Études de la toxicité aiguë de l’extrait aqueux de T. gaetula
Les DL50 et DL100 de l’extrait aqueux de T. gaetula ont été estimées respectivement à 1,2 et 2,4 g/kg P.C. Par conséquent, les doses infratoxiques à étudier sont 160, 300 et 600 mg/kg P.C. Aucune modification du comportement général, ni de l’aspect du foie ni celui des reins n’a été notée.
3.3 Activité immunologique des extraits de T. gaetula
L’étude a porté sur l’effet immunomodulateur ex vivo de T. gaetula par le biais de la cytométrie en flux en évaluant le pourcentage des sous-populations leucocytaires, d’une part, et en recherchant aussi, les effets des extraits aqueux et protéique de T. gaetula sur l’activité proliférative des thymocytes, des splénocytes, des macrophages, sur le pouvoir phagocytaire des macrophages et sur la production d’anticorps, d’autre part.
3.3.1 Activité proliférative des thymocytes, des splénocytes et des macrophages
3.3.1.1 Thymocytes
Pour les extraits aqueux et protéique (Fig. 1), nous avons observé un effet stimulant de l’extrait aqueux à 60 μg/μL et de l’extrait protéique à 6 μg/μL sur l’activité proliférative des thymocytes. En effet, l’extrait protéique exerce un effet stimulant important avec un pourcentage de réponse de 89,7 % par rapport au témoin (p < 0,001). Cette réponse est supérieure à celle obtenue avec le PMA.
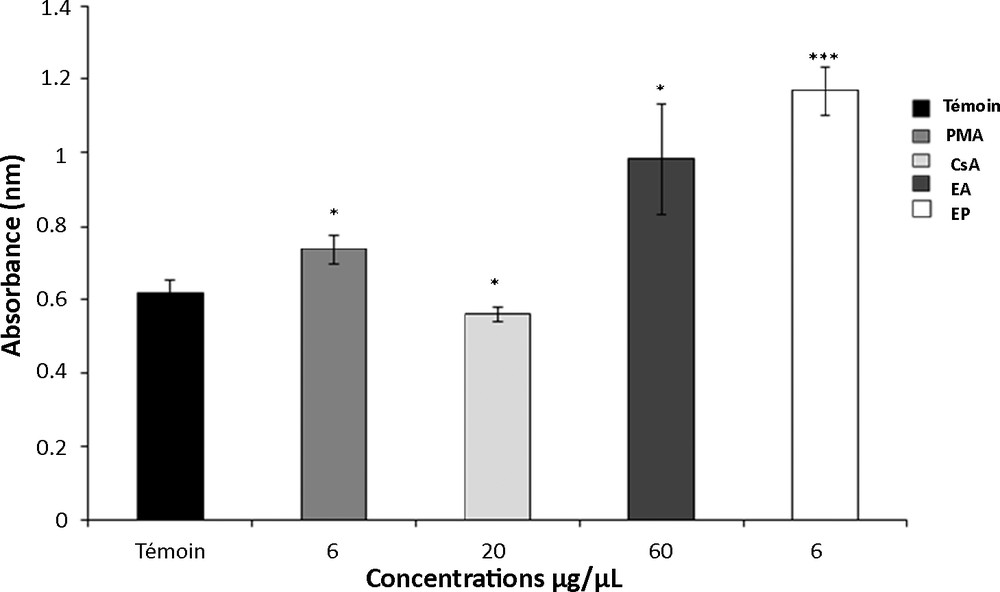
Effets prolifératives de l’extrait aqueux (EA) et de l’extrait protéique (EP) de T. gaetula sur la prolifération cellulaire des thymocytes. Les valeurs représentent la moyenne ± SEM ; N = 5 pour chaque groupe. * p < 0,05 ; *** p < 0,001. PMA : Phorbol Myristate Acétate, CsA : Ciclosporine.
3.3.1.2 Splénocytes
Nous constatons que l’extrait protéique induit une diminution significative de la prolifération des splénocytes par rapport au témoin (51 %, p < 0,001). Par ailleurs, l’extrait aqueux n’exerce aucun effet significatif sur les cellules spléniques en culture (Fig. 2).
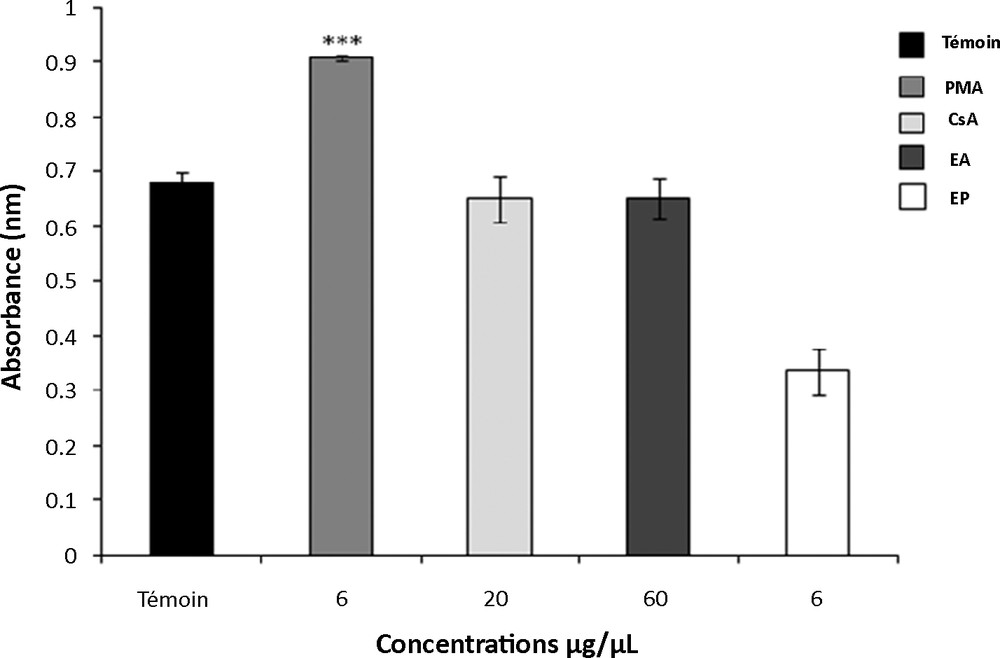
Effets de l’extrait aqueux (EA) et de l’extrait protéique (EP) de T. gaetula sur l’activité prolifératives des splénocytes. Les valeurs représentent la moyenne ± SEM; N = 5 pour chaque groupe. *** p < 0,001. PMA : Phorbol Myristate Acétate, CsA : Ciclosporine.
3.3.1.3 Macrophages
Les résultats obtenus montrent un effet inhibiteur de l’activité proliférative des macrophages, exercé par les extraits aqueux et protéique de T. gaetula. Les pourcentages d’inhibition sont respectivement de l’ordre de 31 et 32 % (Tableau 2).
Évaluation de l’effet des extraits de T. gaetula sur l’activité proliférative des macrophages.
| Témoin | Extrait aqueux de T. gaetula (60 μg/μL) | Extrait protéique de T. gaetula (6 μg/μL) | N | |
| Prolifération | 1,4396 ± 0,2 | 1,03 ± 0,15 | 1,0248 ± 0,19 | 5 |
| % d’inhibition | – – |
31 % p < 0,05 |
32 % p < 0,05 |
5 |
3.3.1.4 Pouvoir phagocytaire des macrophages
La Fig. 3 montre une diminution du pouvoir phagocytaire des macrophages après l’addition des extraits aqueux et protéique de T. gaetula. En effet, les pourcentages d’inhibition de la phagocytose, induite par les extraits aqueux et protéique, sont respectivement de 15 (p < 0,05) et 20 % (p < 0,05).
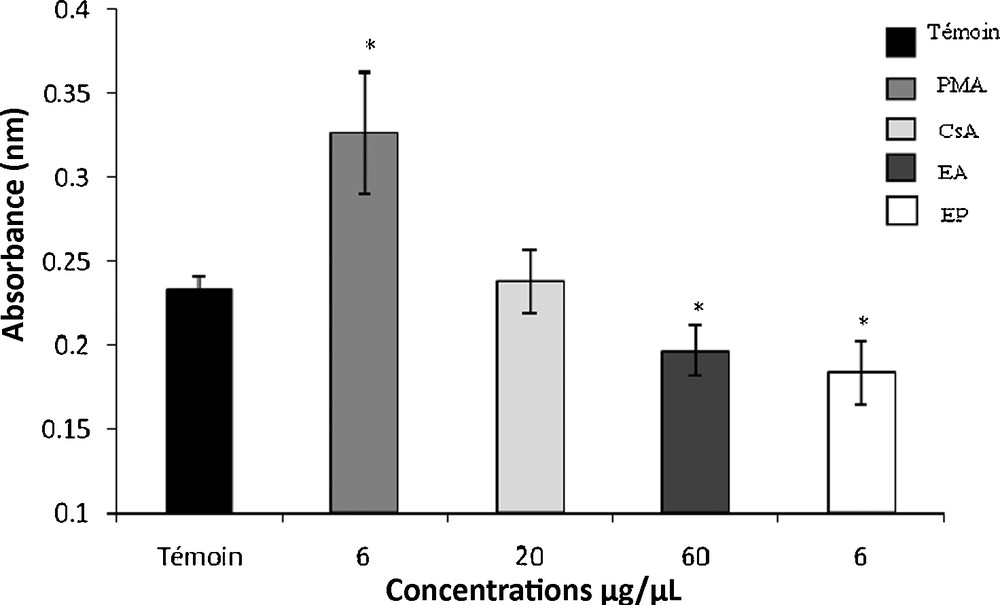
Effets de l’extrait aqueux (EA) et de l’extrait protéique (EP) de T. gaetula sur le pouvoir phagocytaire des macrophages. Les valeurs représentent la moyenne ± SEM; N = 5 pour chaque groupe. *p < 0,05. PMA : Phorbol Myristate Acétate, CsA : Ciclosporine.
3.3.2 Production des anticorps
Les résultats montrent une diminution significative de la production des anticorps après l’addition de l’extrait aqueux de T. gaetula. Cette réponse est traduite par une diminution du nombre des plages d’hémolyse observées. Cependant, l’effet de l’extrait protéique est comparable à celui du témoin (Fig. 4).
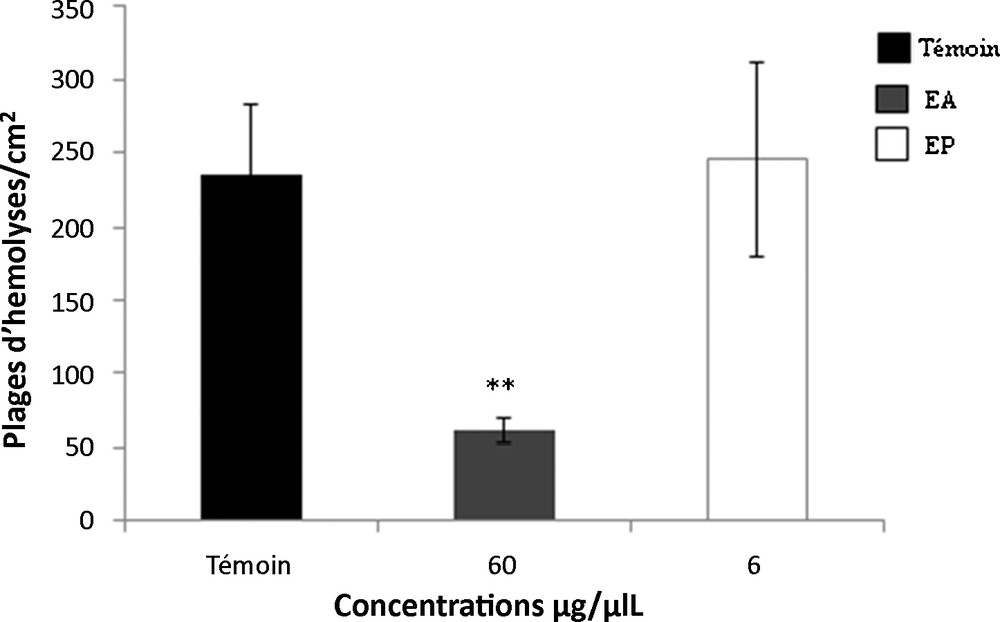
Étude de la réponse humorale sous l’effet de l’extrait aqueux (EA) et de l’extrait protéique (EP) de T. gaetula. Les valeurs représentent la moyenne ± SEM dans N = 5 expériences. ** p < 0,01.
3.3.3 Pourcentage des sous-populations leucocytaires
La Fig. 5a montre un effet suppresseur significatif sur le pourcentage des lymphocytes et des monocytes de la souris, après l’administration de la dose 300 mg/kg P.C de l’extrait aqueux de T. gaetula par rapport au lot témoin ; le taux de variation des lymphocytes est de 53 % (p < 0,001), contre 88 % (p < 0,001) pour celui des monocytes. En outre, cet effet suppresseur est plus accentué que celui induit par le traitement à la prednisolone. Cependant, la dose 600 mg/kg exerce un effet plutôt stimulant sur les pourcentages lymphocytaires et monocytaires, en comparaison au lot témoin et à celui traité par du PMA (respectivement, % de variations : 38 %, 45 % ; p < 0,001, p < 0,05).
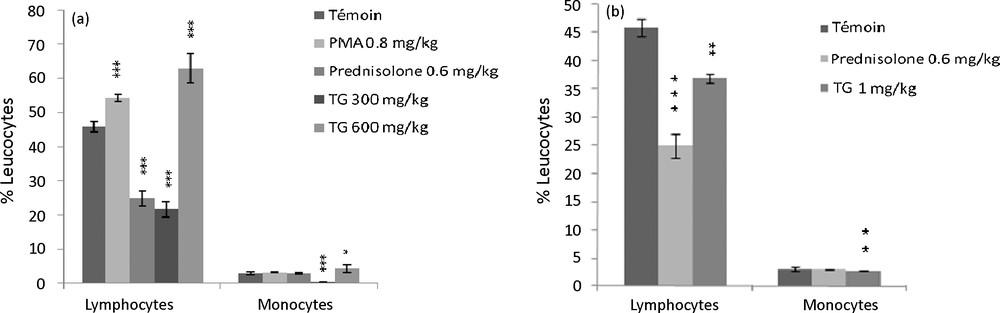
(a) Effets de l’extrait aqueux de T. gaetula (TG) sur le pourcentage des sous-populations leucocytaires chez la souris. Les valeurs représentent la moyenne ± SEM; N = 6 pour chaque groupe. * p < 0,05 ; *** p < 0,001. (b) Effets de l’extrait protéique de T. gaetula (TG) sur le pourcentage des sous-populations leucocytaires chez la souris. Les valeurs représentent la moyenne ± SEM; N = 6 pour chaque groupe. ** p < 0,01 ; *** p < 0,001.
Les résultats de la Fig. 5b ont permis de mettre en évidence un effet suppresseur de l’extrait protéique 1 mg/kg P.C sur les populations lymphocytaires avec un pourcentage de réponse de 84 % par rapport au lot témoin (p < 0,01). Tandis que la population monocytaire ne semble pas être modifiée.
3.4 Évaluation du pouvoir antidépresseur
La Fig. 6a met en évidence une activité antidépressive significative des doses 300 et 600 mg/kg P.C de l’extrait aqueux de T. gaetula. Cet effet se traduit par une diminution du temps d’immobilité par rapport au lot témoin (respectivement, % de variations : 38 %, 39 % ; p < 0,01, p < 0,01). Nous notons également un effet antidépresseur statistiquement significatif de l’extrait protéique à toutes les doses 0,3, 0,6 et 1 mg/kg P.C (respectivement, % de variations, 66 %, 69 %, 60 % ; p < 0,001, p < 0,001, p < 0,001). Ces effets de l’extrait protéique sont plus importants que celui de la sertraline (Fig. 6b).
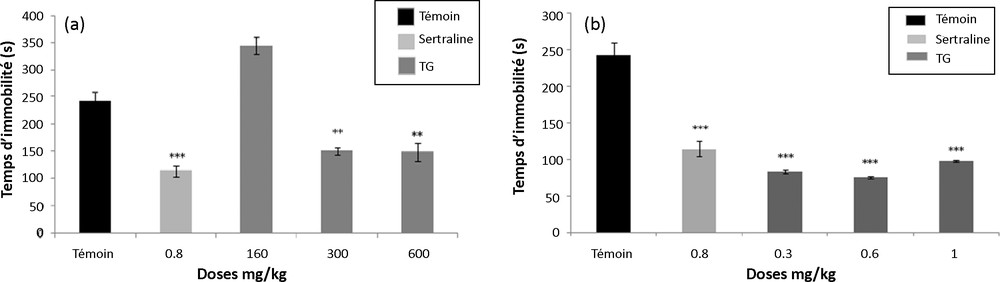
(a) Effet antidépresseur de l’extrait aqueux de T. gaetula (TG) chez les souris. Les valeurs représentent la moyenne ± SEM; N = 6 pour chaque groupe. ** p < 0,01 ; *** p < 0,001. (b) Effet antidépresseur de l’extrait protéique de T. gaetula (TG) chez les souris. Les valeurs représentent la moyenne ± SEM; N = 6 pour chaque groupe. *** p < 0,001.
3.5 Évaluation du pouvoir analgésique
L’extrait aqueux de T. gaetula révèle un effet antinociceptif important après l’administration de toutes les doses. Dans ce sens, nous avons constaté que l’indice d’analgésie, correspondant au degré de protection de l’animal contre la douleur thermique, varie selon les doses thérapeutiques. Nous notons que la dose 300 mg/kg P.C de l’extrait aqueux de T. gaetula exerce un effet antinociceptif prononcé, avec un indice d’analgésie de l’ordre de 92 % (Fig. 7a). Cependant, nous n’avons relevé aucun effet antinociceptif à toutes les doses étudiées de l’extrait protéique (Fig. 7b).
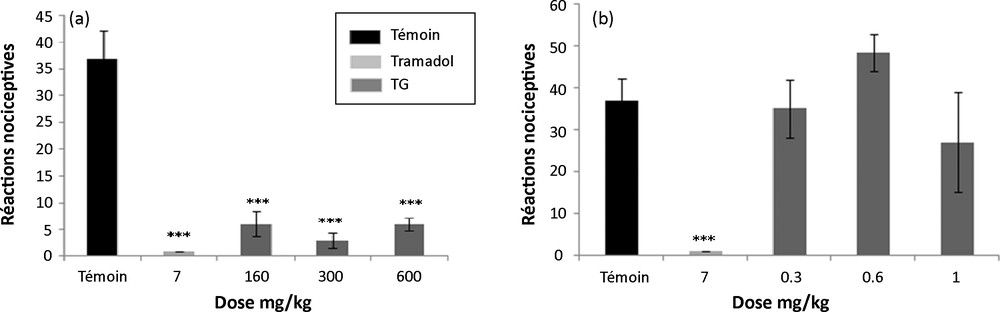
(a) Effet analgésique de l’extrait aqueux de T. gaetula (TG) chez les souris. Les valeurs représentent la moyenne ± SEM ; N = 6 pour chaque groupe. *** p < 0,001. (b) Effet des extraits protéiques de T. gaetula (TG) chez les souris. Les valeurs représentent la moyenne ± SEM; N = 6 pour chaque groupe. *** p < 0,001.
4 Discussion
L’évaluation de la toxicité aiguë de l’extrait aqueux de T. gaetula chez la souris par voie « i.p » a permis de déterminer le seuil infratoxique de cet extrait. Dans ce sens, les doses létales 50 et 100, préalablement établies, sont respectivement 1,2 g/kg P.C et 2,4 g/kg P.C. Toutefois, l’étude menée par Jaouhari et al. [7] démontre une létalité 50 de l’extrait aqueux de T. gaetula à 15,5 g/kg P.C par voie orale. Cette variation de toxicité aiguë est en relation directe avec le mode d’administration [25–27].
Dans un premier temps, nous avons évalué les effets des extraits de T. gaetula sur l’activité proliférative des cellules immunitaires. Tout d’abord, nous avons relevé une potentialisation de la prolifération par l’extrait aqueux et principalement par l’extrait protéique de T. gaetula sur la culture cellulaire des thymocytes. Ce résultat exclue donc toute cytotoxicité et indique que la plante renferme un facteur mitogènique de nature protéique « donnés non publiés » qui stimule spécifiquement les thymocytes. Les splénocytes (lymphocytes T, B et macrophages) sont plutôt inhibés par l’extrait protéique. Si les thymocytes sont stimulés par T. gaetula, l’inhibition observée des splénocytes peut s’expliquer par l’action inhibitrice de la plante sur la prolifération des lymphocytes B et des macrophages. L’étude de ces derniers a révélé en effet une diminution de leur prolifération sous l’effet des extraits de la plante conduisant à une diminution de leur phagocytose. Malgré la stimulation de la prolifération des thymocytes, l’immunité cellulaire va être certainement affectée par la diminution de la prolifération des macrophages et de leur activité phagocytaire, puisque ces derniers participent activement dans la reconnaissance précoce des pathogènes et dans l’activation des lymphocytes T et B par le biais des cytokines tels l’IL-12 et l’IL-10.
Pour les lymphocytes B, on a observé une diminution du nombre des plages d’hémolyse indiquant une inhibition de la réponse humorale surtout par l’extrait aqueux de la plante. Ceci indique que T. gaetula renferme des composés non protéiques tels les saponines [28,29] et les flavones capables de réprimer la production spécifique des anticorps.
Les investigations pharmacologiques ex vivo ont mis en évidence des propriétés de T. gaetula similaires à celles préalablement démontrées in vitro. En concordance avec les travaux de Gaidi et al. [30], l’extrait aqueux de T. gaetula aurait une réponse dose-dépendante. En effet, nous avons constaté des effets différents : (i) immunostimulant à la dose 600 mg/kg P.C (équivalente à la concentration étudiée in vitro), (ii) immunosuppresseur à 300 mg/kg P.C sur les pourcentages des lymphocytes et des monocytes. Nous pouvons expliquer l’effet suppresseur de la dose 300 mg/kg P.C de l’extrait aqueux de T. gaetula sur la population lymphocytaire par les effets cytotoxiques des saponines [30–35]. Cependant, l’effet immunostimulant de la dose 600 mg/kg P.C pourrait être expliqué par l’effet des flavonoïdes [36–41] particulièrement celui des flavones agissant probablement par antagonisme sur les effets des autres composés de la plante (saponines, protéines…). En outre, les protéines concentrées de l’extrait protéique (1 mg/kg P.C) exercent plutôt un effet immunosuppressif. Cette réponse immunosuppressive pourrait être sélective des lymphocytes B sans influencer les lymphocytes T, en s’appuyant sur nos résultats démontrés in vitro.
Concernant la dépression, nous constatons un effet antidépresseur prononcé après l’administration de l’extrait protéique de T. gaetula. Dans ce sens, nous pouvons mettre l’accent sur le rôle que peut jouer les protéines dans cette activité antidépressive, en concordance avec Van Praag [42], Sandyk [43], Young [44] et Meyers [45], ayant montré des effets prometteurs de la tyrosine et de la tryptophane dans le traitement des dépressifs. Nous pouvons soupçonner l’implication d’acides aminés des protéines de nos extraits protéiques, après dégradation protéolytique dans l’organisme, via plusieurs mécanismes : (i) la compensation de la déficience en précurseurs de neurotransmetteurs à partir des acides aminés apportés par les composés protéiques de T. gaetula, tels la tyrosine et la tryptophane, des précurseurs communs de plusieurs neurotransmetteurs (dopamine, sérotonine, etc.), et (ii) l’augmentation de la fluidité membranaire neuronale et celle du nombre des récepteurs de neurotransmetteurs impliqués dans la dépression [46].
Sur le plan analgésique, il apparaît que l’effet anti-nociceptif de T. gaetula est dû principalement aux effets des composés chimiques de l’extrait aqueux. D’autres pistes prometteuses, autres que les protéines, expliqueraient probablement les effets analgésiques de l’extrait aqueux de T. gaetula. Nous pouvons aller dans le sens des effets analgésiques exercés par les saponines type triterpénoide [28,29] et probablement en synergie avec les flavonoïdes de type flavones présents dans cet extrait.
5 Conclusion
Ce travail met l’accent sur des applications thérapeutiques prometteuses à la fois des extraits aqueux et protéique de T. gaetula dans l’immunodulation et le traitement de la douleur et de la dépression. Néanmoins, ce travail reste préliminaire par rapport au mécanisme d’action par lequel agissent les molécules des extraits aqueux et protéique de T. gaetula. Dans ce sens, la réalisation d’autres investigations complémentaires phytochimiques et pharmacologiques sur les aspects étudiés est d’une importance cruciale afin de rechercher et d’identifier de nouvelles substances à multi-activités thérapeutiques, permettant à la fois de réduire le coût du traitement et d’éviter les interactions médicamenteuses dans le cas de manifestations pathologiques multiples.
Remerciements
Nous remercions Pr. Abdeslam ENNABILI de l’Institut National des Plantes Médicinales et Aromatiques (Province de Taounate) pour l’identification botanique du matériel végétal, et le « Center Emiratie Wildlife Propagation (ECWP) », Région de Missour (Maroc) pour le don des animaux.


