Abridged English version
The presentation of the global carbon cycle shows the specific contributions of both soils and biomass to carbon stocks (respectively of 1500 to 2000 Gt and 500 to 650 Gt) and to carbon fluxes that can either contribute to carbon storage or to carbon emission.
In the first part, the spatial distribution of carbon stocks is illustrated for the world and for France. Biomes depend mainly on latitude, but soil carbon stocks are increased by low temperature and hydromorphy, and vary with agricultural practices. This part is completed by a presentation on carbon repartition between biomass and soil for three different ecosystems: a forest, a grassland, and an annual crop. Soil carbon clearly exceeds biomass carbon for the grassland and the crop.
The second part deals with fluxes. A recent historical analysis since 1850 shows that the contribution of terrestrial ecosystems to CO2 emissions has been very important during the last century, in relation with the development of agriculture. Nowadays, if deforestation is still active in the south of the globe (with an annual emission rate of 1.6 GtC), the direction of the flux is reversed to the north, with a carbon sink due to reforestation and some changes in tillage practices.
In the last part, an attempt is made to explain the formation and evolution of a carbon sink through global change (increase in photosynthesis due to increases in CO2, in temperature and in nitrogen deposition). But anthropic actions of prevention through articles 3.3 and 3.4 of the Kyoto protocol could also be very effective. Different solutions are presented: alternatives to deforestation, afforestation, and development of a wood-based energy chain, modifications of agrosystems (with, for example, the development of conservation agriculture), conservation and restoration of grasslands and pastures, desertification prevention.
In conclusion, even if variations and uncertainties are large, it appears that the present participation of terrestrial ecosystems to carbon sequestration is large (over 2 GtC/year). It can certainly be increased by anthropic actions to help in mitigation of climatic change. These actions are important to consider in reference to Kyoto protocol, as they also represent sustainable solutions for environment and development.
1 Introduction
Pour situer la contribution des écosystèmes terrestres à la séquestration de carbone, on peut rappeler les éléments du bilan global du carbone, représentés sur la Fig. 1 d'après les documents de l'IPCC (http://www.ipcc.ch, Intergovernmental Panel on Climatic Change ou en français GIEC, Groupe intergouvernemental d'étude du climat). On voit que le carbone contenu dans la végétation (principalement le bois des arbres) représente presque autant que celui stocké dans l'atmosphère sous forme de CO2, et que l'humus des sols en représente deux fois plus, mais que ces stocks sont faibles devant le carbone minéral contenu dans les océans. Les carbonates des sols représentent quant à eux un stock de 750 GtC, mais n'interviennent pas directement dans le cycle. On remarque aussi l'importance des flux échangés annuellement par la photosynthèse (PPB), la respiration autotrophe (Ra) et la respiration hétérotrophe (Rh). Rh résulte pour l'essentiel de l'activité biologique des décomposeurs qui minéralisent le carbone organique des litières et des sols. Les échanges atmosphère–océan sont aussi élevés ; ils sont provoqués par la différence de pression partielle de CO2 entre la surface de l'eau et l'atmosphère : absorption par les eaux froides sous-saturées en CO2, dégagement par les eaux chaudes sursaturées en CO2. Les flux de carbone provenant de l'utilisation des combustibles fossiles et de la déforestation s'accumulent en partie dans l'atmosphère, et en partie dans les océans et la biosphère continentale.
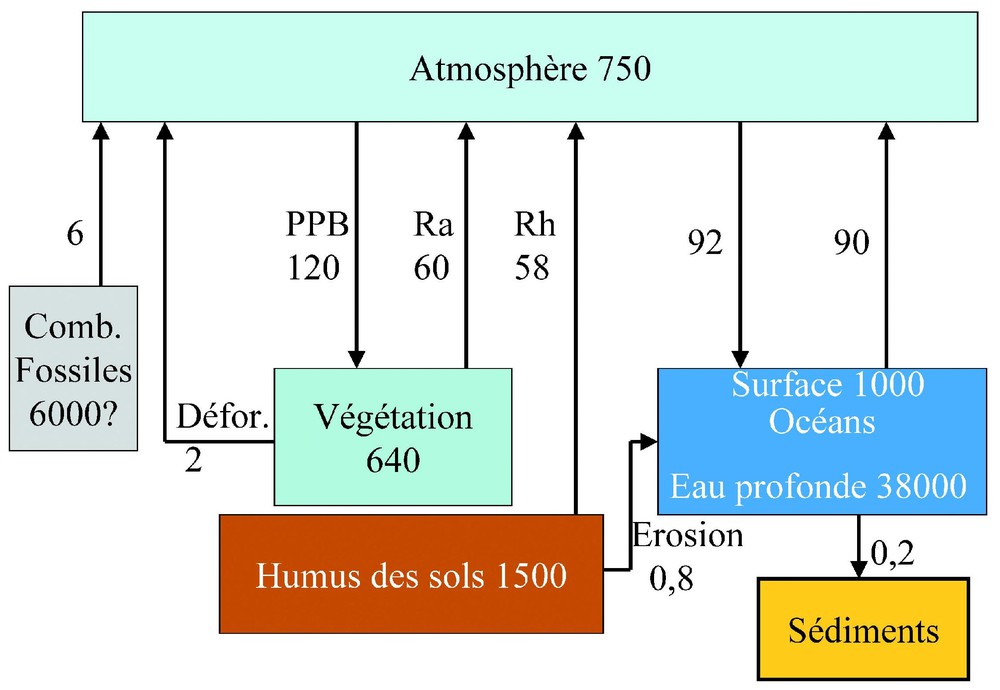
Bilan global du carbone. Les boı̂tes représentent les stocks en milliards de tonnes et les flèches, les flux en milliards de tonnes par an (d'après [19], réactualisé d'après [21]).
Global carbon balance. Boxes represent stocks in billion tons and the arrows the fluxes in billion tons per year (after [19], updated after [21]).
Un bilan de ces flux est donné dans le Tableau 1 pour deux périodes successives. On remarque que malgré une augmentation de la consommation de carbone fossile, le stockage dans l'atmosphère est resté constant, à 3,3 GtC/an (soit une augmentation moyenne de concentration en CO2 de 1,5 ppmv/an), ce qui implique une augmentation de la fixation par les océans et les continents. Les chiffres du Tableau 1 proviennent de mesures précises pour le carbone fossile et l'atmosphère, d'estimations assez grossières pour la déforestation, et d'un modèle ajusté aux mesures disponibles pour les océans. Les chiffres pour les continents sont déduits par différence entre les sources et les puits atmosphérique et océanique. L'existence d'un puits continental important a été confirmée par des modèles inverses déduisant les flux de surface par bandes de latitude du réseau de mesures du CO2 atmosphérique (incluant le 13C du CO2, qui permet de savoir si le flux est d'origine continentale ou océanique [9], et en comparant le gradient latitudinal de concentration en CO2 à ce qu'il serait sans puits continental [12]).
Bilan global de carbone en GtC/an (1 Gt = 1 milliard de tonnes)
Global carbon balance in GtC/year (1 Gt = 1 billion tonnes)
| 1980–1989 | 1990–1998 | |
| Combustion de carbone fossile | 5,5±0,5 | 6,3±0,6 |
| Émissions liées à la déforestation | 1,7±0,8 | 1,6±0,8 |
| Stockage dans l'atmosphère | 3,3±0,2 | 3,3±0,2 |
| Fixation par les océans | 2,0±0,8 | 2,3±0,8 |
| Fixation brute des continents | 1,9±1,3 | 2,3±1,3 |
Dans cette contribution on ne considérera pas le méthane, qui constitue une émission importante pour les sols hydromorphes et les sols de rizière.
On peut donc admettre que la biosphère continentale fonctionne déjà comme un puits et absorbe au moins 2 GtC/an, soit près de 2 % de la fixation photosynthétique ou 3,5 % de la fixation nette après respiration. Le stockage de carbone a nécessairement lieu dans les réservoirs continentaux, soit essentiellement dans la biomasse des arbres et la matière organique des sols. Cependant, une série de questions se pose, auxquelles nous allons essayer de répondre. Comment ce stockage est-il réparti géographiquement ? Peut-on en rendre compte par un modèle mécaniste permettant de prévoir son évolution future ? Peut-on favoriser ce stockage par une gestion ad hoc des cultures, prairies et forêts ?
2 Les principaux stocks de carbone dans les écosystèmes terrestres
Nous tenterons de répondre aux questions posées ci-dessus en regardant déjà la distribution actuelle des biomes (ces grands types de végétation qui dépendent du climat et déterminent la biomasse) et du carbone du sol. La Fig. 2 représente la répartition des biomes, déterminée à partir de données satellitales NOAA–AVHRR, fournissant les variations saisonnières de l'indice de végétation, avec une résolution spatiale de 1 km. L'indice de végétation représente la fraction de sol couverte par des feuilles vertes, et ses variations saisonnières permettent de différencier les principaux biomes. On remarque que les forêts (en vert sur la carte) sont exclues de la surface des continents par le froid des latitudes et altitudes élevées, la sécheresse des zones arides et le défrichement par l'homme dans de nombreuses zones tempérées et tropicales. On a de fortes valeurs de biomasse dans les forêts tropicales, les forêts tempérées (mais avec un mitage lié à l'agriculture) et les forêts boréales. La Fig. 3 représente la carte de répartition du carbone organique du sol, telle qu'elle a été établie par le département américain de l'agriculture (USDA) à partir de données diverses [5,16,30]. On remarque les fortes valeurs de stock dans les hautes latitudes de l'hémisphère nord. Ce stock de carbone dépend de la production végétale, qui amène au sol de la matière organique fraı̂che sous forme de litière aérienne et racinaire, et de la vitesse de décomposition de cette matière organique, qui augmente avec la température, l'humidité et la teneur en oxygène du sol. À haute latitude, la production végétale est assez faible, mais les basses températures et l'engorgement fréquent des sols en eau limitent la décomposition et favorisent donc l'accumulation de matière organique, particulièrement dans les tourbières et les pergélisols. La Fig. 4 présente pour divers biomes la répartition du carbone par unité de surface dans la biomasse [34] et le sol [23]. On retrouve l'importance du carbone des sols par rapport à la biomasse, particulièrement aux hautes latitudes (forêts boréales, toundra) et pour les cultures, prairies et déserts. La biomasse n'est nettement dominante que pour les forêts. On remarque que le stock total moyen de carbone des diverses forêts est de l'ordre de 300 tC/ha, mais que sa répartition varie avec la latitude, majoritairement dans la biomasse en forêt tropicale, dans le sol pour les forêts boréales, et en parties égales dans la biomasse et le sol pour les forêts tempérées.
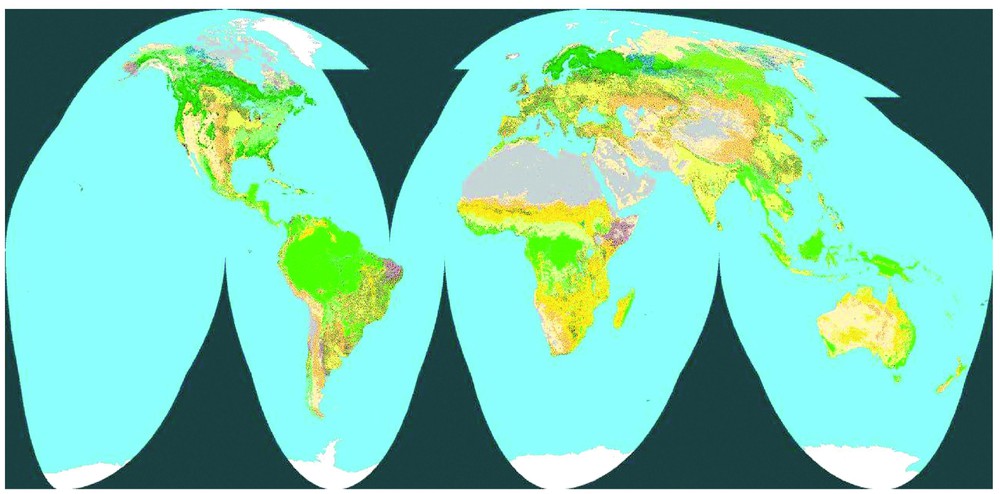
Carte de végétation du globe, établie d'après les variations saisonnières d'indice de végétation du capteur satellital NOAA–AVHRR (d'après [13]).
Vegetation map for the globe, established from seasonal variations of vegetation index (satellite data NOAA–AVHRR ; from [13]).
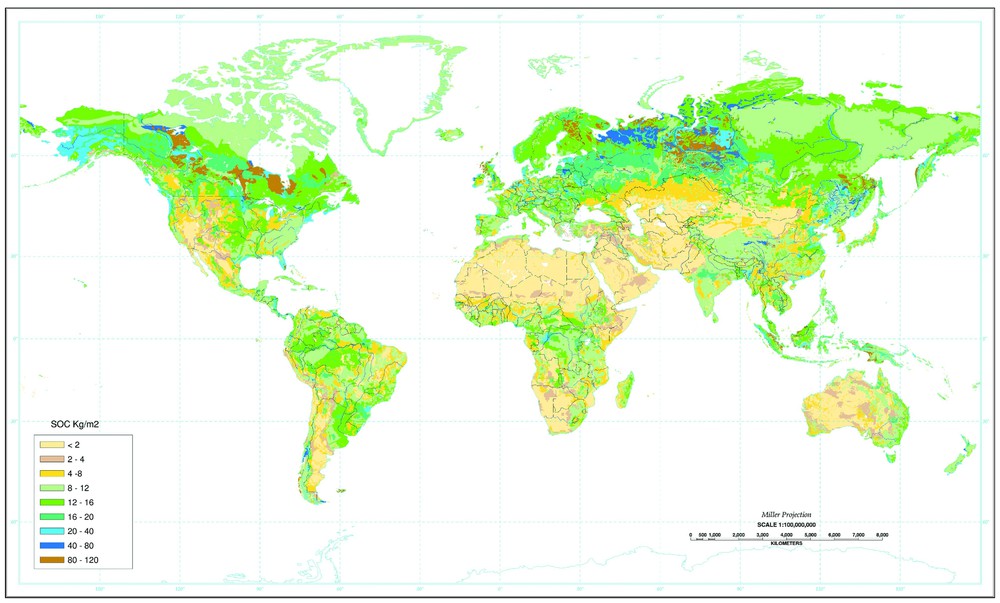
Carte de la distribution des stocks de carbone du sol, établie par l'USDA (département de l'Agriculture des États-Unis). Source : FAO–Unesco (Soil Map of the World, digitized by ESRI. Soil climate map, USDA–NRCS, Soil Survey Division, World Soil Resources, Washington DC, http://www.nrcs.usda.gov/technical/worldsoils/mapindx/soc.html).
Map of soil carbon (from the US Department of Agriculture). Source : FAO–UNESCO (Soil Map of the World, digitized by ESRI. Soil climate map, USDA–NRCS, Soil Survey Division, World Soil Resources, Washington DC, http://www.nrcs.usda.gov/technical/worldsoils/mapindx/soc.html).

Stocks de carbone par unité de surface (tC/ha) dans la végétation et le sol des principaux biomes (d'après [23,30]).
Carbon amounts per unit area (tC/ha) in vegetation and soil of the main biomes (from [23,30]).
Pour évaluer, en climat tempéré, l'importance du mode de gestion sur le bilan carboné, on a représenté sur la Fig. 5 les stocks et flux de carbone pour trois écosystèmes types : une forêt de hêtre, une prairie naturelle et une culture de maı̈s. C'est la culture qui présente la plus forte productivité primaire nette PPN, suivie de la forêt, puis de la prairie. Ces chiffres sont assez représentatifs (comparer aux valeurs de la Fig. 4) : la biomasse d'une forêt adulte varie de 40 tC/ha pour une forêt boréale à 200 tC/ha pour une forêt tropicale, mais on peut trouver des cas extrêmes sur de petites surfaces, avec 1000 tC/ha pour les forêts de séquoias géants de la façade Pacifique de Californie et de l'Oregon. Les stocks de carbone dans les prairies et les cultures sont toujours limités (en général moins de 10 tC/ha). Le stock moyen de carbone du sol varie moins entre les biomes, passant de 50 tC/ha dans les sols désertiques à 250 tC/ha sous forêt boréale (Fig. 4). La relative faiblesse de la production prairiale sur la Fig. 5 provient de sa localisation : il s'agit d'une prairie naturelle située à Matador, près de Swift Current, au sud de la Saskatchewan au Canada, avec une saison de croissance de seulement six mois (avril à septembre), encore réduite d'un mois ou deux par une sécheresse estivale. Des prairies sur sol acide des Cerrados au Brésil peuvent avoir des stocks (essentiellement présents dans le sol) de plus de 200 t/ha. Le stock de carbone est comparable sous prairie et sous forêt et nettement plus faible sous maı̈s. À cause de sa forte biomasse, c'est la forêt qui, des trois écosystèmes, stocke le plus de carbone globalement.
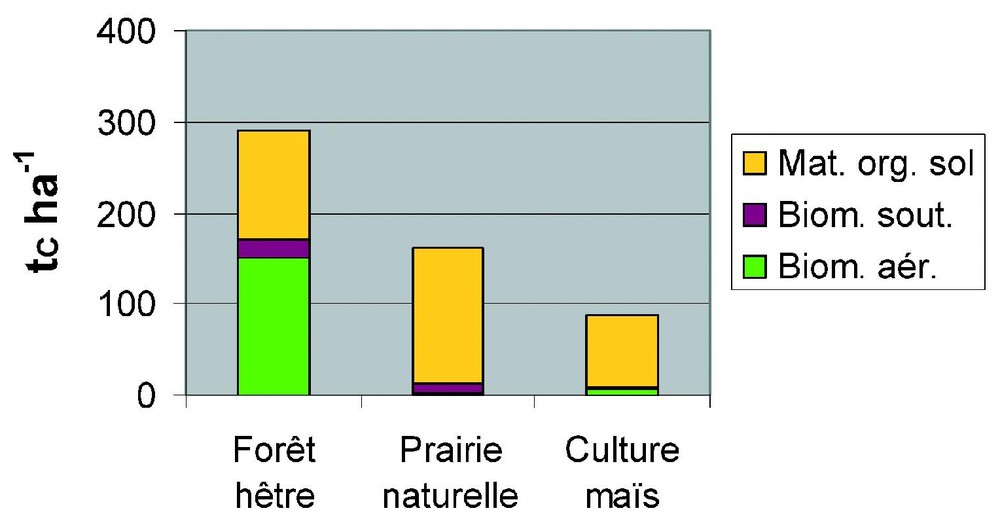
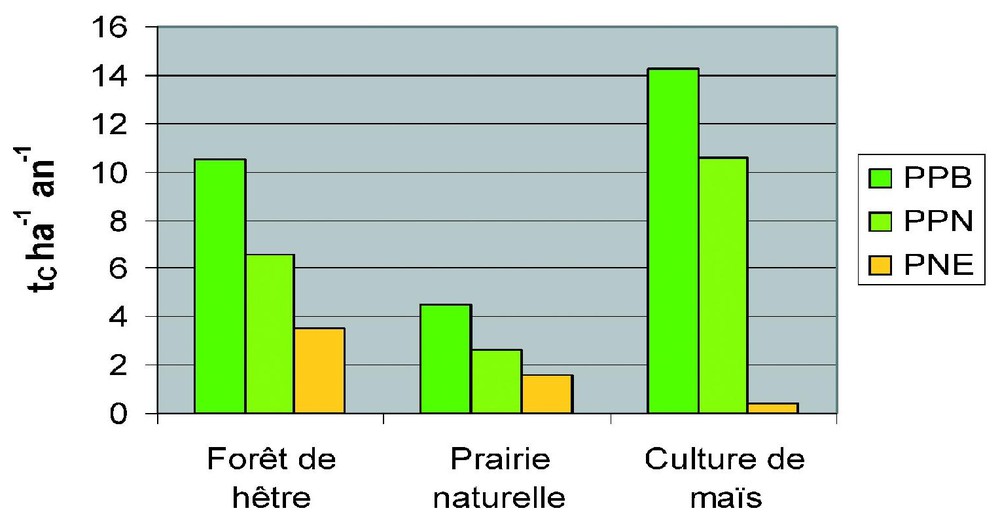
Stocks et flux de carbone dans trois écosystèmes représentatifs des forêts, prairies et cultures. PPB est la productivité primaire brute (carbone fixé par photosynthèse), PPN est la productivité primaire nette (carbone utilisé pour la formation de biomasse), PNE est la productivité nette de l'écosystème, qui correspond au stockage de carbone par cet écosystème.
Carbon stocks and fluxes for three representative ecosystems : forest, grassland and culture. PPB (or GPP) is gross primary production (carbon fixed by photosynthesis), PPN (or NPP) is net primary production (carbon used for biomass formation), PNE (or NEP) is net ecosystem productivity, which corresponds to the storage of carbon by the ecosystem.
Si on considère maintenant la répartition des stocks de carbone du sol au niveau de la France (Fig. 6), le climat (zonalité altitudinale) et le type d'occupation des sols sont les facteurs principaux qui déterminent le stockage du carbone dans les sols [2]. Ainsi, pour une épaisseur de sol de 30 cm, les stocks les plus élevés (100 tC/ha) sont présents dans les sols d'alpage d'altitude, et dans les sols de forêts ou de prairies (70 à 80 tC/ha) ; en revanche, les stocks sont moindres dans les sols cultivés, et plus particulièrement dans les sols de vigne. Le stock de carbone contenu globalement dans les sols de France est de 3,1 GtC. Notons que la valeur des stocks serait beaucoup plus élevée [4] si on prenait une épaisseur de 1 m, les podzols avec l'horizon noir (dit Bh) d'accumulation de matière organique en profondeur, en étant la meilleure illustration. On peut apporter une autre illustration de la complexité du système et donc de la difficulté de modéliser : au sein de la matière organique des sols, on peut ainsi distinguer différents compartiments selon leur taille et leur localisation dans la structure, qui ont des temps de résidence très différents : la matière organique particulaire libre (1 à 2 ans), les petits fragments protégés au sein des agrégats (quelques dizaines d'années) et enfin les acides humiques, à la fois stables sur le plan chimique et souvent liés aux particules d'argile, qui peuvent persister plus de 1000 ans (Fig. 7) [3].
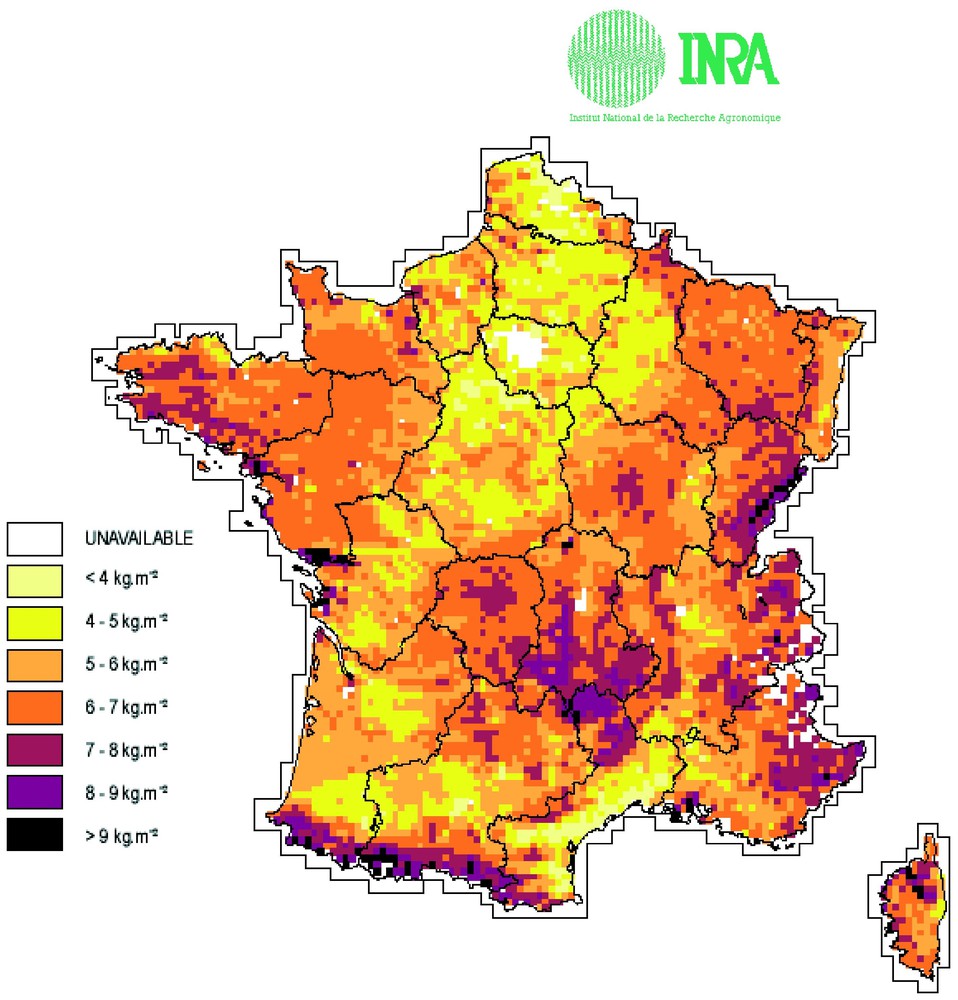
Carte de la répartition du carbone des sols de France, sur une épaisseur de 30 cm (0–9 kg m−2) [2].
Stocks of soil carbon (0–30 cm) in France (0–9 kg m−2) [2].
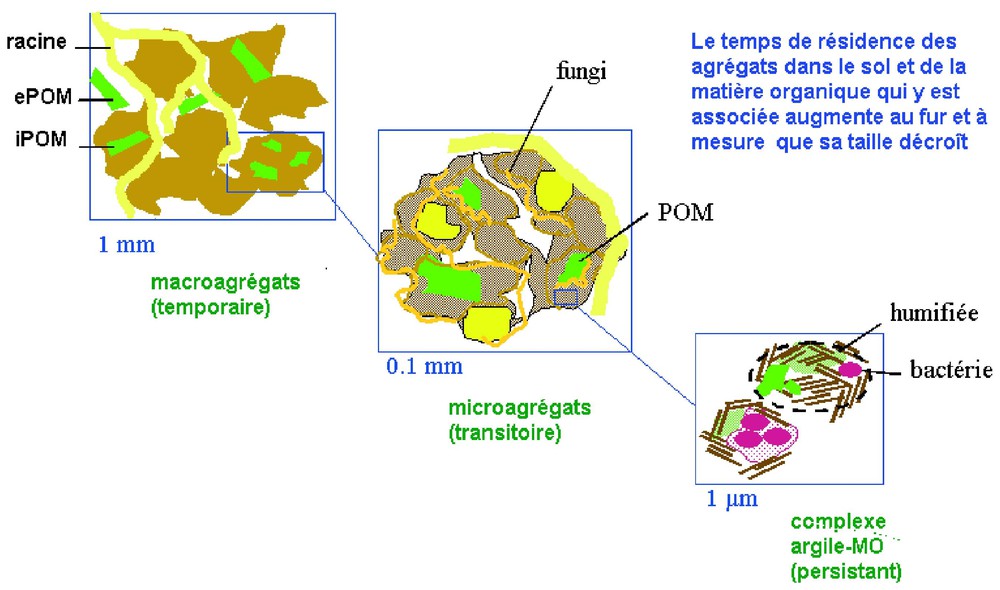
Répartition du carbone au sein des différents niveaux d'agrégation du sol (d'après [3]). Sites de la matière organique du sol dans la matrice du sol (Chenu, non publié). ePOM=particule de matière organique externe, iPOM=particule de matière organique interne.
Carbon location in various kinds of aggregates of the soil matrix (from [3]).
3 Les principaux flux de carbone
3.1 L'évolution historique des flux
L'évolution des émissions mondiales de carbone est représentée sur la Fig. 8. On peut noter qu'avant 1910, année qui marque le début d'un développement industriel important, les émissions provenaient majoritairement du développement de l'agriculture aux dépens des forêts et des prairies (0,6 à 0,7 GtC/an).

Émissions mondiales de carbone (GtC/an) liées à la consommation de combustibles fossiles et aux changements d'utilisation des terres (principalement la déforestation).
World carbon emissions (GtC/year) from energy sources or from land use changes (mainly from deforestation).
À partir de 1950, c'est la déforestation tropicale qui s'intensifie, en particulier en Amérique du Sud et en Asie [6], pour atteindre le taux d'émission actuel, proche de 1,7 GtC/an (la figure indique plutôt 2 GtC/an, en accord avec la dernière estimation publiée par Houghton [18]). Cette déforestation, qui concerne annuellement 15 millions d'hectares environ, est souvent accompagnée de brûlis de la biomasse (slash and burn) et de la minéralisation, sous forme de CO2, d'une bonne partie de la matière organique des sols forestiers. Une évaluation récente [27] pour les incendies de forêts et tourbes de 1997 en Indonésie avance la fourchette, considérable, de 0,81 à 2,57 GtC. Ceci est également illustré par la Fig. 9, qui montre l'évolution du stock de carbone du sol au cours d'une mise en culture de forêt [1] ; le résultat serait le même (50 % de perte en moins de 10 ans), si on partait initialement d'une prairie naturelle. À un niveau régional (plaine centrale des États-Unis), on peut observer sur la Fig. 10 le même phénomène de perte de carbone, lié à la mise en culture des terres de prairie jusqu'en 1950 [7], année à partir de laquelle on constate une stabilisation, suivie d'une remontée du stockage de carbone dans les sols, sous l'influence d'une politique de lutte contre l'érosion avec réduction du labour (pratiques dites de conservation).

Courbe typique de décroissance du stock de carbone d'un sol forestier après mise en culture [1].
Typical decrease of soil carbon, following forest clearing and cultivation [1].

Changements simulés des stocks de carbone du sol (0–20 cm) de 1907 à 1990 pour la plaine centrale à blé des États-Unis.
Simulated changes in soil carbon (0–20 cm) from 1907 to 1990 for the central US Corn Belt.
3.2 La mesure des stocks et flux et de leur variation
Comment améliorer nos estimations de l'absorption de carbone par les écosystèmes terrestres ? Deux pistes sont possibles. L'une passe par une mesure des stocks et de leurs variations, l'autre par une intégration du flux vertical de CO2 échangé entre l'écosystème et l'atmosphère. Pour les stocks de carbone des forêts françaises, on peut utiliser les données de l'Inventaire forestier national (IFN), avec les limites indiquées dans ce numéro par Dupouey : en moyenne 120 000 placettes sont mesurées tous les 10 ans (volume de bois fort sur pied, qu'il faut ensuite convertir en biomasse en ajoutant les branches, puis en carbone), mais sans revenir sur les mêmes placettes, ce qui limite la précision sur l'estimation de la variation. Dans l'avenir, une partie au moins de ces placettes devrait être géoréférencée.
Les teneurs en carbone des sols sont particulièrement hétérogènes (Fig. 6), et l'on a disposé d'environ 18 000 échantillons d'analyse, mais sur 30 cm de profondeur seulement et avec une répartition préférentielle dans les sols cultivés qui ont fait l'objet de demandes d'analyses par les services spécialisés. Dans l'avenir, on utilisera les 2100 sites géoréférencés du nouveau réseau de surveillance des sols (RMQS), en cours de mise en place, avec une maille de 16 km sur 16 km, où l'on mesurera à la fois le profil de densité et de teneur en carbone. On peut envisager alors d'estimer une variation de stock de manière statistique sur un intervalle de 5 à 10 ans. L'expertise de l'Inra souligne le coût élevé de ces opérations statistiques si l'on veut se replacer dans une procédure stricte de vérification pour le protocole de Kyoto.
Les mesures de flux de CO2 au-dessus des écosystèmes sont pratiquées de façon continue (une mesure par demi-heure en général) en routine, dans environ 150 sites dans le monde (voir la carte sur la Fig. 11). Trois de ces sites sont situés en France : un en Lorraine, sur une jeune hêtraie à Hesse, près de Sarrebourg ; un sur une plantation de pin maritime, près de Bordeaux ; un sur taillis de chêne vert, au nord de Montpellier. Deux autres sont en préparation, l'un dans la forêt de Barbeau, à l'ouest de Fontainebleau, sur chêne sessile, l'autre en forêt tropicale, près de Kourou, en Guyane. La Fig. 12 présente le flux de carbone journalier (somme algébrique sur 24 h) au-dessus de la hêtraie de Hesse en 1997 [17]. Le flux est contrôlé par la phénologie (dates d'apparition et de sénescence des feuilles), avec des valeurs positives en hiver, correspondant à un dégagement de CO2, et des valeurs négatives pendant la saison de croissance, dont l'amplitude dépend de l'intensité du rayonnement solaire et de la disponibilité en eau du sol.
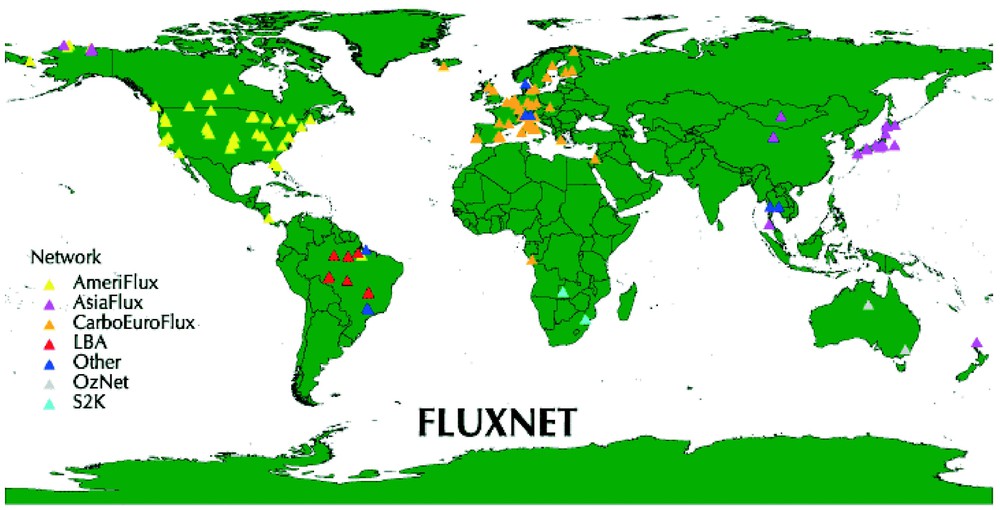
Répartition des stations de mesure du flux de CO2 au-dessus de couverts végétaux (http://www-eosdis.ornl.gov/FLUXNET/index.html).
Sites used for the measurement of CO2 fluxes above vegetation canopies (http://www-eosdis.ornl.gov/FLUXNET/index.html).
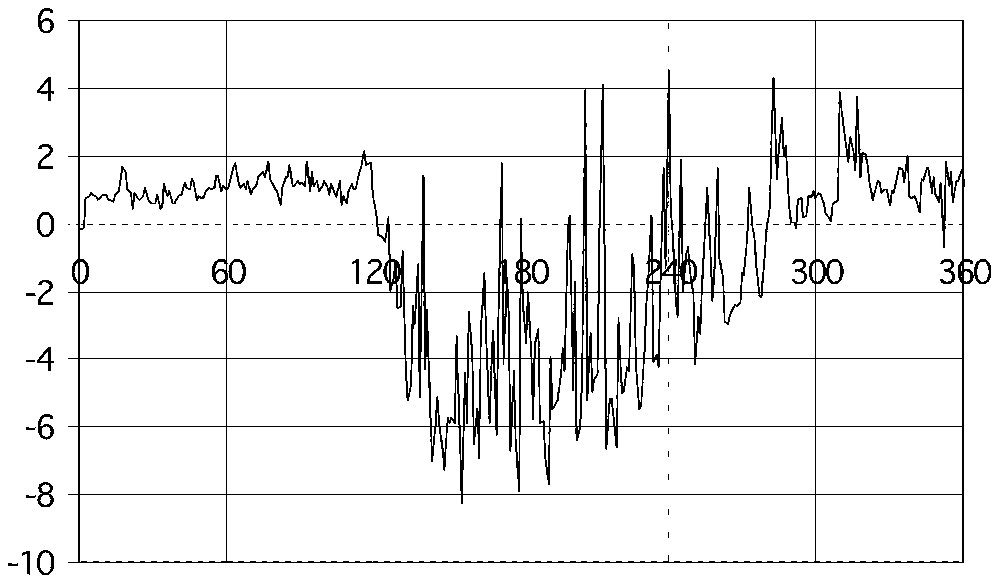
Flux net journalier de carbone (gC m−2 j−1) au-dessus d'une jeune hêtraie en 1997, mesuré par la méthode des corrélations [17]. Une valeur positive correspond à un dégagement de CO2 par l'écosystème.
Net carbon daily flux (gC m−2 j−1) above a young beech forest in 1997, as measured by eddy correlation [17]. A positive value means a release of CO2 by the ecosystem.
Ces mesures de flux sont adéquates pour tester les modèles de processus, mais leur intégration sur une année fournit des valeurs entachées d'une grande incertitude, car résultant d'une différence faible entre deux valeurs élevées, celle de la photosynthèse et celle de la respiration globale de l'écosystème. Les erreurs inévitables commises certains jours ne se compensent pas nécessairement. En particulier, on sait que les mesures de respiration nocturne sont fort imprécises lorsque la vitesse du vent est faible et la turbulence intermittente, et il serait important de les doubler par une estimation indépendante, ce qui est prévu sur les sites français, en utilisant un traceur comme le radon. Même lorsqu'on parvient à sommer le flux de CO2 sur une longue période, on obtient seulement une estimation locale de la fixation de carbone. Un massif forestier géré comme celui de Fontainebleau (ou des Landes) comporte de nombreuses placettes avec des arbres d'âges variés, qui subissent, à intervalles réguliers des coupes d'éclaircie ou d'exploitation. Pour estimer le carbone séquestré au niveau d'un massif, il faut combiner un modèle local de bilan carboné avec une carte de distribution spatiale des peuplements, comme celle établie par l'ONF à Fontainebleau. Le laboratoire d'écophysiologie végétale d'Orsay (Éric Dufrêne et Valérie Le Dantec) a réalisé cette intégration spatiale sur la partie sud du massif de Fontainebleau, en utilisant comme paramètres d'entrée du modèle des données estimées par satellite (indice foliaire, teneur en azote du feuillage). Ceci a permis d'établir les cartes de la Fig. 13, représentant la production primaire nette (PPN, carbone fixé dans la biomasse) et la production nette de l'écosystème (PNE, carbone stocké dans l'écosystème). Il reste à valider cette distribution spatiale, en particulier à partir de la production de bois, qui peut être estimée à partir des analyses de cernes sur des carottes d'arbres (prélèvements non destructifs). Pour être complet, il faut aussi se préoccuper du devenir du bois exporté de la forêt : recyclage rapide vers l'atmosphère pour du bois de chauffage (filière bois–énergie), ou stockage à long terme dans une charpente ou des meubles (filière bois–matériau) ?

Estimation de la productivité primaire nette et de la productivité nette de l'écosystème pour divers peuplements de la forêt de Fontainebleau. Sorties du modèle Castanea, utilisant pour entrées des valeurs d'indice foliaire et de teneur en azote des feuilles, estimées à partir de données avion de réflectance multispectrale [24].
Estimation of net primary productivity and of net ecosystem productivity for various stands of the Fontainebleau forest. Outputs of the Castanea model, using as inputs values of leaf area index and of leaf nitrogen content, estimated by multispectrum reflectance aircraft data [24].
Un autre aspect concerne les forêts non exploitées, rares en zone tempérée, mais encore fréquentes dans les zones tropicales et boréales. Dans ces forêts naturelles, les arbres âgés meurent, ce qui provoque la formation d'une trouée dans le feuillage, favorisant la pénétration de la lumière au sol. Il en résulte une germination des espèces sensibles à la lumière, et une plus forte croissance des espèces déjà présentes, ce qui engendre une mini-succession écologique. La forêt naturelle se présente ainsi comme une mosaı̈que de petites placettes de taille moyenne, égale à celle d'un houppier d'arbre adulte (ou de plusieurs lorsqu'il y a une tempête, ou un feu, ou une attaque de parasites). La théorie écologique prévoit que le bilan carboné d'un tel écosystème en équilibre avec le climat (et appelé climax pour cette raison) est nul, le carbone nécessaire à la croissance des arbres étant entièrement fourni par la respiration autotrophe et hétérotrophe. Mais cette théorie suppose un environnement constant (climat, composition de l'atmosphère), ce qui n'est plus le cas. Comment les changements globaux en cours modifient-ils le bilan carboné de ces écosystèmes « naturels »? Nous avons la chance d'avoir, à Fontainebleau, quelques parcelles en réserve intégrale, qui n'ont subi que peu ou pas de coupes depuis le temps de Louis XIV (qui aimait chasser et avait demandé de créer quelques réserves pour le gibier). C'est un excellent modèle pour étudier si une forêt « naturelle » stocke plus ou moins de carbone qu'une forêt gérée par l'homme. On n'a pas encore de données pour conclure, mais on ne pourra pas expliquer l'importance du puits de carbone de la biosphère continentale sans prendre en compte ces forêts non gérées.
Le puits global de carbone résulte d'un déséquilibre entre les flux représentés sur la Fig. 1. La fixation de carbone augmente pour plusieurs raisons : la photosynthèse de la plupart des plantes (et de tous les arbres) est stimulée par l'augmentation actuelle du CO2 atmosphérique, et par l'augmentation des dépôts azotés liés aux activités humaines ; par ailleurs, la durée de la saison de croissance augmente avec le réchauffement dans les zones tempérées et boréales [26]. La respiration autotrophe des plantes et des animaux suit avec retard cette augmentation, ce qui provoque un stockage de carbone dans les écosystèmes. Une indication claire de l'augmentation des échanges végétation–atmosphère est fournie par l'augmentation des fluctuations saisonnières du CO2 atmosphérique, qui dépend à plus de 80 % des échanges avec les continents [22]. Si le puits global est assez bien estimé, sa répartition géographique est encore incertaine. On a vu la difficulté d'estimer à l'échelle locale le flux net annuel de carbone, qui résulte d'une différence faible entre la photosynthèse du couvert et la respiration de l'écosystème. Il serait préférable de mesurer directement la variation de stock de carbone dans la biomasse et le sol, mais les stocks sont importants et leurs variations faibles, ce qui rend la mesure difficile. Concernant les forêts tropicales non exploitées, Phillips et al. [28] estiment, à partir de mesures sur environ 50 sites, que les forêts néotropicales ont augmenté leur stock de carbone dans la biomasse de 0,7±0,3 tC ha−1 an−1, suggérant que ces forêts pourraient représenter 40 % du puits biosphérique de carbone. Mais Chave et al. [8] ont critiqué ces mesures, certaines étant réalisées sur des parcelles de trop petite surface, et trouvé que la forêt tropicale de Barro Colorado au Panama avait accumulé seulement 0,1±0,3 tC ha−1 an−1 au cours des 15 dernières années. Le débat n'est donc pas clos. On peut espérer dans l'avenir l'aide de techniques non destructives, comme la mesure des hauteurs des arbres par lidar [14] ou la mesure du carbone du sol par diffusion inélastique de neutrons [36].
3.3 La modélisation des flux de carbone
Il existe plusieurs types de modèles pour simuler les flux de carbone de l'échelle locale à l'échelle globale.
Les plus simples utilisent des relations empiriques entre la production végétale et des facteurs du milieu tels que la température moyenne annuelle ou les précipitations annuelles [25]. Ils permettent de tenir compte des changements climatiques, mais pas des changements de composition de l'atmosphère, qui modifient aussi la production via la photosynthèse.
D'autres, encore très simples mais plus réalistes, utilisent le fait que la production d'un couvert végétal est, en première approximation, proportionnelle au rayonnement solaire absorbé par ce couvert [32,33]. Comme on peut estimer à partir de satellites le recouvrement végétal et le rayonnement incident, on peut en déduire le rayonnement absorbé, puis la production sur de grandes surfaces. L'avantage de la méthode est de bien prendre en compte la variabilité spatiale par la mesure satellitale. Ses limites sont qu'elle ne permet pas de prédire l'évolution future des flux de carbone, puisqu'elle dépend de mesures, et que la respiration hétérotrophe (des décomposeurs du sol principalement) doit être estimée par une autre méthode.
D'autres modèles sont dits mécanistes, car ils traitent explicitement les mécanismes de la production et de la décomposition de matière organique : photosynthèse (de la feuille au couvert), respiration autotrophe et hétérotrophe, répartition des assimilats, phénologie et croissance (voir [10] pour une revue). Les facteurs agissant sur la production, comme l'eau ou l'azote, sont simulés de façon empirique ou mécaniste selon les modèles. Ce type de modèle est en général élaboré pour une végétation particulière, dont les mesures servent à déterminer les paramètres du modèle. La difficulté est alors d'obtenir des cartes de répartition spatiale de ces paramètres à l'échelle désirée. Aussi, pour les modèles globaux, on cherche à simplifier au maximum la description des processus, de façon à limiter le nombre de paramètres. Un point délicat lconcerne l'acclimatation des processus à des changements de condition de milieu. On peut simuler la réponse de la photosynthèse à l'augmentation du CO2, en supposant qu'elle est identique à la réponse instantanée de la feuille, mais l'expérience a montré que souvent la réponse à long terme est moins marquée que la réponse instantanée. Il en est de même pour la réponse de la respiration (de la plante ou du sol) à la température. Ces phénomènes sont souvent non pris en compte dans les modèles.
En ce qui concerne la réponse du carbone du sol aux changements globaux et en particulier au réchauffement climatique, on peut déjà craindre une minéralisation importante de la matière organique (avec émission de CO2) des sols boréaux, des tourbes et sols d'altitude. Dans les autres cas, il faudra à la fois tenir compte de l'accroissement des retours de biomasse au sol, et de l'augmentation des émissions due à la stimulation de la respiration hétérotrophe, sachant que, là aussi, peuvent jouer des phénomènes d'acclimatation.
4 Les évolutions possibles sous l'action anthropique
Les évolutions constatées dans le passé sont partiellement réversibles si une volonté politique est clairement affichée, comme c'est le cas actuellement dans le cadre du protocole de Kyoto.
Le reboisement a déjà commencé dans la partie nord du globe depuis les années 1980 (plus de 1,3 million d'ha par an, avec près de 20 000 ha par an pour la France [29]). Ces pratiques devraient être encouragées par l'article 3.3 du Protocole, qui concerne les boisements, mais avec des quantités contingentées par pays (0,88 MtC par an pour la France). En réalité, un potentiel élevé (de près de 10 millions de tonnes) existe en forêt, correspondant à des taux annuels de 4 à 8 tC/ha de séquestration, avec une durée de vie d'une centaine d'années ou plus, si on développe les filières bois–matériau, et une économie des émissions de carbone fossile dans le cas d'une filière bois–énergie.
Le protocole de Kyoto a peu abordé le problème des déforestations dans la partie sud du globe car, pour l'instant, seuls les pays industrialisés sont concernés. Déjà, des possibilités existent dans le cadre des MDP (mécanismes de développement propres), qui correspondent à des investissements dans le Sud (économies d'énergie) des pays du Nord. Des alternatives existent à la déforestation émettrice de carbone, en particulier par le développement de l'agroforesterie, qui comprend des systèmes mixtes culture/arbres très variés et très intéressants à de nombreux points de vue (fixation du C, économique, environnemental...).
Dans les agrosystèmes, des changements d'occupation des terres ou des changements de pratiques agricoles peuvent également favoriser une séquestration du carbone dans les sols.
La réimplantation de forêts ou de prairies sur des terres cultivées entre dans ce cadre et l'on aura le cumul de l'accroissement du carbone de la biomasse et de celui du sol, le premier étant évidemment largement majoritaire dans le cas de la forêt, d'un facteur 10 (taux d'au moins 5 tC/ha/an par rapport à un accroissement maximum de 0,5 tC/ha/an pour le sol).
Une meilleure gestion des pâturages et des terres de parcours offre un potentiel de séquestration (0,1 à 1 tC/ha/an) considérable au niveau mondial, si l'on considère qu'ils couvrent plus de 2 milliards d'hectares [23].
L'article 3.4 du Protocole, qui concerne de tels changements d'occupation ou de pratique, a été adopté à Bonn (conférence des parties COP 6) sans limitation de surface ou de quantité de carbone stockée. Les pratiques culturales concernées peuvent être très variées et concernent toutes une meilleure gestion de la matière organique des sols (Fig. 14), soit en augmentant les apports, soit en diminuant les pertes. On manque encore de données précises régionalisées (qui nécessitent des expérimentations agronomiques de longue durée) sur les gains de carbone possibles. Des évaluations réalisées au niveau européen [15] ou français [20] nous fournissent néanmoins des gammes de variation (0,1 à 0,5 tC/ha/an) pour les taux de séquestration des différentes pratiques agricoles, que ce soient les apports de matière organique ou la modification des pratiques aratoires (labour...).
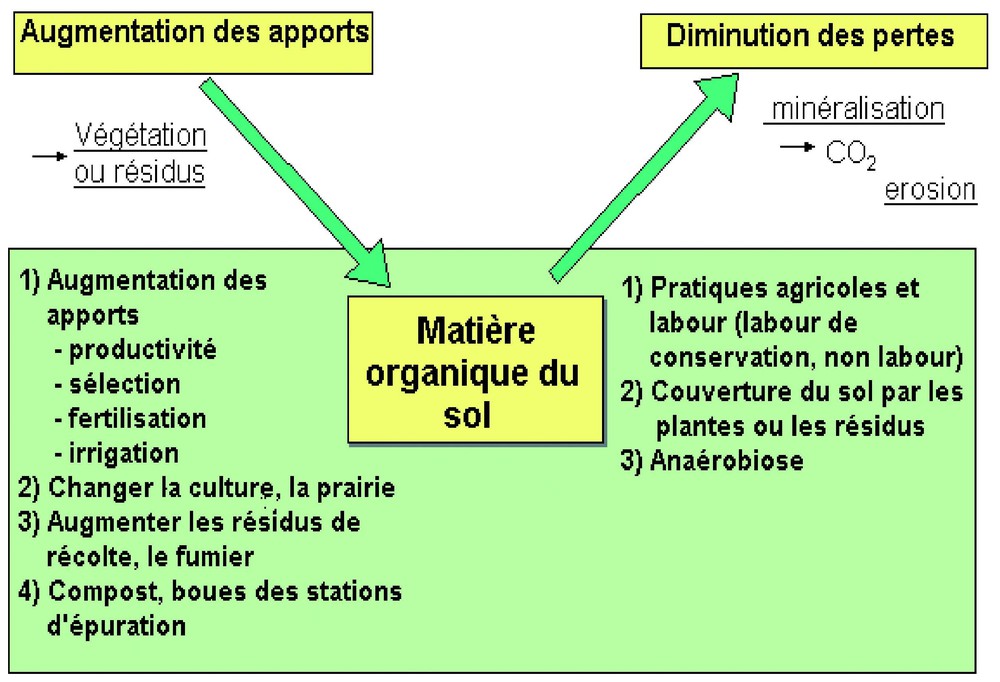
Pratiques utilisables pour favoriser le stockage de carbone par les sols agricoles.
Available tools to induce carbon sequestration in cultivated soils.
La mise en prairie (0,5 à 1 tC/ha/an), l'enherbement des vignobles ou des vergers, l'établissement de jachères permanentes ou de haies de bocages peuvent constituer des moyens plus efficaces.
4.1 Quelques exemples au niveau mondial
L'exemple le plus ancien est celui du développement d'une politique de protection des sols aux États-Unis. Le constat a été fait, dès 1930, que le labour pratiqué sur les terres limoneuses récemment mises en culture conduisait à une érosion éolienne catastrophique (le dust bowl ). Des mesures ont alors encouragé une mise en réserve sous prairie permanente des terres les plus fragiles (15 millions d'ha) et des pratiques, dites de conservation, gardant le sol en partie couvert par les résidus des cultures (actuellement 41 millions d'ha sont concernées). Bien sûr, ces mesures se sont accompagnées du développement d'un service de conservation des sols très développé et de financements spéciaux (une partie est éco-conditionnelle) destinés aux agriculteurs, régulièrement réajustés dans les différentes lois agricoles ( farm bills). Le bilan du carbone stocké est très positif, ce qui n'était pas l'objectif recherché, puisque les gains seraient de 6 millions de tC/an sous prairie et de 15 millions avec la réduction du labour. Des scénarios étendent l'expérience aux 170 millions d'ha de terres cultivables des États-Unis.
L'agriculture de conservation (Madrid 2001) regroupe actuellement différents systèmes de culture, qui vont des techniques culturales simplifiées (TCS) au non-labour, qui implique un semis direct d'une culture sur les résidus de la culture précédente, le sol restant toujours couvert, soit par une plante dite de couverture, soit par des résidus végétaux ou un paillis. Cette forme d'agriculture, très développée en Amérique du Sud (en particulier au Brésil et en Argentine) concerne 60 millions d'ha. Elle est évidemment très recommandée lorsque les sols sont menacés. Le Cirad [11] s'est impliqué depuis plus de dix ans dans le développement de ces nouveaux systèmes de culture.
L'Europe s'intéresse actuellement, dans le cadre de la future réforme de la politique agricole commune, à toutes les pratiques agricoles faisables au plan agronomiques, capables de séquestrer du carbone et susceptibles de présenter des avantages environnementaux. Un développement de ces pratiques pourrait stocker, selon certains scénarios, de 16 à 19 millions de tC par an, ce qui correspond à environ 1,6 % des émissions [15].
En France, l'expertise confiée à l'Inra par le ministère de l'Écologie et du Développement durable (MEDD) constitue une bonne base critique sur la question de séquestration du carbone dans les sols agricoles, et fournit également des scénarios réalistes (1 à 5 millions de tC/an, correspondant à 1 à 2 % des émissions totales). De nombreuses recherches sont actuellement en cours sur le sujet, dans le cadre des programmes « Gestion et impact du changement climatique » (GICC) et « Gestion durable des sols » (Gessol).
4.2 Les bénéfices des pratiques séquestrant le carbone
Comme nous avons déjà pu le voir avec le cas des États-Unis, on est typiquement dans une optique de win-win situation, c'est-à-dire qu'une pratique visant à stocker le carbone possède d'autres avantages. Les bénéfices potentiels, actuellement insuffisamment quantifiés, sont multiples (Tableau 2). À côté de la prévention de l'effet de serre, on doit mettre en avant la protection des sols contre l'érosion, et l'accroissement de la teneur en matière organique qui détermine une série de propriétés (stabilité de la structure, capacité d'échange cationique) et un accroissement de l'activité biologique (en particulier de la faune). Dans les régions soumises à la désertification, ce serait un bon moyen de prévention ou de lutte. À côté de ces bénéfices [35], on doit également mieux évaluer les nouveaux problèmes susceptibles d'être créés du fait d'une utilisation accrue des herbicides et de l'émission éventuelle d'autres gaz à effet de serre (par exemple, N2O).
| Lutte contre l'effet de serre |
| Protection des sols contre l'érosion et la dégradation |
| Accroissement de la qualité physique chimique et biologique |
| des sols |
| Accroissement de la biodiversité (faune...) |
| Régulation du cycle et de la qualité de l'eau |
| Économies de temps de travail et d'énergie pour les |
| agriculteurs (fuel) |
| Agriculture plus durable |
Les primes accordées actuellement au stockage du carbone ne constituent pas une incitation suffisante pour l'agriculture des pays développés (sauf si elles sont éco-conditionnelles, comme aux États-Unis) ; en revanche, elles peuvent constituer un moyen efficace pour le développement d'une agriculture durable au sud du globe.
5 Conclusion
Les écosystèmes terrestres représentent un potentiel de séquestration important :
- – ce potentiel fonctionne déjà, de manière involontaire, avec un puits d'environ 2 GtC an−1 ;
- – il pourrait être augmenté (d'un facteur 2 ?) par des actions volontaires sur la gestion des forêts (et de la déforestation), des prairies (et terres de parcours) et le développement de l'agroforesterie et de nouvelles pratiques en agriculture ; la séquestration dans la biomasse peut représenter des taux annuels relativement élevés (1 à 10 tC/ha/an) ; ceux concernant les sols sont dix fois moins élevés, mais ils peuvent concerner des surfaces considérables ;
- – cela nécessiterait cependant des incitations fortes au niveau mondial européen ou national (Protocole de Kyoto, Fonds mondial pour l'environnement, Banque mondiale, Politique agricole commune, contrats territoriaux d'exploitation ou d'agriculture durable...).
On doit être conscient des limitations importantes qui existent concernant la séquestration du carbone dans les écosystèmes : la capacité et la durée de séquestration (inférieure à 100 ans), sa permanence (réversibilité possible des phénomènes puits–source en cas de changement de politique). Une politique volontariste de séquestration peut retarder l'accroissement de la teneur en CO2 de l'atmosphère pendant quelques décennies ; elle ne peut pas se substituer à la réduction nécessaire des émissions.
Le développement de ces nouveaux systèmes ou nouvelles pratiques de culture doit donc impérativement être lié à d'autres bénéfices environnementaux : protection des sols, biodiversité, lutte contre la désertification. On a donc un bon exemple des interactions pouvant exister entre les trois grandes conventions sur le climat, la biodiversité et la désertification.
Des surprises restent possibles, liées à l'évolution des écosystèmes continentaux du Nord (zone boréale) et, plus généralement, des pergélisols et des sols organiques (tourbières), qui représentent actuellement des puits de carbone et qui peuvent devenir des sources d'émission de CO2 sous l'influence du réchauffement climatique.
Des incertitudes encore très grandes (capacité de séquestration, durée, vérification, émission d'autres gaz à effet de serre) persistent. Il est donc nécessaire de développer les recherches et des expertises aux niveaux mondial, européen et français (cf. travaux de l'IPCC, des programmes CarboEurope, GICC, expertise Inra sur l'agriculture).
Précisons enfin que la solution à long terme pour lutter contre l'accroissement des gaz à effet de serre est bien sûr une limitation des émissions provenant de l'utilisation du carbone des combustibles fossiles, mais aussi de celui provenant de la déforestation, des émissions de CH4 et de N2O provenant de l'agriculture. Les solutions passant par l'accroissement du carbone de la biomasse ou des sols représentent des solutions écologiques, à mieux évaluer, pouvant permettre, à court ou moyen terme, de compenser une partie de l'accroissement des gaz à effet de serre, en attendant le développement de solutions énergétiques alternatives.



