Abridged English version
1 Introduction
The need for permanent observations in coastal marine waters was highlighted during the last two decades in order to understand the consequences of global and local environmental changes on marine ecosystems. In coastal waters, with the respective variability levels in physical and biological processes, their mutual interactions and their high seasonal amplitude, the problem of an appropriate periodicity for an observation strategy over several years remains a critical point. Long-term series must be conducted with the narrowest measuring step possible in order to collect valuable information over natural processes that may range from some hours to some years. In order to examine some aspects of this record-sampling problem, since 1994, a series of 30-min measurements in the shallow waters located under the laboratory (Station marine d'Endoume-Marseilles, France) was conducted.
2 Data acquisition and methods
The instrumented platform for this CAPCOM series is composed of underwater sensors for temperature, conductivity, dissolved oxygen (DO) and pH that are permanently immersed at 1.5-m depth and aerial sensors for light, wind speed and direction. All sensors are wired-connected first to an analogue-digital interface and then to a microcomputer that pilots the sensor successive interrogations (32 measurements each 30 min), achieves half-an-hour statistical treatments and saves the 30-min averages in electronic files. From this nine-year database, the 1998, 1999, and 2000 records are considered here. DO and pH data have been processed thanks to S and T measurements to calculate DO saturation levels [15] and pH at a constant T of 25 °C (hereafter pH25) [22].
3 Seasonal variations
On a daily-averaged basis, DO and pH values exhibited marked seasonal variations (Fig. 1). DO were generally in slight over-saturation, yet less pronounced in fall and winter. Regular seasonal variations are mostly explained by the temperature dependence of O2 solubility, hence lowest values were observed in warm months. Conversely, due to the low efficiency of air–sea CO2 exchange and the strong spring and summer activity of benthic and planktonic primary producers, pH25 values increased during these periods and exhibited highest values at the end of the summer.

Moyennes journalières de certains paramètres physico-chimiques mesurés in situ (1,5 m de profondeur) au site atelier de la station marine d'Endoume pour les années 1998–2000. A. Teneur en oxygène dissous (ronds gris), valeurs à saturation (triangles noirs). Les données d'irradiance cumulées sont présentées à titre indicatif (carrés noirs, n=906). B. pH in situ (ronds gris, n=967), pH25 (triangles noirs, n=903) et température (trait fin, le trait épais correspond à l'ajustement polynomial pour chaque année).
Daily mean values of some physicochemical parameters measured in situ (1.5 m depth) at the study site during the 1998–2000 period. A. DO (grey dots), DO saturation values (dark triangles) and Surface daily integrated irradiance values. B. In situ pH (grey dots), pH25 (dark triangles) and temperature (thin line, the thick line corresponds to annual polynomial fit).
4 Daily, hourly and short term variations
At a daily time scale, DO and pH variations were strongly correlated and showed marked circadian variations (Fig. 2). Diurnal dynamics were broadly dependent on light levels and illumination duration as shown for winter and summer time monthly mean recordings (Fig. 3), DO and pH25 reach synchronously their lower and upper values, for these later, most of the time, 2 to 3 h before sundown. Relations with light variations have also been documented by considering rapid changes occurring during cloudy day (Fig. 4). The DO and pH response was observed for a time span as short as 30 min. This frequency appears as a good compromise for the DO and pH dynamics at the study site.
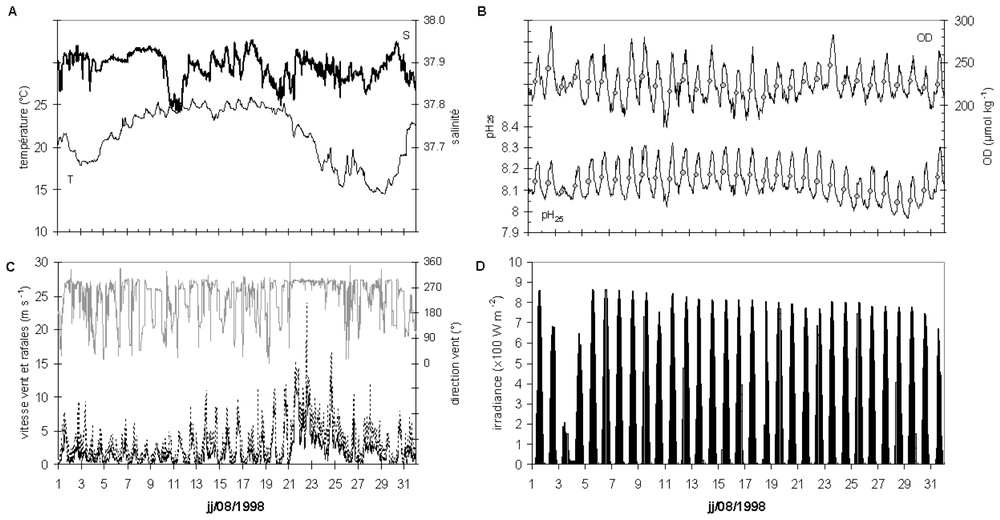
Variations de certains paramètres physico-chimiques mesurés in situ (à 1,5 m de profondeur) et météorologiques au site atelier de la station marine d'Endoume durant le mois d'août 1998. A. Température et salinité. B. OD et pH25. C. Direction et vitesse du vent et des rafales. D. Irradiance en surface. Les mesures ont été effectuées toutes les 30 min, n=1440.
Meteorological records and variations of some physicochemical parameters measured in situ (1.5-m depth) at the study site during August 1998. A. Temperature and salinity. B. DO and pH25. C. Wind direction, speed and blasts. D. Surface irradiance. Data were measured every 30 min, n=1440.

Cumul des variations moyennes demi-heure par demi-heure des teneurs en OD et du pH pour les mois de janvier et juillet 1998. Sont mentionnées les valeurs d'irradiance correspondant au début de la décroissance de milieu d'après-midi, ainsi que les périodes de jour et de nuit représentées par les rectangles respectivement blanc et noir en bas de la figure.
Summation of monthly mean DO and pH 30-min-to-30-min variations for January and July 1998. Surface irradiance levels corresponding to mid afternoon decrease are also mentioned. Black and white rectangles indicate night and day periods, respectively.

Moyennes sur 30 min des valeurs du pH (points blancs) mesuré in situ (1,5 m) et de l'irradiance de surface (W m−2, grisé) pendant 6 j d'enregistrement (8–13 juin 2000).
30 min mean values of in situ pH (white dots) and surface irradiance (W m−2, grey bars) during 6 days (8–13 June 2000).
5 Discussion and conclusion
Temporal variations of DO and pH originate from various physical and biological processes acting simultaneously [12]. Although differences exist between these parameters (direct approach of O2 reservoir, indirect approach of the CO2 one, influence of air sea exchange) their parallel circadian variations, the magnitude of their variations and their rapid response to illumination changes confirmed their potential use for indirect approach of biological activity. Circadian variations have already been reported from the upper to the lower limit of infra-littoral [3,31]. Our results covering 30 min to pluri-annual time scales under a wide range of hydroclimatic conditions emphasize the potentiality of time resolved physicochemical parameters measurements to address community activity, problematic stressed by present environmental changes and coastal waters warming [30]. Addressing the question of the relevant time scale to study physicochemical variability, these results may contribute to the definition of technical requirements and measuring strategy that must be developed in the future to conduct automated long-time series of observations in coastal marine waters.
1 Introduction
L'observation du milieu marin connaı̂t un développement significatif depuis quelques années pour discerner l'impact à long terme des changements globaux sur les zones côtières, qui subissent le plus directement la pression humaine. Dans ces eaux peu profondes considérées parmi les plus productives de la biosphère [19], conséquence de leur biodiversité élevée et d'un haut niveau d'apport de nutriments [26], les variations brusques des conditions hydroclimatiques et les changements à long terme sont peu amortis et ont des conséquences directes dont certaines semblent déjà discernables sur les organismes et les communautés [9,13,27].
Des séries régulières de mesures dans le milieu côtier existent depuis longtemps en France [21,32] et ont été complétées par la mise en place, en 1995, du service d'observation en milieu littoral (SOMLIT) de l'Institut national des sciences de l'Univers (Insu). Ces mesures sont acquises avec des périodicités de mesures allant de l'hebdomadaire au mensuel. Mais, entre deux observations, l'hydrologie des eaux côtières peut subir des modifications profondes et rapides, particulièrement en Méditerranée [25,28]. La nécessité de prendre en compte des échelles d'espace et de temps appropriées à cette variabilité a été exprimée à maintes reprises [20,28].
Se posent alors les questions des fréquences adaptées et des pas de temps minimaux pertinents pour discerner les changements des conditions hydrologiques, et des réponses biologiques qu'ils induisent sur les communautés. Nous avons abordé ces questions au moyen d'une station de mesure immergée à 1,50 m de profondeur et en fonctionnement permanent depuis 1994. Ce travail est consacré à l'analyse et à la synthèse des résultats des années 1998 à 2000. Nous allons procéder par effet zoom en étudiant (i) les variations saisonnières à partir de trois années décrites chacune par plus de 290 j d'enregistrement, (ii) les variations à l'échelle de la journée (48 mesures par jour) à partir d'un mois pris comme exemple, ainsi que (iii) la variabilité à plus petite échelle de temps, celle de l'heure, cette dernière pouvant être considérée comme du quasi continu pour les réponses biologiques.
2 Acquisition des données et expression des résultats
2.1 Station de mesure
La station de mesures est immergée à 1,50 m de profondeur au pied de la station marine d'Endoume (SME), à Marseille (Méditerranée nord-occidentale). Alimentée et pilotée depuis le laboratoire, elle est opérationnelle depuis 1994, avec un pas d'échantillonnage de 30 min. Elle réunit capteurs de température (T, thermistance YSI, précision 0,2 °C, résolution 0,05 °C) ; de salinité (S, conductimètre YSI précision 0,05 ppt ; résolution 0,02 ppt) ; d'oxygène dissous (OD, oxymètre YSI avec thermistance intégrée et agitateur, précision 3 μmol kg−1 ; résolution 1 μmol kg−1) ; de pH (électrode Hanna à amplification de signal, précision 0,02 U ; résolution 0,005 U). Une station météorologique (Davis ; mod. Monitor II) est située sur le toit du laboratoire (+22 m) avec un capteur d'éclairement (pyranomètre Licor – boı̂tier d'interface LI-185B). Pour les mesures de T,S, de pH et de vitesse et de direction du vent, les acquisitions sont réalisées à intervalle de 40 s et, au bout de 30 min, la moyenne de 32 valeurs réparties sur la demi-heure qui précède est stockée, ainsi que la variance. Pour des questions techniques (épuisement de l'électrolyte), l'oxymètre n'est commuté qu'en fin de cycle et la valeur enregistrée correspond à la moyenne de 30 mesures faites en 3 min à la fin de la demi-heure. Toutes les acquisitions analogiques des capteurs sont analysées et numérisées par un voltmètre (résolution 12 bits, 50 000 points sur 0–2 V) et connecté à un micro-ordinateur PC (liaison COM – protocole RS 232). Un programme mis au point au laboratoire pilote en boucle l'interrogation de chaque capteur toutes les 55 s, acquiert les données numérisées, les stocke en RAM, calcule toutes les 30 min les grandeurs statistiques (moyennes et écarts types) et les inscrit alors en ligne dans un fichier horodaté. Une à deux fois par semaine, de l'eau est prélevée à proximité des capteurs pour effectuer en laboratoire un contrôle du pH (solution étalon NBS Merck, pH 7,00 et 10,00), de l'oxygène dissous (méthode de Winckler), de la salinité (salinomètre Guideline de laboratoire).
2.2 Expression des résultats
Les concentrations d'oxygène à saturation et niveaux de saturation ont été calculées à partir des données de T et S in situ [15]. Les valeurs de pH normalisées à T=25 °C (ci-après pH25) ont été calculées à l'aide du logiciel CO2SYS [22] en employant les constantes de dissociation de Merbach et al. [24].
3 Variations saisonnières
Nous présentons (Fig. 1) les moyennes journalières (48 mesures par 24 h) des températures de l'eau, des teneurs en oxygène dissous (OD), du pH et de l'irradiance journalière intégrée en 1998, 1999 et 2000. La température montre une dynamique annuelle moyenne qui varie de 12,5–13 °C en hiver, jusqu'à 25–27 °C en été avec, en période chaude, des refroidissements brusques et brefs, consécutifs à l'établissement de vents de mistral (NNW). La salinité (données non présentées) a varié de 37,75 à 38,18, valeurs classiques pour les eaux côtières de la région [34]. La teneur des eaux en oxygène dissous (ronds gris) varie à l'inverse de la température, puisque sa concentration saturante en dépend. Les valeurs d'OD mesurées sont souvent supérieures aux valeurs correspondantes de la courbe de saturation théorique (triangles noirs), même si elles lui sont fréquemment égales ou inférieures en automne et au début de l'hiver. Les valeurs du pH (échelle NBS, ronds gris) ne montrent pas d'évolution saisonnière nette. En revanche, quand ces valeurs moyennes sont normalisées pour une température de 25 °C (pH25, triangles noirs), se dessine alors nettement une évolution saisonnière, inverse de celle de l'oxygène dissous : valeurs de pH25 plus élevées en été et au début de l'automne qu'en hiver.
Ainsi, une moyenne journalière représentative (48 mesures par jour) permet de décrire un cycle annuel dont la régularité n'est rompue que par des événements météorologiques identifiés. Mais cette échelle de représentation masque un autre niveau de variabilité, qui apparaı̂t tout aussi déterminant pour certains paramètres.
4 Variations à l'échelle de la journée
Nous présentons (Fig. 2) l'évolution sur un mois pris comme exemple (août 1998) des valeurs (A) de T et S, (B) d'OD et du pH25, (C) de la vitesse du vent et (D) d'irradiance en surface (n=1488). La salinité varie peu (de 37,80 à 37,95) pendant cette période, alors que les coups de vents de NW–NNW qui interviennent en début de mois et entre le 21 et le 28 ont un effet net sur la température de l'eau.
Sans le lissage introduit par le calcul de moyennes journalières (points gris reportés à une abscisse correspondant à midi), les tracés d'évolution de l'OD et du pH montrent deux niveaux de variabilité. Le premier concerne la dynamique jour–nuit. Pour l'OD comme pour le pH, on constate des variations circadiennes avec une évolution parallèle de ces deux paramètres à l'échelle de la journée. Les maxima sont synchrones et atteints en milieu de journée, et les minima la nuit. En 12 h, la variation peut atteindre 70 μmol kg−1 pour l'OD et 0,25 U pour le pH. Un second niveau de variabilité est en relation avec les variations d'éclairement d'un jour à l'autre. Pour les conditions de ciel clair du 6 au 31 août, l'irradiance décroı̂t faiblement, mais régulièrement, comme il est normal après le solstice d'été. Un calcul de tendance montre une faible décroissance des amplitudes de variation, significative pour l'OD (y=−1,26 ; r=0,596 ; p<0,001), mais pas pour le pH (y=−0,001 ; r=0,258). En revanche, quand l'irradiance reste à un très faible niveau (atteignant au maximum 210 W m−2, – période du 3 au 5 août –), on constate un net amortissement des variations circadiennes d'OD et du pH. Lors de l'épisode de mistral du 21 au 26 août et du refroidissement consécutif des eaux, on constate une baisse globale du seul niveau moyen du pH25, alors que l'éclairement reste élevé et à des niveaux très voisins des jours précédents et ceci sans que l'amplitude journalière du signal soit modifiée et sans correspondance pour les valeurs d'OD.
Nous avons synthétisé la dynamique circadienne de l'OD et du pH par la présentation des valeurs mensuelles moyennes (n=31, écarts types associés de l'ordre de 4 à 6 % pour l'OD et de 0,2 à 0,3 % pour le pH) des cumuls des différences, demi-heure par demi-heure (Fig. 3), de l'OD (ronds gris) et du pH (carrés noirs) des mois de janvier et juillet 1998 pris ici comme exemples (température et niveaux d'éclairement moyens 13,57–21,46 °C et 156–469 W m−2 respectivement). OD et pH montrent des évolutions parallèles sur 24 h, avec une corrélation linéaire pH=f(OD) élevée (r⩾0,98 ; p<0,001) pour chacun de ces deux mois, corrélation qui reste très hautement significative quand l'ensemble d'une année est pris en compte (par exemple r>0,97 pour 1998). En revanche, selon le mois, il existe des différences pour l'amplitude de variation : 38 μmol kg−1 pour l'OD en juillet contre seulement 29 μmol kg−1 en janvier et respectivement 0,13 et 0,08 UpH pour le pH. Lors de ce cycle type de 24 h, on observe une diminution du pH et de l'OD jusqu'en fin de nuit, puis leur augmentation dès que l'éclairement devient significatif, augmentation plus accentuée ensuite jusqu'en début d'après-midi ; des diminutions parallèles de l'OD puis du pH interviennent ensuite, alors que l'éclairement moyen est encore relativement élevé (387 W m−2 en juillet, 111 W m−2 en janvier) [29]. Cette dynamique circadienne est conservée pour l'ensemble des données des différentes années et est fonction de l'éclairement. D'ailleurs, sur les trois années, on a pu constater que la durée de la phase d'accroissement diurne de l'OD et du pH présentait une saisonnalité marquée, en phase avec celle de la déclinaison du soleil, avec une durée variant en moyenne de 6 à 7 h, en décembre et en janvier, jusqu'à près de 10 h entre mai et septembre.
5 Variations apériodiques à l'échelle de l'heure
Des moyennes semi-horaires du pH et de l'irradiance sur six jours sont présentées (Fig. 4) comme exemples de variations à l'échelle horaire. Durant cette période se sont succédé des jours (8 et 9 juin) avec un ciel clair, et quatre jours à forte nébulosité et à forte variabilité d'éclairement. À l'échelle de la journée, le niveau moyen du pH apparaı̂t, à l'évidence, lié à celui de l'éclairement mais, de plus, ces données montrent que des variations importantes et rapides d'éclairement se traduisent, dans la demi-heure qui suit, par une modification des valeurs de pH enregistrées. La dynamique d'évolution à l'échelle de la journée peut alors être très variable avec l'observation des maxima journaliers en début d'après-midi (les 10 et 11) ou en fin d'après-midi (les 12 et 13). Cette réactivité de l'OD et du pH dans l'eau de mer étudiée, a été systématiquement observée pendant ces trois années d'étude pour des situations de conditions d'éclairement très changeantes en cours de journée. Enfin, il faut signaler que, pour des échelles de temps inférieures à quelques dizaines de minutes, on n'observe plus, en utilisant des fréquences d'acquisition de l'ordre de la minute pour l'OD et le pH, de variation d'ampleur significative et en tous cas interprétable en termes de réponse biologique.
6 Discussion et conclusion
Ces résultats montrent que, quelles que soient les échelles de temps abordées, les variations de température et/ou de lumière induisent dans l'eau de mer une réponse biologique que l'on peut suivre avec les deux paramètres semi-conservatifs étudiés ici : l'OD et le pH. La variabilité temporelle de l'OD et du pH résulte des processus physiques (échanges avec l'atmosphère et advectifs) et biologiques (photosynthèse et respiration, plus précipitation et dissolution de CaCO3 pour le pH). Ces processus agissent simultanément, mais dans des proportions variables au cours du temps et de manière différenciée selon les paramètres [12]. À la différence de l'OD, dont les variations saisonnières s'expliquent principalement par un effet thermique, le cycle saisonnier du pH25 peut être attribué à la production biologique, qui augmente le pH de l'eau de mer de surface, résultat du déplacement de l'équilibre des carbonates lié à la consommation de CO2.
À l'échelle de la journée, le fort couplage entre OD et pH et leur dynamique circadienne de variation traduisent l'influence dominante des processus biologiques. Pourtant, la relation entre ces deux variables et l'activité biologique, de même que leur sensibilité aux échanges avec l'atmosphère, ne sont pas identiques. Compte tenu de la faible profondeur moyenne du site-atelier (3 m), les échanges d'O2 avec l'atmosphère à court terme ne peuvent être négligés. Mais, quelle que soit l'expression employée pour calculer les vitesses de transfert [23,33], la paramétrisation de ces échanges telle qu'elle est décrite dans Waninkhof [33] montre qu'ils ne représenteraient, toutes conditions étant égales par ailleurs, qu'une évasion de l'ordre de 10 μmol kg−1 (évasion nette sur 24 h, maximale l'après-midi, compte tenu de la dynamique du vent et de la teneur en OD), soit au maximum de l'ordre de 10 à 20 % des amplitudes mesurées. De plus, la contribution des processus physiques ne dépend pas de la lumière. La rapidité de réponse du milieu en termes de pH et de concentration en oxygène dissous aux modifications rapides de l'éclairement en fait la démonstration (Fig. 4). Pour le pH, la relation avec l'activité biologique est indirecte. En effet, si le pH diminue la nuit quand la concentration en carbone inorganique dissous augmente (arrêt de la photosynthèse, augmentation de la consommation hétérotrophe) et vice-versa le jour (production communautaire nette positive), son niveau dépend du rééquilibrage du pool CO2–bicarbonates–carbonates, tel qu'il est décrit par le facteur tampon chimique [14]. Néanmoins, l'ampleur des variations du pH constatée à toutes les échelles de temps, en relation directe avec l'éclairement (Figs. 3 et 4), son très bon couplage avec celles de l'OD, son évolution « saisonnière » une fois réalisée sa standardisation à T constante, font du pH un autre descripteur représentatif de l'activité biologique.
La mise en évidence de ces cycles journaliers n'est pas une originalité, mais elle prend une certaine importance, si l'on considère la durée de cette série, la diversité des conditions hydroclimatiques rencontrées, et le fait que ces mesures sont acquises avec un pas de temps de 30 min, intervalle minimum dont nous avons pu vérifier la représentativité. En ce qui concerne le pH, la valeur enregistrée présente la moyenne de 32 mesures réparties sur la demi-heure qui précède, avec des écarts types de distribution toujours de l'ordre de 10−4 UpH. Les dynamiques circadiennes, analogues et faisant partie d'une évolution continue (sauf en cas de variations rapide de l'éclairement diurne) apparaissent clairement déterminées.
Des amplitudes de variation pour le pH et pour l'OD de cette importance en 24 h n'ont jamais été mentionnées à notre connaissance pour les eaux de surface océaniques. En revanche, dans les milieux côtiers et littoraux, elles ont pu être ponctuellement mesurées, dans des zones de faible profondeur [31], jusqu'à la limite inférieure de l'infralittoral [3], parfois avec un pas horaire, mais sans que ne soient simultanément abordées les variations saisonnières et pluriannuelles. Seule une fréquence d'acquisition inférieure à l'heure, comme dans le cas de la série CAPCOM, permet de fonder solidement les interprétations biologiques que l'on peut tirer de ces variations aux différentes échelles de temps [6,29]. Aussi, la forte couverture d'algues benthiques du site atelier contribue pour plus de 80 % à la variabilité totale de l'oxygène dissous, par comparaison avec la biomasse planctonique et à son activité mesurée [5]. Il est vrai que, dans les zones côtières, les flux biogéochimiques sont élevés et qu'elles concentrent près des deux tiers de la biomasse marine avec un rapport moyen biomasse macrophyte / phytoplancton estimé à près de 400 [31].
Il est donc possible de réaliser en milieu côtier, c'est-à-dire dans un environnement où les conditions varient très vite et avec une forte amplitude, des séries de mesures qui couvrent de manière représentative, en même temps le pluriannuel, et le quotidien. Mais pourquoi faire des mesures à ces différentes échelles ? Tout dépend alors de ce que l'on cherche à mettre en évidence. En effet, dans l'étude de phénomènes naturels, ces questions d'échelle ne peuvent se réduire à des questions techniques, mais relèvent d'abord de l'usage qui sera fait de l'information recueillie [11].
Pour la détermination de tendances à long terme, et au niveau global d'un bassin, des mesures dispersées de température d'eaux méditerranéennes profondes conduisent [7,8] à des estimations crédibles du réchauffement, mais de moitié inférieures à celles établies pour les eaux côtières par des séries régulières [30] (+1,2 °C en 30 ans entre 0 et 20 m), au moins hebdomadaires et surtout pérennes, qualité essentielle sur le long terme [10]. Mais une fois cette tendance au réchauffement établie, se pose le problème du suivi de ses conséquences et de l'évolution des écosystèmes côtiers. Outre les questions liées au seuil de tolérance aux changements [20], l'activité des organismes, présentant souvent une forte saisonnalité [1], ou, pour le phytoplancton en Méditerranée, des durées de vie de l'ordre de la semaine, voire inférieures [4,32], leur bilan ne peut valablement s'estimer que par l'intégration de la très forte variabilité de leurs activités à des échelles de temps imbriquées (année, saison, journée). Cela implique une approche globale du fonctionnement des écosystèmes côtiers, qui mette en œuvre des outils et des stratégies adaptés aux grandeurs caractéristiques des processus et phénomènes étudiés, tant pour le suivi des paramètres régulateurs des activités métaboliques (T et irradiance, par exemple) que des paramètres qui en sont le reflet (OD et pH dans le cas présent), et donc de passer à une autre fréquence d'acquisition que bimensuelle, voire hebdomadaire.
Des résultats présentés ici, plusieurs niveaux d'interprétation émergent, en terme d'échelles de temps et de réponses aux changements des conditions environnementales. À l'échelle saisonnière, et du fait de la faible efficience relative des échanges de CO2 à travers l'interface air–mer, la mesure de paramètres liés au système CO2 constitue une empreinte de la production nette intégrée dans le temps [18], plus opérationnelle que celle de l'O2, à cause, pour ce dernier, de ses échanges avec l'atmosphère. En revanche, au niveau du mois ou de la journée, les variations à court terme et la forte réactivité à l'éclairement, ainsi que le fort couplage pH–OD permettent d'envisager un suivi du fonctionnement global de communautés côtières au moyen de ces paramètres mesurables en automatique.
Ces résultats, en posant le problème du pas pertinent des mesures pour l'observation de la variabilité physico-chimique et biologique en zone côtière et littorale, peuvent aussi aider à la définition des instruments dont on doit se doter dans le futur pour appréhender ces différents niveaux de variabilité. De plus, ils peuvent ouvrir des voies pour une réflexion sur des approches globales du métabolisme communautaire, couplant observations biologiques et physico-chimiques, et aider à définir des indicateurs biologiques et écologiques [2,16,17]. Seule la complémentarité de ces approches permettra de suivre, non seulement l'amplitude et les rythmes de changements globaux, mais aussi leurs conséquences sur les écosystèmes.
Remerciements
Pour ce travail, N. Bensoussan a bénéficié du soutien de la région Provence-Alpes-Côte d'Azur et de la société Néréides.


