Abridged English version
Introduction
Steel structures exposed to seawater are often protected against corrosion by cathodic protection. The process often used involves the realization of an electrical connection between steel and a block of a least noble metal (as zinc), which behaves as an anode, so that the steel behaves as a cathode. The resulting anode dissolution contributes to the input of zinc to coastal waters, which may cause ecological damage, as zinc is recognized to be toxic to a variety of biota, at early life stage or inducing chronic toxicity [10,16]. As sediments present various scavenging surface sites, much of the released zinc from anodes is likely to be transferred to the sediment phase [5]. Therefore, adsorbed elements onto solid particles are potentially available as they may be dissolved due to changes in the physicochemical properties of the environment [1,6,8,12]. Many chemical extraction (leaches) procedures have been proposed in the literature to estimate the mobility of heavy metals in sediments in order to determine their bioavailability. Thus, sequential extraction procedures (several steps) are used to differentiate mobile and residual fractions, and to characterize the different labile fractions: exchangeable fraction (weakly bound elements in equilibrium with the dissolved phase), acido-soluble fraction (very sensitive to pH variations), reducible or oxidable fractions (very sensitive to redox conditions and microbiological activity). Sequential extractions are then useful for solid partitioning of particulate elements, to study the origin, the fate, the biological, and physicochemical availability and transport of sorbed elements. The aims of this work are:
- – to study the fate of zinc solubilised from sacrificial anodes.
- – to evaluate the possible influence of imposed potential on heavy metals fractionation in marine sediments in contact with steel under cathodic protection.
Materials and methods
Cathodic protection with zinc sacrificial anode
During one month, at the marine station of Luc-sur-Mer (Normandy, France), an experiment was conducted in a large-scale tank (about 860 L), supplied with decanted natural seawater (stable pH, equal to 8.1). A 70-L container, filled with natural marine sediments (particles diameter <60 μm) is immersed in the tank (Fig. 1). Some steel samples are buried in the sediments and others are immersed in the water. All the samples are corrosion-protected by sacrificial zinc anodes. The resulting imposed potential is – 1 V/Ag–AgCl. Water temperature is maintained at 14 °C. Sediments and water samples are collected at the beginning and at the end of the experiment.
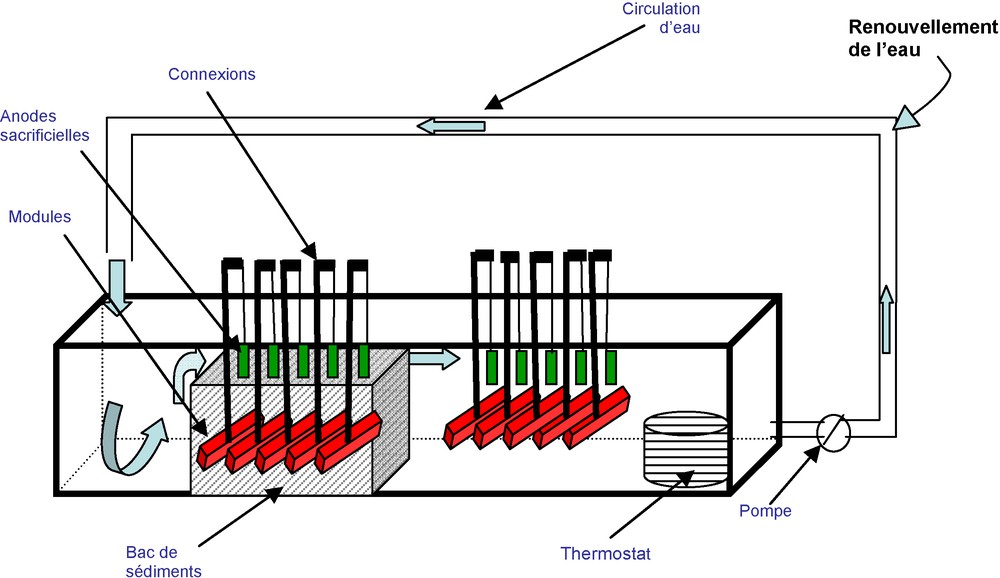
Schéma du bassin expérimental.
Fig. 1. Scheme of the experimental basin.
Sediments characterization
Total concentrations of elements in sediments were determined after microwave-assisted acid digestion (HNO3 and HCl), by Inductively Coupled Plasma Atomic Emission Spectrometry (ICP–AES) (Varian Vista-MPX). Sediments were also leached by an optimized sequential chemical extraction procedure [12]. This procedure selectively and efficiently dissolves all the chemical constituents of the sediments, in the following order: S1: water soluble, S2: exchangeable, S3: acido-soluble, S4: reducible, S5: oxidable fractions, and S6: sum of all these labile fractions.
Results and discussion
Seawater chemical composition
Despite sacrificial anodes dissolution, no significant increase of zinc concentration was detected (Table 1), which might be due to an important dilution phenomena and/or zinc accumulation in sediments (Table 3 and [5]).
Concentration en mg l−1 dans la phase aqueuse au début (aq0) et à la fin de l’expérience (aq1)
Table 1 Chemical composition of seawater in mg l−1 (experiment beginning: aq0, and experiment end: aq1)
| Al | Ca | Cd | Co | Cr | Cu | Fe | K | Mg | Mn | Ni | Pb | Sr | Zn | |
| aq 0 | 0,01 | 349 | 0,000 | 0,003 | 0,000 | 0,01 | 0,000 | 115 | 940 | 0,001 | 0,004 | 0,004 | 2,7 | 0,6 |
| aq 1 | 0,01 | 364 | 0,000 | 0,001 | 0,000 | 0,01 | 0,000 | 119 | 944 | 0,001 | 0,000 | 0,008 | 2,8 | 0,5 |
Marine sediments’ composition
Four collected sediments were analyzed:
- – L0H: superficial sediment (beginning of experiment);
- – L0M: sediment in contact with steel (beginning of experiment);
- – L1H: superficial sediment (end of experiment);
- – L1M: sediment in contact with steel (end of experiment).
Major element concentrations in collected sediments present slight Ca and Fe enrichments, if one compares with the baseline values proposed by Stevenson [19] for marine sediments (Table 2) and, as compensation, are depleted in aluminium, magnesium and potassium. This calcium enrichment is due to erosion of marine shells (that contain calcium carbonate) collected with our sediments. The low aluminium content reflects the relatively low clay minerals’ content of these sediments. No spatial or temporal evolution in the major chemical composition of the sediments was noticed, except for calcium, as its concentration was lower at the end of the experiment in the superficial sediment (L1H).
Pourcentage d’oxydes présents dans les sédiments
Table 2 Oxides’ percentage in sediments
| Al2O3 | CaO | Fe2O3 | K2O5 | MgO | MnO | P2O5 | |
| L0H | 4 | 18 | 6 | 1,7 | 1,2 | 0,04 | 0,5 |
| L0M | 4 | 19 | 6 | 1,5 | 1,0 | 0,04 | 0,5 |
| L1H | 5 | 14 | 6 | 1,7 | 1,2 | 0,04 | 0,5 |
| L1M | 5 | 19 | 7 | 1,7 | 1,2 | 0,04 | 0,5 |
| Stevenson [19] | 9 | 16 | 4 | 1,9 | 1,8 | 0,04 | 0,1 |
Trace elements concentrations present in the initial sediments are reported in Table 3 and compared to the baseline values proposed by Stevenson [19] for non-polluted sediments and to the criteria proposed by the French decree of 14 June 2000 [3]. It appears that these sediments can be considered as moderately polluted, mainly in Pb, Zn, and Cu.
Teneur totale en mg kg−1 des éléments traces présents dans les sédiments
Table 3 Chemical composition in trace elements in mg kg−1 in sediments
| Cd | Co | Cr | Cu | Ni | Pb | Sc | Sr | Zn | |
| L0H | 1 | 7 | 36 | 26 | < | 37 | 2 | 426 | 138 |
| L0M | 1 | 7 | 35 | 24 | < | 37 | 2 | 437 | 126 |
| L1H | 1 | 7 | 39 | 26 | < | 38 | 3 | 436 | 757 |
| L1M | 1 | 7 | 40 | 27 | < | 40 | 3 | 458 | 135 |
| Arrêté du 14 juin 2000 | 1 | / | 90 | 45 | 37 | 100 | / | / | 276 |
| Stevenson [19] | / | 7 | 55 | 15 | 32 | 11 | / | 530 | 57 |
After one month of experiment, no spatial or temporal evolution of the metals concentrations in sediments was observed, for all the studied elements, excepted zinc (Table 3). Indeed, a much higher total Zn concentration is detected in the final superficial sediment (L1H). This zinc enrichment results from sacrificial anode dissolution. This could be correlated to the observed Ca decrease, supposing some cationic exchange processes between these two elements, between superficial sediments and seawater. No influence of sacrificial anodes dissolution was detected on deeper sediments.
Heavy metal partitioning
In agreement with the literature [9], the most important heavy metals scavenged fractions are the acido-soluble (S3), reducible (S4), and oxidable (S5) fractions (Table 4).
Pourcentage de chaque élément solubilisé au cours de l’extraction séquentielle par rapport à sa quantité initialement présente
Table 4 Percentage of leached elements in the different fractions (S1 to S6)
| Ca | Cd | Cr | Cu | Fe | K | Mn | P | Pb | S | Sc | Sr | Zn | |
| L0M_S1 | 1 | 0 | 0 | 1 | 0 | 25 | 0 | 1 | 0 | 46 | 0 | 2 | 0 |
| L0H_S1 | 1 | 0 | 0 | 1 | 0 | 23 | 0 | 1 | 0 | 48 | 0 | 3 | 0 |
| L1H_S1 | 2 | 0 | 0 | 0 | 0 | 23 | 1 | 1 | 0 | 53 | 0 | 4 | 0 |
| L1M_S1 | 1 | 0 | 0 | 5 | 0 | 27 | 0 | 1 | 0 | 53 | 0 | 4 | 0 |
| L0M_S2 | 2 | 0 | 0 | 2 | 0 | 19 | 3 | 2 | 0 | 10 | 0 | 6 | 0 |
| L0H_S2 | 2 | 0 | 0 | 1 | 0 | 19 | 3 | 2 | 0 | 11 | 0 | 6 | 0 |
| L1H_S2 | 2 | 0 | 0 | 1 | 0 | 16 | 2 | 2 | 0 | 10 | 0 | 6 | 0 |
| L1M_S2 | 2 | 0 | 0 | 2 | 0 | 17 | 2 | 2 | 0 | 12 | 0 | 6 | 0 |
| L0M_S3 | 52 | 9 | 3 | 5 | 2 | 13 | 44 | 9 | 22 | 8 | 2 | 51 | 21 |
| L0H_S3 | 52 | 9 | 3 | 6 | 2 | 11 | 44 | 8 | 24 | 8 | 3 | 50 | 23 |
| L1H_S3 | 66 | 8 | 3 | 4 | 2 | 9 | 44 | 8 | 23 | 7 | 2 | 49 | 41 |
| L1M_S3 | 53 | 9 | 3 | 7 | 2 | 10 | 45 | 9 | 28 | 7 | 2 | 50 | 26 |
| L0M_S4 | 3 | 43 | 41 | 36 | 46 | 9 | 19 | 51 | 7 | 8 | 44 | 3 | 43 |
| L0H_S4 | 5 | 41 | 41 | 40 | 44 | 8 | 19 | 59 | 7 | 7 | 43 | 5 | 42 |
| L1H_S4 | 6 | 42 | 38 | 42 | 42 | 7 | 18 | 55 | 6 | 8 | 36 | 4 | 30 |
| L1M_S4 | 4 | 48 | 44 | 41 | 47 | 8 | 21 | 56 | 6 | 6 | 40 | 4 | 44 |
| L0M_S5 | 0 | 9 | 23 | 10 | 8 | 2 | 3 | 3 | 7 | 11 | 9 | 1 | 4 |
| L0H_S5 | 0 | 6 | 21 | 12 | 6 | 3 | 2 | 2 | 8 | 10 | 9 | 1 | 3 |
| L1H_S5 | 0 | 8 | 19 | 10 | 8 | 3 | 3 | 2 | 8 | 9 | 8 | 0 | 2 |
| L1M_S5 | 0 | 9 | 19 | 14 | 8 | 3 | 3 | 2 | 7 | 8 | 8 | 0 | 4 |
| L0M_S6 | 58 | 61 | 67 | 54 | 56 | 68 | 69 | 66 | 36 | 83 | 56 | 63 | 68 |
| L0H_S6 | 60 | 56 | 64 | 58 | 52 | 64 | 69 | 71 | 39 | 85 | 54 | 64 | 69 |
| L1H_S6 | 75 | 58 | 60 | 57 | 51 | 58 | 68 | 68 | 37 | 86 | 46 | 63 | 74 |
| L1M_S6 | 60 | 66 | 65 | 69 | 57 | 65 | 71 | 70 | 41 | 86 | 51 | 64 | 74 |
| Moyenne S6 | 63 | 60 | 64 | 60 | 54 | 64 | 69 | 69 | 38 | 85 | 52 | 63 | 71 |
| Écart type S6 | 8 | 4 | 3 | 7 | 3 | 4 | 1 | 2 | 2 | 2 | 4 | 1 | 3 |
This study points out that the proximity of steel under cathodic protection had no influence on the elements lability (except maybe calcium and copper). The percentages of non-residual element, for all the studied elements, show no spatial or temporal variation. This result is surprising when focusing on zinc, really more concentrated in the L1H sediment. It can be concluded that a part of the released zinc (from sacrificial anode) is irreversibly absorbed into the residual fraction of the sediment.
Moreover, except for zinc, the elements fractionations present no variation between the sediment in contact with steel under cathodic protection (L1M) and other sediments. The potential did not influence the elements partitioning between oxide and reducible fraction in sediments (Table 4).
Focusing on zinc partitioning, it appears that the solubilised zinc is mainly scavenged into the acido-soluble (S3) and the reducible (S4) fractions (Table 4, Fig. 2). This kind of distribution is not unusual for Zn and has been reported in various studies [2,15,17,22]. This was quite surprising for the Zn-contaminated sample, as one could expect that the released zinc would have been firstly accumulated in the water-soluble fraction. But no zinc was leached in the S1 fraction.

Quantité (en μg) de zinc libéré, par gramme de sédiment sec, par les différentes fractions minéralogiques pour les quatre échantillons étudiés.
Fig. 2. Quantity of zinc (μg per g of dry sediment) leachable from the different mineralogical fractions.
As zinc can exert chronic toxicity to certain crustaceans [16], it might be kept in mind that the fate of solubilised zinc (from sacrificial anode) is to scavenge into labile (acido-soluble and reducible) fractions (so bioavailable fractions) of the sediments.
Conclusion
This study points out that the proximity of steel under cathodic protection (E = – 1 V/Ag–AgCl), during one month, has no influence on the elements’ lability nor on the elements’ fractionation, in a slightly polluted sediment.
Moreover, an important increase of zinc concentration in superficial sediments was noticed due to the sacrificial anode dissolution. A part of this dissolved zinc is irreversibly absorbed into the residual fraction of the sediment, but the main part of this solubilised zinc is scavenged into labile (acido-soluble and reducible) fractions of the sediments.
1 Introduction
Les ouvrages métalliques immergés en milieu marin, notamment les infrastructures portuaires, sont souvent protégés contre la corrosion par protection cathodique. Le principe est d’amener la surface de la structure métallique à un potentiel assez négatif pour rendre l’acier suffisamment cathodique et donc non corrodable, en lui permettant de rester dans son domaine d’immunité. Deux méthodes de mise en œuvre existent :
- – la protection par anode sacrificielle : l’anode est constituée d’un métal (souvent essentiellement du zinc) à un potentiel moins élevé que celui de l’acier. Sa fixation sur l’acier (cathode) à protéger assure un bon contact électrique et, ainsi, un courant d’électrons entre l’anode et la cathode ;
- – un courant imposé par générateur externe : les électrons sont produits par un courant électrique provenant d’une source externe (générateur), qui impose une charge négative à l’acier, ce qui crée une réaction cathodique et ainsi protège l’acier.
D’un point de vue environnemental, la protection cathodique par anode sacrificielle en zinc est extrêmement polluante ; la solubilisation des anodes contribue grandement à l’augmentation de la concentration en zinc, notamment en zone portuaire [10,16]. Or, le zinc peut entraîner des maladies chroniques chez certains mollusques et crustacés [16]. Une fois libéré en phase aqueuse, le zinc s’accumule dans les sédiments portuaires, les contaminant à leur tour. Ainsi, des concentrations multipliées par 2,5 par rapport au bruit de fond local ont été reportées pour des sédiments portuaires [5]. Cependant, ces phénomènes de « sorption » (absorption ou adsorption) pouvant être réversibles, tous les éléments métalliques « sorbés » sur un sédiment sont potentiellement remobilisables lors du changement d’un paramètre physicochimique tel que la salinité, le pH, le potentiel d’oxydoréduction et/ou la concentration en ligands [1,6,8,12]. Or, le risque écologique est plus particulièrement lié à la forme chimique de l’élément, à sa mobilité et à sa biodisponibilité (définie, selon Baize [4], comme l’aptitude d’un élément à passer d’un compartiment quelconque du sol dans un être vivant ; cette définition caractérise une aptitude, plus que le déroulement effectif du phénomène). Ainsi, l’évaluation des risques liés à une pollution métallique d’un sédiment ou d’un sol ne dépend pas uniquement de la quantité totale de métaux détectée dans le milieu. De même, une pollution métallique de la phase aqueuse doit être évaluée, non seulement à partir de la quantité totale de métaux présents, mais aussi en fonction de leur disponibilité ; celle-ci est notamment accessible par la technique du gradient de diffusion en couches minces (DGT), qui distingue le métal dissous labile (qui comprend l’ion métallique libre, plus les complexes organiques et inorganiques pouvant se dissocier pendant le laps de temps nécessaire pour la diffusion à travers l’hydrogel) du métal dissous inerte [7].
Pour les sols et les sédiments, de nombreuses techniques (extractions chimiques simples ou séquentielles, ou études par spectroscopie EXAFS : Extended X-Ray Absorption Fine Structure, [11]) sont proposées dans la littérature afin d’estimer l’importance de la fraction mobilisable (ou « labile ») des métaux présents dans des sols ou des sédiments, voire d’essayer d’appréhender leur biodisponibilité. Les extractions séquentielles, multi-étapes [12,18,20,21], tout comme la spectroscopie EXAFS, permettent de différencier non seulement la fraction globalement labile, de la fraction résiduelle, mais aussi de préciser la répartition des éléments dans différentes fractions des sols ou sédiments susceptibles d’être solubilisées dans le milieu naturel lors du changement d’un des paramètres physicochimiques de la phase aqueuse. Elles sont ainsi des outils extrêmement performants pour prédire l’origine, le devenir, la mobilité, voire la biodisponibilité des éléments [13].
Ainsi, les éléments liés à la fraction réellement échangeable, c’est-à-dire les éléments situés essentiellement dans l’espace interfoliaire des minéraux argileux, sont très labiles. Ils sont susceptibles d’être solubilisés lors d’une diminution du pH ou d’une augmentation de la salinité. Les éléments solubilisés avec la fraction acido-soluble seront, comme leur nom l’indique, très sensibles à une diminution du pH, tandis que les éléments piégés par les fractions oxydables (essentiellement composées de matière organique) et réductibles (essentiellement les oxydes de fer et de manganèse) seront, quant à eux, plus sensibles aux variations du potentiel d’oxydoréduction.
Les objectifs de cette étude sont :
- – de suivre le devenir du zinc issu de la dissolution des anodes sacrificielles ;
- – d’évaluer l’éventuelle influence d’un potentiel imposé sur la répartition des éléments (essentiellement métaux lourds) dans les différentes fractions minéralogiques des sédiments au contact de pièces métalliques placées sous protection cathodique.
Une expérience à grande échelle, en conditions semi-naturelles, a été lancée dans un bassin de 860 L à la station marine de Luc-sur-Mer (Normandie, France). Ce bassin est alimenté en eau de mer naturelle décantée et contenant un bac de sédiments naturels. Des échantillons d’acier y sont, soit immergés dans l’eau, soit enterrés dans les sédiments. La protection cathodique est assurée à l’aide d’anodes sacrificielles en zinc. Les prélèvements de sédiments et d’eau de mer sont réalisés en début d’expérience et après un mois d’essai.
2 Matériels et méthodes
2.1 Protection cathodique par anode sacrificielle
Les essais sont réalisés dans un bassin de 380 × 47 × 48 cm (environ 860 L), alimenté en eau de mer naturelle prélevée à 300 m du rivage (pH stable, égal à 8,1), décantée, en circuit fermé mais renouvelable, à hauteur de 5 %. Un bac contenant environ 70 L de sédiments marins naturels (particules de diamètre <60 μm), provenant de la décantation de l’eau de mer utilisée, est placé dans le bassin (Fig. 1). Les échantillons d’acier (5 × 5 cm) sont regroupés en dix modules de 14 échantillons, dont la moitié est enterrée dans le bac de sédiments. Les autres modules sont immergés dans le même bassin. La température de l’eau est maintenue à 14 °C à l’aide d’un thermostat. La protection cathodique est assurée par le couplage de chaque module à une anode sacrificielle en zinc. Le potentiel appliqué est d’environ – 1 V/Ag–AgCl.
2.2 Analyse des sédiments
2.2.1 Concentrations totales
Les sédiments prélevés sont séchés à l’étuve à 37 °C pendant quatre jours, puis broyés dans un mortier en agate. Les teneurs totales sont déterminées par spectrométrie d’émission atomique couplée à un plasma induit (ICP–AES) (Varian Vista-MPX), après minéralisation acide à l’eau régale (10 ml pour 0,2 g de sédiment sec) assistée par micro-ondes (Berghof, Speedwave MSW2).
2.2.2 Extraction séquentielle
La répartition des métaux lourds dans les sédiments est déterminée grâce à un protocole d’extraction séquentielle selon Leleyter et Probst [12]. Ce protocole permet de dissoudre, de manière sélective et efficace, chacune des fractions du sédiment susceptible d’être affectée par un changement de composition physicochimique de la phase aqueuse, à savoir : la fraction soluble à l’eau (S1), la fraction réellement échangeable (S2, composée essentiellement des éléments situés dans l’espace interfoliaire des minéraux argileux), la fraction acido-soluble (S3, essentiellement formée de carbonates et de phosphates [14]), la fraction réductible (S4) (oxydes de manganèse, S4a ; oxydes de fer amorphes, S4b ; oxydes de fer cristallins, S4c) et la fraction oxydable (S5, essentiellement formée de matière organique). La somme de toutes ces fractions lessivables représente la fraction labile du sédiment, qui est notée S6. La concentration de la fraction résiduelle est obtenue par différence entre la concentration totale initiale et celle obtenue par la somme des fractions labiles (S6).
3 Résultats et discussion
3.1 Phase aqueuse
La dissolution des anodes sacrificielles laisse présager d’une augmentation de la teneur en zinc dans l’eau. Or, les concentrations, déterminées par ICP–AES, ne montrent pas de variation significative après un mois d’essai, ni pour Zn, ni pour l’ensemble des éléments analysés (Tableau 1). Ce résultat peut être attribué à une dilution importante, liée au renouvellement continuel de l’eau de mer et/ou à l’accumulation du zinc libéré par les anodes dans les sédiments (Tableau 3 et [5]).
3.2 Composition des sédiments
Afin de suivre l’interaction entre la protection cathodique et les sédiments, quatre prélèvements de sédiments ont été analysés :
- – L0H: prélèvement superficiel en début d’essai ;
- – L0M: prélèvement entre deux plaques métalliques en début d’essai ;
- – L1H: prélèvement superficiel après un mois d’expérience ;
- – L1M: prélèvement entre deux plaques métalliques après un mois d’expérience.
Les Tableaux 2 et 3 donnent la composition des sédiments secs collectés. Ces sédiments sont initialement enrichis en calcium et en fer, si on se réfère aux valeurs de référence proposées par Stevenson [19] et, en compensation, appauvris, notamment en aluminium. Cet enrichissement en calcium provient sans doute de l’érosion des coquillages marins (dans lesquels le calcium est présent sous forme de carbonate de calcium) présents dans les sédiments collectés (hypothèse confirmée, après une analyse par calcimétrie Bernard, selon laquelle les sédiments étudiés contiennent initialement 33 % de carbonates de calcium). La faible concentration en aluminium indique une faible teneur de nos sédiments en minéraux argileux. La seule variation significative après un mois d’essai est une diminution de la teneur en calcium dans les sédiments collectés en surface (L1H).
Les teneurs en cadmium, cobalt, chrome, cuivre, nickel, plomb et zinc des sédiments prélevés au début de l’essai sont toutes inférieures à celles du niveau 1 tel que défini par l’arrêté du 14 juin 2000 relatif aux niveaux de référence à prendre en compte en France lors de l’analyse de sédiments marins ou estuariens présents en milieu naturel ou portuaire [3]. Cependant, on note que les teneurs en cuivre, plomb et zinc sont supérieures aux moyennes rapportées par Stevenson [19], dans les régions de l’Atlantique et de la mer du Nord, pour des sédiments non contaminés. On peut donc considérer que les sédiments utilisés lors de cette expérience sont initialement peu contaminés.
Comme pour les éléments majeurs, après un mois d’expérience, aucune influence notable, spatiale ou temporelle, n’est relevée pour la majorité des éléments étudiés. Seule la teneur en zinc augmente de façon importante dans les sédiments collectés en surface (L1H). Cette augmentation provient, sans nul doute, de la dissolution des anodes sacrificielles. Il semble donc que le zinc libéré par les anodes sacrificielles s’accumule dans les sédiments de surface sans avoir le temps, lors de cette étude, de contaminer les sédiments plus en profondeur.
Cette augmentation peut être mise en parallèle avec la diminution en calcium dans cette zone (L1H). On peut supposer que des phénomènes d’échanges cationiques Ca/Zn se sont produits entre les sédiments de surface et la phase aqueuse.
3.3 Distribution des métaux lourds
Conformément à la littérature [9], les fractions acido-solubles (S3), réductibles (S4) et oxydables (S5) restent les fractions préférentielles de stockage des métaux lourds dans les sédiments (Tableau 4).
Cette étude met en évidence l’absence d’influence notable de la proximité de l’acier sous protection cathodique sur la labilité des éléments présents dans les sédiments, à l’exception du Ca et Cu, qui semblent légèrement sensibles. En effet, pour tous les éléments étudiés, le pourcentage d’élément labile ne montre ni évolution temporelle, ni évolution spatiale (écart type inférieur à 10 %). Ce résultat reste vrai pour le zinc sur l’échantillon L1H, qui présente des teneurs totales cinq fois plus importantes. Ce résultat est très surprenant : on aurait pu s’attendre à ce que tout le zinc accumulé soit labile, ce qui se serait traduit par une augmentation de sa labilité totale dans L1H. Il semble donc qu’une partie du zinc libéré par les anodes s’absorbe, de manière irréversible, dans les sédiments.
De plus, la répartition des éléments (excepté le zinc) dans les différentes fractions minéralogiques des sédiments (notamment les fractions réductibles et oxydables) ne semble pas non plus être influencée par la proximité d’acier sous protection cathodique. En effet, il n’apparaît pas de différence significative entre les pourcentages obtenus, dans les deux fractions minéralogiques, par définition sensibles au potentiel (S4 et S5), entre le sédiment L1M et les autres (Tableau 4).
La distribution du zinc est plus particulièrement intéressante. De façon générale, pour l’ensemble des échantillons, le zinc se trouve de façon prédominante dans les fractions acido-soluble (S3) et réductible (S4). Ce type de distribution n’est pas inhabituel et est rapporté par diverses études, pour des sédiments marins contaminés ou non [2,5,17,22].
Il s’avère néanmoins que le zinc apporté par les anodes sacrificielles a pour site de stockage prépondérant la fraction acido-soluble (S3), tandis que les échantillons qui ne sont pas touchés par cet apport exhibent un site de stockage préférentiel dans la fraction réductible (S4) (Tableau 4, Fig. 2). Or, on aurait pu imaginer qu’une partie du zinc libéré se dépose juste sur les sédiments, sans phénomènes d’adsorption ou d’absorption, et soit donc lessivable à l’eau. Or, il n’en est rien, car la fraction S1 ne libère pas de zinc.
Par ailleurs, il est important de souligner que, si la répartition du zinc dans les différentes fractions du sédiment contaminé par la dissolution des anodes varie peu en termes de pourcentage mobilisé, les quantités absolues (en μg g−1) de zinc labile sont beaucoup plus importantes (cinq à dix fois plus élevées, suivant les fractions considérées, cf. Fig. 2). Cela peut laisser présager un relargage important de zinc (potentiellement biodisponible) dans la phase aqueuse et de pics de concentration pouvant être localement toxiques. Sachant que le zinc peut induire une toxicité chronique chez certains mollusques et crustacés [16], ce résultat est à garder en mémoire.
4 Conclusion
Ce travail a mis en évidence l’absence d’influence notable de la proximité d’un acier placé, pendant un mois, sous protection cathodique (E = – 1 V/Ag–AgCl), sur la labilité et sur la répartition des éléments présents dans des sédiments marins peu pollués.
Parallèlement, les résultats montrent que la dissolution des anodes sacrificielles en zinc conduit à une augmentation de la concentration en zinc dans les sédiments marins directement en contact avec la phase aqueuse. Une fraction de ce zinc semble s’accumuler dans la fraction résiduelle des sédiments, mais une majorité s’associe avec la fraction labile (donc potentiellement biodisponible). Plus précisément, le zinc libéré par les anodes sacrificielles est stocké majoritairement dans deux fractions labiles des sédiments : les fractions acido-solubles et réductibles. Il semble préférable, d’un point de vue environnemental, de mettre en place une protection cathodique par courant imposé plutôt que par anode sacrificielle (méthode qui implique nécessairement un relargage, dans le milieu naturel, de quantités importantes d’espèces métalliques, le plus souvent l’aluminium ou comme ici, le zinc). Cette pollution est d’autant plus préoccupante (notamment en zone portuaire ou à proximité des côtes) qu’elle concerne la fraction mobile des sédiments. Des expériences complémentaires, à plus long terme et sur des sédiments composés d’argiles pures, actuellement développées au laboratoire, permettront d’enrichir les connaissances actuelles sur le devenir du zinc libéré par les anodes sacrificielles.
Remerciements
Cette étude a été en partie financée par des fonds européens (Feder), le conseil régional de Basse-Normandie et le conseil général de la Manche.


