1 Introduction
L’accumulation de la tourbe, qui définit l’écosystème tourbière, est la résultante de deux processus antagonistes : la production de matière organique par la végétation tourbigène 〚1〛 et la décomposition, limitée par l’acidité et l’anoxie du milieu 〚2, 3〛. L’accumulation traduit un déséquilibre entre eux, les quantités produites étant supérieures aux quantités décomposées 〚4〛. L’importance relative de la production et de la décomposition est déterminée par les interactions entre paramètres allogènes (climat, contexte géomorphologique, morphométrie du site, perturbations) et autogènes (succession végétale, hydrologie interne). Les études portant sur le développement des tourbières, souvent présentées en terme de dualité entre ces deux types de paramètres 〚5–9〛, ont mis en évidence l’extrême complexité de ces interactions. Ainsi, certaines tourbières apparaissent essentiellement contrôlées par le climat 〚10–12〛, tandis que d’autres semblent plus influencées par les processus autogènes 〚6, 9, 13, 14〛. Les incertitudes concernant les déterminismes de l’accumulation de la tourbe constituent le principal obstacle à la modélisation du comportement des tourbières dans l’éventualité d’un futur réchauffement climatique 〚15〛.
L’influence majeure des facteurs autogènes sur le développement des tourbières fut reconnue dès le début du siècle au travers de « l’hypothèse de la terrestrialisation » 〚16〛. Cette hypothèse décrit la succession végétale à l’échelle écosystémique sur la base des relations entre la végétation et la nappe phréatique : (1) stade limnique, en eau relativement profonde ; (2) stade telmatique, en eau peu profonde ; (3) stade palustre, inondé ou émergé selon des rythmes saisonniers ; (4) stade terrestre, toujours situé au-dessus de la nappe phréatique. Les tourbières minérotrophes (fens) et ombrotrophes (bogs) représentent typiquement les stades ultimes de cette succession, qui reflète le concept de facilitation 〚17〛 : chaque stade, de par l’accumulation de matière organique qu’il occasionne, modifie les conditions du milieu, en particulier l’hydrologie, et favorise ainsi l’installation et le développement du stade suivant. Cette succession idéale est toutefois souvent incomplète et des inversions peuvent avoir lieu sous l’emprise de facteurs externes 〚18〛.
Malgré l’abondante littérature portant sur le sujet, le rôle joué par la végétation sur le processus d’accumulation de la tourbe est encore largement méconnu. La raison est essentiellement liée aux difficultés posées par la reconstitution indépendante des différents paramètres autogènes, difficultés qui ont souvent conduit les paléoécologues à ne pas les séparer et à évaluer leur influence de manière indirecte 〚13, 14, 19〛. La recherche d’indicateurs spécifiques est pourtant susceptible de permettre la reconstitution séparée de l’accumulation de la tourbe, des dynamiques végétales et de l’hydrologie de surface. Le travail présenté ici s’appuie sur l’étude paléoécologique détaillée d’une tourbière ombrotrophe du Québec méridional 〚9〛. La confrontation des données microfossiles, macrofossiles et sédimentologiques obtenues pour sept profils sédimentaires permet de distinguer les diverses communautés végétales de la succession hydrosérale. En particulier, les stades de marais, fen riche et fen pauvre, généralement très difficiles à différencier sur la base des assemblages fossiles, sont ici clairement individualisés. La précision des reconstitutions paléobotaniques obtenues offre une opportunité unique d’évaluer l’influence exercée par la végétation sur le développement à long terme des tourbières et d’en déterminer les mécanismes.
2 Site étudié
La tourbière de Mirabel (45º41’05’’N, 74º02’50’’O) est située à 30 km au nord-ouest de l’île de Montréal, dans les basses terres du Saint-Laurent, Québec méridional (Fig. 1). La plaine des basses terres est essentiellement constituée par un dépôt argileux d’origine marine, qui laisse affleurer par endroit le substratum gréso-dolomitique. Le climat régional est caractérisé par des précipitations abondantes et bien réparties sur l’ensemble de l’année (moyenne annuelle : 1000 mm). Les températures accusent de fortes amplitudes annuelles, avec de moyennes proches de 21 °C pour juillet et de –10 °C pour janvier. La végétation du Québec méridional appartient au domaine des forêts décidues nordiques, dominées par Acer saccharum, en association avec de nombreux feuillus mésophiles, parmi lesquels Betula alleghaniensis, Tilia americana, Carya cordiformis et Fagus grandifolia 〚20〛.

Formations végétales actuelles et emplacement des carottages sur la tourbière de Mirabel.
La tourbière de Mirabel est une tourbière ombrotrophe bombée (bog), développée dans un ancien chenal de retrait de la mer proglaciaire de Champlain. Elle présente une superficie de 2,15 km2 et se trouve à l’altitude de 75 m. Elle est formée d’une fruticée à Ericacées et sphaignes et de plusieurs boisements périphériques 〚21〛. La partie sud de la tourbière est dominée par des buttes de Sphagnum rubellum, associées au cortège d’Ericacées tourbicoles, principalement représentées par Chamaedaphne calyculata, Kalmia angustifolia et Rhododendron groenlandicum. Le boisement nord, le plus vaste de la tourbière, est constitué par un couvert plus ou moins dense de Picea mariana et de Larix laricina, développé sur une strate arbustive d’Aronia melanocarpa, de Nemopanthus mucronatus et d’Ericacées. Les boisements marginaux, dominés par Abies balsamea et Acer rubrum, sont bordés côté tourbière par une ceinture dense de Nemopanthus mucronatus et d’Aronia melanocarpa. Développés sur un à deux mètres de tourbe, ils abritent une strate muscinale pauvre, composée de quelques buttes dispersées de Sphagnum capillifolium, Sphagnum fimbriatum, Pleurozium schreberi et Dicranum polysetum.
3 Matériel et méthodes
3.1 Travail de terrain
La profondeur de tourbe a été mesurée en 140 points, répartis le long de cinq transects. Associées à des mesures topographiques de surface réalisées pour la moitié sud de la tourbière, ces mesures pachymétriques ont permis de dresser la carte topographique des sédiments basaux. Ce travail a révélé l’existence de plusieurs dépressions, correspondant à la zonation actuelle de la végétation, permettant de définir sept unités fonctionnelles au sein de la tourbière 〚9〛. Dans le but de reconstituer le développement de chacune des unités, sept profils ont été prélevés à l’aide d’un carottier russe 〚22〛, dont la chambre mesure 5 × 60 cm. Les carottes, enveloppées dans des feuillets de plastique et d’aluminium, ont été conservées à la température de 6 °C dans l’attente de leur analyse.
3.2 Travail de laboratoire
L’extraction du pollen a été réalisée sur des échantillons d’1 cm3 selon le protocole conventionnel 〚23〛, mais sans traitement à l’acide fluorhydrique. Le nombre minimum de grains comptés, à l’exclusion du pollen de taxons hydrophiles et des spores de ptéridophytes, est de 500 grains pour le profil central et de 300 grains pour les profils latéraux. L’extraction macrofossile a été réalisée par tamisage sous un faible jet d’eau 〚24〛, sur des échantillons de 3 cm d’épaisseur, représentant des volumes compris entre 6 et 180 cm3. Le contenu organique des sédiments a été évalué par des mesures de perte au feu (mesure du poids de matière carbonisée au cours d’une incinération à 600 °C pendant 30 min 〚25〛).
L’accumulation de tourbe a été calculée à partir de la teneur organique du sédiment et des modèles d’âge–profondeur. L’état de décomposition de la tourbe a, quant à lui, été évalué lors de l’étude sédimentologique, sur la base de la quantité de matière organique indéterminable (Substantia humosa 〚26〛).
3.3 Contrôle chronologique
Sept dates radiocarbone (Tableau 1) et des corrélations palynostratigraphiques entre les différents profils permettent d’établir le cadre chronologique du développement de la tourbière de Mirabel. Deux dates AMS sont rejetées : la date TO-8168 présente des taux de recouvrement anormaux, qui pourraient avoir entraîné une erreur de datation (R. Beukens, comm. pers.), et la date TO-8169 est rejetée sur la base de corrélations palynostratigraphiques avec la tourbière de Mer-Bleue, située dans les basses terres du Saint-Laurent, près d’Ottawa (P.J.H. Richard, données non publiées).
Datations radiocarbone conventionnelles et étalonnées. Les dates rejetées sont notées en italique. Les dates AMS ont été réalisées par spectrométrie de masse sur des macrorestes terricoles.
| N° de la carotte | Profondeur (cm) | Code du laboratoire | Méthode de datation | Âge étalonné | Intervalle de confiance 2σ | Âge conventionnel | Rapport 13C/12C |
| 1 | 82–88 | Beta-135343 | conventionnelle | 2180 | 2340–2060 | 2200 ± 50 | –28.4 |
| 81–90 | TO-8169 | AMS | 3630 | 3960–3360 | 3380 ± 120 | ||
| 232–238 | Beta-135344 | conventionnelle | 6820 | 7180–6680 | 6050 ± 80 | –26.8 | |
| 235–237 | TO-8167 | AMS | 6830 | 7250–6450 | 6010 ± 160 | ||
| 318–325 | Beta-135345 | conventionnelle | 7630 | 7790–7510 | 6800 ± 80 | –19.8 | |
| 321–323 | TO-8168 | AMS | 6310 | 6850–5910 | 5550 ± 220 | ||
| 408–410 | TO-8166 | AMS | 9010 | 9470–8430 | 8050 ± 170 | ||
| 2 | 321–326 | Beta-138673 | conventionnelle | 10030 | 10220–9700 | 8900 ± 80 | –27.6 |
| 6 | 214–217 | TO-8882 | AMS | 9430 | 9530–9130 | 8370 ± 80 |
Le modèle âge–profondeur du profil 1 (Fig. 2) est basé sur une interpolation lissée (splines 〚27〛) à l’intérieur des intervalles de confiance des dates radiocarbone. Cette méthode, qui minimise les variations brutales de l’accumulation, permet d’éviter les biais induits par des datations insuffisantes ou irrégulières. Elle est particulièrement appropriée dans des études qui, comme celle-ci, s’intéressent à la dynamique des variations. La chronologie des profils 2 à 7 a été établie de façon similaire, sur la base de corrélations polliniques avec le profil 1 〚9〛. Les dates radiocarbone conventionnelles ont été étalonnées avec le programme informatique CALIB 4.0 〚28〛 : les âges ainsi obtenus sont notés cal. BP (années calendaires before present).

Modèle âge–profondeur du profil 1. Les points noirs représentent les dates radiocarbone étalonnées et les points blancs marquent respectivement la surface du sédiment (actuel), la déforestation anthropique (250 cal. BP), le declin de Tsuga (5500 cal. BP) et la base de la séquence (évaluée à 9900 cal. BP par corrélation palynostratigraphique). Les barres d’erreur correspondent aux intervalles de confiance à 95,4% (2-sigma).
4 Résultats
4.1 Accumulation organique
L’accumulation organique présente des tendances similaires entre les différents profils (Fig. 3). Le profil 1 est toutefois caractérisé par l’existence d’un pic d’accumulation plus tardif que les carottes latérales. Les valeurs maximales ont été enregistrées dans les profils 1 et 5 (respectivement, 425 et 320 g m–2 an–1). L’apparente augmentation récente de l’accumulation est attribuée aux faibles degrés de décomposition et de compaction de la tourbe au sein de l’acrotelme (zone située au-dessus du niveau inférieur de la nappe phréatique 〚29〛).

Succession végétale et accumulation organique pour les sept profils prélevés dans la tourbière de Mirabel. Les stades hydroséraux sont : E, étang ; M, marais ; FR, fen riche ; FP, fen pauvre ; B, bog.
4.2 Végétation locale
La reconnaissance des différentes stades hydroséraux et/ou communautés végétales (Fig. 3) qui se sont succédé au cours du postglaciaire dans le bassin de Mirabel est basée sur les données sédimentologiques et paléobotaniques 〚9〛.
4.2.1 Étang
Des dépôts de craie lacustre et de gyttja, confinés dans la partie la plus profonde du bassin, attestent l’existence d’un étang central entre 10000 et 7800 cal. BP. La végétation aquatique y était dominée par des taxons submergés, tels que Potamogeton, Myriophyllum, Najas flexilis, Chara, Gloeotrichia et des algues planctoniques. Des macrophytes à feuilles flottantes (Nymphaea odorata subsp. odorata, Brasenia schreberi et Nuphar) étaient présents mais peu abondants. La transition de craie lacustre à gyttja, datée vers 9300 cal. BP dans le profil 1, pourrait traduire l’eutrophisation du plan d’eau associée au développement de marais et de fens riverains.
4.2.2 Marais
Les abords de l’étang initial étaient couverts de marais, dominés par les hélophytes Schoenoplectus tabernaemontani, Typha, Eleocharis et Carex. Ces communautés végétales accumulèrent une tourbe herbacée peu décomposée dans un environnement extrêmement humide, favorable au développement de nombreuses algues planctoniques (Botryococcus, Coelastrum, Mougeotia, Pediastrum). La présence de la mousse brune Calliergon trifarium (Amblystégiacées) dans les profils 1 et 2 atteste la persistance jusque vers 6700 cal. BP de conditions fortement alcalines liées aux apports minérotrophes.
4.2.3 Fen riche
Les marais riverains furent remplacés entre 9300 et 9000 cal. BP par des fens arborés constitués par Larix laricina, Myrica gale, Carex, Menyanthes trifoliata et des fougères à spores monolètes (Fig. 3). La morphologie des spores, qui exclut Thelypteris palustris et Onoclea sensibilis, laisse trois possibilités parmi les taxons dont l’écologie correspond à celle des communautés reconstituées : Woorwardia virginica, Dryopteris cristata et D. spinulosa s.l. (qui comprend notamment D. intermedia, actuellement présent dans les érablières rouges périphériques). Le faible enregistrement des spores monolètes et du pollen de Larix dans le profil 1 indique que les communautés minérotrophes qu’ils ont formées étaient confinées dans les zones périphériques de la tourbière.
4.2.4 Fen pauvre
Une importante transition trophique est révélée par un assèchement généralisé de la surface de la tourbière, par la disparition de Calliergon trifarium et par de profondes modifications des communautés végétales tourbigènes. En particulier, plusieurs taxons minérotrophes (Carex, Menyanthes trifoliata, Myrica gale, Amblystégiacées et fougères) disparaissent au profit de taxons ombrotrophes (Ericacées, Eriophorum vaginatum subsp. spissum et Sphagnum). Ces nouvelles formations végétales comprennent toutefois encore des éléments minérotrophes (Osmunda, Schoenoplectus tabernaemontani, Viola) et transgressifs (Andromeda glaucophylla, Carex disperma/trisperma, Rhynchospora alba, Scheuchzeria palustris), qui attestent le statut trophique transitionnel des fens pauvres qui dominèrent la végétation de la tourbière entre 8000 et 3000–4000 cal. BP.
4.2.5 Bog
La disparition totale de la plupart des composantes floristiques minérotrophes et transgressives marque l’apparition de communautés strictement ombrotrophes. Ces formations, similaires à celles qui constituent la végétation tourbicole actuelle, étaient formées d’Ericacées, de Sphagnum et d’Eriophorum vaginatum subsp. spissum. La tourbe de sphaignes qui s’est accumulée au cours des stades de fen pauvre et de bog est le plus souvent fortement décomposée et ne comporte parfois que très peu d’éléments structuraux reconnaissables.
5 Discussion
Les stades séraux qui se sont succédé tout au long du développement de la tourbière de Mirabel présentent des accumulations organiques variables (Fig. 4). Les stades minérotrophes (marais et fens riches) sont caractérisés dans l’ensemble de la tourbière par des accumulations nettes plus importantes que les stades ombrotrophes (fens pauvres et bogs). Ce contraste est d’autant plus marqué que les tourbes minérotrophes sont antérieures aux tourbes ombrotrophes et qu’elles ont donc été soumises plus longtemps au processus de décomposition.
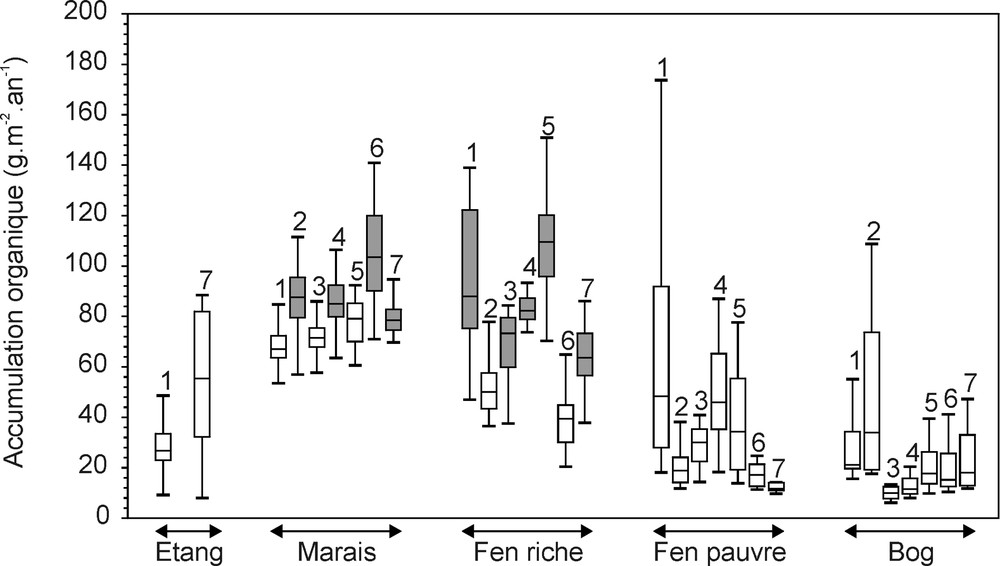
Relation entre végétation et accumulation organique. Les diagrammes de Tukey indiquent la valeur du premier quartile, de la médiane et du troisième quartile. Les moustaches précisent la dispersion des valeurs dans une limite fixée à ±1,5 fois l’intervalle interquartile. Les chiffres indiqués au-dessus des diagrammes correspondent aux numéros des profils. Enfin, les accumulations maximales atteintes dans chacun des profils sont repérées par des boîtes grisées.
5.1 Hétérogénéité floristique
Les communautés végétales les plus productives (Fig. 4) diffèrent d’un point de vue floristique entre les sept profils 〚9〛 : platière à Carex, Andromeda glaucophylla et Scheuchzeria palustris (profil 1), marais à Schoenoplectus tabernaemontani, Carex et Amblystégiacées (profils 2, 4 et 7), bois de Larix à fougères et Carex (profils 3, 4, 5 et 7) et marécage à Typha, Larix et Carex (profil 6). Cette hétérogénéité pourrait révéler l’influence déterminante des apports minérotrophes susceptibles d’avoir généré des accumulations similaires dans des communautés végétales diversifiées. Toutefois, la phase de fen pauvre, qui correspond à des modifications hydrologiques majeures, n’apparaît pas systématiquement reliée à la baisse de l’accumulation (Fig. 3).
5.2 Composition floristique
5.2.1 Taxons ligneux
Les grains de pollen de Larix et les tétrades d’Ericacées, faiblement dispersés, sont considérés comme de bons indicateurs de la présence locale de ces deux taxons. Les enregistrements polliniques de Larix, qui témoignent de son abondance au cours des stades minérotrophes, ne montrent toutefois aucune corrélation nette avec l’accumulation organique (Tableau 2). L’influence de ce taxon apparaît pourtant clairement au travers de l’accumulation de bois, particulièrement importante dans les profils 3 à 6. Cette contradiction révèle une fois de plus la difficulté à évaluer précisément l’abondance d’un taxon sur la seule base des données polliniques. Dans le cas présent, ces dernières surestiment l’importance de Larix durant les stades ombrotrophes, au sein desquels il ne jouait vraisemblablement qu’un rôle secondaire, similaire à son rôle actuel. Le développement local de fruticées à Ericacées présente une forte relation inverse avec l’accumulation organique, aussi bien marquée par les enregistrements polliniques que par les assemblages macrofossiles (Tableau 2). Cette corrélation atteste le rôle majeur joué par les Ericacées dans la constitution de la tourbe ombrotrophe et dans la réduction de l’accumulation.
Relations entre les enregistrements sporopolliniques et macrofossiles des principaux taxons tourbigènes et l’accumulation organique. Les corrélations linéaires sont significatives pour tous les profils et pour l’ensemble du site. Les coefficients de régression non calculés marquent l’absence des éléments considérés au sein des sédiments.
| Profil | 1 | 2 | 3 | 4 | 5 | 6 | 7 | Site | ||
| Pollen et spores | Coefficient de corrélation multiple | 0,647 ± 0,065 | 0,786 ± 0,052 | 0,919 ± 0,024 | 0,895 ± 0,037 | 0,881 ± 0,026 | 0,932 ± 0,023 | 0,851 ± 0,049 | 0,682 ± 0,029 | |
| Coefficient de vérification | 0,372 ± 0,188 | 0,598 ± 0,203 | 0,800 ± 0,131 | 0,793 ± 0,141 | 0,759 ± 0,128 | 0,714 ± 0,233 | 0,741 ± 0,137 | 0,654 ± 0,051 | ||
| Larix laricina | 0,166 | –0,045 | –0,045 | 0,095 | –0,120 | 0,128 | –0,080 | –0,012 | ||
| Ericacées | –0,332 | –0,369 | –0,550 | –0,536 | –0,451 | –0,239 | –0,282 | –0,379 | ||
| Cypéracées | 0,284 | 0,342 | 0,272 | 0,235 | 0,042 | 0,093 | 0,371 | 0,227 | ||
| Typha/Sparganium | 0,012 | –0,115 | 0,107 | 0,106 | 0,016 | 0,559 | –0,035 | 0,038 | ||
| Coefficients de régression | Osmunda | 0,032 | –0,061 | –0,050 | –0,056 | –0,211 | –0,101 | –0,399 | –0,145 | |
| Spores monolètes | –0,047 | 0,045 | 0,280 | 0,310 | 0,440 | 0,219 | 0,121 | 0,238 | ||
| Sphagnum | –0,012 | –0,215 | –0,092 | –0,050 | 0,078 | –0,131 | –0,073 | –0,078 | ||
| Macrorestes | Coefficient de corrélation multiple | 0,653 ± 0,054 | 0,798 ± 0,056 | 0,954 ± 0,159 | 0,978 ± 0,005 | 0,903 ± 0,029 | 0,837 ± 0,034 | 0,847 ± 0,037 | 0,713 ± 0,024 | |
| Coefficient de vérification | 0,526 ± 0,137 | 0,672 ± 0,146 | 0,926 ± 0,391 | 0,976 ± 0,014 | 0,865 ± 0,079 | 0,646 ± 0,284 | 0,672 ± 0,240 | 0,697 ± 0,044 | ||
| Bois | –0,101 | 0,080 | 0,392 | 0,290 | 0,391 | 0,283 | –0,062 | 0,175 | ||
| Ericacées | –0,301 | –0,433 | –0,453 | –0,370 | –0,377 | –0,261 | – | –0,267 | ||
| Herbacées | 0,297 | 0,200 | 0,104 | 0,209 | 0,091 | 0,463 | 0,343 | 0,313 | ||
| Sphagnum | –0,078 | 0,090 | –0,059 | 0,121 | –0,017 | – | –0,497 | –0,061 | ||
| Coefficients de régression | Amblystégiacées | 0,045 | 0,439 | 0,127 | –0,007 | – | – | – | 0,068 | |
| Substantia humosa | –0,005 | –0,161 | –0,270 | –0,324 | –0,222 | –0,274 | –0,315 | –0,270 |
5.2.2 Monocotylédones herbacées
Les stades minérotrophes furent dominés dans l’ensemble de la tourbière par des Cypéracées (Schoenoplectus, Carex), à l’exception d’un marais à Typha dans le profil 6. Les enregistrements polliniques et macrofossiles de ces formations herbacées sont corrélés positivement à l’accumulation organique (Tableau 2), témoignant de leur importance dans ce processus. Le profil 5 est le seul à ne pas présenter de relation nette, ce qui pourrait être lié à la faible représentation des Cypéracées au sein du boisement initial à Larix et à fougères. Dans tous les autres profils, les communautés herbacées minérotrophes ont généré d’importantes accumulations de tourbe. Si ces formations sont connues pour leur productivité élevée 〚30〛, le bon état de conservation des éléments composant la tourbe suggère ici que les fortes accumulations observées résultent également d’une faible décomposition.
5.2.3 Ptéridophytes
L’enregistrement de spores, associé à l’observation épisodique de sporanges, atteste le développement de formations denses de fougères durant les stades de fen riche (Dryopteris/Woodwardia) et de fen pauvre (Osmunda). L’absence de données macrofossiles empêche de préciser l’influence réelle des fougères dans le processus d’accumulation. Leur développement apparaît toutefois bien corrélé à l’accumulation de la tourbe, excepté dans le profil 1, qui se différencie des autres par des corrélations moins fortes et des coefficients de régression inverses (Tableau 2). Ces différences sont attribuées au fait que les spores de Ptéridophytes représentent dans ce profil un apport extra-local.
Les fougères à spores monolètes (Dryopteris/Woodwardia) ont constitué des communautés fortement accumulatrices au sein de boisements périphériques de Larix. De tels marécages à fougères s’observent assez communément à la marge des tourbières actuelles, mais sont généralement très peu tourbigènes. Les seules formations à dominante ptéridophytique actuellement connues pour de semblables potentialités accumulatrices sont des marais à Equisetum 〚31〛.
Le développement d’Osmunda, surtout marqué dans les profils 6 et 7, est au contraire corrélé négativement à l’accumulation de la tourbe. Au vu des données polliniques 〚9〛, la présence passée de ce taxon semble liée au développement d’arbustaies hautes de Nemopanthus mucronatus et d’Alnus incana subsp. rugosa. L’écologie actuelle des trois espèces présentes au Québec (O. cinnamomea, O. claytoniana et O. regalis) s’accorde bien avec celle de ces formations, minérotrophes et faiblement tourbigènes. Les trois espèces d’osmondes sont d’ailleurs actuellement présentes en périphérie de la tourbière, dans des boisements d’Acer rubrum, d’Abies balsamea et d’Alnus incana subsp. rugosa.
5.2.4 Bryophytes
Les Bryophytes ne présentent aucune corrélation nette avec l’accumulation de la tourbe (Tableau 2). On note toutefois des tendances générales : les sphaignes (Sphagnum) sont plutôt associées à de faibles accumulations, tandis que les Amblystégiacées semblent liées à des valeurs plus importantes. Ce patron est plus significatif dans le profil 2 que dans les autres, probablement parce que les Bryophytes y sont mieux conservés. En particulier, les macrorestes de sphaignes, facilement décomposés, peuvent être totalement absents dans les tourbes les plus humifiées. Cette caractéristique différencie les tourbières continentales (telles que Mirabel) des tourbières océaniques et subarctiques, dans lesquelles l’humidité atmosphérique et le froid réduisent significativement la décomposition et permettent une meilleure conservation des sphaignes tout au long des séquences 〚6, 11〛. L’enregistrement irrégulier des macrorestes de Sphagnum dans les profils 3 à 7 témoigne donc de l’importance de la décomposition durant les phases de fen pauvre et de bog. L’enregistrement des spores est beaucoup plus délicat à interpréter : en effet, la sporulation des sphaignes est très variable, dépendant à la fois des espèces et des conditions environnementales 〚32〛.
5.3 Décomposition
La proportion de matière organique indéterminable (Substantia humosa), qui traduit l’état de décomposition du sédiment 〚26〛, présente, dans les profils latéraux, une forte corrélation négative avec l’accumulation (Tableau 2). L’absence de corrélation dans le profil 1 met en évidence le fonctionnement différentiel des zones centrale et latérales et permet d’attribuer la plus grande accumulation dans la zone centrale à une moindre influence de la décomposition. Le profil 1 est en effet caractérisé par une croissance nette moyenne de tourbe de 0,41 mm an–1, contre 0,24–0,31 pour les profils latéraux. Ces gradients de décomposition et d’accumulation depuis le centre vers les marges de la tourbière pourraient révéler l’influence de la strate arborescente. Les arbres, essentiellement présents dans les zones périphériques, favorisent en effet, grâce à leur important système racinaire, l’oxygénation et la décomposition du substrat. Leur ombrage est en outre susceptible de réduire la productivité des strates herbacées et muscinales, essentiellement héliophiles.
6 Conclusions
L’accumulation de la tourbe présente des tendances similaires dans les sept profils étudiés (forte au début de l’Holocène et faible durant l’Holocène moyen et supérieur). Ses variations apparaissent toutefois asynchrones entre les différentes parties de la tourbière (Fig. 3), ce qui suggère son indépendance vis-à-vis du climat. Cette hypothèse est confirmée par une reconstitution paléoclimatique régionale, qui ne se corrèle avec aucune des variations de l’accumulation de tourbe 〚9〛. Ces variations apparaissent en conséquence avoir été essentiellement contrôlées par les paramètres locaux, et en particulier par la végétation. L’influence de cette dernière s’est notamment traduite par la réduction des apports minérotrophes, directement liée à l’élévation de la surface de la tourbière. L’importance passée de ces apports est révélée par l’hétérogénéité floristique des communautés végétales les plus productives, qui suggère l’existence de conditions minérotrophes initiales plus riches que les conditions actuelles. Ces conditions, peut-être liées aux farines de roches laissées par l’inlandsis à la déglaciation, ont permis le développement de marécages tourbigènes à Larix et fougères sans analogue actuel.
Cette influence générale fut modulée localement par différents paramètres, principalement liés à la structure et à la composition de la végétation. Les corrélations entre les enregistrements sporopolliniques et l’accumulation organique varient entre les différents constituants d’une même formation, mettant en évidence l’indépendance des uns par rapport aux autres. Par exemple, Carex et les fougères à spores monolètes présentent des corrélations bien supérieures à celles de Larix, avec lequel ils furent pourtant préférentiellement associés. Ceci révèle l’importance de la structure des communautés, et en particulier de la densité des boisements qui, dans les profils latéraux, est corrélée positivement à la décomposition. On peut cependant noter que la tourbe de bois, bien que souvent fortement décomposée, est associée dans la plupart des profils à des accumulations élevées.
La composition de la végétation a également exercé un contrôle sur l’accumulation de tourbe. Les deux taxons les plus influents autant aux niveaux phyto- que thanatocoenotique furent les deux familles dominantes des communautés tourbicoles : les Cypéracées et les Ericacées. La présence des Cypéracées caractérise des phases de très forte accumulation, attribuables à la fois à une forte productivité (enrichissement minérotrophe) et à une faible décomposition (bonne conservation des restes macrofossiles). Les Ericacées furent quant à elles associées à de faibles accumulations, imputables à la réduction de la productivité végétale (liée à la réduction des apports minérotrophes) et à l’augmentation de la décomposition (notamment traduite par la mauvaise conservation des sphaignes).
Ces résultats montrent que la dynamique postglaciaire de la végétation de la tourbière de Mirabel ne correspond pas parfaitement au gradient hydroséral actuel. Ce dernier est en effet caractérisé par des productions et des décompositions plus élevées dans les fens que dans les bogs, ce qui se traduit par des accumulations à peu près équivalentes dans les deux types de communautés 〚30, 33–35〛. Ces différences entre les hydrosères temporelles et spatiales sont attribuées à l’existence de conditions initiales extrêmement riches, sans équivalent actuel. De telles conditions, mises en évidence en différents endroits du globe 〚36, 37〛, ont pu influencer le développement postglaciaire des tourbières nordiques de manière plus importante que ce que l’on pensait jusqu’à présent.
Remerciements
L’auteur remercie David Fortin, Alayn C. Larouche, Nicole Morasse et Pierre J.H. Richard pour leur aide sur le terrain et au laboratoire, ainsi que deux lecteurs anonymes, pour leurs commentaires qui ont permis d’améliorer le manuscrit. Cette étude s’intègre dans le programme Peatland Carbon Study (Natural Sciences and Engineering Research Council of Canada) et a bénéficié d’une allocation de recherche du ministère français de l’Éducation nationale, de la recherche et de la technologie. Les données micro- et macrofossiles ont été déposées dans la Base de données polliniques et macrofossiles du Québec, université de Montréal, Québec.
Abridged version
Peat accumulation, which defines peatland ecosystems, results from imbalance between production and decomposition. Numerous allogenic and autogenic parameters control the relationships between both processes. Although the influence of autogenic factors is not still well understood, the importance of vegetation was early recognised, through the terrestrialisation hypothesis. According to the concept of facilitation, this hypothesis postulates a natural succession from limnic to palustre, semi-terrestrial then terrestrial communities. This work aims to evaluate the influence exerted by plants on peat accumulation, and to examine its mechanisms. It is based on independent records of plant, hydrology and peat accumulation, collected from seven profiles in a southern Quebec bog.
Mirabel bog is located 30 km northwest of Montreal Island, into the St. Lawrence lowlands. It is an ombrotrophic 2.15 km2 raised bog, comprising an elongate excentric shrubby zone and several peripheral woods. Microfossil (pollen, testate amoebae, algae, fungi) and macrofossil analyses were performed on the seven collected profiles. Coring locations were determined from basal topography and present-day vegetation. Seven radiocarbon dates, together with palynostratigraphic correlations, provide the chronological control of the bog development.
The organic accumulation presents highest values between 10 000 and 6000 cal. BP and lowest ones since 6000 cal. BP. The past history of local vegetation comprises the following stages: (1) pond with Potamogeton, Myriophyllum, Najas, Chara, Nymphaea, Brasenia, Nuphar, Gloeotrichia and planctonic algae; (2) marshes dominated by Shoenoplectus, Typha, Eleocharis and Carex; (3) rich fens characterised by Larix, Myrica, Carex, Menyanthes, monolete ferns and Calliergon trifarium; (4) poor fens inhabiting Ericaceae, Eriophorum, Sphagnum, Osmunda, Schoenoplectus, Viola, Andromeda, Carex, Rhynchospora and Scheuchzeria; and (5) bogs constituted, as today, by Ericaceae, Eriophorum and Sphagnum.
These seral stages present variable accumulations. Minerotrophic formations (marshes and rich fens) are characterised in the whole peatland by greater net accumulations than ombrotrophic ones (poor fens and bogs). Moreover, the most productive communities are floristically different between the seven profiles. This floristic heterogeneity could reveal the major influence of initial minerotrophic inputs, likely to have generated similar accumulations for various plant communities. The role of floristic composition is evaluated by correlating fossil records to peat accumulation; pollen and spores are considered to reflect past phytocoenoses, and macroremains to translate thanatocoenoses. (1) Ligneous fossils (pollen and wood) are mainly represented by Larix and Ericaceae. Wood remains show a positive correlation between tree density and peat accumulation. On the contrary, the development of Ericaceous shrubs was strongly associated with low accumulations, which attests their major influence on the peat accumulation decrease. (2) Herbaceous monocotyledonous plants were mainly represented by Cyperaceae and Typha. Pollen and macrofossil records of their communities are positively correlated with peat accumulation. The high peat accumulations characterising these formations are related to their well-known important productivity, but also to a weak decomposition indicated by the good conservation state of macroremains. (3) Pteridophytes constituted dense communities, dominated by monolete ferns (Dryopteris/Woodwardia) during the rich fen stage and by Osmunda during the poor fen one. Monolete ferns communities, located into peripheral Larix woods, were characterised by very high peat accumulations. Similar present-day formations, generally not or weakly peat-forming, does not constitute good analogues for these past communities. The development of Osmunda is, on the contrary, negatively correlated with peat accumulation. Its occurrences, reported into high shrubby formations of Nemopanthus and Alnus, agree with the ecology of these two minerotrophic, weakly peat-forming taxa. (4) Bryophytes present no obvious correlation with peat accumulation, certainly due to the variable conservation of their remains. However, Sphagnum appears to be rather associated with low accumulations and Amblystegiaceae with high values.
The decomposition degree was evaluated from the proportion of unidentifiable organic matter: except for the central profile, it is negatively correlated with the peat accumulation. This reveals the differential functioning of central and lateral zones and allows attributing the greater accumulation into the central zone to a lower decomposition. The central profile is effectively characterised by an averaged net peat increase of 0.41 mm yr–1, against 0.24–0.31 for lateral profiles. These gradients of decomposition and accumulation from centre to margins could translate the influence of the arborescent stratum. Trees, essentially present in peripheral zones, favour with their important root systems the oxygenation and the decomposition of substrate. Furthermore, their shade is likely to reduce the productivity of heliophilous herbaceous and bryophytic strata.
The similar trends of peat accumulation observed in the seven profiles attest the major influence of vegetation, by the way of the peatland surface elevation, itself resulting in a minerotrophic input decrease. This is enforced by the floristic heterogeneity of the most productive communities, which suggests richer initial minerotrophic conditions than today’s ones. These conditions, maybe related to rock floors abandoned by the inlandsis at the deglaciation, have notably allowed the development of highly peat-forming fern swamps without modern analogues.
This general influence however was locally modulated by different parameters, mainly linked to vegetation structure and composition. Correlations between pollen records and organic accumulation differ between the various components of a same formation, showing the independence of ones from others. For instance, Carex and monolete ferns present higher correlations than Larix, with which they were yet mainly associated. This reveals the importance of the community structure, and notably of the tree density, which, in lateral profiles, is positively correlated with decomposition. The floristic composition also exerted a control on the peat accumulation process. The two most influent taxa, at the phyto- and thanatocoenotic levels, were the dominant families of peatland communities: Cyperaceae and Ericaceae. The first one characterises phases of highest accumulation, attributed both to a high productivity (minerotrophic enrichment) and to a low decomposition (good conservation of macroremains). Ericaceae were associated to low accumulations, due to a decrease in productivity together with an increase in decomposition.
These results show that the postglacial dynamic of Mirabel bog vegetation does not correspond to the modern hydroseral gradient, characterised by higher productions and decompositions in fens than in bogs, and by similar accumulations in both types of communities. These differences between the temporal and the spatial hydroseres are attributed to extremely rich initial conditions without modern analogues. Such conditions, reported from different geographic areas, could have more strongly influenced the postglacial development of northern peatlands than previously thought.



