1 Introduction
L’étude intégrée des écosystèmes aquatiques continentaux a été longtemps limitée aux systèmes limniques (lacs et autres milieux stagnants), systèmes plus ou moins fermés, dont on pouvait appréhender les limites et maîtriser les apports. Les travaux relatifs aux rivières ne concernaient alors qu’un ou quelques groupes d’organismes (les communautés animales benthiques, les poissons et les macrophytes ont été les mieux étudiés 〚1–3〛). Ce n’est que plus tardivement, avec le River Continuum Concept 〚4〛 et le Nutrient Spiraling Concept 〚5,6〛 que les études du fonctionnement écologique des cours d’eau se sont développées. Depuis, la notion d’interdépendance des tronçons de rivière de l’amont vers l’aval 〚7–9, etc.〛 a été complétée par des interactions latérales, mettant en relation la rivière et sa plaine alluviale 〚10–14〛, mais également verticales, par l’intermédiaire des nappes souterraines, l’échelle temporelle représentant une dimension supplémentaire 〚15〛. Ce concept classique (RCC) a nécessité des modifications conséquentes avant d’être appliqué à de larges rivières aménagées (Serial Discontinuity Concept 〚16–19〛).
La Seine compte parmi les fleuves les plus fortement anthropisés d’Europe occidentale, de par ses aménagements hydrauliques (canalisation, création d’annexes hydrauliques...) et par la pollution–eutrophisation d’origine domestique et agricole. Dès 1989, le programme PIREN-Seine, puis le programme Seine-Aval sur l’estuaire à partir de 1995, se sont attachés à comprendre et à modéliser le fonctionnement écologique de ce système Seine à l’échelle du bassin, tant sur les bases conceptuelles existantes (références citées ci-dessus) que sur de nouvelles formulations 〚20〛.
Nous avons porté notre attention sur le compartiment planctonique des grandes rivières dès l’amont de Paris, et en particulier sur le rôle du zooplancton dans le transfert de la matière particulaire. Le plancton animal occupe en effet une position centrale, entre les producteurs primaires et les poissons, et a toujours été considéré comme un bon modèle pour la recherche 〚21–23〛 ; cependant, son rôle dans la rivière a été souvent sous-estimé. Le zooplancton de la Seine a donc été appréhendé à une échelle spatiale qui n’avait, à notre connaissance, pas encore été explorée, incluant les trois types de milieux aquatiques continentaux (lac, rivière, estuaire). Notre objectif était de comprendre le développement du zooplancton, d’amont en aval, et de décrire son comportement aux interfaces (lac–rivière, rivière–tributaire et rivière–estuaire). Bien qu’ayant ainsi privilégié l’aspect spatial à la variabilité temporelle, nous avons toutefois étudié les changements saisonniers de structure et de composition du peuplement dans cette association de milieux aquatiques.
2 Site d’étude
Le secteur d’observations s’étend sur plus de 700 km (Fig. 1) : il commence à 390 km à l’amont de Paris, dans la Marne (pK –387) d’ordre hydrologique 5 et dans la Blaise d’ordre 4, selon la classification de Strahler 〚24〛, au niveau du réservoir (lac de Der) en dérivation, et se termine dans l’estuaire de la Seine à son embouchure à Honfleur (pK 355).

Réseau hydrographique de la Seine et principales stations de prélèvement (triangles noirs) ; schéma du tronçon étudié. Les ordres hydrologiques sont indiqués pour les rivières étudiées. Certains pK sont donnés pour la Marne et pour la Seine. Les pK indiquent la distance en kilomètres du point 0, qui se situe à Paris intra muros : les pK négatifs sont attribués à la Marne et positifs à la Seine.
Le réservoir de la Marne est alimenté pendant la période des hautes eaux (de novembre à mai) par les eaux dérivées de la Marne et de la Blaise. C’est un ouvrage de grandes dimensions : sa surface totale est de 48 km2 à son niveau maximum, sa profondeur moyenne de 8 m et sa capacité maximale de 350 × 106 m3, ce qui explique le temps de séjour des eaux assez long, de l’ordre de 5 à 6 mois. Le statut trophique du réservoir, oligo-mésotrophe, et son fonctionnement écologique sont décris dans les références 〚25,26〛. La restitution des eaux dans la Marne se produit de juillet à octobre pour soutenir le débit d’étiage.
La Marne traverse la Champagne pouilleuse en aval du réservoir, puis elle reçoit les eaux de la Saulx et devient une rivière d’ordre 6. Elle se distingue des autres rivières par la longueur particulière de cet ordre (260 km), aménagé pour la navigation. Les barrages éclusés y maintiennent une profondeur constante d’un minimum de 3,5 m et réduisent la vitesse de l’écoulement. Le temps de séjour des eaux pendant la période d’étiage en aval du réservoir peut atteindre 5 à 7 jours. Les eaux sont riches en éléments nutritifs (PO4 : ∼0,2 mgP l–1 ; NO3 : ∼3,5 mgN l–1). Avec des débits d’étiage de l’ordre de 70–90 m3 s–1 pendant la période d’étude, la concentration en chlorophylle est d’environ 30 μg l–1 (concentration estivale moyenne) et peut atteindre 200 μg l–1 à son exutoire lors du bloom printanier ; la turbidité est de l’ordre de 10 mg MES l–1 et peut atteindre 150 mg MES l–1 en période de hautes eaux.
Dans son cours inférieur, depuis sa confluence avec la Marne jusqu’à son embouchure, la Seine est également aménagée. Dans l’estuaire, la largeur atteint 250 m, et la profondeur varie de 4,5 à 9 m. À l’aval de Paris, la concentration en éléments nutritifs est élevée (PO4 : ∼0,6 mgP l–1 ; NO3 : ∼7 mgN l–1 ; NH4 : ∼5 mgN l–1) ; la teneur en oxygène varie de la sursaturation jusqu’à des valeurs très faibles (près de 2 mg l–1 à l’aval immédiat de Paris et dans l’estuaire) et la concentration en MES augmente de 10 mg l–1 dans la rivière à 1000 mg l–1 dans le bouchon vaseux. L’influence de la marée dynamique est stoppée par le barrage de Poses (pK 202); quant à la marée saline, elle ne se propage pas au-delà de Caudebec (pK 310); la salinité augmente alors régulièrement jusqu’à 33,2‰ à l’embouchure.
3 Matériel et méthodes
3.1 Stratégie des prélèvements
Nous avons adopté un pas de temps de prélèvement variable dans les différents types de milieux étudiés (réservoir, rivière, estuaire). Au total, les observations concernent :
- • une station sur la Blaise et sur la Marne en amont du réservoir (suivis saisonniers de 1993 à 1995, pas de temps bimensuel) ;
- • trois stations dans le réservoir (suivis saisonniers de 1993 à 1995, pas de temps bimensuel) ;
- • deux stations à l’aval immédiat du réservoir (suivis saisonniers de 1993 à 1995, pas de temps bimensuel) ;
- • sept profils longitudinaux (huit stations) de la Marne (été 1995, pas de temps bimensuel) ;
- • une station dans chaque tributaire principal de la basse Seine (Seine, Marne, Oise), juste avant la confluence (de mai à octobre 1999 et 2000, pas de temps bihebdomadaire) ;
- • deux stations dans l’estuaire, amont (Poses, pK 202) et milieu (La Bouille, pK 260) de l’estuaire (suivis saisonniers en 1996, pas de temps bimensuel) ;
- • deux profils longitudinaux (19 stations) de la Seine inférieure et de l'estuaire (juillet et septembre 1997).
Notons ici que les profils longitudinaux ont été réalisés en une journée dans la Marne et en trois jours dans la Seine et dans l’estuaire, dans des conditions hydrologiques stables.
3.2 Échantillonnage, analyses, estimation de la biomasse
Les échantillons de plancton ont été prélevés avec une pompe dans le réservoir (à chaque mètre du fond à la surface) et à l’aide d’un seau gradué et une bouteille de Niskin dans la rivière. Les prélèvements sont réalisés à partir d’un pont au milieu de la rivière ou d’un bateau dans l’estuaire, en considérant que la rivière est un milieu turbulent et bien mélangé, où l’erreur d’échantillonnage sur un transect est inférieure à l’erreur de comptage 〚27〛.
Dix litres d’eau ont été filtrés à travers un tamis de 40 μm de vide de maille et préservés dans une solution de formaldéhyde à 4%. La détermination des organismes et les dénombrements ont été réalisés au microscope. Les Rotifères sont identifiés selon Koste 〚28〛 et Koutikova 〚29〛, les Cladocères, en accord avec Amoros 〚30〛 et Scourfield & Harding 〚31〛, les Copépodes, selon Dussart 〚32〛 et Lescher-Moutoué (comm. pers.). Les biomasses ont été calculées d’après les biovolumes pour les Rotifères et les Protozoaires 〚33,34〛 et d’après les relations taille–poids pour les microcrustacés 〚35〛.
Outre les mesures de température et d’oxygène dissous, l’eau a été prélevée pour les analyses de sels nutritifs et des MES, parallèlement aux échantillons du plancton. La biomasse phytoplanctonique, ressource nutritive principale du zooplancton, a été estimée par la quantité de chlorophylle a 〚36〛.
4 Résultats
L’amont du secteur étudié, caractérisé par de faibles abondances (et biomasses), correspond bien au secteur de démarrage du développement du zooplancton. Dans ces rivières de petits ordres, les organismes benthiques dans les échantillons sont en plus grande proportion qu’à l’aval : 61,5% sur deux stations les plus en amont et seulement 4,1% sur deux stations de l’estuaire. En amont du réservoir de la Marne, dans les rivières d’ordre 4–5, le zooplancton sensu stricto (c’est-à-dire à cycle vital complètement pélagique) de petite taille, à cycle vital court (Rotifera et Protozoa représentant 98,3% en termes de densité et 74,7% en biomasse), prédomine sur les microcrustacés (stades larvaires de Copepoda : nauplii et copépodites essentiellement). Le développement printanier du zooplancton, ainsi que celui du phytoplancton (dominé par les Diatomées), débute dès que les taux de reproduction deviennent supérieurs au taux de dilution, tant en amont qu’en aval (Fig. 2 ; Tableau 1). Si l’accroissement printanier des effectifs est essentiellement lié aux Rotifères et Protozoaires, la période estivale de basses eaux permet aux microcrustacés de prendre la relève, avec une dominance des Copépodes. La tendance est accentuée dans la basse Seine et dans l’estuaire fluvial (ordre 8), où le temps de résidence, qui s’accroît encore (10–20 jours), devient compatible avec un cycle de vie complet des microcrustacés (Fig. 2 ; Tableau 2). La biomasse zooplanctonique est bien plus importante en aval et dominée par les microcrustacés (58%). Les larves planctoniques de Dreissena (Mollusque, Bivalve), dont la dynamique est très différente, sont aussi proportionnellement plus abondantes en aval (Figs. 2 et 3).
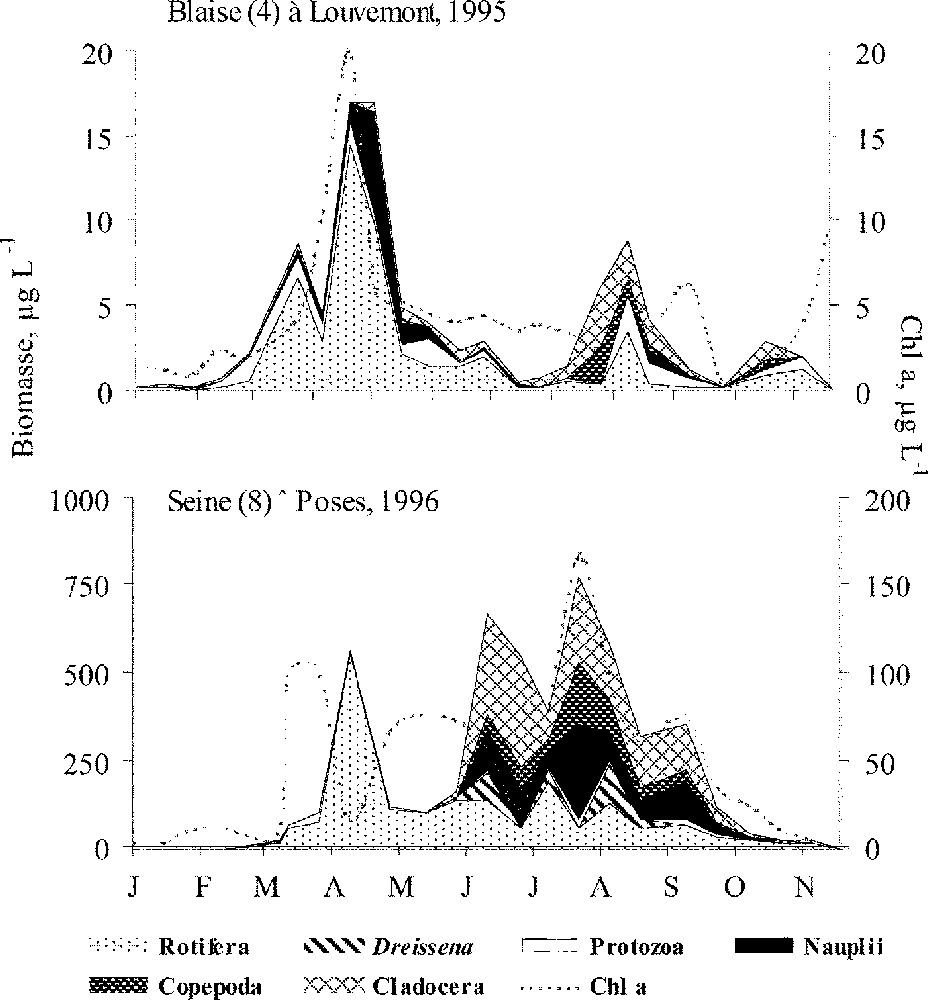
Variations saisonnières des principaux groupes zooplanctoniques (μgPS l–1) et de la concentration en chlorophylle a (μg l–1) dans la Blaise (ordre 4) et dans la Seine à Poses (ordre 8), deux stations distantes de 590 km.
Corrélations entre différents facteurs de contrôle (débit et chlorophylle) du zooplancton dans les rivières d’ordres 4 et 8.
| Variables | Coefficient de corrélation | Signification de la corrélation (n = 24) | |
| débit – chlorophylle a | –0,454 | α < 0,05 | |
| Station amont, ordre 4 | débit – zooplancton | –0,278 | ns |
| chlorophylle a – zooplancton | 0,612 | α < 0,01 | |
| débit – chlorophylle a | –0,576 | α < 0,01 | |
| Station aval, ordre 8 | débit – zooplancton | –0,524 | α < 0,02 |
| chlorophylle a – zooplancton | 0,384 | α < 0,05 |
Évolution, d’amont en aval, de la concentration moyenne en chlorophylle a, du poids (PS) moyen individuel du zooplancton, en comparaison avec le débit et le temps de séjour des eaux dans la Marne (a) et dans la Seine (b) en période estivale (pK : cf. Fig. 1).
| a) Marne (juin–septembre 1995, 11 stations avec le réservoir) | ||||||
| Amont du réservoir | Réservoir | Aval du réservoir | Secteur non navigable | Secteur navigable | Confluence avec la Seine | |
| Variables | pK –387 | pK –352 | pK –284 à –208 | pK –169 à –117 | pK –5 à 0 | |
| Q (m3 s–1) | 11,2 | 29,7 | 36,0 | 52,5 | 53,7 | |
| Temps de séjour (j) | 0,5 | –150 | 1,7 | 2,5 | 3,0 à 3,5 | 4,5 |
| Chlorophylle a (μg l–1) | 32,8 | 5,3 | 22,3 | 25,2 | 21,4 | 14 |
| Zooplancton : poids moyen (μg ind.–1) | 0,05 | 0,29 | 0,23 | 0,07 | 0,06 | 0,12 |
| b) Seine (juillet et septembre 1997, 19 stations) | ||||||
| Aval de Paris | Secteur des rejets urbains | Seine inférieure | Estuaire fluvial | Méandres | Embouchure | |
| Variables | pK 0 à 48 | pK 70 à 84 | pK 101 à 173 | pK 202 à 252 | pK 260 à 310 | pK 337 à 355 |
| Q (m3 s–1) | 235 | 313,8 | 328,7 | 346,3 | 396,4 | 356,5 |
| Temps de séjour (j) | 3,1 à 5 | 5,7 à 6,2 | 6,65 à 9,6 | 10,2 à 12,5 | 12,8 à 16,2 | 19,6 à 25 |
| Chlorophylle a (μg l–1) | 10,8 | 13,2 | 21,9 | 30,9 | 80,9 | 102,5 |
| Zooplancton : poids moyen (μg ind.–1) | 0,04 | 0,05 | 0,055 | 0,06 | 0,065 | 0,07 |
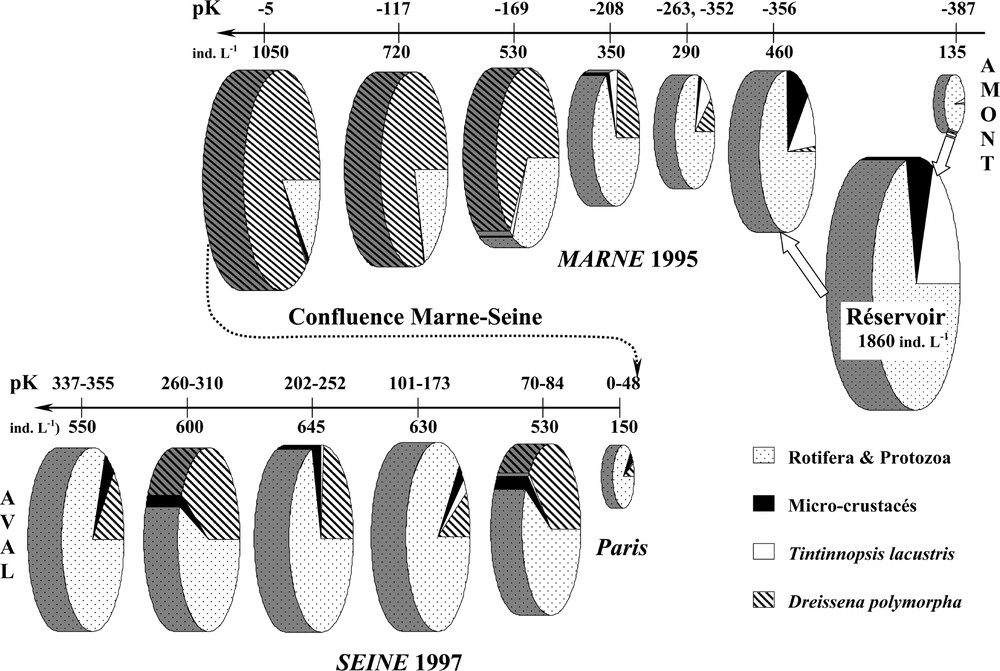
Abondances relatives des principaux groupes zooplanctoniques, de l’amont vers l’aval : dans la Marne et dans la Seine après la confluence avec la Marne (jusqu’à son estuaire). Les stations sont présentées en fonction de leurs pK (cf. Fig. 1). Les abondances moyennes (ind l–1) sont indiquées pour chaque tronçon.
L’influence du réservoir se traduit non seulement par une augmentation de l’abondance des organismes (et de la biomasse), mais aussi par une dérive de la structure et de la composition du peuplement (Figs. 3 et 4). Dans la Marne réceptrice des eaux restituées, le poids moyen individuel est multiplié par 4 (Tableau 2). Le réservoir, au temps de séjour relativement long, permet le développement de grands microcrustacés, exportés dans la rivière de même que les herbivores de petite taille, les Tintinnides (Ciliés), fortement présents dans le réservoir. Le réservoir est donc une source d’organismes pour la rivière. Microcrustacés et Tintinnides disparaissent toutefois rapidement à l’aval (Fig. 3).
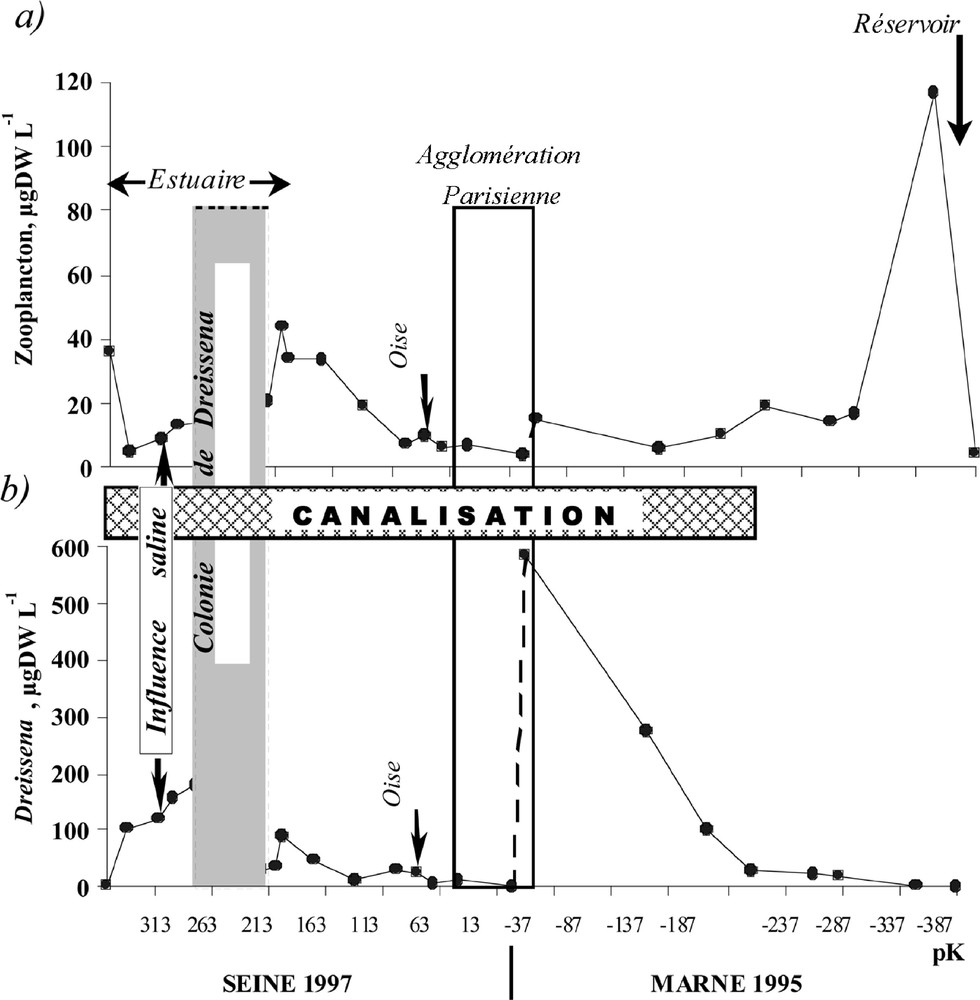
Évolution amont–aval des biomasses dans la Marne (1995) et dans la Seine (1997) : (a) zooplancton sensu stricto ; (b) larves planctoniques de Dreissena.
Dans la seconde moitié de l’axe principal de la Marne, l’abondance du zooplancton (au sens large) s’accroît à nouveau vers l’aval, mais la composition du peuplement diffère. Le peuplement zooplanctonique, de nouveau composé par des petits organismes à temps de génération court (taxons fluviaux : Rotifères, par exemple), est alors dominé par les larves de Dreissena, qui apparaissent ainsi en grande quantité dans le secteur aménagé de la Marne (Figs. 3 et 4).
Dans la Seine, sur 300 km à l’aval de Paris, une nouvelle séquence du développement du zooplancton dulçaquicole se traduit par une augmentation rapide des effectifs (atteignant plus de 6000 Rotifères par litre dans l’estuaire supérieur) et de la proportion de la composante Dreissène (Figs. 3 et 4). Les espèces dominantes du zooplancton (Brachionus calyciflorus, Keratella cochlearis tecta, etc.) indiquent le statut eutrophe de la Seine et de son estuaire.
L’axe principal de la basse Seine reçoit les apports de deux principaux tributaires : la Marne et l’Oise. Ces apports peuvent être très variables (enrichissant, diluant, ou isodensitaires). Certains prélèvements ponctuels montrent des changements dans les proportions des différents groupes zooplanctoniques et dans les effectifs après les confluences (Fig. 5). En termes de flux annuels, chaque rivière contribue au flux total (densités moyennes par seconde pour la saison de production de mai à octobre 1999 et 2000), selon la concentration du zooplancton et son débit : la Seine, – 25%, la Marne, – 12% ; l’Oise, 63%. Rares sont les cas comportant des différences dans la composition spécifique de ces tributaires : un exemple, confirmé par les observations pluriannuelles, concerne l’espèce Keratella robusta qui, présente dans la Seine et dans la Marne, est absente dans l’Oise. Cette espèce provient vraisemblablement des réservoirs implantés dans la partie amont des premières rivières.

Contribution des principaux tributaires au flux total de zooplancton dans la Seine (juillet et septembre 1997). M = Marne, S = Seine, S+M = Seine après la confluence avec la Marne, amont O = Seine en amont immédiat de sa confluence avec l’Oise, S+M+O = Seine à l’aval immédiat des confluences avec la Marne et l’Oise. Les points correspondent aux flux de chlorophylle.
Au total, le flux du zooplancton dans les cours d’eau étudiés à partir de l’ordre 4 croît d’amont en aval de façon exponentielle, tandis que le débit augment linéairement (Fig. 6). Cette séquence est interrompue dans l’estuaire inférieur, où les biomasses du zooplancton dulçaquicole diminuent rapidement à l’apparition des taxons d’eaux saumâtres (Synchaeta bicornis, Eurytemora affinis, Acartia discaudata, etc.), simultanément avec les intrusions salines (Fig. 4).
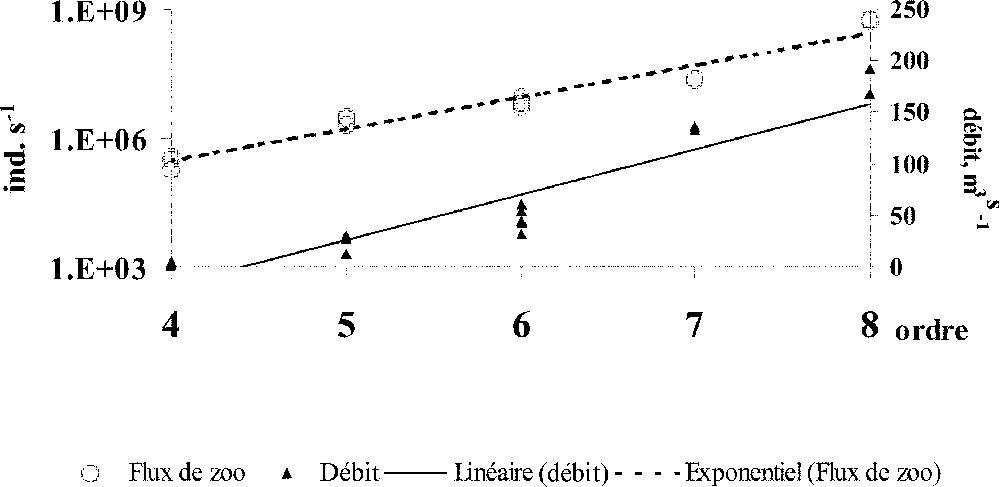
Flux moyens (juin–octobre) du zooplancton sensu stricto, larves de Dreissena exclues, en fonction du débit et du numéro de l’ordre hydrologique dans le bassin de la Seine. Données de 16 suivis saisonniers de 1991 à 1996 (observations pour l’ordre 7, Protozoa exclus, d’après Miquelis 〚37〛). Notez l’échelle logarithmique utilisée pour le flux de zooplancton.
5 Discussion
5.1 Le développement du zooplancton dans un gradient amont–aval
Les cours d’eau de petits ordres (1–3) sont, en général, des milieux à court temps de séjour, pauvres en éléments nutritifs, qui ne favorisent pas le développement planctonique autochtone. La vie aquatique est essentiellement caractérisée par des organismes benthiques. Dans ces zones amont, la composition du plancton est donc souvent déterminée par des inocula, en provenance des zones latérales des rivières, plus ou moins stagnantes 〚38–40〛.
Une véritable production autochtone n’est observée qu’à partir des ordres intermédiaires 4–5. Le zooplancton fluvial se développe tant en réponse à l’augmentation du temps de séjour des eaux (3–5 jours) qu’à l’accroissement de sa ressource nutritive. La biomasse zooplanctonique moyenne y est encore faible, environ 10 μgPS l–1 d’avril à septembre, en raison de la dominance des petites espèces à cycle vital court, comme les Rotifères 〚40–43〛. La richesse spécifique y est élevée, grâce à la composante benthique et périphytique importante, mais seules quelques espèces peuvent toutefois être considérées comme « plancton vrai », c’est-à-dire à cycle de vie complètement planctonique.
Plus en aval, les biomasses zooplanctoniques augmentent, ainsi que les poids moyens individuels. Les grands organismes filtreurs (Daphnia), très rares en amont, sont présents à l’aval si le temps de séjour est suffisamment long pour leur développement. Dans ces conditions, l’influence du zooplancton sur le nanophytoplancton peut être significative, le contrôle étant effectif dès que les densités dépassent 200 individus l–1 〚44,45〛.
Cette tendance amont–aval du développement du zooplancton s. str., résultant d’un compromis entre le temps de génération des organismes et le temps de séjour des eaux 〚27,41,46,47, etc.〛, est modulé par de nombreuses contraintes, parmi lesquelles l’influence d’annexes hydrauliques (ici le réservoir de la Marne), les apports par les tributaires et la colonisation par les Dreissènes. À l’aval de l’estuaire, on peut considérer que l’interface eau douce–eau de mer constitue une ultime perturbation.
5.2 Connexions latérales
Dans le secteur amont, les lâchures du réservoir de la Marne représentent une interruption importante du continuum fluvial 〚47–49〛. Outre les modifications de l’hydraulique et de la qualité de l’eau 〚25,26〛, le réservoir constitue en particulier une source d’organismes 〚49–51〛 : l’accroissement brusque de la biomasse et le changement de la structure observés entre l’amont et l’aval du réservoir ne peuvent pas s’expliquer par la croissance du zooplancton fluvial 〚47,49〛. Le rôle de ce zooplancton, exporté sur la dynamique nanophytoplanctonique est assez limité, puisque les grands filtreurs microcrustacés disparaissent assez rapidement. Plusieurs causes entraînent l’élimination des grandes espèces : ce sont la prédation par les poissons 〚49〛, la turbulence et la turbidité liées à la lâchure. Un courant fort peut en effet endommager les grands Cladocères (effet mécanique négatif) et contribuer à accroître les concentrations en MES qui, obstruant l’appareil de filtration, gênent leur nutrition 〚52〛.
Si l’allongement du temps de séjour à l’aval est favorable au développement de la composante « microcrustacés », il existe également des zones calmes adjacentes présentes dans le secteur inférieur du fleuve (zones portuaires, gravières, sablières) offrant des conditions favorables au développement du plancton 〚53,54〛. Cette connectivité latérale se traduit aussi par la présence dans nos échantillons d’organismes adaptés aux milieux stagnants, incluant petites mares et endroits humides (Leptodora, Bdelloides et Tardigrades des mousses). Un tel « enrichissement » de la composition est souvent évoqué pour les cours d’eau peu aménagés, en connexion avec leur plaine d’inondation pendant les périodes de crue 〚12,14,55〛. Dans le cas de la Seine (fleuve canalisé avec une hydraulique régie par le fonctionnement des barrages–réservoirs et des écluses), cette dimension latérale est plus constante, surtout en regard du plancton, qui se reproduit essentiellement à l’étiage ; pendant cette période, la connexion avec ces annexes est en effet minimale (sauf dans le cas particulier du réservoir de la Marne, en dérivation).
En revanche, à une échelle spatiale plus fine, l’influence des zones rivulaires sur le chenal est possible. En effet, dans les zones calmes à macrophytes (profil transversal de la Marne, pK –117, largeur 60 m, cf. 〚27〛) la densité du zooplancton est significativement plus élevée par rapport au chenal principal : ces zones de ralentissement du courant peuvent donc être considérées comme des sources de plancton d’importance variable en fonction de la couverture en macrophytes 〚56,57〛. Les rivières échantillonnées sont navigables dans leur cours inférieur et ne sont pas très larges (50–250 m). La couverture dans la rivière la plus concernée, la Marne, ne dépasse jamais 10% sur les tronçons à macrophytes 〚58〛. Même si localement ces habitats littoraux propices à une faune plus riche contribuent à l’exportation des taxons périphytiques (par exemple, les Cladocères, Chydoridae : Alona, Pleuroxus, Chydorus, les Rotifères : Trichocerca), leur influence sur l’accroissement des effectifs est très limitée, en comparaison de celle des lacs fluviaux peu profonds 〚57〛. Ces apports ne sont plus perceptibles avec la progression vers l’aval, où la portion « chenal » est beaucoup plus importante par rapport aux habitats rivulaires, au courant considérablement ralenti (profil transversal de la Seine, pK 260, largeur 250 m, cf. 〚27〛).
Inversement, les différences significatives de concentrations zooplanctoniques apparaissent entre les masses d’eau superficielles et profondes dans l’estuaire, où la Seine atteint 9–15 m de profondeur : généralement, la densité au fond y est de deux à quatre fois plus faible (profil transversal 1996, cf. 〚27〛). Le rôle de cette dimension verticale est encore peu clair : contrairement à nos observations, des densités très élevées de microcrustacés sont trouvées dans la couche limite à vitesse de courant très réduite, mais le taux d’échange entre ces couches et la colonne d’eau n’est pas précisé 〚59〛.
Les affluents (la Marne et l’Oise), dont les apports sont variables pendant la saison de production, peuvent représenter également une discontinuité 〚60,61〛, telle qu’une dilution ou une concentration des flux. Leur impact sur la composition du zooplancton reste toutefois moindre, en comparaison des apports venant du réservoir en dérivation, caractérisés par des biomasses élevées et une structure de peuplement très différente de celle de la rivière.
5.3 La composante « Dreissène »
L’invasion des systèmes aquatiques par ces mollusques filtreurs est devenue un sujet d’actualité à l’échelle internationale 〚62〛, à cause de l’impact de cet organisme sur le fonctionnement des écosystèmes. Les abondances des larves, indicatrices de la présence et de la distribution de ce bivalve benthique dans le réseau fluvial 〚63〛, sont souvent exceptionnellement élevées dans les portions aval des rivières étudiées, même si ces larves sont détectées dès l’amont, depuis le barrage–réservoir. Ce gradient amont–aval de la distribution des larves est lié, de toute évidence, à une implantation hétérogène des adultes fixés dans le lit de la rivière 〚64〛. La puissante capacité de filtration de ce mollusque exotique nous a conduits à prendre en compte l’impact top-down de ses deux stades – planctonique et benthique – sur les peuplements phytoplanctonique 〚64–66〛 et zooplanctonique 〚67〛. La diminution des abondances zooplanctoniques dans l’estuaire moyen (pK 230–260), bien en amont de l’influence négative des MES (bouchon vaseux) et de la salinité, est probablement due à l’implantation de la colonie de Dreissènes la plus dense. Cette hypothèse est confirmée par la restructuration du peuplement algal dans ce même secteur 〚27,64〛 : en consommant préférentiellement le nanophytoplancton, les moules favorisent le développement des grandes espèces (coloniales ou filamenteuses).
6 Conclusion
Si l’on se réfère aux différents modèles proposés pour expliquer le fonctionnement des rivières suivant l’axe amont–aval, on constate que le concept d’un continuum (type RCC 〚2,4,9, etc.〛) s’applique mal à la Seine ; le modèle du SDC (Serial Discontinuity Concept 〚16〛) convient mieux à notre cas de rivière fortement aménagée. Plusieurs types de discontinuité ont pu être mis en évidence.
- • Réservoir/rivière. Situé en amont du bassin, le réservoir modifie fortement le régime hydrique naturel ; il joue un rôle de puits vis-à-vis des éléments nutritifs 〚25,26〛 et, lors de la restitution des eaux (de juin à octobre), il introduit une discontinuité quantitative importante, quoique locale, au niveau du plancton (eaux pauvres en phytoplancton et riches en zooplancton, 〚49〛).
- • Affluents/rivière. Les apports latéraux par rapport à l’axe principal de la Seine sont très variables dans le temps, mais à l’échelle annuelle ou pluriannuelle l’Oise assure la plus grande part du flux total du zooplancton en aval de sa confluence. Les apports des affluents sont maintenus au cours du transport des masses d’eau (contrairement à ceux du réservoir), car il s’agit des communautés potamiques qui se retrouvent dans des conditions (niveau de ressources nutritives, environnement physico-chimique) semblables à celles de leurs « sources ».
- • Rivière/estuaire. Naturellement, la salinité devient un facteur très perturbant pour les espèces strictement dulçaquicoles et oligohalines, qui disparaissent dans l’embouchure par éclatement des cellules sous l’effet de la pression osmotique. Ces organismes morts composent une grande partie des détritus organiques dans l’embouchure de la Seine.
Outre ces trois interfaces cités, liés en premier lieu à l’hydrologie, la colonisation par les moules est à l’origine des variations du stock et de la composition du plancton.
Au total, le rôle du zooplancton dans la vie de la rivière, souvent sous-estimé, doit être reconsidéré en prenant en compte sa cinétique particulière et son impact généralement croissant d’amont à l’aval : les relations massiques (en mgC m–2) phyto-/zooplancton calculées pour la Marne (ordre 5 ; 180–200) et pour la Seine (ordre 8 ; 10–12) reflètent cette tendance. Ces résultats confirment donc l’importance de la production autochtone du plancton dans les grandes rivières (Riverine Productivity Model 〚68〛). Lors de son transport, la communauté zooplanctonique est « façonnée » par les contraintes du cours d’eau, variables dans le temps et dans l’espace. À l’image de la Seine, nombre de grandes rivières européennes (la Moselle 〚69〛, le Rhin 〚60,70〛, la Loire 〚54〛, le Rhône 〚71〛, etc.) ont subi de tels aménagements. Les rivières sont des systèmes ouverts qu’il faut étudier à une échelle spatio-temporelle relativement large, pour comprendre, quantifier et hiérarchiser les facteurs qui régissent l’évolution amont–aval du plancton.
Abridged version
Whereas the ecological functioning of lake systems has been widely studied since the 1960’s, comprehensive studies of river functioning only really began with the River Continuum Concept 〚4〛 and Nutrient Spiraling Concept 〚5,6〛, requiring considerable modification of these concepts before applying to large river systems and to strongly regulated rivers (Serial Discontinuity Concept: 〚16–19〛).
The Seine, which is among the most polluted and human-impacted rivers of the Atlantic Coast, has been intensively studied for several years 〚20〛. In the Seine River, zooplankton was studied over a 700 km-long river sector (Fig. 1). The objectives were here (i) to understand zooplankton development within an entire river continuum, strongly affected by human activity, and (ii) to investigate the zooplankton behaviour at the reservoir–river, river–river and river–estuary interfaces. The studied sector begins 350 km upstream from Paris in rivers of orders 4 (the Blaise) and 5 (the Marne). In winter, one part of the discharge from these rivers is diverted into a large reservoir (48 km2, 350 × 106 m3). In the mid-summer, the water is released from the reservoir into the Marne River in order to sustain low flow. The reservoir is oligo-mesotrophic 〚25,26〛. The Marne River, canalised along its last 280 km, reaches the Seine immediately upstream from Paris. The lower reach of the Seine River from Paris to its mouth, also canalised, is strongly affected when it transits through the city, but most markedly downstream, where the Achères waste-water treatment plant discharges the treated effluents from the 10 millions inhabitants of Paris and its suburb (N–NH4 = 5 mgN l–1, N–NO3 = 7 mgN l–1, P–PO4 = 0.7 mgP l–1).
Samples were taken at a twice-monthly interval in the upper part of the studied sector, including the reservoir (1993 to 1995), and in the estuary (1996, 1998). The lower Seine River, from Paris to the estuary, has been investigated in the summer of 1997, with two longitudinal profiles (19 stations). Three major tributaries of lower Seine River (Seine, Marne and Oise Rivers) were sampled weekly from 1999 to 2000 just upstream of their confluences.
In the spring, phytoplankton and zooplankton development begins when discharge decreases (Fig. 2, Table 1). In upstream waters (from 4th–5th river orders, 〚24〛), the zooplankton is dominated by small species (Rotifers and Protozoans) with short generation times and small individual body weight (Fig. 2, Table 2). Conversely, larger species (microcrustaceans), with longer generation times, develop downstream of the river and the estuary.
The upstream–downstream zooplankton development is strongly modified by human impact. In the studied upstream sector, zooplankton input from the Marne reservoir represents one type of alteration of the general trend (Figs. 3 and 4). Even though the residence time of the river water is still very short, microcrustaceans are present in high proportions immediately downstream from the reservoir. Clearly, the reservoir is a source of zooplankton for the river. Large-size microcrustaceans rapidly disappear, mainly due to fish predation 〚49〛, and therefore the exported zooplankton has a low impact on the river phytoplankton. Discontinuities, such as confluences (Seine and Marne, Seine and Oise, Fig. 5) have a relatively small effect on the stock of zooplankton with regard to the water release from the reservoir, but they persist more downstream, because they have the same potamic origin. Each tributary contributes to total annual flux of zooplankton as follow: Seine River: 25%, Marne River: 12% and Oise River: 63%. A few microhabitats with macrophytes or small hydraulic annexes play a small role for this canalised river, but they can modify locally the plankton community structure and composition.
As a whole, the flux of zooplankton rises exponentially whereas discharge increases linearly (Fig. 6) from upstream (4th order) to downstream (8th order), which might confirm the hypothesis of the importance of riverine autochthonous production 〚68〛.
In the studied sector, Dreissena larvae can build up an important biomass, which adds to that of the zooplankton sensu stricto (Fig. 4). The larvae are especially abundant upstream from Paris in the downstream-canalised sector of the Marne River, showing a widespread colonisation of the benthic substrates by the adult Dreissena. One of the largest Dreissena colonies was located in the middle of the estuary 〚64〛. We suppose that this colony can have an important top-down effect on freshwater phyto- and zooplankton, acting before the other factors, like high turbidity and seawater intrusion. More downstream, rising salinity leads to the decrease of freshwater species that are replaced by marine taxa.
As a whole, this large-scale study in the Seine River Basin shows that zooplankton development in the upstream part of system corresponds better to the Serial Discontinuity Concept 〚16〛 more than to classical concept of the River Continuum 〚2,4, etc.〛. The reservoir–river interface is a real disruption for the river, but lacustrine zooplankton inputs from reservoir disappear rapidly in the lotic environment 〚49〛. On the other hand, the tributaries impact remains stable downstream from confluence and contributes to enrichment or dilution of zooplankton in the Seine River. For these canalised and highly managed rivers, littoral microhabitats and small hydraulic annexes cannot be considered as an important source of plankton. Therefore, autochthonous zooplankton production (controlled firstly by water residence time and rarely limited by nutritive resources 〚27,41,46,47〛) is the main responsible for exponential increasing of zooplankton from upstream to downstream as far as the middle estuary, where it reaches very important biomass. Here, one biotic factor, filtration by Dreissena’s colony could explain zooplankton decrease before negative influence of high turbidity and salt-water penetration. Therefore, the role of riverine zooplankton was frequently underestimated, but we must consider zooplankton as well as benthic community in control of nanophytoplankton in downstream parts of such large lowland rivers 〚44,45,65,66〛.
Like the Seine, many other Europeans rivers have been managed (the Moselle 〚69〛, the Rhine 〚60,70〛, the Loire 〚54〛, the Rhone 〚71〛, etc.). To rehabilitate them, it is necessary to consider the rivers as open systems that must be studied at large time and space scales, to understand, quantify and classify the factors that control the upstream–downstream development of plankton.



