1 Introduction
La culture du palmier dattier est une culture stratégique, particulièrement dans les zones sud-marocaines. Le patrimoine phœnicicole est composé d’une multitude de variétés (≡ 230), représentées par environ deux millions de palmiers (soit 44,4%) et plus de 55,6% de khalts ou saïrs (hybrides naturels) 〚1〛. Sa répartition est faite sur une superficie de 44 000 hectares, avec un effectif de 250 000 pieds productifs. Elle s’étend sur plusieurs régions, dont celles de Tafilalet et Drâa, qui contiennent plus de 70% de l’effectif national global en palmiers dattiers 〚2〛. Cette culture constitue le pivot économique et culturel d’une population importante et contribue à la préservation d’un écosystème fragile, menacé par le Bayoud (maladie causée par Fusarium oxysporum) et par la désertification. En effet, les dégâts enregistrés sont importants en termes de réduction de l’effectif de palmiers dattiers (environ 10 millions d’arbres décimés par la maladie du Bayoud), d’érosion génétique (disparition totale des variétés, exemple de Berni et Idrar), de désertification et d’exode des populations rurales.
Pour repeupler la palmeraie dévastée, la propagation traditionnelle par culture de rejets ne peut répondre aux énormes besoins en plants nécessaires pour la reconstitution de la palmeraie marocaine, vu le nombre limité de rejets (20 rejets) que peut produire un palmier au cours de sa vie 〚3, 4〛. Le recours aux techniques de culture in vitro offre la seule alternative permettant la multiplication en masse et la diffusion rapide des cultivars aux phœniciculteurs. Aujourd’hui, dans le monde, la propagation in vitro du dattier est réalisée à travers l’embryogenèse somatique et l’organogenèse, utilisant différents explants. Ainsi, depuis la mise au point de la technique de propagation in vitro du palmier dattier 〚5〛, les autorités marocaines ont mis en place un projet ambitieux ayant pour but de reconstituer la palmeraie dévastée à l’aide de plants issus de cultures in vitro. Ce programme s’échelonne sur 20 ans (1987–2007) et vise à planter 150 000 plants par an 〚6, 7〛.
Dans le but de produire des plants génétiquement conformes, on préfère au Maroc l’utilisation de la technique d’organogenèse à partir de jeunes feuilles de cœurs de rejets, qui permet, en principe, une certaine authenticité variétale, au lieu de la technique d’embryogenèse somatique. Toutefois, le passage par cal peut induire des variations génétiques dans la qualité du fruit, la résistance aux maladies et d’autres caractères morphologiques et horticoles 〚8, 9〛. Ainsi, plusieurs centaines de vitroplants ont été produits à l’Inra de Marrakech, puis transmis à d’autres laboratoires commerciaux.
Après 10 ans de cultures, l’observation au champ des vitroplants de palmier dattier montre des variations morphologiques. Suite aux rapports des offices régionaux de mise en valeur agricole (Ormva) d’Errachidia et d’Ouarzazate, un certain nombre d’anomalies ont été enregistrées (voir Figs 1 et 2) :

Émission de nombreux rejets et dislocations de l’arbre.

Malformation du rachis et dessèchement des folioles.
- • émission de nombreux rejets et gourmands ;
- • malformation des folioles et du rachis ;
- • chute précoce de fruits et faible taux de nouaison ;
- • fruits parthénocarpiques ;
- • absence de maturité pour les dattes de certains clones ;
- • non-conformité de Boufeggouss au Boufeggouss standard ;
- • après 10 ans de culture, 18% d’un échantillon de 1078 vitroplants sont actuellement entrés en production dans la zone d’Errachidia.
Le but de notre étude est l’évaluation de la variabilité intraclonale de vitroplants de palmiers dattiers, obtenus par la technique d’organogenèse à partir de jeunes feuilles de cœurs de rejets, à l’aide de marqueurs morphologiques portant sur les organes végétatifs et reproducteurs.
2 Matériels et méthodes
2.1 Matériel végétal
Le matériel végétal étudié comprend 92 clones (Tableau 1), répartis en trois variétés (BFG, JHL et BSK) et deux saïrs (S16bis et S35). Ces variétés et saïrs sont plantés à la station de mise en valeur agricole d’Errachidia, dans les mêmes conditions, et reçoivent le même entretien depuis 1989. Les mesures des caractères morphologiques sont effectuées sur 24 clones chacun pour BFG, S16bis et S35, et sur 11 pour JHL et 9 pour BSK.
Nombres de clones, date de plantation et d’entrée en production des cultivars et saïrs étudiés.
| Cultivars et saïrs | Code | Nombre de clones | Date de plantation | Entrée en production |
| Boufeggouss | BFG | 24 | 1989 | oui |
| Jihel | JHL | 11 | — | non |
| Bousekri | BSK | 09 | — | non |
| Saïr 16bis | S16b | 24 | — | oui |
| Saïr 35 | S35 | 24 | — | oui |
Pour chaque clone, les mesures de 34 caractères portent à la fois sur l’appareil végétatif (29 caractères) et reproducteur (5 caractères). Toutes les variables (Tableau 2) sont des caractères quantitatifs. Elles concernent :
Codage des caractères morphologiques étudiés.
| Caractères | Codes | |
| Stipe | 1. hauteur du stipe | HS |
| 2. diamètre du stipe | DS | |
| 3. nombre de gourmands | NGd | |
| Palme | 4. longueur totale de la palme | LTP |
| 5. longueur de la partie foliolée | LPF | |
| 6. longueur de la partie épineuse | LPE | |
| 7. gabarit de la partie foliolée en haut | GPH | |
| 8. gabarit de la partie foliolée au milieu | GPM | |
| 9. gabarit de la partie foliolée en bas | GPB | |
| 10. largeur au milieu du rachis | lMR | |
| 11. largeur à la 1re épine | l1E | |
| 12. largeur à la base du rachis | lBR | |
| Foliole (Penne) | 13. nombre total de folioles | NTF |
| 14. longueur de foliole en haut | LFH | |
| 15. longueur de foliole au milieu | LFM | |
| 16. longueur de foliole en bas | LFB | |
| 17. largeur de foliole en haut | lFH | |
| 18. largeur de foliole au milieu | lFM | |
| 19. largeur de foliole en bas | lFB | |
| 20. longueur/largeur de foliole du milieu | L/lFM | |
| 21. densité d’implantation des folioles | DIF | |
| Épine | 22. nombre total des épines | NTE |
| 23. longueur de l’épine en haut | LEH | |
| 24. longueur de l’épine au milieu | LEM | |
| 25. longueur de l’épine en bas | LEB | |
| 26. épaisseur de l’épine en haut | EEH | |
| 27. épaisseur de l’épine au milieu | EEM | |
| 28. épaisseur de l’épine en bas | EEB | |
| 29. densité d’implantation des épines | DIE | |
| Inflorescence | 30. nombre de régimes | NR |
| 31. nombre d’épillets par régime | NPR | |
| 32. nombre de dattes par épillet | NDP | |
| 33. longueur de la spathe | LS | |
| 34. largeur de la spathe | lS |
- • pour l’appareil végétatif, le stipe (trois caractères), la palme (9), les pennes ou folioles (9) et les épines (8) ;
- • pour l’appareil reproducteur, la spathe (deux caractères), le régime (2) et la datte (1).
Les variables de l’appareil reproducteur ne concernent que BFG, S16bis et S35, qui sont entrés en production.
Observations morphologiques
Les études sur l’identification des clones de palmier dattier issus de cultures in vitro n’ont jamais été réalisées jusqu’à maintenant. Certains travaux, qui ont servi de référence à notre recherche, ont concerné des sujets adultes en Californie 〚10〛, d’autres correspondent à des études de phénologie et de pomologie 〚11〛, tandis que les plus récents 〚12, 13〛 présentent différents critères de reconnaissance variétale.
2.2 Analyses des données
Les résultats obtenus pour les caractères morphologiques de l’appareil végétatif et reproducteur ont été traités par analyse en composantes principales (ACP) 〚14, 15〛. Cela permet de visualiser les relations existant entre ces caractères et de voir s’ils peuvent être utilisés comme marqueurs de la variabilité intraclonale des vitroplants. Pour chaque pied, les valeurs en stipe, en palme, en foliole, en épine, en spathe et en régime ont été introduites dans une ACP, en fonction des cultivars étudiés. Ainsi, les matrices sont constituées de 24(BFG), 24(S16B), 24(S35), 11(JHL), 9(BSK) individus et de 34 caractères quantitatifs. De même, une classification hiérarchique a été effectuée pour regrouper les clones homogènes et établir une hiérarchie ou des portions 〚16〛. La métrique utilisée dans notre cas est la distance euclidienne 〚17〛. Par ailleurs, une analyse de variance, à un critère de classification, sur le degré de signification des caractères mesurés a été réalisée par la procédure Anova et t-test. L’Anova a été effectuée sur 23 caractères, alors que le t-test n’a concerné que les caractères du stipe (HS, DS, NGd) et de l’inflorescence (NR, NDP, NPR, LS et lS), dont les mesures sont inférieures à 30 valeurs.
Les différentes analyses ont été effectuées à l’aide des programmes :
- • Excel pour la saisie des données ;
- • SPSS pour l’Anova et le t-test.
- • Stat ITCF pour l’ACP et la classification hiérarchique.
3 Résultats
3.1 Analyse de variance
Les mesures effectuées sur les caractères végétatifs et reproducteurs diffèrent entre les clones au sein de chaque cultivar et saïr étudiés. Les tests Anova et t-test indiquent que tous les caractères diffèrent significativement entre les clones du cultivar S35, alors que seuls 21 caractères (exceptés lFM, LEB), pour les clones BFG, 20 caractères (exceptés LEB, EEB et NGd), pour les clones de S16b, 18 caractères (exceptés LEP, GPH, GPB, LEB et EEB), pour les clones de JHL, et 19 caractères (exceptés LEP, GPH, lMR, LFB et lFB), pour les clones de BSK, diffèrent significativement (Tableaux 3 et 4).
Analyse de variance, de la moyenne des carrés et de la valeur F estimée de 23 caractères morphologiques, relatives à chaque cultivar et saïr, déterminées par l’Anova.
| BFG | S16bis | S35 | JHL | BSK | |||||||||||
| Moyenne des carrés | F observé | Moyenne des carrés | F observé | Moyenne des carrés | F observé | Moyenne des carrés | F observé | Moyenne des carrés | F observé | ||||||
| Caractères | Inter-clones | Intra-clone | Inter-clones | Intra-clone | Inter-clones | Intra-clone | Inter-clones | Intra-clone | Inter-clones | Intra-clone | |||||
| LTP | 1695,980 | 23,236 | 72,989*** | 1476,637 | 34,111 | 43,289*** | 419,157 | 25,528 | 16,420*** | 1197,321 | 59,848 | 20,006*** | 378,815 | 62,593 | 6,052*** |
| LPF | 2552,289 | 39,542 | 64,547*** | 1380,231 | 44,875 | 30,757*** | 3243,128 | 185,958 | 17,440*** | 967,158 | 67,394 | 14,351*** | 1743,176 | 43,778 | 39,819*** |
| LPE | 30,903 | 6,024 | 4,130*** | 24,962 | 6,892 | 3,622*** | 1201,931 | 1290,524 | 0,931* | 13,156 | 3,735 | 3,523 | 18,600 | 4,806 | 3,870 |
| GPH | 30,903 | 6,024 | 5,130*** | 25,191 | 6,559 | 3,841*** | 8,417 | 2,969 | 2,835** | 13,156 | 3,735 | 3,523 | 18,600 | 4,806 | 3,870 |
| GPM | 317,210 | 35,514 | 8,932*** | 120,985 | 24,736 | 4,891*** | 146,461 | 25,014 | 5,855*** | 160,006 | 21,273 | 7,522*** | 203,542 | 23,065 | 8,825*** |
| GPB | 350,728 | 53,483 | 6,558*** | 323,391 | 53,819 | 6,009*** | 258,297 | 43,139 | 5,988*** | 89,438 | 72,977 | 1,226 | 83,58 | 27,889 | 2,997* |
| lMR | 0,121 | 2,778E02 | 4,362*** | 0,245 | 3,750E02 | 6,539*** | 0,126 | 4,042E02 | 3,108*** | 0,106 | 3,061E02 | 3,469* | 2,0883E02 | 3,630E02 | 0,574 |
| l1E | 2,262 | 0,279 | 8,096*** | 3,612 | 0,173 | 20,921*** | 1,580 | 0,107 | 14,739*** | 4,757 | 0,163 | 29,122*** | 2,439 | 0,140 | 17,377*** |
| lBR | 12,488 | 0,938 | 13,352*** | 21,438 | 1,223 | 17,534*** | 16,409 | 1,133 | 14,497*** | 10,797 | 1,368 | 7,895*** | 26,672 | 1,974 | 13,514*** |
| NTF | 152,956 | 2,153 | 71,050*** | 167,099 | 39,389 | 4,242*** | 129,389 | 9,431 | 13,720*** | 115,521 | 3,485 | 33,150*** | 17,537 | 2,741 | 6,399** |
| LFH | 68,119 | 11,006 | 6,189*** | 50,118 | 4,125 | 12,151*** | 49,054 | 6,219 | 7,888*** | 29,584 | 7,698 | 3,843* | 34,576 | 4,899 | 7,057*** |
| LFM | 48,790 | 9,627 | 5,068*** | 85,983 | 11,215 | 7,666*** | 82,472 | 6,675 | 12,355*** | 33,823 | 8,628 | 3,920* | 104,380 | 8,693 | 12,008*** |
| LFB | 217,699 | 39,751 | 5,477*** | 187,125 | 23,550 | 7,946*** | 63,589 | 15,912 | 3,994*** | 118,518 | 22,870 | 5,182** | 3967,673 | 3340,047 | 1,188 |
| lFH | 0,175 | 7,847 × 102 | 2,230** | 0,585 | 5,343 × 102 | 10,942*** | 0,278 | 2,708 × 102 | 10,273*** | 0,293 | 5,273 × 102 | 5,556*** | 0,219 | 9,00 × 10-02 | 2,436* |
| lFM | 6807,448 | 6821,314 | 0,998 | 0,727 | 0,152 | 4,773*** | 0,613 | 9,083 × 102 | 6,744*** | 0,571 | 0,145 | 3,950** | 0,434 | 0,155 | 2,798* |
| lFB | 0,279 | 4,028 × 102 | 6,935*** | 0,308 | 7,806 × 102 | 3,942*** | 0,161 | 6,083 × 102 | 2,642** | 0,194 | 7,545 × 102 | 2,574* | 8,954 × 102 | 4,593 × 102 | 1,950 |
| NTE | 55,507 | 2,306 | 24,075*** | 57,130 | 1,028 | 55,586*** | 8,695 | 0,778 | 11,179*** | 42,139 | 2,879 | 14,638*** | 4,120 | 0,815 | 5,057** |
| LEH | 34,660 | 8,293 | 4,180*** | 28,131 | 14,270 | 1,971* | 39,150 | 9,845 | 3,977*** | 32,755 | 7,519 | 4,356** | 15,832 | 6,735 | 2,351* |
| LEM | 10,471 | 1,390 | 7,543*** | 6,036 | 1,671 | 3,613*** | 10,227 | 2,087 | 4,901*** | 8,523 | 1,808 | 4,713*** | 11,048 | 1,730 | 6,348*** |
| LEB | 0,731 | 0,515 | 1,419 | 0,680 | 0,568 | 1,197 | 0,749 | 0,445 | 1,645* | 0,907 | 0,872 | 1,039 | 2,043 | 0,640 | 3,195** |
| EEH | 5,618 × 102 | 7,222 × 103 | 7,778*** | 5,043 × 102 | 1,167 × 102 | 4,323*** | 3,531 × 102 | 5,139 × 102 | 6,871*** | 6,485 × 102 | 1,485 × 102 | 4,367** | 2,926 × 102 | 1,000 × 102 | 2,926* |
| EEM | 1,884 × 102 | 6,806 × 103 | 2,768*** | 3,070 × 102 | 9,028 × 103 | 3,401*** | 2,377 × 102 | 4,028 × 103 | 5,901*** | 5,491 × 102 | 1,061 × 102 | 5,177*** | 7,370 × 103 | 1,481 × 102 | 4,975** |
| EEB | 1,498 × 102 | 6,528 × 103 | 2,294** | 8,382 × 103 | 5,833 × 103 | 1,437 | 4,928 × 103 | 2,639 × 103 | 1,867* | 5,636 × 103 | 7,789 × 103 | 0,715 | 1,593 × 102 | 5,556 × 103 | 2,867* |
Moyennes et degré de signification des caractères morphologiques du stipe et de l’inflorescence des clones, pour chaque cultivar et saïr, déterminés par le t-test.
| Caractères | BFG | S16bis | S35 | JHL | BSK | |||||
| Moyenne | P* | Moyenne | P* | Moyenne | P* | Moyenne | P* | Moyenne | P* | |
| HS | 93,2708 | < 0,0001 | 105,5833 | < 0,0001 | 103,2708 | < 0,0001 | 85,7727 | < 0,0001 | 85,0556 | < 0,0001 |
| DS | 179,7083 | < 0,0001 | 187,6667 | < 0,0001 | 167,3750 | < 0,0001 | 179,3182 | < 0,0001 | 177,3333 | < 0,0001 |
| NGd | 4,0833 | < 0,001 | 1,5000 | < 0,12 | 2,9167 | < 0,0001 | 8,4545 | < 0,0001 | 8,6667 | < 0,0001 |
| NR | 1,6250 | < 0,004 | 2,7500 | < 0,002 | 3,0417 | < 0,0001 | ||||
| NPR | 59,5311 | < 0,0001 | 66,9850 | < 0,0001 | 51,6287 | < 0,0001 | ||||
| NDP | 6,8444 | < 0,0001 | 5,6250 | < 0,0001 | 21,5100 | < 0,0001 | ||||
| LS | 39,4589 | < 0,0001 | 32,5175 | < 0,0001 | 31,3967 | < 0,0001 | ||||
| LS | 6,7644 | < 0,0001 | 6,3467 | < 0,0001 | 8,6038 | < 0,0001 |
3.2 Analyse factorielle
L’analyse en composante principale (ACP), basée sur 29 caractères morphologiques de l’appareil végétatif et cinq caractères morphologiques de l’appareil reproducteur, montre une divergence des clones au sein de chaque cultivar et saïr (Figs 3 et 4).
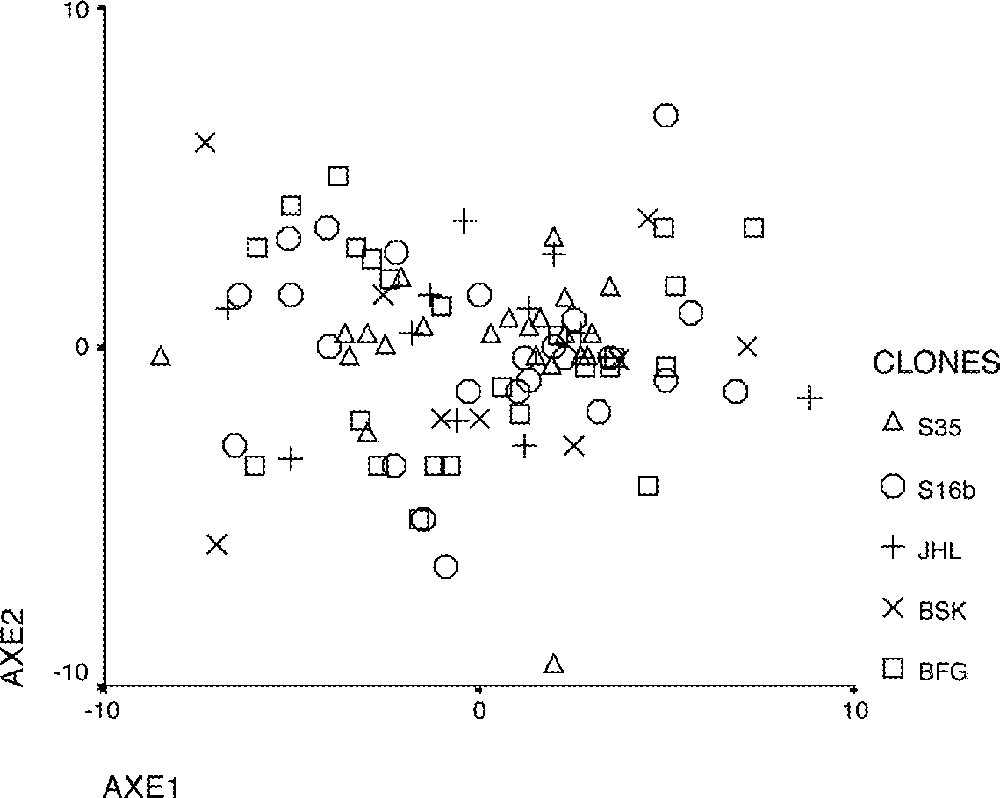
Analyse en composante principale des clones de palmier dattier, issus de trois cultivars et deux saïrs, basée sur 29 caractères morphologiques de l’appareil végétatif. □, BFG ; ×, BSK ; +, JHL ; ○, S16b ; ▵, S35.
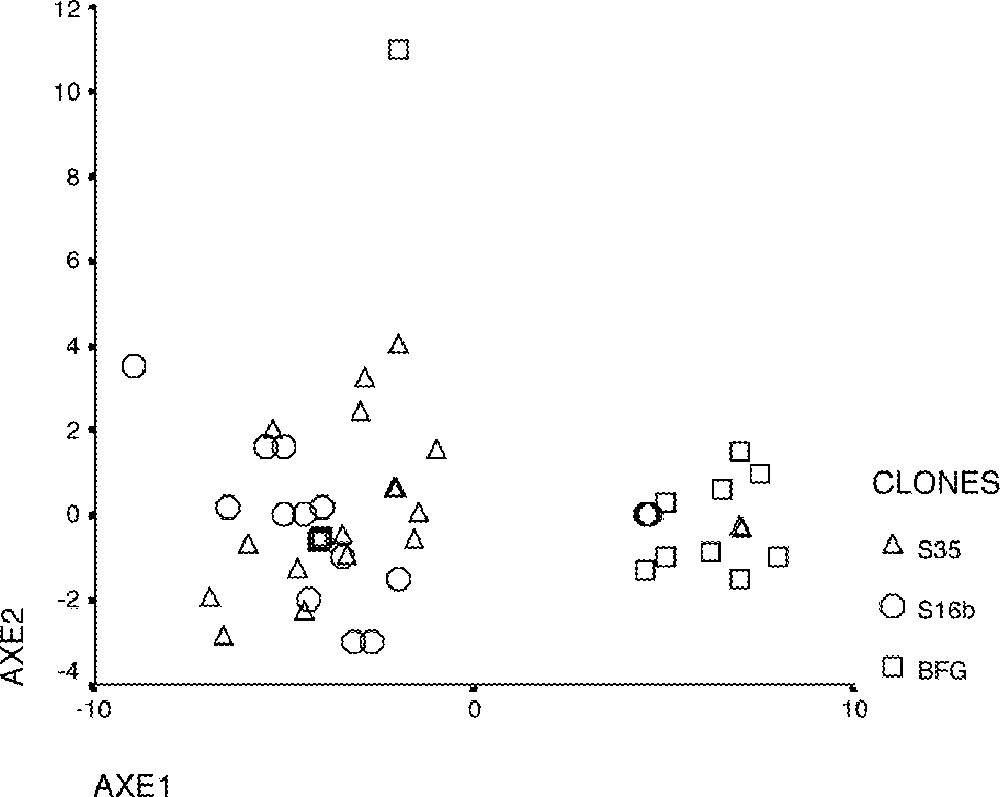
Analyse en composante principale des clones de palmier dattier, issus de deux saïrs et d’ un seul cultivar, basée sur cinq caractères morphologiques de l’appareil reproducteur. ▵, S35 ; ○, S16b ; □, BFG.
3.2.1 Données quantitatives concernant l’appareil végétatif
L’analyse des matrices de corrélations entre les différentes variables de l’appareil végétatif concernant les palmes, stipe, pennes et épines, fait apparaître des variables fortement corrélées (r = 0,9). Toutes les corrélations sont positives entre les variables, sauf pour DIF, DIE, NGd, qui sont corrélées négativement. Ceci pour les clones issus des cultivars (BFG, S16b et S35), alors qu’on note, en plus des trois variables sus-citées, la variable L/lFM pour (JHL) et HS, LEB pour (BSK).
L’ACP effectuée sur les tableaux des données après centrage et réduction montre les variances expliquées par les trois axes et les variables qui ont contribué à leur formation (Tableau 5).
Variances expliquées par les trois premiers axes et regroupement des variables de l’appareil végétatif, contribuant à leur formation.
| Variétés | Axe | % de la variation par rapport à la variation totale | Variables |
| BFG | 1 | 33,1 | LFB–NTE–lFB–GPM–DS–lRB–EEM–EEH |
| 2 | 18,0 | DIE–LTP–LPE–LPF | |
| 3 | 10,6 | –––––––––––––– | |
| S16b | 1 | 34,4 | LTP–LPF–lRM–lRB–DS–LPE–NTF–LFH–HS–LFM |
| 2 | 17,1 | LFB–EEM–DIE–lFM | |
| 3 | 10,2 | –––––––––––––– | |
| S35 | 1 | 31,6 | LTP–LFM–DS–LFB–DIF–HS–l1E |
| 2 | 16,8 | DIE–EEH–lFM–EEM | |
| 3 | 12,8 | LFM–DIF–GPM | |
| JHL | 1 | 49,5 | LTP–LPM–lFM–GPM–lFB–NTE–EEM–EEH–DIF–HS–l1E–lRM–DIE–DS |
| 2 | 15 | LFB–lRB–DIE | |
| 3 | 09,1 | –––––––––––––– | |
| BSK | 1 | 43,8 | l1E–LPF–lRB–EEM–LTP–GPM–LFM–LEH–DIF–EEH–LFB–lFB–GPB |
| 2 | 19,1 | NTF–DIE–LFB–NTE | |
| 3 | 12,9 | HS–lFH |
L’analyse des cercles de corrélation, faite sur les variables suivant les plans formés par l’axe (1–2) et (1–3), montre que, selon l’axe (1), qui contribue à un pourcentage de variance élevé, les variables relatives à la dimension de la palme et du stipe s’opposent à la densité d’implantation des folioles et des épines. Alors que, selon l’axe (2), l’épaisseur de l’épine et la dimension des folioles s’opposent au reste des caractères.
De l’analyse des données brutes, il ressort que les variables végétatives répartissant les clones en des groupes homogènes sont :
- • la hauteur et le diamètre du stipe,
- • le gabarit de la palme au milieu,
- • les longueurs totales de la palme et de la partie foliolée et épineuse,
- • l’épaisseur des épines en haut et au milieu,
- • la longueur et la largeur de la foliole à la base,
- • la densité d’implantation des épines et des folioles.
L’examen des différentes représentations graphiques montre que la variation est importante entre les clones de la même variété et saïr.
3.2.2 Données quantitatives concernant l’appareil reproducteur
Les données quantitatives de l’appareil reproducteur sont celles concernant la spathe le régime et la datte.
Les matrices de corrélation montrent des liaisons élevées entre les variables à r > 0,9 ; les corrélations sont toutes positives.
L’ACP effectuée sur les tableaux des données montre les variances expliquées par les trois axes et les variables qui ont contribué à leur formation (Tableau 6).
Variances expliquées par les trois premiers axes et regroupement des variables de l’appareil reproducteur contribuant à leur formation.
| Variétés | Axe | % de variation par rapport à la variation totale | Variables |
| BFG | 1 | 79,5 | NPR–NDP–LS–lS |
| 2 | 18,2 | NR | |
| 3 | 01 | –––––––––––––– | |
| S16b | 1 | 88,6 | NPR–NDP–LS–lS–NR |
| 2 | 06,2 | –––––––––––––– | |
| 3 | 02,3 | –––––––––––––– | |
| S35 | 1 | 85,5 | NPR–NDP–LS–lS–NR |
| 2 | 07,9 | –––––––––––––– | |
| 3 | 03,8 | –––––––––––––– |
La forte corrélation entre les variables relatives à l’appareil reproducteur a entraîné le regroupement de ces variables sur l’axe (1).
L’analyse des cercles de corrélation et les représentations graphiques (1–2) et (1–3) montrent que les clones sont répartis en deux groupes opposés (Tableau 7). Cette opposition est due à la dimension de la spathe et à celle du régime.
Répartition de 24 clones de BFG, S16b et S35 en deux groupes homogènes selon l’axe (1).
| Variété | Clones homogènes | Clones opposés selon l’axe (1) |
| BFG | 2–4–5–7–9–10–17–19–20 | 1–3–6–8–11–12–13–14–15–16–18–21–22–23–24 |
| S16b | 2–3–4–5–9–10–12–14–15–16–19–22 | 1–6–7–8–11–13–17–18–20–21–23–24 |
| S35 | 2–11–14–15–16–20–23–24 | 1–3–4–5–6–7–8–9–10–12–13–17–18–19–21–22 |
À l’issue de l’analyse, il ressort que les cinq caractères :
- • nombre de régimes,
- • longueur de la spathe,
- • largeur de la spathe,
- • nombre d’épillets par régime,
- • nombre de dattes par épillet,
sont discriminants.
3.3 Classification hiérarchique
La classification hiérarchique effectuée sur les données quantitatives concernant l’appareil végétatif et reproducteur est une classification ascendante hiérarchique. D’après l’arbre hiérarchique, les clones homogènes entre eux, pour chaque cultivar et saïr, sont regroupés en classes (Tableaux 8 et 9).
Classes et effectifs de clones homogènes selon la troncature de la hiérarchie de l’appareil végétatif.
| Variétés | Classes | Effectifs | Clones |
| 1 | 3 | 1–4–7 | |
| 2 | 4 | 2–10–12–20 | |
| 3 | 3 | 16–19–22 | |
| BFG | 4 | 5 | 5–8–15–17–23 |
| 5 | 1 | 11 | |
| 6 | 7 | 3–6–9–14–18–21–24 | |
| 7 | 1 | 13 | |
| 1 | 6 | 1–6–9–10–19–21 | |
| 2 | 1 | 3 | |
| 3 | 3 | 2–14–23 | |
| S16b | 4 | 3 | 12–18–24 |
| 5 | 5 | 4–7–15–16–22 | |
| 6 | 5 | 5–8–13–17–20 | |
| 7 | 1 | 11 | |
| 1 | 7 | 1–2–3–6–12–15–21 | |
| 2 | 10 | 4–5–8–10–11–14–17–20–22–23 | |
| 3 | 2 | 7–19 | |
| S35 | 4 | 2 | 9–13 |
| 5 | 1 | 16 | |
| 6 | 1 | 18 | |
| 7 | 1 | 24 | |
| 1 | 2 | 1–11 | |
| 2 | 4 | 4–8–5–7 | |
| JHL | 3 | 2 | 2–9 |
| 4 | 2 | 3–10 | |
| 5 | 1 | 6 | |
| 1 | 1 | 1 | |
| 2 | 5 | 2–5–6–7–8 | |
| BSK | 3 | 1 | 3 |
| 4 | 1 | 4 | |
| 5 | 1 | 9 |
Classes et effectifs de clones homogènes selon la troncature de la hiérarchie de l’appareil reproducteur.
| Variétés | Classes | Effectifs | Clones |
| 1 | 14 | 1–3–6–8–11–12–13–14–15–16–18–21–22–23 | |
| 2 | 1 | 2 | |
| BFG | 3 | 3 | 4–7–10 |
| 4 | 4 | 5–9–17–19–20 | |
| 5 | 1 | 24 | |
| 1 | 12 | 2–3–4–5–9–10–12–14–15–16–19–22 | |
| 2 | 1 | 1 | |
| S16b | 3 | 5 | 6–7–20–21–23 |
| 4 | 2 | 8–24 | |
| 5 | 4 | 11–13–17–18 | |
| 1 | 8 | 2–11–14–15–16–20–23–24 | |
| 2 | 4 | 1–3–6–10 | |
| 3 | 5 | 4–5–7–9–12 | |
| S35 | 4 | 1 | 8 |
| 5 | 2 | 13–22 | |
| 6 | 3 | 17–18–21 | |
| 7 | 1 | 19 |
La troncature de la hiérarchie n’est pas la même au niveau des deux appareils (végétatif et reproducteur). Elle différencie respectivement sept et cinq classes pour BFG et S16b, sept et sept classes pour S35, alors que, pour chacun des deux cultivars JHL et BSK, qui ne sont pas entrés en production, la classification a engendré cinq classes selon les critères concernant l’appareil végétatif.
4 Discussion
Les analyses que nous avons entreprises sur les vitroplants de palmier dattier nous ont permis de révéler une grande hétérogénéité dans les caractères morphologiques des clones. Les variations observées sont importantes et très hautement significatives entre les clones d’un même cultivar ou saïr. Ces résultats confirment le taux de polymorphisme enzymatique élevé, trouvé chez les mêmes cultivars et saïrs 〚18〛.
Certains auteurs écartent quelques caractères, notamment la longueur et l’épaisseur du stipe, parce qu’ils sont tributaires de plusieurs facteurs, tels que l’âge du palmier, le poids de rejet lors de la plantation et l’effet de la sécheresse 〚19, 20〛. Dans notre cas, tous les vitroplants, ayant le même âge, sont cultivés dans les mêmes conditions écologiques et reçoivent le même entretien, dans une station expérimentale.
Cette étude d’identification de clones de palmier dattier issus de culture in vitro semble n’avoir jamais été réalisée. Toutefois, le choix d’un nombre élevé de caractères morphologiques discriminants et stables s’avère indispensable pour s’assurer de la fiabilité de la caractérisation morphologique. Les travaux antérieurs relatifs à la morphologie du palmier dattier se basant sur de simples observations, la discrimination de tel ou tel caractère est établie d’une façon subjective, comme le fait de différencier l’importance des caractères par des termes tels que bon caractère, caractère assez fidèle ou caractère intéressant 〚21〛. Certains auteurs ont énuméré un nombre élevé de critères dont la probabilité d’être discriminants est grande 〚22–24〛. D’autres ont eu recours à des traitements statistiques unidimensionnels et n’ont utilisé qu’un nombre réduit de variables (4 à 15 caractères) 〚25〛.
En considérant tous les caractères quantitatifs étudiés, la discrimination est liée à 12 caractères de l’appareil végétatif :
- • hauteur et diamètre du stipe,
- • gabarit de la palme au milieu,
- • longueur totale de la palme, de la partie foliolée et épineuse,
- • épaisseur des épines en haut et au milieu,
- • longueur et largeur de la foliole à la base,
- • densité d’implantation des épines et des folioles,
et à cinq caractères de l’appareil reproducteur :
- • nombre de régime,
- • longueur de la spathe,
- • largeur de la spathe,
- • nombre d’épillets par régime,
- • nombre de dattes par épillet.
Nos résultats sont en accord avec ceux trouvés pour 26 cultivars de palmier dattier de Zagora, sur la base d’un traitement statistique multidimensionnel 〚13〛. Parmi les caractères de l’appareil reproducteur, deux ont été cités dans des travaux antérieurs, réalisés sur le palmier dattier, il s’agit de la longueur de la spathe 〚21〛 et de la longueur de la spathe et du nombre des épillets 〚13〛. La hiérarchie basée sur les caractères de l’appareil végétatif ne conduit pas forcément à la même hiérarchie que celle faite sur les caractères de l’appareil reproducteur. Cependant, la non-concordance des caractères floraux et végétatifs n’implique pas que la classification soit fausse 〚26〛.
Les variations morphologiques révélées chez les vitroplants de palmier dattier suggèrent l’influence de la technique de culture in vitro utilisée. En effet, plusieurs facteurs, sources de variations somaclonales, sont liés à la technique de culture des tissus de palmier dattier, à savoir, entre autres : la durée de la culture in vitro et, plus précisément, la longueur de la phase non morphogène 〚27, 28〛, les désordres physiologiques dus aux substances de croissance mutagènes 〚29, 30〛 et l’origine de l’explant mis en culture 〚31〛. Ces aspects rentrent dans ce qu’on peut appeler la maîtrise de la technique de culture in vitro du palmier dattier. En effet, aucun acquis dans le domaine de l’amélioration ne pourra être exploité d’une manière stable et définitive sans la parfaite maîtrise de la voie de régénération conforme. Rappelons que la conformité génétique n’est garantie que lorsque le développement provient de méristèmes axillaires, comme en conditions naturelles. La technique de régénération employée ne fait pas intervenir les bourgeons axillaires, mais des bourgeons néoformés à la base de jeunes feuilles de cœurs de rejets. Cette technique peut être sujette à des variations somaclonales à cause du passage par le stade cal 〚32〛. Cependant, la voie des axillaires demeure peu rentable, vu leur nombre restreint sur les rejets. L’utilisation des inflorescences comme source d’explants reste intéressante, des études histologiques ont montré que l’initiation des bourgeons se fait au niveau de la zone méristématique sous-épidermique des pétales 〚30〛. Cette technique serait donc en faveur d’une stabilité génétique des vitroplants.
L’étude des caractères morphologiques et la recherche de descripteurs permettant la caractérisation clonale des vitroplants de palmier dattier constituent des étapes préliminaires nécessaires pour mieux promouvoir le secteur phœnicicole. Les résultats de telles recherches permettraient de vérifier la conformité de plants de palmier dattier obtenus par micropropagation in vitro.
Remerciements
Ce travail a été réalisé en collaboration avec les deux offices régionaux de mise en valeur agricole (ORMVA) de Tafilalet et d’Ouarzazate.
Abridged version
The culture of date palm (Phoenix dactylifera L) has an important impact on the economic and cultural sectors for many populations in southern Morocco. It contributes to the conservation of a fragile ecosystem, threatened by the Bayoud disease (fusariosis caused by Fusarium oxysporum f. sp. albedinis) and drought. Because of the very limited number of offshoots produced by date palm in its entire life span, mass propagation can only be accomplished by the use of in vitro culture. In Morocco, production of date palm vitroplants is accomplished through organogenesis (from primordial leaves surrounding the shoot tip of the young offshoots), which allows a certain varietal authenticity instead of the technique of somatic embryogenesis, which is subject to genetic variations. However, the observation of vitroplants in the field, after 10 years of culture, allowed us to register many morphological abnormalities. The aim of the present work is to estimate the intraclonal variability of date palm vitroplants with the help of morphological markers related to the vegetative and reproductive developments.
The measures made on the vegetative and reproductive characters differ between clones within each cultivar and saïr studied. The ANOVA test and t-test indicate that all characters exhibit significant differences between the clones of the cultivar S35. Only 21 characters (except lFM, LEB) for BFG clones, 20 characters (except LEB, EEB and NGd) for the S16b clones, 18 characters (except LEP, GPH, GPB, LEB and EEB) for JHL clones, and 19 characters (except LEP, GPH, lMR, LFB and lFB) for BSK clones, showed significant differences.
The principal component analysis (PCA) based on 34 morphological characters, the vegetative and reproductive aspects, showed a difference of clones into each cultivar and saïr. The analysis of correlation matrices leads to many strongly correlated variables (r = 0.9). Correlation between variables, projected in the plans formed by the axes (1–2 and 1–3), showed a group forming the majority of these variables on the axis (1), which contributes to a high percentage of variance. Using hierarchical classification, the truncation of the hierarchy has been found to be different at the level of the two character sets (vegetative and breeder). It leads respectively to seven and five classes for BFG and S16b, seven and seven classes for S35, while for each of JHL and BSK cultivars, which were not yet fruit producing, the classification exhibited five classes, according to the vegetative criteria.
The different analyses revealed a high heterogeneity in the morphological characters of date palm clones. The observed variations are important and very highly significant between clones of the same cultivar or saïr. By considering all the studied quantitative characters, the discrimination is bound to 12 and five characters of the vegetative and reproductive criteria, respectively.
The morphological variations revealed in the date palm vitroplants suggest the effect of the technique used. The technique does not use axillary buds, but buds neoformed on the bases of very young leaves. This technique can be subject to somaclonal variations, because of the passage by the callus stage. The use of young inflorescences as source of explants remains interesting. Histological studies showed that the initiation of buds is made at the level of the subepidermic meristematic zones of the petals. So, this technique could lead to a genetic stability of date palm vitroplants. The study of the morphological characters and the search for descriptors allowing the clonal characterisation of date palm vitroplants constitute a preliminary and necessary step to improve the date palm culture. The results of such works should allow early tests of the genetic conformity in date palm plants obtained by in vitro micropropagation techniques.



