Abridged English version
In Algeria, there are numerous arid and semi-arid regions characterized by dry and saline edapho-climatic conditions. Approximately 3.2 million ha are currently threatened by salinity. One priority strategy that could be implemented to develop these areas is to plant species able to tolerate drought and saline soils. The pistachio tree, a woody species classified as fairly tolerant to salinity, could be considered as a valuable candidate.
This study was carried out to assess the effect of sodium chloride (NaCl) on germination and in vitro development of embryonic axes of Pistacia vera L. and the possibility of using this technique for early selection of salinity tolerant clones. Embryos developed from mature seeds were thus isolated and cultured in vitro on basic MS medium containing various sodium chloride concentrations (0–256.6 mM) and placed in a culture room with a light intensity of 40 μmol m−2 s−1, under a 16:8 h (L/D) photoperiod at a temperature of 22 °C.
The in vitro response of the isolated embryos to salt was evaluated according to the following parameters: percentage germination, survival rate, length of aerial parts and roots, and the number of leaves formed per embryo. The biomass of aerial parts and roots was first evaluated by the fresh matter weight and then oven dried at 65 °C for 48 h. The water content (in %) was measured after 1 month of culture.
The results revealed that salt stress did not alter the in vitro germination of pistachio (Pistacia vera L.). The developed embryos showed a high degree of salt tolerance in addition to their high germination capacity. Very high survival rates of 100, 98.3, 88 and 62.9% were recorded in the presence of 42.8, 85.5, 171.1 and 256.6 mM NaCl, respectively.
The plantlet growth rates indicated that salinity had a negative effect on vegetative axis growth in Pistacia vera L. whereas root growth was improved. The mean decrease in the growth of aerial parts was 56.9%. The decrease in vegetative axis growth was accompanied by a decline in foliar organogenesis. The mean leaves number per plantlet ranged from 9.8 leaves for the control to 2.6 leaves for the highest salt concentration.
Concerning biomass production, the presence of NaCl in the culture medium induced a decrease in aerial part fresh and dry weights while it increased these weights in roots.
These findings indicate that Pistacia vera L. behaves like a salt-tolerant plant. In the presence of salt, a pistachio tree has two strategies to reduce the salt stress: (i) it quickly reduces the growth of leaves and aerial parts, thus potentially enabling it to save energy and resources to overcome the salt stress; (ii) it develops its root system, which is an adaptive strategy to ensure survival when exposed to salt stress.
1 Introduction
La salinisation des sols et la sécheresse sont des facteurs limitatifs majeurs de la production agricole dans plusieurs pays méditerranéens. L'Algérie, dont une grande partie des régions agricoles se caractérise par un climat aride et semi aride, est touchée par le processus de salinité. Actuellement, près de 3,2 millions d'hectares sont menacés de salinisation dans ce pays. Parmi les actions à entreprendre en vue de valoriser et de développer ces régions, les plantations à base d'essences végétales adaptées, capables de résister à la sécheresse et de tolérer les sels constituent une priorité. Le pistachier (Pistacia vera L.) est classé parmi les essences ligneuses moyennement tolérantes à la salinité.
Les impacts du sel sur le développement et le rendement des plantes sont nombreux. Chez plusieurs espèces végétales, les dégâts produits par le stress salin se manifestent communément par une séquence de changements morphologiques et physiologiques [1]. Les fortes concentrations salines peuvent affecter les différents stades de développement de la plante [2,3]. Elles entraînent un déséquilibre ionique et une toxicité chez les végétaux, ce qui peut affecter certains processus métaboliques vitaux.
La culture in vitro a pris une importance croissante dans les programmes d'amélioration des plantes pour la sélection de génotypes tolérants à la salinité [4]. Cette technique constitue un test précoce et rapide pour évaluer et caractériser le comportement des espèces végétales face à une contrainte saline [5]. Elle a été utilisée avec succès pour la sélection de clones tolérants la salinité chez l'oranger et le bigaradier [6], l'eucalyptus [7] et le jojoba [8]. Quelques recherches ont été menées afin d'étudier l'effet de la salinité sur la croissance du pistachier fruitier en conditions in vivo [9] cependant, les expériences effectuées dans les conditions in vitro sont très rares [10].
L'objectif de notre recherche est d'étudier l'effet du chlorure de sodium (NaCl) sur le développement in vitro d'axes embryonnaires de Pistacia vera L. pour exploiter cette technique dans la sélection précoce de clones tolérants au sel.
2 Matériel et méthodes
2.1 Matériel végétal et technique de désinfection
Des graines de Pistacia vera L. libérées de leur épicarpe et séchées naturellement ont été récoltées au mois de septembre 2007 au verger d'El Fehoul (Tlemcen – Algérie) puis conservées à la température du laboratoire.
Après élimination des téguments, les graines sont désinfectées par une immersion, sous hotte à flux laminaire, dans l'éthanol 70% (v/v) pendant 1 min, suivi d'un trempage pendant 15 min dans une solution d'hypochlorite de sodium (NaClO à 2,6% de chlore actif) contenant 2 ou 3 gouttes de détergent domestique qui favorise le contact des tissus avec la solution de chlore. Après la désinfection, on élimine les restes de la solution désinfectante au moyen de 3 rinçages successifs de 10 min chacun, avec de l'eau distillée stérile.
2.2 Technique de prélèvement et mise en culture des axes embryonnaires
Les graines désinfectées sont maintenues dans l'eau distillée stérile pendant une nuit pour augmenter l'imbibition des cotylédons et faciliter le prélèvement des axes embryonnaires.
Le prélèvement des embryons se fait stérilement en ouvrant les graines à l'aide de pinces chirurgicales et en détachant l'axe embryonnaire du cotylédon auquel il adhère encore, à l'aide d'un scalpel en veillant à ne pas endommager les embryons. Les axes embryonnaires sont mis en culture sur les différents milieux testés.
2.3 Milieux nutritifs et conditions de culture
Le milieu de culture de base (MS) se compose de sels minéraux de Murashige et Skoog [11], des vitamines B5 de Gamborg et al. [12], de myo-inositol (100 mg/l), d'hydrolysat de caséine (500 mg/l), de 30 g/l de saccharose et différentes concentrations en NaCl (0 ; 42,8 ; 85,5 ; 171,1 et 256,6 mM). Sans aucun régulateur de croissance, ce milieu a été semi solidifié par du Bacto-agar Difco à 4 g/l. Le pH a été ajusté à 5,7 avec KOH 0,1 N avant passage en autoclave à 113 °C pendant 20 min.
Les embryons isolés, cultivés dans des tubes à essai () contenant 15 ml de milieu nutritif, ont été placés dans une chambre de culture où l'intensité lumineuse est de 40 μmol m−2 s−1, sous une photopériode de 16 h par cycle de 24 h. La température autour des tubes a été maintenue à 22 °C.
2.4 Évaluation de la tolérance au stress salin in vitro
Afin d'explorer la réponse des embryons isolés à la salinité en conditions de culture in vitro, des observations et des mesures relatives à la germination et à la croissance des vitroplants ont été réalisées au terme d'un mois de culture. Cette réponse au sel est évaluée grâce aux paramètres suivants : pourcentage de germination, taux de survie, longueur de la partie aérienne et racinaire ainsi que le nombre moyen de feuilles formées par embryon développé. La biomasse, déterminée par type d'organe (racines, parties aériennes), est mesurée par la masse de la matière fraîche (MF), puis sèche (MS) après séchage dans une étuve à 65 °C pendant 48 h. Les pesées ont été effectuées grâce à une balance de précision (Sartorius CP 225 D), et sont exprimées en mg. La teneur en eau, exprimée en % MF () est calculée après 1 mois de culture.
La réduction relative de la masse de matière exprimée en % du témoin, est une indication de la vigueur relative des plantes sous les conditions de stress salin : .
2.5 Analyse des données
Les résultats obtenus ont été traités par analyse de la variance grâce au logiciel Statgraphics et les moyennes significativement différentes ont été séparées par le test de Duncan au seuil de probabilité de 5%.
Sur les tableaux et les figures, chaque moyenne est affectée d'une lettre et les moyennes suivies d'une même lettre ne sont pas significativement différentes.
3 Résultats
3.1 Effet de NaCl sur la germination in vitro et la survie des embryons
Après 1 mois de culture, les résultats obtenus montrent que la salinité n'a pas influencé la germination in vitro des embryons isolés chez le pistachier fruitier (Pistacia vera L.). Tous les axes embryonnaires mis en culture sur les différents milieux testés ont germé durant la première semaine. Cependant, la contrainte saline affecte la survie des embryons germés dont le taux varie entre 100 et 62,9% (Fig. 1).
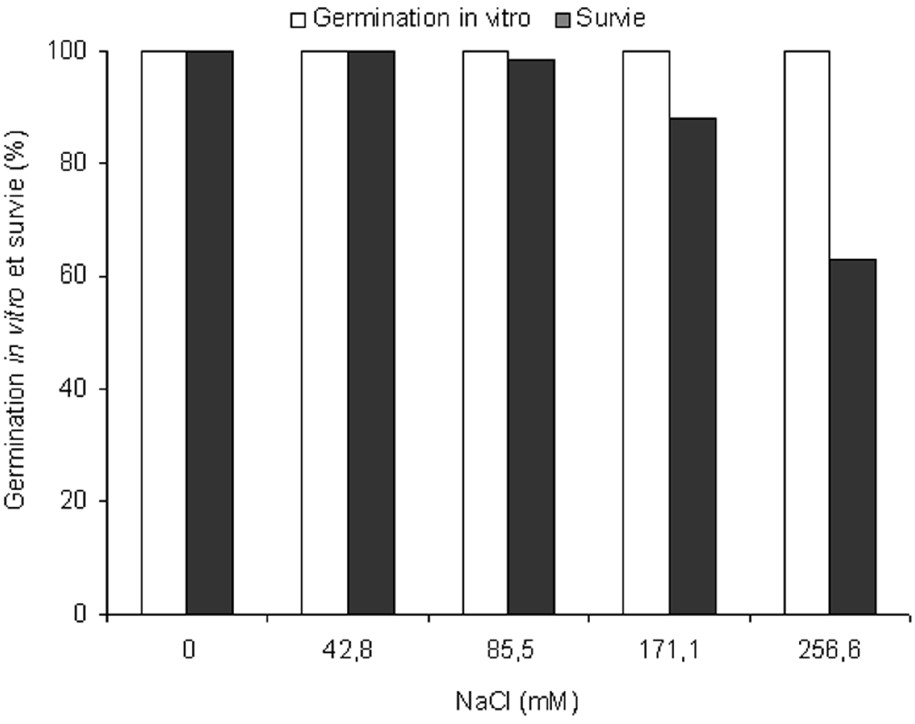
Pourcentages de germination in vitro et de survie des embryons isolés de Pistacia vera L. en fonction de la concentration en sel.
3.2 Effet de NaCl sur la croissance des vitrosemis
La présence de NaCl dans le milieu de culture entraîne, après 30 j de culture, une diminution significative de la longueur de la tige et la production de feuilles par embryon développé. Cette réduction augmente avec la concentration du sel dans le milieu (Fig. 2, A–F). A la fin de l'essai, la longueur moyenne de la tige a été de 4 cm et 1,1 cm respectivement pour le témoin et la concentration la plus élevée de NaCl. La réduction moyenne de la partie aérienne a été de 56,9%. Cependant, le stress salin, à l'exception de la plus forte concentration testée (256,6 mM) améliore de façon significative l'allongement de la radicule qui passe de 3,4 cm pour le témoin à 7,3 cm pour les concentrations de 42,8 et 85,5 mM (Tableau 1).

Variation de la croissance des vitrosemis de Pistacia vera L. sous l'effet de différentes concentrations salines (en mM) : 0 (A) ; 42,8 (B) ; 85,5 (C) ; 171,1 (D) ; 256,6 (E). F : vitrosemis totalement nécrosés en présence de fortes concentrations salines (bar = 1 cm).
Effet de la concentration en NaCl sur les paramètres de croissance, le nombre moyen de feuilles par vitrosemis et le rapport MS racines/MS organes aériens. Les valeurs de la même ligne suivies de la même lettre ne sont pas significativement différentes entre elles au seuil de 5% (N = 40 embryons développés par traitement).
| Paramètres | NaCl (mM) | ||||
| 0 | 42,8 | 85,5 | 171,1 | 256,6 | |
| Longueur de la partie aérienne (cm) | 4,0 ± 0,8 a | 2,6 ± 0,5 b | 1,8 ± 0,4 c | 1,4 ± 0,2 d | 1,1 ± 0,3 e |
| Longueur des racines (cm) | 3,4 ± 2,0 c | 7,3 ± 1,8 a | 7,3 ± 1,9 a | 4,8 ± 1,7 b | 2,2 ± 0,8 d |
| Nombre moyen de feuilles/vitrosemis | 9,8 ± 1,2 a | 8,4 ± 1,2 b | 7,1 ± 1,1 c | 4,8 ± 1,6 d | 2,6 ± 1,1 e |
| MS racines/MS organes aériens (mg) | 0,4 ± 0,1 d | 0,5 ± 0,1 c | 0,7 ± 0,2 b | 0,8 ± 0,3 a | 0,8 ± 0,3 a |
La diminution de la croissance de l'appareil végétatif est accompagnée d'une réduction de l'organogenèse foliaire. En effet, le nombre moyen de feuilles par vitrosemis varie entre 9,8 pour le témoin et 2,6 feuilles pour la concentration la plus élevée (Tableau 1).
Au niveau de la production des biomasses aériennes et racinaires, l'analyse statistique a révélé un effet significatif du sel (). Ainsi, les concentrations élevées du NaCl entraînent une diminution du poids sec des organes aériens (Fig. 3) alors qu'elles améliorent celui des racines (Fig. 4). Le rapport de la matière sèche des racines/parties aériennes augmente avec la concentration saline en raison de l'inhibition de la croissance des organes aériens. Il passe de 0,4 pour le témoin à 0,8 pour le milieu le plus concentré en NaCl (Tableau 1).
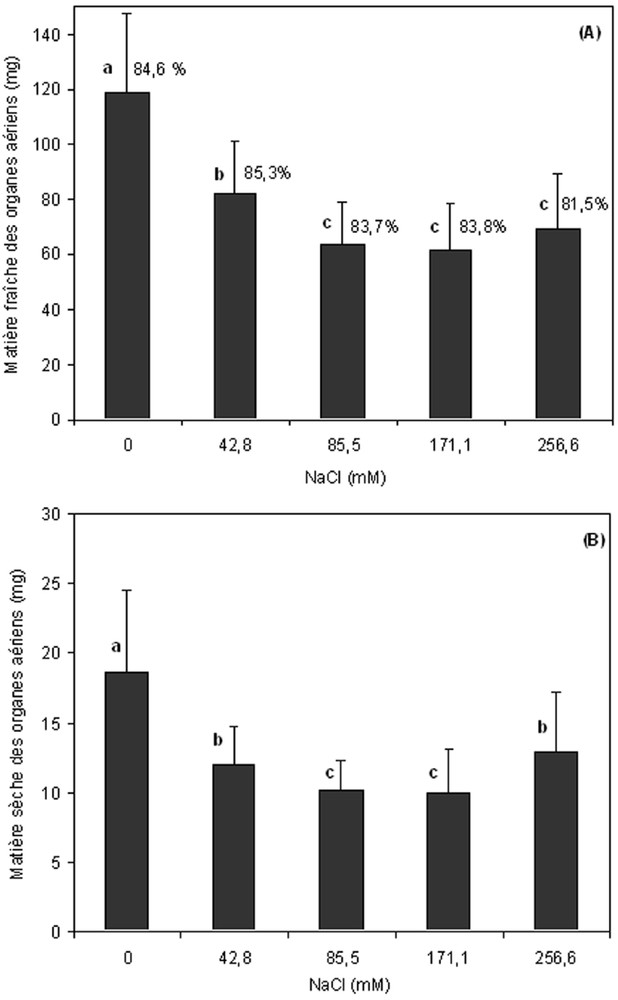
Effet de la concentration en NaCl sur la biomasse aérienne (A : matière fraîche, B : matière sèche) des vitrosemis de Pistacia vera L. après un mois de culture sur MS0. Les valeurs sur les histogrammes correspondent aux teneurs en eau, exprimées en % de la matière fraîche. Les valeurs suivies de la même lettre ne sont pas significativement différentes (N = 40 embryons développés par traitement).

Effet de la concentration en NaCl sur la biomasse du système racinaire (A : matière fraîche, B : matière sèche) des vitrosemis de Pistacia vera L. après un mois de culture sur MS0. Les valeurs sur les histogrammes correspondent aux teneurs en eau, exprimées en % de la matière fraîche. Les valeurs suivies de la même lettre ne sont pas significativement différentes (N = 40 embryons développés par traitement).
En ce qui concerne la turgescence des organes, les différentes concentrations saline testées n'ont eu aucun effet sur l'état d'hydratation des vitrosemis qui est resté presque identique (84% de la matière fraîche en moyenne) pour les différentes doses de NaCl et les différents organes.
4 Discussion
Les résultats obtenus ont montré qu'une contrainte saline n'a pas affecté la germination in vitro chez le pistachier fruitier (Pistacia vera L.). Pour l'ensemble des traitements appliqués, le pourcentage final de germination a été de 100%. Des résultats similaires ont été obtenus chez la même espèce en condition in vivo [9]. Ainsi, la présence du sel peut améliorer la germination chez certaines plantes, c'est le cas de mil : le taux de germination passe de 89,3% pour les témoins à 100% pour les semences stressées à 69 mM (4 g/l) [13].
L'émergence de plantules en milieu salé chez d'autres espèces végétales est inhibée [14,15]. Chez Atriplex halimus L., la vitesse de germination est ralentie à partir de 172,4 mM (10 g/l) de NaCl et davantage inhibée à des concentrations plus élevées [16].
La tolérance au sel s'exprime habituellement en termes de croissance, de rendement ou de survie. Nos résultats obtenus montrent une tolérance au sel chez le pistachier fruitier. En effet, des taux de survie plus élevés ont été enregistré : 100 ; 98,3 ; 88 et 62,9% obtenus respectivement en présence de 42,8 ; 85,5 ; 171,1 et 256,6 mM NaCl. Ces résultats sont en accord avec ceux de Chelli et al. [10]. Ces auteurs signalent que les taux de survie ont dépassé 94% à 131 mM NaCl et étaient de 74,2% à 158 mM et 77,1% à 240 mM respectivement pour Pistacia vera et Pistacia atlantica. La mortalité des espèces végétales en milieu salin est le résultat d'une perturbation de l'alimentation hydrique et d'une inhibition du métabolisme [17].
Le résultat de la croissance des vitrosemis, indique que la salinité a affecté négativement la croissance de l'appareil végétatif de Pistacia vera L. comparativement à celle des racines. Des effets similaires ont été remarqués sur la croissance des plantules de pistachier soumises à un stress salin en conditions in vivo [9]. Les mêmes résultats ont aussi été obtenus chez d'autres plantes : trèfle [18], agrumes [19], sétaire [20]. Cette diminution de la croissance est le résultat au niveau cellulaire d'une baisse du nombre de divisions cellulaires lors des stress abiotiques (stress salin et hydrique). La réduction de la croissance aérienne observée au niveau des vitrosemis peut s'expliquer par des perturbations des taux de certains régulateurs de croissance, notamment l'acide abscissique et les cytokinines induites par le sel [21,22]. De même, Liu et al. [23] ont rapporté qu'une baisse de la quantité de cytokinines a été enregistrée chez Pinus sylvestris, Pinus koraiensis et Abies holophylla soumis à un stress salin.
Concernant la production des biomasses, l'analyse statistique a révélé un effet significatif du stress salin. Ainsi, la présence de NaCl dans le milieu de culture provoque une réduction des poids frais et sec des parties aériennes alors qu'il améliore ceux des racines. Selon Zhu [24], la réduction de croissance de l'appareil végétatif aérien est une capacité adaptative nécessaire à la survie des plantes exposées à un stress abiotique. En effet, ce retard de développement permet à la plante d'accumuler de l'énergie et des ressources pour combattre le stress avant que le déséquilibre entre l'intérieur et l'extérieur de l'organisme n'augmente jusqu'à un seuil où les dommages sont irréversibles.
D'un autre coté, la présence du sel dans le milieu de culture a conduit à une stimulation de la production de la matière fraîche et sèche des racines du pistachier. Une réponse analogue a été signalée chez d'autres plantes tolérantes au sel [13,25–27]. Ces plantes protègent leurs organes aériens contre l'envahissement des ions toxiques (Na+ et Cl−) par une rétention de ceux-ci dans les racines [28]. D'autre part, Bouraoui et al. [29] montrent que la demande énergétique de la croissance des racines chez le triticale est augmentée en milieu salé. Ils précisent que le passage des cellules du stade de division au stade d'élongation s'accompagne d'une modification du métabolisme respiratoire. Le maintien de l'élongation racinaire et la stimulation de la respiration sur milieu salé correspondent à l'un des facteurs de tolérance à la salinité.
Du point de vue de la turgescence des organes, on remarque que la teneur en eau des plantules n'est pas modifiée. Les différentes concentrations de NaCl appliquées n'ont eu aucun effet sur l'état d'hydratation des vitrosemis qui est resté comparable (84% de la matière fraîche en moyenne) pour les différents traitements et organes. Les espèces végétales tolérantes absorbent de grandes quantités d'ions tout en maintenant la turgescence cellulaire et en évitant leur toxicité grâce à un compartimentage cellulaire et l'accumulation dans les vacuoles. L'équilibre osmotique du cytoplasme est alors assuré par une synthèse active de composés organiques solubles [30]. Chez les Citrus, les cultivars les plus résistants au stress salin sont ceux qui limitent le plus efficacement possible l'accumulation des sels dans leur feuilles [31,32].
5 Conclusion
Au stade juvénile, le pistachier fruitier se comporte comme une plante tolérante à la salinité. Outre leur capacité germinative élevée, les embryons isolés de Pistacia vera L. ont montré une grande résistance vis-à-vis du sel. Le taux de mortalité le plus élevé (37,1%) a été enregistré avec la plus forte concentration saline testée (256,6 mM).
En réponse au sel, le pistachier réduit rapidement son expansion foliaire et sa croissance aérienne et tend à maintenir le développement de son système racinaire.
L'utilisation des axes embryonnaires pour évaluer la tolérance au sel a montré, dès le départ, des taux de développement in vitro élevés, même sous stress sévère, indiquant que le taux de développement pourrait être retenu comme critère précoce d'évaluation de la tolérance au sel chez Pistacia vera L. Ainsi, la stimulation de la croissance racinaire en présence de NaCl semble une stratégie développée par le pistachier pour limiter le stress salin. De plus, la réduction de la croissance de l'appareil photosynthétique est un indice de la résistance au sel [33]. La sélection de vitroplants tolérants à la salinité par le biais de la culture in vitro peut contribuer à obtenir des clones homogènes et tolérants à la salinité.
Remerciements
Ce travail a bénéficié du soutien financier du Ministère de l'enseignement supérieur et de la recherche scientifique (Algérie), de l'Ambassade de France à Alger et du CNOUS (Centre national des œuvres universitaires et scolaires – Paris).


