Lors de la séance du 5 février 2001, commune à l'Académie d'agriculture et à l'Académie des sciences, sur le thème : « Agents pathogènes des plantes : découverte, pathogénie, problèmes de société », on a vu que les plantes peuvent être agressées par divers types de micro-organismes pathogènes : champignons, bactéries et mycoplasmes, virus et viroı̈des [1–8]. De plus, dans le cadre de l'interaction incompatible, les plantes développent, face aux micro-organismes, une stratégie complexe et efficace [9,10] :
- • renforcement des barrières mécaniques naturelles, qui peut notamment se traduire par des dépôts surnuméraires de callose ou de lignine ;
- • biosynthèse de phytoalexines et de protéines de défense, parmi lesquelles des enzymes antimicrobiennes ;
- • mort programmée des cellules au niveau de la zone d'infection, accompagnée d'une résistance locale acquise, ce qui assure le confinement du micro-organisme au sein d'un environnement hostile ;
- • résistance systémique acquise, qui permet à la plante d'être encore plus performante en cas de nouvelle agression.
Les plantes doivent aussi faire face à d'autres assaillants, par exemple des mollusques, des nématodes, des acariens et des insectes, ces derniers pouvant être notamment broyeurs ou piqueurs. À cet égard, les pucerons qui plantent leurs stylets dans les tubes criblés du phloème sont considérés comme l'un des principaux groupes de ravageurs au plan mondial. Leur effet n'est pas lié uniquement au prélèvement de sève libérienne. D'une part, ils peuvent provoquer des toxicoses. C'est en particulier le cas de Therioaphis macculata, qui est l'un des principaux ravageurs de la luzerne aux États-Unis (Fig. 1), d'où le travail des sélectionneurs, qui a permis d'introduire des variétés de luzerne résistantes. D'autre part, ils peuvent induire la formation de galles sur les organes aériens et, dans le cas d'une attaque de phylloxéra sur vigne européenne, de « tubérosités » et de « nodosités » racinaires, qui pourrissent. Enfin, et surtout, ce sont les vecteurs d'un grand nombre de maladies à virus. Leur statut de ravageur majeur va sans doute perdurer : d'une part, comme d'autres insectes, ils peuvent développer des résistances vis-à-vis des insecticides ; d'autre part, les traitements insecticides présentent bien souvent l'inconvénient de raréfier leurs prédateurs naturels.

Therioaphis macculata sur une feuille de luzerne. Noter la perte de chlorophylle le long des nervures. Il suffit d'une infestation modérée pour provoquer la mort de la plante (photo aimablement fournie par Serge Carré, Inra de Lusignan, Vienne, France).
Divers exemples montrent que les plantes développent des défenses sophistiquées pour faire face aux insectes. Ainsi, lorsque les feuilles de cotonnier sont attaquées par des larves de Spodoptera exigua Hübner, elles libèrent dans l'environnement des substances volatiles [11]. Il s'agit de l'indole, de terpènes (monoterpènes, sesquiterpènes, homoterpènes) et de petites molécules (hexenals, hexenols, acétate d'hexényle) provenant du clivage de l'acide linolénique. Ces substances volatiles se comportent comme des signaux guidant des hyménoptères parasites vers les chenilles de S. exigua, dans lesquelles ils pondent leurs œufs. La production de ces substances est provoquée par des éliciteurs présents dans la salive du lépidoptère, tout particulièrement la volicitine. Notons que la volicitine est un conjugué formé par la chenille résultant de l'addition de glutamine (et d'un groupement hydroxyle) à l'acide linolénique provenant de l'hôte. Par conséquent, l'impact de l'acide linolénique est complexe : d'une part, il compte parmi les nutriments essentiels à de nombreuses larves de lépidoptères, mais, d'autre part, il contribue à limiter leur nombre.
De nombreuses plantes répondent également à l'attaque des herbivores, en activant des gènes de défense, dont les produits inhibent les protéases digestives de l'agresseur. Ce mécanisme a été étudié de façon détaillée par Ryan et ses collaborateurs [12–14] chez les solanacées, la tomate notamment. Le signal libéré au niveau de la blessure est un petit polypeptide de 18 acides aminés, nommé systémine. Celle-ci provient de l'hydrolyse partielle d'un précurseur, la prosystémine, qui comporte 200 acides aminés chez la tomate. La systémine, très mobile dans la plante et active à des concentrations extrêmement faibles, est considérée par Ryan [13] comme la première hormone peptidique identifiée chez les plantes. La reconnaissance du peptide signal par un récepteur est à l'origine d'une vaste cascade d'événements (Fig. 2) :
- • « décompartimentation » quasi immédiate de l'ion Ca2+ et dépolarisation du potentiel transmembranaire ;
- • activation d'une phospholipase et libération de l'acide linolénique à partir des membranes de l'hôte ;
- • synthèse d'acide jasmonique, un analogue structural des prostaglandines ;
- • activation de gènes codants pour des produits de la voie de signalisation, parmi lesquels la prosystémine et le récepteur de la systémine, des enzymes de la voie de synthèse de l'acide jasmonique, une NADPH oxydase et une polygalacturonase, qui va libérer des oligogalacturonides ;
- • enfin, activation, quelques heures après l'attaque de l'herbivore, de gènes codants pour des inhibiteurs de protéinases et une polyphénol oxydase, c'est-à-dire des produits qui vont exercer un effet dissuasif.
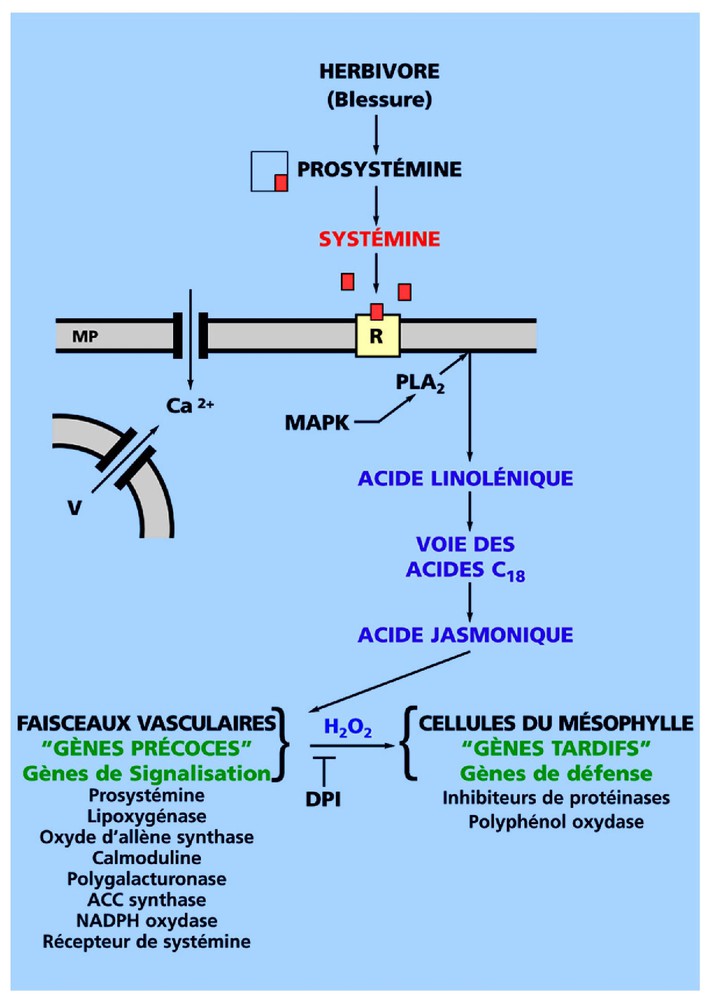
Réponse des tissus foliaires de tomate endommagés par un insecte herbivore, avec les principales étapes étudiées de la cascade de signalisation. L'interaction de la systémine avec son récepteur induit une cascade complexe d'événements, en premier lieu une « décompartimentation » de divers ions (Ca2+, H+, K+) et l'activation d'une MAP kinase. Le niveau des jasmonates commence à s'élever 15 min environ après l'attaque de l'herbivore. Les messagers des gènes précoces commencent à s'accumuler 30 min environ après l'attaque et les messagers des gènes de défense quelques heures plus tard. Le peroxyde d'hydrogène généré dans les tissus vasculaires est un signal systémique induisant l'activation des gènes de défense dans le mésophylle. DPI, chlorure de diphénylène iodonium ; MAPK, MAP kinase ; MP, membrane plasmique ; PLA2, phospholipase A2 ; R, récepteur de la systémine ; V, vacuole (d'après Ryan [13] et Orozco-Cárdenas et al. [14]).
Notons que, si les tissus sont traités avec le chlorure de diphénylène iodonium (DPI), un inhibiteur des NADPH oxydases, on constate que cette substance n'affecte pas l'expression de gènes précoces, comme ceux codants pour la prosystémine ou les enzymes de la voie de synthèse des jasmonates, mais bloque à la fois la production de H2O2 et l'expression des gènes tardifs de défense. Cela suggère que H2O2 est un messager secondaire, intervenant tardivement dans la voie de signalisation [14] (Fig. 2).
La confrontation de la plante cultivée avec ses ennemis n'est pas toujours aussi heureuse : ainsi, dans le cadre d'une relation compatible entre celle-ci et un micro-organisme pathogène, la maladie s'installe ; l'attaque par des herbivores peut également lui être fatale. Durant la première moitié du siècle dernier, l'issue des cultures était encore très incertaine. Les céréales, par exemple, étaient confrontées, non seulement aux mauvaises herbes, mais aussi à diverses maladies fongiques (caries, ergots, charbons et rouilles). En ce qui concerne la pomme de terre, les ravages causés par les doryphores avant et pendant la seconde guerre mondiale sont restés dans les mémoires. On préconisait notamment un ramassage manuel, une méthode également recommandée pour lutter contre les vers blancs. Les dégâts causés par ces derniers avaient été estimés, en 1947, à 30 milliards de francs de l'époque. Ces quelques exemples permettent d'avoir une idée du progrès considérable amené par le développement des produits phytosanitaires, dans le domaine de la protection des récoltes, au cours de la seconde moitié du XXe siècle.
Ceux-ci comprennent les herbicides, les fongicides, les insecticides–acaricides, les nématicides, les rodonticides, les taupicides, les corvifuges et corvicides, les molluscicides, les répulsifs, les substances de croissance et les divers. En fait, les trois premières classes représentent plus de 90 % du marché mondial ; par conséquent, les autres classes sont souvent regroupées parmi les « produits divers ». Le Tableau 1 fait apparaı̂tre quelques familles de fongicides, d'herbicides et d'insecticides–acaricides ayant joué ou jouant actuellement un rôle important dans la protection des plantes cultivées. On trouvera les informations essentielles sur les principales familles de phytosanitaires ainsi que sur leurs mécanismes d'action dans trois articles de synthèse récents [15–17].
Quelques grandes familles de produits phytosanitaires
| Fongicides | Herbicides | Insecticides–acaricides |
| Sulfate de cuivre, soufre (fin XIXe siècle) | Hormones (1942) | Arsénicaux (avant 1940) |
| Dithiocarbamates (1950) | Dérivés de l'urée (1951) | Organochlorés (1939) |
| Phtalimides (1952) | Carbamates (1954) | Organophosphorés (1947) |
| Benzimidazoles (1967) | Di- & triazines (1956) | Carbamates (1956) |
| Triazoles, imidazoles, morpholines (IBS) (1972) | Aminophosphonates (1971) | Benzoyl-urées (1972) |
| Strobilurines (1992) | Sulfonylurées (1977) | Pyrethrinoı̈des (1973) |
La plupart des produits utilisés pour la protection des cultures sont issus de la méthode de synthèse en aveugle avec son cortège de tests. Cette démarche a fourni un certain nombre de molécules ayant des propriétés inattendues, mais remarquables. Ainsi, le diflubenzuron, qui résulte de l'addition d'analogues de deux molécules herbicides (le diuron et le dichlobénil) est un insecticide, plus précisément le premier insecticide larvicide commercialisé ; il offre l'intérêt d'être sans danger pour la faune auxiliaire (oiseaux, gibiers) et les abeilles. Le phoséthyl-Al (ou foséthyl-Al) a été initialement testé comme antitranspirant, avant que l'on n'observe que les parcelles de vigne traitées étaient exemptes de mildiou et que l'on ne découvre par la suite que son mode d'action (plus exactement celui de son métabolite actif, le phosphonate) était totalement différent des fongicides commercialisés jusqu'alors ; il s'agit du premier activateur systémique des réactions de défense [18,19] mis sur le marché. Le glyphosate a été synthétisé dans le cadre de recherches sur des régulateurs de la synthèse de saccharose chez la canne à sucre, avant de devenir l'herbicide le plus vendu dans le monde ; il est, par ailleurs, le premier représentant du groupe des herbicides inhibiteurs de la synthèse d'acides aminés, la cible étant, dans son cas, la 5-énolpyruvyl-shikimate-3-phosphate synthétase.
D'autres produits, en revanche, sont des analogues de métabolites d'organismes divers (plantes supérieures, champignons, bactéries, batraciens). L'amélioration par les chimistes de molécules naturelles ayant des propriétés biologiques intéressantes est une démarche actuellement privilégiée dans le domaine de la protection phytosanitaire des plantes cultivées. Cependant, elle a été initiée très tôt, avec la synthèse des premiers herbicides auxiniques durant la seconde guerre mondiale [20,21]. Ceux-ci ont permis de faire franchir un pas décisif à la protection des céréales vis-à-vis des dicotylédones. Paradoxalement, les bases cellulaires de leur phytotoxicité n'ont pas été claires pendant des décennies. Il a été montré récemment que les gènes codants pour l'acide 1-aminocyclopropane-1-carboxylique synthase (ACC synthase) sont induits dans les minutes qui suivent l'addition d'un herbicide auxinique, d'où une élévation importante, dans les deux heures qui suivent, du niveau de l'ACC et une surproduction d'éthylène et de HCN, ce dernier étant formé à des concentrations physiologiquement toxiques [22,23] (Fig. 3). Par la suite, le niveau de l'acide abscissique s'accroı̂t considérablement et les données obtenues à l'aide de divers outils (mutants déficients en ABA, inhibiteurs de synthèse) suggèrent que l'éthylène interagit positivement avec la voie de biosynthèse de l'ABA, la cible la plus probable étant la 9-cis-époxycaroténoı̈de dioxygénase. L'ABA entraı̂ne la fermeture des stomates, inhibe la croissance et, de concert avec l'éthylène, induit la sénescence des tissus foliaires non encore nécrosés (Fig. 3). Ce mécanisme concerne également les herbicides auxiniques récents (les acides quinoléine carboxyliques). Toujours dans le domaine des herbicides, l'intérêt se porte actuellement sur les callistémones (mésotrione, sulcotrione) [24], qui sont des analogues d'une molécule (la leptospermone) produite par Callistemon citrinus (Myrtacées), un arbuste originaire d'Australie, sous lequel aucune herbe ne pousse.

Mécanismes de l'effet des herbicides auxiniques (voir texte pour le détail). L'acide indole-3-acétique peut induire sensiblement les mêmes réponses lorsqu'il est fourni à des concentrations excessives. AIA, acide indole-3-acétique ; ACC, acide 1-aminocyclopropane-1-carboxylique ; SAM, S-adénosylméthionine ; Xan, xanthoxine (d'après Hansen et Grossmann [22] et Grosmann [23]). Il est par ailleurs possible que les herbicides auxiniques agissent directement sur l'intégralité structurale et fonctionnelle des membranes dans les zones de forte accumulation.
En ce qui concerne les insecticides, on connaı̂t le succès considérable des pyréthrinoı̈des, qui sont des analogues, puissants et relativement stables, des pyréthrines présentes dans les fleurs de pyrèthres, des plantes apparentées à nos chrysanthèmes. Une autre famille émerge actuellement : celle des néonicotinoı̈des. Du côté des fongicides, une nouvelle famille d'analogues retient tout particulièrement l'attention : il s'agit des strobilurines [16]. Tous ces produits présentent l'intérêt d'être efficaces à doses relativement faibles et d'être apparemment très peu toxiques pour les mammifères dans des conditions normales d'utilisation. Ainsi, en ce qui concerne les insecticides, la DL 50 sur rat (voie orale, ) est passée d'environ 10 pour certains organophosphorés à quelques centaines pour les pyréthrinoı̈des, ces dernières molécules étant utilisées à des doses de quelques grammes par hectare. Toutefois, leur sélectivité peut avoir des limites. Ainsi les pyréthrinoı̈des, comme d'ailleurs les pyréthrines, sont redoutables pour les poissons.
L'arsenal phytosanitaire à usage agricole est en constant renouvellement [15–17]. De nouvelles molécules remplacent les plus anciennes, moins performantes en termes d'efficacité biologique ou de respect de l'environnement ainsi que de la santé de l'utilisateur et du consommateur. Cette amélioration ne doit pas masquer (i) les coûts et les contraintes de l'utilisation des produits phytosanitaires, (ii) le problème des résistances et (iii) les conséquences des déséquilibres crées (par exemple, l'élimination d'une catégorie de parasites peut être suivie de l'installation d'une autre catégorie d'ennemis des plantes cultivées). Par ailleurs, les produits dont on dispose ne permettent pas de lutter contre divers parasites, qui génèrent de véritables fléaux. Ceci est lié à la nature de l'agent pathogène, à sa localisation dans la plante ainsi qu'aux dimensions de celle-ci. On peut citer le viroı̈de du cadang-cadang, qui a pratiquement anéanti la production de noix de coco aux Philippines, ou encore l'agent du bayoud (Fusarium oxysporium f. sp. albedinis), qui a détruit les deux tiers des palmiers dattiers au Maroc et une bonne partie de ceux d'Algérie. Compte tenu de ces divers constats, il a été fort sage de poursuivre ou d'initier d'autres approches [25,26], afin d'éviter le tout phytosanitaire et, à terme, de réduire l'usage, aujourd'hui excessif, des pesticides.
Dans ce contexte, et suite aux exposés du 5 février 2001, la présente séance mettra l'accent : (i) sur les cibles cellulaires des principaux fongicides, sur les mécanismes des résistances ainsi que sur des molécules stimulant les réactions de défense de la plante, (ii) sur les bases moléculaires des mécanismes de défense de la plante avec, comme prolongement, la stratégie de lutte génétique contre les pathogènes, (iii) sur les stratégies de protection intégrée des cultures permettant de concilier impératifs économiques, qualité des aliments et respect de l'environnement et (iv) sur les actions développées par le ministère de l'Agriculture dans le cadre de la protection des consommateurs et de la qualité des productions.



