Abridged English version
Lipid membrane abnormalities have been evi- denced in numerous organs and tissues, in hypertensive patients as well as in animal models. Polyunsaturated fatty acids (PUFA), major constituents of membrane phospholipids, are involved in membrane biological properties and cellular functions. Hypertension has a deleterious effect on cellular fatty acid composition and functions of Spontaneously Hypertensive Rats (SHR). Hence, essential fatty acids, linoleic (18:2n−6) and α-linolenic (18:3n−3) acids are implied in the regulation of functions associated with cellular membranes. The PUFA composition of the diet may influence the fatty acid composition of brain neonates, especially during the in utero and after-birth phases. Related to the homeostasis of PUFA, their deficiency may alter the learning ability.
We have investigated the total lipid fatty acid composition of brain hemispheres during the onset of hypertension in male SHR, which also correlates with rapid post-birth nervous system development and maturation, accompanied by noticeable demand for PUFA preformed via transfer from the mother during pregnancy and food supply – maternal milk – after birth, the in situ capability of PUFA synthesis in the newborn brain being limited. Milk lipid composition is not stable, varying from one mother to another, under the influence of environment, nutrition and genome. As the milk fatty acid composition of female SHR may be different from that of their normotensive controls, Wistar Kyoto rats (WKY), adoptive female Wistar rats were used so as to suppress any difference linked to the strain.
We observed no difference in the fatty acid composition between the right and left hemispheres of WKY, whatever the age, 10 or 30 days. The oleic acid (18:1n−9), docosapentaenoic acid (22:5n−3) and docosahexaenoic acid (22:6n−3) levels of the left hemispheres of the 10-day-old SHR were lower than those of the right hemispheres, in which the 20:2n−6, arachidonic acid (20:4n−6), 22:4n−6 and 22:5n−6 contents were higher. Most of these changes disappeared at the age of 30 days. When comparing the left hemispheres, we evidenced higher total n−6 (higher 18:2n−6, 20:4n−6 and 22:4n−6) and lower total n−3 fatty acids in the 10-day-old SHR than WKY, confirmed for the right hemispheres. Most of these differences were not observed in the 30-day-old rats.
The use of male rats ruled out any gender difference. If, at the two age steps studied, high blood pressure is still unknown, the SHR low body weights and glycaemia were symptoms of the onset of the pathology, explained by low tissue insulin sensitivity, because of failing hormone receptors. WKY brain development is characterized by similar total lipid fatty acid composition in the two hemispheres. Based on our results, no definitive conclusions can be drawn on the influence of hypertension onset on total lipid fatty acid composition of SHR pups. It can however be suggested that a few days after birth the fatty acid composition of SHR brain hemispheres was different, despite the fact that SHR pups received the same diet through suckling by adoptive Wistar mothers, free of any known genetic pathology. However, we cannot exclude that such differences may be due to an embryonic development disturbed by major disorders of the lipidic check-up in SHR mothers, originating from high blood pressure. Moreover, even restricted and insufficient, with regard to the needs of growing organism, the in situ PUFA biosynthesis capability of the brain may influence the fatty acid composition. As these differences are lower in the 30-day-old SHR, this seems to support the hypothesis of a prenatal origin of such altered fatty acid composition. Suckling by adoptive female Wistar rats for 20 days, followed by a balanced diet after weaning, are favourable factors for optimal development, which cannot be neglected in the interpretation of the fatty acid compositions.
1 Introduction
L'hypertension artérielle (HTA) est une maladie dont les symptômes initiaux sont souvent frustres. Les accidents vasculaires cérébraux constituent la complication majeure de l'HTA, ce risque pouvant être multiplié par dix en cas d'HTA sévère non traitée pendant une longue période. Des anomalies des lipides membranaires (portant des caractères spécifiques différents entre eux, surtout par la qualité des acides gras (AG) constitutifs) ont été observées, au niveau de nombreux organes et tissus, tant chez des patients hypertendus que chez des modèles animaux [1–6]. Les acides gras polyinsaturés (AGPI) sont des constituants des phospholipides (PL) membranaires. Leur nature est un facteur primordial influençant tant les propriétés biologiques des membranes que les fonctions cellulaires [7,8]. De nombreux travaux réalisés sur des rats spontanément hypertendus (SHR) attestent l'effet délétère de l'HTA sur la composition en AG et le fonctionnement des cellules [6,9–33]. Les acides linoléique (18:2n−6 ; LA) et α-linolénique (18:3n−3 ; ALA), précurseurs de deux familles distinctes d'AGPI non inter-convertibles et d'eicosanoı̈des impliqués dans différents processus physiologiques et pathologiques, participent, en tant qu'éléments constitutifs des PL membranaires, à la régulation des fonctions associées à ces membranes cellulaires. Les AGPI alimentaires présentent un intérêt fondamental en nutrition et en médecine pour l'enfant, l'adulte et le vieillard, en raison des rôles qu'ils jouent pendant la croissance et le développement des tissus, de même que dans le renouvellement cellulaire.
L'incorporation des dérivés supérieurs de LA et ALA dépend du type de cellule, les AGPI en n−3 étant sélectivement captés par les membranes des cellules neurales, d'où leur importance et leur essentialité. Ainsi, ils jouent un rôle fondamental dans l'édification du tissu nerveux, avant et après la naissance [34–37]. Il est maintenant clairement établi que les AGPI sont indispensables au développement normal et à la maturation tissulaire harmonieuse du fœtus et du nouveau-né. Des études expérimentales conduites sur les structures nerveuses (cerveau et rétine) du jeune rat allaité [38] et le statut en AGPI du sang, du cœur, du foie, de l'intestin, mais aussi de la rétine et du cerveau, du porc nouveau-né [39], ainsi que les données recueillies sur le tissu adipeux de nourrissons recevant du colostrum de femme [40], montrent que des variations dans la nature des apports alimentaires en AGPI modifient les compositions en AG des membranes de ces tissus. Ceci est particulièrement vrai pour le cerveau et les organes sensoriels, notamment au moment de la phase de croissance rapide in utero et après la naissance, tant chez la souris [41], que chez le porc [42] et l'enfant [43], contrairement à ce qui est observé pour les tissus cérébraux, relativement résistants aux variations des apports alimentaires en matière d'AGPI, chez l'individu plus âgé. Cette notion est d'autant plus importante que l'activité fonctionnelle du cerveau, plus que celle des autres organes, est liée à une homéostasie stricte de ces AGPI, puisque leur carence peut altérer les facultés d'apprentissage voir, dans certains cas, entraı̂ner la mort [44], d'autant que la nature des AG des membranes peut affecter le transport de certaines substances, tel le glucose : ainsi, une déficience en 18:3n−3 peut entraı̂ner des altérations au niveau du transport du glucose du plasma vers le cerveau [45].
La présente étude a pour but d'analyser la composition en AG des lipides totaux (LT) des hémisphères cérébraux lors de l'installation de l'HTA chez des rats SHR. La période pré-hypertensive correspond, chez cette souche, au premier trimestre postnatal, phase de développement et de maturation particulièrement rapide des systèmes nerveux et sensoriels [46]. Elle s'accompagne d'un besoin considérable en AGPI, nécessaires pour les synthèses et le développement des différentes membranes cellulaires et sub-cellulaires des neurones ainsi que de leurs prolongements dendritiques. Même si les informations disponibles sont encore très insuffisantes, il semble bien que la capacité de synthèse in situ des AGPI du cerveau et des organes sensoriels soit très limitée, aussi bien chez le rat [47] que chez l'enfant et l'homme adulte [46]. Ce besoin ne peut être couvert que par des transferts maternels d'AGPI pendant la gestation puis, chez l'enfant après la naissance, par le lait maternel qui, à ce titre, est considéré comme une référence biologique adaptée aux besoins du nouveau-né [48], et enfin par les apports alimentaires chez l'adulte.
Toutefois, la composition lipidique du lait n'est pas constante, variant d'une mère à l'autre, sous l'influence de l'environnement, de l'alimentation et du génome. La composition en AG du lait des femelles SHR peut être différente de celle du lait de leurs témoins nomotendues, c'est-à-dire les femelles Wistar Kyoto (WKY). Ceci nous a donc conduits à utiliser des rates adoptives de souche Wistar, afin de supprimer d'éventuelles différences de composition liées à la souche, même si des variations interindividuelles mineures peuvent éventuellement subsister, malgré la même alimentation.
Les effets éventuels d'une HTA préprogrammée sur la composition en AG des lipides cérébraux pourront, de ce fait, être mises en évidence chez des mâles préhypertendus SHR nourris comme leurs témoins normotendus WKY.
2 Matériels et méthodes
Dix SHR et 10 WKY mâles ont été allaités par des mères adoptives de souche Wistar (Centre d'élevage R. Janvier, Le-Genest-Saint-Isle, France) jusqu'à leur sevrage à trois semaines, puis nourris avec un régime standard commercial équilibré (A.04, Usine d'alimentation rationnelle, Villemoisson-sur-Orge, France) composé (g/100 g) de protéines 15,5–17,0 ; hydrates de carbone 55,5 ; lipides 2,5–3 (dont 52,3 % de 18:2n−6 et 5,6 % de 18:3n−3) ; vitamines 1,0 ; cellulose 5,0 ; sels minéraux 6,0 ; eau 13,0.
Tous les animaux, disposant d'eau de boisson ad libitum, sont maintenus dans un local climatisé à 22–23 °C, avec une humidité ambiante de 60±5 % et soumis à un rythme nyctéméral de 12 h. Pour la détermination de la glycémie, une goutte de sang capillaire frais a été prélevée au bout de la queue, après élimination de la première goutte. La lecture a été réalisée à l'aide d'un lecteur de glycémie à mémoire (Glucometer 4, Bayer, Puteaux, France).
Cinq WKY et cinq SHR sont pesés, puis sacrifiés par dislocation des vertèbres cervicales, à 10 jours d'âge, entre 07:00 et 08:00 heures, afin de prévenir toute variation d'ordre circadien [49]. Les rats restants sont sacrifiés à 30 jours d'âge dans les mêmes conditions. Les hémisphères cérébraux gauches et droits sont prélevés, puis broyés séparément.
Les AG sont extraits par la méthode de Folch modifiée [50], permettant de récupérer les LT en solution dans du chloroforme. Ce solvant est alors évaporé à l'aide d'un évaporateur rotatif (Büchi Rotavapor, Flawil, Suisse). Après séchage à l'éthanol absolu, les LT sont saponifiés, sous azote, à 80 °C pendant 20 min, par 1 ml de NaOH méthanolique 0,5 M. Les acyles constitutifs sont transméthylés, sous azote, à 80 °C pendant 20 min, à l'aide de trifluorure de bore (BF3) (Sigma-Aldrich, Paris, France) à 14 % dans le méthanol, selon la technique de Slover et Lanza [51]. Les esters méthyliques d'AG sont repris par 2 ml d'isooctane, sur une solution aqueuse de NaCl 35 %. Après agitation vigoureuse, la phase supérieure isooctanique, contenant les esters méthyliques d'AG, est prélevée. Les esters méthyliques sont analysés par chromatographie en phase gazeuse (détecteur à ionisation de flammes Becker–Packard 419 – Packard, Rungis, France – ; colonne capillaire en verre de 25 m de long et de 0,3 mm de diamètre interne, avec comme phase stationnaire du Carbowax 20 M ; injecteur en verre à aiguille de type Ross). Les conditions d'analyse sont les suivantes : température de l'injecteur et du détecteur : 230 °C ; température du four : 170 °C pendant les 20 premières minutes, puis programmation jusqu'à 198 °C à raison de 5 °C min−1 ; pression de l'hélium (gaz vecteur) : 0,6 bar ; débit de l'hélium : 0,4 ml min−1 ; pression de l'hydrogène et de l'air comprimé : 2 bar. L'appareil est couplé à un intégrateur (Delsi Enica 21, Suresnes, France) permettant de calculer les temps de rétention et les surfaces des différents pics des chromatogrammes. Environ 2 μg d'esters méthyliques d'AG en solution dans l'isooctane sont injectés. Chaque ester méthylique d'AG est identifié par son temps de rétention, par rapport à une solution standard d'esters méthyliques d'AG (68A ; Nu-Check-Prep, Elysian, USA), et quantifié par rapport à un étalon interne (17:0, Sigma-Aldrich).
3 Résultats
Les résultats concernant le poids des animaux, des hémisphères cérébraux gauches (HCG) et droits (HCD), ainsi que les glycémies, sont présentés dans le Tableau 1. Les SHR accusent des glycémies significativement supérieures à ceux des WKY du même âge. Les autres résultats ne sont pas significativement différents.
Caractéristiques générales des animaux
| Rats sacrifiés à 10 jours | Rats sacrifiés à 30 jours | |||
| WKY | SHR | WKY | SHR | |
| (n=5) | (n=5) | (n=5) | (n=5) | |
| Poids moyen des rats (au sacrifice) (g) | 26,5 ± 0,9 | 25,6 ± 0,5 | 106,5 ± 3,5 | 100,0 ± 3,1 |
| Poids moyen des hémisphères | ||||
| – cérébraux droits (g) | 0,80 ± 0,04 | 0,81 ± 0,05 | 1,10 ± 0,08 | 1,10 ± 0,09 |
| – cérébraux gauches (g) | 0,80 ± 0,04 | 0,81 ± 0,05 | 1,10 ± 0,08 | 1,10 ± 0,09 |
| Taux de glucose sanguin (au sacrifice) (mg dl−1) | 93,45∗ ± 11,85 | 118,65∗ ± 21,10 | 92,00∗ ± 21,65 | 117,65∗ ± 4,15 |
∗ Valeurs correspondant à une différence, significative à 95% de probabilité (test t de Student–Fisher) au moins, entre la valeur trouvée (± SEM) chez les rats témoins WKY et la valeur correspondante (± SEM ; même âge) chez les rats hypertendus SHR.
En ce qui concerne les compositions en AG des LT des hémisphères cérébraux (Figs. 1 et 2 ; Tableaux 2 et 3), notre analyse repose tout d'abord sur des comparaisons au sein d'une même souche (WKY ou SHR). Aucune différence significative n'est à noter entre les deux hémisphères cérébraux des WKY âgés respectivement de 10 et 30 jours. Pour les SHR de 10 jours, la composition en AG des LT des HCG, comparativement à celle des HCD, se caractérise par une plus faible teneur en 18:1n−9 (−4 %), en 22:5n−3 (−20 %), en 22:6n−3 (−3 %), et des teneurs plus élevées en 20:2n−6 (+27,5 %), en 20:4n−6 (+6 %), en 22:4n−6 (+5,5 %) et en 22:5n−6 (+13,5 %). La plupart de ces différences ne se retrouvent plus chez les SHR âgés de 30 jours.
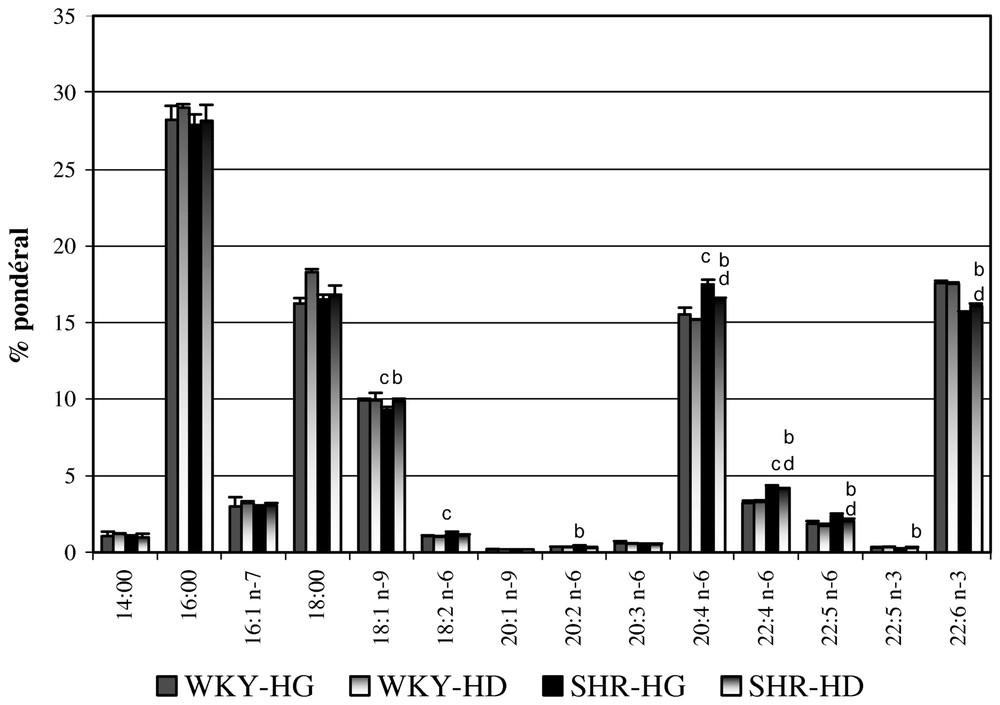
Compositions en pourcentages pondéraux (± SEM) d'acides gras des lipides totaux des hémisphères cérébraux gauches et droits des rats sacrifiés à 10 jours (n=5). La signification des différences est déterminée par le test t de Student–Fisher pour chaque acide gras. ap<0,05 WKY-HG vs. WKY-HD ; bp<0,05 SHR-HG vs. SHR-HD ; cp<0,05 WKY-HG vs. SHR-HG ; dp<0,05 WKY-HD vs. SHR-HD. HD = Hémisphère droit ; HG = hémisphère gauche.

Compositions en pourcentages pondéraux (± SEM) d'acides gras des lipides totaux des hémisphères cérébraux gauches et droits des rats sacrifiés à 30 jours (n=5). La signification des différences est déterminée par le test t de Student–Fisher pour chaque acide gras. ap<0,05 WKY-HG vs. WKY-HD ; bp<0,05 SHR-HG vs. SHR-HD ; cp<0,05 WKY-HG vs. SHR-HG ; dp<0,05 WKY-HD vs. SHR-HD. HD = Hémisphère droit ; HG = hémisphère gauche.
Compositions en acides gras (% pondéraux ± SEM) des lipides totaux des hémisphères cérébraux des rats sacrifiés à 10 jours
| WKY | SHR | |||
| HG | HD | HG | HD | |
| Total AGS | 45,55±1,00 | 46,70±0,30 | 45,30±0,70 | 46,00±1,00 |
| Total AGMI | 13,00c±0,15 | 13,50±0,35 | 12,50c±0,30 | 13,10±0,25 |
| Total AGPI en n−6 | 22,70c±0,95 | 22,20d±0,30 | 26,05c±0,75 | 24,70d±0,45 |
| Total AGPI en n−3 | 17,90c±0,15 | 17,90d±0,05 | 15,85c±0,10 | 16,35d±0,20 |
c p<0,05 WKY-HG vs. SHR-HG ;
d p<0,05 WKY-HD vs. SHR-HD ; AGS : acides gras saturés ; AGMI : acides gras monoinsaturés ; AGPI : acides gras polyinsaturés.
Compositions en acides gras (% pondéraux ± SEM) des lipides totaux des hémisphères cérébraux des rats sacrifiés à 30 jours
| WKY | SHR | |||
| HG | HD | HG | HD | |
| Total AGS | 39,50±1,20 | 40,55±1,00 | 40,65±1,60 | 40,55±0,45 |
| Total AGMI | 21,80c±1,75 | 19,95±1,70 | 18,30c±0,50 | 18,65±1,00 |
| Total AGPI en n−6 | 18,95c±0,25 | 19,15d±1,00 | 20,10c±0,60 | 20,55d±0,50 |
| Total AGPI en n−3 | 19,65±0,60 | 20,70±0,70 | 20,70±0,35 | 20,25±0,40 |
c p<0,05 WKY-HG vs. SHR-HG ;
d p<0,05 WKY-HD vs. SHR-HD.
La comparaison des HCG des SHR âgés de 10 jours avec ceux des WKY du même âge montre que le total des AG en n−6 est significativement plus élevé, avec notamment des teneurs en 18:2n−6, en 20:4n−6 et en 22:4n−6 respectivement supérieures de 11,4, 12,5 et 36,8 %, alors que le total des AG en n−3 est significativement plus faible (15,85 % versus 17,90 %).
L'analyse des compositions en AG des LT des rats âgés de 10 jours fait apparaı̂tre des similitudes entre HCD et HCG.
Ces différences ne subsistent pas, pour l'essentiel, chez les rats sacrifiés à 30 jours d'âge. Seules les teneurs en 18:2n−6, 20:4n−6 et 22:4n−6, ainsi que le total des AG en n−6, très légèrement supérieurs, sont à remarquer chez les SHR, comparativement aux WKY. Dans la mesure où nous avons reporté les acides gras dont les pourcentages pondéraux sont supérieurs à 0,1 % des acides gras totaux, l'analyse de la composition en acides gras des animaux de 30 jours fait apparaı̂tre trois composés supplémentaires par rapport à celle des animaux de 10 jours : 20:0 et 22:0, qui atteignent des niveaux faibles, et 24:1n−9, dont les proportions varient significativement, de 2 à 6 %, selon la souche de rat et l'hémisphère cérébral.
4 Discussion
Cette étude a été réalisée sur des rats mâles, afin de supprimer toute différence éventuelle liée au sexe [52,53].
La composition en AG des lipides alimentaires joue un rôle important, aussi bien dans le développement de l'HTA, que dans les compositions en AG des lipides tissulaires de jeunes SHR [11]. Par ailleurs, l'HTA modifiant la composition lipidique de fluides biologiques, tels que le sang, le sperme, mais aussi le lait maternel, notre étude a été réalisée avec des rats SHR et WKY allaités par des mères adoptives de souche Wistar, tous les animaux ayant ainsi reçu la même alimentation.
Aux deux âges étudiés, si l'HTA n'est pas encore décelable, les glycémies élevées, associées à de faibles poids corporels des SHR, apparaissent cependant comme autant de signes attestant l'installation de cette pathologie. Cette tendance, déjà observée chez des patients et des modèles animaux hypertendus [54–57], s'explique par une sensibilité tissulaire à l'insuline réduite, du fait de récepteurs hormonaux défaillants [58].
La première semaine postnatale écoulée, chez les WKY, témoins normotendus de cette étude, le développement cérébral ne fait apparaı̂tre aucune différence, entre les deux hémisphères, dans les compositions en AG des LT. Cette observation est confortée par l'analyse des résultats des hémisphères cérébraux des WKY sacrifiés à 30 jours d'âge, pour lesquels il n'existe également aucune différence. Chez les jeunes WKY, le développement cérébral se caractérise donc par une composition en AG des LT semblable dans chaque hémisphère.
Chez les SHR sacrifiés à 10 jours, les quantités d'AG sont significativement différentes, comparativement aux témoins normotendus du même âge : d'une manière générale, les AGPI de la famille en n−3 sont présents en quantité moindre, à l'inverse des AGPI en n−6 ; ces différences semblent plus prononcées pour l'hémisphère gauche. Ce phénomène est d'autant plus à souligner que des carences en AGPI en n−3, notamment en 22:6n−3, induisent, au niveau cérébral, une réduction des facultés d'apprentissage [59,60]. Le 22:6n−3, AG cérébral majeur, joue un rôle fondamental dans la fluidité, la stabilité et la perméabilité des membranes biologiques. Des travaux tendent à montrer qu'une variation du taux de 22:6n−3 s'accompagne d'une modification du taux de 20:4n−6 [61]. Le 20:4n−6 constituerait un moyen de « compenser » le plus faible taux de 22:6n−3, visant à maintenir une certaine stabilité membranaire. Nos observations, chez le très jeune SHR, ne permettent pas de tirer des conclusions définitives concernant l'influence de l'installation de l'HTA sur les compositions en AG des LT des deux hémisphères cérébraux. Ces résultats suggèrent toutefois que, dans des premiers jours qui suivent la mise bas, les compositions en AG des hémisphères cérébraux des SHR sont modifiées, et ce malgré une alimentation équilibrée, du fait de leur allaitement par des mères adoptives Wistar, indemnes de pathologies génétiques. Toutefois, il n'est pas à exclure que ces variations de composition puissent être liées à un développement embryonnaire au cours de la gestation perturbé par des troubles importants du bilan lipidique des mères SHR, troubles ayant pour origine l'HTA. La mise en évidence de 24:1n−9, d'une part, et les variations de ses pourcentages pondéraux de 2 à 6 %, selon la souche de rat et l'hémisphère cérébral, constituent par ailleurs des phénomènes qui, non seulement interrogent, mais nécessitent une étude et une réflexion plus approfondies à ce propos.
De plus, bien que très limitée [46] et insuffisante [62,63] par rapport aux besoins de l'organisme en développement, la capacité de synthèse in situ des AGPI du cerveau pourrait influer sur les compositions lipidiques. En effet, les astrocytes et les cellules endothéliales, mais pas les cellules neuronales, ont la capacité de synthétiser du 20:4n−6 et du 22:6n−3 par désaturation et élongation du 18:2n−6 et du 18:3n−3, respectivement [62,63]. Ces étapes de désaturation et d'élongation sont sous l'influence de différents facteurs [64], notamment génétiques, pouvant en partie expliquer les différences de composition observées entre les rats WKY et SHR. Il ne faut cependant pas perdre de vue le fait que, même chez l'homme adulte, les études réalisées avec des isotopes stables n'ont pas encore permis d'estimer réellement les capacités tissulaires cérébrales de désaturation et d'élongation du 18:2n−6 et du 18:3n−3 [65,66].
5 Conclusion
Les différences de composition en AG des hémisphères cérébraux observées chez les très jeunes SHR s'estompent chez les rats âgés de 30 jours. Ces observations semblent conforter l'hypothèse d'une origine prénatale de ces troubles de composition en AG. L'allaitement par des mères adoptives Wistar pendant 20 jours, suivi d'une alimentation équilibrée en AGPI après le sevrage, sont autant de facteurs favorisant un développement optimal qui, de ce fait, ne peuvent être omis dans l'interprétation des résultats des compositions en AG.
Des expériences complémentaires s'avèrent donc nécessaires pour apporter des précisions quant aux causes des modifications en AG des lipides cérébraux observées chez les très jeunes SHR.
Remerciements
Les auteurs adressent leurs sincères remerciements à Mme Anne Magnet, maı̂tre de conférences en anglais scientifique à l'UFR de sciences de la vie de l'université de Bourgogne (Dijon, France), pour la révision du texte anglais (Abstract et Abridged version).


