Abridged English version
The Sahela reservoir, located in Taounate at 90 km from Fès, lying at an altitude of 325 m, was built to provide the population of Taounate with drinking water and to contribute to the irrigation of neighbouring farming perimeters.
In order to assess the impact of crustacean zooplankton on phytoplankton and protozoan ciliates in the Sahela reservoir under semi-arid climate, we conducted experiments during the period from July to December 1999 at the deepest point in the lake (15 m).
Samplings and measurements were carried out in diffusion chambers submerged in situ over a period of 7 h without (control chambers) and with (experimental chambers) crustacean zooplankton. During these experiments, counts were conducted on phytoplankton and ciliates to determine the abundance and the mortality of these organisms due to zooplankton in each diffusion chambers at t=0 and t=7 h of incubation. The zooplankton was counted and dry weight of each taxon was calculated.
The study showed that the growth rates of phytoplankton and ciliates populations varied between 0.02 and 0.05 h−1 and from 0.01 to 0.07 h−1, respectively. The mortality caused by zooplankton grazing fluctuated from 0.07 to 0.2 h−1 of phytoplankton and from 0.01 to 0.2 h−1 of ciliates. These mortalities were significantly and positively correlated with the growth rates (r=0.8; p<0.02; n=9).
In summer, the highest zooplankton biomass (150 μg l−1) mainly composed of cyclopoid Tropocyclops prasinus, caused mortality of the small-sized ciliates, such as Halteria grandinella (0.10 h−1). In autumn, the zooplankton biomass (75 μg l−1), dominated by Daphnia longispina, induced a higher mortality for phytoplankton (0.10 h−1) than ciliates (0.05 h−1). In winter, the zooplankton biomass (100 μg l−1), also represented by D. longispina, had a low impact on ciliate mortality (<0.02 h−1).
This study confirmed the hypothesis of Patersson et al. [22] that in newly flooded reservoir the zooplankton could depend on other energy sources than the phytoplankton, and thereby exert a strong predation on ciliates. The heavy predation by the crustacean zooplankton was exerted on small-sized phytoplankton and ciliates and we demonstrated the relationships between protozoans and zooplankton for the transfer of matter and energy in aquatic food webs. Furthermore, the crustacean zooplankton metabolism was different whether zooplankton was present in diffusion chambers or in the lake.
1 Introduction
Les progrès méthodologiques réalisés en écologie aquatique ont mis en évidence l'existence d'une étroite interaction entre la chaı̂ne trophique traditionnelle et les organismes planctoniques de petite taille, notamment les protistes ciliés [30,38]. De nombreux travaux ont montré que la dynamique du phytoplancton est contrôlée par les éléments nutritifs (bottom-up), mais également par le broutage, notamment celui du zooplancton crustacé (top-down) [12,24,31]. En effet, des travaux expérimentaux effectués en milieux côtiers ou marins montrent que le zooplancton crustacé servirait de lien dans les processus de transfert de matière et d'énergie transitant par la base des réseaux trophiques planctoniques [26]. Si ce rôle du zooplancton en tant que lien trophique est relativement bien connu dans les écosystèmes côtiers, marins ou océaniques [10], ainsi que son importance dans les écosystèmes d'eau douce [5], son impact sur la dynamique des communautés phytoplanctoniques et des protistes ciliés n'a été que très rarement analysé [21,32,33]. Par ailleurs, dans les réservoirs nouvellement mis en eau, la quantité importante de la matière organique provenant de l'immersion des terres inondées pourrait également stimuler la production bactérienne et conduire à une forte quantité d'organismes hétérotrophes et mixotrophes, qui pourrait être une source de nourriture pour le zooplancton crustacé [22]. Les études effectuées dans les réservoirs récemment mis en eau se sont plus attachées à un descriptif des communautés planctoniques et à une comparaison de ces dernières à des niveaux de pré-inondation. La prédation de l'ensemble des organismes de la boucle microbienne par le zooplancton crustacé a été étudié par Thouvenot et al. [34] dans un réservoir récemment mis en eau (La Sep, France). À notre connaissance, cette étude n'a jamais été effectuée dans un réservoir récemment mis en eau sous climat semi-aride. L'ensemble de ces raisons nous a incités à étudier les interrelations du compartiment « zooplancton crustacé » avec les autres organismes planctoniques dans ce réservoir. Compte tenu de l'importance de la gestion de l'eau au Maroc, l'objectif de notre travail a donc été d'étudier les variations temporelles de la composition biochimique du zooplancton crustacé et du broutage des communautés phytoplanctoniques et des protistes ciliés durant les périodes de stratification et celle de l'homogénéisation thermique dans un réservoir récemment mis en eau (Sahela, Maroc) sous climat méditerranéen semi-aride.
2 Matériel et méthodes
2.1 Site d'étude
Le réservoir Sahela est situé dans le Rif marocain (34°30′ N, 4°45′ W), à 90 km de la ville de Fès, a été mis en eau en 1995 et a atteint son taux maximum de remplissage 10 mois plus tard [19]. Il occupe une gorge entaillée par l'oued Sahela. La surface du plan d'eau est de 430 ha, pour une profondeur maximale de 25 m et un volume de 64×106 m3. Il est alimenté par l'oued Sahela. Le réservoir est destiné à renforcer l'alimentation en eau potable de la ville de Taounate et à développer l'irrigation des périmètres agricoles avoisinants [19].
Cette retenue est un lac monomictique chaud. La concentration moyenne en chlorophylle a (6,5 μg l−1) et celle en phosphore total (48 μg l−1), permettent de classer ce réservoir comme un lac oligo-mésotrophe, avec une probabilité de 60 % [16,18,23,25,27].
2.2 Principe de la méthode des chambres de diffusion
La technique utilisée consiste en la mesure des densités du phytoplancton et des protistes ciliés incubés dans des chambres de diffusion immergées in situ, pendant 7 h (entre 10 et 18 h) [33], en présence (chambres expérimentales) et en l'absence (chambres témoins) de zooplancton. Les chambres de diffusion utilisées sont en plexiglas, de 4 mm d'épaisseur, de forme cubique, de dimensions 18×18×18 cm, et d'une capacité de 5,8 l. Sur chacune de leurs faces, sont placées, dans un orifice de 15 cm de diamètre, des membranes filtrantes en nylon de 5 μm de porosité, permettant le renouvellement de l'eau. Sur l'une des quatre faces, sont placés les dispositifs de fixation de la chambre sur le câble de soutien ainsi que le système de remplissage et de vidange. Les chambres sont placées dans une bassine de capacité 40 l, préalablement remplie par un mélange d'eau des profondeurs 2 et 4 m [33]. Pour chaque profondeur, deux chambres sont remplies par l'eau de la profondeur retenue (chambres expérimentales), et deux autres par la même eau, préalablement filtrée sur membrane en nylon de 40 μm de porosité, afin d'éliminer le zooplancton (chambres témoins). Neuf campagnes ont été réalisées entre fin juillet et fin décembre 1999 (deux années après la fin du remplissage du réservoir), avec une périodicité très irrégulière, notamment en période de déstratification du lac (octobre), au point le plus profond du réservoir (15 m).
2.3 Dénombrement du phytoplancton, des ciliés et du zooplancton
Deux aliquots de 100 ml d'eau de chaque chambre sont prélevés à t=0 et t=7 h, et fixés au lugol (phytoplancton) ou au chlorure de mercure, de concentration finale 2,5 % (ciliés), et conservés à 4 °C. L'identification des espèces d'algues a été effectuée au laboratoire [8]. Les protistes ciliés ont été identifiés soit sur le vivant, après examen au microscope à contraste de phase, soit après application de différentes techniques cytologiques, permettant notamment l'observation de l'infraciliature [7]. Les espèces ont été déterminées suivant des critères morphologiques ou morphométriques [28]. Les dénombrements des algues et des protistes ciliés sont réalisés en microscopie inversée selon les méthodes d'Uthermöl [35] et de Sime-Ngando et Grolière [28,29].
Le zooplancton présent dans les chambres est récolté par filtration de la totalité du contenu de la chambre sur nylon de 40 μm de porosité, immédiatement fixé au sucrose/formaldéhyde (4 %), conservé à 4 °C et dénombré en cuve de Dolfus après coloration au rose bengale. Les densités spécifiques sont converties en biomasses à partir des relations longueur–poids sec, établies par Bottrell et al. [2].
La méthode utilisée pour calculer les taux de mortalité du phytoplancton et des protistes ciliés a été décrite par Wiackowski et al. [39], comme suit :
| (I) |
| (II) |
2.4 Composition biochimique des espèces Daphnia longispina et Tropocyclops prasinus
Les échantillons prélevés sont immédiatement congelés dans l'azote liquide ; de retour au laboratoire, les tubes sont mis au congélateur et conservés à −25 °C. Avant dosage, le zooplancton est décongelé, lavé plusieurs fois à l'eau distillée, puis trié. L'analyse du contenu en protéines et glucides a été réalisée sur 100 individus, à divers stades de développement, des espèces principales, notamment Daphnia longispina O.F. Müller, 1785 (Cladocère) et Tropocyclops prasinus Fischer, 1860 (Cyclopoı̈de). Chaque lot, préalablement calciné à 550 °C pendant 6 h et broyé dans un homogénéisateur de type Pötter Elvhejem, est filtré sur membrane GF/C de porosité 0,45 μm.
Les protéines ont été extraites selon la méthode de Lowry et al. [13] (étalon : albumine BSA). Les glucides ont été estimés par la technique de Dubois et Gilles [4], modifiée par Moal et al. [15] (étalon : glucose).
3 Résultats
Les températures extrêmes enregistrées au niveau du réservoir sont de 14 et 26 °C. Une période de stratification thermique, marquée par l'installation d'une thermocline à 10 m de profondeur, est observée en été. Ensuite, une période d'homothermie débute en novembre.
Afin de déceler une éventuelle hétérogénéité verticale des communautés planctoniques, les expériences ont été conduites dans des chambres de diffusion immergées à 2 et 4 m de profondeur. Cependant, nous avons observé très peu de différences entre ces deux profondeurs. Nous ne rapportons ici que les résultats relatifs à 2 m. De plus, nous n'avons retenu que les espèces D. longispina et T. prasinus, qui dominaient le zooplancton (>80 % en biomasse) durant toute la période d'étude.
3.1 Biomasse du zooplancton et des ciliés
Les valeurs extrêmes de la biomasse totale du zooplancton sont 15 et 255 μg l−1, avec une moyenne de 120 μg l−1 (Fig. 1). D'octobre jusqu'à la fin de l'étude, la biomasse du zooplancton est composée de 75 % de Cladocères (D. longispina), alors qu'au début de l'étude, elle est représentée par 55 % de Copépodes cyclopoı̈des (T. prasinus), 25 % de Cladocères (D. longispina) et 20 % de Rotifères (Polyarthra sp.). Durant la période d'étude, la biomasse des protozoaires ciliés est dominée par le groupe des Hyménostomes, notamment Lembadion lucens et Glaucoma scintillans. Les Oligotriches (Halteria grandinella) ne sont dominants qu'à la fin de l'étude (Fig. 2).
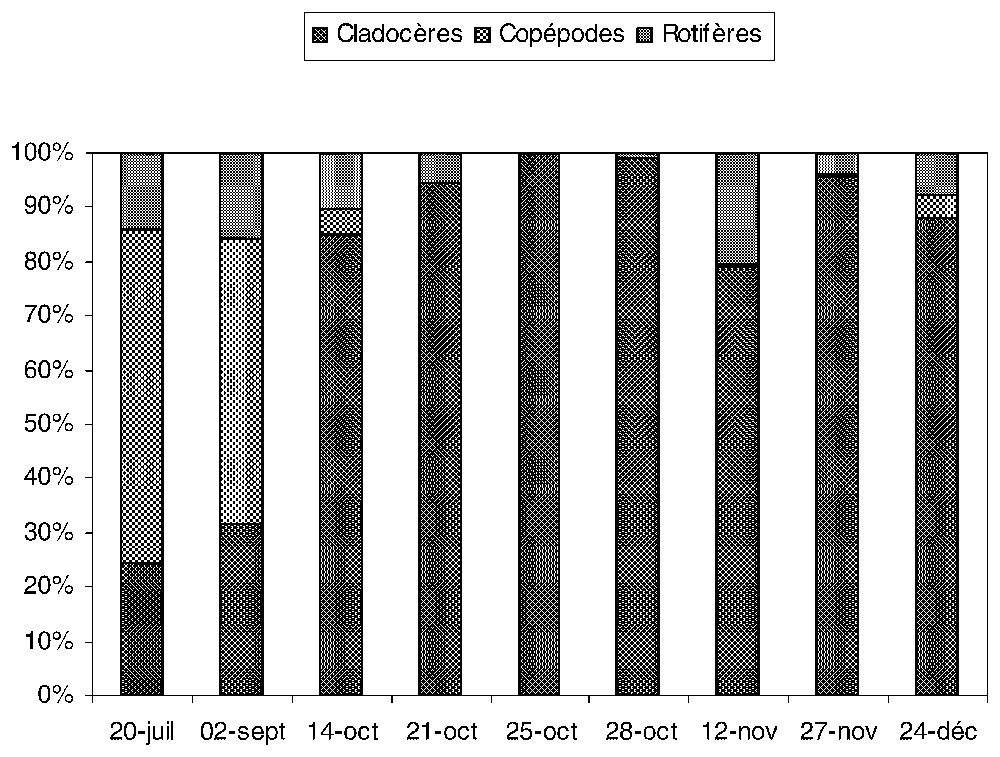
Biomasse relative des Cladocères, Copépodes et Rotifères, mesurée dans les chambres de diffusion expérimentales, à 2 m de profondeur.
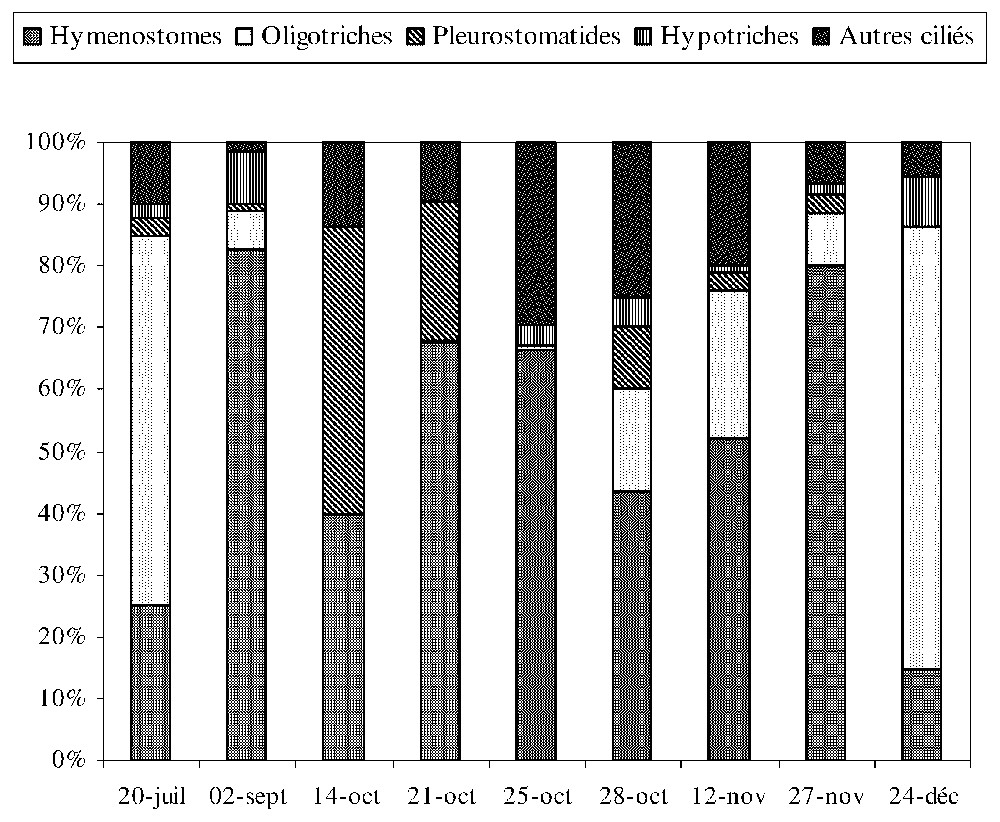
Biomasse relative de différents groupes de Ciliés, mesurée dans les chambres de diffusion expérimentales, à 2 m de profondeur.
3.2 Composition biochimique des espèces D. longispina et T. prasinus
Les teneurs en protéines et glucides de l'espèce D. longispina varient respectivement de 1,4 à 2,2 μg·ind−1 et de 0,4 à 1,2 μg ind−1, les valeurs moyennes étant de 1,7 μg ind−1 (protéines) et de 0,9 μg ind−1 (glucides) (Fig. 3a et b). T. prasinus présente des teneurs en protéines et glucides plus faibles que D. longispina, avec des valeurs en protéines de 1,1 μg ind−1 et glucides de 0,17 μg ind−1 et des extrêmes respectivement de 0,8–1,7 μg ind−1 et 0,08–0,4 μg ind−1 (Fig. 4a et b). Les zooplanctontes présents dans les chambres de diffusion montrent des teneurs en composants biochimiques relativement plus faibles que celles contenues dans le lac, mais leur profil de distribution temporelle est similaire.
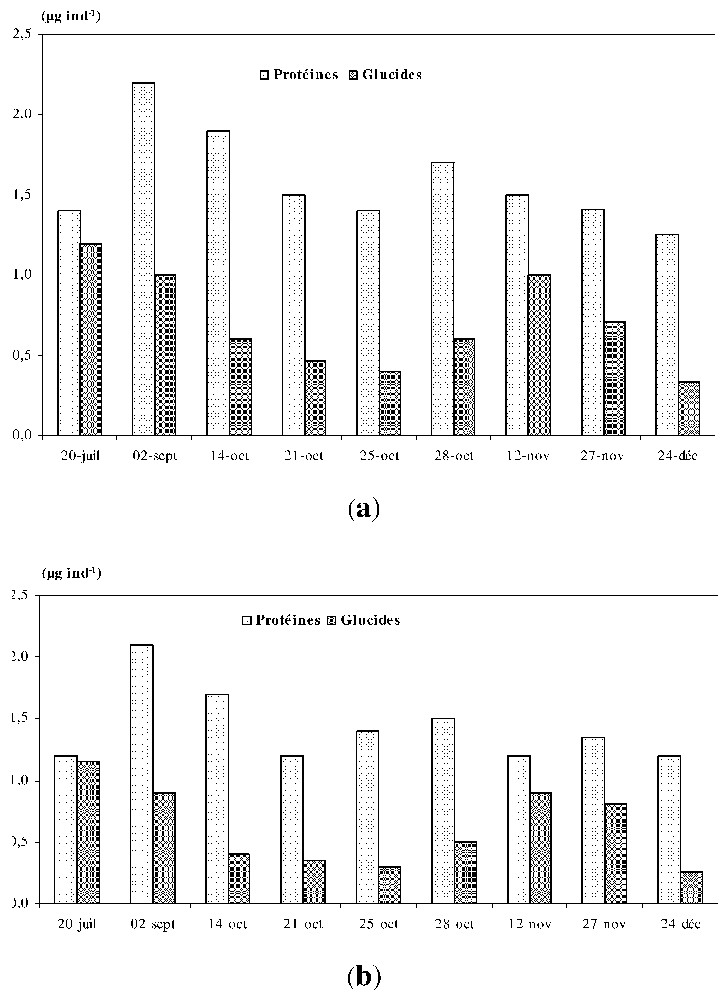
Variations temporelles de la composition biochimique de l'espèce Daphnia longispina (a) dans le réservoir, (b) dans les chambres de diffusion.
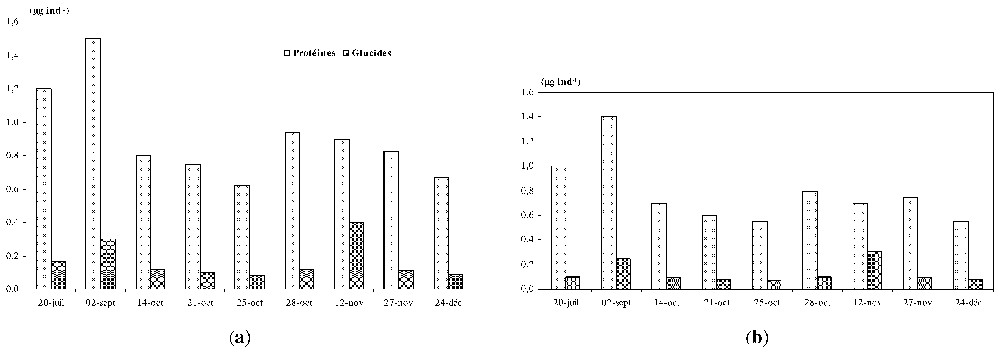
Variations temporelles de la composition biochimique de l'espèce Tropocyclops prasinus (a) dans le réservoir, (b) dans les chambres de diffusion.
3.3 Taux de croissance et taux de mortalité du phytoplancton et des protistes ciliés
Le taux de croissance dans les chambres de diffusion fluctue entre 0,02 et 0,05 h−1 pour le phytoplancton et entre 0,01 et 0,07 h−1 pour les protistes ciliés ; la valeur moyenne est de 0,03 h−1 pour les deux groupes. Ces taux augmentent du 20 juillet au 14 octobre et décroissent ensuite, pour augmenter à nouveau à la fin de l'étude (Fig. 5).
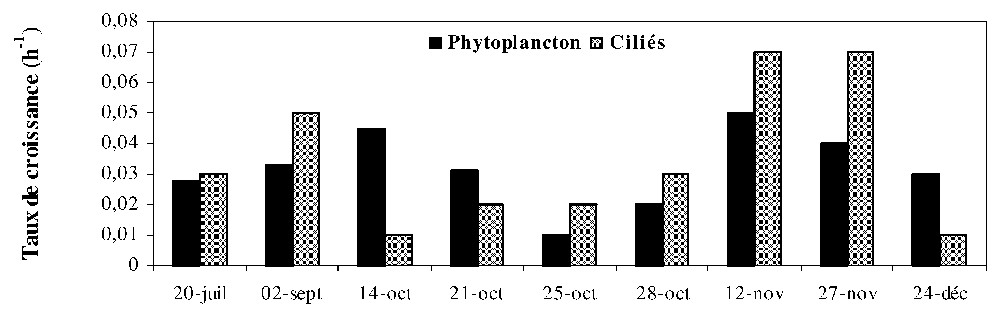
Taux de croissance du phytoplancton et des protistes ciliés en l'absence de zooplancton.
Le taux de mortalité dû au broutage par le zooplancton crustacé varie entre 0,07 et 0,2 h−1 pour le phytoplancton et entre 0,01 et 0,2 h−1 pour les protistes ciliés (Fig. 6 et Tableau 1). La valeur moyenne est de 0,12 h−1(phytoplancton) et 0,07 h−1(ciliés). La plus forte mortalité (0,2 h−1) est enregistrée le 14 octobre pour le phytoplancton et les 12 et 27 novembre pour les protistes ciliés, alors que le plus faible taux de mortalité est mesuré à la fin du mois d'octobre. Ces taux de mortalité sont significativement et positivement corrélés aux taux de croissance (Fig. 7a et b, r=0,8 ; p<0,02 ; n=9).
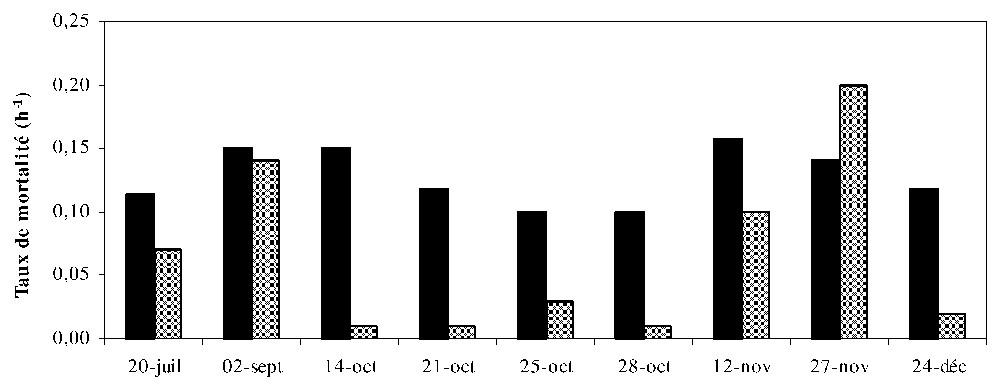
Taux de mortalité du phytoplancton et des protistes ciliés en présence de zooplancton.
Mortalité, longueur et biovolumes moyens des espèces de phytoplancton et des protozoaires ciliés dans le réservoir Sahela
| Taxon ∗ | Longueur (μm) | Biovolume 103 (μm3) | Mortalité (sd) (h) |
| Phytoplancton | |||
| Ceratium hirundinella | 203 | 65,4 | 0,02 ± 0,03 |
| Cryptomonas sp. | 21 | 2,0 | 0,31 ± 0,14 |
| Ankistrodesmus falcatus | 15 | 0,4 | 0,11 ± 0,06 |
| Oocystis crassa | 18 | 1,4 | 0,15 ± 0,08 |
| Elakatothrix gelatinosa | 25 | 0,2 | 0,08 ± 0,05 |
| Cocconeis placentula | 18 | 3,7 | 0,08 ± 0,11 |
| Cyclotella ocellata | 15 | 2,3 | 0,11 ± 0,09 |
| Tetraedron minimum | 12 | 0,4 | 0,07 ± 0,05 |
| Peridinium cinctum | 51 | 32,9 | 0,01 ± 0,01 |
| Ciliés | |||
| Lembadion lucens | 65 | 52,3 | 0,04 ± 0,03 |
| Acineria uncinata | 35 | 16,4 | 0,10 ± 0,28 |
| Glaucoma scintillans | 70 | 230 | 0,02 ± 0,02 |
| Pseudocohnilembus pusillus | 28 | 7 | 0,04 ± 0,07 |
| Halteria grandinella | 30 | 14,1 | 0,11 ± 0,04 |
| Uronema nigricans | 21 | 4,2 | 0,10 ± 0,02 |
∗ Les espèces les plus abondantes et celles qui ont subi une mortalité.
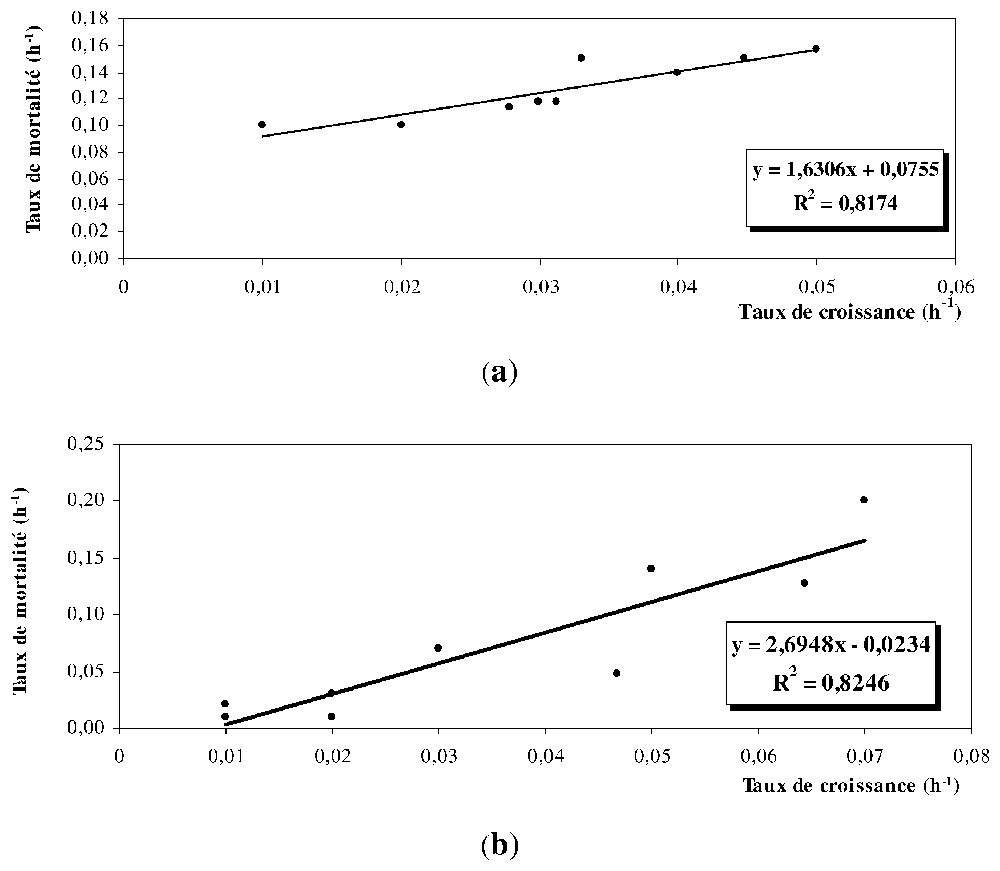
Relation entre le taux de mortalité et le taux de croissance (a) du phytoplancton, (b) des protozoaires ciliés.
4 Discussion
4.1 Limites de la méthode
Depuis les travaux de Pace et Vaqué [20], la mesure de l'impact du broutage du zooplancton crustacé sur le phytoplancton et les protistes ciliés par la méthode des chambres de diffusion a été appliquée par de nombreux auteurs [21,33]. Cette méthode présente l'avantage de permettre la mesure simultanée du taux de croissance du phytoplancton et des protistes ciliés et de leur mortalité due au broutage par le zooplancton crustacé [20], tout en minimisant les erreurs dues à la manipulation des échantillons. Wiackowski et al. [39] a montré que, même en présence d'une forte compétition, la mortalité des proies n'est pas surestimée. Dans le but de surmonter l'ensemble des biais liés à l'effet de bouteille (bottle effects), nous avons utilisé des chambres de diffusion avec des membranes filtrantes en nylon. Ces dernières, tout en permettant des échanges d'eau et de nutriment avec l'eau du lac, demeurent efficaces quant à leur résistance à la pression d'eau. Par ailleurs, des processus de feedback indirects, tels que les excrétats et la nourriture abondante, peuvent stimuler la croissance du phytoplancton et des ciliés, et par conséquent limitent l'utilisation de la méthode.
De plus, lors du calcul de la mortalité réelle, il était impossible de distinguer la part de mortalité due au broutage du phytoplancton par les organismes autres que le zooplancton crustacé, notamment les protistes ciliés et les flagellés. Néanmoins, le fait que le taux de croissance était en général plus élevé dans les chambres de diffusion sans zooplancton suggère que ce dernier joue un rôle prépondérant dans la mortalité des taxons que nous avons mesurée. Cette méthode, bien qu'utilisée de façon assez courante, présente de nombreux problèmes : en particulier, la filtration à 40 μm n'assure pas une séparation parfaite des proies et des prédateurs. De plus, certains ciliés sont sensibles à l'incubation et nombre d'études rapportent des taux de croissance négatifs de certains taxons en l'absence de prédateurs [14]. Par ailleurs, le zooplancton présent dans les chambres de diffusion peut s'avérer incapable d'avoir un comportement de broutage normal.
4.2 Impact du zooplancton sur le phytoplancton et les protozoaires ciliés
En milieu oligo-mésotrophe, l'incubation des échantillons pendant 7 h modifie le comportement et, par conséquent, le métabolisme des zooplanctontes présents dans les chambres de diffusion [11]. Ceci est confirmé par des teneurs faibles en composants biochimiques des zooplanctontes, notamment en protéines (1,4 μg ind−1) pour D. longispina et 0,9 μg ind−1 pour T. prasinus, enregistrées à la fin de l'étude. Ce qui pourrait être dû, à la fois, à la faible qualité nutritionnelle des proies et à la compétition pour l'accès aux ressources alimentaires entre les différentes espèces zooplanctoniques [1]. Cette compétition a engendré une grande pression de broutage exercée sur le phytoplancton [20,34], phénomène qui s'est traduit par de faibles concentrations en glucides des zooplanctontes présents dans les chambres de diffusion.
La rareté des données concernant l'impact du broutage de l'ensemble du zooplancton crustacé sur le phytoplancton et les protistes ciliés, mesuré dans les lacs par la méthode des chambres de diffusion, rend difficile la comparaison de nos résultats avec ceux obtenus dans des milieux similaires. Nos valeurs de taux de croissance sont généralement semblables aux taux rapportés dans la littérature, qui se situent entre 0,02 et 0,07 h−1 pour le phytoplancton et entre 0,01 et 0,06 h−1 pour les ciliés [33] alors qu'ils sont plus faibles que ceux enregistrés dans les lacs canadiens par Pace et Vaqué [20]. Bien que la valeur moyenne de la mortalité calculée pendant cette étude soit conforme à celle obtenue dans d'autres milieux lacustres [3,17,33,37], notre valeur maximale de mortalité (0,2 h−1) est plus faible que celle rapportée par Pace et Vaqué [20] et Thouvenot et al. [33] (0,3 h−1). Par ailleurs, à certains instants de l'étude, notamment en novembre, le taux de mortalité des protistes ciliés était plus élevé, ce qui pourrait être expliqué par une préférence du zooplancton pour les protistes ciliés, dont la qualité nutritionnelle est plus importante que celle du phytoplancton [37]. En effet, ce résultat est confirmé par des teneurs élevées en protéines des zooplanctontes, enregistrées pendant cette période. De plus, cette étude confirme les travaux de Paterson et al. [22], selon lesquels le zooplancton, dans un réservoir récemment mis en eau, peut dépendre d'autres ressources d'énergie que le phytoplancton et exerce alors une forte pression de prédation sur les protistes ciliés.
Il est vraisemblable que nos résultats permettent d'évaluer, en partie, l'impact direct du zooplancton sur le phytoplancton et les ciliés. Néanmoins, dans le cas du phytoplancton, il est difficile de préciser les conséquences indirectes de l'impact du zooplancton sur cette communauté. En effet, la présence des différentes populations zooplanctoniques avec les différentes tailles individuelles peut déterminer la structure de la communauté phytoplanctonique [36]. Cette structure ne résulte pas uniquement de l'impact du zooplancton, mais aussi des excrétats rejetés par celui-ci dans le lac ; par ce moyen, il peut entraı̂ner une compétition entre les algues [31].
5 Conclusion
Dans le réservoir Sahela, le zooplancton exerce un impact important sur le phytoplancton et les protistes ciliés. Celui-ci peut exploiter la production des différents composants de la chaı̂ne trophique et joue un rôle clé dans les processus de régulation des écosystèmes lacustres sous climat semi-aride. De plus, il engendre probablement une importante régénération des éléments nutritifs dans ce réservoir récemment mis en eau, comme cela a été observé en milieu oligotrophe [6]. Cette hypothèse est confirmée, dans la mesure où des résultats convergents existent dans la littérature au sujet de la relation entre la structure des peuplements phytoplanctoniques et la forte pression de prédation du zooplancton [9]. Ce dernier joue un rôle très important dans l'amélioration de la qualité des eaux, retardant ainsi l'eutrophisation. Davantage d'études doivent être réalisées en milieu lacustre, afin qu'on puisse intégrer la composante « zooplancton crustacé » dans les modèles conceptuels qui décrivent l'effet des manipulations des chaı̂nes trophiques sur la qualité des eaux. De plus, cette étude devrait être complétée en prenant en considération les autres composants de la boucle microbienne, en particulier les bactéries et les protozoaires flagellés nanoplanctoniques ; il est aussi intéressant de voir si le rôle bénéfique du contrôle des populations phytoplanctoniques par le broutage est maintenu en présence de poissons planctonophages.



