Abridged English version
1 Introduction
The study of the role of the biological pump in the carbon cycle and in the mineralization of the organic matter in seawater is of special concern in oceanography, because this biological pump contributes significantly to the regulation of the greenhouse effect.
In the ocean, the mineralization of organic matter is mainly achieved by heterotrophic bacteria. Bacterioplankton is ubiquitous and shows an important biodiversity, a wide panel of metabolic activities, and high abundances (on the order of 105 to 106 cells cm−3). In coastal and pelagic waters, except estuarine areas richer in particles, attached bacteria constitute less than 4% of the whole abundance of bacteria, which makes the fraction of free bacteria particularly important. The determination of their abundance is thus one of the first parameters investigated.
Although determination of the whole bacterial abundance does not represent a problem, the estimation of the viable fraction is not easy to apprehend. Estimation of viability is a very important task for the study of microbial assemblages and of their relationships with their natural environment, because it allows one to refer bulk activity measurements to the only fraction of cells potentially responsible for these observations. In the case of bacteria readily cultivable in laboratories, the cell proliferation on culture medium constitutes an evidence of cell viability; it is very different for marine bacteria where the majority of species are not cultivable.
Without entering in the long debate on viable and dead cells, it can be simply said that membrane integrity is considered as one of the main criteria allowing one both to characterize a living cell and to distinguish it from a dead cell. Indeed, the loss of membrane integrity results in the collapse of cell energetics and active transports, another way of saying cell death.
We have developed a bacterial Nucleic-Acid-Double-Staining protocol (NADS) in order to identify by flow cytometry (FCM) viable cells, whether active or inactive, and cells with damaged or compromised membranes within the free aquatic bacterial community. This protocol also discriminates these different clusters of bacteria from detritus and apparatus noise. The principle of the method relies on the simultaneous use of two nucleic-acid fluorochromes and on the fluorescence resonance energy transfer phenomenon (FRET) that occurs between them when they are both closely bound to the nucleic acids. This article deals with the application of this protocol to the study of heterotrophic bacteria in the Bay of Marseilles under winter and spring conditions.
2 NADS protocol principle
This NADS flow cytometric protocol is based on the simultaneous use of two nucleic acid fluorescent dyes, SYBR Green II (maximum λex=254 and 497 nm; maximum λem=520 nm) and propidium iodide (PI; maximum λex=535 nm; maximum λem=617 nm). Cell membranes are permeable to SYBR Green II. But intact plasmic membranes characteristic of viable cells are impermeable to PI, making PI a good indicator of cell viability.
Both dyes are readily excited by the blue light from the laser or arc lamp of a benchtop flow cytometer. The efficiency of the staining is magnified by the FRET from SYBR Green to PI when both are closely bound to the nucleic acids (<70 Å). The fluorescence energy of the SYBR Green is then absorbed by the PI. Consequently, membrane-compromised bacterial cells permeable to PI fluoresce in the red-wavelength range, whereas the fluorescence emitted by membrane-intact cells not permeable to PI is restricted to green wavelengths. Cells with partially damaged membranes let various quantities of PI penetrate and bind some nucleic acids, resulting in a corresponding increase of red fluorescence and a decrease of green fluorescence depending on the extent of the energy transfer from SYBR Green to PI.
The analysis of marine bacteria by FCM using the NADS protocol results in green versus red fluorescence dot plots characterizing cells according to their fluorescence in three different quadrants corresponding to cells fluorescing green, green+red and red. Previous works based on independent methods have demonstrated that green-only fluorescent bacteria can be considered as viable cells (active or inactive), green+red-fluorescent bacteria are damaged cells, and red-only fluorescent bacteria are dead cells fully permeable to PI because of the loss of membrane integrity.
3 Sampling site, meteorological and hydrological dataset
Sea surface samples were collected at two stations on 1 February 2000 and on 30 March 2000 after the spring phytoplanktonic bloom. Both sample collections occurred after a wind event. Station 1 was located south of the city of Marseilles, at Cap Croisette (northwestern Mediterranean Sea) and outside the direct influence of the city. Station 2 was located in the Pointe-Rouge harbour within the city area.
Meteorological and hydrological data used in this study were collected and provided by the ‘Service d'observation du centre d'océanologie de Marseille’ (OSU).
4 Abundances of the different bacterial clusters defined by the NADS protocol
The marine sample analyses by the NADS protocol have underlined not only the spatial-temporal heterogeneity of the total bacterial abundance, but also the heterogeneity of the different physiological states.
From a spatial point of view, the bacterial abundance at station 2 was significantly greater than at station 1 (201% in February, 80% in March, F-test, p<0.001), irrespective of the considered period. This phenomenon can be explained by the location of station 2 inside a port, with hydrological conditions highly favourable to bacterial development (stronger input of organic matter and of allochtonous bacteria by soil draining and from boats; weak stream).
From a temporal point of view, bacteria abundances measured at both stations at the end of March were significantly greater than those measured at the beginning of February (96% increase at station 1, 17% at station 2, F-test, p<0.001). This difference can be explained by taking into account the temporal evolution of the chlorophyll a vertical distribution measured in the Bay of Marseilles. A phytoplankton bloom was observed around 14 March and this has probably enriched the bay in dissolved and particulate organic matter through excretion, viral lysis, and predation of the phytoplankton. There is a strong coupling between phytoplanktonic and bacterial productions, because heterotrophic bacteria are able to use the carbon produced by lysis and predation from microalgae. The greater bacterial abundance observed in spring would therefore be induced by the spring bloom. Although the variability of viable bacteria abundances is high between the two stations and the two sampling periods, the percentage of viable bacteria at both stations was higher in February than in March (Table 1, F-test, p<0.001). As a consequence, the percentage of damaged and dead bacteria clusters was higher in March than in February (58.9 versus 45.9% at station 1 and 38.4 versus 3.3% at station 2). The sea surface temperature was not a regulating factor of the different clusters corresponding to each different bacterial physiological state, because it was similar for both sampling periods and stations (between 12 and 13 °C from 1 January to 5 April). Likewise, the recorded meteorological data do not exhibit any large variation in the air temperature during the first three months of year 2000, and reveal that there was no rain to affect the salinity of the sea surface. The March spring bloom stimulated the development of heterotrophic bacteria, as evidenced by their higher abundance. It is also reasonable to think that the bloom also stimulated the development of their predators (flagellates, ciliates). It is known that bacterial predators feed preferentially on bigger and active (in other words viable) cells. The smallest percentage of viable bacteria in March might be due to this preferential predation, enhanced by the weather conditions before the sampling date. Several works have shown that predation of viable bacteria leads to an increase in damaged and dead bacteria. In agreement with this fact, we indeed observed an increase in the percentage of damaged and dead bacteria after the spring bloom, when the phytoplankton bloom stimulates the development of bacterial predators. To the opposite, in winter conditions, the lower abundance of bacterial predators led to a less important predation. Viable bacteria, less predated, are thus more numerous as shown by the higher percentage observed on 1 February. The weak contribution of the damaged bacteria to the whole bacterial abundances suggests that this state is transitory (and ephemeral) between viable and dead cells. Without fast reparation, damaged membranes degrade quickly and lead to the death of the cell. The effect of UV radiation on a natural planktonic community has been shown to stimulate the abundance of heterotrophic bacteria (up to 49%) as a consequence of negative effects on larger cells and ciliates. We therefore favoured the role of predators in the heterogeneity of the bacteria physiological state.
Concentrations des populations bactériennes totales et des sous-populations définies par le protocole NADS dans les échantillons prélevés dans la baie de Marseille le 1er février et le 30 mars 2000 au large (station 1) et dans un port de plaisance (station 2)
| Station | Date | Concentration | Sous-populations | Concentration | cv | % |
| bactérienne totale | définies par le | des sous-populations | (%) | |||
| ( cellules cm ) | protocole NADS | ( cellules cm ) | ||||
| 1 | 01/02/00 | 2,51 | viable | 1,36 | 3 | 54,1 |
| endommagée | 0,46 | 3 | 18,4 | |||
| morte | 0,69 | 3 | 27,5 | |||
| 30/03/00 | 4,94 | viable | 2,03 | 3 | 41,0 | |
| endommagée | 0,28 | 3 | 5,6 | |||
| morte | 2,64 | 3 | 53,3 | |||
| 2 | 01/02/00 | 7,56 | viable | 7,32 | 4 | 96,7 |
| endommagée | 0,16 | 3 | 2,1 | |||
| morte | 0,09 | 3 | 1,2 | |||
| 30/03/00 | 8,87 | viable | 5,47 | 2 | 61,6 | |
| endommagée | 0,45 | 1 | 5,1 | |||
| morte | 2,95 | 4 | 33,3 |
5 Conclusion
Until now, because of the lack of suitable methods, bacterial activities were always referred to the whole number of cells counted by other techniques (microscopy). This whole abundance can contain a large fraction of dead cells, which are not involved in the biomass production or in any other bacterial activities. Viability is thus an important parameter that must be investigated and we now have tools in the form of flow cytometry and fluorochromes with which to do this.
Without entering into the long debate about viable or dead cells, it is obvious that the loss of membrane integrity can be considered as a non-viability criterion, because it leads to the collapse of cell energetic mechanisms and active transports and so to cell death. The NADS protocol is essentially based on cell membrane integrity, a viability criterion today widely accepted. As soon as red-fluorescent bacteria (permeable to PI) show damaged membranes, this parameter gives a good estimation of non-viable cells. To the opposite, cells with integer membranes, not permeable to PI and therefore only stained by SYBR Green, can be considered as viable, either active or inactive. The NADS protocol allows one, in less than one hour, to get both quantitative and qualitative information leading to the discrimination of bacteria with intact membranes (viable) and with damaged and compromised membranes (dead). It is thus possible to consider its use when high-frequency sampling and routine analyses are needed. The same estimation of viability by the more classical epifluorescence microscopy method after filtration would be more time consuming and less accurate. Moreover, the NADS protocol stains only bacteria containing nucleic acids. As a consequence, all detritus shaped or sized like bacteria are not taken into account in the counting, increasing the accuracy of the abundance calculations.
The NADS protocol underlines the heterogeneity of the different bacterial populations (this study) and thus brings qualitative and quantitative complements to the information characterizing their role in the environment, increasing our knowledge on the importance of microorganisms in the biogeochemical cycles.
1 Introduction
L'étude du rôle de la pompe biologique [1,2] dans le cycle du carbone et dans la reminéralisation de la matière organique en milieu marin constitue un axe majeur de recherche en océanologie [2,3]. Ceci tient en grande partie au fait que la pompe biologique contribue à la régulation de l'effet de serre [4,5].
Dans l'océan, la minéralisation de la matière organique est essentiellement réalisée par les bactéries hétérotrophes, ce qui en fait une des composantes biologiques majeures [6]. Ces bactéries sont ubiquistes, présentent une grande diversité spécifique, un large éventail d'activités métaboliques ainsi qu'une abondance élevée (de l'ordre de 105 à 106 cellules cm−3) [7]. Dans les eaux côtières et pélagiques (à l'exception des zones estuariennes plus riches en particules), les bactéries attachées représentent moins de 4 % (et souvent, moins de 1 %) de l'effectif bactérien total, ce qui souligne l'importance de la fraction bactérienne libre [8]. Leur dénombrement est ainsi un des tous premiers paramètres mesurés.
Si la détermination de la concentration bactérienne totale ne pose pas de problème majeur [9–11], la quantification de la fraction viable n'est pas aussi facile à appréhender. Évaluer la viabilité des micro-organismes est une tâche extrêmement importante dans l'étude des assemblages microbiens et de leur interaction avec leur environnement naturel, car elle permet de ramener les activités globales mesurées par diverses méthodes à la seule fraction des cellules potentiellement responsables de ces observations [12]. Si, dans le cas de souches bactériennes facilement cultivables en laboratoire, la prolifération cellulaire sur milieu de culture constitue la preuve irréfutable de la viabilité cellulaire [13], il n'en va pas de même pour les bactéries marines, pour lesquelles la grande majorité des espèces ne se prête pas à la mise en culture au laboratoire [14].
Sans entrer dans le débat sur la viabilité et la mort cellulaire [13,15,16], l'intégrité membranaire est reconnue comme l'un des principaux critères permettant à la fois de caractériser une cellule vivante et de la distinguer d'une cellule morte. En effet, en isolant les cellules du milieu extérieur, les membranes permettent non seulement de réguler les échanges d'ions et de molécules, mais surtout, elles sont indispensables à l'établissement de la force proton-motrice qui contrôle la synthèse d'ATP suivant la théorie chimiosmotique de Mitchell [17,18].
Nous avons développé le protocole NADS (Nucleic Acid Double Staining) de double marquage des acides nucléiques bactériens, qui permet de distinguer rapidement, par cytométrie en flux au sein des bactéries libres des milieux aquatiques, les cellules viables (actives ou inactives) endommagées ou dont les membranes sont totalement compromises, tout en les distinguant du bruit de fond de l'appareil et des détritus [19].
Le principe de la méthode repose sur l'utilisation simultanée de deux fluorochromes spécifiques des acides nucléiques et sur le transfert d'énergie par résonance qui se produit entre eux lorsqu'ils sont fixés sur les acides nucléiques, à très faible distance l'un de l'autre (<70 Å).
Cet article présente les résultats de la mise en œuvre du protocole NADS dans l'étude de la viabilité des bactéries hétérotrophes dans la baie de Marseille, en situations hivernale et printanière.
2 Principe du protocole NADS
Le protocole de double marquage des acides nucléiques bactériens par cytométrie en flux (NADS) repose sur l'utilisation simultanée de deux colorants fluorescents, marqueurs spécifiques des acides nucléiques, le SYBR Green II (11000 volume/volume de la solution commerciale ; excitation maximale à 254 et 497 nm ; émission maximale à 520 nm) et l'iodure de propidium PI (PI ; 10 μg cm−3 ; excitation maximale à 535 nm ; émission maximale à 617 nm) [20]. Les membranes cellulaires sont perméables au SYBR Green II [21]. En revanche, les membranes plasmiques intactes, caractéristiques des cellules vivantes, sont imperméables au PI, ce qui en fait un bon indicateur de viabilité cellulaire [22–25]. Le PI ne peut donc marquer que les cellules mortes ou endommagées, c'est-à-dire celles qui ont perdu leur intégrité membranaire [26].
Ces deux colorants sont facilement excitables par la lumière bleue d'un laser ou d'une lampe à arc qui équipent généralement les cytomètres analyseurs de routine. L'efficacité du marquage repose sur le transfert d'énergie de fluorescence par résonance (FRET) du SYBR Green vers le PI lorsque ces deux fluorochromes sont fixés à proximité l'un de l'autre sur les acides nucléiques, comme décrit par Barbesti et collaborateurs [27]. Le phénomène de FRET résulte de l'interaction qui se produit entre un fluorochrome donneur d'énergie (le SYBR Green) et un fluorochrome accepteur (le PI) lorsque le spectre d'émission du donneur est en recouvrement avec le spectre d'absorption de l'accepteur et que les molécules du donneur et de l'accepteur sont très proches l'une de l'autre (moins de 7 nm) [28]. Dans le cas du protocole NADS, les deux fluorochromes répondent à ces deux critères, car ils se fixent conjointement sur les acides nucléiques et le spectre d'émission du SYBR Green, centré sur 520 nm, et le spectre d'absorption du PI, centré sur 535 nm, sont bien en recouvrement. L'énergie de fluorescence verte du SYBR Green peut donc être absorbée par le PI dans les conditions requises.
Par conséquent, les cellules dont les membranes sont compromises, donc perméables au PI, fluorescent en rouge alors que les cellules aux membranes intactes, donc imperméables au PI, ne fluorescent que dans le vert (Fig. 1). Les cellules dont les membranes sont partiellement endommagées laissent pénétrer des quantités variables de PI qui se fixe sur les acides nucléiques et entraı̂ne une augmentation de leur intensité de fluorescence rouge au détriment de l'intensité de leur fluorescence verte, en relation directe avec l'importance du transfert d'énergie du SYBR Green sur le PI (Fig. 1). Pour les échantillons marins, le SYBR Green II est préféré au SYBR Green I, car des travaux ont montré qu'il est plus efficace en milieu salé [21].
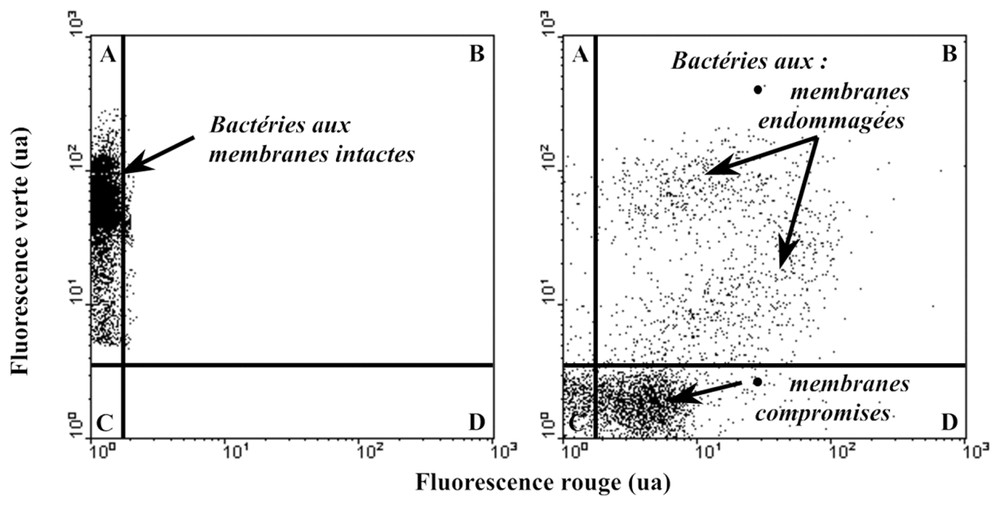
Cytogramme représentant la fluorescence verte versus la fluorescence rouge de suspensions bactériennes analysées suivant le protocole NADS. L'échantillon correspondant au cytogramme de gauche contient essentiellement des bactéries viables (membranes intactes), alors que l'échantillon correspondant au cytogramme de droite ne contient pratiquement que des bactéries endommagées et mortes (membranes faiblement altérées et compromises).
L'analyse des bactéries marines par cytométrie en flux à l'aide du protocole NADS conduit typiquement à des cytogrammes fluorescence verte versus fluorescence rouge, qui caractérisent les cellules suivant la localisation de leurs signaux de fluorescence dans l'un des trois quadrants A, B et D, correspondant respectivement à une fluorescence verte, verte et rouge, et rouge (Fig. 1). Le cadran C correspond au bruit de l'instrument et de l'échantillon (fluorochromes non fixés). Des travaux antérieurs [19] ont démontré, par des méthodes indépendantes, en accord avec la littérature [26], que les bactéries qui fluorescent uniquement dans le vert (car imperméables à PI) peuvent être considérées comme des cellules viables (actives ou inactives) ; celles qui fluorescent à la fois dans le vert et le rouge sont des cellules endommagées, qui laissent pénétrer des quantités variables de PI en raison de l'altération partielle de leurs membranes ; enfin, les cellules qui fluorescent uniquement dans le rouge sont des cellules mortes, car totalement perméables au PI du fait de la perte de leur intégrité membranaire [19,27].
Dans le présent travail, le cytomètre en flux utilisé est le Cytoron Absolute d'Ortho Diagnostic Systems (Roissy, France), équipé d'un faisceau laser argon refroidi par air (longueur d'onde d'émission à 488 nm). Chaque particule est caractérisée par cinq paramètres optiques : diffraction aux petits angles (signal relatif à la taille des particules), diffraction à 90 degrés (signal relatif à la structure interne et à la forme des particules) et trois paramètres de fluorescence mesurant les émissions dans les longueurs d'onde vertes (515–530 nm), oranges (565–592 nm) et rouges (>620 nm). Les données sont collectées en temps réel, en mode liste, à l'aide du logiciel d'acquisition Immuno-count (Ortho Diagnostic Systems), qui permet également d'obtenir directement la concentration cellulaire en cellules mm−3.
3 Sites d'échantillonnage et données météorologiques
Des échantillons d'eau de mer de surface ont été collectés en milieu de matinée le 1er février 2000, juste après un épisode de fort vent de secteur ouest-nord-ouest, et le 30 mars 2000 après une efflorescence printanière et un épisode de fort vent de secteur nord-ouest. Deux stations ont été échantillonnées, situées toutes deux au sud de la ville de Marseille : (i) la station 1, à la pointe du Cap Croisette, considérée comme hors de l'influence directe de la ville ; (ii) la station 2, à l'intérieur même du port de plaisance de la Pointe-Rouge. Les échantillons ont été pré-filtrés sur une soie de porosité 100 μm, afin de prévenir tout risque de colmatage du cytomètre en flux.
Les données météorologiques (température moyenne, minimale et maximale sur la demi-heure écoulée ; vitesse et direction moyenne du vent ; vitesse des rafales ; pluviométrie ; pression atmosphérique) sont celles collectées par le service d'observation du centre d'océanologie de Marseille à la station marine d'Endoume, à l'aide de capteurs aériens. La collecte et le stockage des données sont entièrement automatisés à l'aide d'un micro-ordinateur. L'enregistrement de chacun des paramètres est réalisé à la fréquence de 48 enregistrements par jour (un enregistrement toutes les 30 min).
Les teneurs en chlorophylle a des eaux proviennent des données du Service national d'observation du milieu littoral (SOMLIT) de l'Institut national des sciences de l'univers (Insu). Elles ont été mesurées à la station d'observation Frioul du COM (SOFCOM). Le site d'étude se situe au milieu de l'ouverture vers le large de la rade sud du golfe de Marseille (43°14′300N/5°17′300E). À ce point précis, depuis avril 1994, et tous les 15 jours, la composition des eaux entre la surface et le fond est étudiée. Les profils verticaux de chlorophylle a ont été enregistrés à l'aide d'une bathysonde ECO 57 (ME Meerestechnik Electronik GMBH) équipée d'un fluorimètre à lampe xénon (longueur d'onde d'excitation : 430 nm).
4 Conditions environnementales
La baie de Marseille se caractérise par un vent majoritaire dans le secteur ouest-nord-ouest et nord-ouest (Fig. 2a). L'amplitude des vents varie de 1 à 10 m s−1. La température moyenne de l'air varie de 6 à 16 °C pendant la période de janvier à mars 2000 (Fig. 2b), avec des variations rapides liées aux événements venteux. Le prélèvement d'hiver a été effectué après une rapide augmentation de la température moyenne de l'air (6 à 14 °C), alors que le prélèvement printanier a été effectué après une chute de la température moyenne de l'air (16 à 11 °C). L'évolution de la chlorophylle sur la période du 1er janvier 2000 au 31 mars 2000 à la station SOFCOM est constante sur cinq des six points de prélèvement, sauf l'échantillon du 14 mars 2000, caractérisé par un maximum où la biomasse chlorophyllienne est multipliée par 3 (Fig. 2c).
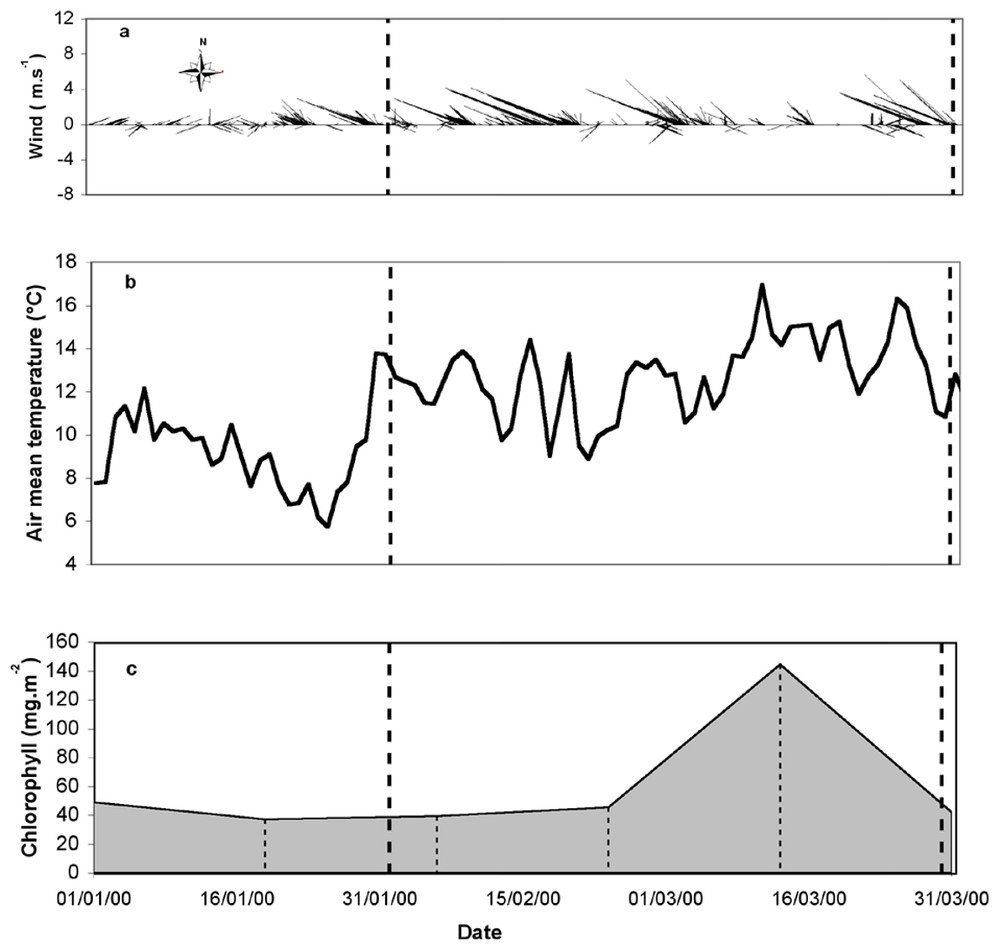
Évolution des paramètres météorologiques enregistrés à la station marine d'Endoume toutes les 30 min : (a) vitesses moyennes du vent, (b) des températures moyennes de l'air en degrés Celsius) et (c) de l'évolution de la teneur en chlorophylle a mesurée dans la baie de Marseille intégrée entre la surface et 55 m de profondeur à la station SOFCOM lors du premier trimestre 2000. Les dates d'échantillonnage sont représentées par les lignes pointillées verticales.
5 Abondances des groupes bactériens définis par le protocole NADS
Les abondances des bactéries aux membranes intactes, endommagées et compromises mesurées aux deux stations le 1er février et le 30 mars sont regroupées au sein du Tableau 1. Chaque abondance correspond à la valeur moyenne issue de duplicats. L'influence de la saison, du site d'échantillonnage et de l'état physiologique sur les dénombrements bactériens est résumée dans le Tableau 2.
Résultat de l'analyse ANOVA sur l'influence des sites (station 1 ou 2), de la saison (hiver ou printemps) et de l'état physiologique (cellules viables ou endommagées–mortes) sur les abondances bactériennes
| Facteurs | Effet | |
| Station | +++ | p<0,001 |
| Période | +++ | p<0,001 |
| État | +++ | p<0,001 |
| État × période | +++ | p<0,001 |
| Station × état | ++ | p=0,003 |
| Période × état | +++ | p<0,001 |
| Station × période × état | +++ | p<0,001 |
Quelle que soit la période considérée, la concentration bactérienne totale est significativement plus importante à la station 2 (>7,5×105 cellules cm−3) qu'à la station 1 (<5,0×105 cellules cm−3) (F-test, p<0,001). Cette différence entre les stations est d'un facteur 3 le 1er février et d'un facteur 1,8 le 30 mars.
Les abondances totales observées aux deux stations le 30 mars sont significativement supérieures à celles du 1er février (F-test, p<0,001). L'accroissement représente plus de 96 % à la station 1 (2,51×105 cellules cm−3 en février contre 4,94×105 cellules cm−3 en mars) et plus de 17 % à la station 2 (7,56×105 cellules cm−3 en février contre 8,87×105 cellules cm−3 en mars).
Le 1er février, aux deux stations, la contribution des bactéries viables (membranes intactes) était supérieure à celles des bactéries aux membranes endommagées et compromises (respectivement 54,1, 18,4 et 27,5 % à la station 1 et 96,7, 2,1 et 1,2 % à la station 2 ; Tableau 1). Les bactéries intactes étaient encore prépondérantes (61,6 %) le 30 mars à la station 2 par rapport aux bactéries endommagées (5,1 %) et compromises (33,3 %). En revanche, à la station 1, ce sont les bactéries compromises qui dominaient le 30 mars, avec une contribution de 53,3 % contre 41 % pour les bactéries intactes et 5,6 % pour les bactéries endommagées (Tableau 1).
Le 30 mars, aux deux stations, les concentrations en bactéries compromises étaient voisines (2,64×105 cellules cm−3 à la station 1 et 2,95×105 cellules cm−3 à la station 2) et significativement supérieures à celles du 1er février (Tableau 1, F-test, p<0,001). Toutefois, la proportion de bactéries compromises s'est avérée dans les deux cas significativement plus importante à la station 1 qu'à la station 2 (respectivement 27,5 et 1,2 % le 1er février et 53,3 et 33,3 % le 30 mars, F-test, p<0,001 ; Fig. 3).
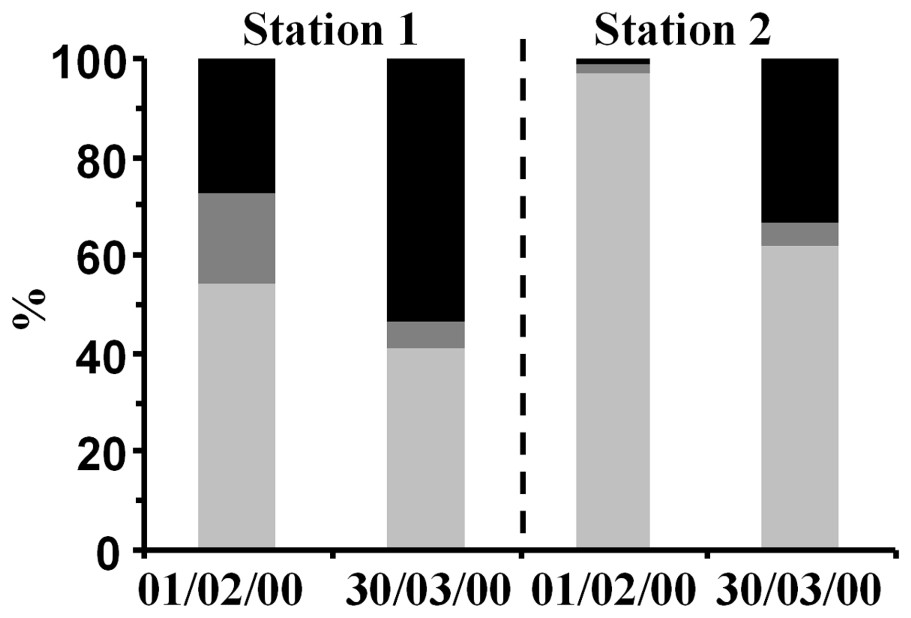
Contribution relative des sous-populations bactériennes définies par le protocole NADS au pool total de bactéries dans la baie de Marseille, en deux stations contrastées, au large (station 1) et dans un port de plaisance (station 2) : bactéries viables (), bactéries endommagées (), bactéries mortes ().
Entre le 1er février et le 30 mars, les concentrations de bactéries intactes et endommagées aux deux stations étudiées ont varié de façon opposée (Tableau 1). Les bactéries intactes à la station 1 étaient plus abondantes de 49 % le 30 mars que le 1er février (respectivement 2,03 et 1,36×105 cellules cm−3), alors qu'à la station 2, elles avaient diminué de 25 % pendant la même période (de 7,32 à 5,47×105 cellules cm−3). Cependant, leur contribution à l'abondance bactérienne totale était significativement plus élevée à la station 2 qu'à la station 1, avec respectivement 96,7 contre 54,1 % le 1er février et 61,6 contre 41 % le 30 mars (F-test, p<0,001, Fig. 3).
Enfin, les bactéries endommagées étaient significativement plus abondantes à la station 1 le 1er février que le 30 mars, avec respectivement 0,46 et 0,28×105 cellules cm−3 (F-test, p<0,001), soit une prédominance d'environ 39 % (Tableau 1). Au contraire, à la station 2, l'abondance des bactéries endommagées le 1er février était significativement inférieure de près de 64 % à celle du 30 mars (respectivement 0,16 et 0,45×105 cellules cm−3, F-test, p<0,001). Leur contribution à l'abondance bactérienne totale était plus élevée à la station 1 qu'à la station 2, avec respectivement 18,4 contre 2,1 % le 1er février et 5,6 contre 5,1 % le 30 mars (Tableau 1, Fig. 3).
6 Interprétation de l'hétérogénéité des abondances des sous-populations bactériennes définies par le protocole NADS
L'analyse des échantillons marins par le protocole NADS permet non seulement de rendre compte de l'hétérogénéité spatio-temporelle des abondances bactériennes totales, mais aussi de l'hétérogénéité spatio-temporelle des abondances des différents états physiologiques (Tableau 1).
D'un point de vue spatial, l'abondance bactérienne à la station 2 était nettement supérieure (plus de 44 %) à celle de la station 1, quelle que soit la période considérée. Ceci peut s'expliquer par le choix de cette station à l'intérieur d'un port de plaisance avec des conditions hydrologiques très propices aux développements bactériens (apports plus importants de matière organique et aussi de bactéries allochtones par lessivage des sols et par les navires ; baie plus abritée, avec moins de courant, etc.).
D'un point de vue temporel, les abondances bactériennes totales mesurées aux deux stations le 30 mars étaient supérieures à celles mesurées le 1er février. Cette plus forte abondance bactérienne s'explique en prenant en compte l'évolution temporelle, au cours de la même période, de la distribution verticale de la chlorophylle a à la station SOFCOM (Fig. 2c). Les observations mettent en évidence une efflorescence phytoplanctonique printanière, qui a débuté aux alentours du 14 mars et qui a très probablement enrichi le milieu en matière organique (particulaire et dissoute) par voie d'excrétion, de lyse virale et de prédation du phytoplancton. Or, on sait qu'il existe un couplage étroit entre production phytoplanctonique et production bactérienne [29–32], car les bactéries hétérotrophes sont capables d'utiliser le carbone provenant de la lyse et de l'excrétion des micro-algues. C'est cette disponibilité en ressources trophiques qui expliquerait la plus forte abondance bactérienne observée au printemps.
Indépendamment de la disparité des concentrations des bactéries viables (membranes intactes) vis-à-vis des stations et des dates, le pourcentage des bactéries viables était plus important le 1er février que le 30 mars aux deux stations (Tableau 1). Par voie de conséquence, le pourcentage de l'ensemble des bactéries endommagées et mortes était plus important le 30 mars que le 1er février aux deux stations également (Tableau 1). La température de l'eau ne constituait pas un facteur de régulation de l'abondance des groupes physiologiques de bactéries, car elle était stable sur la période étudiée (comprise en surface entre 12 et 13 °C du 1er janvier au 5 avril 2000 ; données SOFCOM–SOMLIT non reproduites).
Les enregistrements météorologiques réalisés à la station marine d'Endoume ne montrent aucune précipitation susceptible d'avoir modifié par petit fond (station 2) la salinité de l'eau qui n'a varié qu'entre 37,8 et 38,1 entre le 25 janvier et le 29 mars, sauf pour le prélèvement du 14 mars, pour lequel la salinité est comprise entre 37,4 et 37,7 (données SOFCOM–SOMLIT non reproduites). Lors des journées de prélèvement des 1er février et 30 mars, la température de l'air a subi des variations identiques, entre 10 et 20 °C (Fig. 2b). Toutefois, il est à noter que la température de l'air a subi des évolutions distinctes dans les cinq jours qui ont précédé les prélèvements. Pour la période qui précède le 1er février, un rétablissement thermique progressif suit l'épisode de fort mistral (secteur ouest-nord-ouest) qui a débuté le 28 janvier, avec des vents de 10 m s−1 en moyenne sur 30 min et des rafales à plus de 20 m s−1. Le prélèvement du 30 mars se situe au contraire après un épisode de vent dans le secteur nord-ouest (Fig. 2a).
L'efflorescence printanière de mars a favorisé le développement des bactéries hétérotrophes (augmentation de leur abondance, Tableau 1). Il est tout aussi raisonnable de penser que cette efflorescence a favorisé le développement de leurs prédateurs (flagellés et ciliés par exemple). Or, il est établi que les prédateurs bactériens préfèrent les cellules de plus grande taille [33] et actives (donc viables) [34]. Le plus faible pourcentage de bactéries viables le 30 mars que le 1er février serait donc dû à leur prédation préférentielle, favorisée de plus par les conditions de mer calme qui ont précédé les prélèvements du 30 mars. Plusieurs travaux [35–37] ont établi que le broutage des bactéries viables s'accompagne d'une augmentation du nombre de bactéries endommagées et/ou mortes [12]. Conformément à ce résultat, nous avons effectivement observé une augmentation du nombre et du pourcentage des cellules mortes et endommagées juste après l'efflorescence de printemps (Tableau 1, Fig. 3), période où le développement des prédateurs de bactéries est stimulé par l'abondance phytoplanctonique. Inversement, en hiver, une moindre abondance des prédateurs bactériens induit une pression de prédation moins importante. Les bactéries viables, moins broutées, représentent un pourcentage plus important dans le dénombrement global des bactéries, comme cela a été observé le 1er février (Tableau 1). Le rayonnement UV aurait pu être considéré comme un responsable potentiel de la plus grande altération des cellules bactériennes au printemps. En effet, considérées isolément, les bactéries sont susceptibles d'être particulièrement affectées par le rayonnement UV, du fait de leur petite taille et de leur temps de génération relativement court [38–40]. En réalité, il en va tout autrement dans le milieu naturel. En effet, des travaux récents [40] ont montré que l'exposition à un rayonnement UV légèrement supérieur à la dose naturelle avait un effet global positif sur les bactéries hétérotrophes, qui se traduisait par une augmentation d'abondance de 49 %. L'implication des prédateurs s'avère donc plus vraisemblable que celle du rayonnement UV dans l'hétérogénéité de l'état physiologique des bactéries.
Le pourcentage des bactéries endommagées était significativement plus faible que celui des deux autres sous-populations (18,4 % pour la station 1 le 1er février et <6 % pour les autres mesures). Cette faible représentation suggère que l'état de « cellule endommagée » soit vraisemblablement transitoire et éphémère. Faute de réparation rapide, les membranes altérées doivent se dégrader très vite, supprimant définitivement les fonctions bioénergétiques des cellules affectées et entraı̂nant leur mort.
7 Conclusion
Le protocole NADS, développé pour tester l'intégrité membranaire des bactéries des milieux aquatiques [19] et en déduire leur viabilité, a été appliqué avec succès dans une étude de la viabilité bactérienne dans deux sites contrastés de la baie de Marseille, en période hivernale et après l'efflorescence de printemps. Dans la période d'observation, l'abondance bactérienne totale était plus élevée après l'efflorescence qu'en hiver et elle était plus élevée dans le port de plaisance qu'au large, très probablement à cause d'un apport important et soutenu de matière organique d'origine anthropique.
Au large, la proportion des bactéries mortes et endommagées était de 46 % en hiver et de 59 % en fin d'efflorescence. La diminution du pourcentage de bactéries viables, malgré le doublement de la population totale, est à mettre sur le compte de la prédation, stimulée par l'efflorescence printanière et s'opérant préférentiellement sur les bactéries viables. La responsabilité du rayonnement UV a été écartée sur la base de travaux récents montrant un effet global positif pour les bactéries hétérotrophes dans le milieu naturel.
Dans le port de plaisance, l'abondance totale élevée (7,56×105 cellules cm−3) des bactéries en hiver et le taux très fort (97 %) de bactéries viables témoignent d'une influence importante de l'activité humaine, l'apport en matière organique s'avérant prépondérant par rapport à d'éventuels contaminants létaux (peintures antifouling et autres). La baisse du pourcentage (de 97 à 62 %) des bactéries viables dans le port de plaisance après la phase d'efflorescence suggère que le développement des prédateurs de bactéries serait davantage lié à l'efflorescence phytoplanctonique qu'à la présence de bactéries saines en grande abondance.
À partir de cet exemple d'étude de la viabilité bactérienne dans la baie de Marseille et de l'analyse des sous-populations qui la caractérisent (bactéries viables, endommagées et mortes), on peut considérer que le protocole NADS, utilisé à notre connaissance pour la première fois dans des eaux côtières méditerranéennes, permet d'accéder à des informations nouvelles sur les communautés bactériennes et d'obtenir une meilleure connaissance de l'état physiologique, de la dynamique et du fonctionnement de l'écosystème microbien.
Remerciements
Les auteurs remercient l'Insu–CNRS, l'université de la Méditerranée ainsi que le conseil régional Provence-Alpes-Côte-d'Azur pour leur soutien financier.


