1 Introduction
Les cas de troubles dégénératifs rénaux ont été nombreux au cours de ces dernières décades [1,2]. Parmi les facteurs en cause, on cite les polluants environnementaux tels que les métaux lourds (Pb, Cd, Ni), les produits chimiques utilisés dans l'agriculture et l'industrie, les produits nutritionnels contaminés, les gaz d'échappement des véhicules automobiles...
Diverses études suggèrent que la malnutrition, lorsqu'elle induit une déficience en minéraux (Ca2+, Fe2+, Zn2+, Cu2+ et Mg2+), peut amplifier les effets nocifs des polluants environnementaux sur diverses fonctions.
En 1992, Gerhard [3] a rapporté qu'une déficience en Ca2+ augmente les perturbations induites par les métaux lourds. Chosh [4] a observé que les effets du Pb au niveau du système nerveux étaient aggravés chez des rats mal nourris. Newberne [5] a montré également que l'exposition au Ni de rats adultes souffrant d'une déficience minérale surtout en Mg amplifie le taux des maladies rénales.
Inversement, divers auteurs ont observé que la restriction calorique augmente la longévité et retarde la vieillesse. Lebourg [6] a montré que des rats sous-alimentés avaient des longévités moyennes et maximales supérieures à celles des animaux nourris à volonté, à condition de prendre la précaution de ne pas induire de déficience en sels minéraux. Weindruch [7] a comparé deux lots de souris de 30 mois, l'un nourri normalement et l'autre avec un apport calorique réduit à 26 %. Il a observé que le régime hypocalorique diminuait de 30 à 60 % l'expression des gènes liés au vieillissement. De même, Thorenton [8] a montré que la restriction calorique a tendance à diminuer les maladies cancéreuses provoquées par le stress oxydant et les réactions inflammatoires.
Le nickel (Ni) est un cancérigène responsable de certains cancers du poumon en milieu professionnel. Chez l'animal, il s'accumule au niveau des reins, où il induit des lésions au niveau des glomérules et une protéinurie [9,10]. Diverses études ont montré que, pour se protéger vis-à-vis de la toxicité des métaux lourds (Pb, Cd, Mg, Zn, Ni...), l'organisme dispose d' un mécanisme physiologique de défense, formé par les protéines de stress et les métallothionéines [11,12].
Notre travail a pour but d'explorer l'impact du nickel sur la fonction rénale chez des rats de souche « Wistar », et d'évaluer les effets d'un jeûne intermittent associé, afin d'établir si ce jeûne intermittent peut être considéré comme une restriction calorique bénéfique pour le corps, qui le protège contre les effets cytotoxiques du nickel. Comme biomarqueurs rénaux, nous avons choisi la créatininémie, l'urémie, la créatininurie, l'urée urinaire et l'histologie rénale.
Le stress oxydatif a été évalué par le dosage des protéines de stress (Hsp72) et des métallothionéines (MT).
2 Matériels et méthodes
2.1 Animaux
Notre étude a été réalisée sur 100 rats mâles et 100 rats femelles de souche « Wistar », de poids corporel moyen voisin de 180 g pour les mâles et 130 g pour les femelles. Ces animaux sont groupés par groupe de huit par cage, dans une animalerie où la température ambiante était voisine de 23 °C avec hygrométrie stable, munie d'un système de ventilation et d'un système réglant les périodes d'obscurité (10 h) et de lumière (14 h). Les animaux étaient nourris de granulés équilibrés sur le plan énergétique (SICO, Sfax, Tunisie).
L'alimentation, qualitativement équilibrée par rapport aux normes internationales, est à base de blé, de son fin, de luzerne, de soja et de composés minéralovitaminés à base de phosphate bi-calcique, de carbonate de chaux, d'oligo-éléments et de vitamines.
2.2 Traitement
Les rats mâles et femelles, âgés de trois mois, ont été répartis en deux lots, l'un recevant chaque jour 20 g de nourriture par animal (groupe N), et l'autre recevant la même quantité de nourriture un jour sur deux (groupe J), et ceci pendant un mois. Dans les deux cas, la nourriture est donnée à raison de 20 g par rat, ce qui empêche les animaux soumis au jeûne de compenser ce qu'ils n'ont pas mangé le jour de la privation de nourriture.
Après un mois, chaque lot a été divisé en deux groupes, l'un recevant une eau de boisson normale à base d'eau de robinet (groupes NO et J0) et l'autre recevant de l'eau de boisson enrichie en nickel (100 mg de NiCl2 par litre, groupes NNi et JNi). La dose est choisie d'après la bibliographie [13,14] ; il s'agit d'une dose proche de celles de nos conditions environnementales dans certaines régions polluées. Ce traitement a été poursuivi pendant 2, 4, 10, 16, 30 et 60 jours. Sachant que les rats boivent environ 10 ml par jour, on peut estimer qu'ils ont ingéré chaque jour 1 mg de NiCl2.
Pour le dosage des Hsp et des MT, le Ni a été injecté par voie intra péritonéale, à raison de 4 mg de NiCl2 par kg de poids corporel par jour [14], et ceci pendant 10 jours.
L'injection est réalisée dans le but d'observer un effet rapide.
Les animaux sont pesés chaque jour durant toute la durée de l'expérimentation.
2.3 Sacrifice
Le sacrifice des animaux mâles et femelles a été effectué le jour où les animaux avaient été nourris dans les mêmes conditions que celles de l'animalerie, et toujours dans la matinée, afin d'éviter les variations dues au rythme circadien.
2.4 Prélèvement des échantillons
Les prélèvements sanguins ont été faits après décapitation rapide ; le sang artério-veineux a été recueilli, soit sans anticoagulant, puis centrifugation, pour la détermination du taux de la créatinine sérique, soit sur EDTA, puis centrifugation durant 15 min à 4000 tours min−1 pour la mesure du taux de l'urée plasmatique. Tous les échantillons sont stockés à −30 °C en attendant les dosages.
Pour chaque animal, un rein est plongé rapidement dans un liquide de Bouin alcoolique (fixateur) pour la réalisation des coupes histologiques, l'autre est stocké à −80 °C pour le dosage des protéines de stress (Hsp) et des métallothionéines (MT).
Juste avant le sacrifice, les urines sont collectées sur papier aluminium, pour la détermination des taux de créatininurie et d'urée urinaire.
2.5 Dosages biochimiques
2.5.1 Bilan minéral
Les taux de Fe2+, Mg2+ et K+ rénaux sont déterminés par absorption atomique, après minéralisation nitroperchlorique en phase liquide
2.5.2 Créatinine sérique et urinaire
Le principe est basé sur la réaction de Jaffé. Après déprotéinisation sulfotungstique, la créatinine réagit avec le picrate en milieu alcalin, pour donner une coloration jaune orangée, évaluée au spectrophotomètre à 510 nm (coffret Merck, A022812 et 0248).
2.5.3 Urée plasmatique et urinaire
Le dosage de l'urée est effectué par méthode enzymatique à l'uréase (kit Bio Maghreb, réf. 2011, lot n°601).
2.6 Histologie du rein
Nous avons suivi les étapes classiques de l'histologie Gabe [15]. Pour la coloration, nous avons utilisé la technique à l'hématoxyline éosine (HE), comportant un bain de 5 min d'hématoxyline (MERCK), qui colore en bleu violacé les structures basophiles (noyaux), un bain de HCl 1 % pour différencier les coupes et obtenir une coloration rose, un bain de 3 min en milieu carbonate de lithium pour colorer en bleu les coupes et un bain de 5 min dans l'éosine pour colorer les structures acidophiles (cytoplasme). Tous ces bains sont séparés par des lavages à l'eau de robinet. Les coupes sont observées au microscope optique (Leitzdialuxe 22) et photographiées à l'aide d'un appareil photo (Leicawild MP 48).
2.7 Dosage des protéines de stress
Le dosage des protéines de stress nécessite d'abord une extraction des organes dans le tampon (TBS + EDTA).
2.7.1 Dosage des protéines totales par la méthode de Lowry
Le dosage des protéines des homogénats ainsi obtenus a été réalisé selon la méthode de Lowry [16]. Un volume déterminé (10 μl) d'homogénat protéique a été mis en présence d'une solution alcaline de sulfate de cuivre et de tartrate de sodium pendant 15 min, puis on a rajouté le réactif de Folin pendant 45 min. L'absorbance est mesurée à 750 nm au spectrophotomètre. La courbe d'étalonnage a été réalisée par l'albumine bovine (BSA).
2.7.2 Électrophorèse dans le gel de polyacrylamide–SDS en une dimension
L'électrophorèse a été réalisée suivant la méthode de Laemmli [17]. Elle permet de séparer les protéines en fonction de leur poids moléculaire apparent. Le dodecyl sulfate de sodium (SDS), que l'on rajoute dans l'extrait protéique, est un détergent qui confère aux protéines une charge négative, en se liant au niveau de leurs régions hydrophobes, et détruit leur organisation spatiale. La séparation électrophorétique des protéines a été réalisée à l'aide d'un système (Block Scientific). Les gels de 1 mm d'épaisseur ont été coulés entre deux plaques de verre, préalablement dégraissées à l'alcool et rincées à l'eau distillée.
La partie inférieure était remplie de tampon de migration. Dans la partie supérieure, les peignes ont été enlevés et le gel a été recouvert d'un tampon de migration. Les extraits protéiques ont été dilués volume/volume dans un tampon échantillon. Des quantités correspondant à 20 μg de protéines ont été déposées dans chaque puits. La migration a été réalisée à 160 V, à température ambiante, et arrêtée lorsque le front de bromophénol a atteint le bas du gel (1 h 30 min).
2.7.3 Électrotransfert (Western blotting) et révélation des protéines transférées
Le gel a été placé pendant 10 min dans le tampon de transfert. Il a ensuite été mis au contact de la feuille de nitrocellulose (0,45 μm) dans un système sandwich. Le tout a été placé dans le système de transfert semi-sec. Le transfert a été réalisé à 25 V durant 20 min.
La membrane de nitrocellulose a été immergée dans un bain de rouge ponceau. La présence de protéines colorées nous a permis de vérifier que le transfert était correct et de marquer les protéines de poids moléculaire standard.
2.7.4 Immunodétection et quantification des protéines de stress sur Western blot
Afin de saturer les sites non spécifiques, la membrane de nitrocellulose a été incubée pendant 2 h à 37 °C dans le tampon (TBS–Tween 20).
La membrane a ensuite été incubée en présence des anticorps monoclonaux primaires spécifiques des protéines de stress : Ig G de souris anti Hsp72.
Après une incubation à 8 °C, les anticorps non fixés ont été éliminés par lavage, puis la membrane a été incubée pendant 2 h en présence de l'anticorps secondaire anti Ig G de souris. Après lavage, la membrane de nitrocellulose a été placée pendant 5 min en présence de ECL.
Après révélation du film, une analyse assistée par ordinateur (logiciel Photo Capt) de la surface et de l'intensité des bandes immunoréactives a permis de quantifier l'expression des protéines de stress.
2.8 Dosage des métallotionéines (MT)
Les MT ont été dosées par la technique au 109Cd décrite par Ohtha [18], après extraction dans le tampon d'homogénéisation (saccharose 0,25 M). Cette méthode est basée sur la forte affinité des MT pour le cadmium, avec lequel elles se lient avec une bonne stabilité à pH faible et à haute température.
Le taux de radioactivité dans le surnagent est déterminé par comptage direct. Le taux des MT (exprimée en potentiel de liaison du cadmium) dans chaque échantillon est estimé en nombre de moles de Cd lié par gramme d'organe frais.
2.9 Statistiques
Les résultats sont présentés sous forme de moyenne ±SEM. Les comparaisons entre groupes témoins et groupes traités sont réalisées par un test t de Student,
3 Résultats
3.1 Bilan minéral
Les résultats montrent que les teneurs en fer, en magnésium et en potassium ne sont significativement modifiées dans le rein (Fig. 1), ni par le rythme de prise de nourriture (jeûne intermittent ou non), ni par l'exposition au Ni.
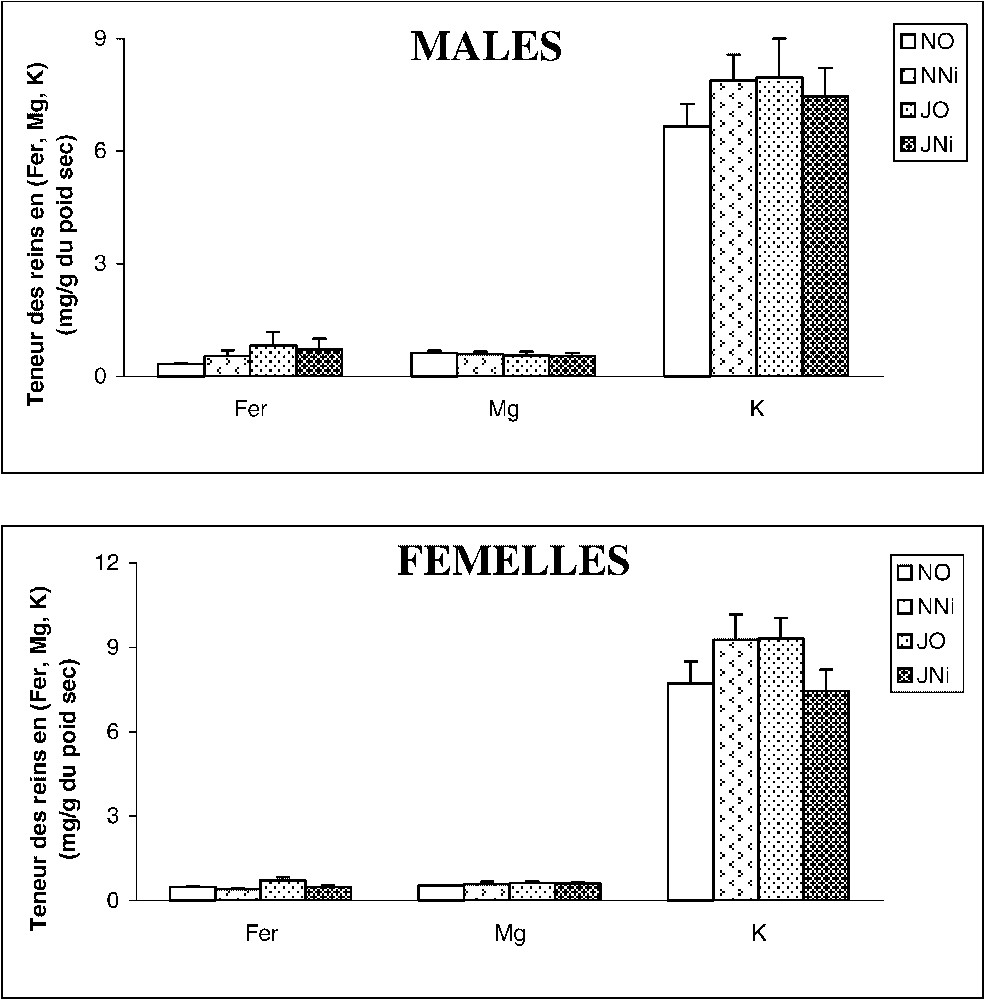
Évolution du taux de (Fe2+, Mg2+, K2+) au niveau des reins chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 60 jours. Nombre de déterminations par groupe : 6.
Les concentrations sériques de P5+, Ca2+ et Mg2+ sont présentées sur la Fig. 2. Il apparaît également que la concentration sérique de ces minéraux n'est pas perturbée chez les rats soumis au jeune intermittent et/ou exposés au nickel.
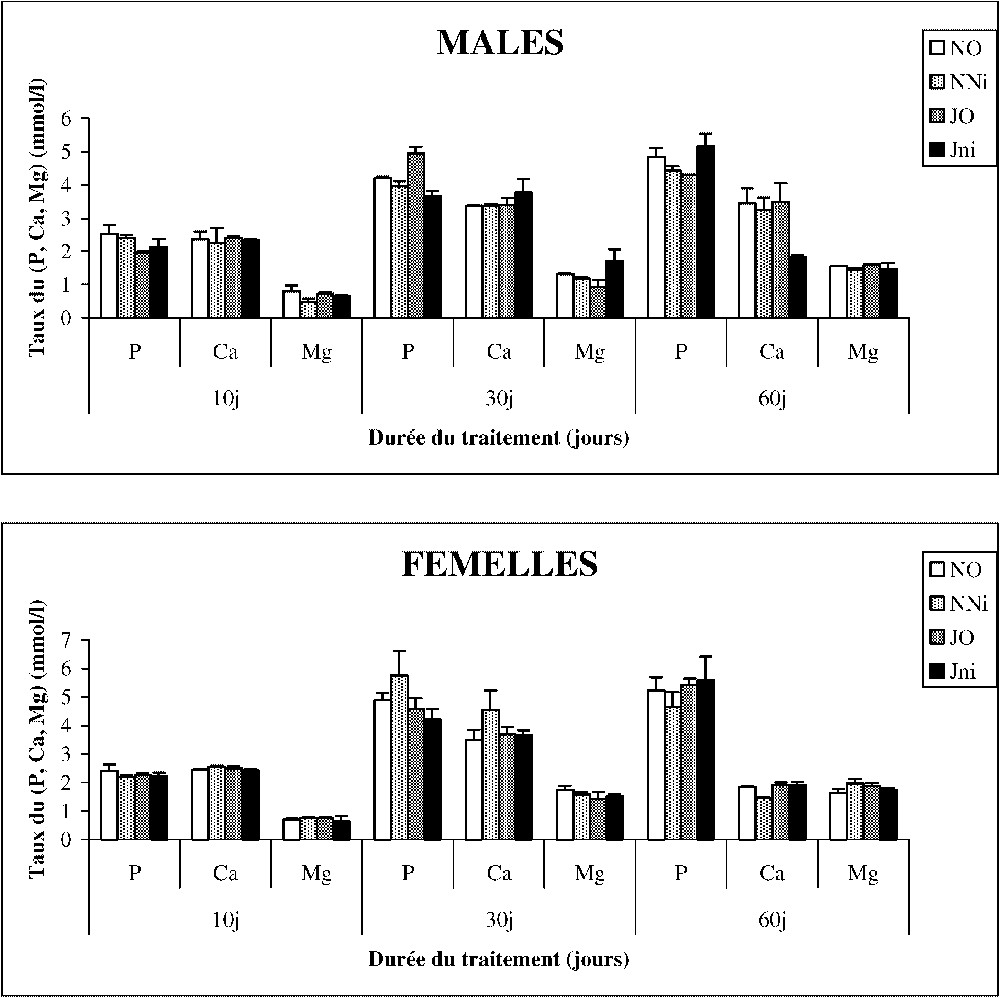
Évolution du taux du (P5+, Ca2+, Mg2+) dans le sérum (mmol l−1) chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 60 jours. Nombre de déterminations par groupe : 6.
3.2 Biomarqueurs rénaux
3.2.1 La créatinine sérique
Le nickel induit chez les rats mâles et femelles nourris d'une façon normale une augmentation significative de la créatininémie entre le 10e et le 16e jour du traitement. En conditions de jeûne intermittent, on note une diminution de la créatininémie à partir du 4e jour de traitement, chez les deux sexes. Dans le cas des rats soumis au jeûne associé au nickel, celui-ci ne semble pas affecter significativement le taux de la créatinine sérique (Fig. 3).
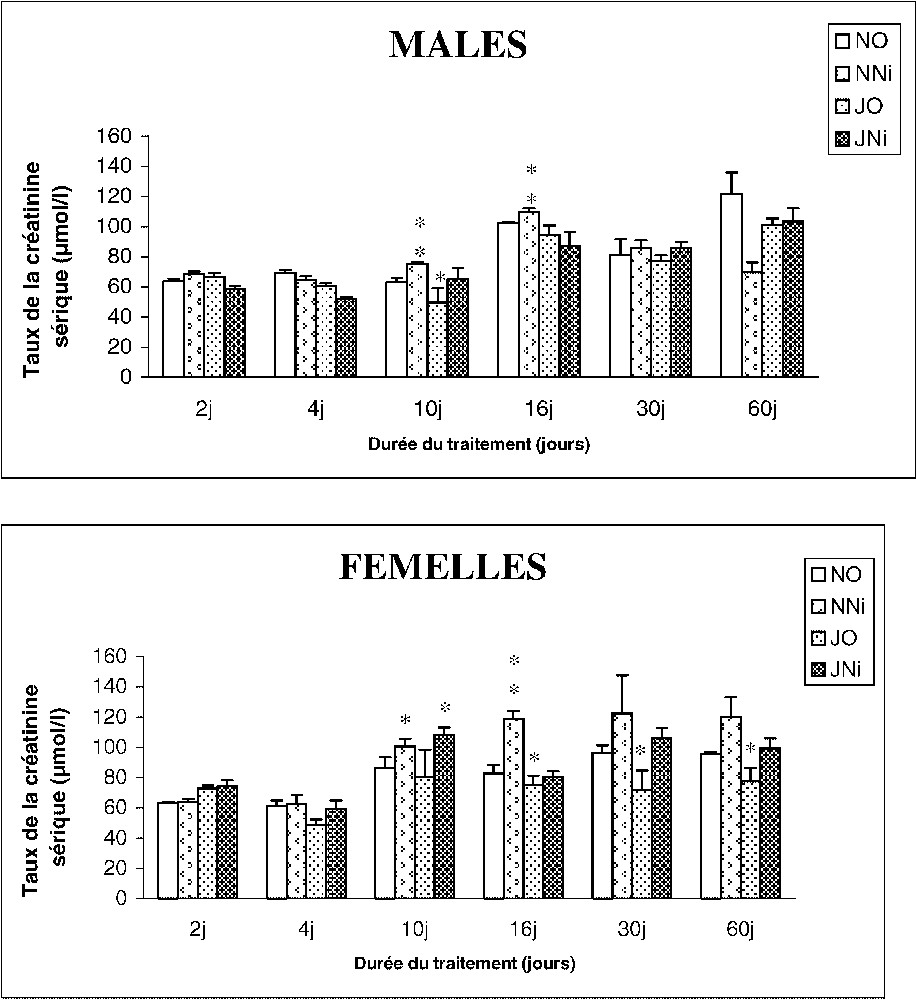
Évolution du taux de la créatinine sérique (μmol l−1) chez des rats soumis (J) ou non (N) à un Jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 jours. ∗ : p⩽0,05 par comparaison avec les rats témoins (NO) ; ∗∗ : p⩽0,01 par comparaison avec les rats témoins (NO). Nombre de déterminations par groupe : 8.
3.2.2 L'urée plasmatique
La détermination de l'urémie montre une augmentation chez les mâles et les femelles nourris et traités par le nickel entre le 10e et le 16e jour. En revanche, le jeûne intermittent révèle une diminution de l'urémie chez les (JO) pour les deux sexes. Associé au jeûne intermittent, le nickel ne semble pas induire de variations de l'urémie (groupe JNi) (Fig. 4).
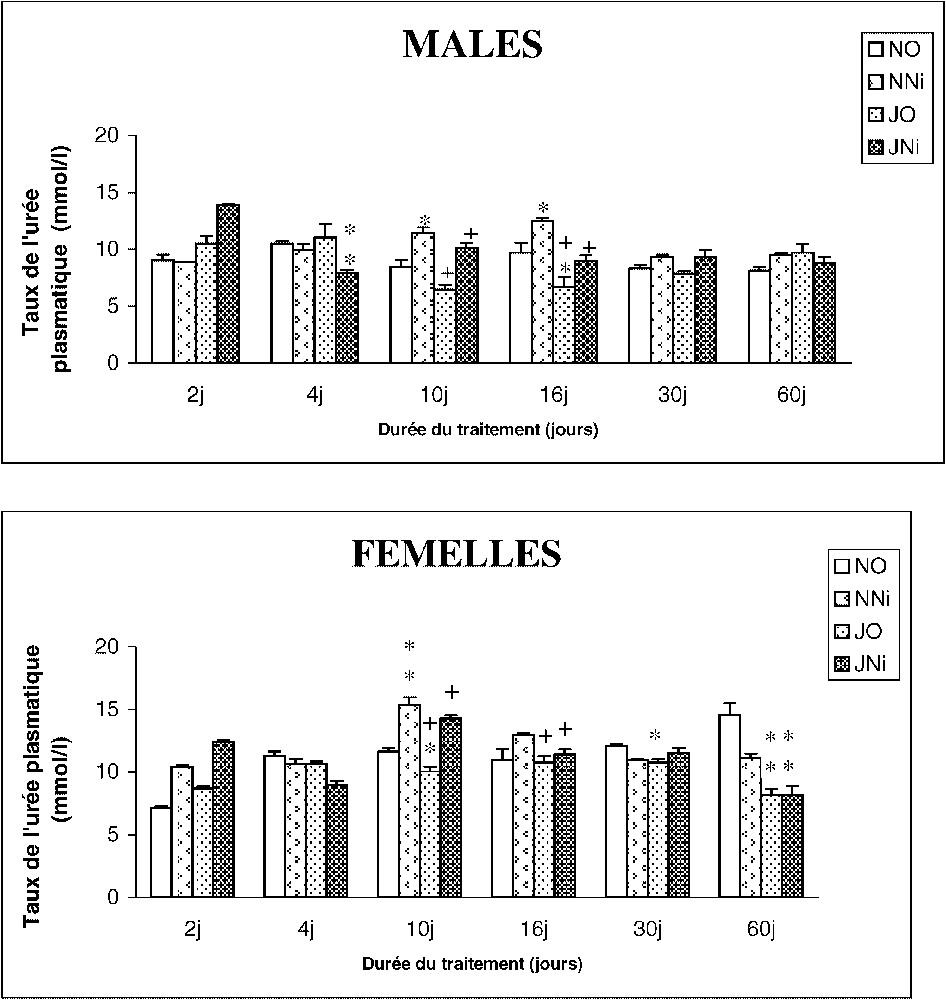
Évolution du taux de l'urée plasmatique (mmol/l) chez des rats soumis (J) ou non (N) à un Jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 jours. ∗ : p⩽0,05 par comparaison avec les rats témoins (NO) ; ∗∗ : p⩽0,01 par comparaison avec les rats témoins (NO) ; + : p⩽0,05 par comparaison avec les rats (NNi) ; ++ : p⩽0,01 par comparaison avec les rats (NNi). Nombre de déterminations par groupe : 8. Masquer
Évolution du taux de l'urée plasmatique (mmol/l) chez des rats soumis (J) ou non (N) à un Jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 jours. ∗ : ... Lire la suite
3.2.3 La créatininurie
L'évolution de la créatininurie pour les (NNi) mâles et femelles ne fait pas apparaître de variation significative par rapport aux témoins (NO). Toutefois, une diminution significative est observée chez les rats soumis au jeûne intermittent (JO), mâles et femelles, par rapport aux témoins. Chez les rats (JNi), on note au contraire une augmentation de ce paramètre par rapport aux (JO) (Fig. 5).
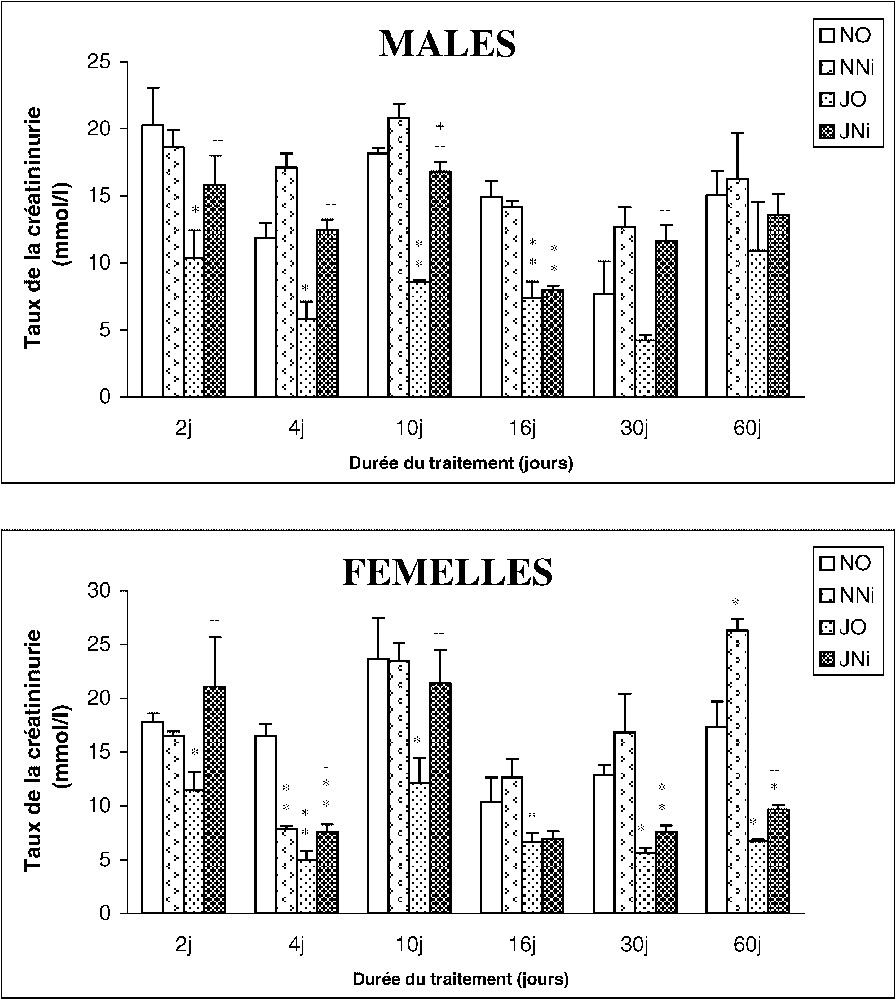
Évolution du taux de la créatininurie (mmol l−1) chez des rats mâles et femelles soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 jours. ∗ : p⩽0,05 par comparaison avec les rats témoins (NO) ;
Évolution du taux de la créatininurie (mmol l−1) chez des rats mâles et femelles soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 ... Lire la suite
3.2.4 L'urée urinaire
La détermination du taux d'urée urinaire ne montre pas de variation significative chez les rats mâles et femelles traités par le nickel. Chez les rats soumis au jeûne intermittent (JO), on note une diminution de ce taux par rapport aux témoins. Toutefois, chez les (JNi) une augmentation significative de ce paramètre par rapport aux (JO) est détectée (Fig. 6).
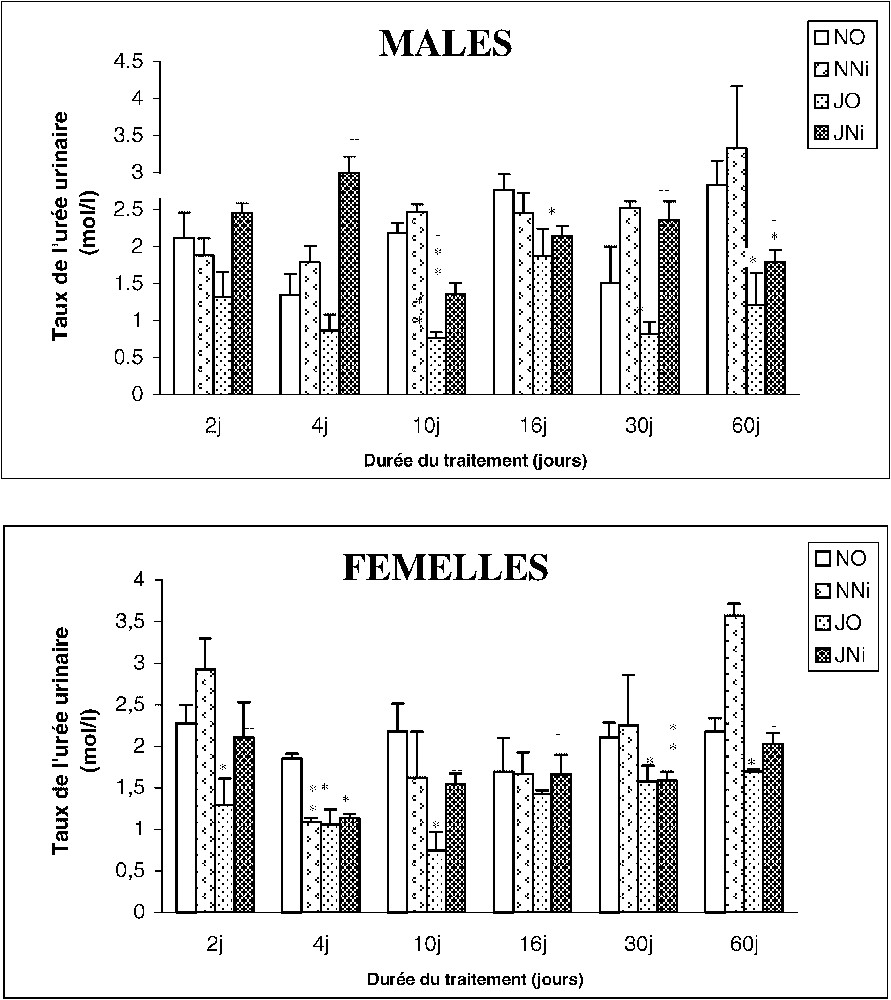
Évolution du taux de l'urée urinaire (mmol/l) chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 jours. ∗ : p⩽0,05 par comparaison avec les rats témoins (NO) ;
Évolution du taux de l'urée urinaire (mmol/l) chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 2, 4, 10, 16, 30 et 60 jours. ∗ : ... Lire la suite
3.3 Étude histologique
L'histologie des reins montre, chez les rats traités au nickel, une altération structurale de la zone corticale, les capsules de Bowman adhérant aux glomérules aux dépends de l'espace des chambres urinaires, qui diminue beaucoup. Au niveau du tube urinaire, principalement du tube proximal, on note une vacuolisation et une hypertrophie des cellules épithéliales aux dépends de l'interstitium rénal et des vaisseaux rénaux, qui se trouvent comprimés, ce qui rendrait difficile les fonctions de filtration, de réabsorption et de sécrétion tubulaire. Ces perturbations histologiques sont maximales aux 10e et 16e jours chez les sujets traités par rapport aux témoins (Fig. 7).
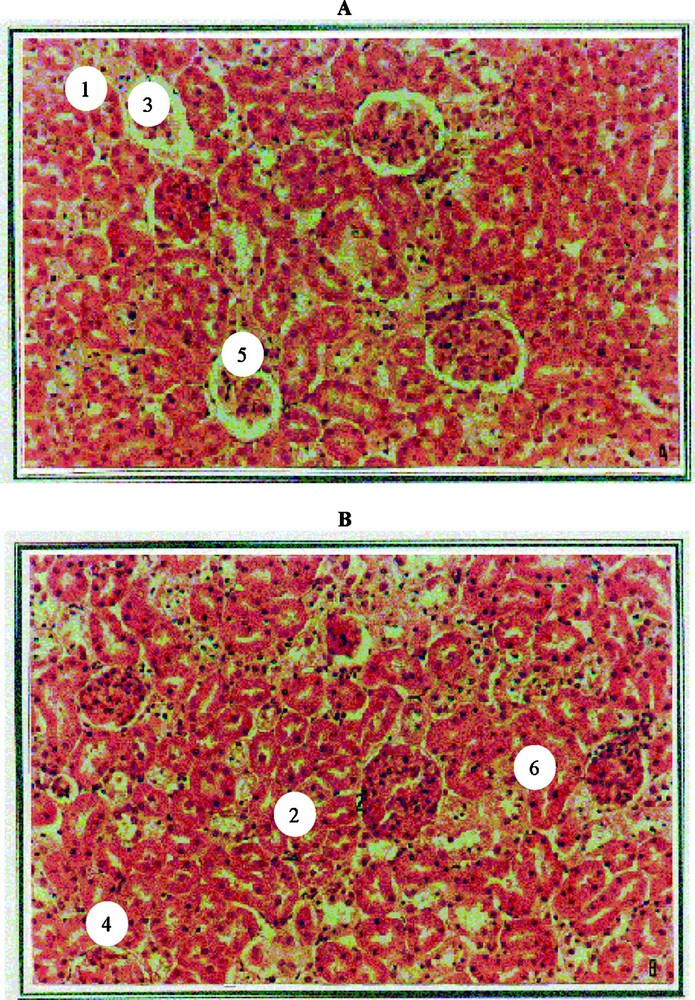
Observation de glomérules et de tubes rénaux normaux « A » (réalisés sur une coupe de rein d'un rat témoin (NO)) et de glomérules et de tubes rénaux atteints « B » (réalisés sur une coupe de rein d'un rat traité au nickel durant 10 jours (NNi)). Coloration : hématoxyline–éosine. Gr : « A et B » × 200. Légende : 1, chambre urinaire normale ; 2, chambre urinaire réduite (atteinte) ; 3, tube proximal normal ; 4, tube proximal à cellules interstitielles hypertrophiées (atteint) ; 5, tube distal normal ; 6, tube distal à cellules interstitielles hypertrophiées (atteint). Masquer
Observation de glomérules et de tubes rénaux normaux « A » (réalisés sur une coupe de rein d'un rat témoin (NO)) et de glomérules et de tubes rénaux atteints « B » (réalisés sur une coupe de rein d'un rat ... Lire la suite
Toutefois, dans le cas du jeûne intermittent (groupes JNi et JO), nos résultats montrent que le pourcentage des chambres urinaires réduites ne varie pas de façon significative par rapport aux témoins (Tableau 1).
Les pourcentages (%) des glomérules à espace urinaire réduit par rapport au nombre total des glomérules chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure du nickel durant 2, 4, 10, 16, 30 et 60 jours. Les valeurs représentent la moyenne ± SEM. Nombre de déterminations par groupe : 8
| 2 j | 4 j | 10 j | 16 j | 30 j | 60j | |
| NO | 13,743 ± 0,852 | 13,105 ± 0,065 | 13,785 ± 1,285 | 14,140 ± 1,640 | 10,56 ± 1,68 | 8,965 ± 1,995 |
| NNi | 23,350 ± 0,710⁎⁎ | 25,250 ± 2,300⁎ | 39,515 ± 1,185⁎⁎ | 38,290 ± 1,710⁎⁎ | 21,975 ± 0,395⁎ | 15,554 ± 0,66⁎⁎ |
| JO | 18,605 ± 0,535+ | 18,965 ± 0,305+ | 19,005 ± 0,615++ | 19,275 ± 0,095++ | 19,58 ± 1,04+ | 12,57 ± 0,16+ |
| JNi | 18,640 ± 3,580+ | 24,150 ± 0,850+ | 20,72 ± 1,01++ | 17,965 ± 0,275++ | 13,07 ± 0,67++ | 11,61 ± 0,75+ |
⁎
⁎⁎
En présence du jeûne intermittent, le nickel perd donc ses effets altératifs sur l'histologie rénale.
3.4 Les protéines de stress
Nos résultats montrent que le nickel inhibe la synthèse de la protéine de stress Hsp 72 dans les reins des rats (NNi) traités durant 1, 3, 5 ou 10 jours. En revanche, en conditions de jeûne intermittent, l'effet inhibiteur du nickel disparaît (Fig. 8).
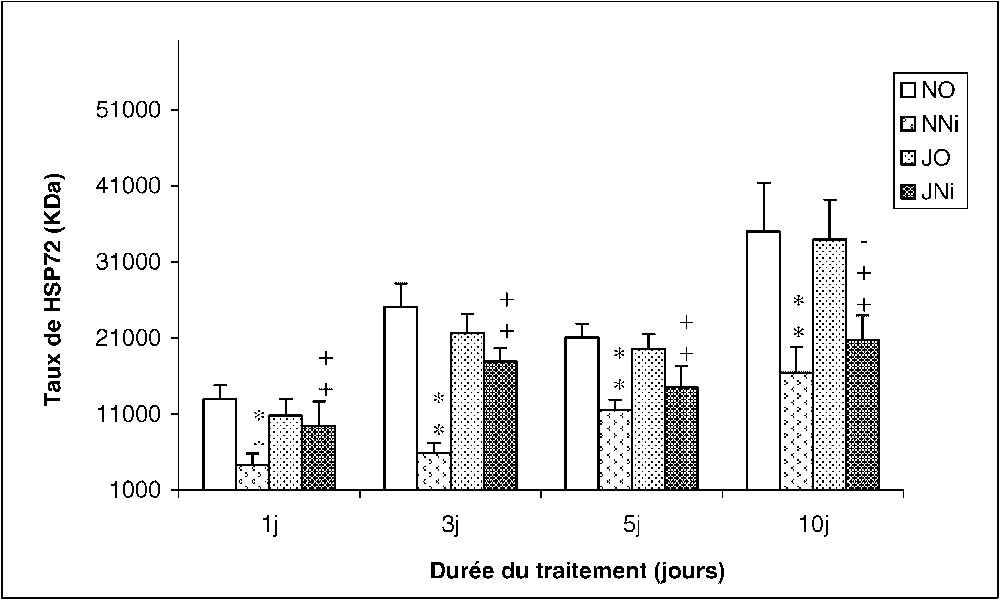
Évolution de la densitométrie des bandes immunoréactives relatives à la protéine HSP72 rénale chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 1, 3, 5 et 10 jours. ∗ : p⩽0,05 par comparaison avec les rats témoins (NO) ;
Évolution de la densitométrie des bandes immunoréactives relatives à la protéine HSP72 rénale chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 1, 3, 5 et ... Lire la suite
3.5 Les métallothionéines
La Fig. 9 met en évidence une baisse significative de l'expression des métallothionéines dans les reins des rats traités par le Ni. Cette inhibition diminue dans le cas où le nickel est associé au jeûne intermittent.
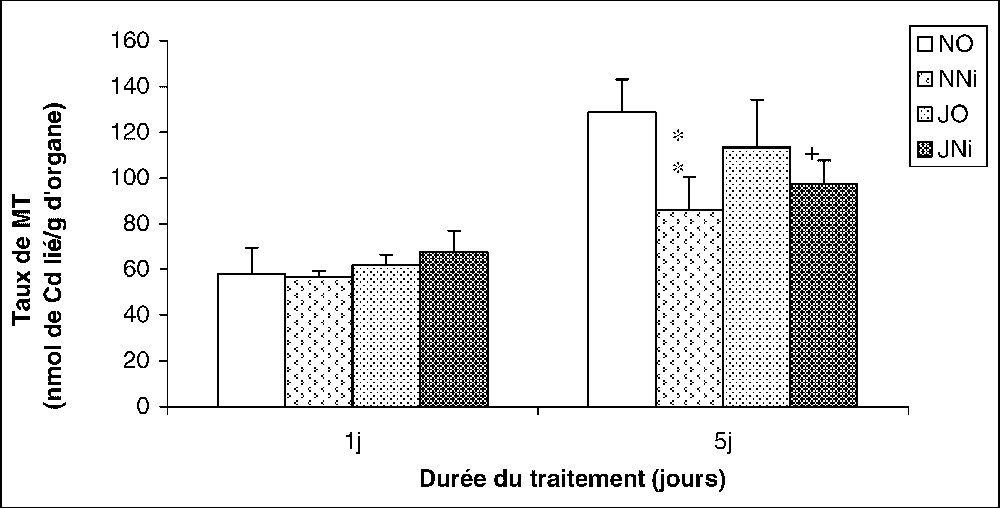
Évolution du taux des métallotionéines rénales (nmol de Cd lié par gramme d'organe frais) chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 1 et 5 jours. ∗ : p⩽0,05 par comparaison avec les rats témoins (NO) ;
Évolution du taux des métallotionéines rénales (nmol de Cd lié par gramme d'organe frais) chez des rats soumis (J) ou non (N) à un jeûne intermittent et traités (Ni) ou non (O) au chlorure de nickel durant 1 et 5 ... Lire la suite
4 Discussion
Nos résultats montrent que le jeûne intermittent n'induit pas de déficience minérale, puisque les teneurs en fer et en magnésium des reins, ainsi que les concentrations sériques en P5+, Ca2+ et Mg2+, sont comparables chez les rats nourris tous les jours ou un jour sur deux.
Il apparaît que ce jeûne intermittent ne peut pas être assimilé à une malnutrition, qui doit intensifier dans les conditions normales les effets cytotoxiques des polluants environnementaux (Pb, Cd, Ni...) [19] sur diverses fonctions, puisqu'il n'a pas entraîné de carence minérale, mais il est intéressant de voir si ce jeûne intermittent est bénéfique ou non sur les reins.
Notre étude sur la fonction rénale a montré que la dose choisie de nickel d'après la bibliographie [13,14] entraînait une augmentation du taux de la créatininémie et de l'urémie entre le 10e et le 16e jour de traitement, ce qui témoigne de l'installation d'une insuffisance rénale transitoire, avec baisse de la filtration glomérulaire. En accord avec nos résultats, El Feki [20], Stengel [21] et Smaoui [22] ont observé que l'intoxication par de nombreux métaux lourds (Pb, Cd et Ni), d'hydrocarbures, de gaz d'échappement, de pesticides induit un dysfonctionnement tubulaire ou une néphropathie tubulo-interstitielle, qui évolue vers une insuffisance rénale. En effet, le rein est particulièrement sensible à l'action des toxiques, en raison de son intense activité métabolique et de ses multiples fonctions, notamment celles d'excrétion et de concentration des xénobiotiques. De même, selon Courrèges [23], des examens cliniques effectués chez des sujets souffrant d'insuffisance rénale montrent une augmentation des taux de la créatinine et de l'urée plasmatiques. Sur le plan clinique, la néphropathie tubulo-interstitielle chronique est diagnostiquée par l'augmentation de l'urée et/ou de la créatinine sanguines, avec protéinurie assez faible [24]. Diwan [25], Vyskocil [26] et Chakrabarti [27] ont montré que la néphrotoxicité du Ni, qui est observée chez le jeune et l'adulte, peut être aussi accompagnée par des lésions au niveau des glomérules, une protéinurie et une aminoacidurie.
L'examen histologique des reins a confirmé ces résultats. En effet, entre le 10e et le 16e jour d'exposition au nickel, nous avons observé une altération structurale au niveau de la zone corticale, où les capsules de Bowman adhèrent aux glomérules, provoquant une réduction de l'espace des chambres urinaires, phénomène qui pourrait être du à une forte fixation du nickel par les reins [28]. Nous avons par ailleurs observé au niveau du tube urinaire, principalement du tube proximal, qu'il y a vacuolisation et hypertrophie des cellules épithéliales.
Afin de confirmer cet effet délétère du nickel sur la fonction rénale, il serait intéressent de mesurer la protéinurie, le débit de créatine dans les urines et le débit urinaire d'urée.
Le jeûne intermittent dans nos conditions expérimentales a induit une diminution de la créatininémie, de l'urémie, de la créatininurie et du taux de l'urée urinaire, ceci étant expliqué par le manque quantitatif d'apport alimentaire et non par une insuffisance rénale, étant donné que l'histologie rénale est normale dans le cas du jeûne intermittent. Il semble donc que la réduction de la quantité des protéines ingérées réduise le catabolisme protidique et baisse par voie de conséquence les taux plasmatiques et urinaires de la créatinine et de l'urée.
Toutefois, chez les rats soumis au nickel associé au jeune intermittent (groupe JNi), on ne note pas d'altération de l'architecture rénale. Une augmentation significative, voire même hautement significative, des biomarqueurs rénaux est observée, surtout pour ce qui concerne les paramètres urinaires. Cette amélioration, réalisée en présence du double stress, témoigne de l'activation de l'excrétion urinaire par augmentation du métabolisme général de l'organisme par le nickel. En supposant, d'après nos observations, que la diurèse est presque la même pour tous les groupes d'animaux, cette amélioration pourrait aussi témoigner de l'activation de l'absorption intestinale des nutriments par le nickel, associée au jeûne intermittent.
Il semble donc que le jeûne intermittent ne puisse pas être assimilé à une malnutrition, puisqu'il n'a, ni entraîné de carence minérale, ni augmenté les effets inhibiteurs du Ni sur la fonction rénale [29–31]. Il semble, au contraire, et comme nous l'avons discuté, que le jeûne intermittent protège le rein contre l'effet néfaste du nickel. Il s'agit donc d'une restriction calorique bénéfique pour le corps, comme il a été signalé par Charnier [32] qui a montré que la restriction en protéines pourrait ralentir considérablement la progression des maladies rénales. De même, Boucher [33] a montré qu'un régime restrictif sur le plan calorique participe à la prévention des maladies chroniques qui augmentent avec l'âge et qui sont probablement liées au stress oxydant. La restriction calorique fait ainsi en sorte de maintenir l'usine cellulaire en bonne condition pendant une plus longue période de temps.
Afin de confirmer notre hypothèse concernant l'effet bénéfique du jeûne intermittent en tant que restriction calorique, nous nous sommes proposés aussi d'explorer l'impact sur les protéines de stress : les Hsp et les MT.
Divers travaux ont démontré que la synthèse des Hsp, initialement observée après un choc thermique, pouvait également être induite par d'autres agents que la chaleur, et en particulier par les métaux lourds [34–36] Selon Bauman [37], Sarge [38] et Croute [39], les Hsp sont induites par une série d'agents toxiques, physiques, chimiques, notamment par les radicaux libres de l'O2, qui peuvent exercer leurs effets sur diverses cibles cellulaires, telles que les protéines, les lipides membranaires ou l'ADN. Ces protéines sont impliquées dans plusieurs fonctions cellulaires de base ; elles réparent notamment les protéines endommagées (dépliées) par un stress, en les repliant, et stimulent la synthèse des enzymes de détoxication active contre les radicaux libres (RL) et des molécules de prévention à temps plein [40]. Les protéines de stress sont, en fait, exprimées pour la plupart de façon constitutive dans toutes les cellules [38,41]. Leur expression constitutive et leur conservation extrême au cours de l'évolution (de la bactérie à l'homme) montrent qu'elles jouent un rôle essentiel dans la vie cellulaire.
Nos résultats ont montré que le traitement par le nickel induit une chute importante de l'expression de la Hsp72. KLEIN [42] a observé que les dommages intracellulaires majeurs produits par le nickel se situent au niveau de l'hétérochromatine. Des études récentes [43] rapportent que le nickel réprime la transcription de certains gènes, à condition qu'ils soient localisés prés de l'hétérochromatine. Cette inhibition de la transcription serait due à une désacétylation des histones et à une hyperméthylation de l'ADN. Il serait donc intéressant de savoir si le gène de la Hsp72 est proche de l'hétérochromatine. Par ailleurs, certains travaux suggèrent que le nickel pourrait contrôler l'expression des gènes de façon post-transcriptionnelle. En effet, Kaur [44] a montré que, dans le noyau, le nickel se fixe à l'ARN, mais pas à l'ADN, ni aux protéines. De même, Sutherland [45] a montré que le chlorure de nickel, administré à des concentrations variant de 0,2 à 0,6 mM, réduit la transcription de certains gènes au niveau de l'ARN à la suite d'une désacétylation des histones et à une hyperméthylation de l'ADN.
En présence du jeûne intermittent associé au nickel, l'expression de la Hsp72 est au contraire améliorée chez les (JNi) par rapport aux (NNi). Il semble que le jeûne intermittent réduise l'effet cytotoxique du nickel et qu'il n'est peut être pas considéré comme une malnutrition qui intensifie ces effets. Il semble qu'il s'agit d'une restriction calorique bénéfique pour le corps en ce qu'elle augmentant les processus de défense cellulaire vis-à-vis des effets cytotoxiques du stress oxydant induit par le Ni. Yu [46] a montré que la restriction calorique induisait l'expression des protéines de stress HSP27, 70 et 90 au niveau de l'hypothalamus des rats. Or, ces HSP, et plus particulièrement les HSP70, joueront un rôle important de protection ou de réparation des protéines endommagées par le stress oxydant.
Nos recherches portent aussi sur les (MT), comme second type de protéines synthétisées en situation de stress. Les (MT) sont des protéines intracellulaires de faible poids moléculaire (6000–7000 Da) ubiquitaires dans le règne animal. Les MT-I et MT-II sont les deux isoformes majeures chez les mammifères [47]. Les MT possèdent une composition spéciale d'acides aminés. En effet, elles ne possèdent pas d'acides aminés aromatiques dont le tiers des résidus sont des cystéines. Les résidus cystéines servent comme ligand aux métaux. La synthèse des MT est induite par des facteurs divers, tels que les métaux, les glucocorticoïdes, les cytokines et les radiations ionisantes [48]. Les niveaux de distribution et d'induction des MT semblent varier selon les espèces et les organes [48,49]. Les MT sont supposées jouer des rôles physiologiques multiples, incluant la détoxification des métaux potentiellement toxiques (Pb, Cd, Ni...), la régulation des métaux essentiels à l'état de trace, tels que le zinc, le cuivre et le chrome et la participation dans les systèmes cellulaires de défense antioxydante [50]. À cause de leur teneur élevée en groupements sulfhydriques, les MT peuvent réagir avec les radicaux libres (RLO) et les électrophiles [51]. Divers travaux ont montré que les MT sont des protéines intracellulaires induites pour protéger l'organisme vis-à-vis de la toxicité du cadmium [52]. De même, Andrews [53] a également montré que le cadmium est l'inducteur majeur des MT, bien qu'il ne manifeste que de faibles effets sur l'endommagement de l'ADN.
Nos résultats ont montré, au contraire, que le nickel inhibe la synthèse des MT durant la période de traitement. Ce ci confirme les travaux de Murata [54], qui a montré que la synthèse des MT augmente avec différents métaux lourds, tels que Ag, Hg, Cu et CO, à l'exception du nickel, qui inhibe cette synthèse. De même Lee [55] a montré que le nickel, du fait de ses interactions préférentielles avec les régions hétérochromatiques, inhibe la transcription des gènes codants pour les MT et les Hsp70.
En présence du jeûne intermittent associé au nickel, nous avons noté une amélioration de la synthèse des MT par rapport à ce qui se passe en présence du nickel seul. Il semble que l'effet cytotoxique du nickel soit réduit en conditions de jeûne intermittent. Ceci confirme les travaux de Kondoh [56] qui a montré que les MT jouent, chez des rats soumis à un cycle répétitif d'un jeûne alternatif de 24 h, un rôle antioxydant important, en réduisant la peroxydation lipidique induite par le stress oxydant. Ceci prouve aussi, dans notre cas, que le jeûne intermittent agit comme une restriction calorique bénéfique pour le corps, conformément aux travaux de Dhahbi [57], qui a montré que la restriction calorique augmente la longévité, retarde les changements physiologiques en relation avec l'âge et réduit l'incidence de cancer. Yu [46] a montré que la restriction calorique a un effet protecteur antioxydant, qu'elle induit un ralentissement général des fonctions cellulaires, d'où une moindre production de radicaux libres. La restriction calorique retarde ainsi « l'épuisement » cellulaire et permettrait de maintenir fonctionnels les différents systèmes endocriniens. C'est le cas pour la GH, les hormones thyroïdiennes ou les différents neuromédiateurs du système nerveux central. La restriction calorique entraînerait aussi le maintien du système immunitaire [58,59].
En conclusion, notre étude suggère que le nickel et le jeûne intermittent agissent selon deux mécanismes différents. En effet, le nickel agit comme un stress oxydant par ses effets cytotoxiques, alors que le jeûne intermittent agit comme une restriction calorique bénéfique, qui augmente les processus de défense cellulaire vis-à-vis des effets peroxydants du nickel.


