Abridged English version
High heavy-metal contamination of soils is one of the major environmental stresses. Excessive accumulation of such pollutants in plant tissues causes alterations in various vital growth processes. In spite of considerable literature on the subject, the fundamental mechanism of heavy-metal toxicity has not yet been fully characterized and remains so far an open question. Apparently, cell decompartmentalisation and modification of membrane functions represent the first targets for metal toxicity.
The present paper deals with changes of membrane lipid composition, biosynthesis, and peroxidation in leaf cells accompanying the accumulation of Cd in Brassica napus seedlings.
For that purpose, two-week-old rape seedlings were grown on plastic beakers (6-l capacity, 6 plants per beaker) filled with continuously aerated nutrient solutions supplied with CdCl2 at various concentrations (0, 5, 10, 25 and 50 μM). Seedlings grown in medium without CdCl2 (0 μM) represent the control. Plants were cultivated in a greenhouse under controlled conditions (25/20 °C day/night temperature, 70% relative humidity, and 16-h photoperiod). After 14 days of heavy-metal treatment, young leaves that appeared after Cd application and roots were harvested and used for chemical analyses. Cadmium was assayed by atomic absorption spectrophotometry. Extraction of total lipids was obtained using the following solvent mixture: chloroform/methanol (1:1, v/v). Lipid classes were separated on silica gel thin layer chromatography (TLC) plates. Fatty acid methyl esters were analysed by FID-GC on a capillary column SupelcowaxT10 (30 m × 0.53 mm, 1-μm film thickness). Radioactive labelling of lipids was achieved by laying sodium (1-14C) acetate microdroplets, on young leaves of either control or treated seedlings, using a Hamilton syringe. Lipid peroxidation was estimated by a spectrophotometric determination of malondialdehyde (MDA) content. Concentration of MDA was calculated using its extinction coefficient (155 m M−1 cm−1).
Rape plants accumulated substantial amounts of Cd with increasing external metal concentrations. Root metal content was considerably higher than that of leaves. Cadmium treatment resulted in a growth reduction of rape shoots and roots, reaching 67.2 and 55.4% respectively at 50 μM of CdCl2.
After 14 days of Cd treatment, significant decline in the lipid status was found in heavy-metal-stressed plants. At the highest Cd dose (50 μM), the total lipid amount of leaves represented only 57.7% of the control one. Such Cd-induced lipid reduction was due to a sharp decrease in glycolipid (GL) and neutral lipid (NL) fractions. All molecular species of glycolipids (MGDG, DGDG and SL) were depressed by the metal, MGDG being more affected than the two others. In contrast to GL and NL fractions, phospholipid (PL) one increased under heavy-metal treatment. Among phospholipid molecules, PC and PE contents increased, while that of PG decreased. The other constituents (PA and PI) remained unchanged.
Similarly, contents of root total lipids and lipid fractions (phospholipids and neutral lipids) decreased, while galactolipids, which represent a minor fraction in roots, were unaffected.
The fatty acid composition of leaf lipids was also modified by cadmium application. Nevertheless, such changes differed between individual lipids. Fatty acids subjected to variation were linolenic, hexadecatrienoic, and trans palmitoleic acids. For MGDG, a decrease in C16:3 was shown, while in DGDG, C18:3 dropped sharply from 61% (control) to 38% (50 μM CdCl2). The decrease of C18:3 was accompanied by an increase in the proportions of C18:2, C18:1, and C18:0. The level of linolenic acid in SL was also depressed. Concerning phospholipids, no changes occurred in the fatty acid composition of PC and PE. Unlikely, there was a significant decrease in tri-unsaturated fatty acids (C18:3 and C16:3) and in trans palmitoleic acid (trans-C16:1) for PG.
Radioactive labelling kinetics with sodium (1-14C) acetate as precursor showed that radioactivity level in total lipids increased transiently at the lowest cadmium dose (5 μM), as compared to that of control. For intermediate Cd concentrations (10 and 25 μM), the radioactivity level in total lipids was similar to that of the control. However, the extreme cadmium dose (50 μM) depressed the percentage of radioactivity incorporated in total lipids for all incubation times. Likewise, high Cd concentration reduced levels of acetate incorporation in tri-unsaturated fatty acids (C18:3 and C16:3).
On the other hand, MDA, which is a degradation product resulting from membrane lipid peroxidation, was accumulated in leaf tissue at CdCl2 concentrations higher than 10 μM. At 50-μM Cd, the level of MDA accumulation represented more than 600% of the control.
Taken together, our data show that Cd reduced considerably the contents of chloroplastic lipids (MGDG, DGDG, SL and PG), whereas extrachloroplastic lipids, especially PC and PE, were enhanced by this metal. Furthermore, cadmium changed markedly the fatty acid composition of chloroplastic lipids (MGDG, DGDG, SL and PG), while that of extrachloroplastic lipids remained unchanged. Cadmium treatment caused also a lipid biosynthesis inhibition as well as a lipid peroxidation.
In fact, the loss of membrane chloroplastic lipids in rape plants treated with cadmium may be related to an enhanced rate of catabolism and/or to the suppression of lipid biosynthesis. In addition, the reduced levels of polyunsaturated fatty acids (C18:3 and C16:3) resulted from an inhibition of their desaturation process and/or a stimulation of their peroxidation. Also, the greater decrease of MGDG content than that of DGDG was observed in metal-stressed rape leaves, resulting in a decrease of the MGDG/DGDG ratio, might be caused by a high galactolipase activity, which attacks preferentially MGDG.
All these changes would mainly concern the photosynthetic apparatus, in which cadmium could disturb the architecture of the thylakoïd membranes. Such a disorganization affects, in turn, some light reaction processes, especially those associated with PSII activity. In contrast to glycolipids, contents of phospholipids, mainly PC and PE, increased under Cd treatment, probably owing to a stimulation of their biosynthesis. Such an increase in phospholipid may be considered as a defence strategy developed by the plant to ensure a better endocellular compartmentalization of the chemical pollutant. In this way, some authors have showed that extrachloroplastic membrane vesiculation might represent a mechanism for Cd detoxification in tomato and other heavy-metal tolerant species.
1 Introduction
L'intensification des activités humaines, notamment industrielles et agricoles, et la consommation croissante de l'énergie fossile ont contribué, au cours de ces dernières décennies, à la contamination des agroécosystèmes par les métaux lourds [1]. Ces derniers représentent un groupe hétérogène d'éléments chimiques, certains d'entre eux, comme le fer et le cuivre, étant considérés comme essentiels pour la nutrition et les activités métaboliques de l'organisme vivant, tandis que d'autres, tels que le cadmium, ne sont pas jusqu'à présent reconnus comme remplissant une fonction chez les êtres vivants [2]. Les niveaux de contamination des écosystèmes par le cadmium n'ont cessé d'augmenter au cours de ces dernières années [3]. Actuellement, l'émission anthropologique annuelle du cadmium dans l'écosphère est estimée à environ 30 000 t [4]. Ainsi, l'accumulation de ce polluant chimique cause de nombreux troubles physiologiques chez le végétal, tels qu'une dépression de l'activité photosynthétique [4,5] et une réduction de l'absorption minérale [6]. La diminution de la croissance est également un signe de toxicité du métal, éventuellement associée à une sénescence [7,8]. Certains travaux ont montré que le Cd interfère avec les processus d'absorption et de transport d'un certain nombre d'éléments essentiels pour la croissance et le développement de la plante [9–11]. La respiration cellulaire et la transpiration sont également affectées par le métal [12].
Les études consacrées à l'influence du cadmium ou des métaux lourds, d'une manière générale, sur le métabolisme lipidique des membranes cellulaires sont relativement récentes. En effet, les métaux lourds paraissent affecter la composition en lipides membranaires chez les plantes supérieures, modifiant de la sorte leur intégrité, leur fluidité et, par voie de conséquence, leur perméabilité [13,14]. En outre, le cadmium semble provoquer une peroxydation lipidique par le biais d'un stress oxydatif [15,16].
Dans le présent travail, nous avons étudié l'impact du cadmium sur certains paramètres physiologiques et biochimiques chez le colza, et notamment la composition en lipides membranaires des feuilles, étant donné le rôle que jouent ces molécules dans l'activité photosynthétique ainsi que dans la structure et la fonction des membranes cellulaires, sièges de divers échanges métaboliques dans la cellule.
2 Matériels et méthodes
2.1 Conditions de culture
Après désinfection par l'eau oxygénée, les graines de colza (Brassica napus L. variété drakkar 00) sont mises à germer. Six jours après, les plantules sont repiquées sur des seaux en plastique de 6 l, remplis d'une solution nutritive de base [17], aérée de manière constante par des pompes à aquarium. Les cultures sont conduites sous serre, en conditions contrôlées de température (25/18 °C ; jour/nuit) et d'humidité relative . Après deux semaines, les plantules sont transférées durant 14 jours dans des conditions de stress métallique imposées par l'apport du Cd dans la solution nutritive sous forme de CdCl2 à des concentrations de 5, 10, 25 et 50 μM.
2.2 Dosage du Cd
Le Cd contenu dans les tissus est dosé sur l'extrait nitrique obtenu après minéralisation du matériel végétal par attaque nitroperchlorique à chaud. Les teneurs en Cd sont déterminées par spectrophotométrie à absorption atomique.
2.3 Marquage in vivo des lipides foliaires
Dans les expériences de marquage in vivo des lipides foliaires, nous avons utilisé le (1-14C) acétate de sodium fourni par Amersham (USA), qui présente une activité spécifique de 1,95 GBq mmol−1, soit 52,8 mCi mmol−1. Le marquage radioactif des lipides a été réalisé par le dépôt de microgouttes de (1-14C) acétate de sodium à l'aide d'une microseringue Hamilton sur de jeunes feuilles en place de colza témoins et traitées par le cadmium. Au bout de chaque temps d'incubation (2, 6, 12 et 24 h), les feuilles marquées sont prélevées, rincées abondamment à l'eau distillée, puis utilisées pour l'extraction des lipides.
2.4 Analyse des lipides
L'extraction des lipides des tissus de colza a été réalisée selon la méthode d'Allen et Good [18]. La séparation des diverses classes de lipides à partir de l'extrait lipidique total a été faite par chromatographie unidimensionnelle sur couche mince de gel de silice, selon la méthode de Lepage [19]. Les esters méthyliques des acides gras des lipides totaux ou des classes lipidiques sont obtenus selon la technique de Metcalfe et al. [20], puis analysés par chromatographique en phase gazeuse (CPG) en utilisant une colonne capillaire SupelcowaxT10 de 30 m de longueur et 0,53 mm de diamètre, imprégnée d'un film dont l'épaisseur est de 1 μm. La température de la colonne est maintenue à 200 °C, l'azote est utilisé comme gaz vecteur, les températures de l'injecteur et du détecteur sont respectivement de 230 et 250 °C. La quantification des acides gras est réalisée en utilisant le comme étalon interne.
2.5 Séparation des acides gras radioactifs
Les acides gras radioactifs, sous forme d'esters méthyliques, des lipides totaux sont séparés par chromatographie sur couche mince de gel de silice imprégnée de nitrate d'argent, en utilisant des plaques de silicagel (WF 254 S Merck), qui permettent une double séparation des acides gras en fonction, d'une part, de la longueur de la chaîne et, d'autre part, du nombre d'insaturation à l'exception des acides gras saturés (acides palmitique et stéarique) qui migrent ensemble vers le front du solvant.
2.6 Mesure de la radioactivité
La radioactivité des lipides totaux est mesurée à l'aide d'un compteur à scintillation liquide (Packard Tricarb 460).
2.7 Mesure des produits de peroxydation
La peroxydation des lipides est estimée par l'évolution de la teneur en malonyldialdehyde (MDA), déterminée selon la méthode décrite par Alia et al. [21]. L'homogénéisation du tissu végétal dans l'acide trichloroacétique à 5% à raison de 1 g par 10 ml est suivie d'une centrifugation pendant 15 min à 12 000 g. Au surnageant est ajouté à volume égal de l'acide thiobarbiturique (TBA) dans le TCA 20%. Le mélange est incubé à 100 °C pendant 25 min. L'absorbance du surnageant obtenu après centrifugation à 10 000 g pendant 5 min est lue à 532 nm. La densité optique est ensuite corrigée par la soustraction de l'absorbance non spécifique à 600 nm. La concentration de MDA est calculée en utilisant son coefficient d'extinction, à savoir 155 mM−1 cm−1.
2.8 Analyse statistique
Les résultats sont des moyennes ±ES de trois à cinq répétitions. Les analyses statistiques sont effectuées en utilisant des tests ANOVA.
3 Résultats
3.1 Accumulation tissulaire du Cd
Les teneurs en Cd (μg g−1 MS) dans les parties aériennes et les racines de colza augmentent en fonction de l'accroissement des doses de CdCl2 (Fig. 1A). Les niveaux d'accumulation du métal restent maintenus à des valeurs beaucoup plus élevées dans les racines que dans les parties aériennes, et ceci pour toutes les concentrations utilisées.
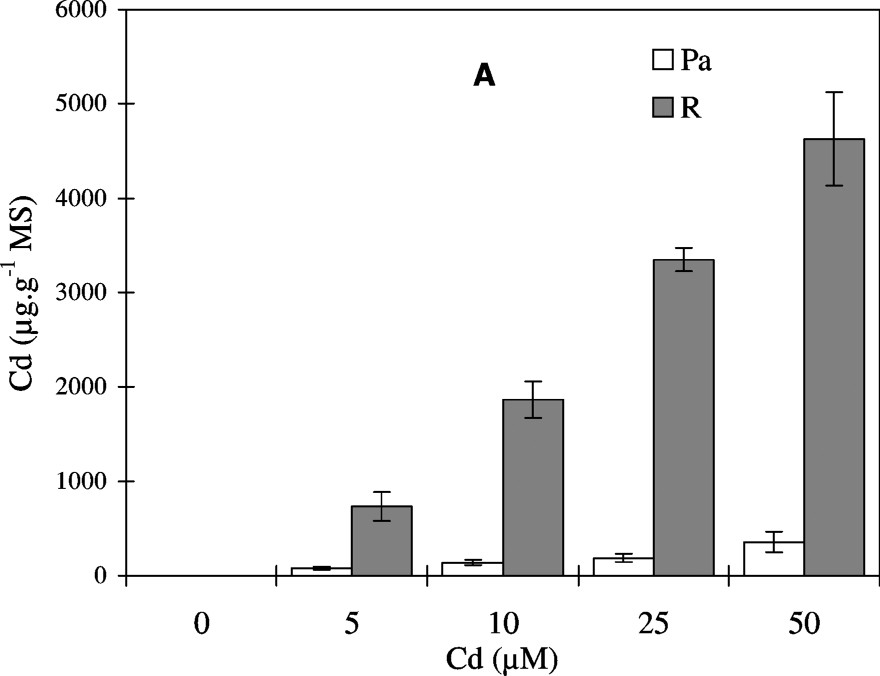

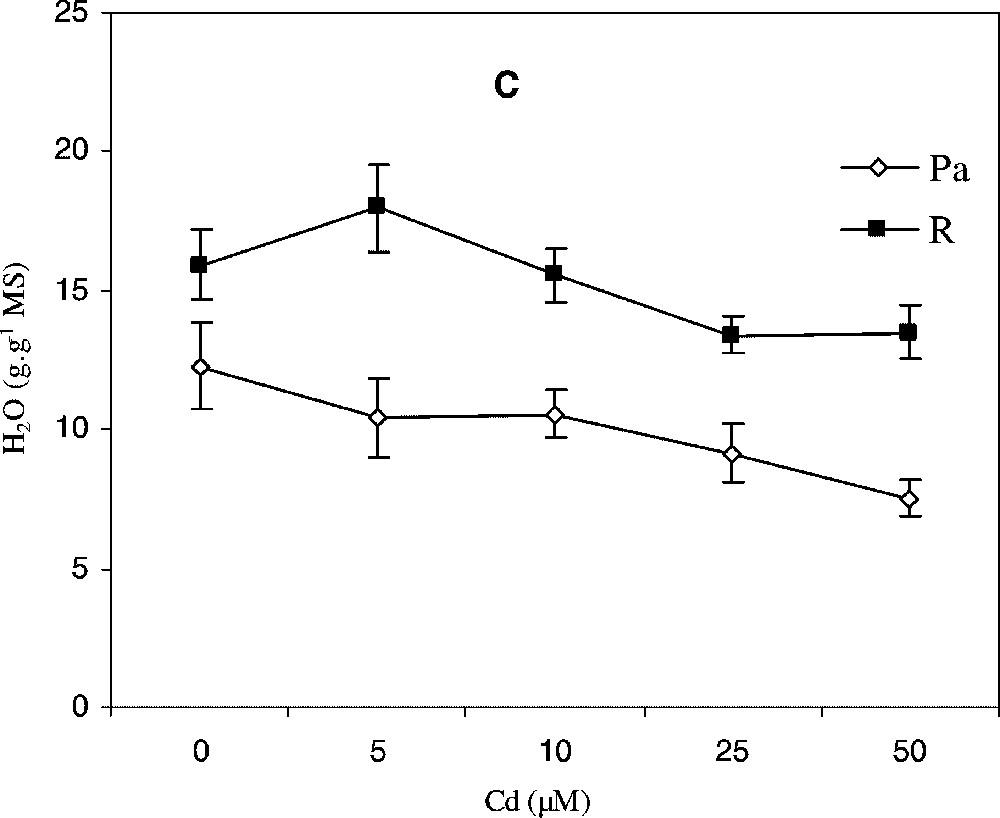
Variation de l'accumulation endogène de cadmium Cd (A), de la production de matière sèche (B) et de l'hydratation des tissus (C) au niveau des parties aériennes (Pa) et des racines (R) de colza traité avec différentes doses de CdCl2. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=5).
3.2 Aspects morphologiques
Les premiers symptômes visuels de toxicité par le cadmium ont été décelés chez les plantules de colza après une semaine de traitement. En effet, à ce stade, on a commencé à observer un jaunissement au niveau des feuilles dont l'intensité est fonction de la concentration du polluant. On a également noté des tâches de nécrose qui sont particulièrement marquées pour les concentrations extrêmes (25 et 50 μM de CdCl2).
3.3 Croissance des plantules
Le traitement par le Cd entraîne une dépression de la croissance qui se fait sentir dès la première dose de cadmium employée (5 μM), et ceci s'observe aussi bien au niveau des racines qu'au niveau de la partie aérienne (Fig. 1B). L'inhibition de la croissance s'accentue davantage à la plus forte dose de Cd (50 μM), puisque la chute de la biomasse atteint 55,4 et respectivement pour les racines et la partie aérienne.
3.4 Hydratation des tissus
L'estimation de la teneur en eau des tissus en fonction de la concentration de cadmium dans le milieu hydroponique est illustrée par la Fig. 1C. Pour la partie aérienne, on observe, d'une façon générale, une diminution de la teneur en eau, dont l'importance est fonction de la concentration du Cd.
Il en est de même pour les racines, qui montrent une légère tendance à la baisse de leur degré d'hydratation, particulièrement aux traitements 25 et 50 μM. Quoi qu'il en soit, il semble important de signaler que les racines restent toujours les organes les plus hydratés et que la partie aérienne est apparemment davantage affectée par le métal.
3.5 Composition et biosynthèse des lipides et des acides gras
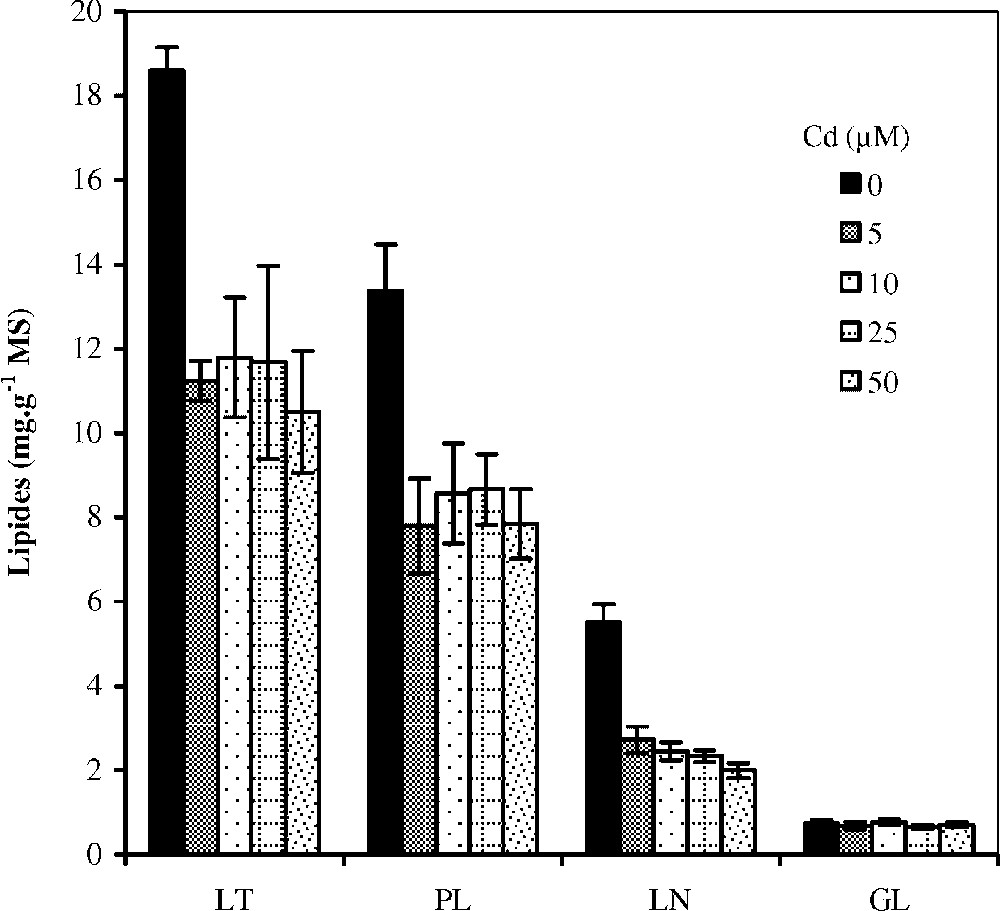
Le traitement par le cadmium pendant deux semaines a entraîné une chute de la teneur en lipides totaux (LT) au niveau des feuilles (Fig. 2), si bien que pour ce qui concerne le traitement le plus sévère (50 μM), la quantité de ces constituants organiques ne représente plus que de celle du témoin correspondant. Ces résultats s'accordent avec certains travaux réalisés sur d'autres espèces végétales traitées par le cadmium ou d'autres métaux lourds [13]. La diminution de la teneur en lipides totaux trouve son origine dans la chute considérable des teneurs en glycolipides (GL) et en lipides neutres (LN), pouvant atteindre respectivement jusqu'à 70 et 62% de réduction par rapport aux témoins correspondant à la dose de 50 μM de CdCl2 (Fig. 2). La réduction très importante de la quantité de glycolipides est due à une énorme baisse des teneurs des trois espèces de molécules qui les composent, à savoir le monogalactosyldiacylglycérol (MGDG), le digalactosyldiacylglycérol (DGDG) et les sulfolipides (SL), avec une chute nettement marquée au niveau du MGDG, dont la teneur est réduite de 76% à 50 μM de Cd alors que les sulfolipides sont les glycolipides les moins affectés (Fig. 3).

Variation des teneurs en lipides totaux (LT), glycolipides (GL), phospholipides (PL) et lipides neutres (LN) au niveau des feuilles de colza traité avec différent doses de cadmium. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=3).
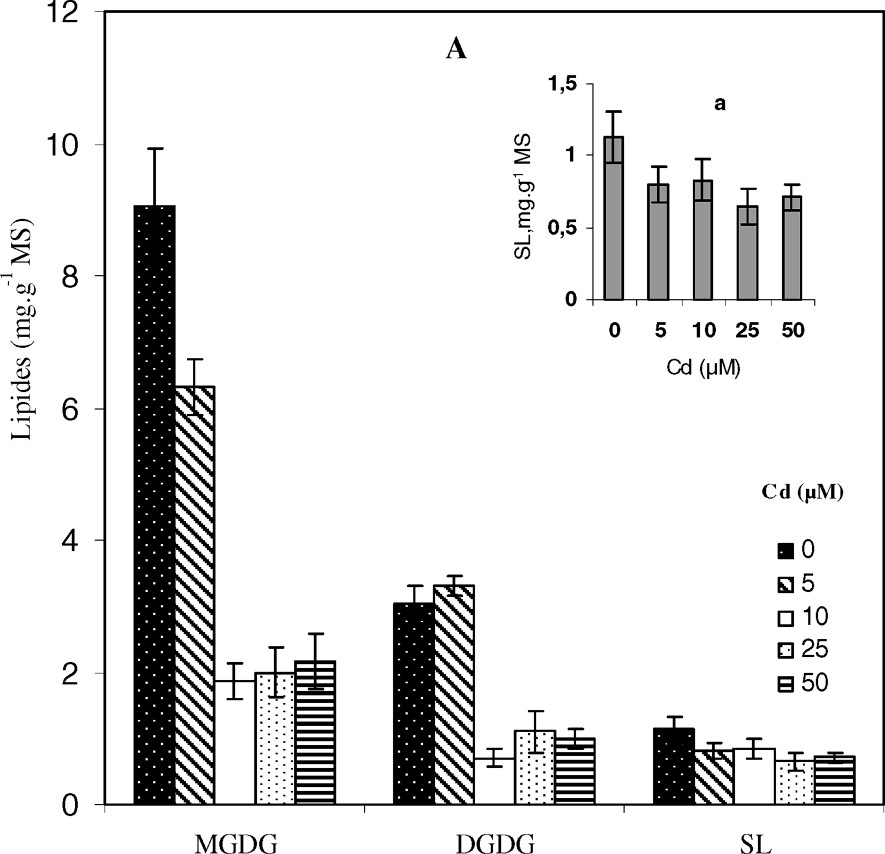
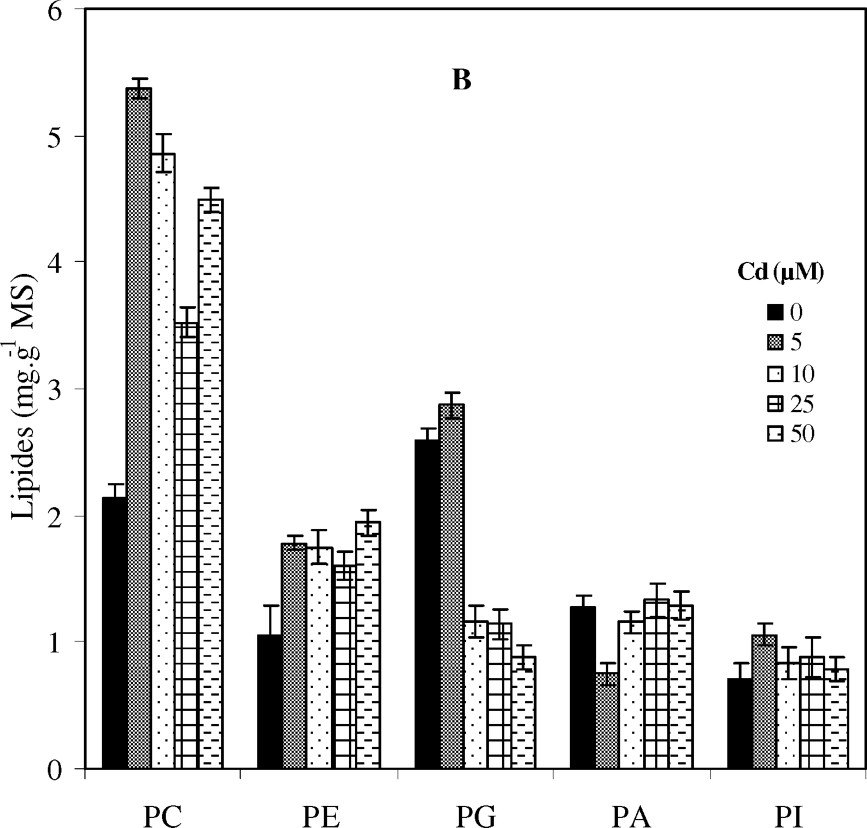
Variation des teneurs des molécules de glycolipides (MGDG, DGDG et SL) (A) et de phospholipides (PC, PE, PG, PI et PA) (B) au niveau des feuilles de colza traité avec différentes doses de cadmium. a (in A) : Variation des teneurs de SL. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=3).
Par ailleurs, la teneur en phospholipides (PL) accuse une augmentation en présence de cadmium dans le milieu de culture (de l'ordre de 21% à la dose 50 μM de Cd) (Fig. 2). Cette hausse est engendrée uniquement par un accroissement des teneurs en phosphatidylcholine (PC) et phosphatidyléthanolamine (PE). Les teneurs en acide phosphatidique (PA) et en phosphatidylinositol (PI) restent relativement stables, alors que le phosphatidylglycérol (PG) subit une forte chute, atteignant 66% de réduction à 50 μM de Cd (Fig. 3B).
La variation de la composition en acides gras totaux des feuilles traitées est surtout marquée par une forte baisse des pourcentages des acides linolénique et hexadécatriénoïque , si bien que leurs teneurs chutent respectivement de 47 à 37% et de 16 à 9% pour des concentrations comprises entre 5 et 50 μM de Cd (Tableau 1). Cette forte baisse des tri-insaturés est parallèlement accompagnée d'une augmentation du pourcentage du , qui accuse une hausse de 14% à 50 μM de CdCl2. Les proportions de , et augmentent également, alors que l'isomère trans de l'acide palmitoléique ( trans) subit une diminution. La composition en acides gras des glycolipides est considérablement affectée par le métal (Tableau 2). Ainsi, au niveau du MGDG, la teneur de chute. La proportion de dans la molécule de DGDG passe de 61% chez le témoin à 38% à la dose 50 μM de Cd, soit une réduction de 23%. À côté de cette diminution, on assiste à une augmentation des teneurs de , et . La teneur en chute également dans les SL au profit de celle de et . En ce qui concerne la composition en acides gras des principaux phospholipides des feuilles traitées, seuls les acides gras du PG (, et ) diminuent fortement sous l'effet du traitement, alors que ceux des autres phospholipides, notamment la PC et la PE, sont pratiquement inchangés (Tableau 3). Le pourcentage de l'isomère trans de l'acide palmitoléique, acide gras caractéristique de la molécule de PG de la feuille, chute au profit de celui du . On note également, dans ce phospholipide, une hausse des pourcentages de et .
Variation de la composition en acides gras totaux (%) au niveau des feuilles de colza traité par différentes doses de Cd. Les valeurs de la même colonne avec les mêmes lettres ne sont pas significativement différentes au seuil de 5%. Les valeurs sont des moyennes ±ES (n=3)
| Cd (μM) | Acides gras | ||||||||
| C16:0 | C16:1c | C16:1t | C16:2 | C16:3 | C18:0 | C18:1 | C18:2 | C18:3 | |
| 0 | |||||||||
| 5 | |||||||||
| 10 | |||||||||
| 25 | |||||||||
| 50 |
Variation de la composition en acides gras (%) des différentes molécules de glycolipides au niveau des feuilles de colza traité par différentes doses de Cd. Les valeurs de la même colonne avec les mêmes lettres ne sont pas significativement différentes au seuil de 5%. Les valeurs sont des moyennes ±ES (n=3)
| Cd (μM) | Acides gras | ||||||||
| C16:0 | C16:1c | C16:1t | C16:2 | C16:3 | C18:0 | C18:1 | C18:2 | C18:3 | |
| MGDG | |||||||||
| 0 | 1,6 ± 0,1e | ||||||||
| 5 | 2,9 ± 0,17d | ||||||||
| 10 | 5,9 ± 0,36a | ||||||||
| 25 | 5,0 ± 0,26b | ||||||||
| 50 | 4,2 ± 0,34c | ||||||||
| DGDG | |||||||||
| 0 | 21,6 ± 2,42b | ||||||||
| 5 | 25,5 ± 1,57a | ||||||||
| 10 | 26,3 ± 1,96a | tr | |||||||
| 25 | 22 ± 1,90b | tr | |||||||
| 50 | 19,1 ± 1,47b | ||||||||
| SL | |||||||||
| 0 | 46,9 ± 3,75b | tr | tr | ||||||
| 5 | 55,4 ± 3,31a | tr | |||||||
| 10 | 55,1 ± 3,03a | tr | |||||||
| 25 | 42,2 ± 2,36b | tr | |||||||
| 50 | 41,4 ± 3,26b | tr |
Variation de la composition en acides gras (%) des différentes molécules de phospholipides dans les feuilles de colza traité par différentes doses de Cd. Les valeurs de la même colonne avec les mêmes lettres ne sont pas significativement différentes au seuil de 5%. Les valeurs sont des moyennes ±ES (n=3)
| Cd (μM) | Acides gras | ||||||||
| C16:0 | C16:1c | C16:1t | C16:2 | C16:3 | C18:0 | C18:1 | C18:2 | C18:3 | |
| PC | |||||||||
| 0 | tr | ||||||||
| 5 | tr | ||||||||
| 10 | tr | ||||||||
| 25 | tr | ||||||||
| 50 | tr | ||||||||
| PG | |||||||||
| 0 | tr | ||||||||
| 5 | tr | tr | |||||||
| 10 | |||||||||
| 25 | |||||||||
| 50 | |||||||||
| PE | |||||||||
| 0 | tr | ||||||||
| 5 | 0,7±0,1 | ||||||||
| 10 | tr | ||||||||
| 25 | tr | ||||||||
| 50 | tr |
Ces résultats montrent clairement que le Cd affecte considérablement les teneurs en lipides chloroplastiques (MGDG, DGDG, PG et SL), alors que les teneurs en lipides extrachloroplastiques (PC et PE) augmentent sous l'effet du traitement par le métal.
Par ailleurs, en suivant la cinétique d'incorporation du (1-14C) acétate de sodium dans les lipides totaux en fonction de la concentration de cadmium (Fig. 4), nous constatons que, pour le cas du traitement faible (5 μM), les feuilles de colza incorporent plus de radioactivité que les témoins. Aux traitements 10 et 25 μM de CdCl2, la radioactivité incorporée au niveau des feuilles devient presque similaire à celle des feuilles témoins, alors que la plus forte dose de cadmium (50 μM) entraîne une baisse dans la quantité de radioactivité incorporée par les lipides totaux (Fig. 4).
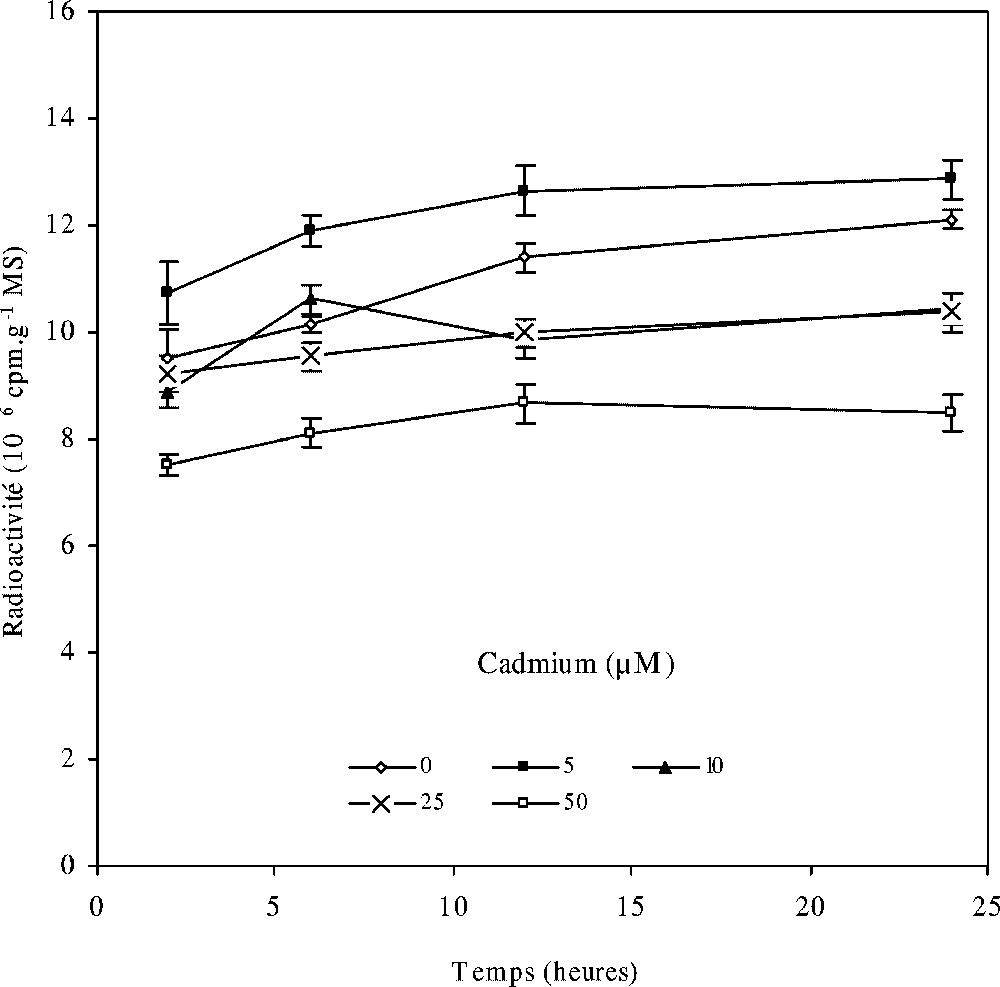
Évolution des lipides totaux radioactifs des feuilles de colza cultivé sur un milieu hydroponique et traité avec différentes concentrations de cadmium en fonction de la durée de marquage au (1-14C) acétate de sodium. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=3).
Sur la Fig. 5 est représentée l'évolution du pourcentage d'incorporation de l'acétate marqué dans les acides gras à 18 atomes de carbone des lipides totaux dans les feuilles témoins et traitées par 50 μM de Cd. Nos résultats indiquent que le traitement par le cadmium provoque une réduction des pourcentages de radioactivité de l'acide linolénique au profit des acides oléique et linoléique. Ces variations, notées particulièrement dans le , se révèlent pour toutes les concentrations de cadmium employées et durant toute la durée de la cinétique de marquage.
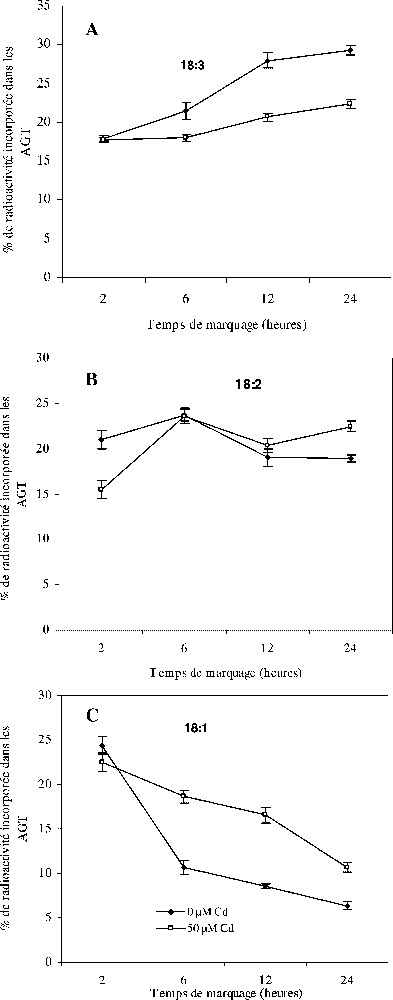
Évolution du taux de radioactivité des acides gras saturés à 18 atomes de carbone des lipides totaux des feuilles de colza, cultivé sur milieu hydroponique et traité avec différentes doses de cadmium en fonction de la durée d'incubation. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=3). AGT : acides gras totaux.
Par ailleurs, la Fig. 6 présente les résultats relatifs aux effets du cadmium sur la teneur en lipides totaux des racines de colza cultivé sur milieu hydroponique. On observe une baisse considérable de cette teneur dès la première dose du métal utilisée. À titre d'exemple, cette teneur passe de 18,6 mg g−1 MS (témoin) à 11,23 mg g−1 MS (traitement avec 5 μM de Cd), soit une réduction de . Cette baisse de la teneur en lipides totaux trouve son origine dans la chute des teneurs en phospholipides et en lipides neutres. Les résultats présentés dans le Tableau 4 montrent que la composition en acides gras totaux au niveau des racines subit des variations sous l'effet du traitement. En effet, on note une légère diminution de la teneur de compensée par une augmentation concomitante de celle de .
Variation des teneurs en lipides totaux (LT), glycolipides (GL), phospholipides (PL) et lipides neutres (LN) au niveau des racines de colza traité avec différent doses de cadmium. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=3).
Variation de la composition en acides gras totaux (%) au niveau des racines de colza traité par différentes doses de Cd. Les valeurs de la même colonne avec les mêmes lettres ne sont pas significativement différentes au seuil de 5%. Les valeurs sont des moyennes ±ES (n=3)
| Cd (μM) | Acides gras | |||||
| C16:0 | C16:1c | C18:0 | C18:1 | C18:2 | C18:3 | |
| 0 | 21 ± 2a | 12,9 ± 1,4b | 29,2 ± 2,7b | |||
| 5 | 21,9 ± 1,6a | 10,2 ± 1,1b | 33 ± 3b | |||
| 10 | 22,8 ± 1,9a | 9,4 ± 0,6b | 30,5 ± 2,3ab | |||
| 25 | 20,9 ± 1,4a | 10,9 ± 0,7b | 24,3 ± 1,8a | |||
| 50 | 20,8 ± 1,9a | 11 ± 0,5a | 24,4 ± 3,2a |
3.6 Teneur en malonyldialdéhyde (MDA)
Les données relatives au dosage du malonyldialdéhyde (MDA) sont représentées dans la Fig. 7. Nos résultats révèlent que les niveaux d'accumulation de ce produit majeur de la peroxydation des lipides membranaires dans les feuilles jeunes de colza cultivé sur milieu hydroponique et traité par des doses croissantes de CdCl2 augmentent d'une façon spectaculaire à partir de la dose 5 μM de Cd, si bien qu'au traitement avec 50 μM, son taux d'accroissement dépasse 600% par rapport au témoin.
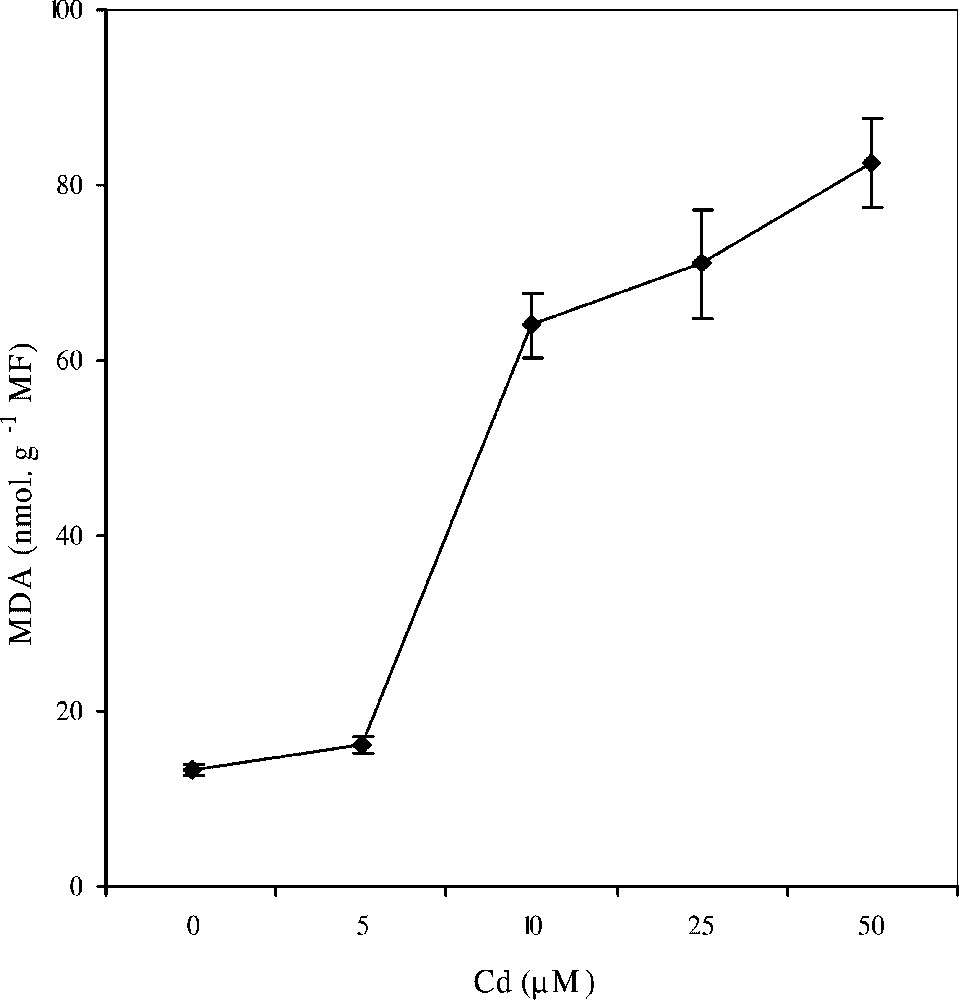
Évolution des teneurs en malonyldialdéhyde (MDA) au niveau des feuilles jeunes de colza cultivé sur milieu hydroponique, en fonction des doses croissantes de cadmium. Les intervalles de sécurité sont calculés au seuil 95% de probabilité. Les valeurs sont des moyennes ±ES (n=3).
4 Discussion
Les racines de colza possèdent une grande capacité d'accumulation de cadmium (Fig. 1A) et semblent jouer le rôle d'organes pièges permettant d'immobiliser une bonne partie du métal afin de limiter son exportation vers les organes aériens [22,23]. L'accumulation du Cd dans les racines peut s'expliquer, soit par une forte précipitation du métal dans les espaces intercellulaires [24] ou dans les vaisseaux du xylème [25,26], soit par une importante rétention pariétale du polluant [27], ou par sa séquestration endocellulaire par des peptides soufrés [28,29].
Le traitement de la plante de colza par des doses croissantes de Cd a entraîné des troubles physiologiques et métaboliques importants.
De point de vue morphologique, on note des signes visuels d'intoxication au niveau foliaire (chloroses, taches nécrotiques) qui pourraient être attribués à une déficience en éléments minéraux notamment le manganèse, le magnésium et le fer [30,31].
La croissance de la plante est réduite en présence de Cd dans le milieu de culture (Fig. 1B). Cette réduction de la production de biomasse serait due à une perte de la turgescence cellulaire [32] et d'une carence nutritionnelle induite par le métal [6,33].
En fait, parallèlement à la chute de croissance, on assiste à une déshydratation de plus en plus prononcée au niveau de la partie aérienne (Fig. 1C). Cette baisse de l'hydratation des tissus peut résulter d'un dérèglement dans l'absorption et le transport de l'eau dans la plante. En effet, la baisse de croissance des racines et, par voie de conséquence, de la surface d'absorption racinaire [34] mène à une situation de déséquilibre entre la demande en eau de la partie aérienne et la capacité d'absorption des racines pour satisfaire cet appel.
Par ailleurs, le traitement par le Cd provoque des modifications importantes au niveau du métabolisme des lipides et des acides gras chez la plante.
En ce qui concerne les lipides polaires, on observe, dans les feuilles, une réduction des quantités des lipides chloroplastiques (MGDG, DGDG, SL et PG), tandis que les quantités des lipides extrachloroplastiques (PC et PE) augmentent (Figs. 3A et B).
La réduction des lipides chloroplastiques peut engendrer des perturbations dans l'ultrastructure des thylakoïdes. Il est connu le MGDG est indispensable à l'activité du PSII [35] ; on peut alors penser que des teneurs faibles en ce composé (Fig. 3A) modifieraient l'organisation du complexe PSII et réduiraient son activité.
L'augmentation des teneurs en PC et PE peut être considérée comme une stratégie de défense élaborée par la plante dans le but d'assurer une meilleure compartimentation endocellulaire du métal. À cet effet, Djebali et al. [36] ont montré que la vésiculisation (formation de petites vacuoles) est utilisée comme un moyen de détoxification du Cd chez la tomate. Le même phénomène est observé chez d'autres espèces tolérantes [37].
En ce qui concerne la composition en acides gras des lipides foliaires, on enregistre uniquement des modifications dans les lipides chloroplastiques, tandis que la composition acidique des lipides extrachloroplastiques est pratiquement stable (Tableau 3).
Les lipides du chloroplaste sont caractérisés par leur richesse en acides gras polyinsaturés (surtout et ) (Tableau 2), ce qui explique leur grande susceptibilité vis-à-vis des métaux lourds, et notamment le Cd. En effet, ce dernier peut générer un stress oxydatif en catalysant la formation de radicaux libres ou espèces oxygénées réactives qui s'attaquent aux acides gras polyinsaturés et provoquent leur peroxydation [16]. Toutefois, l'inhibition par le Cd de l'activité des désaturases n'est pas à exclure [38].
À cet égard, l'importante réduction de la teneur de l'isomère trans de l'acide palmitoléique au profit du dans la molécule de PG serait due à une inhibition de la Δ3 désaturase, ce qui pourrait avoir un effet négatif sur l'activité photosynthétique [39].
Dans les racines, la présence de Cd dans le milieu de culture entraîne une réduction des teneurs en phospholipides et lipides neutres, ainsi qu'une légère diminution de la teneur en au profit du (Tableau 4). Malgré un niveau d'accumulation du métal très élevé comparé à celui de la partie aérienne, les racines semblent montrer une meilleure résistance face au Cd (inhibition moins prononcée de la croissance, relative stabilité de la composition en acides gras des lipides). Cette différence de comportement laisse suggérer l'existence dans les cellules racinaires de mécanismes de bioprotection plus élaborés.
Des expériences de marquage radioactif in vivo sur des feuilles en place ont montré que l'incorporation du (1-14C) acétate dans les acides gras totaux des feuilles est stimulée à la faible dose de Cd (5 μM), tandis qu'elle est inchangée aux doses 10 et 25 μM (Fig. 4). Il est à noter qu'à ces mêmes concentrations, les teneurs en lipides non marqués chutent considérablement (Fig. 2). Ceci suggère qu'il y a une dégradation de ces lipides [13,40]. Cependant, à la plus forte dose de CdCl2 (50 μM), l'incorporation du (1-14C) acétate subit une réduction qui atteint 30% par rapport au témoin après 24 h d'incubation. L'augmentation de l'incorporation de la radioactivité dans les acides oléique et linoléique aux dépens de l'acide linolénique semble indiquer que le Cd provoque une altération de la synthèse des acides gras tri-insaturés.
En plus, le dosage du malonyldialdéhyde (MDA) dans les feuilles montre que sa teneur augmente proportionnellement à la concentration du Cd dans le milieu de culture, ce qui prouve qu'il y a une dégradation oxydative des lipides et des acides gras insaturés, probablement consécutive au stress oxydatif généré par le métal [41,42].
Le traitement de la plante de colza par le Cd entraîne une peroxydation des lipides et notamment des lipides chloroplastiques riches en acides gras polyinsaturés, mais à forte dose, il y a, en plus, une inhibition de la biosynthèse des acides gras.
Les modifications observées au niveau des lipides du chloroplaste peuvent affecter la structure des membranes thylakoïdales et inhiber par conséquent la photosynthèse.


