1 Introduction
Les mécanismes de passage des éléments minéraux pouvant être toxiques chez l'organisme vivant se sont révélés beaucoup plus complexes qu'on ne le supposait. C'est ainsi que d'importantes études ont été entreprises, utilisant de nouvelles méthodes de microanalyse, afin de mieux comprendre le comportement de ces éléments dans les organismes vivants. Ces études ont permis de découvrir en 1974 une fonction jusque-là inconnue d'un organite cytoplasmique microscopique spécialisé, le lysosome, capable d'extraire l'uranium présent à l'état de trace dans le sang pour le concentrer en quelques heures jusqu'à des concentrations 100 000 fois supérieures aux concentrations sanguines [1]. Ce mécanisme unique de détoxication, extrêmement rapide et puissant, est maintenant bien compris ; il est de nature enzymatique, et on a pu montrer par la suite que 15 éléments toxiques tels que ceux du groupe IIIA de la classification périodique de Mendeleïev, les lanthanides, certains actinides, etc., sont éliminés de cette façon [2]. Parmi tous les organes étudiés, le foie semble être un site privilégié de concentration sélective de nombreux éléments minéraux [2]. Parmi ces éléments, le gadolinium (Gd), un lanthanide largement répandu dans la nature, occupe une place de choix, compte tenu de ses nombreuses applications, à la fois médicales et industrielles. En effet, le gadolinium est utilisé, de par ses propriétés paramagnétiques, comme agent de contraste dans les imageries par résonance magnétique nucléaire (IRM) tels que le Gd-DTPA, le Gd-DOTA et le Gd-EDTA, pour détecter les tumeurs hépatiques, cérébrales, etc. Cet élément est également très utilisé dans les industries les plus modernes, telles que la fabrication des mémoires d'ordinateurs, les lecteurs enregistreurs vidéo [3]...
Le but du présent travail a été :
- – de préciser d'abord la localisation intracellulaire du Gd au niveau du foie consécutivement à son administration par voie parentérale sous forme d'un sel soluble de nitrate de Gd ;
- – de déterminer ensuite le site de sa concentration intracellulaire au niveau de l'intestin proximal consécutivement à son administration par voie orale.
Pour cela, trois méthodes d'observation et d'analyse, parmi les plus sensibles, ont été utilisées : la microscopie électronique par transmission (MET), la microanalyse ionique analytique (MIA) et la microanalyse par sonde électronique (MASE).
2 Matériel et méthodes
2.1 Expérimentation animale
Pour toutes les expérimentations réalisées, de jeunes rats mâles adultes de souche Wistar, pesant 200 g en moyenne, ont été sélectionnés. La solution administrée était un sel soluble de nitrate de Gd (GdNO3-Sigma), et ce par deux voies, parentérale et orale.
2.1.1 Administration par voie parentérale
Un premier groupe de huit rats a reçu par voie parentérale sept injections de 1 ml, contenant 4 mg de nitrate de Gd par injection, échelonnées sur deux semaines, soit trois injections par semaine
2.1.2 Administration par voie orale
Un troisième groupe de 16 rats a reçu par voie orale une solution soluble contenant 30 mg de nitrate de Gd (GdNO3-Sigma). Six rats témoins, maintenus dans les mêmes conditions expérimentales, ont reçu 1 ml de sérum physiologique, constituant ainsi le groupe témoin. Les rats ont été sacrifiés, soit 6 h, soit 4 j après l'administration ; le duodénum et le foie ont ensuite été prélevés.
2.2 Traitement des échantillons
Les fragments ont été traités selon les techniques classiques de microscopie électronique. La microanalyse a été réalisée avec une microsonde Camebax équipée d'un MET sur des coupes ultrafines de tissus prélevés, déposées sur des grilles en cuivre. Les spectromètres utilisés sont de type « à dispersion de longueur d'onde ». Ils ne permettent aucune ambiguïté quant à l'interprétation des spectres. Des coupes semi-fines ont été déposées sur des lames d'or pur pour l'étude au MIA. Les lames d'or sont de très haute pureté chimique et ne constituent donc pas une source d'éléments contaminants.
2.3 Méthodes d'observations et d'analyse
2.3.1 Microscopie électronique par transmission
La microscopie électronique est une technique qui permet de visualiser les structures grâce à des appareils dont la source de rayonnement émet des électrons. Le type de microscope électronique utilisé dans cette étude était un microscope électronique par transmission de type Philips EM 300.
2.3.2 Microanalyse ionique analytique
Cette technique permet d'obtenir des images analytiques représentant la carte de distribution de la plupart des isotopes des éléments présents dans une coupe de tissu, avec une résolution spatiale de 0,5 μm [4]. L'intérêt majeur de cette méthode est lié à sa très haute sensibilité, permettant la détection et l'imagerie d'éléments présents en très faible concentration (<0,1 ppm), soit un gain considérable, de l'ordre de 1000 à 100 000 pour la majorité des éléments par rapport à la microanalyse par sonde électronique, première méthode de microanalyse proposée par Raymond Castaing [5]. Une deuxième caractéristique nouvelle de cette méthode, encore peu exploitée en biologie, est la possibilité de distinguer entre eux les différents isotopes stables ou non d'un même élément, permettant ainsi de déterminer les rapports isotopiques dans des volumes intracellulaires de l'ordre du micron cube ou moins. Le microanalyseur utilisé est de type SMI 300 (Cameca).
2.3.3 Microanalyse par sonde électronique
La microanalyse par sonde électronique, basée sur la spectrographie des rayons X, introduite par Castaing [5], est une méthode d'analyse ponctuelle permettant de déterminer dans un échantillon la composition chimique de volumes extrêmement petits de matière, inférieurs au micron cube. L'appareil utilisé est une microsonde Camebax équipée d'un microscope électronique par transmission de type Philips EM 300. La détection des éléments est réalisée avec un spectromètre de type dispersif en longueur d'onde et équipé d'un cristal PET (pentaerthritol), TAP (thalium acid phtalate) ou LiF (lithium fluoride).
3 Résultats
3.1 Administration par voie parentérale
3.1.1 Foie
Microscopie électronique par transmission (Fig. 1A).
L'étude ultrastructurale réalisée sur des coupes ultrafines de foie de rat ayant reçu par injections parentérales une dose totale de 140 mg/kg de nitrate de Gd montre des cellules hépatiques avec leurs noyaux (N), un canalicule biliaire (Cb) et différents organites cellulaires – ergastoplasme (E), lysosomes (L), mitochondries (m). On note la présence d'amas granulaires denses situés près du canalicule biliaire, correspondant à des accumulations intralysosomiales. Ces accumulations, observées aussi bien au niveau des cellules de Küppfer qu'au niveau des hépatocytes, sont tantôt petites, tantôt volumineuses, et la plupart des lysosomes présentent un contour irrégulier (Fig. 1A). Aucune autre anomalie n'a été observée au niveau du tissu hépatique.
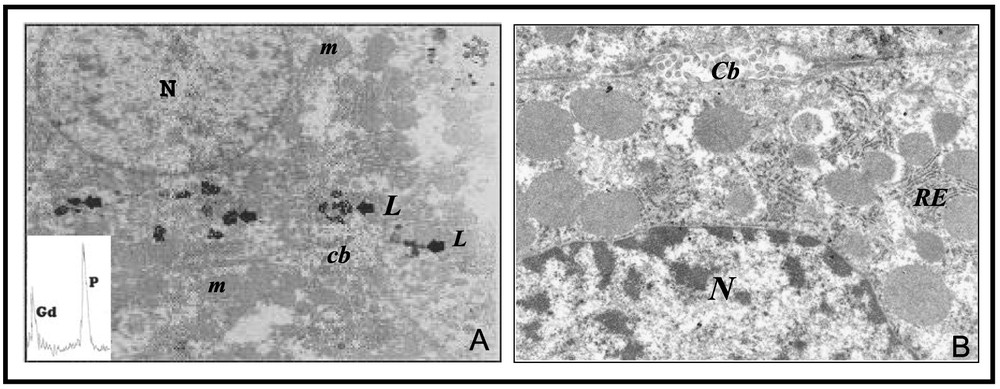
(A) Microscopie électronique par transmission (G:×16 000) : hépatocyte avec le noyau (N) et des lysosomes (L) chargés d'un matériel dense aux électrons situés près d'un canalicule biliaire (Cb). Microanalyse par sonde électronique : le spectre d'analyse X révèle la présence de phosphore (P) et de gadolinium (Gd) au sein des lysosomes. (B) Microscopie électronique par transmission (G:×5000) : hépatocyte avec le noyau (N). On observe le réticulum endoplasmique (RE) ainsi qu'un canalicule biliaire (Cb). On n'observe aucune surcharge au niveau des différents territoires. Masquer
(A) Microscopie électronique par transmission (G:×16 000) : hépatocyte avec le noyau (N) et des lysosomes (L) chargés d'un matériel dense aux électrons situés près d'un canalicule biliaire (Cb). Microanalyse par sonde électronique : le spectre d'analyse X révèle la ... Lire la suite
L'étude ultrastructurale réalisée sur des coupes de foie des rats témoins ne montre aucune surcharge au niveau des différents territoires étudiés (Fig. 1B).
Microanalyse par sonde électronique.
Cette technique, mise en œuvre sur les amas de granulations denses intralysosomiaux observés antérieurement en MET sur des coupes de foie de rats traités, a pu mettre en évidence sur le cristal de TAP la raie Kα caractéristique du phosphore (P) et, sur le cristal de LiF, la raie Lα caractéristique du Gd (Fig. 1A).
Microanalyse ionique analytique (Fig. 2).
La microanalyse ionique permet d'obtenir la répartition de l'ion calcium (Ca2+) au sein d'une coupe de foie. Cette image a pour unique objectif la reconnaissance de la structure histologique du tissu, montrant notamment l'emplacement des noyaux cellulaires. Sur le même champ, la répartition d'un isotope du Gd, le 158Gd, a été cartographiée. Des amas plus ou moins volumineux localisés dans tout le territoire hépatique ont été observés. Aucune trace de Gd ou d'autres éléments chimiques exogènes n'a été détectée par les différentes techniques utilisées au niveau des coupes de foie de rats témoins (Fig. 3).
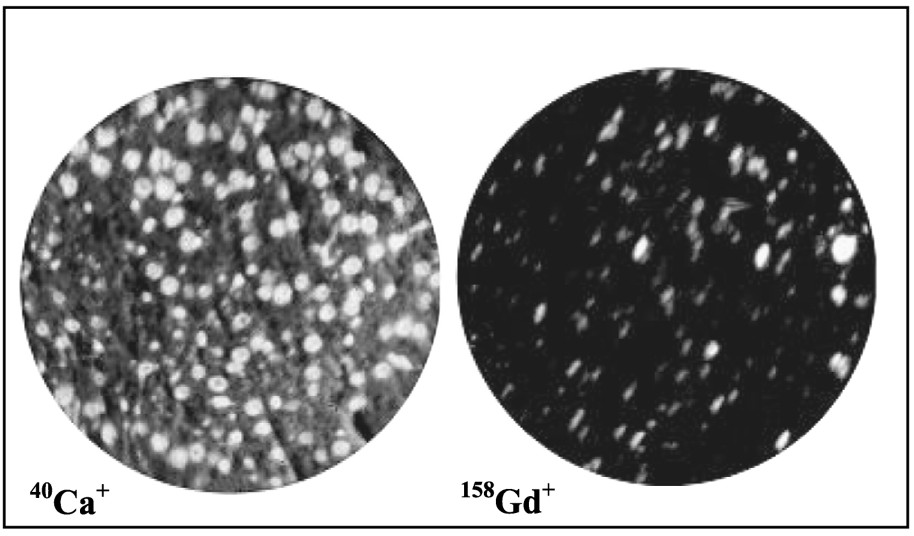
Microscopie ionique analytique (G:×400) : l'image de gauche représente la distribution du 40Ca+ ; sur la même plage, l'image de droite donne la distribution du 158Gd+, qui apparaît sous forme de points brillants, avec un aspect non homogène.

Microscopie ionique analytique (G:×400) : on observe à gauche l'image de la distribution du 40Ca+, à droite, et sur la même plage, l'image de la distribution du 158Gd+. Aucune trace de gadolinium n'a été retrouvée au niveau des différents territoires hépatiques.
3.2 Administration par voie orale
3.2.1 Duodénum (6 h)
Microscopie électronique par transmission et microanalyse par sonde électronique.
Administré par voie orale et sous forme soluble, le Gd a été retrouvé sous forme de granulations plus ou moins denses au niveau des lysosomes de la partie apicale des entérocytes duodénaux 6 h après l'administration. Nous n'avons pas pu appliquer la MASE du fait de la taille très réduite des lysosomes des entérocytes duodénaux (Fig. 4). Aucune autre anomalie n'a été relevée au niveau des différents territoires intestinaux étudiés.

Microscopie électronique par transmission. (G:×10 000) : pôle apical d'un entérocyte duodénal. On distingue les microvillosités (Mv) et, dans le cytoplasme, les lysosomes (L), chargés d'un matériel dense aux électrons.
Microanalyse ionique.
Appliquée sur des coupes de duodénum de rats ayant reçu une administration unique de la solution soluble de nitrate de Gd, la MIA a montré la présence de points brillants contournant les pôles apicaux des entérocytes duodénaux 6 h après l'administration. Ces points brillants, témoignant de la localisation spécifique du Gd, correspondent aux régions des cellules où ont été antérieurement observés les lysosomes chargés (Fig. 5).

Microscopie ionique analytique (G:×400) : l'image de gauche représente la distribution du 40Ca+ au sein d'une villosité intestinale (∗) entourée de part et d'autre de deux villosités incomplètes. À droite, et sur la même plage, on observe l'image de la distribution du 158Gd+. Le gadolinium apparaît sous forme de points brillants (↑) contournant les villosités.
3.2.2 Foie (6 h)
Aucune trace de Gd n'a été retrouvée au niveau de cet organe quand les prélèvements sont effectués 6 h après l'administration orale de Gd, quelle que soit la technique d'analyse utilisée.
3.2.3 Duodénum (4 j)
Microscopie électronique par transmission et microanalyse par sonde électronique.
Ces deux techniques n'ont pas permis de mettre en évidence de trace de Gd au niveau du duodénum lorsque les prélèvements étaient effectués 4 j après l'administration orale de cet élément (Fig. 6).

Microscopie électronique par transmission (G:×5000) : pôle apical d'un entérocyte duodénal 4 j après administration orale du gadolinium. On distingue les microvillosités (Mv) et, dans le cytoplasme, les mitochondries (m) et de nombreux lysosomes (L) non chargés.
Microscopie ionique analytique.
Nous n'avons pas pu détecter de gadolinium ou d'autres éléments exogènes à l'aide de la MIA au sein du duodénum.
3.2.4 Foie (4 j)
Aucune trace de Gd n'a été observée au niveau du foie prélevé 4 j après l'administration orale de cet élément, quelle que soit la méthode d'analyse utilisée.
4 Discussion
4.1 Administration par voie parentérale
Depuis l'introduction de méthodes de microanalyse telles que la MASE et la MIA, une deuxième fonction du lysosome a été mise en évidence : celle de concentrer sélectivement certains éléments minéraux toxiques ou atoxiques, la première fonction connue du lysosome étant celle de dégrader les molécules organiques [6]. Ce phénomène de concentration sélective des éléments minéraux a été démontré d'abord au niveau du tube rénal pour l'uranium et l'or [1], puis généralisé pour d'autres éléments de la classification périodique de Mendeleïev comme l'aluminium, l'indium, le gallium, l'hafnium, le zirconium, le chrome, le niobium, le gadolinium, le cérium, le samarium, le thulium, le lanthane, le palladium, le nickel, le platine, le cuivre et l'argent [2]. Ce mécanisme de précipitation sélective de certains éléments minéraux est dû à l'existence, au sein des lysosomes, d'enzymes telles que les phosphatases ou les sulfatases acides, capables de précipiter l'élément administré sous forme de sels de phosphate ou de sulfate insolubles. Ce sont les travaux de Berry et al. sur l'aluminium [7] qui ont permis de mettre en évidence une activité phosphatase acide intralysosomale et de proposer que cette précipitation pourrait être assimilée à une réaction de Gomori in vivo [8]. Nos études microanalytiques ont montré la présence de dépôts au niveau des différents territoires hépatiques, à savoir les canaux biliaires, les hépatocytes et les cellules de Küppfer (Figs. 1A et 2). Ces résultats confirment les travaux de Hocine et al. [9–11] et rappellent ceux obtenus pour d'autres lanthanides comme le cérium, le lanthane [2,12] et le terbium [10] qui ont été retrouvés au niveau du tissu hépatique. Les lysosomes des cellules du foie sont donc les organites cibles de concentration et de précipitation du Gd (Figs. 1A et 2). L'analyse par sonde électronique de ces amas de grains denses a permis de détecter du phosphore et du Gd (Fig. 3). On peut alors conclure que les dépôts observés en MET sont composés de gadolinium (Gd) associé à du phosphore (P), formant du phosphate de gadolinium insoluble dans les lysosomes.
4.2 Administration par voie orale de nitrate de gadolinium
Le phénomène de précipitation d'un élément minéral au sein de la muqueuse gastro-intestinale a été décrit pour la première fois par Florent et al. en 1991 [13]. En effet, il a été démontré que le Maalox, un antiacide à base d'hydroxyde d'aluminium, en ingestion prolongée chez l'homme lors de situations pathologiques telles que les ulcères gastroduodénaux, traverse le pôle apical des entérocytes et précipite ensuite au niveau des lysosomes, probablement sous forme de phosphate d'aluminium insoluble au sein des cellules duodénales, fundiques et antrales. Deux autres éléments du groupe IIIA de la classification périodique ont été étudiés, l'indium et le gallium [14], de même que certains lanthanides, tels que le cérium [12,14], le lanthane [14,15], le thulium [14,15] et l'europium [14]. Ces travaux ont montré que ces éléments précipitent au niveau des lysosomes de la partie apicale des entérocytes duodénaux sous forme de sels de phosphate insolubles. L'analyse des entérocytes duodénaux des animaux dont les prélèvements ont été effectués 6 h après l'ingestion de nitrate de Gd a montré la présence de points brillants relativement denses aux électrons dans les lysosomes de la partie apicale des entérocytes duodénaux (Figs. 3 et 4). Nous n'avons pas pu détecter de Gd ou d'autres éléments exogènes au niveau des dépôts intralysosomaux par la méthode de la MASE. Par analogie avec les travaux antérieurs effectués grâce à la MASE ainsi que d'après les résultats de nos travaux réalisés sur le foie qui ont montré que le Gd précipitait dans les lysosomes associé à du phosphore, il apparaît très probable que le même phénomène a lieu au niveau des lysosomes des entérocytes. Cependant, la démonstration directe n'a pas pu être faite ici par MASE, compte tenu des faibles quantités de Gd présent dans les entérocytes, d'une part, et d'autre part, des faibles dimensions du lysosome dans cette cellule particulière qu'est l'entérocyte, dont le renouvellement est très rapide (∼4 j) [13–15]. Aucune surcharge n'a été non plus retrouvée au niveau du foie, lorsque le Gd a été administré par voie orale. L'absence de cet élément au niveau du foie faisant suite à son administration par voie orale s'oppose à la facilité avec laquelle on le retrouve au niveau de ce même organe lorsque l'élément est administré par voie parentérale (Figs. 1A et 2). En effet, administré par voie orale, le Gd précipite au niveau des lysosomes des entérocytes duodénaux, puis est éliminé par le phénomène naturel d'apoptose en moins de quatre jours hors de l'organisme (Fig. 5). De ce fait, et compte tenu de sa faible absorption intestinale, il ne présente pas de risque potentiel pour l'organisme. En revanche, administré par voie parentérale, son élimination reste lente. Ces observations doivent être interprétées à la lumière de nos connaissances actuelles sur les aspects anatomo-fonctionnels de l'appareil digestif. En effet, malgré la relation très étroite qui existe entre le grêle et le foie, le Gd n'a pas été retrouvé au niveau des cellules hépatiques consécutivement à son administration par voie orale, témoin du rôle joué par la muqueuse duodénale en tant que siège de la précipitation de cet élément sous forme insoluble, empêchant ainsi son passage dans le sang et jouant de ce fait un véritable rôle de barrière à l'égard d'éléments pouvant être toxiques ou n'ayant pas de rôle physiologique connu. En effet, les cellules ayant concentré et insolubilisé ces éléments meurent naturellement par apoptose au bout de 72 h, puis sont éliminées par voie digestive avec leurs précipités, contribuant ainsi à la détoxication du milieu intérieur.


