Abridged English version
The evolution of plant vascular tissues solved the problem of long-distance transport of water and nutrients, thus enabling early vascular plants to gradually colonize land. This vascular system, composed of phloem and xylem, provides both a pathway for interorgan transport and a mechanical support. In contrast to xylem, whose vessels are made of the lignified walls of dead cells and ensure the transport of water, mineral salts and some hormones, phloem controls the transport and distribution of photosynthetic products from mature leaves to other organs, including meristems, developing organs, fruit or sink, storage organs. The phloem tubes consist of files of living cells called the sieve elements. Photoassimilates are normally loaded into the sieve-tube system at the minor veins of mature leaves. They enter the long-distance component of the phloem by pressure-driven bulk flow of the translocation stream. Both loading and unloading of nutrients rely on symplasmic delivery either via plasmodesmata or through the apoplasm, via specific transporters located at the plasma membranes of companion cells and sieve elements. The identification and the characterization of such transporters are essential to the understanding of phloem functions.
The phloem pathway is also implicated in plant responses to environmental stimuli such as light, nutrient deprivation, abiotic stress, pathogen infection, and pest attack. A role for a phloem interorgan communication system has been postulated in many developmental or physiological processes, such as floral induction, wounding response and systemic acquired resistance. A milestone was the identification of the non-cell autonomous FT protein known as the florigen. This discovery established that proteins trafficking over long distances within the phloem stream are able to regulate the expression of genes in distant organs. More evidence came from the dissection of the wound-response signalling pathway in the phloem, which showed that phloem not only produces and translocates signals over long distances, but also amplifies the signal and produces secondary messengers. Finally, the identification of a number of small mobile RNAs in the phloem sap suggests that a more general control pathway operates though the phloem for global coordination of gene expression in different organs.
At the tissue level, the companion cell-sieve element complex forms the functional unit of phloem tubes in angiosperms. The complexity of phloem function in relation to structure and physiology is now being recognized. Nevertheless, despite a key role in plant life and adaptation, little is known about the genes controlling phloem differentiation and function. Phloem represents a small proportion of plant tissues, as phloem cells are small; indeed this made its study problematic in the past. This difficulty was recently overcome using phloem-enriched fractions of plant tissues, which enabled the generation of libraries of genes that were preferentially expressed in the phloem and potentially involved in specific functions. This has provided new clues for the identification of key factors controlling the transport of macromolecules in the phloem, as well as signalling pathways and signals involved in long-distance coordination in plants.
1 Introduction
La colonisation des milieux terrestres par les végétaux s'est accompagnée de nombreuses adaptations, portant sur l'architecture des plantes, leur reproduction, l'économie de l'eau dans l'organisme et la mise en place de tissus vasculaires véhiculant entre différents organes l'eau, les nutriments, les sels minéraux et différents signaux. L'apparition du xylème et du phloème ont été des étapes évolutives essentielles. En revanche, ces deux tissus présentent une anatomie très différente. Les flux de sève phloémienne se font au sein de files de cellules vivantes, les éléments criblés, sous un gradient de pression hydrostatique, alors que les flux de sève xylémienne se font dans des files de cellules mortes, les éléments de vaisseaux, sous l'action conjuguée de la poussée racinaire, de la capillarité et de l'évapotranspiration. Les deux tissus communiquent par des échanges latéraux, permettant l'ajustement des besoins en eau et la coordination des flux de sève. Les fonctions de ces tissus sont également bien distinctes. Le xylème achemine l'eau puisée par les racines et chargée d'ions minéraux vers les parties aériennes de la plante, alors que le phloème assure la distribution des sucres produits au cours de la photosynthèse vers l'ensemble des organes non photosynthétiques. Cette fonction est essentielle, puisque les sucres transportés par le phloème constituent la source énergétique de tous les tissus. Le phloème transporte également de nombreux autres métabolites, ions, ou signaux. Il constitue ainsi une voie centrale de transport et de signalisation. Il est utilisé comme voie de transport par les virus phytopathogènes, pour la colonisation systémique de la plante, ainsi que par le phytoplasmes et diverses bactéries du phloème. De surcroît, le phloème est la cible des insectes piqueurs suceurs, les pucerons par exemple, qui se nourrissent de sève élaborée.
Les recherches les plus récentes menées sur le phloème ont révélé les mécanismes de chargement en photoassimilats du phloème, son rôle central dans différents mécanismes de signalisation à longue distance et certains mécanismes de régulation du métabolisme azoté et carboné en réponse à l'environnement. Elles ont aussi révélé des aspects insoupçonnés de la signalisation entre organes chez les végétaux supérieurs, régissant des étapes clés de développement ou d'adaptation à l'environnement.
2 Anatomie du phloème : une spécialisation cellulaire unique
Dans les feuilles, les tissus vasculaires présentent une organisation en réseau fermé, dont la géométrie suit des règles mécaniques assez simples [1]. Cette architecture diffère en cela de celle en réseau ouvert observé chez les animaux. Les nervures sont organisées de façon hiérarchique (Fig. 1A) à partir des nervures principales (nervure d'ordre I). Les nervures d'ordre II et III forment une trame régulière. Les nervures d'ordre IV présentent souvent une extrémité libre, en cul-de-sac. Dans les parties aériennes de la plante, phloème et xylème ont le plus souvent une organisation coaxiale (Fig. 1B), permettant des échanges entre ces deux tissus, avec le phloème en position externe et le xylème en position interne. Le phloème assure le transport de la sève élaborée des organes photosynthétiques (organes « sources ») vers les autres organes ( « puits ») (Fig. 1C). Cette sève est ainsi chargée de photoassimilats, essentiellement des sucres. Dans les feuilles, la direction des flux de sève phloémienne varie en fonction du développement de la plante, en réponse à la capacité d'exportation des photoassimilats. Mais les feuilles ne sont pas les seuls organes se comportant, suivant les conditions physiologiques, comme « puits » ou « source » : citons par exemple les organes de stockage ou de transport à partir desquels les sucres peuvent être remobilisés.
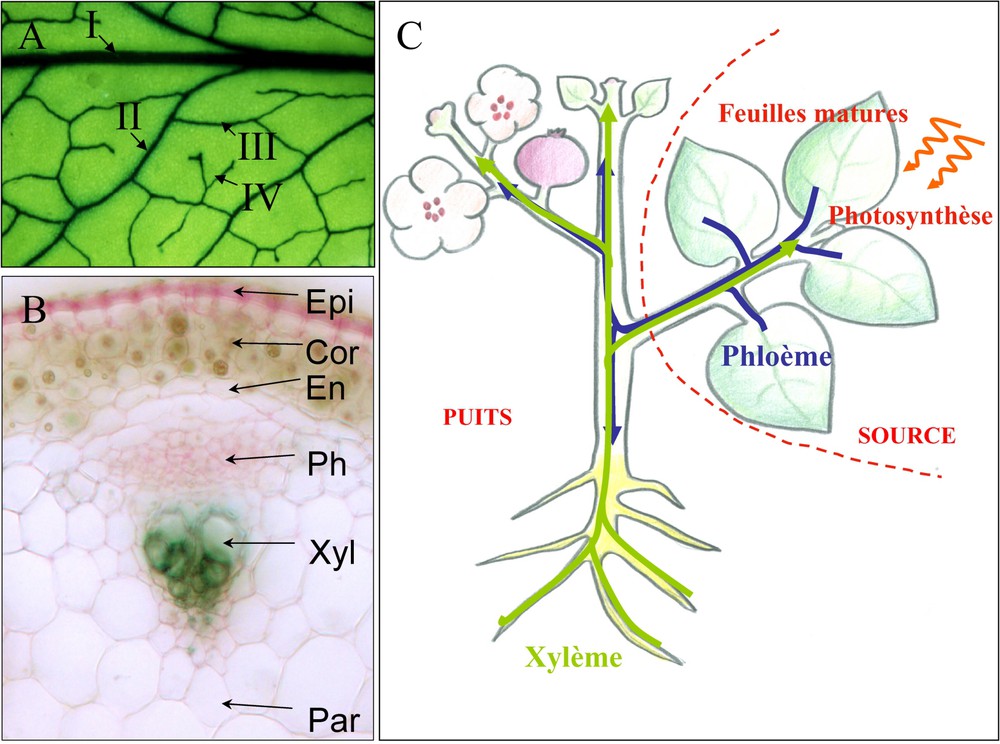
Organisation et architecture des tissus vasculaires. (A) Architecture des nervures dans une feuille d'Arabidopsis thaliana. Les nervures sont visualisées par une coloration bleu foncée, obtenue par expression d'un marqueur dans les tissus vasculaires. Dans la feuille, la nervure principale (nervure d'ordre I) est reliée aux nervures d'ordre II. Les nervures d'ordre III relient, dans le limbe foliaire, les nervures d'ordre II. Les nervures les plus fines (ordre IV) sont parfois en cul-de-sac. (B) Organisation des tissus vasculaires dans la hampe florale d'Arabidopsis thaliana. Observation des tissus vasculaires dans une coupe transversale de hampe florale. Les tissus vasculaires sont colorés différentiellement avec du carmin aluné et du vert d'iode. Ces réactifs colorent en vert la lignine (parois du xylème) et en rose la cellulose (parois du phloème). Xyl : xylème (en vert) ; Ph : phloème (en rose) ; En : endoderme ; Epi : épiderme ; Cor : cortex ; Par : parenchyme médullaire. (C) Représentation schématique des flux de sève dans les tissus vasculaires, phloème et xylème. Le xylème (représenté en vert clair sur la figure) transporte l'eau et les sels minéraux absorbés par les racines vers les parties aériennes de la plante. Le phloème (représenté en bleu sombre sur la figure) transporte les sucres, produits par photosynthèse, des organes photosynthétiques (feuilles matures) vers les autres organes : fruits, racines, méristèmes, organes de stockage et organes en cours de formation. Les organes exportateurs sont appelés « source » et les organes importateurs sont appelés « puits ». (Le lecteur est renvoyé à la version electronique de cet article pour l'interpretation des références à la couleur dans cette légende de figure.)
L'organisation du phloème repose sur plusieurs types cellulaires très spécialisés [2]. Les processus de différenciation du phloème commencent seulement à être élucidés [3,4] ; l'analyse de mutants affectés dans la formation du phloème suggère un lien important avec la mise en place du xylème. Les principaux types cellulaires dans le phloème sont les cellules compagnes, les cellules de parenchyme phloémien et les cellules des éléments criblés (ou éléments criblés). Chez certaines espèces, par exemple le lin et le chanvre, des fibres phloémiennes riches en cellulose sont également présentes. La sève élaborée est transportée au sein des éléments criblés. Les cellules qui les composent s'organisent en longues files cellulaires dont les parois transversales (les cribles), qui sont perforées de nombreuses ouvertures (les pores), laissent librement circuler la sève phloémienne. Ces cellules subissent de nombreuses modifications nécessaires à leur fonction de transport : disparition de la vacuole, du noyau, du réticulum endoplasmique granuleux et de l'appareil de Golgi [5,6]. Les modifications des parois des éléments criblés conduisent à un épaississement des parois latérales (appelés dépôts nacrés) et à une modification des plasmodesmes présents entre éléments criblés et cellules compagnes (plasmodesmes branchus). Les plastes des éléments criblés évoluent pour le stockage de l'amidon (amyloplastes). Les organelles persistant dans les cellules des éléments criblés (mitochondries, plastes, réticulum endoplasmique lisse) sont généralement observées à la périphérie des cellules, probablement ancrées à la membrane par des structures spécifiques [6]. Chez les dicotylédones, apparaissent également des structures protéiques particulières, appelées protéines P, qui présentent une organisation filamenteuse [7]. Ces protéines P auraient un rôle structural qui reste à définir. Chez les fabacées, des structures particulières des éléments criblés, les forisomes, ont été isolées et caractérisées. Ces forisomes présentent un état condensé ou dispersé en réponse à des stress [8,9] ; ce processus, réversible, serait impliqué dans le blocage du flux de sève phloémienne lors de blessures ou d'altérations de l'intégrité des éléments criblés.
Le chargement en métabolites de la sève phloémienne se fait le plus souvent au travers de l'interface du complexe cellule compagne–élément criblé, et implique des structures de communication intercellulaire, les plasmodesmes. Chez certaines espèces, les cellules compagnes présentent très peu de liaisons symplasmiques (par les plasmodesmes) avec les cellules du parenchyme phloémien, et présentent des parois modifiées. Il s'agit de protubérances pariétales ; celles-ci, tapissées par la membrane plasmique, augmentent significativement les surfaces d'échange entre l'apoplasme phloémien et le symplasme du complexe conducteur. Ces cellules compagnes, hautement spécialisées, sont dénommées cellules de transfert.
Malgré ces modifications profondes, les cellules des éléments criblés sont toujours vivantes, puisqu'elles maintiennent une activité enzymatique et énergétique [2]. En revanche, du fait de la disparition du noyau et du réticulum endoplasmique granuleux, elles dépendent pour leur approvisionnement en protéines et en métabolites des cellules compagnes. Les cellules compagnes présentent ainsi une intense activité métabolique et apparaissent comme des centres de trafic intercellulaire intense. Le chargement des sucres dans le phloème est contrôlé au niveau du complexe cellule compagne–élément criblé [10]. De nombreux autres composés sont chargés dans les éléments criblés, notamment acides aminés, vitamines, ions, composés xénobiotiques, sulfates, phosphates, composés phénoliques, antioxydants, molécules signal, métaux [11–21]. Le complexe cellule compagne–élément criblé constitue ainsi un exemple exceptionnel de transfert et de contrôle de la répartition de nombreux métabolites et ions minéraux entre l'ensemble des organes de la plante [6,22]. Les cellules du parenchyme phloémien, dont le rôle est moins connu, apparaissent également très actives ; elles sont impliquées dans le chargement, le stockage ou la maturation de composés métaboliques variés [23–28].
Des observations ont également révélé un rôle insoupçonné de la compartimentation dans les différents types cellulaires du phloème. Par exemple, les glucosinolates sont stockés dans les cellules S du phloème [24], alors que les myrosinases, enzymes impliquées dans leur clivage en composés toxiques pour les insectes, sont synthétisées et stockées dans les cellules M du phloème [25]. Lors d'une agression par les insectes, glucosinolates et myrosinases sont mis en présence et les thiols produits sont chargés dans les éléments criblés.
Les cellules du phloème présentent d'autres particularités. Elles représentent une très faible fraction du volume des organes, en raison de leur taille réduite [5]. Elles fonctionnent dans un environnement pauvre en oxygène [29].
3 Spécialisation des fonctions du phloème dans les nervures de différents ordres
Dans la feuille, les différentes nervures ne présentent pas les mêmes caractéristiques de chargement et de déchargement. Dans les organes « source », le chargement en sucre est assuré par les nervures d'ordre IV [30,31]. Le déchargement en soluté se fait dans les organes « puits » dans les nervures d'ordre III [32,33]. La transition source–puits s'accompagne d'une modification de l'architecture des plasmodesmes, de simples dans les organes « puits » à branchus dans les organes « sources » [30–32].
Les propriétés des plasmodesmes varient au cours du développement [34,35]. Elles permettent l'établissement de domaines symplasmiques, permettant le trafic intercellulaire par les plasmodesmes de molécules suivant leur taille [31,33,36]. La taille d'exclusion limite des plasmodesmes est finement régulée au cours du développement, lors de la transition source–puits, suivant les organes et suivant la physiologie de la plante [30,34,35,37–40].
4 Composition de la sève phloémienne
Un rôle essentiel du phloème est le transport des sucres, notamment sous forme de saccharose, qui est un élément essentiel du métabolisme énergétique de la plante. Le saccharose est la forme principale de transport des glucides à longue distance. Sa concentration dans la sève élaborée peut atteindre, suivant les espèces, 0,5 à 1 M. La sève phloémienne, qui est légèrement alcaline (pH 7,5–8,5), contient également des composés azotés, dont des acides aminés (de l'ordre de 50 à 200 mM), des acides organiques et amides, des protéines (de 0,1 à 30 mg/ml), des peptides, des ARN, des sels minéraux (K+), des ions (Ca2+) et d'autres signaux (hormones, oxyde d'azote, espèces réactives de l'oxygène ...). La plupart des hormones ont été retrouvées dans la sève phloémienne, notamment auxine, cytokinine, acide abcissique, gibbérelline et éthylène [41]. L'acide salicylique et l'acide jasmonique, molécules « signal » essentielles dans la mise en place systémique des mécanismes de défense, sont également retrouvés [20,42]. De nombreuses protéines sont présentes dans la sève phloémienne. Plus de 150 protéines ont ainsi été identifiées dans la sève phloémienne chez différentes espèces [43–48]. Il s'agit d'enzymes participant au contrôle du potentiel redox, de composés antioxydants, de protéines de structure (protéines P, éléments du cytosquelette), de protéines de défense (PR protéines, inhibiteurs de protéase) et d'enzymes agissant sur le métabolisme primaire ou secondaire [49–54]. Des protéines présentant des propriétés de fixation à l'ARN, de chaperone ou des facteurs de transcription putatifs ont également été identifiées [55–59]. De même la sève phloémienne comporte une large variété de métabolites [60,61].
Il est vraisemblable que les protéines et les métabolites présents dans la sève phloémienne différent en partie de ceux qui sont présents dans les cellules compagnes. Certaines protéines sont synthétisées directement dans les éléments criblés au cours de leur différenciation [52]. En revanche certaines protéines synthétisées dans les cellules compagnes ne sont pas exportées dans les éléments criblés [62]. Un résultat inattendu a été la mise en évidence du fait que la destination des protéines dans les parties aériennes ou racinaires de la plante via le phloème est sélective et recrute des facteurs de sélection, ou chaperones, phloémiens [63]. De même, le profil métabolique de la sève phloémienne varie dans différents éléments criblés d'un même faisceau cribrovasculaire [60]. Ces résultats suggèrent qu'il existe des domaines phloémiens distincts de par leurs compositions protéiques et métaboliques.
5 Chargement, transport et déchargement des sucres
La forme principale de transport des sucres est le saccharose, sucre non réducteur. Chez certaines espèces, d'autres sucres peuvent être transportés, comme le raffinose (trisaccharide) et le stachyose (tétrasaccharide), ou des sucres-alcools (ou polyols), mannitol et sorbitol. Les glucides issus de la photosynthèse (trioses phosphates) et synthétisés dans les chloroplastes des tissus chorophylliens (cycle de Calvin–Benson) sont convertis en saccharose dans le cytoplasme. Il est assez généralement admis que le saccharose est acheminé des cellules où il est synthétisé vers les tissus vasculaires en suivant la voie symplasmique, c'est-à-dire par les plasmodesmes. Chez les espèces apoplasmiques, il serait ensuite chargé dans l'apoplasme (ou apoplaste), c'est-à-dire l'espace extracellulaire, au niveau de la gaine périvasculaire ou du parenchyme phloémien [64], par un mécanisme peu documenté [10]. L'étape de chargement proprement dit, dans le complexe cellule compagne-élément criblé, se fait suivant les espèces soit par des transporteurs de disaccharides (voie apoplasmique) soit directement par les plasmodesmes (voie symplasmique) (Fig. 2A). Chez certaines espèces, en particulier les cucurbitacées, le saccharose est converti dans les cellules de transfert en oligosaccharides de la famille du raffinose (RFO) de plus haut poids moléculaire, comme le stachyose ou le raffinose, transportés selon un modèle de polymer trap dans les éléments criblés. Cependant, ces modes de chargement du phloème ne sont pas universels, certaines plantes ayant développé d'autres stratégies pour l'acheminement des sucres [65].
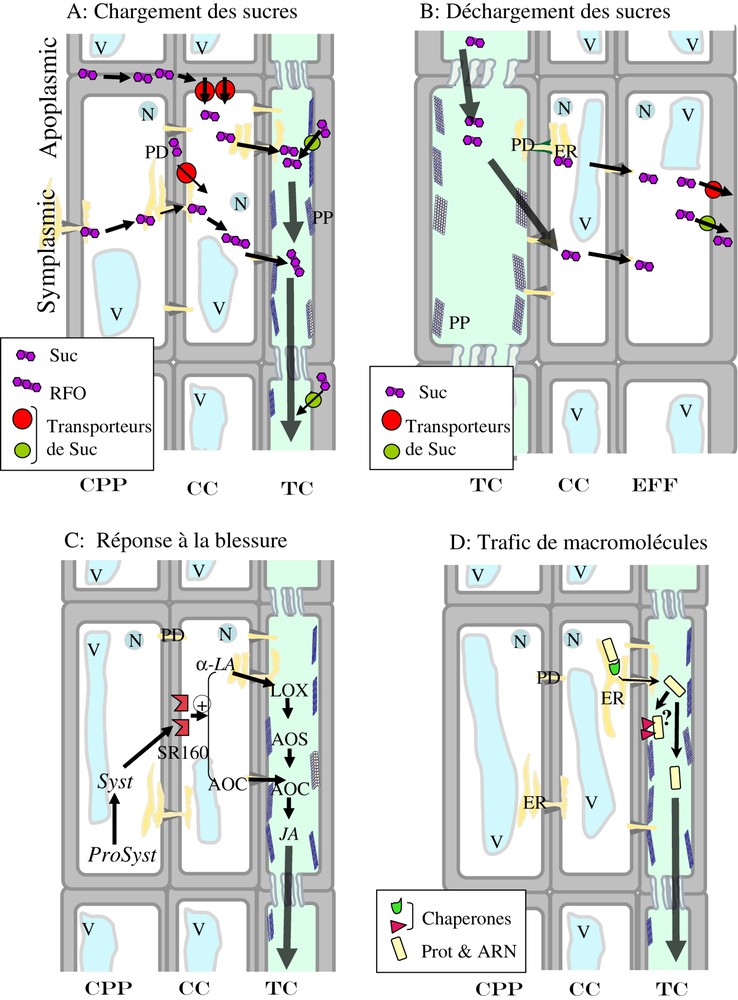
Transport et trafic de métabolites et de macromolécules dans le phloème. CPP : cellule du parenchyme phloémien, CC : cellule compagne, TC : tube (ou élément) criblé ; EFF : cellule d'efflux ; V : vacuole ; N : noyau, PD : plasmodesme ; ER : réticulum endoplasmique, PP : protéines P ; Suc : saccharose ; RFO : oligosacharides de type raffinose. (A) Représentation simplifiée des mécanismes de chargement en sucre chez les espèces symplasmiques ou apoplasmiques, dans le phloème de collecte (simplifié d'après [10]). Le chargement nécessite, chez les espèces apoplasmiques, des transporteurs de saccharose, situés sur la membrane plasmique des cellules compagnes (influx) et des cellules des éléments criblés (rechargement). (B) Représentation simplifiée des mécanismes de déchargement en sucre, dans le phloème de déchargement. Quelques transporteurs de saccharose ont été identifiés pour l'efflux du saccharose dans l'apoplasme. (C) Représentation schématique de la signalisation à longue distance en réponse à la blessure, dans le phloème, chez la tomate (d'après [87,88,90]). Cette réponse requiert l'amplification de la systémine et de l'acide jasmonique, dans les tissus phloémiens. ProSyst : prosystémine ; Syst : systémine ; SR160 : récepteur de la systémine ; α-LA : acide alpha linolénique ; LOX : lipoxygénase ; AOS : allène oxyde synthase ; AOC : allène oxyde cyclase. (D) Représentation schématique du trafic de macromolécules dans le phloème, dans le phloème de collecte (simplifié d'après [120]). Les macromolécules (protéines, ARNm ou petits ARN) empruntent certainement différentes voies, soit via le réticulum endoplasmique, soit via le cytosquelette, pour être acheminées vers les plasmodesmes à l'interface entre cellule compagne et cellule d'élément criblé. Ce transport intracellulaire nécessite des protéines chaperonnes. Après être transportées dans les éléments criblés, certaines sont transportées à longue distance par flux de masse. Il est possible que certains pools de protéines ou d'ARN restent ancrés aux structures membranaires des cellules dans lesquelles elles ont été déchargées (ARN non circulant).
L'identification des transporteurs de saccharose a constitué une avancée majeure [66–68]. Ces transporteurs fonctionnent contre le gradient de concentration grâce à l'action d'une pompe à proton couplée à une ATPase membranaire qui génère une force proton-motrice (cotransport proton/saccharose). Les transporteurs de saccharose caractérisés à ce jour sont localisés dans la membrane plasmique des cellules compagnes ou des éléments criblés [69–71] ; les transporteurs présents dans les cellules compagnes sont impliqués dans le chargement, tandis que les transporteurs présents dans les éléments criblés sont impliqués dans le rechargement. Certains de ces transporteurs sont localisés dans les mêmes cellules et pourraient exister sous forme d'hétéro-oligomères [71,72]. En revanche, ces transporteurs sont généralement très spécifiques et ne permettent pas le chargement des autres sucres transportés dans le phloème, à l'exception d'un transporteur AtSUC5 qui transporte le saccharose et la vitamine H [73]. Des transporteurs permettant le chargement de sucres alcools, mannitol et sorbitol, ont également été identifiés [74,75]. Un aspect inattendu de la physiologie des transporteurs est la présence, dans les complexes cellule compagne–élément criblé, de combinaisons de transporteurs variables suivant la position ou l'âge de ces éléments conducteurs. Par exemple, chez le plantain, des combinaisons distinctes de transporteurs de saccharose et de sucres-alcools (polyols) ont été décrites en fonction de l'âge des éléments conducteurs [76], au sein d'un même faisceau vasculaire. Ces résultats suggèrent une spécialisation des éléments criblés suivant le stade de développement et la physiologie de la plante. Certains transporteurs de saccharose sont localisés dans d'autres organes, comme les racines ou la graine, ou induits en réponse à des stress, et interviennent dans le déchargement des sucres [77,78] (Fig. 2B).
La vitesse du flux de sève phloémienne, qui peut atteindre 1 m/h, est considérable, compte tenu du diamètre des éléments criblés (de l'ordre de quelques microns). Elle est contrôlée par un flux de masse [79] généré par la pression hydrostatique résultant de la différence de pression osmotique entre les organes « sources » et les organes « puits ». Les relations source–puits, qui régulent la force respective des différents « puits » et des différentes « sources », restent l'objet d'intenses investigations par modélisation [80–83].
6 Réponse à la blessure et signalisation à longue distance
Les propriétés uniques du phloème lui permettent d'exercer un rôle essentiel dans la communication à longue distance intervenant dans différents processus physiologiques, développementaux ou adaptatifs [84]. L'exemple de la réponse systémique lors d'une blessure chez la tomate illustre le rôle particulier du phloème dans la signalisation à longue distance. Lorsque les plantes sont blessées, un signal est produit, qui active une réponse dans les feuilles non blessées. Cette réponse se caractérise par l'activation de gènes de défense, codant notamment pour des inhibiteurs de protéases. De nombreux résultats ont indiqué que la systémine, petit peptide de 18 acides aminés produit après clivage d'un précurseur, la prosystémine, était impliquée dans cette activation à distance des gènes de défense [85]. En réalité, il semble maintenant que le rôle de la systémine serait de promouvoir la réponse systémique en amplifiant la synthèse d'acide jasmonique dans les tissus phloémiens, acide jasmonique qui serait le véritable signal systémique [86,87]. Cette hypothèse est corroborée par l'observation du fait qu'alors que la prosystémine est synthétisée dans les cellules du parenchyme phloémien [88], les principales enzymes de biosynthèse de l'acide jasmonique sont présentes directement dans le complexe cellule compagne–éléments criblés [89–91]. L'induction systémique des gènes de défense dépend alors de la production de peroxyde d'hydrogène, qui joue le rôle de messager secondaire dans les organes « puits » [92]. De plus, la synthèse de prosystémine et des enzyme de biosynthèse de l'acide jasmonique est compartimentée dans des cellules distinctes. Le modèle actuel propose que la systémine se fixe sur une récepteur SR160 à la surface des cellules compagnes [93], ce qui initie la synthèse d'un pool d'acide jasmonique mobile [86] (Fig. 2C).
7 Réponse aux agents pathogènes et résistance systémique acquise
Le rôle du phloème dans la mise en place de réponse de défense lors d'infection par des pathogènes est largement documenté [94]. Lors de l'interaction avec des agents pathogènes avirulents, la plante développe une réponse généralisée, qui succède à une réponse hypersensible caractéristique. Cette réponse, la SAR (Systemic Acquired Resistance, [95]), se traduit par une résistance renforcée à d'autres agents pathogènes dans les feuilles n'ayant pas été mises en contact avec l'infection initiale [96]. Des signaux de défense sont transportés à longue distance via le phloème à partir des feuilles initialement infectées ; cela se traduit par l'induction de gènes de défense codant notamment pour les protéines PR (pathogenesis-related). La cinétique de transmission du signal est identique à celle du transport des sucres ou d'autres composés diffusant dans le phloème [97]. La mise en place de la SAR est associée à la production locale et systémique d'acide salicylique (SA), qui est un constituant clé dans la voie de signalisation conduisant à l'induction des gènes de défense. Différents composés ont été incriminés comme signaux systémiques, notamment l'acide salicylique [98], des molécules dérivées de lipides, les formes réactives de l'oxygène, le calcium, des oligosaccharides, des oligopeptides. Cependant, le rôle de l'acide salicylique comme signal systémique a été rapidement invalidé, en dépit de son rôle essentiel dans la SAR [99]. La découverte du rôle de DIR1, une LTP (Lipid Transfer Protein), et d'une protéine ayant une activité de lipase, SABP2 (SA Binding Protein 2), dans la mise en place de la réponse systémique [100,101] argumentent en faveur du rôle de dérivés de lipides comme signaux systémiques pour la SAR [102]. Des résultats récents suggèrent que l'acide jasmonique, qui est un dérivé de l'acide linolénique, pourrait être un constituant essentiel du signal systémique [103], hypothèse corroborée par l'observation du fait que l'acide jasmonique est nécessaire à la mise en place de la SAR [104].
8 Floraison et développement
Le rôle du phloème dans la signalisation à longue distance pour des transitions développementales est décrit depuis longtemps. L'exemple le plus documenté est celui de l'induction florale, qui est contrôlée par plusieurs voies de signalisation [105,106]. L'une d'elles est associée à la perception de la photopériode dans les feuilles « sources ». La dissection génétique de cette voie de signalisation chez Arabidopsis a permis d'établir un rôle essentiel de deux gènes, CO (CONSTANS) et FT (flowering locus T). CO code pour un facteur de transcription à doigt de zinc, participant à la perception de la photopériode. CO agit dans le phloème où il régule l'expression de FT, qui code pour une protéine de type inhibiteur de RAF-kinase [107]. FT intervient dans l'activation des gènes d'identité du méristème floral. FT agit sur sa propre expression par une boucle d'autorégulation positive dans l'apex caulinaire. L'observation du fait que le transcrit de FT serait présent dans les éléments criblés a étayé quelque temps l'hypothèse selon laquelle l'ARNm de FT constituerait le signal systémique [108]. Ces données ont toutefois été remises en cause par la démonstration du fait que la protéine FT est transportée à longue distance dans le phloème et joue un rôle essentiel dans l'initiation de la floraison [109,110]. Ces données convergent pour établir le rôle central de FT comme composant du signal mobile, le « florigène », responsable de l'initiation de la floraison [111,112]. Le mécanisme de contrôle de la floraison basé sur le couple CO/FT apparaît très général, puisqu'il s'exerce sur des plantes annuelles, comme Arabidopsis, et sur des plantes pérennes ligneuses, comme le peuplier [113].
9 Transport d'ARN et contrôle à distance de l'expression génique
De nombreux ARN, petits ARN ou ARNm, ont été identifiés dans la sève phloémienne, en faible concentration. Après l'identification initiale d'ARNm dans la sève de riz [114], la présence d'ARNm a été établie dans de nombreuses autres espèces [55,70,115–119]. Malgré leur faible concentration dans la sève phloémienne, leur rôle biologique a été établi dans différents processus de développement [120]. Une première démonstration du rôle du transport d'un ARNm dans le phloème a été la caractérisation moléculaire du mutant mouse ears (Me) chez la tomate [121]. Ce mutant présente un défaut de morphologie foliaire très caractéristique. La mutation est associée à la fusion de deux gènes, mettant en présence les régions de régulation promotrices d'un gène codant pour une phosphofructokinase (PFP), enzyme du cycle glycolytique, et la séquence codante de LeT6, un gène à homéoboîte de type KNOTTED-1 (KNOX). La réalisation de greffe entre le mutant Me et des greffons de type sauvage a permis d'établir que le transcrit résultant de la fusion pPFP-LeT6 était présent dans les complexes cellules compagnes–éléments criblés et transporté via le phloème dans les greffons. Il confère à longue distance le phénotype Me. Ce travail démontre que le transport d'ARNm à longue distance dans le phloème peut entraîner des modifications développementales, en affectant à distance l'expression d'autres gènes [122].
Il est également bien établi que le phloème intervient dans la systémie des phénomènes de silencing [123,124]. Ce processus est « non cellule autonome » (il n'est pas restreint aux cellules dans lesquelles les signaux sont produits), et fait intervenir une signalisation de cellule à cellule et à longue distance. Des petits ARN, miRNA et siRNA, ont été détectés dans la sève phloémienne [59]. Si la nature du signal impliqué dans la systémie n'est pas établie, les siRNA présents dans la sève pourraient être des constituants importants [125]. En revanche, la cinétique des flux de sève constitue un déterminant majeur de cette systémie, ce qui permet d'exclure d'autres modes de transmission de l'information [126]. Il n'est pas établi définitivement que les miRNA aient aussi un rôle « non cellule autonome » via le phloème [127].
10 Nouveaux outils et futurs enjeux
Une limitation importante à l'étude du phloème est la faible représentation du tissu phloémien dans les organes (de l'ordre de 0,5% en volume dans les feuilles, d'après [5]). Les transcrits et les peptides correspondant aux gènes exprimés spécifiquement dans le phloème ne sont que difficilement détectés dans des organes entiers. C'est en partie pour surmonter ce problème que des techniques d'enrichissement en phloème ou en tissu vasculaire ont été développées. Plusieurs techniques ont été utilisées : la microdissection laser chez le riz, le maïs et Arabidopsis [61,128,129] ; la microdissection de coupes fines sur peuplier [130–132] ; la dissection de tissus vasculaires sur plantain, eucalyptus ; la dissection manuelle de phloème sur Arabidopsis et céleri [133–140] ; le tri de cellules après protoplastisation [141,142].
Ces méthodes ont permis d'établir les premiers inventaires de gènes préférentiellement exprimés dans le phloème dans des conditions de développement variées, sur des espèces annuelles ou pérennes [128–142]. Peu d'études ont abordé pour l'instant la réponse du phloème lors de stress en adaptation à des variations de l'environnement [138]. Or, il apparaît que de nombreux gènes codant pour des protéines de fonction inconnue, mais possédant des domaines transmembranaires ou annotées comme protéines de stress, sont exprimés spécifiquement dans le phloème. L'analyse de ces gènes devrait permettre d'élucider certains des mécanismes de signalisation et de défense mis en place dans le phloème.
Enfin, il reste à établir avec précision la nature des ARN circulants dans la sève phloémienne, ARNm ou petits ARN, et à démontrer leur fonction, même si les premiers inventaires d'ARN présents dans la sève phloémienne ont été récemment décrits [143–146]. En effet, il n'est toujours pas clairement établi dans quelle mesure ces ARN contribuent à la signalisation à longue distance via le phloème, et sous quelle forme (ARN nus ou ribonucléoprotéines). La démonstration du transport de macromolécules dans le phloème (Fig. 2D) et d'une activité biologique liée à ce transport à longue distance a représenté une avancée majeure en biologie des plantes. En revanche de nombreuses questions restent ouvertes, en particulier la nature des mécanismes de régulation du trafic intercellulaire par les plasmodesmes, notamment dans les complexes cellules compagnes–éléments criblés, et les cibles biologiques de différentes molécules transportées dans la sève phloémienne (ARN, protéines, peptides, hormones et autres signaux métaboliques). Enfin, la possibilité d'isoler des protoplastes de tubes criblés [147] permet d'envisager des approches fonctionnelles sur ces cellules hautement spécialisées.
La réponse à ces questions devrait ouvrir de larges perspectives sur la biologie du développement, la capacité de croissance des plantes, l'adaptation des plantes aux stress environnementaux et les mécanismes de défense vis-à-vis de certains ravageurs phloémophages et des agents pathogènes du phloème.
Remerciements
Je remercie mes collègues Françoise Vilaine, Julie Bénéteau, Pavel Kerchev, Élisabeth Truernit, Catherine Bellini, Lionel Gissot, Mathieu Castelain et Rozen Le Hir pour les discussions fructueuses et leur contribution aux travaux développés à Versailles sur ce programme. Je remercie également Jean Louis Bonnemain, Rémi Lemoine et Jean-François Moreau-Gaudry pour une relecture critique du manuscrit. Ces recherches sont soutenues par un financement Inra–Formas Phloem long-distance signalling and homeostasis : functional characterisation of orphan genes expressed in the phloem.


