Abridged English version
Hexachlobenzene (HCB) has been primarily used as an antifungal in agriculture. While its usage is banned in many countries, this chlorinated aromatic hydrocarbon still contaminates the environment because of its remanence and persistence properties. Furthermore, it may be a by-product of some industrial chlorination processes or the result of the combustion of products containing chlorine. It is one of the substances whose effects on the ecosystem have been well demonstrated.
In this study, Meriones unguiculatus has been chosen since its natural biotope is located near farms where pesticides are habitually used.
Previously, we reported the toxic effects of HCB on the liver and thyroid functions in this animal.
In the present work, we focused on the gonadotoxic effects of subchronic exposure to low doses of HCB (1.6, 4 and 16 mg HCB/Kg of body weight) in males.
Sexually mature meriones were housed under light (12 h light/12 h dark cycles) and temperature (
Three groups were orally administered HCB mixed in olive oil every day between 9 and 10 AM over a period of 30 days. So, the sum of individual doses ingested per animal in each group over the experiment was approximately 0.5, 1.25 and 5% of the oral DL50 determined in the rat. A control group was force-fed without any HCB in the olive oil.
Animals were sacrificed and testes and seminal vesicles were dissected out for morphological estimations. One testicle was fixed for histological analysis and the plasma samples were frozen at −30 °C before testosterone determination.
Morphological and morphometrical estimations were applied to quantify some structural constituents of the testes. The testicular relative weight was significantly decreased in all treated groups, while no change was noted in that of the seminal vesicle.
The parameters of the seminiferous tubules showed that HCB administration did not cause significant changes in the tubular diameter; a decrease in their spermatozoid content was noted and appeared correlated with a modification of the spermatogenesis process.
The testicular spermatic activity in testes of HCB-treated animals decreased significantly – lot I (1.6)
Plasma testosterone levels were decreased significantly in the groups treated with 4 and 16 mg HCB/kg BW (
In conclusion, these results supplement and confirm the sensitivity of Meriones unguiculatus to the toxic effect of the HCB. Previously, we demonstrated that weak amounts of this pesticide affect the liver and thyroid functions with sex-dependent differences in the plasmatic rates of TT4 and TT3 [12]. The present study highlights the gonadotoxic effect of hexachlorobenzene in male meriones; the impact of this toxicity on the fertility and consequently on the perpetuity of this species could result in regarding this animal as a ‘sentry-animal’ with respect to the environmental pollutants.
1 Introduction
Les biphényles chlorés (BPCs) ainsi que les hexachlorocyclohexanes font partie des contaminants environnementaux ubiquitaires [1–3]. Bien que l'efficacité insecticide de la totalité des isomères de l'hexachlorocyclohexane ne soit pas établie, des mixtures techniques renfermant l'ensemble de ces composés ont été commercialisées au travers le monde [4]. Au-delà de leur effet contaminant de l'environnement via l'usage agricole, les BPCs continuent à persister, puisqu'ils sont utilisés dans différents secteurs industriels, tels que la fabrication des transformateurs et conducteurs électriques, ou encore les lubrifiants hydrauliques [5,6].
L'hexachlorobenzène (HCB), initialement utilisé en tant que fongicide [7], continue à être redistribué dans le monde du fait de sa rémanence et de sa persistance [8].
La toxicité de l'HCB a été clairement mise en évidence chez les animaux de laboratoire ; on note essentiellement une hépatotoxicité ainsi qu'une perturbation de plusieurs fonctions endocrines [9–12]. Chez l'homme, un certain nombre de signes cliniques relatifs aux intoxications par le HCB ont été rapportés [13] : une hypertrophie du foie, de la glande thyroïde et des ganglions lymphatiques, une porphyrie ainsi que des anomalies neurologiques, dermatologiques ou orthopédiques.
Les effets néfastes des contaminants environnementaux sur la reproduction et le développement ont été établis chez différentes espèces. Du côté du mâle, une tendance vers une décroissance de la fertilité en termes de quantité et de qualité du sperme produit [14], des effets interférant avec l'action d'hormones sexuelles et affectant la différenciation et la fonction épididymaire ont été rapportés chez le rat [15,16]. Des substances comme le lindane induisent une dégénérescence des tubes séminifères, une altération des activités d'enzymes stéroïdogéniques ainsi qu'une altération du métabolisme de la testostérone [17].
Chez la femelle, une exposition chronique de guenons à l'HCB provoque des modifications ultrastructurales dégénératives de l'épithélium ovarien des cellules folliculeuses de l'œuf en développement [18,19], ainsi que des variations des concentrations plasmatiques d'hormones de reproduction [20]. Dans un précédent travail, nous avons rapporté certains aspects de la toxicité subchronique de l'HCB sur les fonctions hépatique et thyroïdienne chez une espèce de rongeurs (Meriones unguiculatus) dont le biotope naturel se situe aux environs des exploitations agricoles. Certaines de ces manifestations toxiques, notamment sur la fonction thyroïdienne, faisaient ressortir un dimorphisme sexuel [12].
Dans le présent travail, nous présentons l'impact de l'HCB sur certains paramètres relatifs à la fonction de reproduction mâle chez ce même rongeur. L'évaluation des activités testiculaires et spermatiques a été réalisée par une étude histomorphométrique ; l'impact endocrinien a été exploré par la détermination de la testostéronémie.
2 Matériels et méthodes
2.1 Animaux
Les animaux qui ont servi à cette étude sont composés de mérions mâles (Meriones unguiculatus), sexuellement matures, plus communément connus sous le nom de gerbilles ou de mérions de Mongolie. Les animaux proviennent d'un élevage développé au sein de notre animalerie à partir de géniteurs fournis par l'institut Pasteur de Tunis.
Ils sont maintenus dans des conditions de température, d'hygrométrie et d'éclairement contrôlés (
2.2 Protocole expérimental
Les mérions sont répartis en quatre groupes. Le traitement par le HCB est réalisé quotidiennement par gavage entre 9 h et 10 h du matin en mélange dans de l'huile d'olive. Trois lots, I, II et III, sont traités respectivement par des doses de 1,6, 4 et 16 mg/kg PC/j. À l'issue des 30 j de traitement, les animaux ont cumulé 48, 120 et 480 mg d'HCB, soit approximativement 0,5%, 1,25% et 5% de la DL50 déterminée chez le rat. Le quatrième (lot T : témoins) sera constitué par des animaux ne recevant que de l'huile d'olive.
À la fin du traitement, les mérions sont sacrifiés, par décapitation, entre 9 h et 11 h du matin. Le sang artério-veineux, récupéré dans des tubes héparinés, est centrifugé à 5 °C pendant 15 minutes à 3000 t/min. Le plasma, reparti en plusieurs aliquotes, est conservé à −30 °C. Pour chaque animal, les appareils génitaux (testicules et vésicules séminales) sont pesés. Des fragments de testicules sont rapidement prélevés et fixés en vue des examens histologiques. Parallèlement à l'étude cytomorphologique, nous avons réalisé une étude quantitative histomorphométrique par la comparaison des diamètres et du contenu en spermatozoïdes des tubes séminifères. Ce test consiste à déterminer, sur dix tubes séminifères choisis au hasard, le diamètre ainsi que le nombre de tubes vidés de leurs spermatozoïdes.
Le dosage de la testostérone a été réalisé par RIA en utilisant un Kit Immunotech (testostérone direct, IM 1119). Tous les échantillons sont dosés en double. Les coefficients de variation intra- et inter-essais sont respectivement de 14,8% et 15% (
2.3 Statistiques
Les résultats expérimentaux sont exprimés sous forme de moyenne arithmétique, accompagnée de l'erreur standard (
3 Résultats
3.1 Effet de l'HCB sur l'évolution pondérale des testicules et des vésicules séminales
Les résultats consignés dans le Tableau 1 montrent que le traitement à l'HCB ne semble pas affecter significativement l'évolution pondérale des mérions constituant les différents lots. En revanche, une diminution significative du poids relatif des testicules apparaît chez les animaux des groupes traités par rapport au groupe témoin. Cette diminution n'est pas corrélable à la dose administrée. L'évolution du poids relatif des vésicules séminales ne présente pas, quant à lui, de variations notables.
Évolution du poids corporel et des poids relatifs des testicules et des vésicules séminales (moyenne ± SEM) chez Meriones unguiculatus traités par différentes doses d'HCB
| Doses HCB en mg | ||||
| 0 | 1,6 | 4 | 16 | |
| Poids corporel (g) | 71,97 ± 1,99(15) | 74,24 ± 1,9 (18) | 73,17 ± 2,7 (16) | 70,48 ± 2,37 (17) |
| Poids relatif testiculaire (%) | 1,6 ± 0,03 (15) | 1,25 ± 0,07 (18)⁎⁎ | 1,38 ± 0,09 (15)⁎ | 1,41 ± 0,07 (16)⁎ |
| Poids relatif vésicules séminales (%) | 0,6 ± 0,06 (15) | 0,59 ± 0,04 (18) | 0,6 ± 0,05 (16) | 0,49 ± 0,03 (16) |
⁎
⁎⁎
3.2 Étude histologique
3.2.1 Étude qualitative
L'architecture des testicules chez les mérions traités par 1,6 mg d'HCB/kg PC/j ne présente aucune modification histologique par rapport aux témoins (Fig. 1). En effet, on observe de nombreux tubes séminifères séparés par un tissu vascularisé renfermant des cellules interstitielles ou cellules de Leydig. La paroi de ces tubes séminifères englobe une série de cellules comprenant tous les stades, depuis les spermatogonies jusqu'aux spermatozoïdes, en passant par les spermatocytes et les spermatides. Les spermatozoïdes sont localisés au niveau de la lumière du tube.
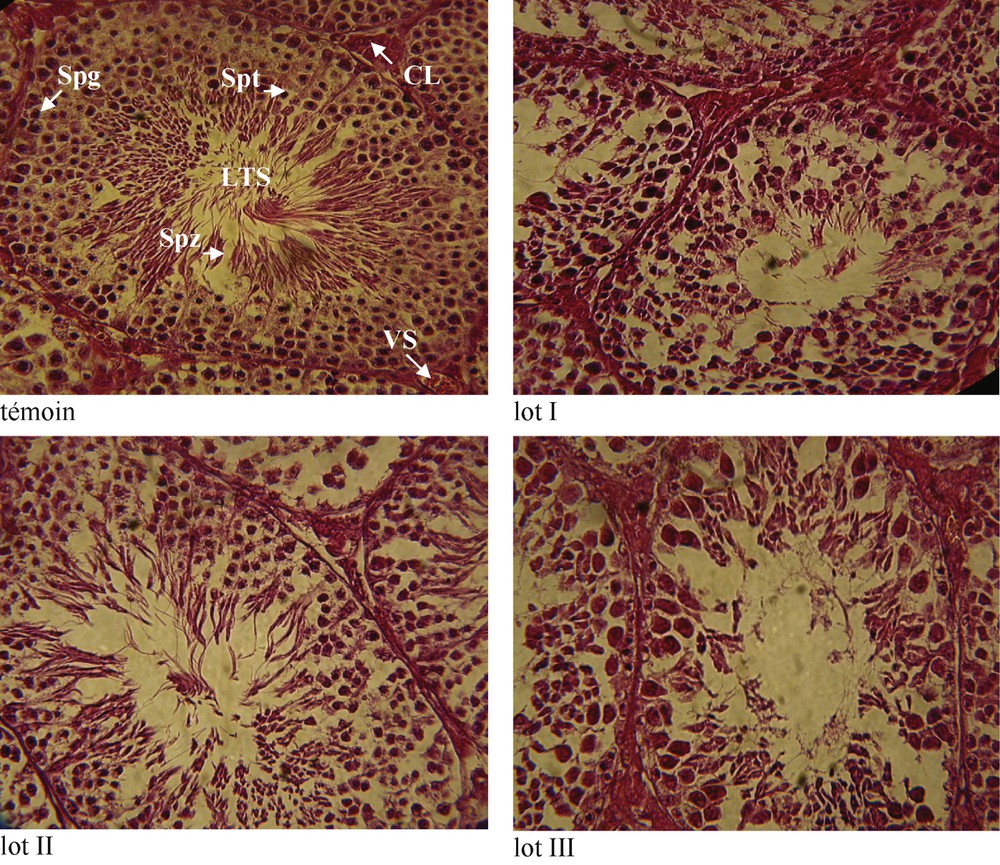
Coupes montrant les détails d'un tube séminifère. Vaisseaux sanguins (VS), cellules de Leydig (CL), spermatogonie (Spg), spermatocytes I et II (Spt), spermatozoïdes (Spz), lumière du tube séminifère (L TS). Agrandissement : ×400 ; coloration : hématoxyline/éosine.
L'observation des coupes histologiques des testicules de mérions gavés par 16 mg d'HCB/kg PC/j montre que la paroi des tubes séminifères reste inchangée. En revanche, on assiste à une diminution nette du nombre de spermatozoïdes, ce qui suggère une modification du déroulement de la spermatogenèse avec une perturbation de la phase de différenciation des spermatogonies immatures en spermatides matures, puis en spermatozoïdes.
Ce même résultat est enregistré de manière beaucoup plus atténuée chez les animaux du lot II traités par 4 mg d'HCB/kg de PC/j (Fig. 1).
3.2.2 Étude quantitative
L'étude histomorphométrique réalisée sur les testicules par la comparaison des diamètres des tubes séminifères ainsi que par la détermination du nombre de tubes vidés de leurs spermatozoïdes a permis d'évaluer l'état de l'activité testiculaire et de l'activité spermatique.
Nos résultats montrent que l'intoxication à l'HCB durant 30 j affecte essentiellement les animaux du lot III. Elle entraîne une légère diminution, non significative, du diamètre des tubes séminifères (Fig. 2). En revanche, l'activité spermatique subit chez ces animaux une baisse significative, de l'ordre de 32% par rapport aux témoins (
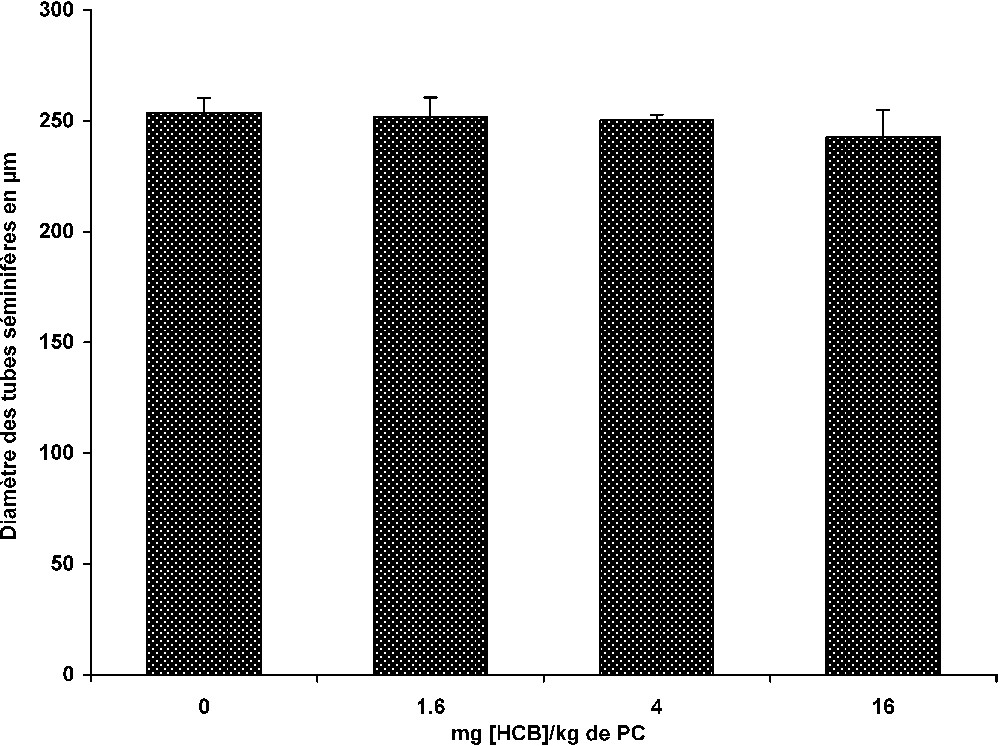
Effet de différentes doses d'HCB sur le diamètre des tubes séminifères chez le mérion après 30 j de traitement.
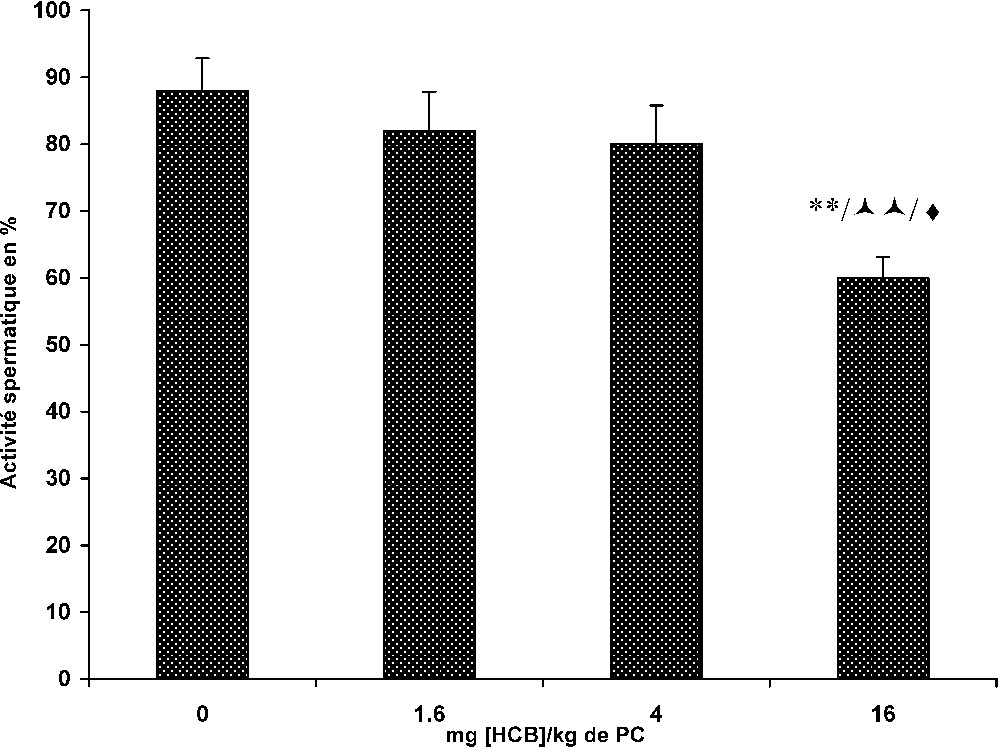
Effet de l'HCB sur l'activité spermatique des tubes séminifères chez le mérion après un traitement de 30 jours. (Lot T : témoins (0) ; lot I : (1,6) ; lot II (4) ; lot III : (16) mg [HCB]/kg PC.) ** : p<0,01, lot III vs. lot T. , : p<0,01, lot III vs. lot I. ♦: p<0,05 lot III vs. lot II.
3.3 Effet de l'HCB sur le taux de testostérone plasmatique
L'effet de l'HCB sur le taux plasmatique de la testostérone se manifeste chez les animaux appartenant aux lots II et III, traités respectivement avec 4 et 16 mg d'HCB/kg/j. En effet, chez ces animaux, la teneur plasmatique de la testostérone présente une diminution significative. Elle passe de
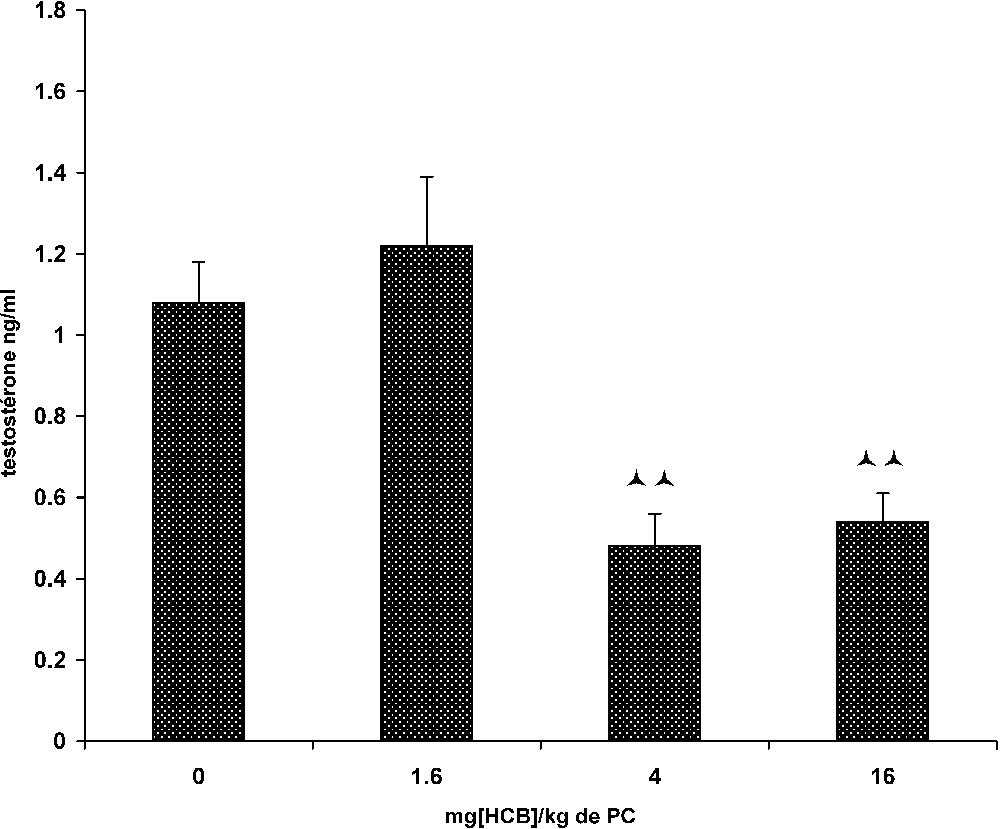
Évolution de la testostéronémie chez le mérion après un traitement de 30 j. (Lot T : témoins (0) ; lot I : (1,6) ; lot II (4) ; lot III : (16) mg [HCB]/kg PC). : p<0,01 lots II et III vs. lot T.
4 Discussion
Meriones unguiculatus est un animal qui vit aux abords des fermes et des exploitations agricoles. Son statut de rongeur parasite fait de lui un bon candidat pouvant servir d'animal « sentinelle » à l'effet des contaminants environnementaux. Les pesticides organochlorés présentent un problème toxicologique particulier à cause de leur persistance, leur rémanence et à leur faculté de s'accumuler dans les tissus adipeux. La mobilisation métabolique des réserves graisseuses entraîne sa redistribution dans tous les organes et l'expression de ses divers effets toxiques. Cette étude a été menée afin d'évaluer les effets de doses croissantes d'HCB sur la fonction testiculaire du mérion sexuellement mature.
Sur le plan morphologique, le traitement à l'HCB n'affecte, ni le poids corporel, ni celui des vésicules séminales. En revanche, une diminution du poids relatif testiculaire est observée chez les trois groupes d'animaux traités comparativement aux animaux témoins. L'absence d'impact de l'HCB sur le poids corporel du rat a été par ailleurs signalée [21–23]. Ainsi, chez le rat Sprague Dawley mâle, Wade et al. [22] ont montré que l'exposition à différents composés organochlorés, y compris le HCB, n'a aucun effet significatif, ni sur le poids corporel final, ni sur le gain de poids des animaux traités pendant 70 j avec des doses allant jusqu'à 1000 fois la dose estimée sans danger.
Nos résultats montrent également l'absence d'effets de l'HCB sur le poids des vésicules séminales. En revanche, une hypoplasie traduite par une diminution significative du poids relatif testiculaire est observée chez les trois groupes d'animaux traités. Les effets toxiques des composés organochlorés diffèrent, d'une part, selon le produit [24] et, d'autres part, selon le sexe. Les effets de l'HCB seraient par exemple plus ressentis au niveau du système reproducteur femelle que mâle [25]. Oskam et al. [26] affirment que le HCB provoque une diminution du poids relatif des testicules de l'ours blanc (Ursus maritimus). En revanche, Wade et al. [22] signalent que, chez le rat, ce xénobiotique ne modifie, ni le poids des testicules, ni celui des vésicules séminales.
L'étude cytoarchitecturale fait apparaître un changement qualitatif au niveau des tubes séminifères. Une nette diminution des spermatozoïdes occupant la lumière de ces tubes est observée ; elle paraît plus accentuée avec la dose la plus forte (16 mg/kg/j) et suggérerait une modification du déroulement de la spermatogenèse. Ce processus impliquant la division et la différenciation des spermatogonies immatures en spermatides matures, puis en spermatozoïdes, a lieu à l'intérieur des tubes séminifères, en étroite association avec les cellules de Sertoli [14]. Ces cellules somatiques de l'épithélium séminifère produisent des facteurs vitaux, qui gouvernent le développement des cellules germinales et, par là-même, la production spermatique [27]. Ainsi, tout composé de nature à perturber la viabilité et la fonction des cellules de Sertoli affecterait profondément la spermatogenèse. À l'issue de cette première phase testiculaire de maturation, les spermatozoïdes, ainsi que leur microenvironnement liquidien initialement élaboré par les tubes séminifères, migrent vers l'épididyme. Au cours de ce trajet, les spermatozoïdes se concentrent après absorption du liquide dans lequel ils baignent et acquièrent progressivement leur mobilité ainsi que leur pouvoir fertilisant [28,29]. Un certain nombre de contaminants environnementaux, dont les PCB, sont connus pour induire des perturbations à divers niveaux. L'accélération de la phase de migration des spermatozoïdes vers l'épididyme affecterait non seulement le nombre des spermatozoïdes, mais également leur qualité, compromettant ainsi le processus de maturation épididymale et, par conséquent, leur pouvoir fécondant [30].
L'évaluation histomorphométrique des tubes séminifères n'a pas révélé de variations significatives de leur diamètre et ce, quelle que soit la dose d'HCB administrée. En revanche, l'effet subchronique d'une intoxication à l'HCB semble affecter significativement l'activité spermatique chez les animaux du lot recevant la plus forte dose (
Sur le plan hormonal, la comparaison des taux de testostérone chez les différents lots de mérions révèle une baisse hautement significative (
L'effet perturbateur de l'HCB sur la fonction endocrine mâle a été signalé. Oskam et al. [26] ont étudié l'impact de l'HCB présent dans l'environnement et ont montré que, chez l'ours blanc, l'équilibre des hormones stéroïdes, y compris les androgènes, était affecté et que le HCB contribue à une diminution significative de la concentration plasmatique en testostérone. Gray et al. [32], Kelece et al. [33], et Babineau et al. [18] affirment que les organochlorés, notamment le HCB, peuvent affecter la fonction de reproduction en jouant un rôle oestrogen-like. Ce phénomène ne pourrait survenir que lorsque la concentration du produit est très élevée par rapport aux œstrogènes et androgènes endogènes [34].
Gore [35] suggère, par ailleurs, que le HCB pourrait affecter profondément l'expression des gènes de la GnRH. En effet, à cause de son caractère liposoluble et de la richesse particulière du système nerveux en lipides, les neurones à GnRH vont être particulièrement sensibles à l'HCB, qui provoquerait alors un dysfonctionnement de l'axe hypothalamo-hypophyso-gonadique.
En conclusion, ces résultats viennent compléter et confirmer la sensibilité de Meriones unguiculatus à l'effet toxique de l'HCB. En effet, dans un précédent travail, nous avons montré que des faibles doses de ce pesticide affectaient les fonctions thyroïdienne et hépatique chez cette espèce [12]. La présente étude met en évidence un effet gonadotoxique de l'hexachlorobenzène chez Meriones unguiculatus mâle ; l'impact de cette toxicité sur la fertilité et, par conséquent, sur la pérennité de cette espèce pourrait ouvrir la perspective de la considérer comme « animal sentinelle » vis-à-vis des polluants environnementaux. Il faut cependant souligner que l'espèce sur laquelle a porté notre étude est connue sous le nom de gerbille ou de mérion de Mongolie et occupe à l'état sauvage les régions arides et semi-arides du Nord-Est de la Chine et de la Mongolie. Il serait donc intéressant d'étendre des travaux similaires aux espèces du même genre vivant en Afrique du Nord : à savoir Meriones crassus, Meriones libicus et Meriones shawi.


