1 Introduction
Au cours de ces dernières années, de nombreux groupes de recherche se sont intéressés aux effets potentiellement toxiques de divers agents chimiques et physiques de notre environnement sur la fertilité humaine 〚1〛 Une baisse significative de la concentration des spermatozoïdes et du volume du liquide séminal dans la population humaine a en effet été observée entre 1938 et 1990, concomitamment à une augmentation de l’incidence des cancers du testicule 〚2〛.
Parmi les polluants incriminés, il apparaît important de préciser la toxicité du plomb, étant donné l’abondance de ses sources et de sa répartition (canalisations d’eau, pollution industrielle, trafic automobile…) et la possible bioconcentration de ce métal dans le plasma séminal 〚3〛 ou le liquide folliculaire 〚4〛. Des études, essentiellement d’ordre clinique et épidémiologique, réalisées chez des ouvriers exposés au Pb au cours de leur travail et chez des policiers ou des chauffeurs de taxi, ont mis en évidence une baisse de la fertilité féminine et du nombre de grossesses, une diminution de la fertilité masculine associée à une diminution du nombre et de la motilité des spermatozoïdes et à une réduction du volume du liquide séminal 〚5, 6〛.
Toutefois, les conclusions de ces études sont souvent contradictoires, du fait de l’hétérogénéité des populations étudiées (tabagisme, habitudes alimentaires, patrimoine génétique…) et de leur environnement, dans lequel de nombreux facteurs peuvent agir en synergie 〚7〛. Par ailleurs, les études réalisées in vitro ne permettent pas d’expliquer le mécanisme d’action de ces polluants environnementaux sur la fertilité, comme s’accordent à le dire de nombreux experts internationaux 〚8, 9〛, car les résultats de ces recherches n’intègrent pas les mécanismes complexes de régulation hormonale de l’organisme.
Dans ce cadre, et afin de préciser le mécanisme d’action du plomb sur les fonctions de reproduction, nous avons soumis pendant trois mois des rats blancs adultes de souche « Wistar » à deux concentrations de ce métal. Les taux de Pb dans le sang (plombémie) et dans la queue (qui représente un organe de stockage) ont été mesurés, afin d’évaluer l’effet dose et l’effet temps.
La fonction sexuelle masculine a été analysée par le suivi de la croissance des organes sexuels, l’étude histologique des testicules et le dosage de la testostérone sérique. La toxicité du Pb sur les cellules de la lignée germinale mâle a été évaluée par la mise en évidence de cellules en apoptose.
La fonction sexuelle féminine a été explorée par la mesure de la croissance des organes sexuels, par l’analyse de frottis vaginaux et la détermination du taux de gestation et du nombre d’implantations après des accouplements avec des mâles non exposés.
2 Matériels et méthodes
2.1 Animaux
300 rats mâles et femelles de souche « Wistar », pubères, âgés de 3 mois et pesant autour de 140 g, ont été groupés par huit dans des cages placées dans une animalerie maintenue entre 22 et 24 °C, de taux d’hygrométrie stable, munie d’un système de ventilation et d’un système régulant les périodes d’obscurité (10 h) et de lumière (14 h). Les animaux ont eu accès ad libitum à la nourriture (bouchons à 14% de protéines, SICO, Sfax, Tunisie) et à l’eau.
2.2 Protocole expérimental
Les rats témoins (T) recevaient de l’eau distillée comme eau de boisson. Les rats traités disposaient d’eau distillée enrichie en acétate de plomb à raison de 3 (P1) et 6 mg ml–1 (P2). Tous les animaux étaient pesés chaque matin, avant la présentation de l’alimentation, et durant toute la période du traitement, qui a été, selon les groupes, de 15, 30, 45, 60 ou 90 jours.
2.3 Sacrifice des animaux et prélèvement des échantillons biologiques
Le sacrifice des animaux a toujours eu lieu le matin, par décapitation rapide pour éviter l’effet de stress. Le sang artério-veineux a été recueilli, soit sur héparine pour le dosage du plomb sanguin, soit sans anticoagulant puis centrifugé, pour le dosage de la testostérone sérique. Tous les échantillons sanguins et sériques ont été stockés à –20 °C, en attendant les dosages.
Les testicules, les épididymes, les vésicules séminales, la prostate, les ovaires et l’utérus ont été prélevés, débarrassés de leurs tissus adipeux, puis pesés.
Les queues des animaux, destinées à la minéralisation pour le dosage du plomb accumulé, ont été coupées, puis maintenues pendant 48 h dans une étuve à 80 °C.
2.4 Effets du Pb sur la fonction sexuelle des rats femelles
– Les effets du Pb sur l’imprégnation hormonale de la muqueuse vaginale ont été évalués par l’analyse cytologique des frottis vaginaux.
– La fertilité a été analysée par croisement des rates traitées pendant 90 j avec des mâles témoins. Les femelles sont restées une semaine en présence des mâles et ont été sacrifiées 15 jours plus tard. Les cornes utérines ont été disséquées, pour rechercher une éventuelle gestation, et le nombre d’implantations a été déterminé.
2.5 Effets du Pb sur les testicules
L’étude histologique a été réalisée, selon les techniques classiques, après fixation dans le liquide fixateur de Bouin, inclusion en paraffine et coloration à l’hématoxyline–éosine.
La mise en évidence de cellules en apoptose a été réalisée par coloration au bleu de toluidine boraté (bleu de toluidine 1%, tétraborate de sodium 1%), cette technique permettant de visualiser la condensation de la chromatine.
2.6 Recherche histochimique du plomb au niveau des testicules
Les dépôts de plomb ont été colorés au rhodizonate de sodium à 0,5% dans un tampon tartrique à pH 3 et les cellules contre-colorées à l’hémalun. Le plomb se présente sous forme de cristaux de couleur brun foncé.
2.7 Dosage de la testostérone sérique
La testostérone sérique a été mesurée par un dosage radio-immunologique (RIA) par compétition, commercialisé par Immunotech. La testostérone à doser (échantillon ou standard) et la testostérone marquée à l’iode 125 (traceur) ont été ajoutées simultanément aux tubes renfermant l’anticorps anti-testostérone fixé à la paroi. Après homogénéisation et incubation, la fraction libre a été éliminée par aspiration et lavages. La fraction liée fixée sur l’anticorps a été mesurée à l’aide d’un compteur gamma, relié à un ordinateur. Elle est inversement proportionnelle aux taux de la testostérone ajoutée (échantillon ou standard). La concentration en testostérone de l’échantillon est donnée directement en ng ml–1.
2.8 Dosage du plomb au niveau du sang et de la queue
Le plomb a été mesuré par spectrophotométrie d’absorption atomique à effet Zeeman Z-61000 (Hitachi) à une longueur d’onde de 283,3 nm, après minéralisation liquide des échantillons biologiques prélevés. Celle-ci a été obtenue dans des ballons de Kjeldahl, à l’aide d’une rampe à fourche, et en présence d’un mélange nitroperchlorique (2:1 v/v). Le taux du plomb a été calculé à l’aide d’une courbe d’étalonnage réalisée à partir de solutions titrées de plomb. Les réactifs et les matériels utilisés au cours de ce travail ont été contrôlés à l’aide d’échantillons « blancs », subissant les mêmes étapes de traitement.
2.9 Statistiques
Les résultats sont présentés sous forme de moyenne ± SEM. Les comparaisons intergroupes témoins et traités sont réalisées par un test t de Student. Une valeur de p ≤ 0,05 est considérée comme significative.
3 Résultats
3.1 Effets du plomb sur la croissance corporelle
D’après les résultats reportés dans le Tableau 1, le plomb induit une baisse de la croissance corporelle, avec récupération après un mois de traitement. Cette baisse est plus accentuée chez les groupes P2 que chez les groupes P1, chez les femelles que chez les mâles et durant le premier mois de traitement. Au-delà de cette période, la croissance corporelle est corrigée, malgré le traitement.
Augmentation du poids corporel en pourcentage du poids initial.
| 15 j | 30 j | 45 j | 60 j | 90 j | ||
| T | 37,36 | 15,33 | 9,54 | 4,19 | 4,56 | |
| Mâles | P1 | 27,63 | 13,49 | 10,8 | 11,41 | 3,51 |
| P2 | 18,36 | 8,88 | 12,88 | 8,04 | 7,95 | |
| T | 29,13 | 10,61 | 3,92 | 5,74 | 5,34 | |
| Femelles | P1 | 13,27 | 9,54 | 3,88 | 5,29 | 5,21 |
| P2 | 11,09 | 8,81 | 2,65 | 5,79 | 4,57 |
3.2 Effets du plomb sur l’appareil génital mâle
3.2.1 Croissance des organes sexuels
Les concentrations de plomb présentes dans l’eau de boisson des rats traités ont induit, par rapport aux rats témoins, une baisse significative des poids absolus et relatifs des testicules, de l’épididyme, des vésicules séminales et de la prostate. Cette baisse a été observée après 15 jours de traitement pour la plus forte dose de Pb (groupe P2 : 6 mg d’acétate de Pb par millilitre d’eau) et seulement au bout de 45 j pour le groupe P1, abreuvé avec 3 mg d’acétate de Pb par millilitre d’eau. Après 60 jours de traitement, les poids des organes sexuels des deux groupes P1 et P2 ont retrouvé des valeurs normales, comparables à celles des rats témoins, suggérant qu’un processus d’adaptation s’est mis en place (Tableaux 2 et 3).
Évolution du poids absolu PA (g) et du poids relatif PR (g pour100 g du PC) des testicules et de l’épididyme chez des rats témoins (T) et traités par l’acétate de plomb (P1 et P2) durant 15, 30, 45, 60 et 90 j. Les valeurs représentant la moyenne ± SEM : * p ≤ 0,05 par comparaison avec les rats témoins ; ** p ≤ 0,01 par comparaison avec les rats témoins ; n : nombre de déterminations par groupe et pour chaque durée de traitement = 8.
| 15 j | 30 j | 45 j | 60 j | 90 j | |||||||
| PA | PR | PA | PR | PA | PR | PA | PR | PA | PR | ||
| T | 1,029 ± 0,039 | 0,637 ± 0,025 | 1,104 ± 0,026 | 0,617 ± 0,024 | 1,201 ± 0,042 | 0,522 ± 0,007 | 1,240 ± 0,055 | 0,493 ± 0,017 | 1,280 ± 0,077 | 0,417 ± 0,008 | |
| Testicules | P1 | 0,988 ± 0,060 | 0,644 ± 0,024 | 0,954 ± 0,076 | 0,545 ± 0,022* | 1,033 ± 0,046* | 0,484 ± 0,015* | 1,140 ± 0,028 | 0,503 ± 0,036 | 1,262 ± 0,050 | 0,458 ± 0,008 |
| P2 | 0,758 ± 0,076** | 0,538 ± 0,033** | 0,778 ± 0,045** | 0,465 ± 0,020** | 0,916 ± 0,057** | 0,488 ± 0,014* | 1,203 ± 0,033 | 0,644 ± 0,031* | 1,168 ± 0,057 | 0,469 ± 0,040 | |
| T | 0,299 ± 0,039 | 0,194 ± 0,023 | 0,390 ± 0,019 | 0,198 ± 0,005 | 0,461 ± 0,016 | 0,211 ± 0,004 | 0,497 ± 0,021 | 0,198 ± 0,005 | 0,551 ± 0,033 | 0,180 ± 0,009 | |
| Épididymes | P1 | 0,234 ± 0,053 | 0,204 ± 0,033 | 0,353 ± 0,049 | 0,199 ± 0,026 | 0,349 ± 0,031** | 0,192 ± 0,004* | 0,411 ± 0,22* | 0,180 ± 0,010 | 0,518 ± 0,026 | 0,187 ± 0,006 |
| P2 | 0,138 ± 0,023** | 0,104 ± 0,015** | 0,225 ± 0,018** | 0,141 ± 0,009** | 0,274 ± 0,031** | 0,166 ± 0,009** | 0,420 ± 0,041 | 0,220 ± 0,018 | 0,470 ± 0,023 | 0,184 ± 0,013 |
Évolution du poids PA (g) et du poids relatif PR (g pour 100 g de PC) des vésicules séminales et de la prostate chez des rats témoins (T) et traités par l’acétate de plomb (P1 et P2) durant 15, 30, 45, 60 et 90 j. Les valeurs représentent la moyenne ± SEM. * p ≤ 0,05, par comparaison avec les rats témoins. ** p ≤ 0,01, par comparaison avec les rats témoins ; n : nombre de déterminations par groupe et pour chaque durée de traitement = 8.
| 15 j | 30 j | 45 j | 60 j | 90 j | |||||||
| PA | PR | PA | PR | PA | PR | PA | PR | PA | PR | ||
| T | 0,656 ± 0,133 | 0,376 ± 0,055 | 0,733 ± 0,093 | 0,355 ± 0,047 | 1,125 ± 0,055 | 0,479 ± 0,020 | 1,272 ± 0,172 | 0,506 ± 0,067 | 1,340 ± 0,107 | 0,439 ± 0,032 | |
| Vésicules séminales | P1 | 0,480 ± 0,153 | 0,179 ± 0,070 | 0,585 ± 0,074 | 0,279 ± 0,052 | 0,608 ± 0,138** | 0,300 ± 0,064* | 0,938 ± 0,149 | 0,348 ± 0,051 | 0,988 ± 0,043* | 0,358 ± 0,019 |
| P2 | 0,121 ± 0,042** | 0,104 ± 0,031** | 0,153 ± 0,024** | 0,125 ± 0,022** | 0,473 ± 0,090** | 0,253 ± 0,023** | 0,650 ± 0,142** | 0,325 ± 0,060 | 1,181 ± 0,087 | 0,470 ± 0,031 | |
| T | 0,256 ± 0,021 | 0,148 ± 0,011 | 0,304 ± 0,047 | 0,173 ± 0,020 | 0,366 ± 0,033 | 0,164 ± 0,010 | 0,517 ± 0,082 | 0,204 ± 0,031 | 0,450 ± 0,013 | 0,148 ± 0,012 | |
| Prostate | P1 | 0,174 ± 0,037 | 0,095 ± 0,020 | 0,245 ± 0,033 | 0,128 ± 0,026 | 0,177 ± 0,041** | 0,094 ± 0,014** | 0,326 ± 0,051 | 0,137 ± 0,016 | 0,365 ± 0,050 | 0,144 ± 0,022 |
| P2 | 0,096 ± 0,026** | 0,064 ± 0,015** | 0,099 ± 0,030** | 0,065 ± 0,017** | 0,130 ± 0,029** | 0,068 ± 0,008** | 0,285 ± 0,073 | 0,108 ± 0,030 | 0,437 ± 0,043 | 0,172 ± 0,012 |
3.2.2 Étude histologique des testicules
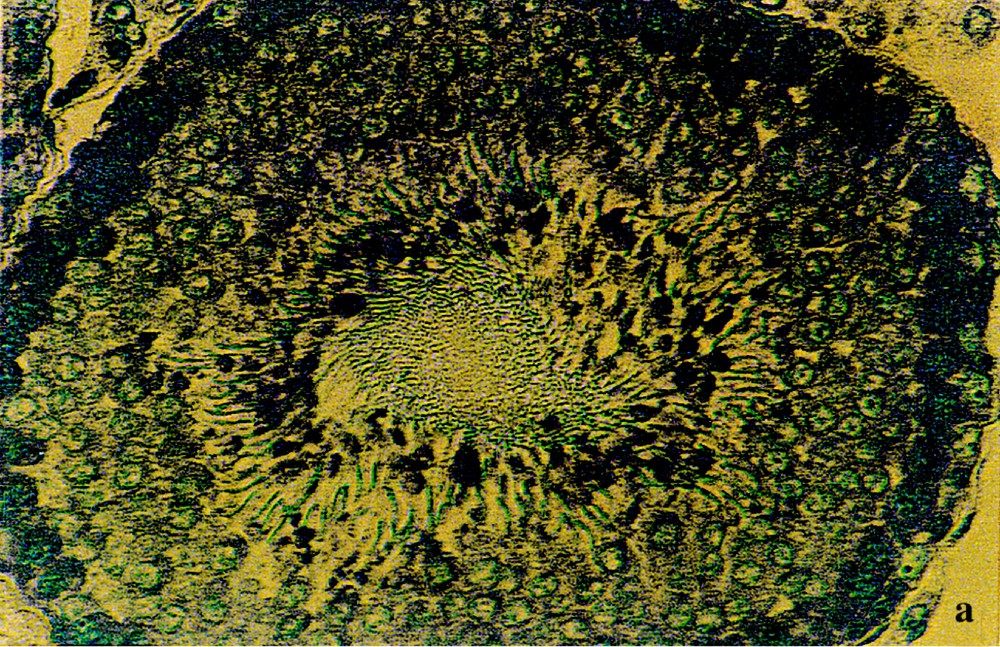
Comme le montrent les coupes histologiques, les testicules témoins (Fig. 1a) sont constitués de tubes séminifères serrés, avec des espaces interstitiels étroits. Chez les rats traités (Fig. 1b), ces espaces sont plus larges et la moitié des tubes séminifères apparaissent vides et de diamètre réduit.
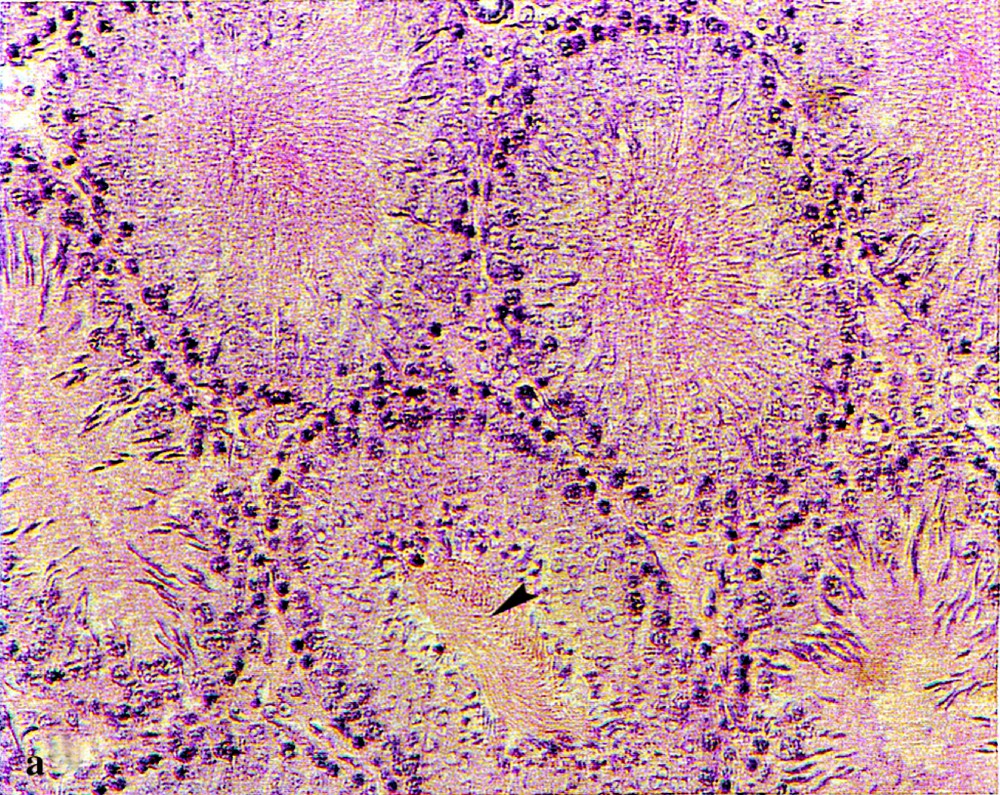
Structures histologiques des testicules de rats témoins (a) et traités par l’acétate de plomb (b) administré dans la boisson à une concentration de 0,6 % pendant 45 j. Coloration : hématoxyline–éosine. (Gr : × 70). Les flèches indiquent la présence (a) ou l’absence (b) de spermatozoïdes dans la lumière des tubes séminifères).
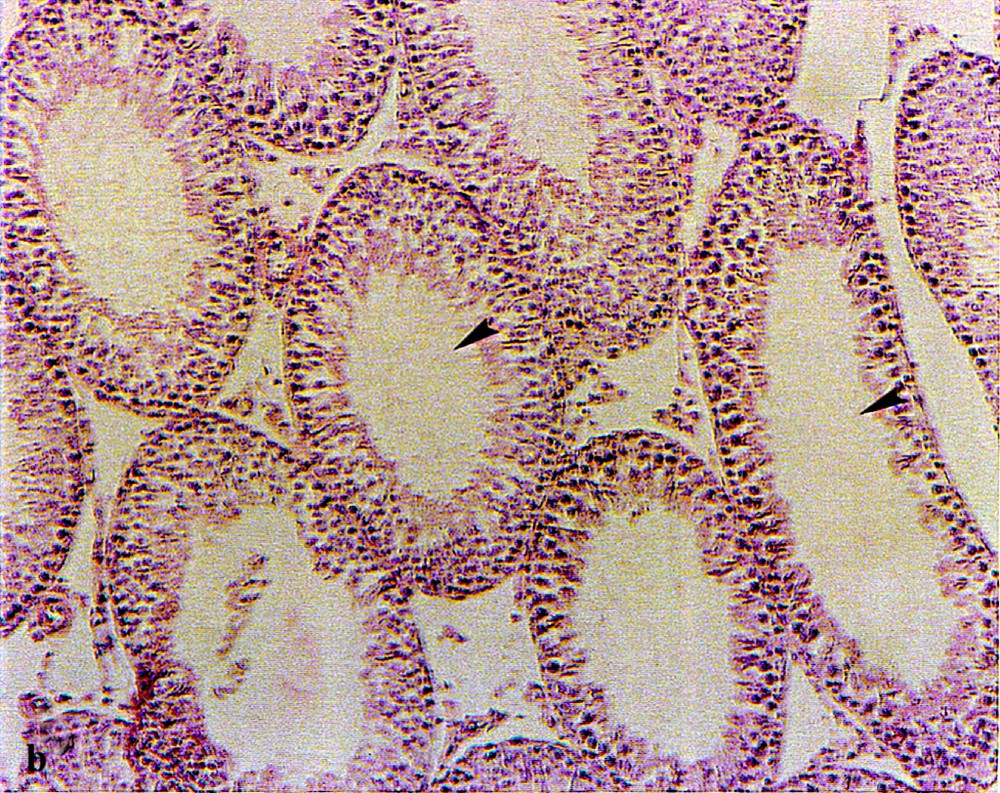
Au niveau de l’épithélium des tubes séminifères témoins (Fig. 2a), on observe les différents stades de la spermatogenèse, qui s’y déroule d’une façon centripète, avec des spermatogonies de petite taille en périphérie, des spermatocytes I et II de plus grande taille, avec des noyaux volumineux parfois en mitose, des spermatides plus petites, situées vers l’intérieur des tubes et, enfin, des spermatozoïdes mûrs, dont les flagelles remplissent la presque totalité de la lumière des tubes.


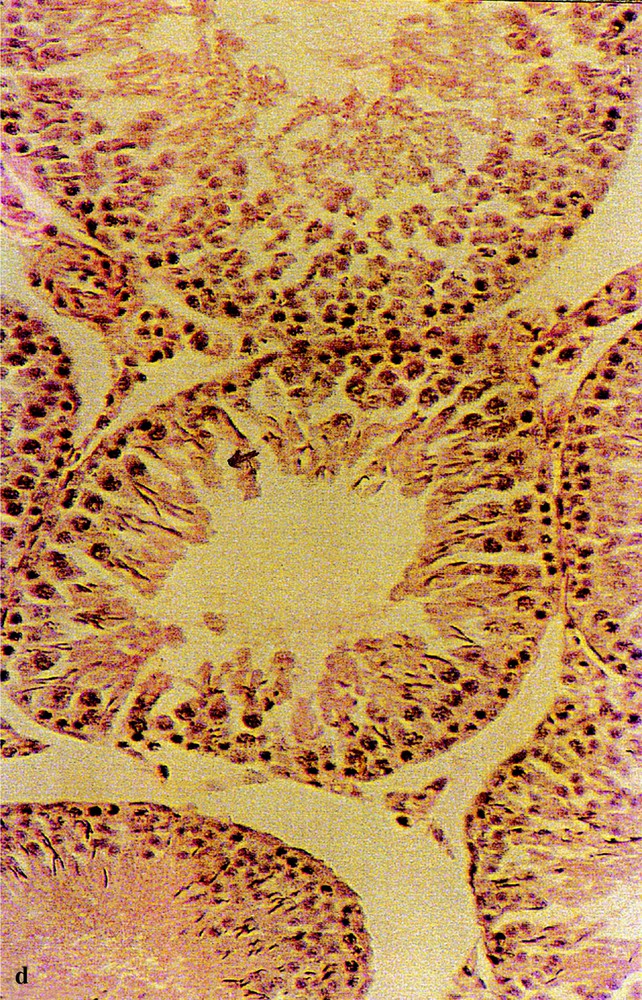
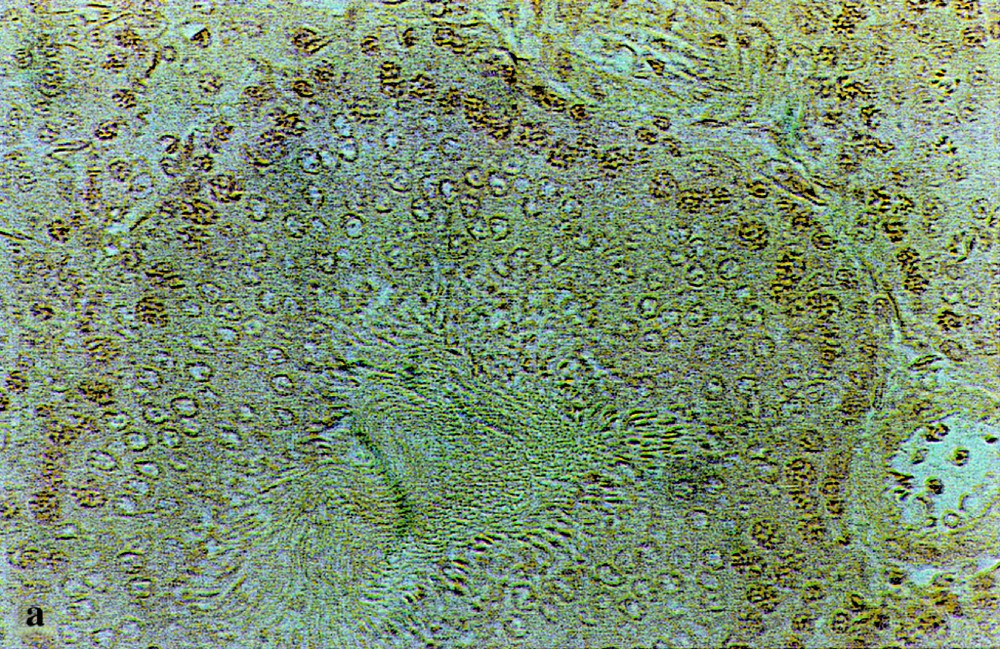
Structures histologiques des testicules de rats témoins (a) et traités par l’acétate de plomb, montrant différents types d’altérations :
– blocage de la spermatogenèse : (b) spermatozoïdes sans flagelles ; (c) absence totale de spermatozoïdes ;
– destruction des cellules de Sertoli : (d) présence de travées au niveau des tubes séminifères.
Coloration : hématoxyline-éosine. (Gr : × 180).
Chez les rats traités (Fig. 2b–d), les différents stades de la spermatogenèse apparaissent fortement perturbés après 15 j de traitement pour P2 et 45 j pour P1. Parmi les perturbations observées, on note des spermatozoïdes sans flagelles (Fig. 2b), ou une absence totale de spermatozoïdes (Fig. 2c) et/ou des anomalies de structure de la paroi des tubes séminifères, avec des travées vides, apparemment sans cellules de Sertoli, entre les cellules germinales (Fig. 2d). Ces perturbations semblent persister jusqu’au 90e jour du traitement, malgré la correction hormonale signalée vers cette date. Toutefois, on note une amélioration histologique, mais qui reste partielle.
3.2.3 Mise en évidence de cellules apoptotiques
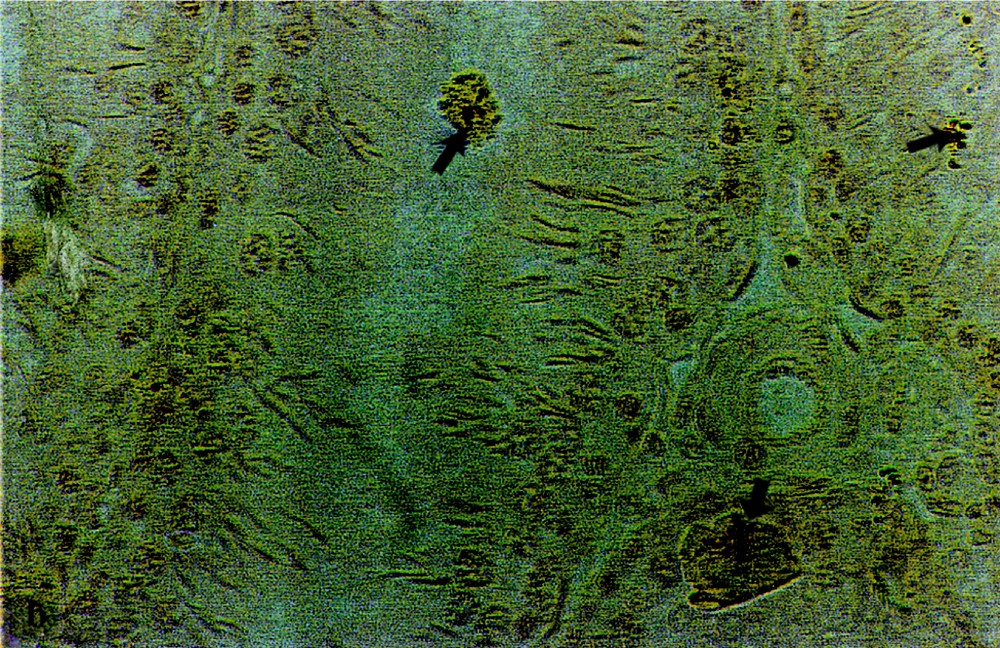
À partir du 30e jour de traitement plombé (P1 et P2), on observe, au niveau de la lumière des tubes séminifères (Fig. 3b), des cellules à noyaux denses de couleur bleu foncé, à chromatine condensée, dont la morphologie est évocatrice d’une apoptose. Au contraire, les cellules normales (Fig. 3a) montrent des noyaux clairs à chromatine décondensée et des nucléoles bien visibles. Ce phénomène d’apoptose semble persister jusqu’à la fin du traitement, malgré la correction du taux de la testostérone sérique.

Mise en évidence de cellules apoptotiques au niveau des testicules de rats témoins (a) et traités au plomb durant 90 jours (b). Coloration au bleu de toluidine boraté (Gr : × 235). Les flèches indiquent les cellules apoptotiques.
Dans la mesure où ces cellules apoptotiques ne sont observées que dans la zone où se trouvent normalement les spermatides et les spermatozoïdes, il semble que le plomb agisse essentiellement sur les derniers stades de la spermatogenèse.
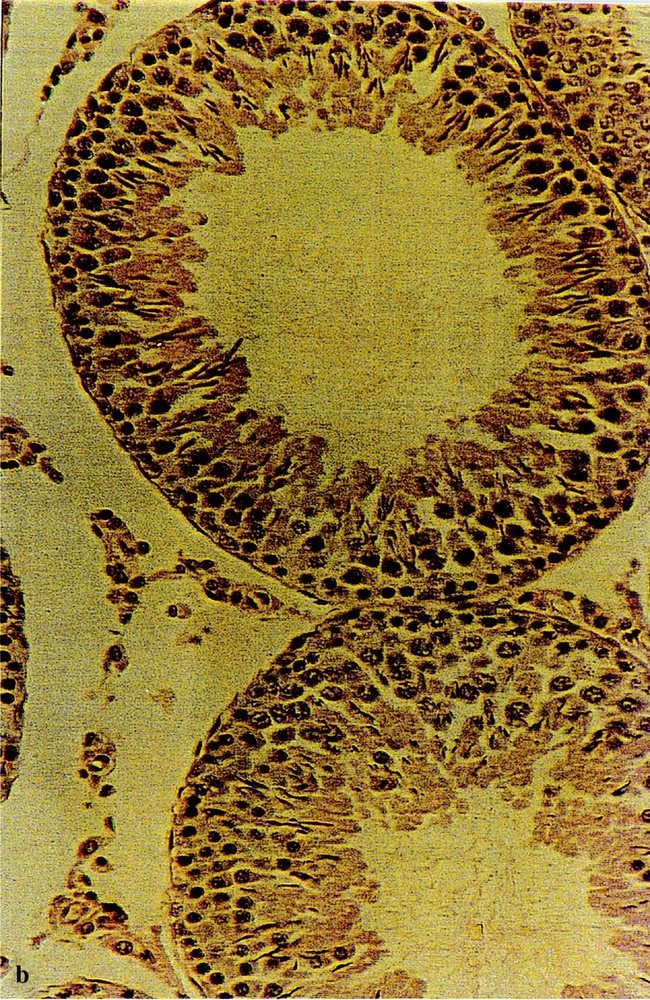
3.2.4 Détection histochimique du plomb par chélation avec le rhodizonate de sodium
Cette technique a permis de mettre en évidence des chélates de plomb au niveau des tubes séminifères des rats exposés (Fig. 4b). Ces chélates apparaissent de couleur brune sur un fond cellulaire bleu foncé coloré par l’hémalun. Les tubes témoins (4a) sont dépourvus de ces chélates.
Recherche histochimique à la rhodizonate de sodium de dépôts de plomb au niveau des testicules de rats témoins (a) et traités au plomb durant 90 j (b). Coloration de fond à l’hémalun (Gr : × 120). Les flèches indiquent ces dépôts de plomb.
3.2.5 Dosages de la testostérone sérique
La sécrétion de cette hormone est de caractère âge-dépendant, ainsi que le montrent les histogrammes de la Fig. 5. Le niveau de sécrétion passe par un maximum vers le 30e jour, ce qui correspond à un âge de presque 4 mois. Au-delà de cette période, le taux sérique de l’hormone baisse, pour retrouver une valeur moyenne de l’ordre de 0,9 ng ml–1.
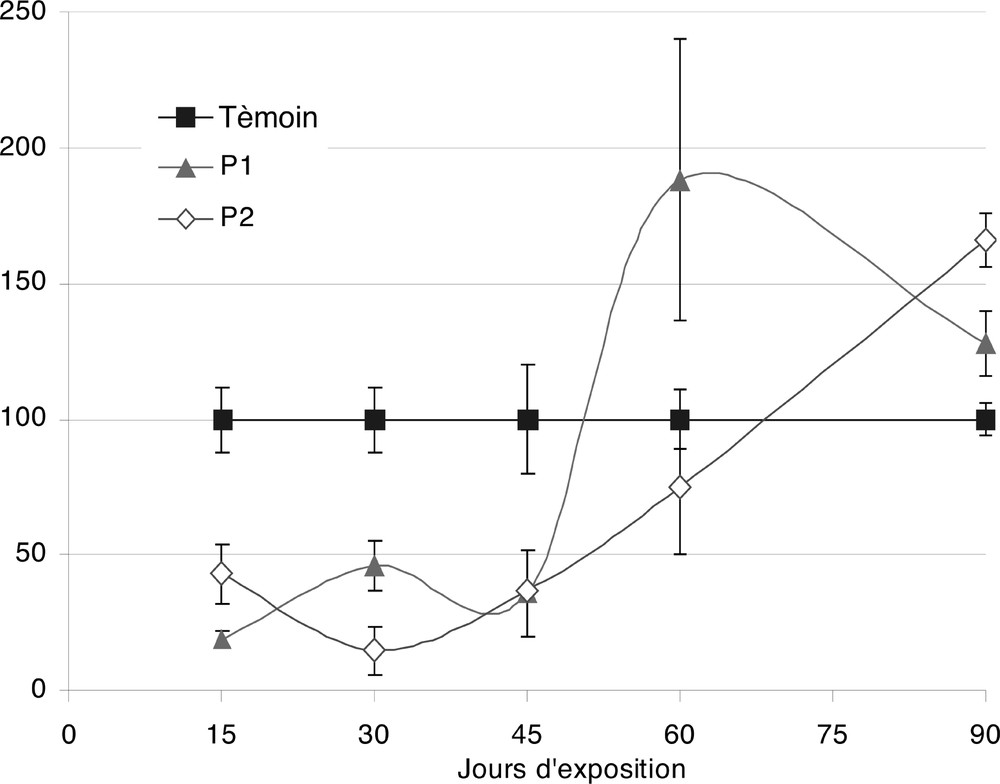
Variations relatives, par rapport aux témoins, des concentrations de testostérone sérique chez des rats exposés, de façon chronique, à deux concentrations d’acétate de plomb P1 (3 mg ml–1) et P2 (6 mg ml–1). Nombre de déterminations (n) : 7 par groupe et par durée.
Chez les rats traités, le Pb entraîne une chute de la sécrétion de cette hormone de l’ordre de 50 à 80% entre le 15e et le 45e jour de traitement. Ensuite, la concentration de testostérone augmente, malgré le traitement plombé, et dépasse celle des témoins, au 60e jour pour la plus faible dose de Pb (P1) et au 90e jour pour la plus forte dose (P2). Cette augmentation du taux de testostérone est parallèle à la reprise de poids des organes sexuels et est en accord avec le phénomène d’adaptation déjà suggéré.
3.3 Effets du plomb sur l’appareil génital femelle
3.3.1 Croissance des organes sexuels et frottis vaginaux
Nos observations n’ont pas mis en évidence de variation significative des poids absolus et relatifs de l’ovaire et de l’utérus chez les rates traitées par rapport aux témoins.
De même, l’étude cytologique des frottis vaginaux, correspondant aux quatre stades du cycle vaginal, n’a pas montré de différence significative entre les rates témoins et exposées au Pb. Nous avons retrouvé une abondance normale de cellules épithéliales au pro-oestrus et de cellules kératinisées à contours géométriques à l’œstrus (qui correspond à la période ovulatoire et au pic de la sécrétion d’œstrogène). Nous avons observé l’apparition caractéristique de leucocytes et de cellules phagocytaires au post-oestrus, et la disparition des cellules kératinisées au di-oestrus, qui est une période de moindre activité hormonale.
3.3.2 Taux de gestation et nombre d’implantations
Les accouplements entre mâles témoins et femelles exposées au Pb pendant 90 j ont fait apparaître une baisse du taux de la gestation pour les femelles P1 et surtout P2. Ce taux est passé de 100% (mâles T × femelles T) à 44,44% (mâles T × femelles P1) et à 14,29% (mâles T × femelles P2) (Tableau 3). Parallèlement, le nombre moyen d’implantations par portée est respectivement passé de 10,85 à 5,75 et 6,5 pour les femelles T, P1 et P2. Les mêmes effets sont observés, mais d’une façon moins sévère, chez les mâles P1 et P2 accouplés avec les femelles T (Tableau 4).
Résultats des croisements entre mâles (M) et femelles (F), témoins (T) ou traités par l’acétate de plomb (P1 ou P2) pendant 90 j. n : nombre de déterminations par groupe et pour chaque durée de traitement.
| Taux de gestation (%) | Nombre moyen d’implantations par portée | |
| M(T) × F(T) | 100 | 10,857 ± 0,125 (n = 14) |
| M(P1) × F(T) | 87,5 | 10,143 ± 0,225 (n = 7) |
| M(P2) × F(T) | 62,5 | 7,800 ± 0,167 (n = 5) |
| M(T) × F(P1) | 44,44 | 5,750 ± 0,550 (n = 8) |
| M(T) × F(P2) | 14,29 | 6,500 ± 0,441 (n = 6) |
3.4 Plombémie et plomb osseux
La Fig. 6 montre que la concentration sanguine du Pb, tout au long du traitement plombé, a été augmentée d’un facteur qui a fluctué entre 4 et 6 (par rapport aux témoins). De façon surprenante, cette concentration est donc restée relativement stable au cours du traitement. En effet, elle n’a pas augmenté avec le temps d’exposition, laissant supposer qu’elle correspond à un état d’équilibre entre absorption, accumulation et excrétion du Pb.
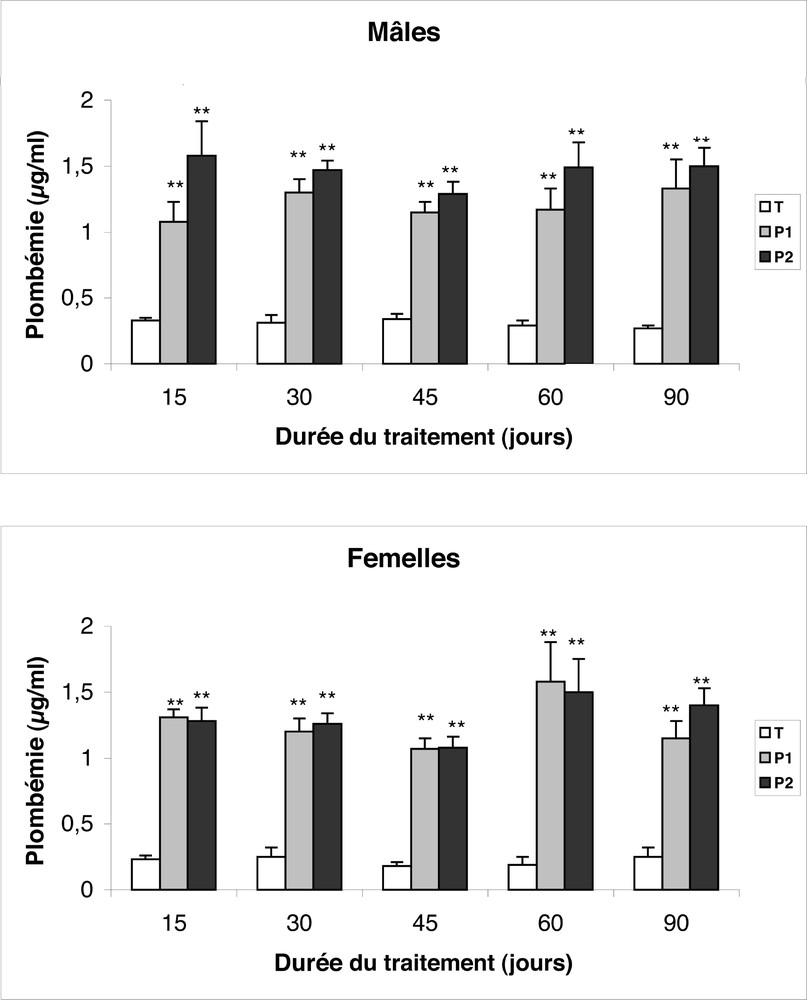
Évolution de la plombémie (μg par millilitre de sang) chez des rats témoins (T) et traités par l’acétate de plomb (P1 et P2) durant 15, 30, 45, 60 et 90 j. ** p ≤ 0,01, par comparaison avec les rats témoins. n = Nombre de déterminations (9 par groupe et par traitement).
Cette augmentation de la plombémie est dose-dépendante (p < 0,001) chez les rats mâles, mais pas chez les femelles, comme le mettent en évidence les valeurs moyennes de la plombémie calculées pour toute la durée du traitement pour les doses P1 et P2 (Tableau 5A). Si l’on considère que le niveau de base de la plombémie des rats témoins est de l’ordre de 0,2–0,3 μg ml–1, on peut donc relier les effets observés au niveau du tractus génital à une augmentation des concentrations sériques de Pb de l’ordre de 1μg ml–1.
Comparaison des valeurs moyennes de la plombémie (A) du 15 au 90e jour et du taux de Pb au niveau de la queue (B) à la fin du traitement (90e jour) chez des rats témoins et abreuvés de façon chronique avec de l’eau distillée contenant (P1) 3 ou (P2) 6 mg ml–1 d’acétate de Pb tri-hydraté, soit 1,6 ou 3,2 mg de Pb par millilitre d’eau. ** p < 0,01 par comparaison avec les témoins. p < 0,01 par comparaison de P2 par rapport à P1.
| Rats mâles | Rats femelles | ||||
| Variations | Variations | ||||
| (A) Plombémie moyenne (μg ml–1 sang) | Témoins | 0,311 ± 0,044 | 0,224 ± 0,058 | ||
| P1 | 1,216 ± 0,154** | + 0,905 | 1,265 ± 0,228** | + 1,041 | |
| P2 | 1,468 ± 0,173** | + 1,157 | 1,308 ± 0,191** | + 1,084 | |
| (B) Plomb osseux (μg g–1 Pds sec) | Témoins | 2,33 ± 0,14 | 3,66 ± 0,60 | ||
| P1 | 134,37 ± 5,72** | X 58 | 72,54 ± 11,90** | X 20 | |
| P2 | 209,10 ± 4,72** | X 90 | 160,08 ± 9,21** | X 43 |
Au niveau de la queue, le taux de plomb osseux mesuré au 90e jour de traitement a été augmenté d’une façon dose-dépendante en fonction des doses administrées (Tableau 5B). Pour P1 et P2, les taux de Pb ont été respectivement augmentés, d’un facteur 58 et 90 chez les mâles et seulement d’un facteur 20 et 43 chez les femelles. Dans la mesure où ces importantes augmentations sont grossièrement proportionnelles aux doses administrées (deux fois plus importantes pour P2 que pour P1), il est vraisemblable qu’elles sont le résultat d’une accumulation dose-dépendante du Pb au cours de l’exposition chronique à ce polluant. On peut estimer la quantité de Pb accumulée par jour à 1,4 et 2,3 μg g–1 de poids sec chez les mâles et 0,76 et 1,73 chez les femelles.
Le fait que l’accumulation du Pb soit deux fois plus importante chez les mâles que chez les femelles (Fig. 7) est peut-être dû au fait que les mâles ont consommé plus d’eau plombée que les femelles.
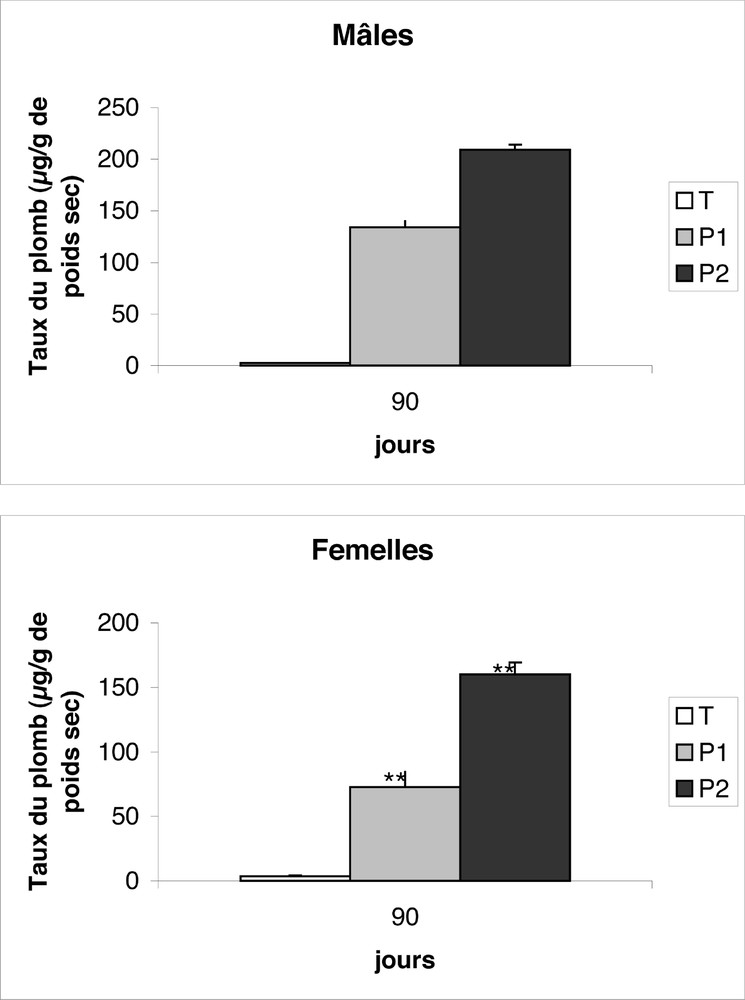
Évolution du plomb au niveau de la queue (μg par gramme de poids sec) chez des rats témoins (T) et traités par l’acétate de plomb (P1 et P2) durant 15, 30, 45, 60 et 90 j. ** p ≤ 0,01 par comparaison avec les rats témoins. ++ p ≤ 0,01, par comparaison avec les rats traités P1. n = nombre de déterminations (9 par groupe et par traitement).
4 Discussion
Dans le but d’évaluer les effets sur la fertilité d’expositions chroniques au Pb, nous avons abreuvé, pendant 90 j, des rats mâles et femelles de souche « Wistar », pubères, avec de l’eau distillée seule (lots témoins) ou contenant de l’acétate de plomb à deux concentrations : 3 mg ml–1 (lot P1) ou 6 mg ml–1 (lots P2).
Chez les rats mâles, ce traitement a entraîné des augmentations dose-dépendantes de la plombémie égales à de 0,9 μg ml–1 pour P1 et 1,2 μg ml–1 pour P2, qui n’ont pas significativement varié en fonction du temps de traitement. En relation avec ces concentrations, une atrophie des testicules, des vésicules séminales, de la prostate et des épididymes est apparue d’autant plus précocement que la dose de Pb était plus forte. Vers la fin du traitement, cette atrophie est corrigée, ce qui semble être la conséquence directe de la correction hormonale.
L’étude histologique des testicules des rats exposés au Pb a mis en évidence des anomalies « dose-dépendantes » au niveau de la plupart des tubes séminifères atrophiés et, en particulier, un arrêt de la spermiogenèse. Ces perturbations histologiques, qui apparaissent vers le début du traitement, persistent jusqu’à la fin, avec une faible amélioration, malgré la correction de la fonction hormonale et du poids du tractus génital signalés vers cette date. Ces résultats sont en accord avec ceux rapportés par divers auteurs. Des perturbations du nombre, de la mobilité et de la morphologie des spermatozoïdes ont été observées chez des rongeurs, des singes, ou chez l’homme 〚6, 10, 11〛 pour des plombémies supérieures à 0,4 μg ml–1.
Parallèlement au blocage de la spermiogenèse, nous avons observé la présence de cellules de type apoptotique dès le 30e jour du traitement et jusqu’à la fin (90e jour) ; ces cellules sont caractérisées par un noyau à chromatine condensée et fragmentée. L’élimination des cellules germinales par apoptose intervient spontanément dans des conditions physiologiques normales, mais elle est augmentée lors d’altérations des testicules induites par des toxiques chimiques 〚12〛 et sans doute par le Pb, comme le suggèrent nos premières observations. Des travaux récents montrent que l’induction de l’apoptose des cellules germinales est sous la dépendance d’une action paracrine des cellules de Sertoli 〚13〛.
Nos résultats sont en faveur d’une action spécifique du Pb sur les cellules de Sertoli, puisque nous avons observé des espaces vides entre les cellules de la lignée germinale des rats traités, ce qui correspond très vraisemblablement à une disparition des cellules de Sertoli. Ce résultat original n’a pas, à notre connaissance, été rapporté dans la littérature. Toutefois, Nathan et al. 〚14〛 n’ont pas remarqué en 1992 d’effets sertoliens du plomb in vivo chez le rat de souche « Sprague Dawley » ; la dose utilisée ainsi que la durée du traitement, qui ne sont pas les mêmes que les nôtres, pourraient être à l’origine de cette divergence d’observation. Conformément à nos résultats, Adhikari et al. 〚15〛 ont observé in vitro que le Pb (4–40 μM) entraînait le détachement des cellules de Sertoli, des cellules germinales en coculture, et pensent que cette action pourrait être à l’origine des perturbations de la spermatogenèse que l’on peut observer in vivo. En effet, les cellules de Sertoli ont un double rôle : (i) de par leur rôle de barrière hémato-testiculaire, elles protègent les cellules germinales des substances sanguines toxiques 〚16〛 ; (ii) sous l’action de la FSH (hormone hypophysaire) et de la testostérone (libérée par les cellules de Leydig), elles sécrètent diverses protéines, qui commandent la différenciation et la production des spermatozoïdes. L’effet toxique du Pb sur ces cellules peut donc expliquer, du moins en partie, l’arrêt de la spermiogenèse.
Nous avons par ailleurs observé, une chute importante de la concentration sérique de la testostérone du 15e au 45e jour du traitement au Pb. Pour des temps de traitement plus longs, la concentration sérique de cette hormone augmente, puis dépasse celle des témoins. Cette hyperactivité compensatrice est certainement due à un processus de rétrocontrôle, une faible concentration de testostérone stimulant la production de LH par l’hypophyse (et donc celle de testostérone). Cette hypothèse est confirmée par le fait que les rats exposés à la plus faible concentration de Pb sérique montrent, au 90e jour de traitement, une tendance au retour à la normale des valeurs sériques de testostérone. Or, on sait qu’un excès de testostérone inhibe la production de gonadolibérine hypothalamique (GnRH) et donc celle de FSH et LH (et par conséquent la production de testostérone). Une adaptation des fonctions hormonales lors d’expositions de longues durées au Pb semble donc probable, d’autant plus que nous avons observé que les organes sexuels retrouvaient un poids normal en fin de traitement de la même façon que pour le poids corporel, qui a montré une correction. Cette hypothèse demande cependant à être confirmée par le dosage des hormones impliquées dans ces processus de régulation, éventuellement la testostérone testiculaire et la LH, pour établir la part de l’atteinte hypophysaire.
Foster et al. 〚17〛 ont montré l’implication du Pb dans ces systèmes de régulation chez le singe. Ils ont observé que les taux de LH étaient diminués en fonction du temps de traitement, de même que le rapport inhibine/FSH. Dans la mesure où l’inhibine est une hormone produite par les cellules de Sertoli sous l’action de la FSH, ces auteurs suggèrent que le Pb induit un dysfonctionnement des cellules de Sertoli, ce qui confirmerait nos résultats.
Le mécanisme d’action du plomb sur les cellules interstitielles de Leydig sécrétrices de la testostérone n’est pas clairement établi. On peut supposer un effet cytotoxique du Pb, entraînant une chute de l’activité métabolique de ces cellules. Thoreux et al. 〚18〛 ont montré, in vitro et ex vivo, que le Pb inhibait l’expression de certaines enzymes impliquées dans la biosynthèse des hormones stéroïdes.
L’adaptation de la fonction hormonale explique bien la correction des poids des organes sexuels annexes. Toutefois, malgré cette correction, la défaillance histologique des testicules, avec l’atteinte des cellules de Sertoli, et le phénomène d’apoptose, qui a touché les derniers stades de la spermatogenèse, semblent persister, malgré une faible amélioration. Ceci est confirmé par le test de fertilité réalisé à la fin du traitement. En effet, l’accouplement de mâles P1 et P2 avec des femelles T met en évidence, chez celles-ci, une diminution du taux de gestation et du nombre d’implantations. Toutefois, il serait intéressant de refaire ce test de fertilité aux périodes où la spermatogenèse paraît la plus touchée, c’est-à-dire au 45e jour du traitement.
D’après nos résultats, il semble donc que le plomb est à l’origine d’une double perturbation testiculaire. L’une est fonctionnelle, hormonale, elle est corrigée à la fin du traitement, alors que l’autre est organique, touche directement l’histologie testiculaire, est la cause directe de l’altération de certaines cellules de Sertoli et du blocage des derniers stades de la spermatogenèse, avec apparition de phénomène d’apoptose, et n’est pas corrigée. La mise en évidence histochimique de chélates de plomb au niveau des testicules, et plus précisément au niveau des tubes séminifères des rats traités, confirme bien l’action directe du plomb au niveau de ces organes. Cependant, il serait intéressant de mesurer la concentration du plomb testiculaire pour clarifier davantage notre hypothèse.
La fertilité des rates est également perturbée par la contamination au Pb. Après 3 mois de traitement plombé, les femelles mises en présence de mâles témoins ont présenté une diminution du taux de gestation et du nombre moyen d’implantations. Dans la mesure où les phases du cycle sexuel, explorées par les frottis vaginaux, étaient normales, on peut supposer que cette chute de la fertilité est en rapport avec un développement ou une production anormale d’ovocytes. En effet, une inhibition du développement et de la maturation folliculaire a été observée chez des souris exposées au Pb par Junaid et al. 〚19〛, ainsi qu’une diminution du nombre d’implantations 〚20〛. Toutefois, une étude histologique des ovaires chez les rates traitées s’avère nécessaire pour clarifier nos déductions.
Dans des populations humaines vivant autour de fonderies, Nordstrom et al. 〚21〛 ont trouvé une augmentation significative des avortements spontanés. De même, une étude épidémiologique réalisée par Panova et Ivanova 〚22〛 a montré que le plomb pourrait être responsable d’un dysfonctionnement ovulatoire.
Le taux de plombémie est souvent utilisé comme biomarqueur d’une pollution par le Pb. En effet, des augmentations de la plombémie ont été souvent rapportées dans des populations exposées à des concentrations relativement faibles de Pb dans l’eau, l’atmosphère ou le sol 〚23, 24〛. De plus, divers types de professions sont exposées à une augmentation de la plombémie : c’est le cas des policiers 〚5〛, des chauffeurs des taxis 〚25〛 ou des soudeurs 〚26〛.
Nous n’avons, pour notre part, pas observé de corrélation nette entre les deux doses de Pb administrées et la plombémie. En effet, pour les deux doses, les taux de plombémie sont relativement proches et ils ne varient pas en fonction de la durée du traitement. Ces résultats sont en accord avec les données de la littérature. Dupas et Géraut 〚27〛 ont montré l’absence de corrélation entre le plomb dans l’air et la plombémie, puisque cette dernière est la résultante de nombreux facteurs, parmi lesquels le plus important est la fixation du plomb au niveau des os. Le plomb sanguin reflète l’état momentané de l’équilibre entre le plomb absorbé et le plomb fixé et ne reflète pas la durée d’exposition. Toutefois, bien que non fiable, la plombémie reste un outil indispensable au dépistage du saturnisme. Des signes d’intoxication peuvent apparaître pour des valeurs de 0,4 μg ml–1 chez l’homme 〚28〛.
Si l’on veut évaluer avec précision le niveau de pollution par le Pb et surtout la durée d’exposition, la concentration du plomb osseux semble être un bon marqueur 〚29〛. Hu 〚30, 31〛 a montré que l’os se comporte comme un dosimètre cumulatif d’intoxication plombée. Les dosages de Pb osseux, que nous avons réalisés au niveau de la queue des rats confirment ces résultats. Après 90 j de traitement plombé, nous avons obtenu une très importante augmentation, dose-dépendante, de la quantité de Pb au niveau de la queue, qui ne peut qu’être la résultante d’une accumulation (ou d'une fixation) journalière dose-dépendante de ce métal au niveau du tissu osseux.
5 Conclusion
Ce travail montre que, chez des rats adultes, une exposition chronique au Pb diminue la fertilité des rats femelles et inhibe la maturation des cellules de la lignée germinale mâle. Les résultats sont en faveur d’un effet cytotoxique du Pb sur les cellules de Sertoli, induisant secondairement la mort des cellules germinales mâle par apoptose.
Par ailleurs, la mesure du plomb osseux s’avère être un bon marqueur d’exposition au plomb, qui intègre les effets doses et temps.
Abridged version
In nature, lead is present in air, water and polluted foods. It comes from the industrial wastes, from fish caught in contaminated seawaters, from heavy road traffic, from plants that are close to sources of emissions and refineries, from tobacco… Numerous authors have studied the impact of lead on health. It can cause saturnism, disruption of the fertility…
However, works concerning the mechanism of the effect of lead on fertility are very rare or non-deductive.
The object of this study is to explore the impact of chronic exposures to lead on the reproductive functions in pubescent rats.
Three hundred male and female rats (B.W. 140 g) were fed on concentrated tablets (SICO, Sfax). The drinking water was controlled. Some rats received distilled water (T), the other ones received distilled water rich in lead acetate, at two concentrations: 3 mg ml–1 (P1 group) or 6 mg ml–1 (P2 group). This treatment lasted 15, 30,45, 60 or 90 days, depending on the groups.
Our results showed that in male rats, absolute and relative weights of testis, epididym, prostate and seminal vesicles were found to significantly decrease at day 15 in the P2 group and at day 45 in the P1 group. However, at day 60, these absolute and relative weights returned to control values.
Lead-induced pathological changes in spermatogenesis were observed at day 15 by histological study: arrest of cell germ maturation, Sertoli cell changes, and presence of apoptotic cells, revealed by borated toluidine blue in the testis. Presence of lead deposits was observed after histochemical staining using sodium rhodizonate. These histological disruptions persisted until day 90 of the treatment.
A decrease of testosterone serum level was detected from the 15th day in both P1 and P2 groups. This decrease was compensated by an important increase on the 60th day (P1) and on the 90th day (P2); then, the testosterone level returned to the same values as control ones, although the exposure continued.
In female rats, absolute and relative weights of ovary and uterus were found unchanged. The vaginal smears practised in females revealed the oestrus phase in all groups.
Exposed males/females were bred with control females/males, and the fecundity was assessed at G15 by counting the number of implantations. These numbers seemed to be highly reduced in females (P1 and P2) as compared to control females (T).
The determination of the concentration of lead in the blood showed that this factor increases among treated subjects in a constant way, independently of the dose and of the duration of the treatment. Nevertheless, the rate increase of lead in the tail seemed to be dose-dependent.
The tail seemed to be a dosimeter of lead bioaccumulation. It constitutes an endogenous source of lead impregnation. The concentration of lead in the blood is only an indicator of recent exposure.
In conclusion, our results tried to show that the administration of lead acetate by oral route in drinking water at the rate of 3 or 6 mg ml–1 during 15, 30, 45, 60 or 90 days for rats in growth period seemed to cause two reproductive disruptions. The first one would be functional, affecting the hormonal function, while the second one would be organic, affecting the uterus inside, with reduction of the rate of pregnancies, and affecting the testicular histology, with pathological changes in spermatogenesis, Sertoli cells, and presence of apoptotic cells. Whereas the first one was rapidly corrected, the second one seemed to have persisted.



