Abridged English version
The focus of this study was to examine the effects of N, P and Si fertilizations on the biomass, growth and taxonomic composition of phytoplankton in the Bizerte Lagoon (southwestern Mediterranean Sea, Tunisia). Enrichment experiments were conducted during March, June, August, October, and December 2004. Polycarbonate bottles filled with seawater were enriched with different nutrients according to four treatments N:Si:P ratios [+NSi/−P (40:40:1), +P/−NSi (20:20:2,5), +NP/−Si (16:0:1) and +Si/−NP (16:32:1)] and incubated in situ for six days at one station in the lagoon, located far from the shore. All bottles were sampled at 0, 2, 4 and 6 days of incubation for analyses of Chl a and of phytoplankton biomasses.
In natural water, Chl a concentration and algal carbon biomasses varied significantly during months, with the highest levels recorded in summer (June and August, 4–4.4 μg Chl a L−1 or 1126–1721 μg C L−1). The summer phytoplankton community was characterized by an important proliferation of diatoms, which represented 48% of the total phytoplankton biomass. However, dinoflagellates were prevailing during the other periods of the year.
Enrichment experiments showed that phytoplankton was limited by N, P and Si during the year, as all fertilizations were followed by significant increases in Chl a and in the final phytoplankton carbon biomasses. In summer (June/August), Si was more limiting for phytoplankton than N and P. Indeed, the +Si/−NP (in August) and +NSi/−P (in June) treatments induced more pronounced enhancements in Chl a than those observed when Si was deficient (+P/−NSi and +NP/−Si treatments).
Diatoms highly responded to +Si/−NP and +NSi/−P enrichments and they dominated the final phytoplankton community (52–61%) in both treatments. Si seemed to have the main role in controlling diatom development: Si enrichment (+NSi/−P) and, even when N was deficient, (+Si/−NP) induced substantial increases in diatom biomass and growth. However, Si deficiency (+NP/−Si) was followed by less pronounced enhancement in diatom variables. SIMPER results showed that several diatoms (Asterionella formosa, Chaetoceros decipiens, C. diadema, Coscinodiscus granii, Cylindrotheca closterium, Guinardia delicatula, Paralia sulcata and Prorosira glacialis) highly contributed to the significant change in algal composition between control and +Si/−NP treatment.
Nutrient enrichments affected also the community of dinoflagellates, but their strong responses were observed when P was in excess (+NP/−Si and +P/−NSi). Indeed, the biomasses and the growth rates of dinoflagellates were mostly stimulated by +P/−NSi and +NP/−Si enrichments. After 6 days, dinoflagellates represented more than 70% of the total phytoplankton biomass in both treatments. Moreover, SIMPER analysis indicated that dinoflagellates, such as Gymnodinium, Gyrodinium, Prorocentrum and Protoperidinium were the main contributors to the difference in algal taxonomic composition between control and +P/−NSi treatment.
Unlike diatoms and dinoflagellates, flagellates showed weak responses to nutrient treatments during only some months of the year.
Our study highlighted the role of nutrients in controlling the phytoplankton dynamic in the lagoon. Diatoms growth and biomass were mostly affected by Si, while the dinoflagellate dynamics seemed to be strongly tied to P availability. Nutrient increase in the lagoon may influence algal growth as well as specific composition in different ways, depending on the period of the year and the nature of the nutrient.
1 Introduction
Depuis les dernières décennies, l'enrichissement nutritif anthropique (eutrophisation) a été identifié comme un problème écologique pour plusieurs écosystèmes côtiers [1]. Les producteurs primaires étaient les premiers organismes affectés par ce phénomène, ce qui entraîne comme conséquences des changements dramatiques de leur structure et leur dynamique saisonnière [2]. Par suite de l'eutrophisation accrue des régions littorales, plusieurs études écologiques ont mis l'accent sur l'effet des nutriments sur le phytoplancton [3]. Par conséquent, déterminer quel élément nutritif limite le phytoplancton constitue une étape importante dans le développement des stratégies efficaces de gestion des écosystèmes [4]. La disponibilité des nutriments constitue le principal facteur qui contrôle le phytoplancton lorsque les conditions de lumière et de température sont adéquates [5]. En effet, elle peut affecter son taux de croissance [6], sa biomasse [7–9] et sa composition spécifique [8,10]. L'azote (N) a été considéré comme le principal élément qui limite la croissance du phytoplancton dans les lacs tropicaux [11], les eaux du Pacifique central [12] et de l'Atlantique nord [7], les estuaires et les baies [13]. Cependant, une limitation par le phosphore (P) a été enregistrée dans les lacs [14], la mer des Sargasses [15] et les eaux côtières [5,16]. En général, le rapport N:P des concentrations ambiantes peut indiquer le nutriment limitant. Un rapport (rapport de Redfield) indique une limitation par l'azote, alors qu'une limitation par le phosphore survient lorsque le rapport [5,17]. Dans les eaux côtières, où l'apport anthropique d'azote et de phosphore est élevé, le Si pourrait être le nutriment qui contrôle la dynamique du phytoplancton [18]. En effet, le Si peut limiter la biomasse et la production des diatomées [19]. Ce nutriment intervient dans la structure et le métabolisme des diatomées, si bien qu'il joue un rôle central dans leurs floraisons [20]. D'autres travaux ont plutôt reporté une co-limitation des producteurs primaires par N et P dans différents milieux aquatiques [6,8,10,13], et par N, P et Si [16,19].
Bien que la mer Méditerranée soit généralement une région oligotrophe [21], des cas d'eutrophisation ont été identifiés dans un certain nombre de secteurs côtiers, à cause des rejets des eaux usées urbaines et industrielles, des effluents des oueds et du lessivage des terres agricoles [22]. Des études expérimentales menées dans les eaux côtières de la Méditerranée ont montré que c'est le phosphore, plutôt que l'azote, qui limite la production phytoplanctonique [23]. Dans les lagunes côtières du Sud de la Méditerranée, notamment la lagune de Bizerte (Nord-Est de la Tunisie), des enrichissements nutritifs ont révélé qu'en hiver l'azote est le nutriment limitant pour le phytoplancton, alors qu'en été les producteurs primaires étaient co-limités par l'azote et le phosphore [6]. Jusqu'à cette date, aucune étude n'a porté sur l'effet de Si sur le phytoplancton de cette lagune, bien que les diatomées dominent la biomasse carbonée de la communauté algale du printemps et de l'été [24]. Le présent travail propose donc d'étudier l'impact des enrichissements simultanés en N, P et Si sur le phytoplancton dans la lagune pendant les différentes saisons.
2 Matériel et méthodes
2.1 Site d'étude
La lagune de Bizerte (37°8′–37°14′N, 9°48′–9°56′E) est située sur la côte nord de la Tunisie (Fig. 1). Elle a une superficie de 150 km2 et une profondeur moyenne de 8 m. Ce plan d'eau communique avec la mer Méditerranée par un canal de 12 m de profondeur et de 7 km de longueur. L'apport marin est fort en été, avec une circulation anticyclonique dans la lagune [25]. Les vents dominants du nord-ouest constituent le facteur principal forçant, puisque les marées sont négligeables [26]. Cette lagune, connue par une importante activité de pêche et d'aquaculture, supporte une forte biomasse (1–7 μg Chl a L−1) et une active production phytoplanctonique (50–360 μg C m−3 d−1) [24]. Ceci peut être dû à une disponibilité nutritive assez élevée ( : 0,8–11 μM ; : 0,14–0,48 μM) [6].

Localisation de la station d'étude dans la lagune de Bizerte.
2.2 Expériences d'enrichissement nutritif
Afin d'examiner les effets des nutriments sur le phytoplancton, cinq expériences d'enrichissement ont été conduites au printemps (mars), à l'été (juin et août), à l'automne (octobre) et à l'hiver (décembre) de 2004 dans une station de la lagune (Fig. 1) éloignée du rivage et des zones de rejet industriel et urbain. Pendant chaque expérience, des bouteilles en polycarbonate pré-stérilisées ont été remplies avec 2 l d'eau prélevée à une profondeur de 2 m (maximum de Chl a) et préfiltrée sur un filet de vide de maille de 200 μm (afin d'enlever le mésozooplancton). Les bouteilles ont été enrichies selon les différents traitements : T (témoin non enrichi) ; +NSi/−P (addition de trois solutions nutritives selon un rapport , 40 μM NO3 + 40 μM Si(OH)4 + 1,5 μM PO4) ; +P/−NSi (addition de trois solutions nutritives selon un rapport , 20 μM NO3 + 20 μM Si(OH)4 + 2,5 μM PO4) ; +NP/−Si (addition de trois solutions nutritives selon un rapport , 16 μM NO3 + 0 μM Si(OH)4 + 1 μM PO4) et +Si/−NP (addition de trois solutions nutritives, selon un rapport , 16 μM NO3 + 32 μM Si(OH)4 + 1 μM PO4). Les traitements +NP/−Si et +Si/−NP ont été réalisés seulement en août, alors que les autres enrichissements (+NSi/−P et +NP/−Si) ont été effectués en mars, juin, octobre et décembre.
Tous les traitements réalisés en duplicata sont incubés in situ pendant 6 j. Deux bouteilles de chaque traitement ont été prises aux 2e, 4e et 6e jours d'incubation pour analyser les nutriments (, , et Si(OH)4) et la Chl a, ainsi que pour identifier et dénombrer le phytoplancton. Au début de chaque incubation, la température et la salinité de l'eau ont été mesurées in situ au moyen d'un salinomètre muni d'un thermomètre (microprocesseur Conductivity Meter LF 196). La turbidité de l'eau a été mesurée au moyen d'un néphélomètre de type Hach 2100P. La teneur de l'oxygène dissous et le pH de l'eau, relevés respectivement à l'aide d'un oxymètre (WTW Oxi 330, sonde WTW CellOX 325) et d'un pH-mètre (WTW 538) portatifs.
Des échantillons initiaux ont été également prélevés pour déterminer les concentrations des nutriments, la Chl a, l'abondance et la composition taxinomique du phytoplancton dans l'eau naturelle. Toutes les solutions nutritives utilisées ont été préparées avec de l'eau déminéralisée. Tout le matériel employé pour l'incubation et la filtration a été rincé à l'acide chlorhydrique (10%) et lavé à l'eau bidistillée avant utilisation.
2.3 Analyses au laboratoire et calcul
2.3.1 Nutriments
Pour analyser les nutriments, des échantillons de 500 ml ont été filtrés sur des filtres Whatman GF/F ; les filtrats ont été conservés à jusqu'à l'analyse. Les nitrites et les nitrates ont été déterminés selon le procédé de Wood et al. [27]. L'ammonium a été mesuré suivant la technique de Koroleff [28]. Les analyses des phosphates et de l'acide orthosilicique ont été basées sur les méthodes de Murphy et Riley [29] et de Mullin et Riley [30], respectivement. Les limites de détection des méthodes analytiques d'analyse de , , , et Si(OH)4 sont 0,01, 0,05, 0,05, 0,02 et 0,1 μM, respectivement.
2.3.2 Chlorophylle a
Pour doser la Chl a, des échantillons de 1000 ml ont été filtrés sur des filtres Whatman GF/F. L'extraction de la Chl a a été réalisée dans l'acétone 90% pendant 30 h dans l'obscurité et à 5 °C. Les concentrations des pigments ont été estimées en utilisant la méthode spectrophotométrique de Lorenzen [31].
2.3.3 Abondance et biomasse du phytoplancton
Pour dénombrer et identifier le phytoplancton, des échantillons d'eau (150 ml) ont été fixés avec une solution de Lugol acide (concentration finale de 3%). Les abondances cellulaires ont été déterminées sous microscope inversé à l'immersion [32,33]. Dans chaque échantillon, au moins 200 cellules ont été comptées. Les dimensions de 50 cellules de chaque taxon ont été mesurées en utilisant un micromètre oculaire de calibrage ; les volumes cellulaires ont été déterminés en appliquant des formes géométriques standard [34]. Les biovolumes (μm3 cellule−1) ont été convertis en contenu cellulaire de carbone (pg C cellule−1) en employant les équations de conversion suivantes [35] : pg C cell−1 = 0,288 V0,811p, où Vp est le volume plasmatique, pour les diatomées, et pg C cell−1 = 0,216 V0,939p pour les flagellés et les dinoflagellés. La biomasse carbonée du phytoplancton a été ensuite déterminée en multipliant le contenu carboné des cellules par leur abondance.
2.4 Taux de croissance du phytoplancton
Le taux de croissance net du phytoplancton dans les différents traitements a été estimé en utilisant le modèle exponentiel de Landry et Hassett [36] :
| (1) |
2.5 Analyses statistiques
Les analyses statistiques ont été réalisées à l'aide du logiciel SPSS. 11.0 pour Windows.
Une analyse de variance (ANOVA) à un seul facteur a été utilisée pour tester la signification des variations temporelles de la Chl a et des biomasses carbonées du phytoplancton. Les coefficients de corrélation de Spearman () ont été calculés pour tester la relation linéaire entre les variables phytoplanctoniques (Chl a et biomasse carbonée) et les facteurs abiotiques.
Les effets significatifs des enrichissements nutritifs sur les variables estimées (Chl a, biomasse carbonée et taux de croissance du phytoplancton) ont été testés par une analyse de variance (ANOVA) à deux facteurs (le traitement nutritif et le jour). Lorsque l'effet est significatif, un test a posteriori de comparaison multiple (test de Dunett) a été réalisé pour déterminer quel traitement nutritif a été significativement différent du témoin. Lorsque la normalité de la distribution des données (test de Kolmogorov–Smirnov) et/ou l'homogénéité des variances (test de Bartlett–Box) n'ont pas été vérifiées, une analyse ANOVA non paramétrique (Kuskal–Wallis) a été employée.
Une analyse multivarié MDS (non-parametric multi-dimensional scaling ordination), suivie d'une mesure de similarité de Bray–Curtis, a été appliquée sur les racines carrées des biomasses finales (après 6 j de traitement) des différents taxa, pour déterminer si des changements sont intervenus dans la composition taxonomique finale du phytoplancton entre les différents traitements nutritifs. Une analyse des pourcentages de similarité (SIMPER) a été utilisée pour évaluer la contribution des taxa à la dissimilarité observée entre les enrichissements nutritifs et le témoin.
3 Résultats
3.1 Variabilité temporelle du milieu naturel
3.1.1 Physicochimie
Le Tableau 1 présente les données physicochimiques enregistrées dans le milieu naturel de la station d'étude au cours des différentes périodes (mars, juin, août, octobre et décembre) de l'année 2004. La température de l'eau a montré un maximum en août (26,90 °C) et un minimum en décembre (13,25 °C). La salinité a été plus élevée en été (juin : 35,70 PSU et août : 37,10 PSU) qu'aux autres saisons (26,30–28,00 PSU). La teneur en oxygène dissous (6,50–7,70 mg L−1) et le pH (7,20–8,95) des eaux n'ont pas beaucoup varié au cours du temps. Les eaux de la station ont été plus turbides en hiver (9,85 NTU) et en automne (7,00 NTU) qu'au printemps (1,70 NTU) et qu'en été (2,20–3,70 NTU). Les concentrations en et en ont varié entre 2,10 et 4,01 μM et entre 0,34 et 0,80 μM, respectivement. Les teneurs en Si(OH)4 les plus faibles ont été mesurées en octobre (0,51 μM), alors que les plus fortes ont été accusées en août (1,87 μM).
Physico-chimie de l'eau naturelle de la station d'étude au début de chaque expérience d'enrichissement pendant l'année 2004
| Mars | Juin | Août | Octobre | Décembre | |
| Température (°C) | 17,20 ± 0,07 | 23,10 ± 0,55 | 26,90 ± 0,29 | 16,90 ± 0,48 | 13,25 ± 0,36 |
| Salinité (PSU) | 26,30 ± 0,02 | 35,70 ± 0,81 | 37,10 ± 0,35 | 26,32 ± 0,03 | 27,95 ± 1,06 |
| Oxygène dissous (mg L−1) | 7,70 ± 0,02 | 6,85 ± 0,03 | 6,50 ± 0,04 | 7,10 ± 0,02 | 7,40 ± 0,05 |
| pH | 8,30 ± 0,04 | 8,57 ± 0,01 | 8,73 ± 0,05 | 8,95 ± 0,03 | 7,20 ± 0,00 |
| Turbidité (NTU) | 1,70 ± 0,02 | 3,70 ± 0,00 | 2,20 ± 0,00 | 7,00 ± 0,04 | 9,85 ± 0,09 |
| (μM) | 4,10 ± 0,06 | 2,91 ± 0,03 | 2,10 ± 0,02 | 3,90 ± 0,09 | 3,93 ± 0,03 |
| (μM) | 12,68 ± 0,36 | 20,76 ± 0,10 | 19,59 ± 0,08 | 25,29 ± 0,09 | 17,06 ± 0,11 |
| (μM) | 0,54 ± 0,01 | 0,45 ± 0,01 | 0,34 ± 0,02 | 0,80 ± 0,03 | 0,56 ± 0,07 |
| Si(OH)4 (μM) | 0,67 ± 0,02 | 0,57 ± 0,02 | 1,87 ± 0,01 | 0,51 ± 0,00 | 0,55 ± 0,01 |
3.1.2 Communauté phytoplanctonique
Les concentrations en Chl a et les biomasses carbonées du phytoplancton ont significativement varié () au cours des mois, avec un maximum en juin/août (4–4,4 μg Chl a L−1 ou 1126–1721 μg C L−1) et un minimum en décembre (2 μg Chl a L−1 ou 370,5 μg C L−1) (Tableau 2). La Chl a et la biomasse carbonée du phytoplancton ont été positivement corrélées avec la température (, ) et la salinité (, ), mais reliées négativement à la turbidité de l'eau (, ).
Concentration en Chl a et biomasse carbonée du phytoplancton dans l'eau naturelle de la station d'étude au cours de l'année 2004 (moyennes ± écart types). Les valeurs entre parenthèses présentent les contributions relatives des groupes taxinomiques à la biomasse phytoplanctonique
| Date | Mars | Juin | Août | Octobre | Décembre |
| Chl a (μg L−1) | 3,0 ± 0,3 | 4,4 ± 0,2 | 4,0 ± 0,3 | 3,1 ± 0,2 | 2,0 ± 0,2 |
| Biomasse carbonée (μg C L−1) | |||||
| – Phytoplancton total | 755,0 ± 24,3 | 1721,2 ± 208,3 | 1126,0 ± 42,8 | 647,4 ± 22,1 | 370,5 ± 121,5 |
| – Dinoflagellés | 498,0 ± 15,9(66%) | 910,3 ± 134,7(61%) | 526,1 ± 4,0(46%) | 373,1 ± 43,1(57%) | 228,0 ± 98,3(61%) |
| – Diatomées | 184,1 ± 4,5(24%) | 491,5 ± 1,9(33%) | 536,6 ± 28,6(48%) | 246,9 ± 29,5(38%) | 117,2 ± 17,1(31%) |
| – Flagellés | 71,9 ± 3,8(9%) | 76,6 ± 14,9(5%) | 63,3 ± 10,2(5%) | 27,4 ± 8,5(4%) | 25,3 ± 6,0(7%) |
La communauté phytoplanctonique naturelle a été composée de trois groupes taxinomiques, à savoir les dinoflagellés, les diatomées et les flagellés, qui ont montré des différentes contributions relatives à la communauté phytoplanctonique au cours de l'année (Tableau 2). Les dinoflagellés ont dominé le phytoplancton en mars, juin, octobre et décembre, puisqu'ils ont contribué pour 57–66% à la biomasse totale. Les diatomées ont constitué une fraction plus importante en août (48%) qu'aux autres périodes (24–38%). Cependant, les flagellés n'ont présenté que 4–9% de la biomasse totale du phytoplancton.
3.2 Effets des enrichissements nutritifs sur la communauté phytoplanctonique
3.2.1 Effets sur la biomasse chlorophyllienne
Les traitements +NSi/−P et +P/−NSi, réalisés en mars, juin, octobre et décembre 2004 ont été suivis par des augmentations significatives de la Chl a par rapport au témoin ( ; Fig. 2A, B, C et D). En juin, la fertilisation avec +NSi/−P a induit une plus forte stimulation du phytoplancton que celle observée après traitement +P/−NSi (Fig. 2B). En effet, au 6e jour d'incubation, les concentrations en Chl a dans ce traitement ont dépassé de cinq à huit fois celles dans le témoin. En août, les teneurs en Chl a ont significativement () augmenté dans les deux traitements +Si/−NP et +NP/−Si par rapport au témoin (Fig. 2E), la réponse la plus prononcée étant observée après l'addition de +Si/−NP.
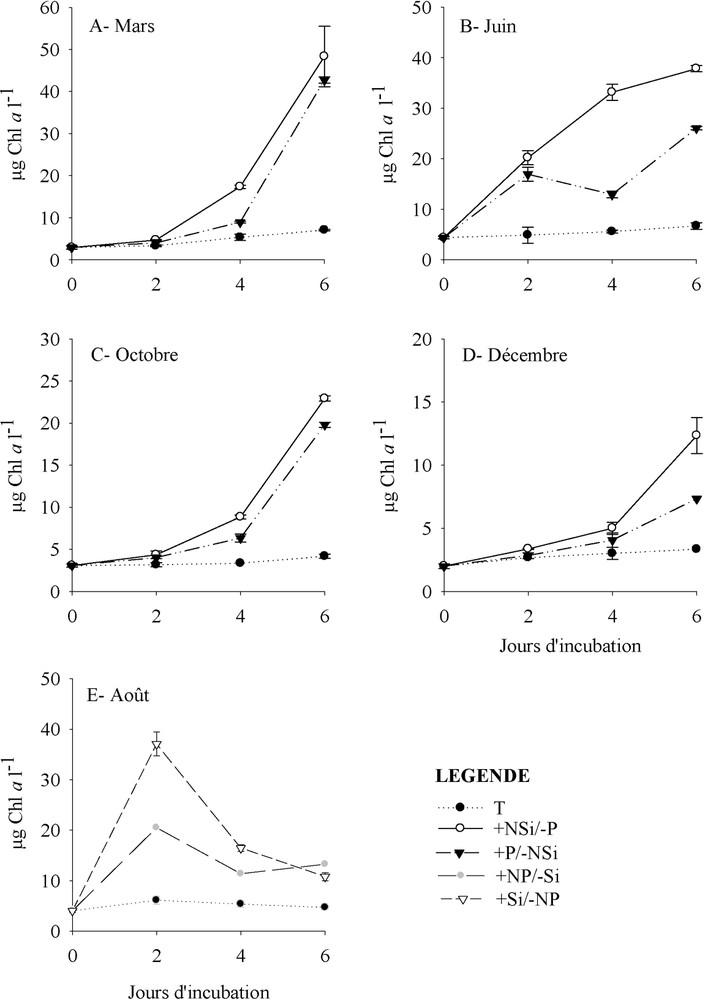
Variations temporelles des concentrations en Chl a (moyennes ± écart types) dans le témoin (T) et les enrichissements nutritifs (+NSi/−P, +P/−NSi, +NP/−Si et +Si/−NP) au cours de l'année 2004.
3.2.2 Effet sur les différents groupes phytoplanctoniques
3.2.2.1 Effet sur les diatomées.
Pendant les quatre mois (mars, juin, octobre et décembre), les diatomées ont répondu fortement à l'enrichissement +NSi/−P, en augmentant significativement () leur biomasse (Fig. 3A, B, C et D). En outre, les taux de croissance de la plupart des taxa dominants ont été stimulés par ce traitement (Tableau 3). En octobre et en décembre, les diatomées ont dominé la communauté finale du phytoplancton après addition +NSi/−P. En effet, ces microalgues ont contribué pour 52–61% de la biomasse du phytoplancton au 6e jour (Fig. 3C et D). Le traitement +Si/−NP, réalisé en août, a aussi significativement () stimulé la biomasse des diatomées totales (Fig. 3E) et la croissance de la plupart des taxa (Tableau 3), tels que Chaetoceros spp., Dactyliosolen spp., Entomoneis spp., Nitzschia spp. et Thalassiosira spp. Après traitement +Si/−NP, les diatomées ont dominé la communauté finale du phytoplancton (Fig. 3E). Les fertilisations ont induit un changement de la composition taxinomique finale des diatomées par rapport au témoin. En mars, les deux traitements +P/−NSi et +NSi/−P ont augmenté la contribution relative de Thalassiosira gravida par rapport au témoin. L'addition de +NSi/−P a aussi favorisé le développement des espèces d'Entomoneis, qui ont contribué davantage à la communauté finale des diatomées (Fig. 4A). En juin, l'effet du traitement +P/−NSi a été marqué par l'apparition de Pseudo-nitzschia spp. et une importante prolifération de Skeletonema costatum. Comme en mars, la contribution d'Entomoneis a augmenté après 6 j de traitement +NSi/−P, en juin (Fig. 4B). En octobre et en décembre, les compositions taxinomiques des diatomées sont restées presque inchangées par rapport au témoin (Fig. 4C et D). En août, le traitement +NP/−Si a provoqué une augmentation de la contribution relative de Chaetoceros spp., alors que les espèces de Guinardia ont été favorisées par l'enrichissement +Si/−NP (Fig. 4E).
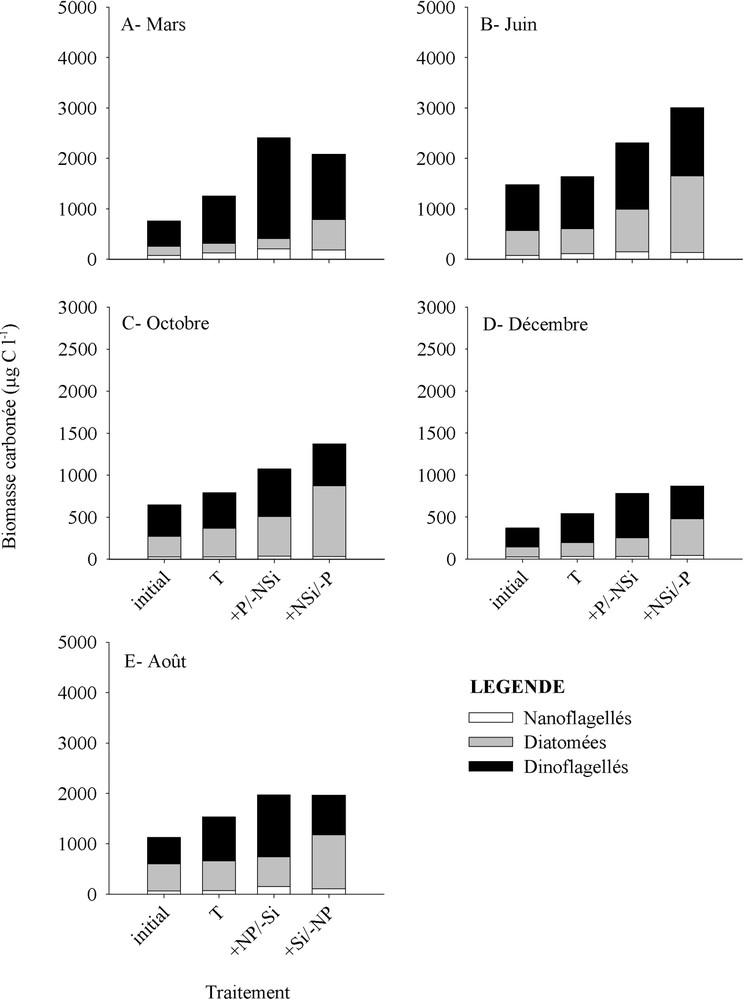
Biomasses carbonées initiales et finales (après 6 j d'incubation) dans le témoin (T) et les différents enrichissements nutritifs (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP) au cours de l'année 2004.
Taux de croissance (j−1) des principales diatomées dans le témoin (T) et les différents enrichissements nutritifs (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP) au cours de l'année 2004 (moyennes ± écart types). Les valeurs en gras sont significativement (P<0,001) supérieures au témoin
| T | +P/−NSi | +NSi/−P | +NP/−Si | +Si/−NP | ||
| Chaetoceros spp. | mars | 0,010 ± 0,005 | −0,016 ± 0,015 | 0,213 ± 0,020 | ||
| juin | 0,002 ± 0,055 | −0,077 ± 0,060 | 0,090 ± 0,018 | |||
| août | 0,074 ± 0,042 | 0,301 ± 0,032 | 0,333 ± 0,011 | |||
| octobre | 0,013 ± 0,006 | −0,141 ± 0,038 | 0,095 ± 0,008 | |||
| décembre | 0,075 ± 0,039 | 0,166 ± 0,127 | 0,299 ± 0,121 | |||
| Dactyliosolen spp. | mars | – | – | – | ||
| juin | −0,034 ± 0,047 | 0,047 ± 0,162 | 0,155 ± 0,071 | |||
| août | 0,371 ± 0,322 | – | – | 0,008 ± 0,001 | 0,610 ± 0,085 | |
| octobre | 0,192 ± 0,107 | 0,254 ± 0,100 | 0,287 ± 0,111 | |||
| décembre | −0,010 ± 0,000 | −0,448 ± 0,471 | 0,168 ± 0,141 | |||
| Entomoneis spp. | mars | 0,002 ± 0,000 | −0,057 ± 0,081 | 0,333 ± 0,070 | ||
| juin | 0,092 ± 0,122 | 0,033 ± 0,012 | 0,404 ± 0,057 | |||
| août | 0,173 ± 0,041 | −0,001 ± 0,286 | 0,486 ± 0,088 | |||
| octobre | 0,033 ± 0,047 | 0,099 ± 0,045 | 0,187 ± 0,012 | |||
| décembre | – | – | – | |||
| Guinardia spp. | mars | −0,004 ± 0,005 | −0,032 ± 0,046 | 0,210 ± 0,121 | ||
| juin | 0,023 ± 0,104 | 0,219 ± 0,78 | 0,226 ± 0,049 | |||
| août | 0,128 ± 0,019 | −0,251 ± 0,068 | 0,294 ± 0,042 | |||
| octobre | 0,085 ± 0,022 | 0,099 ± 0,026 | 0,193 ± 0,029 | |||
| décembre | 0,047 ± 0,081 | 0,034 ± 0,21 | 0,143 ± 0,115 | |||
| Gyrosigma spp. | mars | 0,004 ± 0,001 | 0,007 ± 0,001 | 0,150 ± 0,047 | ||
| juin | – | – | – | |||
| août | 0,173 ± 0,245 | −0,173 ± 0,245 | 0,173 ± 0,245 | |||
| octobre | 0,001 ± 0,001 | 0,072 ± 0,023 | 0,126 ± 0,054 | |||
| décembre | – | – | – | |||
| Leptocylindrus spp. | mars | – | – | – | ||
| juin | 0,443 ± 0,010 | 0,407 ± 0,010 | 0,627 ± 0,004 | |||
| août | – | – | – | – | – | |
| octobre | 0,062 ± 0,044 | 0,104 ± 0,068 | 0,252 ± 0,015 | |||
| décembre | 0,022 ± 0,191 | 0,085 ± 0,121 | 0,267 ± 0,026 | |||
| Nitzschia spp. | mars | 0,298 ± 0,140 | 0,367 ± 0,065 | 0,501 ± 0,141 | ||
| juin | 0,231 ± 0,330 | 0,202 ± 0,238 | 0,421 ± 0,248 | |||
| août | 0,557 ± 0,294 | 0,617 ± 0,207 | 0,749 ± 0,402 | |||
| octobre | 0,009 ± 0,007 | 0,143 ± 0,013 | 0,180 ± 0,013 | |||
| décembre | 0,063 ± 0,204 | −0,015 ± 0,162 | 0,241 ± 0,128 | |||
| Pleurosigma spp. | mars | −0,027 ± 0,038 | −0,033 ± 0,110 | 0,038 ± 0,059 | ||
| juin | 0,045 ± 0,087 | 0,172 ± 0,000 | 0,213 ± 0,032 | |||
| août | −0,025 ± 0,491 | 0,019 ± 0,001 | −0,384 ± 0,472 | |||
| octobre | 0,001 ± 0,007 | 0,040 ± 0,057 | 0,120 ± 0,060 | |||
| décembre | – | – | – | |||
| Skeletonema spp. | mars | – | – | – | ||
| juin | −0,015 ± 0,074 | 0,436 ± 0,040 | 0,229 ± 0,068 | |||
| août | – | – | – | – | – | |
| octobre | – | – | – | |||
| décembre | – | – | – | |||
| Thalassiosira spp. | mars | 0,001 ± 0,002 | 0,149 ± 0,047 | 0,373 ± 0,037 | ||
| juin | – | – | – | |||
| août | −0,173 ± 0,041 | 0,006 ± 0,002 | 0,173 ± 0,041 | |||
| octobre | 0,057 ± 0,081 | 0,183 ± 0,183 | 0,189 ± 0,217 | |||
| décembre | 0,047 ± 0,081 | 0,150 ± 0,049 | 0,230 ± 0,058 |
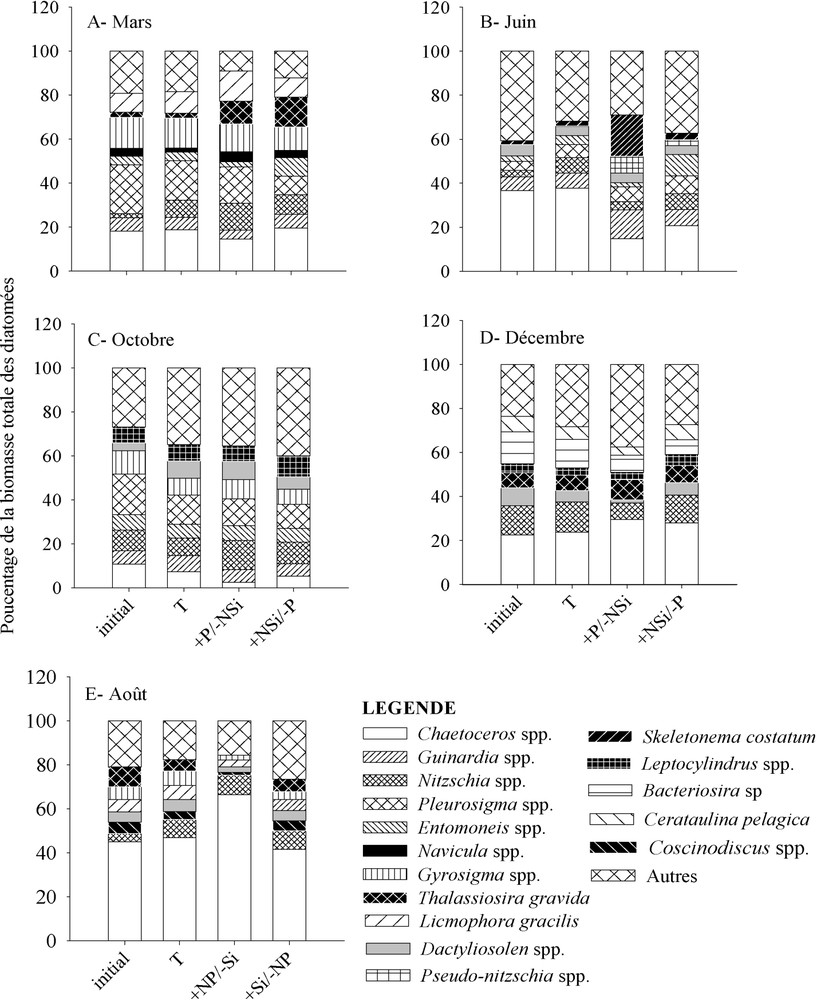
Composition taxinomique des diatomées à l'état initial et final (après 6 j de traitement) dans le témoin (T) et les différents enrichissements nutritifs (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP) au cours de l'année 2004.
3.2.2.2 Effet sur les dinoflagellés.
Contrairement au cas des diatomées, la biomasse des dinoflagellés a été surtout stimulée par l'enrichissement +P/−NSi pendant les quatre saisons (Fig. 3A, B, C et D). Dans ce traitement, les dinoflagellés ont contribué à hauteur de 68 à 83% à la biomasse finale du phytoplancton pendant le printemps (mars) et l'hiver (décembre). L'addition de +P/−NSi a favorisé la croissance de plusieurs taxa (Tableau 4). Le traitement +NP/−Si, réalisé en août, a aussi significativement (P < 0,05) stimulé la biomasse des dinoflagellés totaux (Fig. 3E) et la croissance de quelques taxa, tels que Ceratium spp. et Protoperidinium spp. (Tableau 4).
Taux de croissance (j−1) des dinoflagellés dans le témoin (T) et les différents enrichissements nutritifs (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP) au cours de l'année 2004 (moyennes ± écart types). Les valeurs en gras sont significativement (P<0,001) supérieures au témoin
| T | +P/−NSi | +NSi/−P | +NP/−Si | +Si/−NP | ||
| Ceratium spp. | mars | 0,097 ± 0,061 | 0,148 ± 0,045 | 0,057 ± 0,065 | Ceratium spp. | |
| juin | – | – | – | |||
| août | 0,145 ± 0,132 | 0,378 ± 0,008 | ||||
| octobre | 0,000 ± 0,000 | 0,001 ± 0,000 | 0,000 ± 0,000 | |||
| décembre | 0,047 ± 0,081 | 0,189 ± 0,081 | 0,139 ± 0,153 | |||
| Gymnodinium spp. | mars | 0,054 ± 0,079 | 0,147 ± 0,048 | 0,110 ± 0,003 | Gymnodinium spp. | |
| juin | −0,002 ± 0,006 | −0,246 ± 0,367 | 0,025 ± 0,136 | |||
| août | 0,792 ± 1,112 | 0,773 ± 1,100 | ||||
| octobre | 0,041 ± 0,028 | 0,100 ± 0,058 | 0,137 ± 0,055 | |||
| décembre | 0,047 ± 0,265 | 0,062 ± 0,173 | 0,092 ± 0,129 | |||
| Gyrodinium spp. | mars | 0,304 ± 0,266 | 0,751 ± 0,013 | 0,710 ± 0,092 | Gyrodinium spp. | |
| juin | 0,105 ± 0,131 | −0,181 ± 0,123 | 0,203 ± 0,145 | |||
| août | 0,004 ± 0,005 | −0,124 ± 0,356 | ||||
| octobre | −0,332 ± 0,474 | −0,026 ± 0,030 | −0,332 ± 0,474 | |||
| décembre | −0,414 ± 0,081 | −0,413 ± 0,081 | −0,413 ± 0,081 | |||
| Prorocentrum spp. | mars | 0,099 ± 0,004 | 0,262 ± 0,090 | 0,141 ± 0,084 | Prorocentrum spp. | |
| juin | 0,068 ± 0,097 | −0,138 ± 0,306 | 0,030 ± 0,038 | |||
| août | −0,524 ± 0,163 | 0,006 ± 0,008 | ||||
| octobre | 0,067 ± 0,081 | 0,298 ± 0,039 | 0,135 ± 0,025 | |||
| décembre | 0,052 ± 0,089 | 0,150 ± 0,120 | 0,095 ± 0,043 | |||
| Protoperidinium spp. | mars | 0,120 ± 0,120 | 0,206 ± 0,048 | 0,074 ± 0,235 | Protoperidinium spp. | |
| juin | 0,206 ± 0,020 | 0,068 ± 0,004 | 0,123 ± 0,445 | |||
| août | 0,238 ± 0,469 | 0,507 ± 0,578 | ||||
| octobre | 0,198 ± 0,120 | 0,185 ± 0,118 | 0,222 ± 0,102 | |||
| décembre | −0,011 ± 0,000 | 0,058 ± 0,081 | 0,058 ± 0,081 | |||
| Ceratium spp. | mars | 0,097 ± 0,061 | 0,148 ± 0,045 | 0,057 ± 0,065 | Ceratium spp. | |
| juin | – | – | – | |||
| août | 0,145 ± 0,132 | 0,378 ± 0,008 | ||||
| octobre | 0,000 ± 0,000 | 0,001 ± 0,000 | 0,000 ± 0,000 | |||
| Gymnodinium spp. | décembre | 0,047 ± 0,081 | 0,189 ± 0,081 | 0,139 ± 0,153 | Gymnodinium spp. | |
| mars | 0,054 ± 0,079 | 0,147 ± 0,048 | 0,110 ± 0,003 | |||
| juin | −0,002 ± 0,006 | −0,246 ± 0,367 | 0,025 ± 0,136 | |||
| août | 0,792 ± 1,112 | 0,773 ± 1,100 | ||||
| octobre | 0,041 ± 0,028 | 0,100 ± 0,058 | 0,137 ± 0,055 | |||
| Gyrodinium spp. | décembre | 0,047 ± 0,265 | 0,062 ± 0,173 | 0,092 ± 0,129 | Gyrodinium spp. | |
| mars | 0,304 ± 0,266 | 0,751 ± 0,013 | 0,710 ± 0,092 | |||
| juin | 0,105 ± 0,131 | −0,181 ± 0,123 | 0,203 ± 0,145 | |||
| août | 0,004 ± 0,005 | −0,124 ± 0,356 | ||||
| octobre | −0,332 ± 0,474 | −0,026 ± 0,030 | −0,332 ± 0,474 | |||
| Prorocentrum spp. | décembre | −0,414 ± 0,081 | −0,413 ± 0,081 | −0,413 ± 0,081 | Prorocentrum spp. | |
| mars | 0,099 ± 0,004 | 0,262 ± 0,090 | 0,141 ± 0,084 | |||
| juin | 0,068 ± 0,097 | −0,138 ± 0,306 | 0,030 ± 0,038 | |||
| août | −0,524 ± 0,163 | 0,006 ± 0,008 | ||||
| octobre | 0,067 ± 0,081 | 0,298 ± 0,039 | 0,135 ± 0,025 | |||
| Protoperidinium spp. | décembre | 0,052 ± 0,089 | 0,150 ± 0,120 | 0,095 ± 0,043 | Protoperidinium spp. | |
| mars | 0,120 ± 0,120 | 0,206 ± 0,048 | 0,074 ± 0,235 | |||
| juin | 0,206 ± 0,020 | 0,068 ± 0,004 | 0,123 ± 0,445 | |||
| août | 0,238 ± 0,469 | 0,507 ± 0,578 | ||||
| octobre | 0,198 ± 0,120 | 0,185 ± 0,118 | 0,222 ± 0,102 |
Pendant les différentes périodes, les enrichissements ont été suivis par une légère modification de la composition finale des dinoflagellés. L'effet le plus marqué a été observé en mars et juin, durant lesquels les traitements +P/−NSi et +NSi/−P ont augmenté les contributions relatives de Gyrodinium et/ou de Protoperidinium par rapport au témoin (Fig. 5A et B).

Composition taxinomique des dinoflagellés à l'état initial et final (après 6 j de traitement) dans le témoin (T) et les différents enrichissements nutritifs (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP) au cours de l'année 2004.
3.2.2.3 Effet sur les flagellés.
La biomasse des flagellés a été significativement () augmentée par les additions +P/−NSi et +NSi/−P, seulement en mars (Fig. 3A). Toutefois, la contribution des flagellés à la biomasse phytoplanctonique finale reste faible. Durant ce mois, ces deux traitements ont surtout stimulé la croissance des Chlorophycées et des Prymnesiophycées (Fig. 6A). En août, les deux traitements +Si/−NP et +NP/−Si ont induit une augmentation significative () de la biomasse carbonée des flagellés (Fig. 3E) et ont favorisé la croissance de quelques groupes, tels que les Prasinophycées, les Chlorophycées et les flagellés < 5 μm (Fig. 6E).

Composition taxinomique des flagellés à l'état initial et final (après 6 j d'incubation) dans le témoin (T) et les différents enrichissements nutritifs (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP) au cours de l'année 2004.
Au cours des différentes périodes, la composition taxinomique finale des flagellés est restée sensiblement la même dans les différents traitements (Fig. 6).
3.2.3 Effet sur la composition taxinomique du phytoplancton total
Les réponses des taxa de différents groupes aux traitements nutritifs ont induit un remaniement de la composition finale du phytoplancton total. L'analyse MDS a effectivement montré que les compositions finales du phytoplancton dans les traitements étaient différentes de celle du témoin (Fig. 7). En effet, des dissimilarités moyennes élevées ont été observées entre le témoin et tous les enrichissements nutritifs (Tableau 5). De plus, les additions nutritives sont dissemblables entre eux. Les effets des fertilisations sur la composition du phytoplancton étaient remarquables, surtout en mars, juin et août, puisque les différences les plus fortes par rapport au témoin ont été mesurées durant ces mois. L'analyse des pourcentages de similarité (SIMPER) a montré que les différences significatives entre les traitements et les témoins ont principalement résulté des changements des biomasses des espèces dominantes (Tableau 6).
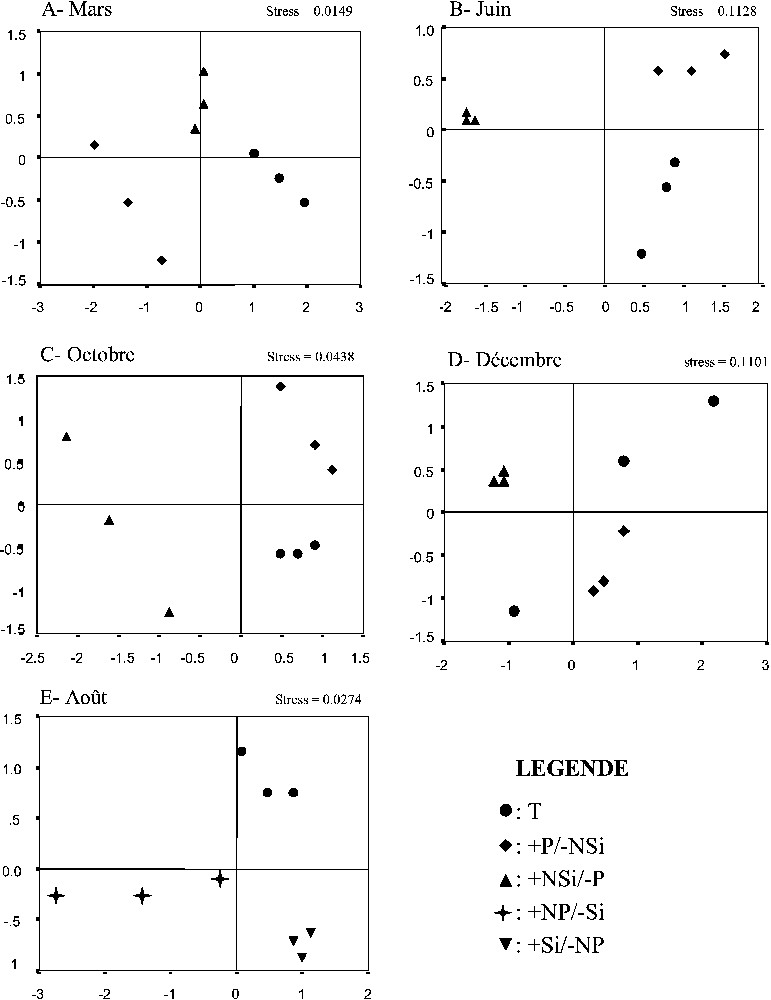
Résultats de l'analyse non paramétrique MDS (positionnement multidimensionnelle) des biomasses finales des taxa phytoplanctoniques dans les différents traitements nutritifs au cours de l'année 2004.
Dissimilarités moyennes concernant la composition taxinomique finale du phytoplancton entre les différents traitements nutritifs au cours de l'année 2004
| T | +P/−NSi | +NSi/−P | +NP/−Si | +Si/−NP | ||
| Mars | T | |||||
| +P/−NSi | 491,56 | |||||
| +NSi/−P | 299,69 | 343,23 | ||||
| Juin | T | |||||
| +P/−NSi | 330,82 | |||||
| +NSi/−P | 486,90 | 530,18 | ||||
| Août | T | |||||
| +NP/−Si | 282,29 | |||||
| +Si/−NP | 221,42 | 307,13 | ||||
| Octobre | T | |||||
| +P/−NSi | 104,63 | |||||
| +NSi/−P | 158,92 | 143,73 | ||||
| Décembre | T | |||||
| +P/−NSi | 104,21 | |||||
| +NSi/−P | 120,83 | 125,07 |
Résultats de l'analyse des pourcentages de similarité (SIMPER), montrant les espèces responsables des différences entre le témoin et les traitements (+P/−NSi, +NSi/−P, +NP/−Si et +Si/−NP)
| +P/−NSi | +NSi/−P | +NP/−Si | +Si/−NP | |
| Mars | Gyrodinium fusiforme (+) | Thalassiosira gravida (+) | ||
| Gyrodinium spirale (+) | Ceratium longipes (−) | |||
| Protoperidinium depressum (+) | Gyrodinium spirale (+) | |||
| Prorocentrum rostratum (+) | Entomoneis sp. (+) | |||
| Gymnodinium sanguineum (+) | Gyrosigma sp. (+) | |||
| Protoperidinium conicum (−) | ||||
| P. compressum (−) | ||||
| Prorocentrum compresssum (+) | ||||
| Licmophora gracilis (+) | ||||
| Gyrodinium fusiforme (+) | ||||
| Juin | Protoperidinum conicum (+) | Entomoneis sp. (+) | ||
| Skeletonema costatum (+) | Rhizosolenia crassispina (+) | |||
| Gymnodinium sanguineum (+) | Guinardia delicatula (+) | |||
| Gyrodinium fusiforme (+) | Gyrodinium fusiforme (+) | |||
| Guinardia delicatula (+) | Asterionella formosa (+) | |||
| Protoperidinium depressum (+) | ||||
| Gyrosigma sp. (+) | ||||
| Pleurosigma directum (+) | ||||
| Attheya longipes (+) | ||||
| Cylindrotheca closterium (+) | ||||
| Protoperidinium sp. (+) | ||||
| Pleurosigma strigosum (+) | ||||
| Prorocentrum arcuatum (+) | ||||
| Nitzschia rectilonga (+) | ||||
| Août | Protoperidinium sp. (+) | Chaetoceros decipiens (+) | ||
| P. depressum (+) | Asterionella formosa (+) | |||
| Chaetoceros decipiens (+) | Chaetoceros diadema (+) | |||
| Chaetoceros teres (+) | Cylindrotheca closterium (+) | |||
| Ceratium fusus (+) | Prorosira glacialis (+) | |||
| Gyrodinium fusiforme (−) | ||||
| Coscinodiscus granii (+) | ||||
| Paralia sulcata (+) | ||||
| Guinardia delicatula (+) | ||||
| Octobre | Protoperidinium sp. (+) | Leptocylindrus danicus (+) | ||
| Gyrodinium fusiforme (+) | Cyclotella sp. (+) | |||
| Prorocentrum micans (+) | Protoperidinium brevipes (+) | |||
| Gyrosigma fascicola (+) | Gyrodinium fusiforme (−) | |||
| Torodinium robustum (+) | Asterionellopsis glacialis (+) | |||
| Prorocentrum lima (+) | Pleurosigma strigosum (+) | |||
| Prorocentrum micans (+) | ||||
| Pleurosigma directum (+) | ||||
| Coscinodiscus granii (+) | ||||
| Dactyliosolen fragilissimus (+) | ||||
| Gyrosigma fasciolla (+) | ||||
| Cylindrotheca closterium (+) | ||||
| Chaetoceros mitra (+) | ||||
| Décembre | Dinophysis norvegica (+) | Gyrodinium formosum (+) | ||
| Protoperidinium sp. (+) | Thalassiosira gravida (+) | |||
| Prorocentrum micans (+) | Cerataulina pelagica (+) | |||
| Ceratium fusus (+) | Dactyliosolen fragilissimus (+) | |||
| Ceratium fusus (+) | ||||
| Chaetoceros decipiens (+) | ||||
| Ceratium lineatum (+) | ||||
| Nitzschia rectilonga (+) | ||||
| Leptocylindrus danicus (+) |
4 Discussion
4.1 Variation saisonnière du phytoplancton
Comme il a été déjà signalé par d'autres auteurs [6,37], les biomasses chlorophylliennes et carbonées du phytoplancton ont montré des variations significatives au cours de l'année 2004, avec des maxima estivaux (4–4,4 μg Chl a L−1 ; 1126–1721 μg C L−1 ; Tableau 2). Les fluctuations temporelles du phytoplancton seraient certainement régies par le changement saisonnier des facteurs physicochimiques du milieu [6,38,39]. En effet, les concentrations phytoplanctoniques ont été corrélées positivement avec la température de l'eau (, ) et la salinité (, ) et négativement avec la turbidité de l'eau (, ).
Les travaux antérieurs ont montré que la composition des communautés algales change dans le temps, en réponse aux variations saisonnières des conditions environnementales [24,40,41]. Au cours de cette étude, la communauté phytoplanctonique estivale a été caractérisée par une importante prolifération des diatomées qui ont contribué en août à hauteur de 48% à la biomasse totale des microalgues. Cependant, les dinoflagellés ont dominé pendant les autres périodes de l'année (Tableau 2). La prolifération estivale des diatomées a été signalée par des travaux antérieurs dans la lagune de Bizerte [6,24] et également dans d'autres écosystèmes côtiers méditerranéens, comme la baie de Tunis (côtes tunisiennes, [42]), les lagunes de Mar Menor (côtes espagnoles, [43]), d'Orbetello (côtes italiennes, [44]) ainsi que sur les côtes libanaises [45], égyptiennes [46] et catalanes [47]. L'augmentation de la température de l'eau, de la salinité et des teneurs en Si(OH)4 au cours de l'été (surtout en août, Tableau 1) pourrait contribuer à la prolifération estivale des diatomées, puisque des corrélations positives ont été observées entre ces variables abiotiques et la biomasse des diatomées (température : , ; salinité : , ; Si(OH)4 : , ). Plusieurs travaux ont effectivement montré que ces microalgues se développent tout particulièrement à de fortes températures et salinités [24,38] et que leur croissance augmente avec la disponibilité de Si [19,48,49].
Contrairement aux diatomées, les dinoflagellés ne sont pas toujours tributaires des conditions nutritives du milieu, étant donné qu'ils ont des comportements trophiques très diversifiés (autotrophie, hétérotrophie, mixotrophie) [50,51]. Les dinoflagellés sont aussi dotés des mouvements migratoires dans la colonne d'eau qui leur permettent d'éviter leurs prédateurs zooplanctoniques [52]. En outre, certains dinoflagellés peuvent sécréter des substances capables d'inhiber la croissance et de provoquer la lyse d'autres espèces phytoplanctoniques [53]. Ces caractéristiques des dinoflagellés contribuent probablement à leur dominance durant presque toute l'année dans notre site d'étude. D'une façon générale, il a été prouvé que le développement des dinoflagellés est plus favorisé que celui des autres groupes phytoplanctoniques dans les écosystèmes à faible turbulence, et à long temps de renouvellement des eaux, tels que les lagunes [51].
4.2 Limitations nutritives du phytoplancton au cours des différentes périodes de l'année
La limitation nutritive des producteurs primaires a été signalée dans plusieurs milieux méditerranéens. Plusieurs travaux ont reporté une limitation par le P en Méditerranée occidentale et orientale [23], alors que d'autres ont souligné que c'est plutôt le N (et non le P) qui est limitant dans certains secteurs orientaux de cette mer [54]. Une étude récente réalisée dans la lagune de Bizerte a montré que le N est l'élément limitant pour le phytoplancton en hiver, alors qu'en été le N et P co-limitent la croissance microalgale [6]. La présente étude a traité pour la première fois des effets des additions simultanées de N, P et Si.
Les résultats ont montré que le phytoplancton est limité par les nutriments N, P et Si pendant les différentes périodes de l'année. Les différents enrichissements nutritifs ont induit des augmentations des concentrations en Chl a (Fig. 2) et des biomasses finales du phytoplancton (Fig. 3) par rapport aux témoins. Les taux de croissance de plusieurs taxa observés après différentes fertilisations ont été significativement supérieurs à ceux déterminés dans les témoins (Tableaux 3 et 4). En plus, les producteurs primaires ont montré des degrés de limitation pour les trois nutriments au cours de l'année. Durant l'été (juin et août), le Si semble être plus limitant pour le phytoplancton que N et P. Effectivement, les traitements +Si/−NP (en août) et +NSi/−P (en juin) ont induit des augmentations de la Chl a plus prononcées que celles observées lorsque Si est déficient (traitements +P/−NSi et +NP/−Si) (Fig. 2B et E). La communauté initiale du phytoplancton de la lagune a été caractérisée par une intense prolifération estivale des diatomées (Fig. 3B et E). Ceci pourrait expliquer la forte réponse des microalgues à l'addition de Si (+NSi/−P ; +Si/−NP), qui est un élément indispensable à la structure et au métabolisme des diatomées. Durant les autres périodes de l'année (mars, octobre et décembre) le phytoplancton a présenté presque les mêmes degrés de limitation pour les trois éléments N, P et Si. Les concentrations en Chl a ont augmenté de la même manière dans les traitements suivants : +NSi/−P et +P/−NSi (Fig. 2A, C et D).
4.3 Limitations nutritives des différents groupes taxinomiques
Les groupes taxinomiques (diatomées, dinoflagellés et flagellés) ont montré diverses réponses aux enrichissements nutritifs, aboutissant à des changements importants des communautés de microalgues. Les résultats de l'analyse multivariée (MDS) ont effectivement montré que les compositions spécifiques finales du phytoplancton après les traitements +NSi/−P, +P/−NSi, +NP/−Si et +Si/−NP ont été nettement différentes de celles des témoins (Fig. 7). Des dissimilarités élevées ont été également observées entre chaque enrichissement nutritif et le témoin et entre les fertilisations (+NSi/−P, +P/−NSi, +NP/−Si et +Si/−NP) (Tableau 5).
Les diatomées ont fortement répondu à l'addition +NSi/−P durant les quatre périodes de l'année (mars, juin, octobre et décembre), puisque leur biomasse finale dans ce traitement a dépassé de loin (2–4 fois) celle du témoin (Fig. 3A, B, C et D). Ces microalgues qui n'ont contribué que pour 24–38% à la biomasse de la communauté initiale du phytoplancton (Tableau 2) sont devenues dominantes (52–61%) dans la communauté phytoplanctonique après 6 j de traitement +NSi/−P (Fig. 3A, B, C et D). Les biomasses finales des diatomées estimées dans le traitement +Si/−NP en août ont également fortement dépassé celles accusées dans les autres traitements (Fig. 3E). Outre les biomasses, les taux de croissance de la plupart des diatomées ont été stimulés par les fertilisations +NSi/−P et +Si/−NP durant presque toutes les expériences (Tableau 3). Ces résultats indiquent que N et Si sont limitants pour la majorité des diatomées rencontrées dans la lagune durant les différentes périodes de l'année. Cependant, les deux traitements n'ont pas la même importance dans le contrôle des diatomées. Une étude antérieure menée dans la lagune de Bizerte a signalé que la croissance des diatomées est régie par N durant l'été et l'hiver [6]. Nos résultats révèlent que c'est plutôt le Si qui a un rôle plus important dans le développement des diatomées. En effet, l'ajout de Si combiné avec N (traitement +NSi/−P) et même lorsque N est déficient (traitement +Si/−NP) a été suivi par une augmentation nette de la croissance de la plupart des taxa de diatomées. En revanche, la déficience en Si (traitement +NP/−Si) a entravé l'effet stimulateur de l'ajout de N sur la croissance de la majorité des diatomées, sauf celles des espèces de Chaetoceros (Tableau 3). De plus, la biomasse finale des diatomées après traitement +NP/−Si n'a pas été différente de celle du témoin, mais inférieure à celle observée après enrichissement +Si/−NP (Fig. 3E). Ces faits suggèrent que le Si est le principal élément qui limite la croissance des diatomées dans la lagune et que le N a un rôle moins intense dans le contrôle de ces microalgues. La disponibilité de Si est évidemment importante pour la croissance et le développement des diatomées [19,48,49] et pour soutenir la synthèse des nouveaux frustules au moment de la division cellulaire [20,55,56].
Une étude d'enrichissement menée dans la rade de Brest (France) a montré que, consécutivement à l'ajout de Si, la communauté printanière du phytoplancton initialement composée du nanophytoplancton est devenue dominée par les microalgues essentiellement constituée de diatomées [57]. D'autres travaux ont aussi indiqué que la fertilisation avec Si a induit une augmentation de la biomasse des diatomées plus prononcée que les enrichissements avec N et/ou P [19,58,59].
Quoique les additions +P/−NSi et +NP/−Si n'ont induit aucun effet significatif sur la biomasse totale des diatomées (Fig. 3), la croissance de certains taxa a été favorisée par ces traitements : c'est le cas de Chaetoceros, Guinardia, Gyrosigma, Nitzschia et Thalassiosira (Tableau 3). Cependant, la stimulation de la croissance de ces taxa a été observée seulement pendant une des cinq périodes de l'étude et a aussi été moins prononcée que celles induites par les traitements +NSi/−P et +Si/−NP (Tableau 3). Ceci suggère que, par périodes, le N et P pourraient être spécifiquement limitants pour la croissance de certaines espèces de diatomées. Des travaux de fertilisation dans des microcosmes, menés dans les eaux côtières eutrophes en Méditerranée, ont signalé que l'ajout de N et P a induit une importante augmentation de la biomasse des diatomées [23]. D'autres travaux d'enrichissement nutritif ont attesté que, dans le cas où le Si est déficient, la communauté du phytoplancton serait composée de chaînes de diatomées de petites tailles faiblement silicifiées, comme Chaetoceros, Skeletonema et Thlalassiosira [9,19,39]. Nos résultats ont indiqué que Skeletonema costatum est contrôlée surtout par P, puisque son taux de croissance (Tableau 3) et sa biomasse finale (Fig. 4B) ont fortement répondu au traitement +P/−NSi. Des expériences d'enrichissement in vitro ont rapporté effectivement que Skeletonema costatum est limité par le P [9].
Comme pour diatomées, les enrichissements nutritifs ont affecté la communauté des dinoflagellés, mais leur forte réponse a concerné l'élément P. La biomasse finale des dinoflagellés et les taux de croissance de plusieurs taxa ont été fortement stimulés par le traitement +P/−NSi et +NP/−Si durant presque toutes les périodes de l'année (Tableau 4, Fig. 3). Après six jours de ces traitements, les dinoflagellés ont contribué à plus de 70% de la biomasse totale du phytoplancton (Fig. 3). Ces résultats indiquent que le développement des dinoflagellés dans la lagune est fortement lié à la disponibilité du P. Les dinoflagellés sont caractérisés par un contenu cellulaire élevé en ADN et, par suite, ces organismes ont un fort besoin en l'élément P [60]. Ceci pourrait expliquer leur forte réponse aux additions de P (traitement +P/−NSi, +NP/−Si). Des travaux menés dans la lagune de Bizerte et d'autres régions méditerranéennes ont monté l'effet stimulateur des additions de P sur la croissance des dinoflagellés [6,61,62]. Il a été aussi signalé que la fertilisation avec NP dans des mésocosmes a été suivie d'une importante prolifération des dinoflagellés [59].
Les effets spécifiques des enrichissements nutritifs sur la croissance des taxa de diatomées et de dinoflagellés ont été suivis par un remaniement dans la communauté finale de ces microalgues (Figs. 4 et 5) et dans la composition spécifique du phytoplancton total (Fig. 7). Les différences significatives entre les traitements et les témoins ont principalement abouti à des changements des biomasses des espèces dominantes (Tableau 6). L'augmentation de la biomasse de plusieurs espèces de diatomées et de quelques espèces de dinoflagellés et la diminution d'autres au cours des expériences étaient responsables de la différence significative entre le traitement +NSi/−P et le témoin (Tableau 6). L'addition +Si/−NP réalisée en août a induit l'accroissement significatif de la biomasse de quelques espèces de diatomées par rapport au témoin, telles que Asterionella formosa, Chaetoceros decipiens, C. diadema, Coscinodiscus granii, Cylindrotheca closterium, Guinardia delicatula, Paralia sulcata et Prorosira glacialis (Tableau 6). La fertilisation +P/−NSi a stimulé l'augmentation de la biomasse de plusieurs genres de dinoflagellés par rapport au témoin durant les quatre périodes de l'année tel que Gymnodinium, Gyrodinium, Prorocentrum et Protoperidinium.
Pendant certaines périodes de l'année, le traitement +NSi/−P a favorisé le développement de quelques dinoflagellés, dont certains sont hétérotrophes, comme Ceratium, Gymnodinium, Gyrodinium et Protoperidinium (Tableau 4). Ceci peut être une réponse à l'augmentation de la biomasse de leurs proies potentielles, les diatomées [63].
Contrairement aux diatomées et aux dinoflagellés, la biomasse des flagellés a augmenté dans les traitements +NSi/−P et +P/−NSi seulement en mars et dans les traitements +NP/−Si et +Si/−NP en août (Fig. 3A et E). En outre, ce ne sont que certains groupes (Chlorophycées, Prasinophycées et Prymnésiophycées) qui ont répondu aux traitements en augmentant leur croissances. Toutefois, la composition finale des nanoflagellés dans les différentes fertilisations reste inchangée par rapport au témoin (Fig. 6). De plus, l'analyse SIMPER a montré que les flagellés n'ont pas contribué aux changements dans la composition taxinomique du phytoplancton entre chaque traitement et le témoin (Tableau 6).
5 Conclusion
Le présent travail montre que le phytoplancton dans la lagune de Bizerte est limité par les nutriments (N, P et Si) au cours des différents mois de l'année 2004. Les traitements nutritifs ont induit des augmentations significatives des concentrations chlorophylliennes et des biomasses finales du phytoplancton par rapport aux témoins. En outre, les producteurs primaires ont monté des degrés de limitation pour les nutriments au cours de l'année. Durant l'été (juin et août), le Si semble être plus limitant pour le phytoplancton que N et P. Le nutriment Si joue le rôle le plus important sur la croissance et le développement des diatomées, puisque l'enrichissement de +Si/−NP en août a induit une augmentation significative de la biomasse de plusieurs taxa (Asterionella formosa, Chaetoceros decipiens, C. diadema, Coscinodiscus granii, Cylindrotheca closterium, Guinardia delicatula, Paralia sulcata et Prorosira glacialis). Les biomasses et les taux de croissance des dinoflagellés ont été stimulé significativement par les traitements +P/−NSi et +NP/−Si durant presque toutes les périodes de l'année. Après 6 j de ces traitements, les dinoflagellés ont contribué à hauteur de plus de 70% de la biomasse totale du phytoplancton. En outre, l'enrichissement de +P/−NSi a favorisé la prolifération de plusieurs genres de dinoflagellés, tels que Gymnodinium, Gyrodinium, Prorocentrum et Protoperidinium. Ceci suggère que la dynamique des dinoflagellés est surtout contrôlée par le nutriment P. Contrairement aux diatomées et dinoflagellés, la biomasse et la croissance des flagellés n'ont été stimulées par certains traitements que pendant une période donnée.
Les augmentations des décharges nutritives d'origine anthropique, agricole et industrielle finissent par déséquilibrer le système planctonique de la lagune, puisque les nutriments N, P et Si peuvent affecter de différentes manières la dynamique du phytoplancton et induire des remaniements dans la composition des microalgues pendant différentes périodes de l'année.
Remerciements
Nous exprimons notre gratitude à M.E. Mahmoudi pour son aide en analyses statistiques et nous remercions un expert anonyme pour ses suggestions utiles.


