Abridged English version
The systematic of Lophogobius cyprinoides Gobiidae of the Manche-à-Eau lagoon has not been deeply studied up to this present work. From specimens sampled from January to April 2008, the following characters have been studied: meristic characters, sexual dimorphism, morpho-anatomic characters and head (HLS), trunk (TLS) and caudal (CLS) lateral system. The following diagnosis was established: number of fins rays D1: VI; D2: I+ 9; C: 21–22; A: I+ 8; P: 17–18; Pv: 10; number of scales in longitudinal serie Ec: 27–28; number of vertebras V: 26. The sexual dimorphism described for the first time using scanning electron microscopy (SEM) concerns the urogenital papilla and its extremity. Its shape is different according to sex: conic to male and cylindrical to female. The female's anatomical proportions are greater, except those calculated in head length. The male's crest is longer and the female's one a little higher. The HLS has been observed using SEM after 2% glutaraldehyde fixation in sea water: (1) the three anterior and posterior oculoscapular and preopercular canals and the mucous pores σ, λ, κ, ω, α, β, ρ, ρ1, ρ2, γ, δ, ɛ are present; the distribution and number of superficial neuromasts (sensory papillae or genipores) are original and demonstrated with photographic documents; (2) suborbital sensory papillae of HLS without horizontal row a; (3) 6 transversal rows; (4) rows 5 and 6 are cut by row b; (5) upper part of row 6 is sometimes absent; (6) rows o and n are separated by row g; (7) row h is placed at the crest end; (8) row la is diffuse between rows as and as’; (9) row tr above u is absent; (10) both series of neuromasts i and f are present under the lower jaw. The TLS is made up of 19 vertical rows ltm regularly spread along the trunk up to the caudal stalk and of 4 dorsal ld rows below the dorsal fins and one ventral w above the ano-urogenital papilla. The CLS is made of 3 caudal rows lc, lc’ and lc”. Genetic characterization was performed by polymerase chain reaction and the ribosomal 18S rDNA was sequenced. The coding sequences for 18S ribosomic DNA support the morphological observations obtained and allow phylogenic comparison between Caribbean and Atlantic-Mediterranean Gobiids.
1 Introduction
Parmi plus de 2000 espèces de la famille des Gobiidae répertoriées dans le monde [1], certaines ont été découvertes récemment [2], d’autres ont peu, ou pas, été l’objet d’une description systématique. Sans doute à cause de leur statut d’espèce sédentaire avec leurs grandes capacités adaptatives qui leur ont permis de réussir dans tous les types de milieux aquatiques, ces petits poissons sont souvent présents en grand nombre dans les écosystèmes lagunaires, mais souvent représentés par peu d’espèces. Dans la Mer des Caraïbes en Guadeloupe, Bathygobius soporator (Valenciennes, 1837), Gobionellus oceanicus (Pallas, 1770), Gobionellus shufeldti (Jordan & Eigenmann, 1887), Gobionellus smaragdus (Valenciennes, 1837) validé Ctenogobius, Gobionellus sp. et Lophogobius cyprinoides (Pallas, 1770) ont été inventoriés dans plusieurs lagunes à mangrove [3]. Cependant leur biologie reste méconnue ou leur systématique esquivée. C’est le cas du gobie à crête L. cyprinoides (Fig. 1). En effet, les recherches effectuées jusqu’à présent sur la systématique de cette espèce concernent les travaux effectués dans l’océan Atlantique et le Pacifique [4] dans une étude comparative avec Lophogobius cristulatus (Ginsburg, 1939). Les caractères méristiques ont été étudiés au Vénézuela [5,6].

Le gobie à crête Lophogobius cyprinoides (Pallas, 1770) ; LT = 45 mm.
Dans le présent travail, nous proposons d’étudier la systématique du gobie à crête L. cyprinoides (Pallas, 1770), en vue de l’étude ultérieure de sa biologie en relation avec les stratégies adaptatives qu’il est susceptible de déployer. Les objectifs sont donc centrés sur :
- • la systématique des caractères méristiques aux niveaux des rayons des nageoires paires et impaires, des nombres d’écailles sur la ligne latérale et de vertèbres, et la caractérisation du dimorphisme sexuel ;
- • la mesure des distances et le calcul des proportions morpho-anatomiques ;
- • la caractérisation du système latéral céphalique (SLC), troncal (SLT) et caudal (SLQ) suivant la distribution des canaux et des pores muqueux ou gros pores, et des neuromastes (papilles sensorielles ou génipores) ;
- • la caractérisation génétique par amplification polymerase chain reaction (PCR) et le séquençage des séquences codantes de la sous-unité ribosomale 18S.
1.1 Présentation de l’espèce
Parmi les petits poissons Téléostéens appartenant à la famille des Gobiidae, le genre Lophogobius est représenté par trois espèces : bleekeri (Popta, 1921), cristulatus (Ginsburg, 1939) et cyprinoides (Pallas, 1770). Celles-ci se répartissent respectivement sur les côtes ouest du Pacifique en Malaisie [7] et en Nouvelle Guinée [8], est du Pacifique Central [9], et en Atlantique ouest des Bermudes (Floride) à la côte nord de l’Amérique du sud [10,11] en passant par les Antilles. De longueur totale (LT) maximale de 100 mm [4], L. cyprinoides a pour caractéristique principale une crête dermique s’étendant de la région interorbitaire à l’origine de la nageoire dorsale. Les écailles, cténoïdes et cycloïdes, relativement grandes, couvrent tout le corps à l’exception de la partie antérieure supérieure de la tête longeant le pied de la partie antérieure de la crête ; celles couvrant la poitrine et la zone pectorale sont cycloïdes. Les deux mâchoires sont formées d’une bande épaisse de dents villiformes et d’une ligne externe un peu plus grande, fine et pointue [4]. De manière générale, la soudure des deux nageoires pelviennes forme le disque pelvien ventral qui a une fonction limitée de ventouse et de locomotion. Le système latéral (SL) des Gobiidae est utilisé pour la détermination des espèces appartenant à cette famille. Il s’agit des éléments du SLC constitués des canaux sensoriels muqueux débouchant à l’extérieur par des pores muqueux ou gros pores, et de neuromastes superficiels appelés initialement papilles ou génipores [12], alignés en séries. Seuls les neuromastes superficiels sont présents sur le SLT et SLQ.
L’importance économique de ce poisson est négligeable. Sur l’ensemble de son aire de répartition, cette espèce ne fait pas l’objet de pêches commerciales, mais localement elle peut être capturée dans les pêches ciblant d’autres espèces ou à des fins de recherche. Malgré les pressions environnementales, cette espèce ne figure pas sur la liste rouge des espèces menacées [13].
1.2 Présentation du site de prélèvement
Les échantillons proviennent de la lagune de la Manche-à-Eau, située au nord-est de l’île de la Basse-Terre en Guadeloupe dont les coordonnées géographiques sont 16° 16′ 36″ de latitude Nord et 61° 33′ 24″ de longitude Ouest. Elle est affluente à la Rivière-Salée, via un chenal lagunaire de plus de 1500 m qui sépare les deux principales îles de la Guadeloupe : la Basse-Terre et la Grande Terre. Elle a une morphologie allongée et est de dimensions réduites : 910 m de longueur, 425 m de largeur, 26 × 103 m2 de surface et entre 1,5 et 2,0 m de profondeur [14]. Cette lagune d’eau saumâtre n’est drainée que par une petite ravine et par percolation. En dehors des évènements paroxysmiques majeurs de type cyclonique, les variations saisonnières faibles des paramètres physicochimiques [14] n’influencent pas la zonation biologique [15].
La lagune est entièrement encerclée par la mangrove avec pour végétation le palétuvier rouge Rhizophora mangle Linné, 1753, suivi plus en arrière du palétuvier noir Avicennia germinans Linné, 1753 et du palétuvier blanc Laguncularia racemosa Linné, 1753. Les fonds sédimentaires sont caractérisés par de la vase, du sable (substrats rocheux quasiment absents) sur lesquels reposent de nombreux débris végétaux (branches, troncs, feuilles). Le dernier inventaire ichtyofaunistique fait état en 2002 de 34 espèces appartenant à 23 familles [15], dont les Clupeidae, Engraulidae, Gerreidae, Scianidae et Sparidae en représentent 98 %.
2 Matériels et méthodes
2.1 Échantillonnage et traitement au laboratoire
Les échantillonnages ont été pratiqués au moyen de casiers remplis de palmes de cocotier déposés sous environ 1,40 m d’eau à deux stations au niveau de la lagune. Cette méthode a permis de capturer des individus benthiques de tailles différentes aux mœurs sédentaires. Aussitôt après leur capture, ceux-ci ont été euthanasiés par le froid.
Les individus pêchés au casier de février à juin 2008 ont été sexés d’après l’observation de la forme de la papille urogénitale développée ou en développement, généralement conique chez les mâles et cylindrique chez les femelles Gobiidae [16], puis on a mesuré la longueur totale (LT) allant du bout du museau à l’extrémité de la caudale au millimètre inférieur à l’aide d’un ichtyomètre, et pesé la masse totale (MT) au centième de gramme à l’aide d’une balance électronique Metler P 1210. Ensuite, selon la destination de l’étude, les sous-échantillons ont été pour une partie, refrigérés, et pour l’autre, fixés soit à la glutaraldéhyde à 2 % en eau de mer, soit dans du formol à 5 % en eau douce.
2.2 Caractères méristiques
Sur différents individus, on a compté les nombres de rayons présents sur les nageoires dorsales (D1 et D2), caudale (C), anale (A), pectorale (P), du disque pelvien (dp), ceux des rayons branchus et segmentés simples (dorsaux et ventraux) de la nageoire caudale, ainsi que le nombre d’écailles (Éc) sur la ligne latérale allant de l’origine supérieure de la nageoire pelvienne jusqu’au milieu de la base de la nageoire caudale. Le nombre de vertèbres (V), de l’occipital non compris à l’urostyle, inclus a été compté après le traitement suivant : dissection sur chaque individu des sous-échantillons frais, et séchage à l’étuve pendant 24 h à 30 °C. On a vérifié l’existence ou non d’un dimorphisme sexuel avec l’ocelle jaune et noire (Fig. 1) présente sur la première nageoire dorsale sous loupe binoculaire, et avec la papille urogénitale par l’observation au microscope électronique à balayage (MEB).
2.3 Distances et proportions morpho-anatomiques
Pour caractériser morpho-anatomiquement cette espèce de Gobiidae, sous loupe binoculaire avec un pied à coulisse précis à 0,02 mm, on a mesuré sur un lot d’individus de taille et de sexe différents, les distances morpho-anatomiques [17] en ajoutant les distances relatives à la crête (Tableau 1 ; Fig. 2). Ensuite les distances ont été ramenées en proportions corporelles d’unités de longueurs : standard (LS), de pédoncule caudale (pc), de la tête (Lt), de diamètre de l’œil (Œ) et de disque pelvien-anus (dp-a) [17].
Codification des distances morpho-anatomiques mesurées sur L. cyprinoides.
| Distances mesurées | Distances mesurées | Distances mesurées |
| Longueur totale (LT) | Longueur de la crête (Lc) | Hauteur du corps au disque pelvien (Hdp) |
| Longueur standard (LS) | Hauteur de la crête (Hc) | Hauteur du corps à l’anale (HA) |
| Longueur de la tête (Lt) | Museau – origine de la crête (M-co) | Largeur du corps à l’anale (lA) |
| Largeur de la tête (lt) | Museau – fin de la crête (M-cf) | Hauteur du pédoncule caudal (Hpc) |
| Museau – dorsale 1 (M-D1) | Longueur de la dorsale 1 (LD1) | Disque pelvien – anus (dp-an) |
| Museau – dorsale 2 (M-D2) | Longueur de la dorsale 2 (LD2) | Longueur du museau (LM) |
| Museau – anus (M-an) | Longueur de l’anale (LA) | Diamètre de l’œil (Œ) |
| Museau – anale (M-A) | Longueur de la caudale (LC) | Longueur post-orbitale (Lpo) |
| Museau – disque pelvien (M-dp) | Longueur de la pectorale (LP) | Hauteur de la joue (Hj) |
| Longueur du pédoncule caudal (Lpc) | Longueur du disque pelvien (Ldp) | Distance interorbitale (I) |
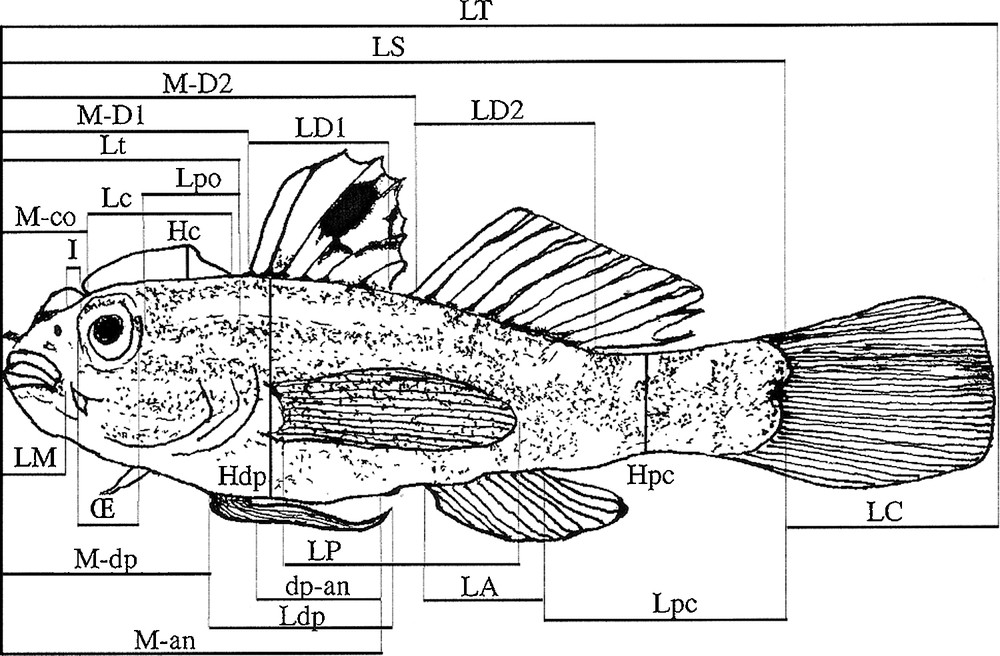
Exemple de quelques distances morpho-anatomiques mesurées sur L. cyprinoides (voir codification sur le Tableau 1).
2.4 Caractérisation du système latéral céphalique, troncal et caudal
Pour dénommer le SL, nous avons adopté la terminologie de Sanzo [18] modifiée par Miller [19]. Pour l’observation du SLC, en utilisant le MEB, on a prélevé la tête sur des individus frais de taille et de sexe différents, en la coupant au scalpel après le début de la première nageoire dorsale et de la pectorale. Pour l’observation au MEB du SLT et SLQ, on a utilisé des petits individus entiers. Les échantillons sont préparés selon la méthode décrite par Bouchereau et Gros [20]. Seule l’orientation des séries de neuromastes a été observée, et non celle des neuromastes eux-mêmes. Toutes les observations ont été faites en double lecture toujours sur le côté gauche de l’individu.
2.5 Prélèvements d’autres espèces de Gobiidae
Pour les analyses phylogénétiques, on a prélevé des individus de plusieurs espèces de Gobiidae provenant de milieux d’eau douce de la Caraïbe : Awaous banana (Valenciennes, 1837) capturé le 16 avril 2008 à la pêche électrique dans la rivière de la Lézarde (Guadeloupe), ou d’eau saumâtre de Méditerranée comme Pomatoschistus microps (Krøyer, 1838), Pomatoschistus minutus (Pallas, 1770) et Gobius niger Linneaus, 1758, capturés le 29 août 2008 à la capéchade dans la lagune de Mauguio (Languedoc).
2.6 Analyses génétiques
Les extractions d’ADN ont été réalisées avec le kit DNeasy Blood & Tissue Kit® de Qiagen (Cat. No. 69504) en suivant le protocole du fabricant. Les séquences de l’ADNr 18S des Gobiidae étudiées ont été amplifiées par PCR (polymerase chain reaction) à l’aide du kit GoTaq® Flexi DNA Polymerase kit produit par Promega (Cat. No M8306) et du couple d’amorces 1F (5′-TACCTGGTTGATCCTGCCAGTAG-3′) et BIR (5′-GAGTCTCGTTCGTTATCGGA-3′) [21]. Les 25 μL du milieu réactionnel étaient constitués de 11,7 μL d’H2O, 5 μL 5X buffer, 2 μL 2,5 mM dNTP (Promega), 2 μL 25 mM MgCl2, 0,3 μL Taq polymerase (5U/μL), 1 μL 10 μM amorce 1F, et 1 μL 10 μM amorce BIR. Les réactions PCR ont été réalisées avec un appareil GeneAmp® PCR system 2700 de Applied Biosystems, selon le programme suivant : 3 min 94 °C de dénaturation initiale, puis 10 cycles touchdown de 30 s à 94 °C ; 65 °C à 52 °C pendant 30 s, et 1 min à 72 °C, puis 25 cycles 94 °C pendant 30 s, 30 s à 52 °C, et 1 min à 72 °C, une étape d’élongation finale a été réalisée pendant 5 min à 72 °C. Les amplifias PCR ont été séquencés directement par GATC Biotech (http://www.gatc-biotech.com).
Les séquences de l’ADNr 18S (1200 nt) ont été alignées à l’aide du logiciel Clustal X [22] et les alignements ont été vérifiés manuellement. Les relations phylogéniques ont été estimées par la méthode maximum likelihood (ML) et la méthode probabiliste bayésienne (Bayesian). Les analyses ont été réalisées à l’aide des logiciels PhyML [23] et MrBayes [24] et optimisées avec le modèle d’évolution GTR (general time reversible) incluant une correction Γ. La robustesse des nœuds a été testée avec 1000 bootstraps réplicats pour l’arbre ML, et les probabilités a posteriori pour les analyses bayésiennes ont été testées par 4 chaînes Markov, dont chaque chaîne a été soumise à 1 000 000 générations.
2.7 Numéro d’accession des séquences nucléotidiques
Les séquences obtenues au cours de cette étude ont été déposées dans la base de données EMBL sous les numéros d’accessions FN252247 (P. microps), FN252248 (P. minutus), FN252249 (G. niger), FN252250 (A. banana) et FN252251 (L. cyprinoides).
3 Résultats
3.1 Relations longueur totale–longueur standard, masse totale–longueur totale
Les relations (Tableau 2) entre longueur totale LT (mm) et longueur standard LS (mm) sont de type linéaire LT = a × LS + b, et entre la masse totale MT (g) et la longueur totale LT (mm) de type puissance MT = a × LTb.
Tableau comparatif des valeurs (en gras) des paramètres a et b des relations longueurs standard (LS) – totale (LT), et masse (MT) – longueur (LT) pour l’ensemble de l’échantillon de L. cyprinoides et pour trois espèces de gobiidés atlanto-méditerranéens.
| Relation | a | b | n | r 2 | ≤ LS (mm) ≤ | ≤ LT (mm) ≤ | ≤ MT (g) ≤ |
| LT = a.LS + b | 1,235 | −0,593 | 533 | 0,984 | 15–62 | 18–78 | - |
| G. niger [25] | 1,305 | −1,391 | 250 | 0,994 | 42–104 | 54–136 | - |
| P. minutus [26] | 1,181 | −0,158 | 807 | 0,994 | 22–64 | 24–76 | - |
| P. microps [27] | 1,193 | −0,489 | 85 | 0,995 | - | 19–53 | - |
| MT = a.LTb | 1,412 × 10−5 | 2,994 | 666 | 0,968 | - | 18–78 | 1,08–4,45 |
| G. niger m [28] | 4,137 × 10−6 | 3,267 | 143 | 0,995 | - | 37–120 | 0,52–27,15 |
| G. niger f [28] | 3,958 × 10−6 | 3,278 | 114 | 0,993 | - | 42–102 | 0,83–14,62 |
| P. minutus [25] | 1,448 × 10−6 | 3,438 | 4462 | 0,995 | - | 25–83 | 0,14–5,74 |
| P. microps m [28] | 7,446 × 10−6 | 3,088 | 94 | 0,963 | - | 27–43 | 0,20–0,98 |
| P. microps f [28] | 7,366 × 10−6 | 3,099 | 62 | 0,971 | - | 28–43 | 0,24–0,76 |
3.2 Diagnose
Le comptage du nombre de rayons des nageoires dorsales D1 et D2, caudale C, anale A, pectorale P et pelvienne Pv, du nombre d’écailles Ec sur la ligne latérale, de vertèbres (Tableau 3) et celui de rayons branchus et des rayons segmentés simples (dorsaux et ventraux) de la nageoire caudale sur quatre individus dont trois mâles et une femelle (Tableau 4) a été effectué sur dix individus. Quel que soit le sexe, L. cyprinoides présente 26 vertèbres (32 < LT (mm) < 61, pour 5 individus de chaque sexe).
Les différents caractères méristiques comptés sur L. cyprinoides.
| Sexe | M1 | M2 | M3 | M4 | M5 | M6 | F1 | F2 | F3 | F4 | min–max | moy | ét |
| LT | 47 | 50 | 40 | 61 | 50 | 50 | 35 | 37 | 33 | 37 | 33–61 | 44,00 | 8,96 |
| LS | 38,12 | 40,08 | 32,08 | 50,42 | 38,08 | 38,38 | 26,94 | 30,08 | 28,08 | 28,42 | 26,94–50,42 | 35,07 | 7,33 |
| D1 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6–6 | 6 | 0 |
| D2 | I + 10 | I + 9 | I + 9 | I + 10 | I + 10 | I + 10 | I + 9 | I + 9 | I + 9 | I + 9 | 9–10 | 9,4 | 0,52 |
| C | 22 | 20 | 20 | 25 | 26 | 24 | 20 | 20 | 20 | 21 | 20–26 | 21,8 | 2,53 |
| A | I + 9 | I + 8 | I + 9 | I + 7 | I + 7 | I + 7 | I + 8 | I + 8 | I + 8 | I + 7 | 7–9 | 7,8 | 0,79 |
| P | 18 | 18 | 17 | 18 | 17 | 18 | 17 | 19 | 17 | 18 | 17–19 | 17,7 | 0,67 |
| Pv | 11 | 10 | 10 | 10 | 10 | 10 | 11 | 11 | 10 | 10 | 10–11 | 10,3 | 0,48 |
| Éc | 28 | 28 | 27 | 28 | 28 | 28 | 28 | 28 | 27 | 27 | 27–28 | 27,7 | 0,48 |
Nombre de rayons branchus (B) et segmentés simples dorsaux (D) et ventraux (V) de la nageoire caudale de L. cyprinoides.
| [4] | Présent travail | |||||
| D + B + V | Nombre | LS moy | Sexe | LT | D + B + V | Total |
| 5 + 9 + 3 | 1 | 9,6 | Femelle | 37 | 3 + 13 + 5 | 21 |
| 3 + 11 + 3 | 1 | 10,2 | Femelle | 39 | 4 + 14 + 4 | 22 |
| 3 + 12 + 2 | 14 | 13,1 | Femelle | 44 | 4 + 14 + 4 | 22 |
| 3 + 13 + 1 | 1 | 15,5 | Femelle | 45 | 5 + 14 + 3 | 22 |
| 2 + 13 + 2 | 28 | 18 | Mâle | 50 | 5 + 14 + 5 | 24 |
| 2 + 14 + 1 | 105 | 33,33 | Mâle | 50 | 5 + 14 + 7 | 26 |
| 2 + 15 + 0 | 1 | 48,4 | Mâle | 55 | 6 + 14 + 4 | 26 |
| 1 + 15 + 1 | 6 | 55,8 | Mâle | 57 | 6 + 15 + 6 | 27 |
| 1 + 14 + 2 | 1 | 71,4 | Mâle | 59 | 5 + 15 + 4 | 24 |
| - | - | - | Mâle | 61 | 6 + 14 + 5 | 25 |
| - | - | - | Mâle | 66 | 6 + 14 + 6 | 26 |
3.3 Dimorphisme sexuel
Nous avons observé à la loupe binoculaire plus de 1000 individus des deux sexes depuis 2005. La forme de la papille urogénitale chez L. cyprinoides a été caractérisée suite aux observations faites au MEB. Chez la femelle, elle a une forme de cylindre (Fig. 3A) avec dans la partie distale, l’orifice urogénital entouré par les deux dispositifs morpho-anatomiques (Fig. 3B) suivants : (1) deux languettes, l’une ventrale (inférieure ou externe) courte et l’autre dorsale (supérieure ou interne) relativement plus longue disposée symétriquement de part et d’autre de l’orifice urogénital ; (2) deux lobes latéraux droit et gauche, chacun formé d’un mamelon porteur de sept à 10 digitations (Fig. 3B) qui forment une demi-couronne séparée par les deux languettes dorsale et ventrale. Chez les mâles, ces dispositifs sont totalement absents. La papille, cylindrique au départ du tronc, se termine par un cône du côté du pore urogénital, de taille plus réduite, qui est entouré d’une bordure lisse (Fig. 3C, D). D’autre part, l’ocelle présente sur 91 (24 mâles ; 67 femelles) des 114 individus (36 mâles ; 78 femelles) observés tous sexes confondus en mars et avril 2008, ne peut donc être considérée comme un critère du dimorphisme sexuel.
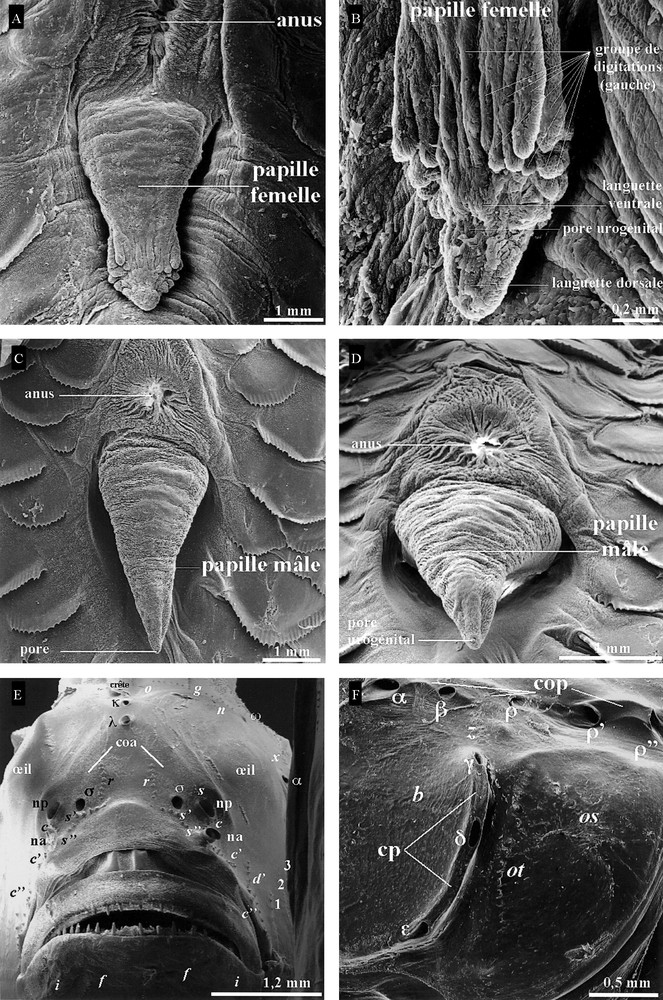
Vues ventrales, observées au microscope électronique à balayage, des papilles urogénitales de L. cyprinoides. A, B. Femelle. C, D. Mâle. E. Vue de face (G × 25) de la distribution des séries c, c’, c”, d’, f, i, g, n, o, r, s, s’, s”, 1, 2, 3 de neuromastes superficiels et de celle des pores muqueux dans les canaux oculoscapulaire antérieur (coa) κ, λ du système latéral céphalique de L. cyprinoides observé au microscope électronique à balayage. F. Vue de profil (G × 30) de la distribution des pores muqueux dans les canaux oculoscapulaire postérieur (cop) : ω, α, β, ρ, ρ’, ρ” et préoperculaire (cp) : γ, δ, ɛ, et narines antérieures (na) et postérieures (np) ; G : grossissement.
3.4 Caractères morpho-anatomiques
Les mesures des distances morpho-anatomiques (Tableau 5) ont été entreprises sur 10 individus dont 6 mâles et 4 femelles et ramenées en proportions d’unités de longueur selon le sexe (Tableau 6) et tous sexes confondus (Tableau 7). Ramenées en LS, 17 proportions calculées chez les mâles sont supérieures à celles des femelles, soit 74 %, et converties en Lt on observe 71 % en faveur des mâles. Les mâles sont relativement plus trapus que les femelles.
Distances morpho-anatomiques mesurées (à 0,02 mm) sur L. cyprinoides selon le sexe (voir codification dans le Tableau 1).
| Sexe | M1 | M2 | M3 | M4 | M5 | M6 | min–max | F1 | F2 | F3 | F4 | min–max |
| LT | 40 | 47 | 50 | 50 | 50 | 61 | 40–61 | 33 | 35 | 37 | 37 | 33–37 |
| LS | 32,08 | 38,1 | 40,08 | 38,4 | 38,08 | 50,42 | 32,08–50,42 | 26,94 | 28,4 | 30,08 | 28,42 | 26,94–30,08 |
| Lt | 10,96 | 11,20 | 14,08 | 12,42 | 12,88 | 15,08 | 10,96–15,08 | 7,76 | 9,28 | 10,24 | 8,42 | 7,76–10,24 |
| lt | 7,68 | 9,60 | 10,40 | 8,82 | 8,50 | 11,10 | 7,68–11,10 | 6,40 | 6,80 | 6,96 | 5,22 | 5,22–6,96 |
| M-D1 | 12,24 | 15,76 | 16,48 | 15,18 | 14,68 | 17,58 | 12,24–17,58 | 10,24 | 10,10 | 11,28 | 10,68 | 10,10–11,28 |
| M-D2 | 16,56 | 22,56 | 22,80 | 23,62 | 23,40 | 26,54 | 16,56–26,54 | 15,52 | 15,68 | 15,84 | 17,72 | 15,52–17,72 |
| M-an | 17,44 | 18,08 | 19,76 | 21,08 | 20,48 | 25,10 | 17,44–25,10 | 13,68 | 15,68 | 16,64 | 14,00 | 13,68–16,64 |
| M-A | 18,48 | 18,96 | 20,08 | 24,10 | 23,10 | 27,74 | 18,48–27,74 | 14,32 | 16,24 | 17,84 | 18,00 | 14,32–18,00 |
| M-dp | 10,96 | 11,60 | 12,72 | 14,34 | 13,80 | 17,12 | 10,96–17,12 | 9,28 | 9,60 | 10,00 | 12,88 | 9,28–12,88 |
| Lpc | 7,84 | 9,44 | 10,96 | 7,92 | 7,08 | 8,60 | 7,08–10,96 | 5,84 | 6,24 | 6,96 | 4,20 | 4,20–6,96 |
| Lc | 5,68 | 6,96 | 8,16 | 8,78 | 8,78 | 9,20 | 5,68–9,20 | 4,48 | 5,04 | 5,04 | 5,00 | 4,48–5,04 |
| Hc | 1,36 | 1,52 | 1,52 | 1,78 | 2,10 | 2,12 | 1,36–2,12 | 1,12 | 1,28 | 1,36 | 1,52 | 1,12–1,52 |
| M-co | 5,36 | 6,40 | 7,44 | 6,08 | 5,28 | 7,18 | 5,28–7,44 | 3,76 | 4,24 | 4,48 | 4,58 | 3,76–4,58 |
| M-cf | 9,68 | 13,36 | 15,60 | 12,06 | 12,00 | 13,42 | 9,68–15,60 | 15,44 | 9,28 | 9,52 | 10,08 | 9,28–15,44 |
| LD1 | 5,36 | 5,12 | 5,20 | 7,34 | 6,18 | 9,78 | 5,12–9,78 | 4,16 | 4,32 | 4,64 | 4,58 | 4,16–4,64 |
| LD2 | 6,00 | 5,44 | 5,44 | 9,40 | 8,86 | 11,74 | 5,44–11,74 | 4,88 | 4,88 | 5,28 | 5,44 | 4,88–5,44 |
| LA | 5,52 | 4,80 | 6,56 | 8,10 | 6,18 | 19,30 | 4,80–19,30 | 4,00 | 4,63 | 4,64 | 3,78 | 3,78–4,64 |
| LC | 7,52 | 9,60 | 10,00 | 11,20 | 10,10 | 10,18 | 7,52–11,2 | 5,76 | 7,36 | 6,56 | 6,28 | 5,76–7,36 |
| LP | 8,32 | 7,76 | 8,48 | 11,16 | 10,88 | 11,56 | 7,76–11,56 | 6,40 | 6,96 | 7,20 | 7,34 | 6,40–7,34 |
| Ldp | 7,44 | 6,56 | 8,64 | 9,34 | 9,14 | 9,46 | 6,56–9,46 | 6,40 | 6,40 | 6,48 | 6,24 | 6,24–6,48 |
| Hdp | 8,08 | 9,20 | 9,44 | 9,80 | 9,96 | 12,60 | 8,08–12,60 | 5,76 | 6,78 | 7,20 | 7,16 | 5,76–7,20 |
| HA | 7,60 | 7,84 | 7,84 | 8,62 | 8,50 | 11,48 | 7,60–11,48 | 4,24 | 5,76 | 6,48 | 6,00 | 4,24–6,48 |
| lA | 8,32 | 9,04 | 8,80 | 8,48 | 9,00 | 10,68 | 8,32–10,68 | 4,80 | 6,40 | 7,20 | 5,08 | 4,80–7,20 |
| Hpc | 4,88 | 4,40 | 5,04 | 4,08 | 4,22 | 6,16 | 4,08–6,16 | 3,04 | 3,60 | 3,38 | 3,18 | 3,04–3,60 |
| dp-an | 6,24 | 6,16 | 6,16 | 7,58 | 7,42 | 9,20 | 6,16–9,20 | 4,80 | 4,96 | 5,20 | 4,76 | 4,76–5,20 |
| LM | 2,08 | 2,08 | 2,16 | 2,68 | 2,28 | 3,48 | 2,08–3,48 | 1,52 | 1,60 | 1,84 | 1,62 | 1,52–1,84 |
| Œ | 2,56 | 1,92 | 2,56 | 3,32 | 3,20 | 3,42 | 1,92–3,42 | 1,52 | 1,60 | 1,68 | 2,48 | 1,52–2,48 |
| Lpo | 6,96 | 6,08 | 6,88 | 3,52 | 3,36 | 4,18 | 3,36–6,96 | 3,84 | 4,56 | 6,00 | 2,74 | 2,74–6,00 |
| Hj | 5,68 | 6,24 | 6,80 | 7,44 | 7,18 | 9,78 | 5,68–9,78 | 4,56 | 4,00 | 5,60 | 4,38 | 4,00–5,60 |
| I | 3,60 | 3,04 | 3,60 | 3,84 | 3,06 | 3,42 | 3,04–3,84 | 1,60 | 2,48 | 2,56 | 2,88 | 1,60–2,88 |
Comparaison des moyennes des proportions morpho-anatomiques. Voir codification dans le Tableau 1 mésurées sur L. cyprinoides selon le sexe.
| Auteur | Présent travail | [4] | |||||||||
| Sexe | Mâles (Manche-à-Eau) | Femelles (Manche-à-Eau) | Vénézuela | Mâles (A et P) | Femelles (A et P) | ||||||
| Effectif | 6 | 4 | 1 | 13 | 14 | ||||||
| Min-max | Moy. | Ét | Min–max | Moy. | Ét | Cerv. | Min–max | Moy. | Min–max | Moy. | |
| En LS | f | ||||||||||
| LS | 32,08–50,42 | 39,52 | 6 | 26,94–30,08 | 28,46 | 1,28 | 79,0 | 21,6–81,5 | 43,9 | 24,6–54,2 | 35,9 |
| Lt | 29,38–35,13 | 32,46 | 2,36 | 28,80–34,04 | 31,29 | 2,48 | 22,78 | 30,5–34,4 | 32,6 | 31,2–33,8 | 32,6 |
| lt | 22,02–25,95 | 23,73 | 1,59 | 18,37–23,94 | 22,30 | 2,65 | − | − | − | − | − |
| M-D1 | 34,87–41,34 | 38,93 | 2,38 | 35,56–38,01 | 37,16 | 1,09 | 28,53 | 31,9–36,1 | 34,4 | 33,2–35,9 | 34,5 |
| M-D2 | 51,62–61,54 | 57,22 | 4,31 | 52,66–62,35 | 56,96 | 4,12 | 54,13 | − | − | − | − |
| M-an | 47,43–54,92 | 51,59 | 3,14 | 49,26–55,32 | 52,64 | 3,09 | 54,85 | − | − | − | − |
| M-A | 49,74–62,79 | 55,98 | 5,39 | 53,16–63,34 | 58,25 | 4,25 | 55,70 | 56,5–62,1 | 58,5 | 56,5–59,9 | 58,3 |
| M-dp | 30,43–37,36 | 33,98 | 2,62 | 33,24–45,32 | 36,70 | 5,77 | 37,43 | − | − | − | − |
| Lpc | 17,06–27,35 | 22,14 | 4 | 14,78–23,14 | 20,39 | 3,79 | 18,84 | − | − | − | − |
| Lc | 17,71–23,06 | 20,08 | 2,41 | 16,63–17,75 | 17,18 | 0,57 | 14,24 | − | − | − | − |
| Hc | 3,79–5,51 | 4,39 | 0,62 | 4,15–5,35 | 4,63 | 0,51 | 2,73 | − | − | − | − |
| M-co | 13,87–18,56 | 16,00 | 1,75 | 13,96–16,12 | 14,97 | 0,88 | 11,52 | − | − | − | − |
| M-cf | 26,62–38,92 | 32,28 | 4,23 | 31,65–57,31 | 39,28 | 12,10 | 23,33 | − | − | − | − |
| LD1 | 12,97–19,40 | 16,31 | 2,72 | 15,21–16,12 | 15,55 | 0,39 | 21,24 | − | − | − | − |
| LD2 | 13,57–24,49 | 19,59 | 4,83 | 17,18–19,14 | 18,00 | 0,85 | 22,18 | − | − | − | − |
| LA | 12,59–38,28 | 20,29 | 9,22 | 13,30–16,30 | 14,97 | 1,26 | 20,65 | − | − | − | − |
| LC | 20,19–29,18 | 24,91 | 3,01 | 21,38–25,92 | 22,80 | 2,10 | 27,63 | 26,8–35,2 | 31 | 27,4–33,2 | 30,1 |
| LP | 20,36–29,08 | 24,67 | 3,75 | 23,76–25,83 | 24,51 | 0,94 | 25,76 | 28,8–35,4 | 31,6 | 29,6–34,5 | 31,9 |
| Ldp | 17,21–24,34 | 21,51 | 2,94 | 21,54–23,76 | 22,45 | 0,96 | 15,29 | 24,0–27,4 | 25,7 | 24,8–26,8 | 25,8 |
| Hdp | 23,55–26,16 | 24,92 | 0,95 | 21,38–25,19 | 23,60 | 1,60 | 27,48 | − | − | − | − |
| HA | 19,56–23,69 | 21,89 | 1,53 | 15,74–21,54 | 19,67 | 2,67 | 25,72 | 23,0–32,4 | 25,9 | 24,2–27,9 | 25,8 |
| lA | 21,18–25,94 | 23,08 | 1,71 | 17,82–23,94 | 20,54 | 3,16 | − | − | − | − | − |
| Hpc | 10,63–15,21 | 12,21 | 1,63 | 11,19–12,68 | 11,60 | 0,72 | 15,13 | 13,0–18,9 | 14,7 | 12,3–15,2 | 14,1 |
| dp-an | 15,37–19,75 | 18,077 | 1,88 | 16,75–17,82 | 17,33 | 0,45 | 18,66 | − | − | − | − |
| En Lpc | |||||||||||
| Hpc | 45,99–71,63 | 55,41 | 9,64 | 48,56–75,71 | 58,51 | 12,10 | 80,31 | − | − | − | − |
| En Lt | |||||||||||
| LM | 15,34–23,08 | 19,20 | 2,77 | 17,24–19,59 | 18,51 | 1,09 | 25,72 | 18,7–27,1 | 24,3 | 20,2–26,0 | 22,9 |
| Œ | 17,14–26,73 | 22,15 | 3,76 | 16,41–29,45 | 20,67 | 6,01 | 36,11 | 17,8–30,7 | 25 | 22,5–29,1 | 25,8 |
| Lpo | 26,09–63,50 | 41,46 | 16,1 | 32,54–58,59 | 47,44 | 10,9 | 47,33 | 49,0–52,3 | 50,7 | 49,6–52,8 | 51,1 |
| Hj | 48,30–64,85 | 56,05 | 5,84 | 43,10–58,76 | 52,14 | 6,63 | 54,50 | − | − | − | − |
| Lt | 65,99–85,71 | 73,37 | 6,69 | 62,00–82,47 | 71,43 | 8,69 | 58,3–83,2 | 71,1 | 62,8–76,3 | 68,2 | |
| LC | 51,82–70,69 | 61,96 | 6,85 | 49,22–59,38 | 55,16 | 4,49 | 62,5 | 57,1–74,8 | 69,9 | 65,3–75,5 | 69,9 |
| Hc | 10,80–16,30 | 13,57 | 1,86 | 13,28–18,05 | 14,89 | 2,16 | 12,00 | 7,1–7,9 | 12 | 8,8–14,4 | 11,6 |
| En Π| |||||||||||
| I | 95,65–158,30 | 125,15 | 25,20 | 105,30–155,00 | 132,20 | 25,20 | – | − | − | − | − |
| En dp-an | |||||||||||
| Ldp | 102,83–140,26 | 119,20 | 13,45 | 124,62–133,33 | 129,52 | 3,71 | 81,94 | − | − | − | − |
Proportions morpho-anatomiques (en %) de L. cyprinoides selon le sexe (voir codification dans le Tableau 1).
| Sexe | M1 | M2 | M3 | M4 | M5 | M6 | F1 | F2 | F3 | F4 | Min–max | Moy. | Ét |
| En LS | |||||||||||||
| LS | 32,08 | 38,12 | 40,08 | 38,38 | 38,08 | 50,42 | 26,94 | 28,4 | 30,08 | 28,42 | 26,94–50,42 | 35,1 | 7,29 |
| lT | 34,16 | 29,38 | 35,13 | 32,36 | 33,82 | 29,91 | 28,80 | 32,68 | 34,04 | 29,6 | 28,80–35,13 | 31,99 | 2,35 |
| lt | 23,94 | 25,18 | 25,95 | 22,98 | 22,32 | 22,02 | 23,76 | 23,94 | 23,14 | 18,4 | 18,37–25,95 | 23,16 | 2,06 |
| M-D1 | 38,15 | 41,34 | 41,12 | 39,55 | 38,55 | 34,87 | 38,01 | 35,56 | 37,50 | 37,6 | 34,87–41,34 | 38,22 | 2,09 |
| M-D2 | 51,62 | 59,18 | 56,89 | 61,54 | 61,45 | 52,64 | 57,61 | 55,21 | 52,66 | 62,4 | 51,62–62,35 | 57,11 | 4,00 |
| M-an | 54,36 | 47,43 | 49,30 | 54,92 | 53,78 | 49,78 | 50,78 | 55,21 | 55,32 | 49,3 | 47,43–55,32 | 52,02 | 2,99 |
| M-A | 57,61 | 49,74 | 50,10 | 62,79 | 60,66 | 55,02 | 53,16 | 57,18 | 59,31 | 63,3 | 49,74–63,34 | 56,89 | 4,85 |
| M-dp | 34,16 | 30,43 | 31,74 | 37,36 | 36,24 | 33,95 | 34,45 | 33,80 | 33,24 | 45,3 | 30,43–45,32 | 35,07 | 4,10 |
| Lpc | 24,44 | 24,76 | 27,35 | 20,64 | 18,59 | 17,06 | 21,68 | 21,97 | 23,14 | 14,8 | 14,78–27,35 | 21,44 | 3,81 |
| Lc | 17,71 | 18,26 | 20,36 | 22,88 | 23,06 | 18,25 | 16,63 | 17,75 | 16,76 | 17,6 | 16,63–23,06 | 18,92 | 2,36 |
| Hc | 4,24 | 3,99 | 3,79 | 4,64 | 5,51 | 4,20 | 4,16 | 4,51 | 4,52 | 5,35 | 3,79–5,51 | 4,49 | 0,56 |
| M-co | 16,71 | 16,79 | 18,56 | 15,84 | 13,87 | 14,24 | 13,96 | 14,93 | 14,89 | 16,1 | 13,87–18,56 | 15,59 | 1,50 |
| M-Cf | 30,17 | 35,05 | 38,92 | 31,42 | 31,51 | 26,62 | 57,31 | 32,68 | 31,65 | 35,5 | 26,62–57,31 | 35,08 | 8,49 |
| LD1 | 16,71 | 13,43 | 12,97 | 19,12 | 16,23 | 19,40 | 15,44 | 15,21 | 15,43 | 16,1 | 12,97–19,40 | 16,01 | 2,08 |
| LD2 | 18,70 | 14,27 | 13,57 | 24,49 | 23,27 | 23,28 | 18,11 | 17,18 | 17,55 | 19,1 | 13,57–24,49 | 18,96 | 3,72 |
| LA | 17,21 | 12,59 | 16,37 | 21,10 | 16,23 | 38,28 | 14,85 | 16,30 | 15,43 | 13,3 | 12,59–38,28 | 18,17 | 7,43 |
| LC | 23,44 | 25,18 | 24,95 | 29,18 | 26,52 | 20,19 | 21,38 | 25,92 | 21,81 | 22,1 | 20,19–29,18 | 24,07 | 2,77 |
| LP | 25,94 | 20,36 | 21,16 | 29,08 | 28,57 | 22,93 | 23,76 | 24,51 | 23,94 | 25,8 | 20,36–29,08 | 24,61 | 2,84 |
| Ldp | 23,19 | 17,21 | 21,56 | 24,34 | 24,00 | 18,76 | 23,76 | 22,54 | 21,54 | 22 | 17,21–24,34 | 21,88 | 2,31 |
| Hdp | 25,19 | 24,13 | 23,55 | 25,53 | 26,16 | 24,99 | 21,38 | 23,87 | 23,94 | 25,2 | 21,38–26,16 | 24,39 | 1,34 |
| HA | 23,69 | 20,57 | 19,56 | 22,46 | 22,32 | 22,77 | 15,74 | 20,28 | 21,54 | 21,1 | 15,74–23,69 | 21,00 | 2,23 |
| lA | 25,94 | 23,71 | 21,96 | 22,09 | 23,63 | 21,18 | 17,82 | 22,54 | 23,94 | 17,9 | 17,82–25,94 | 22,07 | 2,58 |
| Hpc | 15,21 | 11,54 | 12,57 | 10,63 | 11,08 | 12,22 | 11,28 | 12,68 | 11,24 | 11,2 | 10,63–15,21 | 11,96 | 1,32 |
| dp-an | 19,45 | 16,16 | 15,37 | 19,75 | 19,49 | 18,25 | 17,82 | 17,46 | 17,29 | 16,7 | 15,37–19,75 | 17,78 | 1,47 |
| En Lpc | |||||||||||||
| Hpc | 57,14 | 46,61 | 45,99 | 51,52 | 59,60 | 71,63 | 52,05 | 57,69 | 48,56 | 75,7 | 45,99–75,71 | 56,65 | 10,14 |
| En Lt | |||||||||||||
| LM | 18,98 | 18,57 | 15,34 | 21,58 | 17,70 | 23,08 | 19,59 | 17,24 | 17,97 | 19,2 | 15,34–23,08 | 18,93 | 2,18 |
| Œ | 23,36 | 17,14 | 18,18 | 26,73 | 24,84 | 22,68 | 19,59 | 17,24 | 16,41 | 29,5 | 16,41–29,45 | 21,56 | 4,52 |
| Lpo | 63,50 | 54,29 | 48,86 | 28,34 | 26,09 | 27,72 | 49,48 | 49,14 | 58,59 | 32,5 | 26,09–63,50 | 43,86 | 13,91 |
| Hj | 51,82 | 55,71 | 48,30 | 59,90 | 55,75 | 64,85 | 58,76 | 43,10 | 54,69 | 52 | 43,10–64,85 | 54,49 | 6,14 |
| Lt | 70,07 | 85,71 | 73,86 | 71,01 | 65,99 | 73,61 | 82,47 | 73,28 | 67,97 | 62 | 62,00–85,71 | 72,60 | 7,14 |
| LC | 51,82 | 62,14 | 57,95 | 70,69 | 68,17 | 61,01 | 57,73 | 54,31 | 49,22 | 59,4 | 49,22–70,69 | 59,24 | 6,71 |
| Hc | 12,41 | 13,57 | 10,80 | 14,33 | 16,30 | 14,06 | 14,43 | 13,79 | 13,28 | 18,1 | 10,80–18,05 | 14,10 | 1,98 |
| En Π| |||||||||||||
| I | 140,63 | 158,33 | 140,63 | 115,66 | 95,63 | 100,00 | 105,26 | 155,00 | 152,38 | 116,00 | 95,63–158,33 | 127,96 | 24,05 |
| En dp-an | |||||||||||||
| Ldp | 119,23 | 106,49 | 140,26 | 123,22 | 123,18 | 102,83 | 133,33 | 129,03 | 124,62 | 131,09 | 102,83–140,26 | 123,33 | 11,56 |
3.5 Le système latéral céphalique (SLC)
D’après les observations menées directement au MEB et sur les prises de vues respectives enregistrées sur des individus de taille et de sexe différents, les pores muqueux respectifs (Fig. 3E, F) des canaux oculoscapulaires antérieur (σ, λ, κ, ω, α, β, ρ) et postérieur (ρ’, ρ”), et préoperculaire (γ, δ, ɛ) [18] sont tous présents. Les pores κ et λ situés en avant de la crête sont très rapprochés l’un de l’autre (Fig. 3E).
Les séries de neuromastes [18] ne sont pas toutes présentes (Fig. 4A–D). En effet, manquent : la série longitudinale a sous l’œil, ainsi que la série transversale 7 (ou verticale) de la région sous-orbitale, la ligne r’ de la région post-orbitale et enfin la série tr de la région de l’oculoscapulaire située au-dessus de la série u. En revanche, la série e est discontinue au niveau de la commissure des lèvres et se poursuit sous la mâchoire inférieure latéralement avec les séries f et i (Fig. 4C) de la région mandibulaire-oculoscapulaire. Dans la région suborbitale, on compte 6 séries transversales (Fig. 4A) avec les séries 1 à 4 continues et les séries 5 à 6 discontinues, car elles sont coupées par la série b en rangées supérieures (5 s et 6 s) et inférieures (5i et 6i). L’orientation des neuromastes (Fig. 4A) de la série r située au-dessus du museau est plutôt verticale. En arrière des yeux et du canal oculoscapulaire antérieur, les séries g et m s’intercalent avec n et o et sont plaçées plus antérieurement, les séries n et o sont fusionnées et plutôt alignées que parallèles (Fig. 4C). Sous la partie postérieure de la crête (Fig. 4D), les neuromastes sont non alignés, la répartition des séries la, la’, la” est différente de celles annoncées [12,18], car elles sont plutôt verticales qu’horizontales, tandis que la série as est orientée plutôt verticalement qu’horizontalement. Le nombre de neuromastes comptés dans leurs séries sur les échantillons (Tableau 8) correspond à celui qui est dessiné sur la synthèse de nos observations du SLC de L. cyprinoides (Fig. 4D, E).
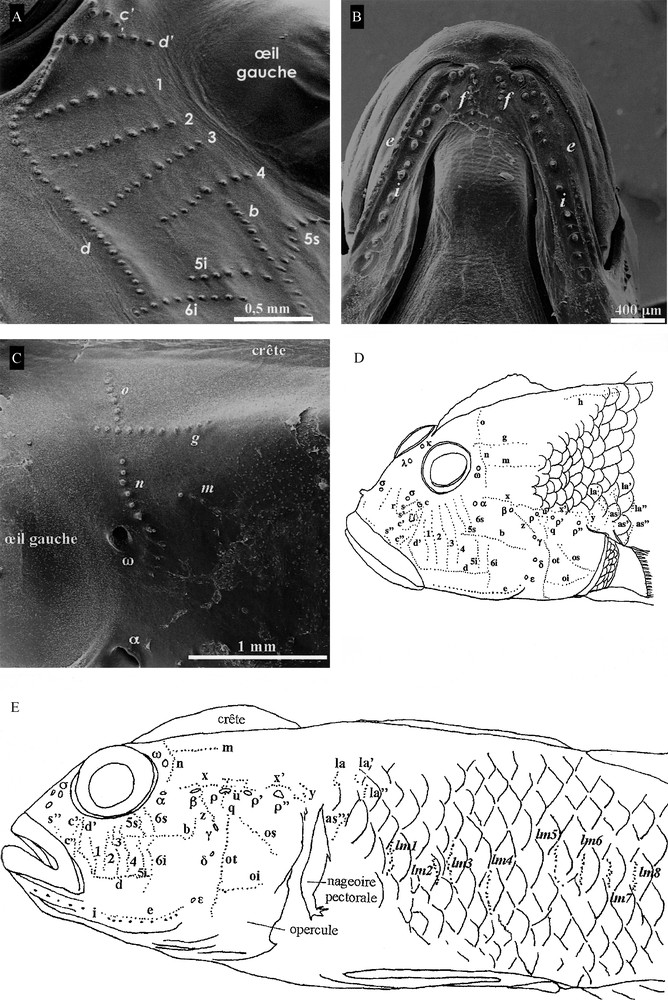
Distribution des séries de neuromastes superficiels du système latéral céphalique de L. cyprinoides observé au microscope électronique à balayage. A. Vu de profil (G × 30) : c”, d, d’, 1, 2, 3, 4, 5 s, 4i, 6 s, 6i, b. B. Vue ventrale (G × 30) de la mâchoire inférieure avec les séries e, f, i. C. Vue de profil gauche (G × 30) : pores muqueux ω, α, et séries o, g, m, n. D. Synthèse, modifiée de [20], des observations en vue 3/4 de dessus de la distribution des pores et canaux muqueux et des neuromastes du système latéral céphalique de L. cyprinoides avec la terminologie de [17], revue par [18], des pores muqueux (lettres grecques) et des séries de neuromastes (chiffres arabes et lettres latines) correspondants. E. Représentation schématique du système latéral céphalique (SLC) et d’une partie du troncal (SLT) en vue 3/4 de dessous avec les séries transversales ltm1 à ltm8 ; lm : ltm.
Nombres de neuromastes sur les séries du système latéral céphalique gauche du Gobiidae L. cyprinoides.
| Position des séries | Dénomination des séries et nombre de neuromastes | |||||||||||
| Postorbitales (PO) | r | s | s ’ | s ” | c | c ’ | c ” | |||||
| 9 | 7 | 5 | 4 | 8 | 6 | 7 | ||||||
| Suborbitales (SO) | 1 | 2 | 3 | 4 | 5i | 5s | 6i | 6s | b | d | d’ | |
| 12 | 15 | 20 | 19 | 11 | 12 | 15 | 10 | 27 | 26 | 26 | ||
| Mandibulaires-préoperculaires (MP) | e | i | f | |||||||||
| 25 | 13 | 7 | ||||||||||
| Oculoscapulaire (OS) | x | x ’ | z | q | u | y | as | as ’ | as ” | la | la ’ | la ” |
| 23 | 11 | 15 | 11 | 2 | 10 | 8 | 3 | 9 | 10 | 14 | 9 | |
| Operculaires (OP) | ot | os | oi | |||||||||
| 35 | 19 | 13 | ||||||||||
| Dorsales antérieures (DA) | n | g | o | m | h | |||||||
| 15 | 16 | 9 | 13 | 25 | ||||||||
| Position des séries | Dénomination des séries et nombre de neuromastes | |||||||||||
| Série transversale dorsale | ld | ld’ | ld” | ld”’ | ||||||||
| 12 | 5 | 4 | 5 | |||||||||
| Série transversale médiane | ltm1 | ltm2 | ltm3 | ltm4 | ltm5 | ltm6 | ltm7 | ltm8 | ltm9 | ltm10 | ||
| 14 | 9 | 12 | 11 | 9 | 8 | 11 | 11 | 11 | 8 | |||
| ltm11 | ltm12 | ltm13 | ltm14 | ltm15 | ltm16 | ltm17 | ltm18 | ltm19 | ||||
| 7 | 10 | 10 | 9 | 10 | 8 | 9 | 8 | 9 | ||||
| Série transversale ventrale | w | |||||||||||
| 10 | ||||||||||||
| Série horizontale caudale | lc | lc’ | lc” | |||||||||
| 11 | 10 | 10 |
3.6 Le système latéral troncal (SLT) et caudal (SLQ)
Au-delà de la tête, le SLT est composé (Tableau 8) de 19 séries transversales médianes ltm (Fig. 5A), régulièrement espacées jusqu’à l’extrémité du pédoncule caudal, comprenant 8 à 14 neuromastes, et de 4 séries dorsales, ld (± 12 neuromastes) sous D1, ld’ (6 neuromastes) entre D1 et D2, ld” (± 5 neuromastes) sous D2 et ld”’ (5 neuromastes) après D2 (Fig. 5A). Une série ventrale w (10 neuromastes) est présente à hauteur de la papille urogénitale.
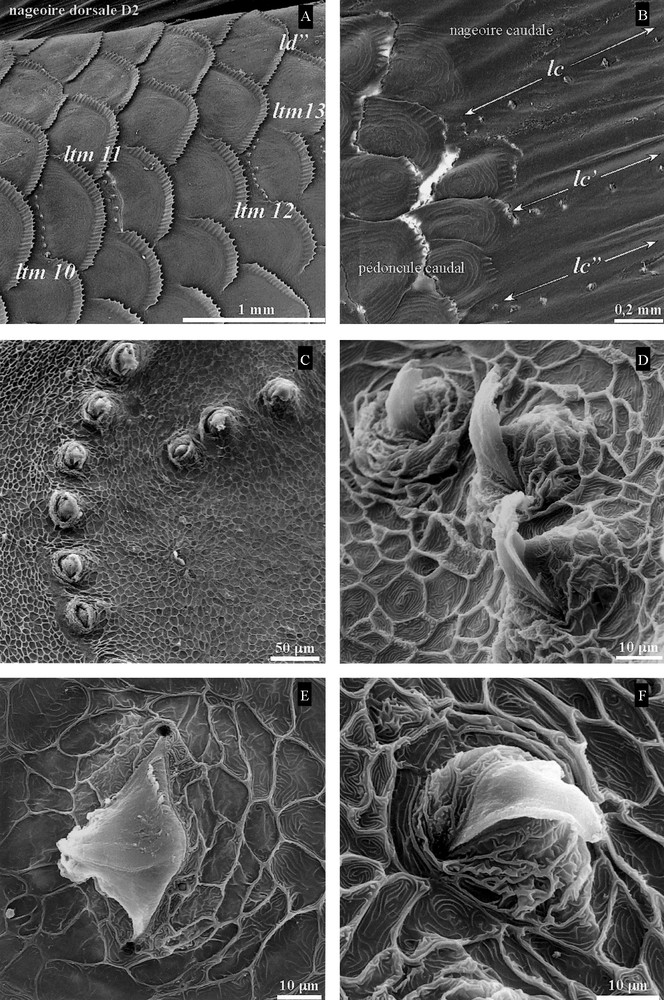
A. Séries transversales médianes ltm et dorsale ld sous la nageoire dorsale D2, ltm10, ltm11, ltm12, ltm13, ld” (G × 30). B. Séries horizontales lc, lc’, lc” du système latéral caudal (SLQ) sur la nageoire caudale (G × 30). C et D. Orientation des neuromastes dans les séries du SLT (G × 200, G × 800). E et F. Morphologie des neuromastes (G × 1500, G × 2000) ; G : grossissement.
Les 3 séries horizontales lc, lc’, lc” (10 à 11 neuromastes) du SLQ sont présentes sur la nageoire caudale (Fig. 5B), partant du pied de la nageoire vers l’extrémité.
3.7 Caractéristiques des neuromastes
Le nombre de neuromastes est variable entre les séries du SL et leur orientation est semblable à l’intérieur d’une même série (Fig. 5C, D). Un neuromaste, de hauteur totale d’environ 77 μm, se présente comme un mamelon ovoïde (80 × 62 μm) haut de 17 μm, surmonté d’une cupule gélatineuse en forme de croissant à sa base et de voile courbé, pointu et tronqué (53 μm de haut) dans la partie distale (Fig. 5E, F ; Tableau 9). Aucune structure ciliée n’est visible. Cette allure est constante.
Caractéristiques en tailles (μm) des neuromastes du système latéral céphalique de L. cyprinoides observées au microscope électronique à balayage sous différents grossissements.
| G | n | Lbm | σ | Min | Max | lbm | σ | Min | Max | n | lbc | σ | Min | Max |
| 200 | 33 | 78 | 12 | 55 | 110 | 61 | 11 | 40 | 83 | 2 | 69 | 16 | 58 | 80 |
| 400 | 4 | 75 | 9 | 63 | 83 | 67 | 8 | 69 | 50 | - | - | - | - | - |
| 800 | 3 | 68 | 14 | 55 | 83 | 60 | 10 | 50 | 69 | - | - | - | - | - |
| 1000 | 8 | 90 | 32 | 40 | 130 | 62 | 16 | 34 | 90 | 2 | 108 | 3 | 106 | 110 |
| 1500 | 2 | 80 | 18 | 67 | 93 | 67 | 9 | 60 | 73 | - | - | - | - | - |
| 2000 | 1 | 108 | - | - | - | - | 74 | - | - | - | - | - | - | - |
| Total | 51 | 80 | 18 | 40 | 130 | 62 | 11 | 34 | 90 | 4 | 88 | 25 | 58 | 110 |
| G | n | ht | σ | Min | Max | hm | σ | Min | Max | n | hc | σ | Min | Max |
| 800 | 1 | 88 | - | - | - | 19 | - | - | - | 2 | 54 | 11 | 46 | 63 |
| 1000 | 5 | 74 | 13 | 63 | 89 | 15 | 6 | 11 | 25 | 7 | 51 | 16 | 28 | 75 |
| 1500 | 1 | 84 | - | - | - | 25 | - | - | - | 1 | 60 | - | - | - |
| 2000 | 1 | 76 | - | - | - | 17 | - | - | - | 1 | 59 | - | - | - |
| Total | 8 | 77 | 11 | 63 | 89 | 17 | 6 | 11 | 25 | 11 | 53 | 13 | 28 | 75 |
3.8 Analyse phylogénétique d’après le séquençage du gène codant pour l’ARN ribosomal 18S
Ce travail a donné lieu au séquençage des sous-unités ribosomales 18S de 5 espèces de Gobiidae présentes dans la Caraïbe, en Atlantique et en Méditerranée. Si on les compare, celles-ci se distinguent (Fig. 6) de Acanthogobius flavimanus (Temminck & Schlegel, 1845) d’origine asiatique. Les espèces atlanto-méditerranéennes comme P. minutus et P. microps se regroupent et sont génétiquement proches de la troisième espèce atlanto-méditerranéenne étudiée G. niger. De même, les espèces caraïbéennes L. cyprinoides et A. banana sont génétiquement apparentées sur la base de leurs séquences d’ADNr 18S.

L’arbre présente les relations phylogéniques basées sur les séquences d’ADNr 18S, entre L. cyprinoides (en gras) et d’autres Gobiidae provenant de Méditerranée et de la Caraïbe, ou disponibles dans les bases de données. Les valeurs des nœuds indiquent la valeur des boostraps et les probabilités a posteriori (ML)/(Bayesian). La séquence d’ADNr 18S de Perca fluviatilis (AF518195) a été utilisée comme groupe extérieur afin d’enraciner l’arbre. L’échelle représente une estimation de la substitution des acides aminés de 0,1 %.
4 Discussion
4.1 Relations longueur totale–longueur standard, masse totale–longueur totale
La valeur de la pente (a = 1,235) calculée pour la relation longueur LT – longueur LS (Tableau 2) est plus proche de celle trouvée chez d’autres Gobiidae atlanto-méditerranéens de même écologie comme G. niger : 1,305 [25] que de celles de P. microps : 1,193 [26] ou de P. minutus : 1,181 [27]. D’après le paramètre de puissance (b = 2,994) calculé pour la relation masse–longueur (Tableau 2), la croissance de L. cyprinoides est isométrique. La valeur de b est voisine de celle de P. microps mâle : 3,088, femelle : 3,099, G. niger mâle : 3,267, femelle : 3,278, [28], P. minutus sexes confondus : 3,438 [27].
4.2 Diagnose
Les éléments communs de diagnose de L. cyprinoides des Petites Antilles, apportés par la présente étude et du Vénézuela [5,6] présentent des valeurs très proches à l’exception du fait que nous n’avons pas trouvé de variation avec la taille des nombres de rayons branchus, dorsaux et ventraux de la nageoire caudale. Les résultats sur les nombres de rayons de la nageoire pelvienne et de vertèbres sont originaux.
4.3 Dimorphisme sexuel
L’ocelle jaune et noir présent sur la première nageoire dorsale n’est pas un critère de dimorphisme sexuel comme le sont les papilles urogénitales bien distinctes dans chaque sexe. Elles font partie, avec les œufs non sphériques (piriformes) et les glandes accessoires, des apomorphes qui caractérisent les poissons Téléostéens de la famille des Gobiidae [29]. Les neuromastes de nombreux Gobiidae européens ont été décrites et même classées [30,31]. La plupart des travaux disponibles sur cette structure [32–34] traitent des gobies indo-pacifiques. La technique au MEB permet d’apprécier la complexité architecturale de la papille [16,28,35] et d’en suggérer un rôle fonctionnel lié au sexe. Cette protubérance qui prolonge les conduits urinaires et génitaux au-delà de la surface abdominale peut devenir volumineuse en période de reproduction et est souvent à l’origine d’un dimorphisme sexuel secondaire permanent comme chez P. microps, P. minutus ou G. niger. Il permet de reconnaître aussi le sexe des plus petits individus dont la papille est en développement. Dans le présent travail, les deux individus non sexés à cause d’une papille non individualisée mesurent 18 et 20 mm (LT), les plus petits sexés font 25 et 22 mm respectivement pour le mâle et la femelle. Le dimorphisme sexuel démontré par la morphologie de la papille ne présuppose pas que les individus ainsi sexés sont adultes. La période de maturation gonadique n’est pas encore connue.
4.4 Caractères morpho-anatomiques
Les résultats, présentés dans cette étude sur les proportions anatomiques définies [17] pour l’étude systématique des Gobiidae, caractérisent L. cyprinoides avec des informations supplémentaires obtenues sur des nouvelles proportions calculées à partir de distances morpho-anatomiques non envisagées [17], et qu’il a été pourtant nécessaire de prendre en compte. Il s’agit de la longueur Lc et de la hauteur de la crête Hc, et des longueurs du museau à l’origine M-co et à la fin de la crête M-cf. D’après ces proportions, il existerait un dimorphisme sexuel morpho-anatomique, cependant difficilement discernable à l’œil nu.
4.5 Le système latéral
L’utilisation [20] du MEB pour l’étude systématique du SL confirme l’obtention de résultats tangibles et aisément reproductibles.
Généralement dans le SLC, les deux pores médians impairs κ et λ du canal oculoscapulaire antérieur sont plus éloignés l’un de l’autre que ceux de L. cyprinoides. Le pore κ situé le plus souvent chez les Gobiidae en arrière de l’œil, est situé au milieu de l’espace interorbitaire de L. cyprinoides. Cette différence s’expliquerait par la présence de la crête dermique qui déplacerait, lors de sa formation, un peu plus en avant κ vers λ. La série a est considérée ici comme absente. Mais, n’est-elle pas fusionnée avec la série d’ qui s’oriente ici vers l’œil (Fig. 4D, E) ou avec une série verticale manquante plutôt que comme G. paganellus [36], G. auratus, G. bucchichii, G. capito et G. geniporus [18] ? Avant la série b coupant les séries 5s, 5i et 6s, 6i, on compte quatre séries de neuromastes superficiels sur cinq possibles. De plus, l’absence de la série tr au-dessus de u est aussi une originalité de L. cyprinoides, comme la répartition plutôt verticale qu’horizontale des séries r et s, s’, s” de neuromastes situées sur la face supraorbitaire. C’est la présence de la crête sur la tête de L. cyprinoides qui doit être la raison de cette disposition différente de celle généralement observée. Cette interprétation de l’emplacement et de l’orientation différents de ceux attendus pour certaines séries de neuromastes situées autour de la crête est confirmée avec les séries o, g et m qui sont regroupées près de la série n, alors qu’elles sont habituellement observées comme étant séparées de la série n. La série o est alignée dans le prolongement de la série n (Fig. 4C) et les séries g et m postérieures sont placées perpendiculairement contre les séries o et n, respectivement.
Enfin, la disposition des groupes de séries la, la’, la” et as, as’, as” est aussi originale. La série e est discontinue en se poursuivant sous la mâchoire inférieure (Fig. 3E, 4B), latéralement le long des séries f et i, au-delà de la commissure des lèvres. Cette disposition a également été observée sur d’autres gobies [18], de même que la présence des séries f et i situées en dessous de la mâchoire inférieure (Fig. 4B). Il semblerait que c’est au cours de l’ontogenèse de la crête de L. cyprinoides que les pores muqueux κ et λ se sont retrouvés relativement plus rapprochés les uns des autres antérieurement en avant de la crête, que la disposition généralement observée. En même temps que la naissance de la crête, non seulement l’orientation verticale des séries de neuromastes r et s, s’, s” (Fig. 4D) s’est trouvée déplacée antérieurement avec les tissus qui les soutiennent, mais aussi celle des séries o, g et m qui ont glissé en direction antérieure vers la série n (Fig. 4C), de la même façon.
Les séries médianes transversales du SLT observées chez L. cyprinoides sont montrées exclusivement dans cette étude, avec un nombre fini sur les deux flancs du corps du spécimen. Au-delà de la tête, le SLT est composé de 14 à 17 séries transversales médianes ltm, régulièrement espacées jusqu’à l’extrémité du pédoncule caudal, composées de 12 à 22 neuromastes, et de séries dorsales ld, toujours une sous la dorsale 1, de zéro à trois sous la dorsale 2, avec 17 à 23 neuromastes présents.
4.6 Les neuromastes
Parmi les neuromastes canaux et superficiels, seuls ces derniers ont été étudiés en tant que critères systématiques dans le présent travail. Les structures ciliées des neuromastes superficiels n’ont pu être observées car ils ont conservé leur cupule gélatineuse lors des manipulations des échantillons pour leur préparation technique. On peut raisonnablement affirmer que des cellules mécanoréceptrices sont bien présentes pour rendre le SL fonctionnel et que la structure, présente sous le mamelon, correspondrait à un ensemble de cellules sensorielles ciliées entourées de cellules support [37] voisin de celui existant chez le poisson zèbre Dano rerio (Hamilton, 1822).
4.7 Analyse phylogénétique d’après le séquençage du gène codant pour l’ARN ribosomal 18S
Ce travail a donné lieu au séquençage des sous-unités ribosomales 18S, de 5 espèces de Gobiidae présentes dans la Caraïbe et en Méditerranée (Fig. 6). Les espèces caribéennes L. cyprinoides et A. banana montrent une forte homologie de leurs séquences ADNr 18S. De même, les espèces atlanto-méditerranéennes P. minutus et P. microps, sur la base de leurs séquences ADNr 18S, sont fortement apparentées entre elles, et dans une moindre mesure avec G. niger, avec qui elles partagent leur aire de répartition. Les Gobiidae présents de part et d’autre de l’Atlantique semblent partager un même ancêtre commun et se distinguent de A. flavimanus d’origine asiatique. Ce résultat préliminaire sur la phylogénie des Gobiidae devra être étoffé, afin d’affiner notre compréhension des liens génétiques et de la phylogéographie des Gobiidae.
La phylogénie des Gobiidae basée sur les séquences nucléotidiques des sous-unités ribosomales 18S, est rendue difficile par le faible nombre d’études réalisées et donc la mise à disposition de l’information génétique. Cependant, des travaux récents de phylogénie chez les Gobiidae ont été réalisés à partir de marqueurs mitochondriaux tels que les séquences des sous-unités ARNr 12S et ARNr 16S [38]. L’utilisation de tels marqueurs pourrait s’inscrire dans le cadre d’une étude phylogénique des Gobiidae de la Caraïbe, afin de valoriser l’information génétique déjà mise à disposition dans les bases de données.
Remerciements
Nous remercions le Centre Commun de Caractérisation des Matériaux (C3MAG) de l’université des Antilles et de la Guyane qui a mis ses équipements à notre disposition pour la réalisation de ce travail.


