Abridged English version
The study of the diet of nocturnal birds of prey is of great utility in ecology and paleontology. The interest is increased in the case of species with large range and opportunist diet like the Barn Owl. The diet ecology of Tyto alba is intensively studied everywhere in the world and to some extent in Algeria. This kind of study informs us on the ecology of the predator and especially on the structure and the composition of its preys, like the small vertebrates. These works are necessary in community ecology as well as in population dynamics studies to increase our knowledge of biodiversity, conservation, and rodent pest control.
The aim of the present work is the study of the community structure of the preys of T. Alba in arid regions of Central Algeria and their variations according to the different stations of hunting. The establishment of detailed list of preys will inform us on the situation of the biodiversity of the biotopes exploited by this predator. Moreover, the importance of the rodent preys, especially the pest species, will be highlighted to detect the impact of this raptor in the limitation of the size of populations of such kind of preys, injurious to agriculture.
This study focuses upon regurgitation pellets collected between 2000 and 2006 in six stations, among which one is localized in the area of M'Sila (Ain El-Hadjel), and the five others in the area of Djelfa (Garden of conservation of the forests, Bahrara, El-Massrane, Baraka and Hassi Bahbah). In climatic terms, the area of M'Sila is characterized by very important dry periods, which last more than nine months each year. On the contrary, at Djelfa, these periods do not last more than seven months. It is to be mentioned that the area of M'Sila belongs to the arid bioclimatic zone and Djelfa to the semi-arid one.
However, the regurgitation pellets of the Barn Owl are collected under Pinus halepensis and Pistacia atlantica, which are used like places of nesting and perch for this raptor. The samples are monthly collected during different periods, between 2000 and 2002 for the first station and between 2005 and 2006 for the other ones.
The identification of the invertebrate prey species is made possible by the consultation of the collection of insectariums of the department of agricultural and forest zoology (ENSA, Algiers) and with the use of specialized keys. In the same way, for vertebrates, various keys were used for birds, the Soricomorpha, and the rodents in addition to the consultation of the collections of small mammals of the National Museum of Natural History (MNHN, Paris).
For the analysis of the results, several indices are used, in particular the richness (S), which is the number of species found in all pellets of T. alba, amended by the average richness (Sm) which represents the median number of species per pellets. We used also relative abundance (AR %), which is the percent proportion of the individuals number of a prey species (ni) in relation to the overall number of the individuals of all the prey species (N), as well as biomass (B %), which is the percent proportion of the weight of the individuals of a specie (Pi) to the total weight of the whole of the preys (P). For diversity, various indexes were used, like Shannon-Weaver's diversity (H′), maximum diversity (H′ max), and Pielou's index (E). We compared the composition of the diet of the Barn Owl between the stations by the Chi2 test (χ2). Factorial correspondence analysis (FCA) is used with the aim of showing the spatial distribution of the components of the diet of T. alba according to the stations, in order to characterize the diet of this predator in the Algerian highlands.
The analysis of 706 pellets coming from steppe areas of Algeria allowed the identification of 76 species (Ni = 1380) distributed into three classes of invertebrates and four classes of vertebrates. The stations richest in prey species are El-Mesrane, with S = 38 (Sm = 2.0 ± 1.1; N = 135) and Bahrara with S = 37 (Sm = 2.4 ± 1.9; N = 58). On the other hand, Baraka which is the poorest one, with only S = 15 prey species (Sm = 2.0 ± 1.9; N = 47).
The examination of the diet spectrum of T. alba displays the existence of nine categories of preys, which all present a highly significant dependence according to the stations (χ2obs = 141.7; χ2cri = 25.0; ddl = 15; P < 0.0001). The most important preys are Rodentia (58.5 % with El-Mesrane ≤ AR ≤ 86.3 % at Ain El-Hadjel), Insecta (8.5 % at Ain El-Hadjel ≤ AR ≤ 33.5 % at Bahrara) and Aves (0.39 % at Ain El-Hadjel ≤ AR ≤ 22.2 % at El-Mesrane).
In terms of biomasses, the rodents are the most significant part of the diet of the Barn Owl (61.4 ≤ B % ≤ 99.2) on the high plateaus of the country. In the event of a deficit, the complement is assured by the Soricomorpha (B ≤ 28.5 % at Ain El-Hadjel) or by the birds (B ≤ 11.7 % at Baraka).
Generally, Meriones shawii is the most consumed prey in all stations (31.9 ≤ AR % ≤ 76.6). In addition, other preys appear very selected after this one, like Rhizotrogus sp. (7.5 ≤ AR % ≤ 16.7), Passer sp. (0.2 ≤ AR % ≤ 13.9), Gerbillus nanus (0.9 ≤ AR % ≤ 13.6), and G. gerbillus (1.4 ≤ AR % ≤ 10). These last prey species are consumed by the Barn Owl in all stations, which reflects their abundance in the stations exploited by this predator. For the biomasses, M. shawii largely dominates all the prey species (62.0 ≤ B % ≤ 92.9). It is followed by Jaculus jaculus (1.4 ≤ B % ≤ 17.4).
The values of the diversity expressed by the Shannon-Weaver index are here relatively low, which reflects a rather poor biodiversity [1.58 ≤ H′ (bits) ≤ 3.66]. However, the diet of T. alba converges towards balance at most stations (0.69 < E < 0.76), except Ain El-Hadjel (E = 0.35), where the predator consumes much M. shawii. Of this fact, we can say that the Barn Owl presents a diet relatively diversified on the high plateaus of Algeria, with sometimes a preference oriented towards M. shawii, which totalizes more of the three-quarters of the diet.
1 Introduction
Les rapaces nocturnes ont une très grande utilité dans plusieurs domaines scientifiques, notamment l’écologie et la paléontologie [1]. Cela est accentué lorsqu’il s’agit d’une espèce protégée à grande aire d’action [2] et de répartition, comme c’est le cas de la Chouette effraie [3]. Compte tenu de type de proies sélectionnées, comme les rongeurs, principalement les rats et les souris, qui causent des dégâts sur les cultures en plein champs et dans les stocks [4], ce prédateur est considéré comme un auxiliaire utile à l’agriculture [5]. Il faut souligner également que certaines espèces de rongeurs, comme le cas de la Mérione de Shaw, constituent des réservoirs de germes pathogènes responsables de maladies transmissibles à l’homme, telle la leishmaniose cutanée [6].
L’écologie trophique de Tyto alba a fait l’objet de plusieurs travaux dans plusieurs régions du monde [7–15] et en Algérie [16–18]. Ce genre d’étude a enrichi nos connaissances sur l’écologie trophique du prédateur et surtout sur la structure et la composition de ses proies, notamment les micromammifères, qui sont très sollicités dans les études portant sur la biodiversité, l’écologie et la dynamique des populations [19].
Le présent travail observe les variations stationnelles du menu trophique de T. alba en milieu aride en Algérie centrale. L’inventaire détaillé des proies consommées par cette dernière espèce devrait donner des indications sur l’état de la biodiversité des milieux exploités par ce prédateur dans cette région. En outre, l’importance des rongeurs proies considérées comme pestes, notamment la Mérione de Shaw, sera mise en évidence afin de déceler l’impact de ce rapace dans la limitation de la taille des populations de ce genre de proies nuisible à l’agriculture [20].
2 Présentation des régions d’étude
Ce travail a été réalisé dans six stations d’étude localisée dans la région de M'Sila et de Djelfa (Fig. 1). En termes climatiques, la région de M'Sila est caractérisée par des périodes sèches très importantes, qui durent plus de neuf mois. En revanche, à Djelfa, ces périodes ne durent pas plus de sept mois. La région de M'Sila appartient à l’étage bioclimatique aride à hiver doux et celle de Djelfa à l’étage semi-aride à hiver froid.
Situation géographique des régions d’étude.
Les pelotes de l’Effraie sont collectées sous les pins d’Alep et les pistachiers, qui servent comme lieux de nidification et de perchoir pour ce rapace. Les échantillons sont collectés mensuellement, durant des périodes différentes, entre 2000 et 2002 pour la station 1 et entre 2005 et 2006 pour les autres stations.
La station 1 (Ain El-Hadjel) (35° 35′ N ; 3° 58′ E) est caractérisée par des altitudes variant entre 600 et 750 m et est connue par la culture de l’orge (Hordeum vulgare) destinée à l’alimentation du bétail. De part et d’autre, les parcelles comprennent des pieds de pistachier (Pistacia atlantica) et des touffes de jujubiers (Ziziphus lotus).
La station 2 (JCF) (34° 58′ N ; 3° 24′ E) est un milieu urbain situé au centre-ville de Djelfa. Le couvert végétal est formé par une strate arborescente représentée par le Pin d’Alep (Pinus halepensis) et une strate herbacée représentée par le gazon (Stenotaphrum americanum).
La station 3 (Bahrara) (34° 47′ N ; 3° 14′ E) est située dans le massif forestier de Séhary Guerbi occupée par 48 % de Pin d’Alep, accompagné de part et d’autre par le Genévrier oxycèdre (Juniperus oxycedrus) et le Genévrier de Phénicie (J. phoenicea).
La station 4 (El-Mesrane) (34° 56′ N ; 3° 05′ E) est un milieu forestier partiellement à vocation agricole caractérisée par des champs cultivés en blé (Triticum durum) et en orge. La strate arborescente est formée de pins d’Alep.
La station 5 (Barraka) (34° 51′ N ; 3° 10′ E) se trouve à environ 6 km au sud de la station 2. C’est un milieu naturel comprenant une strate arborescente formée essentiellement par le Pin d’Alep, le Genévrier oxycèdre et le Genévrier de Phénicie.
La station 6 (Hassi Bahbah) (35° 08′ N ; 3° 01′ E) est une forêt de pins d’Alep reboisée en 1956, puis réaménagée dans le programme du Barrage vert en 1985. Elle est caractérisée par une densité de plantation égale à 950 pins d’Alep par hectare.
3 Matériel et méthodes
Au laboratoire, l’analyse des pelotes se fait par la voie humide aqueuse qui consiste à faire ressortir de la pelote tous les éléments (os, fragments d’arthropodes…) qui informent sur l’identité des proies consommées. L’identification des espèces proies invertébrées est assurée par la consultation de la collection de l’insectarium de l’École nationale supérieure d’agronomie d’Alger et par l’utilisation des clés de référence [21,22]. Concernant les vertébrés, il a été utilisé la clé de Cuisin pour les oiseaux [23], la clé de Heim de Balsac et Bourlière [24] et d’Aulagnier et Thevenot [25] pour les Soricomorphes et les clés d’Osborne et Helmy [26], d’Orsini et al. [27] et de Barreau et al. [28], ainsi que les collections du Muséum national d’histoire naturelle (MNHN, Paris) pour les rongeurs.
L’étude de la structure des communautés des proies est analysée grâce à l’utilisation de quelques paramètres et indices, notamment la richesse totale (S) qui est le nombre total d’espèces identifiées dans toutes les pelotes de T. alba [29], amendée par la richesse moyenne (Sm), qui représente le nombre moyen d’espèces notées dans l’ensemble des pelotes [30]. L’abondance relative (AR %), qui est le rapport du nombre d’individu d’une espèce proie (ni) au nombre total d’individus de toutes les espèces proies (N) [31], la biomasse (B %), qui est le rapport du poids frais en grammes des individus d’une catégorie de proie (Pi) au poids total de l’ensemble des proies (P) [32], l’indice de diversité de Shannon–Weaver (H′), qui est donné par la formule suivante : H′ = −∑ qi log2 qi, exprimé en unités bits où (qi) est la fréquence relative de l’espèce proie (i) considérée [33], et l’indice de Pielou (E) qui est le rapport de la diversité observée (H′) à la diversité maximale, qui est H′max = log2 S, où S est la richesse totale [34,35]. Nous avons comparé la composition du régime alimentaire de la Chouette effraie entre les stations d’étude en utilisant le test du Chi2 (χ2). Ce dernier paramètre est la somme des rapports entre les carrés des écarts et les effectifs théoriques. C’est la distribution théorique la plus utilisée en statistique [36]. L’analyse factorielle des correspondances (AFC) vise à visualiser en un ou plusieurs graphiques la plus grande partie possible de l’information contenue dans un tableau de données [37]. Elle peut, sur différents types de données, décrire la dépendance ou la correspondance entre un grand nombre de variables et d’individus [38]. Dans la présente étude, cette analyse est utilisée dans le but de montrer la distribution spatiale des composantes du menu trophique de T. alba en fonction des stations d’étude sur les axes, afin de caractériser le régime de ce prédateur sur les hauts plateaux algériens.
4 Résultats
L’analyse de 706 pelotes provenant des régions steppiques d’Algérie a permis l’identification de 76 espèces proies (Ni = 1380) réparties en trois classes d’invertébrés et quatre classes de vertébrés (Tableau 1). Les stations les plus riches en espèces proies sont El-Mesrane, avec S = 38 (Sm = 2,0 ± 1,1 ; N = 135), et Bahrara, avec S = 37 (Sm = 2,4 ± 1,9 ; N = 58) (Tableau 1). En revanche, c’est à Baraka que le régime alimentaire de la Chouette effraie est le moins diversifié, avec seulement S = 15 espèces proies (Sm = 2,0 ± 1,9 ; N = 47).
Richesse totale et la richesse moyenne en espèces proies de Tyto alba recensées dans les différentes régions steppiques d’Algérie.
| M'Sila | Djelfa | |||||
| Ain El-Hadjel | JCF | Bahrara | El-Mesrane | Baraka | Hassi Bahbah | |
| N | 355 | 42 | 58 | 135 | 47 | 69 |
| N i | 518 | 110 | 161 | 342 | 108 | 141 |
| S | 23 | 20 | 37 | 38 | 15 | 19 |
| S m | 1,18 ± 0,47 | 2,25 ± 1,30 | 2,42 ± 1,87 | 2,01 ± 1,09 | 2,04 ± 1,18 | 1,96 ± 0,95 |
5 Variation du régime alimentaire en fonction des catégories proies
L’examen du spectre alimentaire de l’Effraie des clochers montre l’existence de neuf catégories proies (Fig. 2). Les plus importantes en termes de pourcentage de consommation sont les Rodentia (58,5 % à El-Mesrane ≤ AR ≤ 86,3 % à Ain El-Hadjel), les Insecta (8,5 % à Ain El-Hadjel ≤ AR ≤ 33,5 % à Bahrara) et les Aves (0,39 % à Ain El-Hadjel ≤ AR ≤ 22,2 % à El-Mesrane) (Fig. 2). Le test du Chi2 montre que la relation entre les catégories de proies et les stations est très hautement significative (χ2obs = 141,7 ; χ2cri = 25,0 ; ddl = 15 ; p < 0,0001).
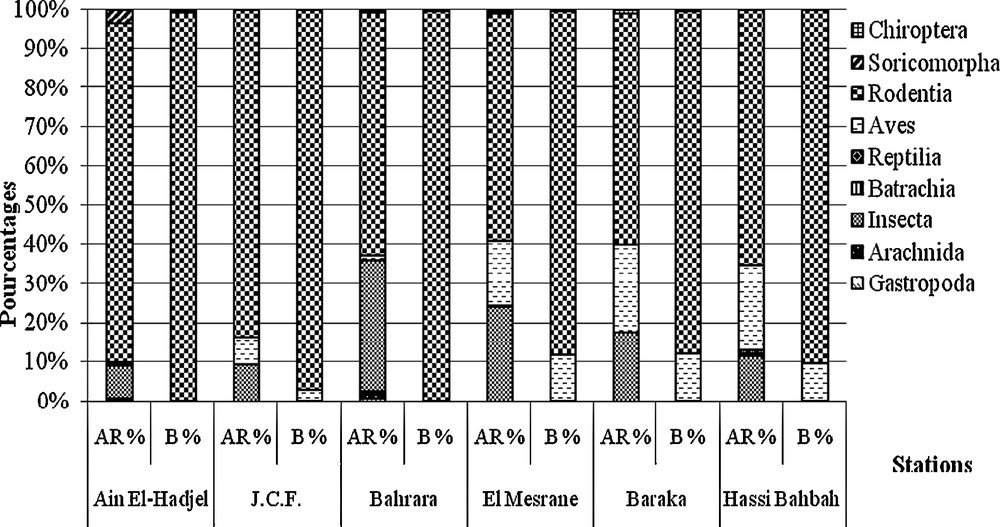
Abondance relative en nombre (AR %) et en biomasse (B %) des catégories proies de Tyto alba en notées dans les pelotes des différentes stations steppiques d’Algérie.
En termes de biomasses, les rongeurs totalisent la part la plus importante du repas de l’Effraie des clochers (61,4 ≤ B % ≤ 99,2) sur les hauts plateaux du pays (Fig. 2). Quand le nombre de rongeurs consommés baisse, le complément est assuré, soit par les insectivores (B % ≤ 28,5 à Ain El-Hadjel), soit par les oiseaux (B % ≤ 11,7 à Baraka) (Fig. 2).
L’étude des variations du régime alimentaire de la Chouette effraie en fonction des stations montre l’existence d’une très grande ressemblance des composantes du régime (0,877 ≤ Cc ≤ 0,995) (Tableau 2).
Matrice de corrélation de Pearson des catégories proies identifiées dans les pelotes de Tyto alba dans plusieurs stations des Hauts Plateaux algériens (α = 0,05).
| Ain El-Hadjel | JCF | Bahrara | El-Mesrane | Baraka | Hassi Bahbah | |
| Ain El-Hadjel | 1,000 | 0,995 | 0,909 | 0,920 | 0,917 | 0,941 |
| JCF | — | 1,000 | 0,910 | 0,944 | 0,949 | 0,969 |
| Bahrara | — | — | 1,000 | 0,956 | 0,904 | 0,877 |
| El-Mesrane | — | — | — | 1,000 | 0,989 | 0,970 |
| Baraka | — | — | — | — | 1,000 | 0,992 |
| Hassi Bahbah | — | — | — | — | — | 1,000 |
6 Variation du régime alimentaire en fonction des espèces proies
D’une manière générale, Meriones shawii est la proie la plus consommée dans toutes les stations (31,9 ≤ AR % ≤ 76,6) (Tableau 3). D’autres types de proies montrent de moindres abondances relatives, notamment Rhizotrogus sp. (7,5 ≤ AR % ≤ 16,7), Passer sp. (0,2 ≤ AR % ≤ 13,9), Gerbillus nanus (0,9 ≤ AR % ≤ 13,6) et G. gerbillus (1,4 ≤ AR % ≤ 10). Il est à mentionner que ces dernières espèces proies sont consommées par l’Effraie dans toutes les stations.
Nombre d’individus, abondance relative en nombre d’individus (AR %) et en biomasse (B %) des espèces proies recensées dans les pelotes de Tyto alba collectées sur les steppes algériennes.
| Catégories | Espèces | Stations | |||||||||||||||||
| Ain El-Hadjel | JCF | Bahrara | El-Mesrane | Baraka | Hassi Bahbah | ||||||||||||||
| N i | AR % | B % | N i | AR % | B % | N i | AR % | B % | N i | AR % | B % | N i | AR % | B % | N i | AR % | B % | ||
| Gastropoda | Leucochroa candidissima | — | — | — | — | — | — | 1 | 0,62 | 0,01 | — | — | — | — | — | — | — | — | — |
| Arachnida | Dysdera sp. | — | — | — | — | — | — | 2 | 1,24 | 0,00 | — | — | — | — | — | — | — | — | — |
| Scorpio maurus | — | — | — | — | — | — | 1 | 0,62 | 0,03 | — | — | — | — | — | — | — | — | — | |
| Galeodes sp. | 3 | 0,58 | 0,01 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Phalangidae sp. ind. | 1 | 0,19 | 0,00 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Insecta | Mantis relegiosa | 1 | 0,19 | 0,04 | — | — | — | — | — | — | 1 | 0,29 | 0,01 | — | — | — | — | — | — |
| Pamphageidae sp. ind. | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Gryllotalpa vulgaris | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | 2 | 1,42 | 0,03 | |
| Gryllus sp. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,00 | — | — | — | — | — | — | |
| Acrididae sp. ind. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,01 | — | — | — | — | — | — | |
| Calliptamus barbarus | 1 | 0,19 | 0,00 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Dericorys millierei | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,00 | — | — | — | — | — | — | |
| Cyphocleonus exanthematicus | — | — | — | — | — | — | — | — | — | 6 | 1,75 | 0,01 | — | — | — | — | — | — | |
| Anisolabis mauritanicus | — | — | — | — | — | — | 2 | 1,24 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Coleoptera sp. ind. | — | — | — | 2 | 1,82 | 0,01 | 2 | 1,24 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Zabrus sp. | — | — | — | 1 | 0,91 | 0,00 | 1 | 0,62 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Acinopus sp. | — | — | — | — | — | — | 1 | 0,62 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Acinopus megacephalus | — | — | — | — | — | — | 6 | 3,73 | 0,02 | — | — | — | — | — | — | — | — | — | |
| Harpalidae sp. ind. | — | — | — | — | — | — | 3 | 1,86 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Aphodius sp. | — | — | — | — | — | — | 4 | 2,48 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Rhizotrogus sp. | 39 | 7,53 | 0,05 | 2 | 1,82 | 0,01 | 9 | 5,59 | 0,04 | 21 | 6,14 | 0,08 | 18 | 16,67 | 0,18 | 13 | 9,22 | 0,11 | |
| Phyllognathus sp. | — | — | — | — | — | — | 1 | 0,62 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Phyllognathus silenus | — | — | — | — | — | — | 1 | 0,62 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Hydrophilus sp. | 1 | 0,19 | 0,00 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Tenebrionidae sp.1 ind. | — | — | — | — | — | — | 3 | 1,86 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Tenebrionidae sp.2 ind. | 2 | 0,39 | 0,00 | — | — | — | 2 | 1,24 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Asida sp. | — | — | — | 2 | 1,82 | 0,01 | 1 | 0,62 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Pachychila sp. | — | — | — | — | — | — | 1 | 0,62 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Pemilia sp. | — | — | — | — | — | — | 1 | 0,62 | 0,01 | 6 | 1,75 | 0,05 | — | — | — | 1 | 0,71 | 0,02 | |
| Lithoborus sp. | — | — | — | — | — | — | 1 | 0,62 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Akis sp. | — | — | — | — | — | — | 1 | 0,62 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Scaurus sp. | — | — | — | — | — | — | 3 | 1,86 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Sepidium sp. | — | — | — | — | — | — | 1 | 0,62 | 0,00 | 2 | 0,58 | 0,00 | — | — | — | — | — | — | |
| Chrysoperla sp. | — | — | — | 1 | 0,91 | 0,00 | — | — | — | — | — | — | — | — | — | — | — | — | |
| Hypera sp. | — | — | — | — | — | — | 2 | 1,24 | 0,00 | — | — | — | — | — | — | — | — | — | |
| Baridus sp. | — | — | — | 1 | 0,91 | 0,00 | — | — | — | — | — | — | — | — | — | — | — | — | |
| Lepidoptera sp. ind. | — | — | — | 1 | 0,91 | 0,00 | 5 | 3,11 | 0,01 | 43 | 12,57 | 0,11 | 1 | 0,93 | 0,01 | — | — | — | |
| Noctuidae sp. ind. | — | — | — | — | — | — | 3 | 1,86 | 0,01 | — | — | — | — | — | — | — | — | — | |
| Batrachia | Discoglossus pictus | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | 1 | 0,71 | 0,16 |
| Reptilia | Reptilia sp. ind. | 2 | 0,39 | 0,02 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Geckonidae sp. ind. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,02 | — | — | — | — | — | — | |
| Chalcides occellatus | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | 1 | 0,71 | 0,41 | |
| Aves | Aves sp. ind. | — | — | — | — | — | — | — | — | — | 3 | 0,88 | 0,31 | — | — | — | 7 | 4,96 | 1,62 |
| Passeriformes sp. ind. | 1 | 0,19 | 0,04 | — | — | — | 1 | 0,62 | 0,21 | 2 | 0,58 | 0,21 | — | — | — | — | — | — | |
| Collumba livia | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,67 | — | — | — | — | — | — | |
| Streptopelia sp. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,65 | — | — | — | — | — | — | |
| Delichon urbica | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | 1 | 0,71 | 0,21 | |
| Sturnus vulgaris | — | — | — | 1 | 0,91 | 0,65 | — | — | — | 15 | 4,39 | 5,6 | 5 | 4,63 | 5,28 | 1 | 0,71 | 0,83 | |
| Galerida cristata | — | — | — | 1 | 0,91 | 0,38 | — | — | — | 2 | 0,58 | 0,26 | — | — | — | — | — | — | |
| Motacilla alba | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,09 | — | — | — | — | — | — | |
| Sylviidae sp. ind. | — | — | — | 1 | 0,91 | 0,27 | — | — | — | — | — | — | — | — | — | — | — | — | |
| Sylvia sp. | — | — | — | — | — | — | — | — | — | 2 | 0,58 | 0,19 | — | — | — | 1 | 0,71 | 0,22 | |
| Phylloscopus sp. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,03 | — | — | — | — | — | — | |
| Carduelis chloris | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,13 | — | — | — | — | — | — | |
| Serinus serinus | — | — | — | — | — | — | — | — | — | 7 | 2,05 | 0,41 | 4 | 3,7 | 0,66 | 2 | 1,42 | 0,26 | |
| Passer sp. | 1 | 0,19 | 0,05 | 5 | 4,55 | 1,52 | 1 | 0,62 | 0,21 | 21 | 6,14 | 2,87 | 15 | 13,89 | 5,78 | 19 | 13,48 | 5,77 | |
| Rodentia | Jaculus orientalis | 15 | 2,90 | 4,42 | 6 | 5,45 | 1,36 | 3 | 1,86 | 4,66 | 2 | 0,58 | 1,56 | 2 | 1,85 | 4,4 | 10 | 7,09 | 17,37 |
| Gerbillinae sp. ind. | — | — | — | 1 | 0,91 | 0,38 | — | — | — | 2 | 0,58 | 0,26 | — | — | — | 5 | 3,55 | 1,45 | |
| Gerbilllus sp. | 9 | 1,74 | 0,45 | 6 | 5,45 | 2,27 | 4 | 2,48 | 1,03 | 20 | 5,85 | 2,66 | 7 | 6,48 | 2,63 | 19 | 13,48 | 5,63 | |
| Gerbillus nanus | 6 | 1,16 | 0,20 | 15 | 13,64 | 5,78 | 9 | 5,59 | 2,38 | 14 | 4,09 | 1,22 | 1 | 0,93 | 0,25 | 4 | 2,84 | 0,78 | |
| Gerbillus gerbillus | 7 | 1,35 | 0,40 | 11 | 10 | 4,82 | 3 | 1,86 | 0,91 | 7 | 2,05 | 1,06 | 3 | 2,78 | 1,29 | 6 | 4,26 | 2,07 | |
| Gerbillus campestris | 1 | 0,19 | 0,04 | — | — | — | 1 | 0,62 | 0,31 | 5 | 1,46 | 0,59 | — | — | — | 1 | 0,71 | 0,26 | |
| Gerbillus tarabulli | 5 | 0,97 | 0,33 | — | — | — | — | — | — | 12 | 3,51 | 2,1 | 3 | 2,78 | 1,49 | 2 | 1,42 | 0,78 | |
| Gerbillus simoni | 3 | 0,58 | 0,09 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Meriones shawii | 397 | 76,64 | 92,89 | 44 | 40 | 79,84 | 71 | 44,1 | 88,18 | 125 | 36,55 | 77,17 | 43 | 39,81 | 75,02 | 45 | 31,91 | 62,02 | |
| Pachyuromys duprasi | 1 | 0,19 | 0,08 | — | — | — | 1 | 0,62 | 0,45 | 1 | 0,29 | 0,22 | 1 | 0,93 | 0,63 | — | — | — | |
| Mus sp. | — | — | — | 1 | 0,91 | 0,23 | 3 | 1,86 | 0,47 | 8 | 2,34 | 0,56 | 3 | 2,78 | 0,84 | — | — | — | |
| Mus musculus | — | — | — | 1 | 0,91 | 0,23 | 5 | 3,11 | 0,78 | 1 | 0,29 | 0,2 | — | — | — | — | — | — | |
| Mus spretus | 3 | 0,58 | 0,11 | 7 | 6,36 | 2,24 | — | — | — | 2 | 0,58 | 0,1 | — | — | — | — | — | — | |
| Rattus sp. | — | — | — | — | — | — | — | — | — | — | — | — | 1 | 0,93 | 1,47 | — | — | — | |
| Rattus norvegicus | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,52 | — | — | — | — | — | — | |
| Soricomorpha | Crossidura sp. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,05 | — | — | — | — | — | — |
| Crocidura russula | 16 | 3,09 | 0,31 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Crocidura whitakeri | 2 | 0,39 | 0,04 | — | — | — | 1 | 0,62 | 0,22 | — | — | — | — | — | — | — | — | — | |
| Elephentulus rozeti | 1 | 0,19 | 0,39 | — | — | — | — | — | — | — | — | — | — | — | — | — | — | — | |
| Chiroptera | Chiroptera sp. ind. | — | — | — | — | — | — | — | — | — | 1 | 0,29 | 0,03 | 1 | 0,93 | 0,09 | — | — | — |
| Totaux | 76 | 518 | 100 | 100 | 110 | 100 | 100 | 161 | 100 | 100 | 342 | 100 | 100 | 108 | 100 | 100 | 141 | 100 | 100 |
Pour les biomasses, les rongeurs occupent le premier rang des proies les plus profitables en poids (Tableau 3). En effet, M. shawii domine largement tous les types de proies ingérées (62,0 ≤ B % ≤ 92,9). Elle est suivie par Jaculus jaculus (1,4 ≤ B % ≤ 17,4). Cependant, Passer sp. (0,1 ≤ B % ≤ 5,8) peut parfois être consistant en termes de masses. En revanche, les invertébrés ne sont représentés que par des faibles taux de biomasse (B % < 0,2) (Tableau 3).
Les valeurs de l’indice de diversité de Shannon–Weaver varient entre 1,58 bits et 3,66 bits (Fig. 3). Ces dernières sont un peu plus faibles que celles de la diversité maximale (3,91 ≤ H′max [bits] ≤ 5,25). Cependant, le rapport de ces deux indices, qui correspond à l’indice de Pielou (H′/H′max) montre que le régime de l’Effraie tend vers l’équilibre dans la plupart des stations, notamment à Hassi Bahbah (E = 0,76) (Fig. 4). Le contraire est vrai à Ain El-Hadjel (E = 0,35), où le prédateur se rabat le plus souvent sur M. shawii, proie abondante et consistante en termes de biomasse (Tableau 3).

Diversité de Shannon–Weaver et diversité maximale appliquées aux espèces proies de Tyto alba en fonction des stations étudiées dans les régions steppiques d’Algérie.
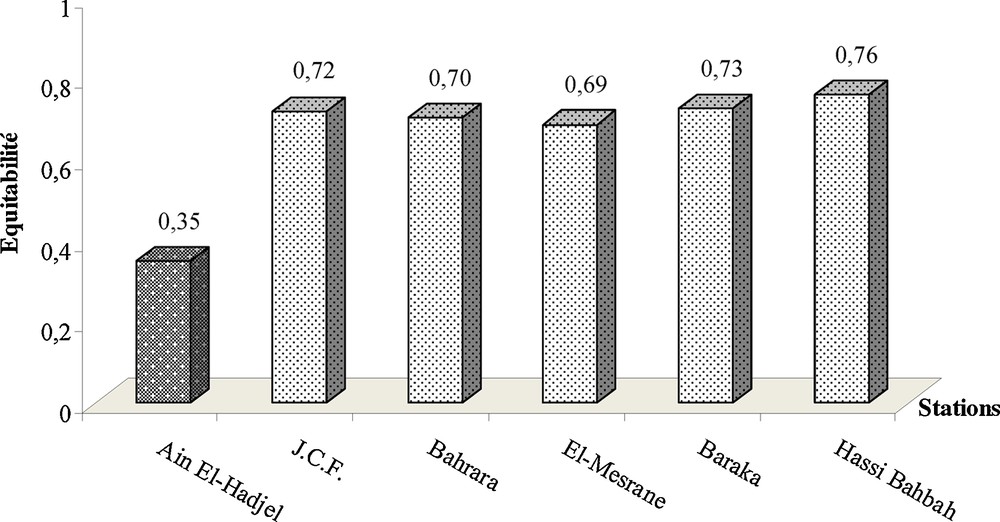
Variation des valeurs de l’indice de Pielou appliqué aux espèces proies de Tyto alba en fonction des stations étudiées dans les régions steppiques d’Algérie.
L’application de l’AFC pour les composantes trophiques de l’Effraie en fonction des stations montre que certaines d’entre elles sont sensiblement différentes les unes par rapport aux autres, notamment Ain El-Hadjel, Bahrara et El-Mesrane (Fig. 5). Cette dernière se caractérise par la présence de 13 espèces proies consommées uniquement dans cette station, comme c’est le cas de Gryllus sp. (sp9) et de Carduelis chloris (sp54). Il en est de même à Bahrara, où 17 espèces proies sont recensées, notamment Scorpio maurus (sp3) et Pemilia sp. (sp29), alors que le régime à Ain El-Hadjel se caractérise par neuf espèces proies, telles Galeodes sp. (sp4) et Elephantulus roseti (sp75). Ces différences marquent nettement les variations du régime de la Chouette effraie sur les hauts plateaux algériens (Fig. 5).
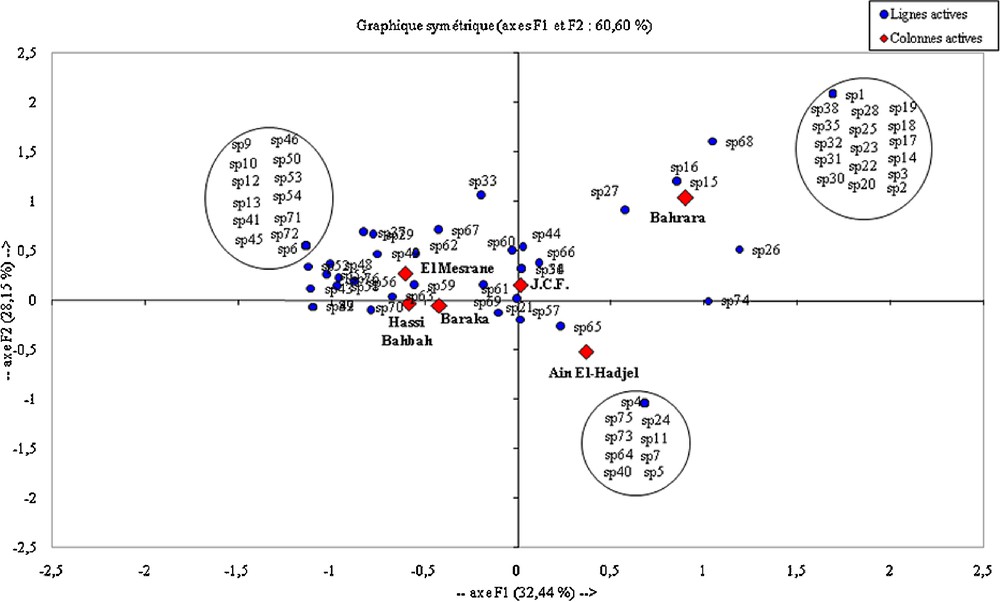
(Couleur en ligne.) Représentation graphique de la projection des espèces proies consommées par Tyto alba dans la steppe algérienne et des stations d’étude en fonction des axes 1 et 2 (60,59 % de la variabilité totale).
7 Discussion
7.1 Richesses du menu trophique
L’étude du régime alimentaire de la Chouette effraie sur les hauts plateaux d’Algérie a permis le dénombrement de 1380 individus (N = 706 pelotes) (Tableau 1). Les 76 espèces proies identifiées sont représentées tant par des invertébrés (S = 38 espèces proies) que par des vertébrés (S = 38 espèces proies), contrairement à ce que mentionne la littérature dans le monde – [39] aux États-Unis, [40] au Chili et en Espagne, [41] en France, [42] en Espagne, [43] en Grèce, [13] en Tunisie, [44,45] en Syrie, [14] à Madagascar, [46] en République tchèque, [47] au Brésil – et même en Algérie [16–18,48], où les micromammifères sont nettement plus représentés que les autres catégories proies.
En termes de stations, il se trouve que, dans les milieux qui abritent des peuplements invertébrés plus riches, l’Effraie consomme plus d’espèces de cette catégorie (Tableau 1) – cas de Bahrara (S = 25). L’inverse est vrai si les vertébrés proies sont les plus riches, notamment à El-Mesrane (S = 28). Il est à rappeler que la station Bahrara constitue un milieu arboricole stable formée par le Pin d’Alep et le Genévrier ; en revanche El-Mesrane est un milieu forestier, où sont implantées des petites parcelles de blé et d’orge. En effet, la diversité floristique joue un rôle très important dans la répartition des espèces animales [49] et agit sur le comportement alimentaire des oiseaux prédateurs ainsi que sur leurs proies [50,51].
7.2 Composantes du régime alimentaire en fonction des catégories proies
D’une manière générale, l’Effraie se nourrit de plusieurs catégories de proies (Gastropoda, Arachnida, Insecta, Batrachia, Reptilia, Aves, Rodentia, Soricomorpha, Chiroptera) dans les zones arides. On compte ainsi un minimum de cinq catégories en Tunisie [13] et un maximum de neuf au Maroc [52] et en Algérie (cette étude). Cependant, il est à remarquer que les composantes du régime en Algérie (cette étude) et au Maroc [52] sont presque similaires.
L’examen du contenu des pelotes de l’Effraie collectées sur les hauts plateaux d’Algérie montre l’importance des Rodentia (58,5 % à El-Mesrane ≤ AR ≤ 86,3 % à Ain El-Hadjel). Cette dernière catégorie de proies occupe une part très importante dans son régime un peu partout dans le monde [7,8,10,53–57] et notamment dans les régions arides [11–13,51,52] et même en Algérie [17,18,20], où ce dernier est basé le plus souvent sur des proies plus consistantes, comme la Mérione de Shaw [58]. Cette forte consommation des rongeurs peut être expliquée par leur abondance, et surtout par le fait qu’ils sont les proies les plus exposées au rapace nocturne par suite de leur période d’activité dans la nuit. Néanmoins, les Insecta (8,5 % ≤ AR ≤ 33,5 %) et les Aves (0,39 % ≤ AR ≤ 22,2 %) peuvent subvenir aux besoins du prédateur en cas de rareté des proies les plus recherchées, en fonction des stations et des disponibilités alimentaires attachées à celles-ci [41]. Par ailleurs, ce prédateur peut être un grand consommateur de musaraignes [41,59,60]. Il peut même sélectionner des proies de taille plus importantes, telles que les lagomorphes [53]. Parfois on trouve des batraciens [50, cette étude] des reptiles [1] et même des carnivores [52] parmi les composantes du régime de ce prédateur.
En outre, les rongeurs totalisent la part la plus importante de la biomasse (61,4 ≤ B % ≤ 99,2) des proies ingérées sur les hauts plateaux d’Algérie. Ceci est en accord avec de nombreux travaux d’autres auteurs. Debus et al. [53] en mentionnent pour près de 82 % en Australie, Pailley et Pailley [57] en enregistrent pour 87,3 % en France, tandis que Leonard et Dell’Arte [13] en notent pour 87,6 % en Tunisie. L’abondance des rongeurs dans le régime alimentaire de l’Effraie peut être expliquée par leur pullulation très importante, notamment le nombre de petits par portée et surtout l’importance de leur poids, qui varie entre 10 g (Mus musculus) et 200 g (M. shawii) [61]. Il se peut qu’en cas de déficit, le complément soit assuré par les oiseaux (B ≤ 11,7 % à Baraka) ou par les Soricomorpha (B ≤ 28,5 % à Ain El-Hadjel). Ce comportement a été mentionné en France [41] et au Pakistan [60].
7.3 Composantes du régime alimentaire en fonction des espèces proies
En termes d’espèces, M. shawii constitue incontestablement la proie la plus abondante dans les pelotes de toutes les stations (31,9 ≤ AR % ≤ 76,6) (Tableau 3). De même, elle totalise l’essentiel de la biomasse des proies ingérées (62,0 ≤ B % ≤ 92,9). D’après [6], cette proie domine le régime de T. alba sur les hauts plateaux d’Algérie (AR % = 87,0 ; B % = 99,1). En revanche, en Europe de l’Ouest, les Microtinae, notamment avec le genre Microtus, sont les plus quantifiées [62,63]. En outre, les Murinae, comme Mus au Proche-Orient [42] et les Gerbillinae comme Gerbillus dans les régions arides [64,65], sont les plus recherchées. D’autres proies sont présentes dans toutes les stations, comme Rhizotrogus sp. (7,5 ≤ AR % ≤ 16,7), Passer sp. (0,2 ≤ AR % ≤ 13,9), G. nanus (0,9 ≤ AR % ≤ 13,6) et G. gerbillus (1,4 ≤ AR % ≤ 10). Ces dernières ne représentent que de faibles biomasses (B % < 6). Dans les régions aride de l’Australie, Mus domesticus constitue près de deux tiers du régime de la Chouette effraie (AR % = 62) et près des trois quarts de la biomasse (B % = 74) [53]. Cependant, le régime de l’Effraie sur les hauts plateaux algériens présente des spécificités en fonction des stations ; cela est nettement visible sur le graphique de l’AFC, où il est avéré que certaines espèces proies caractérisent le régime de ce prédateur dans des stations bien déterminées, comme c’est le cas de Gryllus sp. (sp9) et de C. chloris (sp54) à El-Mesrane, de S. maurus (sp3) et de Pemilia sp. (sp29) à Bahrara et de Galeodes sp. (sp4) et E. roseti (sp75) à Ain El-Hadjel (Fig. 5). Par ailleurs, il est à rappeler que les caractéristiques du domaine vital sont en relation étroite avec les proportions des différentes proies trouvées dans les pelotes de l’Effraie [66–69].
7.4 Diversité
Il est à constater que la biodiversité des milieux steppiques échantillonnés par l’Effraie est relativement pauvre (1,58 ≤ H′ bits ≤ 3,66). Ces résultats concordent avec ceux trouvés par Delibes et al. [70] en Espagne (1,32 ≤ H′ bits ≤ 1,82) et Bon et al. [71] en Italie (1,04 ≤ H′ bits ≤ 2,14) et même avec ce qui a été relevé sur les Hauts Plateaux algériens [6] à Mergueb (H′ = 0,89 bits). Cependant, le régime de l’Effraie est varié, avec une tendance vers l’équilibre des composantes dans la plupart des stations (0,69 ≤ E ≤ 0,76), sauf à Ain El-Hadjel (E = 0,35), où il y a une préférence pour M. shawii.
8 Conclusions
Neuf catégories proies composent le régime alimentaire de l’Effraie sur les Hauts Plateaux algériens. Les rongeurs représentent plus de la moitié des proies et de la biomasse ingérée, où la Mérione de Shaw totalise plus des trois quarts du régime à Ain El-Hadjel. T. alba a donc un rôle très important en termes de régulation des populations de M. shawii, qui est un fléau agricole classé comme tel par décret en Algérie (no 95-387 du 28 novembre 1995) à la suite des dégâts infligés aux cultures, notamment celles des céréales [72]. En outre, il faut souligner l’importance de la conservation de ce prédateur, protégé par décret (no 03-10 du 19 juillet 2003), qui contribue à la limitation de la propagation de la leishmaniose cutanée dans la région.


