1 Introduction
L’athérome est associé à l’inflammation et celle-ci joue un rôle dans son développement [1]. Obésité et syndrome métabolique sont aussi associés à une inflammation à bas bruit [2], et le tissu adipeux (TA) des personnes obèses présente lui-même des signes d’inflammation [3–5]. Cette inflammation modérée de l’obésité pourrait contribuer au développement de l’insulinorésistance [2] et des complications vasculaires [6]. Les artères sont entourées par du TA péri-adventitiel (TAPA). Des molécules produites par ce TAPA peuvent agir directement (effet outside to inside) sur la paroi artérielle [7,8]. Le TA est hétérogène, avec des différences d’expression de gènes et de sécrétion de molécules entre les TA sous-cutané (SC) et intra-abdominal [9,10]. L’obésité, facteur de risque cardio-vasculaire [11], est associée à des concentrations circulantes augmentées de marqueurs de l’inflammation, de cytokines pro-inflammatoires (TNFα, IL-6, IL-1β), de molécules solubles d’adhésion cellulaire (VCAM, ICAM1) et de chimiokines (MCP-1, IL-8) [3,4,6]. Les concentrations de molécules anti-inflammatoires et anti-athérogènes [12], comme l’adiponectine, sont au contraire diminuées dans l’obésité [6]. De plus, malgré des données parfois contradictoires [13,14], l’expression des récepteurs de l’adiponectine (AdipoR1 et R2) peut être diminuée, en particulier dans le TA. La perte de poids corrige en partie ces anomalies [15,16]. Le TA est une source de ces facteurs pro-inflammatoires, et la masse adipeuse augmentée des personnes obèses contribue à leur sécrétion excessive [2,4,6]. Le TA lui-même présente une inflammation modérée, avec infiltration accrue de macrophages (Mf) [3,16]. La sécrétion accrue de MCP-1 par le TA dans l’obésité pourrait contribuer à cette infiltration par des Mf. Ces derniers ont un phénotype activé et sont une source majeure de production par le TA de TNFα, IL-6 et 8, MCP-1 et PAI-1. Ces cytokines pro-inflammatoires et chimiokines favorisent l’inflammation de la paroi artérielle, l’adhérence, la migration de monocytes et leur conversion en macrophages, stimulant ainsi le développement de l’athérome [6]. Ces cytokines entraînent aussi une insulinorésistance [5]. Au total, le TA est dans l’obésité une source de molécules aux effets délétères sur la paroi artérielle, pouvant favoriser le développement de l’athérome. L’hétérogénéité du TA décrite sur le plan métabolique et de l’expression de nombreux gènes [9,10,18] existe aussi au niveau de l’état inflammatoire dans l’obésité. Chez l’homme et l’animal, l’infiltration macrophagique, la sécrétion de cytokines néfastes et l’expression de l’angiotensinogène [17,18] sont plus élevées dans le TA viscéral que dans le TA sous-cutané, contribuant aux effets défavorables de l’obésité viscérale. Le TAPA est un composant du TA viscéral. Les données, en particulier chez l’homme, sur sa biologie sont rares, mais elles suggèrent déjà que le TAPA peut avoir des effets importants et directs sur la paroi artérielle, et donc qu’un état inflammatoire élevé et un profil d’expression génique et de sécrétion de molécules défavorables peuvent favoriser directement le développement de l’athérome [19].
Le TAPA sécrète des molécules agissant sur le tonus artériel et les résistances vasculaires [20–23], y compris chez l’homme [24]. De plus, il stimule directement la prolifération des cellules musculaires lisses vasculaires (CMLV) [25]. Ceci montre que le TAPA peut agir directement sur la paroi artérielle. Le TAPA pourrait aussi, comme d’autres TA, exprimer des gènes et sécréter des molécules agissant directement sur l’artère pour induire l’inflammation ainsi que l’insulinorésistance, et pour favoriser l’athérome [7,8]. De ce fait, les angioplasties entraînent une inflammation de l’intima et de la media, mais aussi de l’adventice et du TAPA [26] ; cette inflammation périvasculaire peut jouer un rôle dans la resténose. De plus, le TA épicardique des sujets avec athérome coronarien contient des cellules inflammatoires et exprime plus de chimiokines et cytokines pro-inflammatoires que le TA SC [27]. Enfin, le TAPA chez l’homme et les rongeurs contient des Mf et exprime IL-8 et MCP-1 [28].
Au total, le TAPA peut agir directement sur la paroi artérielle et peut être un siège d’inflammation. Des modifications à son niveau d’expression et de sécrétion de chimiokines, cytokines et d’autres molécules agissant sur la paroi artérielle, comme l’angiotensine II, dans l’obésité et l’insulinorésistance pourrait contribuer directement au développement de l’athérome. Cependant, à ce jour, le degré d’inflammation du TAPA dans l’obésité, du TA entourant la plaque d’athérome, les modifications d’expression de gènes pro et anti-inflammatoires/athérogènes dans ces sites de TA comparés à d’autres n’ont pas été caractérisés, chez l’homme comme dans des modèles expérimentaux. De plus, il n’a pas été établi comment cet état inflammatoire du TAPA est contrôlé, en particulier par des facteurs nutritionnels.
2 Matériel et méthodes
2.1 Études in vivo chez le rat en accord avec les directives pour l’expérimentation animale de l’université Claude-Bernard Lyon-1 (UCBL1)
2.1.1 Rat Zucker obèses
Le rat Zucker obèse est un modèle d’obésité et d’insulinorésistance d’origine génétique. Les rats obèses (ZO, n = 18) et contrôles (CO, n = 18), tous mâles, ont été fournis par Charles River (France). Ils sont arrivés à l’âge de 6 semaines et ont été hébergés pendant tout le protocole dans les locaux de plate-forme ANIPHY (explorations physiologiques du petit animal vivant) de l’UCBL1 dans des conditions de température (22 ± 1 °C) et d’éclairage (lumière allumée à 7 h et éteinte à 19 h) contrôlées. Les animaux ont reçu ad libitum de l’eau et une alimentation standard de laboratoire (Harlan Global Diet 2018).
Les rats Zucker obèses et leurs contrôles ont été répartis en trois lots de six rats chacun et suivis respectivement pendant 7 (un groupe ZO et CO), 14 (un groupe ZO et CO) et 21 (un groupe ZO et CO) semaines avant le sacrifice final. Pour l’étude de l’expression des gènes pro-inflammatoires dans le tissu adipeux, nous avons choisi le groupe de rats obèses et contrôles de 14 semaines, qui ont montré des résultats significatifs comparativement aux groupes de 7 et 21 semaines. À ce stade de l’expérimentation, les rats Zucker obèses présentent un état d’hyperinsulinémie comparativement à leurs contrôles correspondants témoignant d’une insulinorésistance dès la septième semaine.
2.1.2 Le rat stressé
Cette étude a été réalisée sur 12 rats Sprague Dawley (provenant de la société Charles River, France). Les rats ont été habitués à être manipulés lors des changements de cage durant une semaine avant le début des manipulations. Les animaux ont été séparés en deux groupes de poids initial identique :
- • 6 rats contrôles, ne subissant aucun stress, qui ont été manipulés pour la pesée et le nettoyage des cages ;
- • 6 rats stressés durant deux semaines à l’aide de différents exercices.
Les différentes méthodes de stress induit chez les rats sont :
- • la contention (les rats sont placés pendant une heure dans des tubes de contention) ;
- • la nage forcée (les rats doivent nager pendant 15 min dans de l’eau à 25 °C) ;
- • un troisième mode de stress consistant à placer les rats sur une plate-forme étroite entourée d’eau (ils doivent donc éviter de bouger afin de ne pas tomber dans le liquide).
Ces trois stress sont modérés. Chaque jour l’animal est stressé, les stress sont changés tous les jours suivant un ordre tiré au hasard.
2.2 Étude dans les plaques athéromateuses chez l’homme
Ce travail a été fait sur des échantillons recueillis chez des patients diabétiques et non diabétiques. Le protocole a été approuvé par le comité d’éthique de Lyon. Avec leur accord informé écrit, des pièces d’endartériectomie carotidienne, de tissu adipeux péricarotidien (au voisinage immédiat et à distance de la plaque) et sous-cutané (SC) du cou ont été recueillies durant l’opération de sujets atteints d’athérome carotidien (Pr Patrick Feugier). Les échantillons directement collectés dans la salle d’opération ont été immédiatement congelés dans de l’azote liquide. Ce travail a concerné 21 sujets (15 de sexe masculin et 6 de sexe féminin, d’un âge moyen de 70,95 ± 1,98 ans).
2.3 Techniques opératoires et analytiques
Afin de contrôler l’évolution métabolique des rats, nous avons réalisé des prélèvements de sang au niveau de la queue (à 7, 14 et 21 semaines pour le rat Zucker, trois prises de sang dans la journée précédent le sacrifice – 8 h, 13 h, 17 h – pour le rat stressé). Après centrifugation, le plasma est conservé à –80 °C pour le dosage des paramètres biochimiques – glycémie (glucomètre), triglycéridémie, cholestérolémie et acides gras non estérifiés (AGNE ; dosage enzymatique par le kit bioMérieux®), ainsi que pour le dosage de l’insuline (Rat Insulin ELISA, Mercodia) et TNFα (TNFα ELISA kit).
Au terme de l’expérimentation (21 semaines, stade du diabète non insulino-dépendant et deux semaines de stress pour les rats stressés), les rats sont sacrifiés après anesthésie au pentobarbital IP (6 mg/kg). Les différents types de TA (TAPA, TAE, TAR), sont prélevés rapidement et rincés dans du salé isotonique froid, puis congelés immédiatement dans l’azote liquide puis conservés à –80 °C jusqu’aux analyses ; les surrénales des rats stressés sont prélevées et pesées.
2.4 Mesures des ARNm et PCR quantitative en temps réel
Les ARN totaux sont extraits à partir des différents sites de TA chez le rat et chez l’homme selon la méthode du guanidium/thiocyanate/phénol/chloroforme (TRIZOL-Invitrogen®, Cergy-Pontoise, France) [29]. L’ARN total extrait est traité par la DNAse I (QIAGEN) ; sa concentration et sa pureté sont évaluées par densité optique à 230, 260 et 280 nm ; son intégrité est vérifiée par électrophorèse sur gel d’agarose.
Pour les mesures des taux d’ARNm, l’ARN total est rétrotranscrit avec une reverse transcriptase (SuperScript™, Invitrogen) en présence d’amorces au hasard et des hexamères de séquence aléatoire (Random Primer Promega).
La PCR est réalisée par l’appareil iCycler MyIQ (BIORAD, Marnes-la-Coquette, France) utilisant iQ SYBER green Supermix (Biorad). Pour mesurer l’expression des gènes cibles, une gamme étalon est préparée au même temps que les échantillons, en utilisant les amorces spécifiques pour chaque gène.
2.5 Statistiques
Les résultats sont exprimés en moyennes affectées de l’erreur standard. Les comparaisons sont été faites (Prism 5.02, GraphPad, San Diego, CA, États-Unis), soit par le test t de Student (two-tailed) pour les valeurs non appariées (comparaison de deux groupes) ou par analyse de variance à un facteur (ANOVA) (pour la comparaison de plusieurs groupes) suivie du test de Newman–Keuls (comparaison de tous les groupes entre eux) ou test de Dunnett (comparaison par rapport à un groupe de référence).
3 Résultats
3.1 Rat Zucker obèse
Il n’y a pas de différence significative de la glycémie entre les rats Zucker obèses et leurs contrôles correspondants à 7 et 14 semaines. Les triglycérides plasmatiques restent stables chez les animaux contrôles aux différents temps ; ils sont plus élevés chez les Zucker obèses ; comparativement à leurs contrôles ; nous enregistrons à 14 semaines (2,15 ± 0,30 mM vs 0,55 ± 0,07 mM). Le cholestérol plasmatique est élevé chez les Zucker obèses à 7,14 et 21 semaines. Il augmente avec l’âge chez les deux groupes. En ce qui concerne les acides gras non estérifiés (AGNE) plasmatiques, leur concentration ne change pas chez les rats Zucker contrôle. Chez les obèses, ils augmentent à partir de la quatorzième semaine (p < 0,001) (Tableau 1).
Paramètres métaboliques chez le rat Zucker obèse (ZO) et son contrôle (CO) à 7, 14 et 21 semaines d’expérimentation.
| CO | ZO | |
| Glucose mM | ||
| 7 semaines | 6,89 ± 0,13 | 7,56 ± 0,53 |
| 14 semaines | 7,52 ± 0,58 | 7,90 ± 0,34 |
| 21 semaines | 6,05 ± 0,64 | 10,59 ± 2,45*$ |
| Insuline μg/L | ||
| 7 semaines | 0,8 ± 0,4 | 4,8 ± 1,0** |
| 14 semaines | 1,70 ± 0,4 | 6,7 ± 0,3*** |
| 21 semaines | 1,2 ± 0,2 | 6,3 ± 0,5*** |
| Triglycérides mM | ||
| 7 semaines | 0,49 ± 0,09 | 1,19 ± 0,09** |
| 14 semaines | 0,55 ± 0,07 | 2,15 ± 0,30** |
| 21 semaines | 0,72 ± 0,17 | 3,73 ± 1,09*$ |
| Cholestérol mM | ||
| 7 semaines | 2,83 ± 0,13 | 4,35 ± 0,25 |
| 14 semaines | 2,94 ± 0,11 | 5,75 ± 0,24***$$ |
| 21 semaines | 3,77 ± 0,19$$ | 7,07 ± 1,05***$$ |
| AGNE mM | ||
| 7 semaines | 0,95 ± 0,7 | 0,90 ± 0,09 |
| 14 semaines | 0,74 ± 0,08 | 1,52 ± 0,08*** |
| 21 semaines | 0,75 ± 0,12 | 2,50 ± 0,44**$$ |
La mesure des ARNm des cytokines pro-inflammatoires (IL-6, MCP-1, TNFα, IL-1β) au niveau des différents sites de tissu adipeux rénal (TAR), épididymaire (TAE) et péri-aortique (TAPA) – a montré une augmentation significative (p < 0,01) de TNFα et IL-6 dans le TAR et le TAPA des rats Zucker obèses comparativement aux contrôles correspondants.
Les concentrations d’ARNm de MCP-1 ont enregistré une augmentation de 215 % et 569 % dans le TAR et TAPA des rats Zucker obèses comparativement à leur concentration dans le TA des rats contrôles. Cependant, étant donné les variations individuelles, l’étude statistique n’a pas montré de différence significative (Fig. 1).

Concentrations d’ARNm des gènes impliqués dans l’inflammation (TNFα, IL-6, MCP-1) dans les différents sites de tissu adipeux (TAE, TAR, TAPA) des rats Zucker contrôles et obèses.*p < 0,05, **p < 0,01 vs valeurs obtenues chez les rats Zucker contrôles.
3.2 Le rat stressé
Les valeurs de la glycémie ont été comparées entre les deux groupes à différents moments de la journée, 8 h, 13 h et 17 h. Une diminution significative de la glycémie est observée à 13 h et 17 h chez les rats stressés (Fig. 2). Ceci peut être expliqué par un changement du comportement alimentaire chez les rats stressés. Le stress a pu modifier la période d’alimentation des rats durant la nuit ainsi que la quantité consommée. De même, une diminution peu significative (p < 0,05) de la concentration en insuline est observée chez les rats stressés à 8 h ; cet écart s’estompe pour le reste de la journée (Fig. 2). Une diminution significative des triglycérides dans le foie des animaux stressés est observée (p < 0,01) (Fig. 3A). Le stress n’a pas donc entraîné une stéatose hépatique. Cette baisse pourrait être due à une diminution de la quantité de nourriture consommée la veille du sacrifice. La pesée des surrénales prélevées au moment du sacrifice, montre un poids plus élevé (*p < 0,05) chez le groupe ayant subi les exercices de stress (Fig. 3B).

Mesure de la glycémie et de l’insuline chez les rats stressés et leurs contrôles pendant trois temps différents de la journée. *p < 0,05 vs groupe contrôle.

A. Triglycérides hépatiques. B. Poids des surrénales. *p < 0,05, **p < 0,01 vs groupe contrôle.
Chez le rat Wistar soumis au stress, la mesure des ARNm de TNFα a montré une augmentation peu significative (p < 0,05) de ce gène dans le TAE et le TAPA des rats stressés comparativement aux rats contrôles. En ce qui concerne l’IL-6, la tendance à l’augmentation chez les rats stressés n’est pas significative. L’expression de MCP-1 est plus élevée dans le TAPA des animaux stressés comparativement aux contrôles (40,83 × 10−3 ± 13,49 × 10−3 ng/μg 18S vs 13,62 × 10−3 ± 3,42 × 10−3 ng/μg 18S). En ce qui concerne les ARNm de l’IL-1β dans le tissu adipeux, les animaux stressés et contrôles ne montrent pas de différence significative (Tableau 2).
Expression des gènes pro-inflammatoires (TNFα, IL-6, MCP-1, IL-1β) dans le tissu adipeux épididymaire (TAE) et périartériel (TAPA) des rats Wistar contrôles et stressés.
| TAE | TAPA | |||
| Contrôles | Stressés | Contrôles | Stressés | |
| TNF-α (ng/μg 18S) | 2,02 × 10−3 ± 0,3 × 10−3 | 4,78 × 10−3 ± 1,52 × 10−3* | 2,62 × 10−3 ± 0,57 × 10−3 | 7,52 × 10−3 ± 2,8 × 10−3* |
| IL-6 (ng/μg 18S) | 11,99 × 10−3 ± 6,11 × 10−3 | 18,82 × 10−3 ± 6,49 × 10−3 | 10,91 × 10−3 ± 2,83 × 10−3 | 49,03 × 10−3 ± 22,55 × 10−3 |
| MCP-1 (ng/μg 18S) | 48,36 × 10−3 ± 9,13 × 10−3 | 47,8 × 10−3 ± 23,26 × 10−3 | 13,62 × 10−3 ± 3,42 × 10−3 | 40,83 × 10−3 ± 13,49 × 10−3 |
| IL-1β (ng/μg 18S) | 3,00 × 10−3 ± 1,63 × 10−3 | 24,69 × 10−3 ± 20,49 × 10−3 | 1,38 × 10−3 ± 1,04 × 10−3 | 8,33 × 10−3 ± 6,06 × 10−3 |
3.3 Étude dans les plaques athéromateuses chez l’homme
Les sujets diabétiques de type 2 sont au nombre de 5, avec un diabétique de type 1 et un sujet avec un diabète insulino-requérant. Les paramètres biochimiques concernant ces sujets sont représentés dans le Tableau 3.
Biochimie clinique chez les patients diabétiques et non diabétiques.
| Glycémie (mmol/L) | Triglycérides (mmol/L) | Cholestérol (mmol/L) | HDL (mmol/L) | LDL (mmol/L) | ApoB g/L | Hémoglobine glyquée (%) | |
| Sujets non diabétiques | 5,00 ± 0,29 | 1,83 ± 0,17 | 4,18 ± 0,24 | 1,02 ± 0,04 | 2,25 ± 0,17 | 0,75 ± 0,03 | 5,85 ± 0,15 |
| Sujets diabétiques | 10,63 ± 1,87* | 2,72 ± 0,46* | 4,62 ± 0,32 | 0,94 ± 0,08 | 2,42 ± 0,22 | 0,89 ± 0,05 | 8,07 ± 0,94* |
Nous avons analysé l’expression de cytokines pro-inflammatoires TNF-α, IL-6 et MCP-1 dans le tissu adipeux au voisinage de la plaque (TAPAp) et dans celui situé à distance de la plaque (TAPAs), et également au niveau du tissu adipeux sous-cutané (TAssC) des sujets diabétiques et non diabétiques. Les résultats ont montré que les concentrations d’ARNm de de TNFα et d’IL-6 sont plus élevées dans le TAPAp et TAssC comparativement au TAPAs ; cependant, l’étude statistique n’a pas montré de différence significative. En ce qui concerne les ARNm de MCP-1, leur concentration est plus élevée dans le TAPAp comparativement au TAPAs et TAssC chez les sujets diabétiques (φφ < 0,01) ; nous enregistrons respectivement 3,49 × 10−2 ± 1,17 × 10−2 ng/μg 18S vs 7,17 × 10−3 ± 2,34 × 10−3 ng/μg 18S et 1,42 × 10−2 ± 4,70 × 10−3 ng/μg 18S.
Chez les sujets diabétiques, nous avons noté une augmentation peu significative de TNFα dans le TAssC comparativement aux sujets non diabétiques (1,60 × 10−3 ± 3,96 × 10−4 ng/μg 18S vs 0,74 × 10−3 ± 1,57 × 10−4 ng/μg 18S), *p < 0,05. Une augmentation également significative (**p < 0,01) est notée de MCP-1 dans le TAPAp chez les sujets diabétiques comparativement aux sujets non diabétiques ; nous enregistrons 3,49 × 10−2 ± 1,17 × 10−2 ng/μg 18S vs 7,26 × 10−3 ± 1,00 × 10−3 ng/μg 18S (Fig. 4).
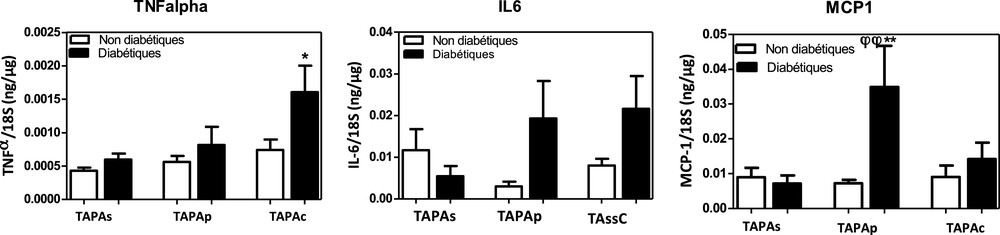
Les concentrations d’ARNm des gènes pro-inflammatoires (TNFα, IL-6, MCP-1) dans le tissu adipeux périartériel au voisinage de la plaque athéromateuse (TAPAp) et à distance de la plaque (TAPAs) et le tissu adipeux sous-cutané (TAssC). **p < 0,01 vs TAPAp chez les sujets non diabétiques, φ p < 0,01 vs TAPAs et TAssC chez les sujets diabétiques.
4 Discussion
Notre travail a porté sur l’expression des molécules pro-inflammatoires dans le tissu adipeux périartériel (TAPA) en comparaison avec d’autres sites de tissu adipeux sous-cutané (SC) et viscéral (épididymaire et rénal). Au cours de cette étude préliminaire, l’inflammation a été évaluée uniquement au niveau des ARNm. Pour cela, nous avons mené des études ex vivo chez l’homme, et, dans des modèles animaux d’obésité (rat Zucker obèse) et de stress (rat Wistar stressé). Notre but était de déterminer si le TAPA entourant la plaque d’athérome présente un état inflammatoire plus marqué que les autres sites de TA, d’une part, et si des facteurs de risques connus d’athérome (stress chronique, insulinorésistance, diabète) sont associés à un profil inflammatoire plus marqué, d’autre part. Nos résultats obtenus chez l’homme, ont montré une augmentation des cytokines pro-inflammatoires (TNFα, MCP-1, IL-6) dans le TAPA au niveau des plaques athéromateuses en comparaison avec leur expression dans le TAPA entourant la partie saine de la carotide. Cette augmentation est plus marquée chez les sujets diabétiques en comparaison avec les sujets non diabétiques.
Les résultats de Chatterjee et ses collaborateurs [19] ont montré, au niveau du TAPA humain prélevé chez des donneurs d’organes, que les adipocytes périvasculaires présentent un état pro-inflammatoire élevé et une différenciation adipocytaire réduite dans les conditions basales. Ces travaux ont montré également que le TAPA chez la souris est très sensible aux effets d’un régime riche en lipides, qui entraîne une réduction de l’expression des gènes associés à l’adipocyte (PPARγ, C/EBPα, et FABP), alors qu’il y a une augmentation des gènes pro-inflammatoires (IL-8 et MCP-1). Ces résultats de Chatterjee [19] ont été obtenus dans le TAPA chez l’homme et la souris en absence de processus athéroscléreux. Ils ont ainsi suggéré que le TAPA pourrait jouer un rôle primaire dans le développement de l’inflammation adventitielle qui contribue aux lésions athérosclérotiques.
L’obésité a atteint des proportions alarmantes dans les pays industrialisés ; elle constitue un important facteur de risque pour le développement de l’athérosclérose. Elle est associée à l’insulinorésistance, à la dyslipidémie et à l’augmentation des marqueurs inflammatoires circulants. Nos résultats chez le rat Zucker obèse ont montré une augmentation de TNFα, IL-6 et MCP-1 dans le TAPA en comparaison avec les autres sites de tissu adipeux viscéral (rénal et épididymaire). Ces résultats rejoignent ceux de Manka et ses collaborateurs [30] chez la souris après transplantation du TAPA en provenance de souris soumises à un régime riche en lipides ; cette transplantation a accéléré l’hyperplasie néo-intimale, l’infiltration de macrophages au niveau de l’adventice et l’angiogenèse adventitielle ; les mécanismes impliqués sont liés à l’expression de MCP-1.
Chez le rat Wistar soumis à un stress modéré, nous avons montré l’augmentation de l’expression de cytokines pro-inflammatoires (TNFα et IL-1β) dans le TA viscéral et de MCP-1 dans le TAPA. Ces résultats rejoignent ceux de Bailey–Downs [31] chez des souris soumises à un régime riche en lipides, qui ont montré une augmentation du stress oxydatif (accroissement de l’activité de la NADPH oxydase et diminution de la NO synthase endothéliale et de l’adiponectine) dans le TAPA, en association avec une augmentation de cytokines pro-inflammatoires (TNFα, IL-6) possédant plusieurs effets pathophysiologiques.
En conclusion, nos résultats chez l’homme ont montré que le TAPA est inflammatoire au niveau des plaques carotidiennes athéromateuses, et que cet état est accentué par le diabète. L’expérimentation animale menée au cours de notre étude a montré qu’un état d’obésité ou de stress est associé à un profil inflammatoire du tissu adipeux périvasculaire.
Référence non citée
[31].


