1. Introduction
Neisseria meningitidis (meningococcus) is a Gram-negative bacterium, famously known as the causative agent of cerebrospinal meningitis, but this diplococcus is also responsible for other forms of invasive disease, including septicaemia and peripheral purpuric lesions. Meningitis symptoms have been reported in ancient texts throughout history, including by Hippocrates and his followers, who described an acute inflammation of the brain or of the meninges accompanied with acute fever and delirium that they named phrenitis, a term used until the 19th century [1]. The description of the disease as a clinical entity was further reported by Gaspard Vieusseux in 1805 during the epidemic of cerebrospinal fever in Geneva. At the time, the disease was linked to particular properties of the air rather than to a contagious agent transmitted from individual to individual [2]. The bacterium was first observed in 1885 in the spinal fluid of a patient by the Italian pathologist Ettore Marchiafava, however, the causative link between the bacterium (then known as Diplococcus intracellularis meningitidis) and the epidemic cerebrospinal meningitidis was established in 1887 by the Austrian pathologist Anton Weichselbaum [3]. Successful therapy of meningococcal meningitis began in the first decade of the 20th century with the introduction of serum therapy by Simon Flexner [4]. Whereas the mortality rate for untreated meningococcal disease was 75–80%, treatment with serum prepared by injecting live and killed bacteria into horses reduced mortality rate to 30%. Antibiotic therapy began later with the introduction of sulfonamides in the 1930s and the discovery of penicillin by Alexander Fleming in 1941. It decreased mortality to approximately 15% [5]. This marked the start of the antibiotic era. Since then, meningococcal meningitis has become a curable illness, although the rates of morbidity and mortality remain unchanged [6, 7]. In the 1960s, sulfonamides became ineffective because of increased resistance to the drug. Although effective antibiotic therapy is still accessible for meningococcal diseases, antimicrobial resistance is an emerging threat that has become a global major health issue, undermining the future of antibiotic effectiveness.
Over the past two decades, our knowledge on meningococcal pathogenesis has tremendously expanded, providing important clues on the interaction of this bacterium with its host, and leading to the development of new therapeutic tools. Here we summarize the recent advance in our understanding of the initial pathophysiological steps of invasive meningococcal diseases, and we shed light on some promising novel therapeutic options.
2. Pathophysiology of invasive meningococcal disease
Neisseria meningitidis is strictly adapted to humans. This bacterium normally resides in the nasopharynx of approximately 10% of the population, as an asymptomatic carriage. Meningococci are transmitted among a population by person-to-person exchange of saliva and respiratory secretions, or by inhalation of fine bacterium-containing liquid droplets suspended in air. Only a small fraction of meningococcal strains, which cluster among a few phylogenetic lineages, are responsible for invasive meningococcal disease (IMD). Pathology is initiated when meningococci gain access to the bloodstream and successfully replicate in blood vessels despite host defenses. Blood borne dissemination of meningococci throughout the body can lead to different clinical forms of IMD, such as septicemia, meningitis and different peripheral manifestations such as purpura, pneumonia and, more rarely, septic arthritis or pericarditis [8]. The diversity of clinical symptoms induced by N. meningitidis reflects the compartmentalized intravascular peripheral and/or central bacterial growth and inflammation [9]. Meningitis, which is caused by the invasion of the central nervous system through the subarachnoid space, is observed in as many as 37–49% of patients with IMD. IMD can also rapidly evolves towards an acute septic shock in 10–18% of the patients. This can result in the formation of petechial rash and purpuric lesions due to meningococci-triggered thrombosis in blood vessels of skin microcirculation, leading to necrosis, disseminated intravascular coagulation, organ failure, and death of these patients despite prompt antimicrobial therapy [9]. 7–12% of patients with IMD present both shock and meningitis, whereas 18–33% have mild forms of the disease without shock or meningitis. 10%–20% of survivors develop long-term sequelae and lifelong morbidity, including limb loss, neurologic impairment, allergic complications, hearing loss. The onset of the disease is typically rapid and fulminant, and it mostly affects children under 2 years of age and young adults.
3. Meningococcal vaccines
To date, 12 capsular serogroups (A, B, C, E, H, I, K, L, W, X, Y, and Z) have been identified worldwide, but only 6 serogroups (A, B, C, W, X and Y) cause the vast majority of IMD cases. The dynamic epidemiology of these serogroups varies with time, geographical region and the impact of vaccination [6, 7]. Meningococcal meningitis is observed in a range of situations, from sporadic cases, small clusters, to epidemics throughout the world, with seasonal variations. The largest burden of meningococcal disease occurs in sub-Saharan Africa, known as the “meningitis belt”, which spans across 26 countries from Senegal in the West to Ethiopia in the East, where repeated pandemics of serogroup A disease have taken place. Currently, vaccines are available for all major disease-causing serogroups except serogroup X. Effective vaccines based on capsular polysaccharides have been developed for serogroups A (MenA), C (MenC), W (MenW), and Y (MenY). The similarity of the serogroup B polysaccharide to polysialic acid structures present on human neural cell adhesion molecule make this polysaccharide poorly immunogenic and with a theoretical risk for autoimmunity. Thus, another approach was set, using as antigens several proteins frequently found in serogroup B. However, the diversity of proteins expressed among serogroup B isolates make the protein-based vaccines only broadly protective as they do not cover all pathogenic B strains [10]. Over the past two decades, the meningococcal immunisation programs have reduced IMD incidence across most parts of the world [7, 11]. The introduction of MenC conjugate vaccines in the early 2000s was associated with rapid declines in meningococcal C disease in high-income countries, whilst implementation of a MenA conjugate vaccine since 2010 in the “meningitis belt” has led to near-elimination of meningococcal A disease during 2010–2015 [12]. However, capsule-switching, which is the change of capsular type within a meningococcal clone, as well as off-switching of capsular expression, is sometimes observed, thus modifying the epidemiology of IMD. Most IMD cases in Africa are now caused by MenC, MenW and MenX. In high-income countries, where long term MenC and MenACWY immunisation programs have been led, MenB is now the predominant serogroup responsible for most IMD cases [7, 11]. This evolution reveals the need for a universal multivalent meningococcal vaccine that would target all pathogenic meningococcal lineages.
Meningococcal type IV pili. (A) Scanning electron microscopy image of meningococci adhering at the surface of human endothelial cells. (B) High resolution image (direct stochastic optical reconstruction microscopy, dSTORM) of meningococci. (A, B) Note the presence of T4P, the long filamentous structures that form between bacteria. (C) Schematic representation of the Type IV pilus machinery. T4P are made of pilus subunits, which are processed before filament assembly by the prepilin peptidase PilD. Pilins are assembled into a long helical structure, which extrudes through a pore formed by the secretin PilQ at the outer membrane. PilQ recruits the PilNOP alignment subcomplex, which resides within the periplasm, the cytoplasmic protein PilM and the integral membrane protein PilG, also referred to as the platform protein. The major pilin PilE assembles with other low abundant (minor) pilins, such as PilV, PilX or Comp, which fine-tune pilus functions. The dynamic extension and retraction cycles of T4P are orchestrated by the two cytoplasmic ATPases, PilF and PilT, that power polymerization and depolymerization of the pilus polymer, respectively. Various proteins fine-tune the function, stability and dynamics of theT4P, including PilT orthologs, PilC and PilW proteins.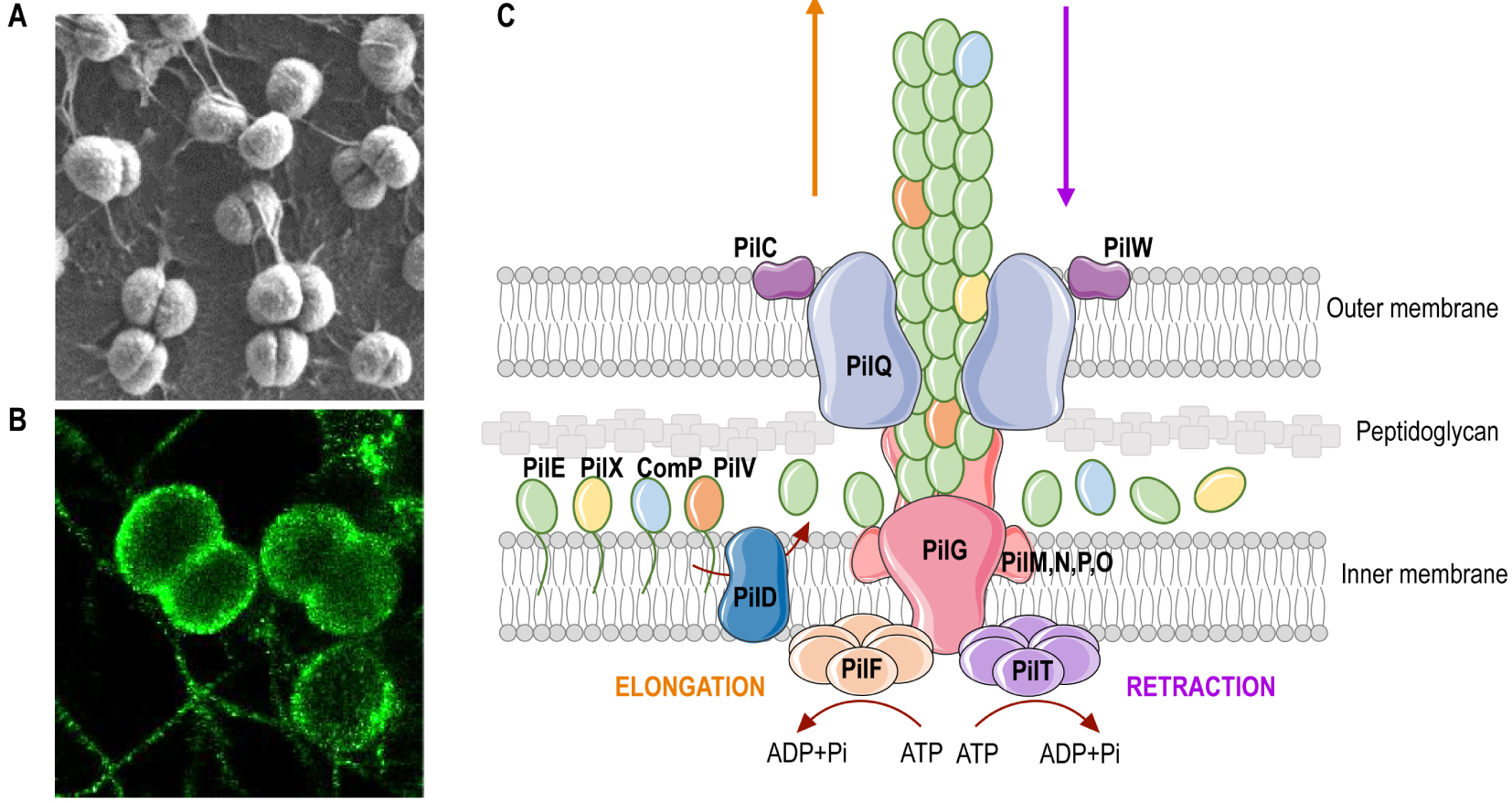
4. Virulence factors
The polysaccharidic capsule, together with the sialylated lipooligosaccharide (LOS) and factor H-binding protein (fHBP), play essential roles in bacterial survival in the bloodstream, through evasion of bactericidal activity of the complement, antibody recognition and phagocytosis by innate immune cells [13]. However, why some clonal complexes of N. meningitidis are more likely than others to cause invasive disease is unknown [14]. Pathogenesis has been linked to both host-dependent factors, such as deficiency in components of the complement system or other polymorphisms in genes involved in inflammation, immunity and coagulation [15, 16], as well as bacterial factors, such as the haemoglobin receptor HmbR [17] and a filamentous prophage [18], which were detected at a significantly higher frequency among disease-causing isolates than among carriage isolates.
Pilus-mediated interaction with human vessels. (A) Schematic representation of the T4P-mediated adhesion of meningococci to human endothelial cells. Circulating meningococci adhere to endothelial cells by a direct interaction between T4P and a complex formed by the two cell receptors CD147 and β2AR, stabilised at the endothelial cell surface by the scaffolding protein α-actinin-4. Both T4P components PilE and PilV are required to promote adhesion and signalling. These pilins display lectin-like activity and bind to specific glycans on both CD147 and β2AR. This interaction likely promotes conformational changes of the β2AR leading to its “biased” activation. (B) Images of human skin grafts isolated from non-infected and infected mice. Top row, Haematoxylin and eosin (HE) staining of the skin grafts, presenting signs of platelet and red blood cell aggregation in infected vessels. Second row, Immunofluorescence analysis of the skin grafts showing the human vessels (collagen IV), bacteria, platelet aggregation and nuclei.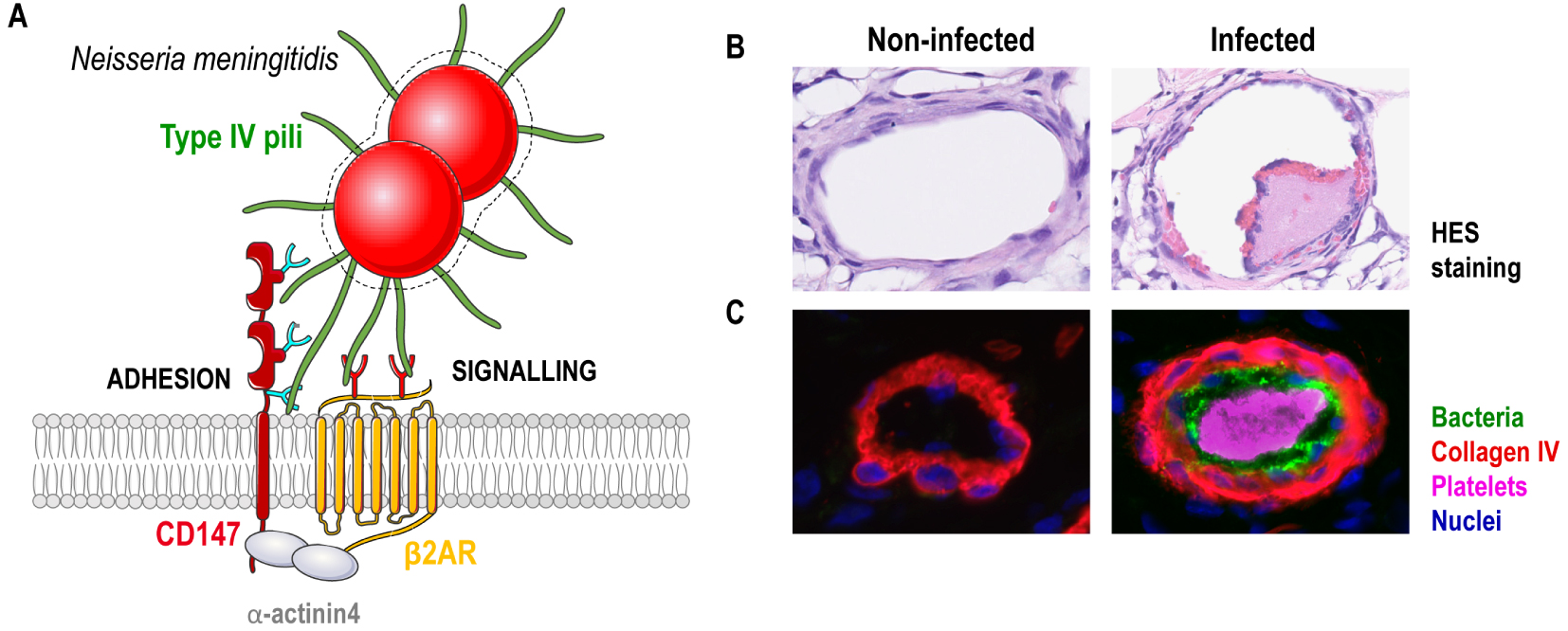
5. Type IV Pilus, a central player in meningococcal disease
Over the last decade, interaction of invasive bloodborne meningococci with endothelial cells that line blood vessels has emerged as a crucial step in meningococcal pathophysiology [19]. The intimate interaction of meningococci with peripheral blood vessels is responsible for the major endothelial dysfunctions, local thrombotic responses, vascular leakage and necrotic purpura [19]. Meningococci can also tightly interact with brain vessels, which form the blood–brain barrier (BBB) that secures neuronal homeostasis, and breach this tight barrier to reach the meninges and the cerebrospinal fluid where they replicate, causing meningitis [20, 21]. Meningococcal interaction with endothelial cells relies on meningococcal type IV pili (T4P), which have emerged as a major factor in meningococcal pathogenesis [22]. The T4P nanomachine, exceptionally widespread among bacteria and archaea, is involved in multiple functions, including motility, aggregation, DNA uptake, adhesion to abiotic and biotic surfaces or biofilm formation. As such, T4P has been designed as a prokaryotic Swiss Army knife [23, 24].
Made of the non-covalent assembly of pilus subunits, called pilins, which are processed before filament assembly by dedicated prepilin peptidases, T4P are long helical structures anchored in the inner membrane. They are actively extruded through a pore at the outer membrane and extend beyond the capsule (Figure 1) [23, 25]. T4P also retract, making them highly dynamic structures through the antagonistic action of two inner membrane-associated ATPases: PilF, which promotes fibre extension by the addition of pilin subunits from an inner-membrane reservoir, and PilT, which promotes fibre retraction through pilus disassembly and melting into the inner membrane. These dynamic elongation/retraction cycles generate forces that triggers movement within bacterial clusters, referred to as twitching motility [26].
A T4P fibre is primarily composed of the major pilin PilE [25]. Additional proteins are present in lower abundance although they are essential either to initiate pilus assembly or to promote additional functions such as DNA binding, aggregation and adherence [27]. Meningococcal T4P bind DNA through the minor pilin ComP via an electropositive stripe that is predicted to be exposed on the filaments surface and allows DNA to be pulled across the outer membrane upon pilus retraction [28, 29]. Bacterial aggregation and microcolony formation are mediated by the minor pilin PilX that allows interbacterial interactions due to intrinsic aggregative properties. [30]. Additionally, as clinical samples of N. meningitidis are invariably capsulated, T4P are the only mean by which bacteria can efficiently adhere to host endothelial cells [31]. Adhesion requires the contribution of both PilE and the minor pilin PilV [32, 33].
To address the role of meningococcal T4P in vivo, we circumvented the human specificity of this bacterium by establishing a humanized mouse model for meningococcal infection. In this model, SCID mice are grafted with human skin; as the human and host vessels anastomose, maintaining functional human blood vessels within the graft, this xenograft system is a unique tool to study bacterial interaction with human endothelial cells under realistic conditions in a live host [34, 35]. Using this model, demonstration has been made that both PilE and PilV are essential to promote vascular colonization of human vessels, and subsequent intravascular coagulation, inflammation and vascular leakage [33, 34] (Figure 2). It was further shown that adhesion to blood vessels provides a highly replicative niche for meningococci that seed the bloodstream from this reservoir, thus promoting sustained bacteraemia and lethality [36]. Pilus-retraction is not required for vessel colonization in vivo but it is necessary to release the T4P-dependent contacts between bacteria and, in turn, to bacterial detachment from colonized microvessels allowing sustained bacteremia [37]. Altogether, these studies have demonstrated the major role of T4P in promoting the early pathological events that pave the way towards IMD.
6. Host cell receptors for meningococcal type IV pili
A major challenge has been the identification of the cellular receptors for meningococcal T4P. It turns out that both PilE and PilV directly interact with a complex formed by at least two endothelial cell receptors, CD147 and the beta2-adrenergic receptor (β2AR), which act in concert to promote initial adhesion and signalling events leading to bacterial stabilization at the endothelial cell surface (Figure 2).
6.1. The adhesion receptor: CD147
To colonize human endothelia, meningococcal T4P first interact with CD147 (also called extracellular matrix metalloproteinase inducer (EMMPRIN) or Basigin) [33]. CD147 is a member of the immunoglobulin (Ig) superfamily composed of two extracellular Ig-like domains. It is broadly expressed on the surface of various cell types and plays diverse biological functions and regulatory mechanisms in human physiological and pathological processes, including the Ok blood group, cardiovascular system, nervous system, T cell-mediated immune responses and in the progression of many cancers by stimulating the secretion of matrix metalloproteinases (MMPs) and cytokines [38, 39]. It is also a well-known marker of brain capillaries, as it is highly expressed at the surface of cerebral endothelial cells where it plays a role in BBB development and control of BBB permeability [40, 41]. Interfering with T4P/CD147 interaction potently inhibited the primary attachment of meningococci to both peripheral and cerebral human endothelial cells in vitro and prevented colonization of vessels in human brain tissue explants ex vivo [33]. Consistent with neuropathological findings in patients with meningococcal meningitis, meningococci interacted in situ with CD147-positive brain vessels, predominantly in Virchow-Robin spaces and in cortical regions, and with CD147-positive leptomeningeal cells, whereas bacteria were not associated with glial or neuronal cells that do not express CD147 [33]. These results demonstrated that CD147 plays a critical role in the tropism of N. meningitis for human brain meninges. Protein–protein interaction analysis showed that PilE and PilV directly interact with the membrane proximal Ig domain of CD147, with an interaction strength in the range of CD147 interaction with its natural ligand cyclophilin A. Although of low affinity, this interaction is thought to be enhanced by the multimeric organization of the pilins along the pilus fibers and the accumulation of CD147 molecules at bacterial adhesion sites [33]. Interestingly, besides its critical role as host receptor for meningococcal T4P, CD147 was shown as an invasion receptor for Plasmodium falciparum entry in erythrocytes [42] and an epithelial entry receptor for several viruses including human immunodeficiency virus (HIV) [43], Human cytomegalovirus (HCMV) [44], measles virus (MeV) [45], severe acute respiratory syndrome coronavirus (SARS-CoV) [46] and more recently, for severe acute respiratory syndrome coronavirus 2 (SARS-CoV2) [47, 48]. As observed for Neisseria meningitidis, binding of P. falciparum or viruses to CD147 is responsible for their host specificity [45, 49, 50].
6.2. The signaling receptor: beta2-adrenergic receptor
Following bacterial adhesion, T4P interact with the β2AR, a member of the G protein coupled receptor family, physiologically involved in the control of the vascular tone by catecholamines. In contrast to β2AR agonists which engage the receptor in a binding pocket formed by the seven transmembrane helical domains of the receptor and promote the activation of the canonical cAMP production pathway through adenylyl cyclase and protein kinase A activation [51], meningococcal T4P directly interact with the extracellular N-terminus portion of β2AR. This unusual interaction promotes a “biased” activation of the β2AR, only accompanied by its phosphorylation by the GRK kinase and the recruitment of β-arrestins, two scaffold proteins involved in receptor signalling by forming complexes with several signalling proteins [52]. As a result, activation of the β2AR by meningococci induces the local reorganization of the cortical actin cytoskeleton and remodelling of the cell/cell junctions, contributing to both bacterial stability at the endothelial cell surface and vascular alterations [52, 53]. Interaction of PilE and PilV with CD147 is a pre-requisite to activate the β2AR. This cooperation is facilitated by the organisation of CD147 and β2AR in hetero-oligomeric complexes that are stabilized at the cell plasma membrane by the scaffolding protein α-actinin-4 [54]. α-actinin-4-driven organization of CD147/β2AR receptor complexes in highly ordered clusters is essential to provide β2AR activation and optimal binding strength for meningococcal adhesion to endothelia [54].
6.3. The role of carbohydrates in meningococcal receptor recognition
Both the Ig proximal domain of CD147 and the N-terminal portion of β2AR are heavily glycosylated, questioning the role of the carbohydrates in receptor recognition by meningococcal T4P. De facto, a large fraction of the microbial adhesins display a lectin activity and bind to specific glycans on host cells [55]. The wide structural diversity of carbohydrates allows many combinatorial possibilities for fine-tuning host-microbial interactions. It provides relatively strong tissue tropism and species-specific recognition [56]. However, such diversity makes it difficult to characterize the exact nature of the specific carbohydrate motifs recognized by microbial adhesins. Combining different approaches (mutagenesis, lectin affinity methods, enzymatic procedure and mass spectrometry analysis), the specific glycan determinants recognized by meningococcal T4P on both CD147 and β2AR have been identified [57, 58]. Adhesion to CD147 is provided by the recognition of a complex tri-antennary sialylated poly-N-acetyllactosamine-containing N-glycan presented on the N-glycosylation site of the membrane proximal domain of CD147. Notably, while this specific N-glycan may be naturally present on receptors other than CD147, it is differently fucosylated. Fucosidase treatment was then sufficient to promote adhesion, showing that fucosylation profile is an important determinant in the glycan recognition by meningococcal T4P and meningococcal tropism for its host [57]. Interaction of meningococcal T4P with the β2AR requires the two N-branched glycan chains exposed on the N-terminus portion of the receptor [58]. This recognition requires a terminally exposed N-acetylneuraminic acid (sialic acid, Neu5Ac). At the difference of most mammals that synthesize the sialic acid variant N-glycolylneuraminic acid (Neu5Gc) from Neu5Ac by the cytidine monophosphate-N-acetylneuraminic acid hydroxylase (CMAH), humans only express Neu5Ac because of a loss-of-function mutation in the human CMAH gene. This interaction might also play a determinant role in the host specificity of meningococci.
These studies hence revealed the molecular basis of selective receptor recognition by meningococcus that sustains its specific species recognition of humans. They open the path to the identification and synthesis of powerful inhibitors of adhesion that may form the basis for novel therapeutic agents to combat this infectious disease.
7. Type IV pili as targets for anti-virulence therapies
Much research has been conducted in recent years to improve treatments for infectious diseases, reduce adverse effects and overcome the emergence of antibiotic resistance. This implies the development of compounds that act on previously unutilized conserved targets. Recently, bacterial virulence properties have been revisited as attractive targets for the development of new therapeutic agents. From such a perspective, T4P represent particularly appealing virulence factor targets, as they are associated with a remarkable array of properties, ranging from motility to adhesion host cells, and are arguably one of the most widespread virulence factors [23, 26]. Two studies have recently reported the discovery of drugs promoting T4P disassembly. A high-throughput screen designed to identify compounds able to prevent T4P-dependent adhesion of meningococci to endothelial cells led to the identification of a molecule inhibiting the activity the ATPase PilF that promotes T4P assembly [59]. While another study has revealed that members of the phenothiazine family of drugs, in particular trifluoperazine and thioridazine previously used for years in human medicine to treat psychotic disorders, rapidly promote T4P disassembly by an alteration of the sodium gradient due to impaired activity of the Na+ pumping NADH-ubiquinone oxidoreductase (Na+-NQR) complex [60]. When administrated in infected human skin grafted mice, these phenothazines decreased meningococcal colonization of the human vessels, reduced associated vascular dysfunctions, intravascular coagulation and inflammation, and improved mouse survival. When used in combination with antibiotics, they reduced signs of exacerbated thrombosis and inflammation associated with antibiotic killing activity, demonstrating the potential benefit of these molecules in addition to antibiotic treatment [60]. Thioridazine and related molecules were well tolerated and effective at a dose regimen compatible with human use. They are therapeutically safe with few side effects, as proven by the 60-plus years they have been in use. These exciting observations enable to consider a repositioning for these drugs as adjuvant therapy for treatment of invasive meningococcal disease to reduce the heavy toll of purpuric lesions. The demonstration that such drugs are also efficient on other type IV pili-expressing bacterial pathogens (Neisseria gonorrhoeae and Pseudomonas aeruginosa) enlarges their broad applicability [60]. Due to the well-conserved set of proteins involved in T4P, the identification of agents targeting pilus assembly machinery represents particularly promising strategy to reduce virulence and combat infection diseases.
8. Conclusion
Despite large immunization programs, meningococcal disease remains capable of causing large outbreaks associated with severe disease and high case fatality. The moving panel of serogroups causing IMD in vaccinated countries reinforces the need for multivalent vaccines against all major meningococcal pathogenic lineages. Recent investigations have pointed to a key role of T4P in meningococcal pathogenesis, highlighting the interest of targeting these structures to reduce meningococcal virulence. Identification of the host receptor and the critical determinants recognized by T4P has opened novel perspective for treatment and prevention of meningococcus-induced vascular dysfunctions. Future studies will aim at identifying factors/pathways that would support vascular integrity/barrier function, implement endothelial cytoprotection mechanisms and limit detrimental haemostatic and inflammatory processes to reduce the heavy toll of these infections.
Conflict of interest
The authors have no conflict of interest to declare.
Acknowledgments
ISS and JZ are supported by the University Paris Descartes and the Fondation pour la Recherche Médicale, respectively. SB is supported by a collaborative research grants from the Agence Nationale de la Recherche (ANR-18-CE15-0019-01), the Fondation pour la Recherche Médicale (FRM EQU202003010400), INSERM, CNRS, and the Université de Paris.
French version
1. Introduction
Neisseria meningitidis (méningocoque) est une bactérie à Gram négatif, connue comme l’agent responsable de la méningite cérébrospinale, mais il existe d’autres manifestations cliniques associées aux infections invasives à méningocoque, telles que la septicémie associée dans les formes les plus graves à l’apparition de lésions purpuriques. Les symptômes de la méningite ont été rapportés tout au long de l’histoire depuis les textes anciens, notamment par Hippocrate et ses disciples qui ont décrit une inflammation aiguë du cerveau ou des méninges accompagnée d’une fièvre aiguë et d’un délire qu’ils ont nommé phrénite, un terme utilisé jusqu’au 19e siècle [1]. La description de la maladie en tant qu’entité clinique a ensuite été rapportée par Gaspard Vieusseux en 1805 lors de l’épidémie de fièvre cérébro-spinale à Genève. A l’époque, la maladie était liée à des propriétés particulières de l’air plutôt qu’à un agent contagieux transmis d’individu à individu [2]. La bactérie a été observée pour la première fois en 1885 dans le liquide céphalorachidien d’un patient par le pathologiste italien Ettore Marchiafava, mais le lien de causalité entre la bactérie (alors connue sous le nom de Diplococcus intracellularis meningitidis) et la méningite cérébrospinale épidémique a été établi en 1887 par le pathologiste autrichien Anton Weichselbaum [3]. Les premiers succès thérapeutiques pour la méningite à méningocoque sont arrivés dans la première décennie du 20e siècle avec l’introduction de la thérapie sérique par Simon Flexner [4]. Alors que le taux de mortalité des maladies à méningocoques non traitées était de 75 à 80%, le traitement avec le sérum, préparé par injection à des chevaux de bactéries vivantes ou inactivées, a réduit le taux de mortalité à 30%. L’antibiothérapie a commencé plus tard avec l’introduction des sulfamides dans les années 1930 et la découverte de la pénicilline par Alexander Fleming en 1941. Elle a permis d’abaisser la mortalité à environ 15% [5], marquant le début de l’ère des antibiotiques. Depuis lors, la méningite à méningocoque est devenue une maladie curable, bien que les taux de morbidité et de mortalité restent stables [6, 7]. Dans les années 1960, les sulfamides sont devenus inefficaces en raison d’une résistance accrue à ces antibiotiques. Bien qu’une antibiothérapie efficace soit encore accessible pour les infections à méningocoque, la résistance antimicrobienne est une menace émergente qui s’est imposée comme un problème de santé majeur à l’échelle mondiale, hypothéquant pour l’avenir l’efficacité des traitements antibiotiques actuels.
Au cours des deux dernières décennies, nos connaissances sur la pathogenèse du méningocoque se sont considérablement développées, fournissant des indices importants sur l’interaction de cette bactérie avec son hôte et conduisant au développement de nouveaux outils thérapeutiques. Nous résumons ici les progrès récents dans notre compréhension des étapes physiopathologiques initiales des maladies invasives à méningocoque, et nous mettons en lumière de nouvelles options thérapeutiques prometteuses.
2. Physiopathologie des maladies invasives à méningocoques
Neisseria meningitidis est strictement adapté à l’homme. Cette bactérie réside normalement dans le nasopharynx d’environ 10% de la population, sous forme de portage asymptomatique. Les méningocoques sont transmis entre individus au sein d’une population par l’échange de salive et de sécrétions respiratoires, ou par l’inhalation de fines gouttelettes liquides contenant la bactérie en suspension dans l’air. Seule une petite fraction des souches de méningocoques, regroupés au sein de quelques lignées phylogénétiques, est responsable des infections invasives à méningocoques (IIM). La pathologie est initiée lorsque les méningocoques accèdent fortuitement à la circulation sanguine et réussissent à se répliquer dans les vaisseaux sanguins malgré les défenses de l’hôte. La dissémination hématogène des méningocoques dans l’organisme peut conduire à différentes formes cliniques d’IIM, comprenant septicémie, méningite, différentes manifestations périphériques : purpura, pneumopathie et, plus rarement, arthrite septique ou péricardite [8]. La diversité des symptômes cliniques induits par N. meningitidis reflète l’inflammation générée par la croissance bactérienne au niveau intravasculaire, périphérique et/ou central [9]. La méningite, qui est causée par l’invasion du système nerveux central à travers l’espace sous-arachnoïdien, est observée chez 37 à 49% des patients atteints d’une IIM. L’IIM peut également évoluer rapidement vers un choc septique aigu pour 10–18% des patients. Cela peut entraîner la formation d’une éruption pétéchiale et de lésions purpuriques dues à la thrombose déclenchée par les méningocoques dans les microvaisseaux cutanés, conduisant à la nécrose, à une coagulation intravasculaire disséminée, à la défaillance des organes et au décès de ces patients malgré une thérapie antimicrobienne précoce [9]. 7–12% des patients atteints d’IIM présentent à la fois un choc septique et une méningite, tandis que 18–33% ont des formes légères de la maladie sans choc ni méningite. 10 à 20% des survivants développent des séquelles à long terme et une morbidité permanente, notamment par amputation, atteinte neurologique, complications allergiques ou perte auditive. Le début de la maladie est généralement rapide et fulminant, et elle touche surtout les enfants de moins de 2 ans et les jeunes adultes.
3. Vaccins antiméningococciques
À ce jour, 12 sérogroupes capsulaires (A, B, C, E, H, I, K, L, W, X, Y et Z) ont été identifiés dans le monde, mais seuls 6 sérogroupes (A, B, C, W, X et Y) sont à l’origine de la grande majorité des cas d’IIM. La dynamique épidémiologique de ces sérogroupes varie avec le temps, la région géographique et l’impact de la vaccination [6, 7]. La méningite à méningocoque est observée dans le monde entier sous diverses formes (cas sporadiques, cas groupés, épidémies régionales ou pandémies pouvant toucher plusieurs pays), avec des variations saisonnières. C’est en Afrique subsaharienne, connue sous le nom de « ceinture de la méningite », que le fardeau des infections à méningocoque est le plus lourd. Cette région s’étend sur 26 pays, du Sénégal à l’ouest à l’Éthiopie à l’est, où des pandémies répétées d’infection à sérogroupe A ont eu lieu. Actuellement, des vaccins sont disponibles pour tous les principaux sérogroupes pathogènes, à l’exception du sérogroupe X. Des vaccins efficaces basés sur les polysaccharides capsulaires ont été développés pour les sérogroupes A (MenA), C (MenC), W (MenW) et Y (MenY). La similarité du polysaccharide du sérogroupe B avec les structures d’acide polysialique présentes sur des molécules d’adhésion des cellules neurales humaines rend ce polysaccharide peu immunogène et confère un risque théorique d’auto-immunité. Une autre approche a donc été adoptée, utilisant comme antigènes plusieurs protéines fréquemment retrouvées au sein du sérogroupe B. Cependant, la diversité des protéines exprimées parmi les isolats du sérogroupe B fait que ces vaccins ne confèrent qu’une protection incomplète car ils ne couvrent pas toutes les souches B pathogènes [10]. Au cours des deux dernières décennies, les programmes de vaccination contre le méningocoque ont permis de réduire l’incidence des IIM dans la plupart des régions du monde [7, 11]. L’introduction des vaccins conjugués MenC au début des années 2000 a été associée à un déclin rapide des maladies à méningocoques C dans les pays à haut revenu, tandis que la mise en œuvre d’un vaccin conjugué MenA depuis 2010 dans la « ceinture de la méningite » a conduit à la quasi-élimination des maladies à méningocoques A entre 2010 et 2015 [12]. Cependant, le « capsule-switching », qui est le changement de type capsulaire au sein d’un clone méningococcique, ainsi que le « off-switching » de l’expression capsulaire, sont parfois observés, modifiant ainsi l’épidémiologie des IIM. La plupart des cas d’IIM en Afrique sont maintenant causés par MenC, MenW et MenX. Dans les pays à revenu élevé, où des programmes de vaccination à long terme contre MenC et MenACWY ont été menés, MenB est maintenant le sérogroupe prédominant responsable de la plupart des cas d’IIM [7, 11]. Cette évolution révèle la nécessité d’un vaccin méningococcique universel multivalent qui ciblerait toutes les lignées méningococciques pathogènes.
Pili de type IV du méningocoque. (A) Image en microscopie électronique à balayage de méningocoques adhérant à la surface de cellules endothéliales humaines. (B) Image haute résolution (microscopie optique stochastique de reconstruction, dSTORM) de méningocoques. (A, B) Notez la présence des T4P, les longues structures filamenteuses qui se forment entre les bactéries. (C) Représentation schématique de la machinerie des pili de type IV. Les T4P sont constitués de sous-unités de pilines, produites sous formes de prépilines, clivées avant assemblage par la peptidase PilD. Les pilines sont assemblées en une longue structure hélicoïdale qui s’extrude à travers un pore formé par la sécrétine PilQ au niveau de la membrane externe. PilQ recrute le sous-complexe d’alignement PilNOP, qui réside dans le périplasme, la protéine cytoplasmique PilM et la protéine intégrale de membrane PilG, également appelée protéine plate-forme. La piline majeure PilE s’assemble avec d’autres pilines peu abondantes (mineures), telles que PilV, PilX ou Comp, qui confèrent aux pilus ses fonctions. Les cycles dynamiques d’extension et de rétraction des T4P sont orchestrés par deux ATPases cytoplasmiques, PilF et PilT, qui assurent respectivement la polymérisation et la dépolymérisation du pilus. Diverses protéines régulent la fonction, la stabilité et la dynamique des T4P, notamment les orthologues de PilT, les protéines PilC et PilW.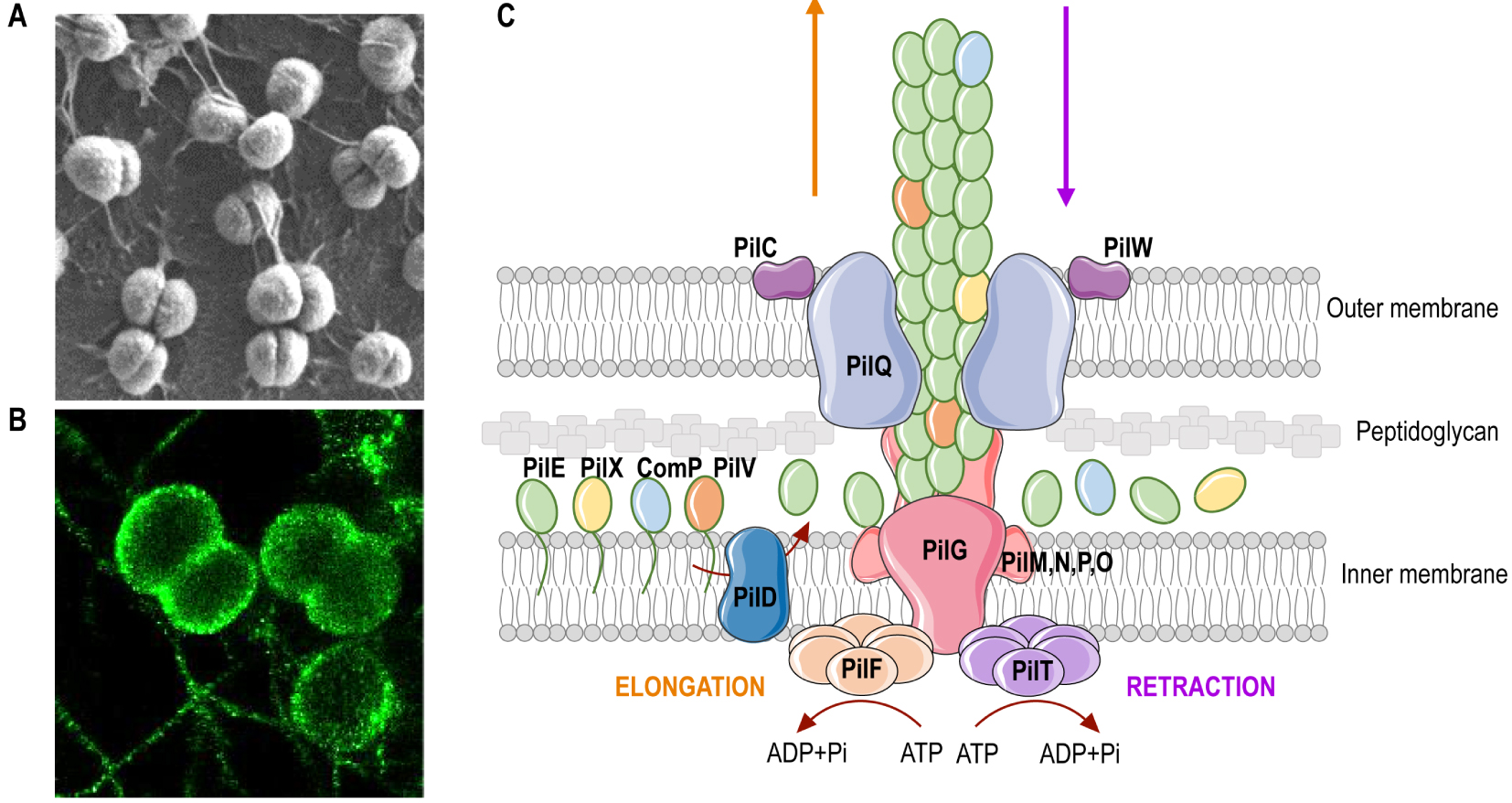
4. Facteurs de virulence
La capsule polysaccharidique, ainsi que le lipooligosaccharide sialylé (LOS) et la protéine de liaison au facteur H (fHBP), jouent un rôle essentiel dans la survie des bactéries dans la circulation sanguine, en permettant l’échappement à l’activité bactéricide du complément, à la reconnaissance des anticorps et à la phagocytose par les cellules immunitaires innées [13]. Cependant, on ignore pourquoi certains complexes clonaux de N. meningitidis sont plus susceptibles que d’autres de provoquer une maladie invasive [14]. La pathogénie dépend à la fois de facteurs liés à l’hôte, tels qu’une déficience en composants du système du complément ou de polymorphismes dans des gènes impliqués dans l’inflammation, l’immunité et la coagulation [15, 16], et à des facteurs bactériens, tels que le récepteur de l’hémoglobine HmbR [17] et un prophage filamenteux [18], qui ont été détectés à une fréquence significativement plus élevée parmi les isolats pathogènes que parmi les isolats retrouvés en portage.
Interaction avec les vaisseaux humains médiée par les pili de Type IV. (A) Représentation schématique de l’adhésion des méningocoques aux cellules endothéliales humaines médiée par les T4P. Les méningocoques circulants adhèrent aux cellules endothéliales via une interaction directe entre les T4P et un complexe formé par les deux récepteurs cellulaires CD147 et β2AR, stabilisés à la surface des cellules endothéliales par la protéine d’échafaudage α-actinine-4. Les deux composants des T4P, PilE et PilV, sont nécessaires pour promouvoir l’adhésion et la signalisation. Ces pilines présentent une activité de type lectine et se lient à des glycanes spécifiques sur CD147 et β2AR. Cette interaction favorise probablement les changements de conformation du β2AR conduisant à son activation « biaisée ». (B) Images de greffons de peau humaines isolées de souris non infectées et infectées. Rangée supérieure, coloration à l’hématoxyline et à l’éosine (HE) des greffons cutanés, présentant des signes d’agrégation des plaquettes et des globules rouges dans les vaisseaux infectés. Deuxième ligne, analyse par immunofluorescence des greffons cutanés montrant les vaisseaux humains (collagène IV), les bactéries, l’agrégation des plaquettes et les noyaux.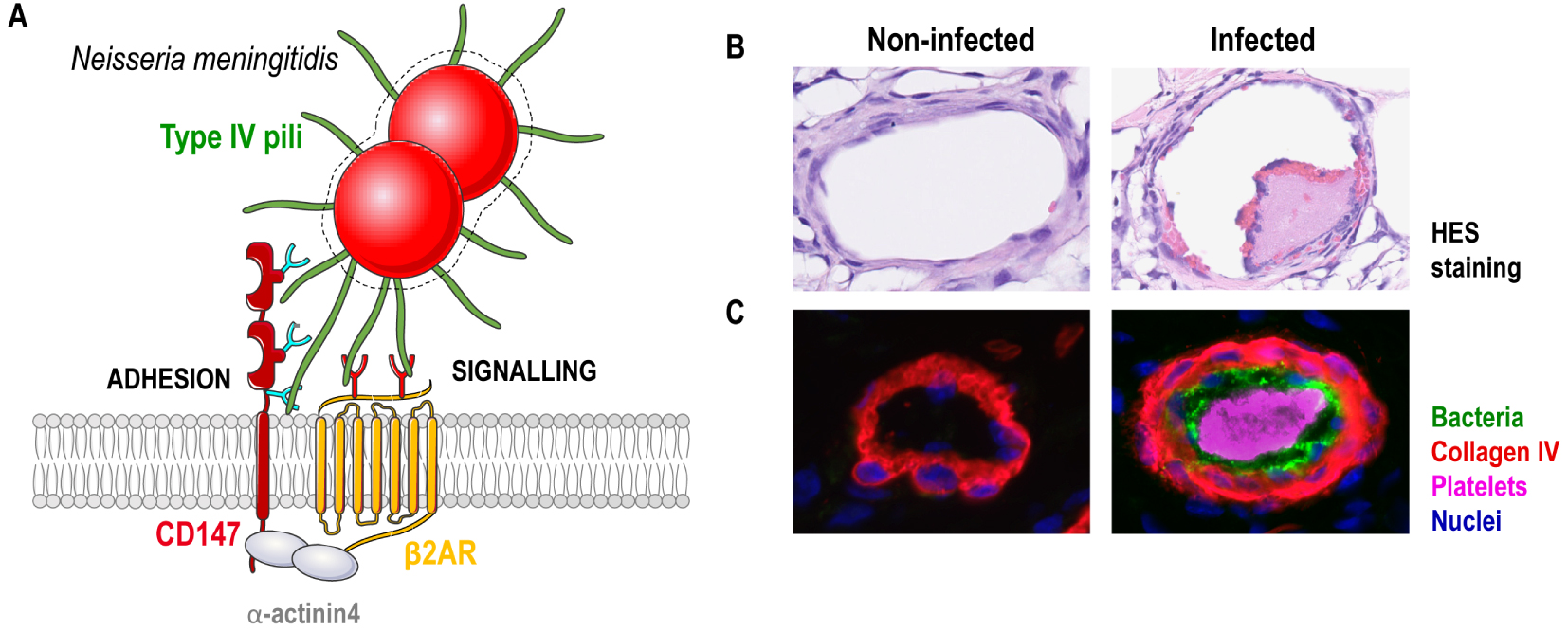
5. Le pilus de type IV, un acteur central des maladies a meningocoque
Au cours de la dernière décennie, l’interaction des méningocoques parvenus jusqu’à la circulation sanguine avec les cellules endothéliales qui tapissent les vaisseaux sanguins est apparue comme une étape cruciale de la physiopathologie des méningocoques [19]. Au niveau périphérique, cette interaction intime avec les vaisseaux sanguins est responsable de dysfonctions endothéliales, d’une réponse thrombotique locale, de fuites vasculaires et du purpura nécrotique [19]. Au niveau central, l’interaction avec les vaisseaux de la barrière hémato-encéphalique (BHE) conduit au franchissement de cette barrière normalement étanche qui assure l’homéostasie neuronale, pour atteindre les méninges et le liquide céphalo-rachidien où la réplication du méningocoque provoque une méningite [20, 21]. L’interaction avec les cellules endothéliales repose sur les pili de type IV (T4P) portés par le méningocoque qui sont apparus comme un facteur majeur dans la pathogenèse du méningocoque [22]. La nanomachine T4P, largement répandue chez les bactéries et les archées, est impliquée dans de multiples fonctions, notamment la motilité, l’agrégation, l’absorption d’ADN, l’adhésion à des surfaces abiotiques et biotiques ou la formation de biofilms. À ce titre, les T4P peuvent apparaître comme un « couteau suisse » procaryote [23, 24].
Constitués de l’assemblage non covalent de sous-unités appelées pilines, préalablement soumises à l’action d’une prépiline peptidase, les T4P sont de longs filaments de structure hélicoïdale, ancrés dans la membrane interne. Elles sont activement extrudées à travers un pore de la membrane externe et s’étendent au-delà de la capsule (Figure 1) [23, 25]. Les T4P peuvent également se rétracter, ce qui en fait des structures très dynamiques grâce à l’action antagoniste de deux ATPases associées à la membrane interne : PilF, qui favorise l’extension des fibres par l’ajout de sous-unités de piline provenant d’un réservoir de la membrane interne, et PilT, qui favorise la rétraction des fibres par le désassemblage des pili et leur réintégration dans la membrane interne. Ces cycles dynamiques d’élongation/rétraction génèrent des forces qui déclenchent des mouvements au sein des amas bactériens, appelés « twitching » ou motilité par secousses [26].
En plus de la piline principale PilE [25], les T4P sont composés d’autres pilines dites mineures car présentes en plus faible quantité mais qui s’avèrent essentielles pour initier l’assemblage du pilus ou pour promouvoir des fonctions spécifiques telles que la liaison à l’ADN, l’agrégation et l’adhérence [27]. Les T4P lient l’ADN grâce à la piline mineure ComP, sur une région électropositive exposée à la surface des filaments. L’ADN est alors tracté à travers la membrane externe lors de la rétraction du pilus [28, 29]. L’agrégation bactérienne et la formation de microcolonies sont médiées par la piline mineure PilX qui permet les interactions inter-bactériennes grâce à ses propriétés agrégatives intrinsèques [30]. De plus, comme les échantillons cliniques de N. meningitidis sont invariablement capsulés, le T4P est le seul moyen par lequel les bactéries peuvent adhérer efficacement aux cellules endothéliales de l’hôte [31]. L’adhésion nécessite la contribution de PilE et de la piline mineure PilV [32, 33].
Pour étudier le rôle du T4P méningococcique in vivo, nous avons contourné la spécificité humaine de cette bactérie en établissant un modèle murin humanisé d’infection méningococcique. Dans ce modèle, des souris SCID sont greffées avec de la peau humaine. L’anastomose entre les vaisseaux humains et les vaisseaux de l’hôte maintient la fonctionnalité des vaisseaux sanguins humains dans la greffe. Ce système de xénogreffe est un outil unique pour étudier fidèlement l’interaction bactérienne avec les cellules endothéliales humaines chez un hôte vivant [34, 35]. Ce modèle a permis de montrer que PilE et PilV sont essentiels pour promouvoir la colonisation vasculaire des vaisseaux humains, la coagulation intravasculaire, l’inflammation et la fuite extravasculaire qui s’ensuivent [33, 34] (Figure 2). L’adhésion aux vaisseaux sanguins fournit ainsi une niche hautement réplicative pour les méningocoques qui diffusent dans la circulation générale à partir de ce réservoir, favorisant une bactériémie durable et la létalité [36]. La rétraction du pilus n’est pas nécessaire pour la colonisation des vaisseaux in vivo, mais elle est essentielle pour dissocier les amas de bactéries tenues entre elles par leurs T4P et les libérer dans le flux sanguin, ce qui permet une bactériémie durable [37]. Dans l’ensemble, ces études ont démontré le rôle majeur des T4P dans la promotion des événements pathologiques précoces qui ouvrent la voie aux IIM.
6. Récepteurs des cellules hôtes pour les pili de type IV du méningocoque
Une étape majeure a été l’identification des récepteurs cellulaires pour les T4P méningococciques. Il s’avère que PilE et PilV interagissent directement avec un complexe formé par au moins deux récepteurs des cellules endothéliales, CD147 et le récepteur bêta2-adrénergique (β2AR), qui agissent de concert pour promouvoir l’adhésion initiale et les événements de signalisation conduisant à la stabilisation de la bactérie à la surface des cellules endothéliales (Figure 2).
6.1. Le récepteur d’adhésion : CD147
Pour coloniser les endothéliums humains, les T4P du méningocoque interagissent d’abord avec CD147 (également appelé extracellular matrix metalloproteinase inducer (EMMPRIN) ou Basigin) [33]. CD147 est un membre de la superfamille des immunoglobulines (Ig) composé de deux domaines extracellulaires de type Ig. Il est largement exprimé à la surface de divers types de cellules et joue diverses fonctions biologiques et mécanismes de régulation dans les processus physiologiques et pathologiques humains, notamment le groupe sanguin O, le système cardiovasculaire, le système nerveux, les réponses immunitaires médiées par les cellules T et dans la progression de nombreux cancers en stimulant la sécrétion de métalloprotéinases matricielles (MMP) et de cytokines [40, 41]. C’est également un marqueur bien connu des capillaires cérébraux car il est fortement exprimé à la surface des cellules endothéliales cérébrales où il joue un rôle dans le développement de la BHE et le contrôle de sa perméabilité [42, 43]. L’inhibition de l’interaction T4P/CD147 prévient la fixation initiale des méningocoques aux cellules endothéliales humaines périphériques et cérébrales in vitro et empêche la colonisation des vaisseaux dans des explants de tissu cérébral humain ex vivo [33]. Conformément aux observations anatomopathologiques obtenues chez les patients atteints de méningite à méningocoque, les bactéries ont interagi in situ avec les vaisseaux cérébraux CD147-positifs, principalement dans les espaces de Virchow-Robin et dans les régions corticales, et avec les cellules leptoméningées CD147-positives. A l’opposé, le méningocoque n’était pas associé aux cellules gliales ou neuronales qui n’expriment pas CD147 [33]. Ces résultats ont démontré que CD147 joue un rôle critique dans le tropisme de N. meningitis pour les méninges du cerveau humain. L’analyse des interactions protéine–protéine a montré que PilE et PilV interagissent directement avec le domaine Ig de CD147 proximal à la membrane, avec une force d’interaction comparable à celle de CD147 avec son ligand naturel, la cyclophiline A. Bien que de faible affinité, cette interaction est probablement renforcée par l’organisation multimérique des pilines le long des fibres du pilus et l’accumulation de récepteurs CD147 aux sites d’adhésion bactérienne [33]. Il est intéressant de noter qu’en plus de son rôle essentiel de récepteur de l’hôte pour les T4P du méningocoque, CD147 est également un récepteur d’invasion pour l’entrée de Plasmodium falciparum dans les érythrocytes [44] et un récepteur épithélial pour plusieurs virus, notamment le virus de l’immunodéficience humaine (VIH) [45], le cytomégalovirus humain (HCMV) [46], le virus de la rougeole (MeV) [47], le coronavirus du syndrome respiratoire aigu sévère (SARS-CoV) [48] et, plus récemment, le coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV2) [49, 50]. Comme cela a été observé pour N. meningitidis, la liaison de P. falciparum ou de virus à CD147 est responsable de leur spécificité d’hôte [47, 51, 52].
6.2. Le récepteur de signalisation : le récepteur bêta2-adrénergique
Suite à l’adhésion bactérienne, les T4P interagissent avec le β2AR, un membre de la famille des récepteurs couplés aux protéines G, physiologiquement impliqué dans le contrôle du tonus vasculaire par les catécholamines. Contrairement aux agonistes du β2AR qui engagent le récepteur dans une poche formée par les sept domaines transmembranaires du récepteur et favorisent l’activation de la voie canonique de production d’AMPc par l’activation de l’adénylyl cyclase et de la protéine kinase A [53], les T4P du méningocoque interagissent directement avec la partie extracellulaire N-terminale du β2AR. Cette interaction inhabituelle favorise une activation « biaisée » du β2AR, uniquement accompagnée de sa phosphorylation par la kinase GRK et du recrutement des β-arrestines, deux protéines d’échafaudage impliquées dans la signalisation des récepteurs en formant des complexes avec plusieurs protéines de signalisation [38]. En conséquence, l’activation du β2AR par le méningocoque induit la réorganisation locale du cytosquelette d’actine cortical et le remodelage des jonctions cellule/cellule, contribuant à la fois à la stabilité bactérienne à la surface des cellules endothéliales et aux altérations vasculaires [38, 54]. L’interaction de PilE et PilV avec CD147 est un pré-requis pour activer le β2AR. Cette coopération est facilitée par l’organisation de CD147 et de β2AR en complexes hétéro-oligomériques qui sont stabilisés à la membrane plasmique cellulaire par la protéine d’échafaudage α-actinine-4 [39]. L’organisation, sous l’impulsion de l’α-actinine-4, des complexes de récepteurs CD147/β2AR en clusters hautement ordonnés est essentielle pour assurer l’activation du β2AR et une force de liaison optimale pour l’adhésion des méningocoques aux endothéliums [39].
6.3. Le rôle des glucides dans la reconnaissance des récepteurs du méningocoque
Le domaine Ig proximal de CD147 et la partie N-terminale de β2AR sont tous deux fortement glycosylés, ce qui suggérait un rôle des carbohydrates dans la reconnaissance du récepteur par le T4P du méningocoque. De fait, de nombreuses adhésines microbiennes présentent une activité de lectine et se lient à des glycanes spécifiques sur les cellules hôtes [55]. La grande diversité structurelle des carbohydrates offre de nombreuses combinaisons d’interactions hôte-microbe. Elle permet un tropisme tissulaire fort et une reconnaissance spécifique des espèces [56]. Cependant, cette diversité rend difficile la caractérisation de la nature exacte des motifs glucidiques spécifiques reconnus par les adhésines microbiennes. En combinant différentes approches (mutagenèse, méthodes d’affinité avec les lectines, procédure enzymatique et analyse par spectrométrie de masse), les structures glycaniques spécifiquement reconnues par les T4P du méningocoque sur CD147 et β2AR ont été identifiées [57, 58]. La liaison à CD147 est assurée par la reconnaissance d’un N-glycane complexe tri-antenné sialylé contenant un poly-N-acétyllactosamine présenté sur le domaine Ig proximal à la membrane de CD147. Alors que ce N-glycane spécifique peut être naturellement présent sur des récepteurs autres que CD147, il est différemment fucosylé. Un traitement à la fucosidase est alors suffisant pour favoriser l’adhésion, montrant que le profil de fucosylation est un déterminant important dans la reconnaissance des glycanes par les T4P du méningocoque et le tropisme du méningocoque pour son hôte [57]. L’interaction des T4P du méningocoque avec le β2AR nécessite les deux chaînes branchées de N-glycanes exposées sur la partie N-terminale du récepteur [58]. Cette reconnaissance nécessite un acide N-acétylneuraminique exposé en position terminale (acide sialique, Neu5Ac). A la différence de nombreux mammifères, les humains sont incapables de synthétiser un acide syalique N-glycolylneuraminique (Neu5Gc) à partir du Neu5Ac grâce à la cytidine monophosphate-N-acétylneuraminique hydroxylase (CMAH), puisqu’ils présentent une mutation de perte de fonction dans ce gène. Aussi, cette interaction pourrait également largement participer à la spécificité d’hôte du méningocoque.
Ces études ont donc révélé les bases moléculaires de la reconnaissance sélective des récepteurs CD147 et β2AR par le méningocoque, faisant de ce dernier un pathogène strictement humain. Elles ouvrent la voie à l’identification et à la conception de puissants inhibiteurs de l’adhésion qui pourraient constituer de nouveaux agents thérapeutiques contre cette maladie infectieuse.
7. Les pili de type IV comme cibles pour les thérapies anti-virulence
De nombreuses recherches ont été menées ces dernières années pour les traitements des maladies infectieuses, dans l’objectif d’améliorer leur action, de réduire des effets indésirables et de contourner l’émergence de la résistance aux antibiotiques. Cela implique le développement de composés qui agissent sur des cibles conservées jusqu’alors inexploitées. Récemment, des effecteurs de la virulence bactérienne ont été revisités comme des cibles attractives pour le développement de nouveaux agents thérapeutiques. Dans cette perspective, les T4P sont des candidats particulièrement intéressants car ils confèrent un grand nombre de propriétés aux bactéries et ils sont très répandus [23, 26]. Deux études ont récemment identifié des molécules favorisant le désassemblage des T4P. Un criblage à haut débit conçu pour identifier des composés capables de prévenir l’adhésion des méningocoques aux cellules endothéliales dépendante des T4P a conduit à l’identification d’une molécule inhibant l’activité de l’ATPase PilF qui favorise l’assemblage des T4P [59]. Une autre étude a révélé que les composés de la famille des phénothiazines, en particulier la trifluopérazine et la thioridazine, utilisées depuis des années en médecine humaine pour traiter les troubles psychotiques, favorisent le désassemblage rapide des T4P par une altération du gradient de sodium due à une activité réduite du complexe Na+ NADH-ubiquinone oxydoréductase (Na+-NQR) [60]. Administrées à des souris greffées avec de la peau humaine et infectées par le méningocoque, ces phénothazines réduisent la colonisation des vaisseaux humains par le méningocoque, les dysfonctionnements vasculaires, coagulation intravasculaire et inflammation associées , et améliorent la survie des souris. Utilisées en association avec des antibiotiques, elles réduisent les signes de thrombose exacerbée et d’inflammation associés à l’action bactériolytique des antibiotiques, démontrant le bénéfice potentiel de ces molécules en complément d’un traitement antibiotique [60]. La thioridazine et les molécules apparentées ont été bien tolérées et efficaces à un régime de dose compatible avec l’utilisation humaine. Elles sont thérapeutiquement sûres et présentent peu d’effets secondaires, comme le prouvent les plus de 60 ans d’utilisation chez l’homme. Ces observations exaltantes permettent d’envisager un repositionnement de ces médicaments comme thérapie adjuvante pour le traitement des maladies invasives à méningocoques afin de réduire le lourd tribut des lésions purpuriques. La démonstration que ces médicaments sont également efficaces contre d’autres bactéries pathogènes exprimant des pili de type IV (Neisseria gonorrhoeae et Pseudomonas aeruginosa) élargit leur champ d’application [60]. En raison de l’ensemble bien conservé des protéines impliquées dans la biogenèse des T4P, l’identification d’agents ciblant la machinerie d’assemblage des T4P représente une stratégie particulièrement prometteuse pour réduire la virulence et combattre les maladies infectieuses.
8. Conclusion
Malgré les vastes programmes de vaccination, les infections invasives à méningocoque continuent de provoquer de grandes épidémies associées une létalité élevée. Le panel mouvant de sérogroupes à l’origine des IIM dans les pays à fort taux de vaccination renforce le besoin de vaccins multivalents contre tous les sérogroupes de méningocoques pathogènes. Des recherches récentes ont mis en évidence un rôle clé des T4P dans la pathogenèse du méningocoque, soulignant l’intérêt de cibler ces structures pour réduire sa virulence. L’identification des récepteurs cellulaires des T4P et des déterminants critiques reconnus par les T4P a ouvert de nouvelles perspectives pour le traitement et la prévention des dysfonctionnements vasculaires induits par les méningocoques. Les études futures viseront à identifier les facteurs/voies qui soutiendraient l’intégrité vasculaire/fonction de barrière, à mettre en œuvre des mécanismes de cytoprotection endothéliale et à limiter les processus hémostatiques et inflammatoires néfastes afin de réduire le lourd tribut de ces infections.
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêt à déclarer.
Remerciements
ISS et JZ sont soutenus par l’Université Paris Descartes et la Fondation pour la Recherche Médicale, respectivement. SB est soutenue par une bourse de recherche collaborative de l’Agence Nationale de la Recherche (ANR-18-CE15-0019-01), la Fondation pour la Recherche Médicale (FRM EQU202003010400), l’INSERM, le CNRS et l’Université de Paris.




 CC-BY 4.0
CC-BY 4.0