La version française de l’article est disponible à la suite de la version anglaise
Louis Pasteur is celebrated by the scientific community and by the general public as the founding father of microbiology. But what is microbiology if not the science of living organisms that have in common their “small size”? …. They are alive but we can only see them under the microscope or … not at all. In a very singular way, Pasteur became interested in these microscopic organisms—microbes or “germs”—not because of their size but, from the outset, from the point of view of the chemist and even the physicist. His constant preoccupation has always been to apply the method and strategies of the basic sciences to living processes, whatever the scale of the organism concerned: today we would say “from the molecule to the brain”. His fundamental aim was, throughout his work, went beyond the biology of microbes, to the chemistry of life. In this brief article, I would like to show that this disposition and experience of a chemist is the sign of the originality of Pasteur’s entire work (see also Duclaux [1], Debré [2], Raichvarg [3], Grimoult [4]). Above all, it gives rise to a lesser-known aspect of his scientific progeny: the origin and development of therapeutic chemistry—which his successors, and especially Daniel Bovet, brilliantly illustrated at the Pasteur Institute—and, more unexpectedly, of the therapeutic chemistry of the nervous system or “neuropharmacology”.
The young Pasteur received from his Jura family of tanners a solid common sense and a taste for work, as well as an interest in art from his mother. He attended primary and secondary school in Arbois. Despite several failures, his family environment encouraged him to pursue higher education. He had not chosen his path yet. He painted many pastel portraits of his family members, all of which were full of realism and psychological truth and already showed a keen sense of observation. In 1840, he obtained the baccalaureate in literature and then, in 1842, after another failure, the baccalaureate in science with a mediocre grade in chemistry! He succeeded in the entrance exam to the Ecole Normale Supérieure but judged his rank to be insufficient (15/22), a trait that denoted an intellectual ambition that would animate him until his death. Aware of his limitations, the young Pasteur decided to continue his education at the Lycée Saint Louis in Paris. In 1843, he attended classes given at the Sorbonne by the chemist Jean-Baptiste Dumas, which impressed him and he was finally admitted—fourth—to the École Normale Supérieure. It was then that he asked Dumas to receive him in his laboratory for private lessons … on Sunday afternoons! Gifted with an audacious imagination, he knew how to combine rigor and concentration and loved working with his hands. Inspired by Dumas, the young Pasteur became passionate about chemistry. His first teachers recognized his precocious talent for a discipline that would mark him for life. He became an associate professor of chemistry in the laboratory of Antoine-Jérôme Balard at the Ecole Normale Supérieure and devoted himself to research. In 1847, he submitted his thesis for the doctorate in science at the Faculty of Science in Paris.
At the time, two theses were required to obtain a doctorate: one in chemistry and the other in physics. As a beginner, the young Pasteur practiced handling laboratory products and the reactions to which they contributed. He chose the commonplace reaction of bringing ammonia gas into contact with arsenic chloride, which he followed at various temperatures and in varying proportions. He examined the products obtained and compared them with the chemical equations involved. In doing so, and encouraged by the laboratory environment, he examined the crystalline forms of arsenious acid present among these products and noted a diversity of crystalline forms—or dimorphism—without, however, dwelling on them. This went on to be his chemistry thesis. His physics thesis focused on a physical property that the young researcher was able to measure with a device—the polarimeter—developed by his eminent neighbor at the Collège de France: Professor Jean-Baptiste Biot. It was the optical activity of certain acid solutions, and their ability to deviate the plane of polarization of the light reflected by a crystal, in other words, their rotatory power. Pasteur showed that reagents with the same crystal form have the same rotatory power: a rather banal conclusion. In the context of the laboratory, crystalline diversity and rotatory power are constantly debated. But the young Pasteur did not understand the link between the two. The intellectual framework of the young Pasteur’s first contribution was thus set up. His exceptional capacity for astonishment and his power of synthesis would follow.
The scientific context of Antoine-Jérôme Ballard’s chemistry laboratory at the Ecole Normale Supérieure aroused the enthusiastic curiosity of the young Pasteur. According to Grimoult [4] the laboratory benefited from a short visit in 1847 of Auguste Laurent, professor at the faculty of Bordeaux, who was interested in the relation between the atomic composition of a crystal and its three-dimensional shape. Pasteur resumed, in this context, the examination of dimorphism and noted that sulfur crystallizes in several distinct crystalline forms, in particular, in straight and oblique rectangular prisms that he interpreted on the basis of stable chemical equilibria. A note presented four years earlier to the Academy by the physicist Jean-Baptiste Biot (October 14, 1844) created in Pasteur, in his own words “a first movement of the spirit towards discovery”. The author was a German researcher, Eilhard Mitscherlich, and his paper dealt with tartaric acid, discovered in 1770 in the tartar of wine barrels, and para-tartaric acid (also called racemic by Gay Lussac), which had just been isolated and was the subject of a lively debate with the famous Swedish chemist Jöns Jacob Berzelius. Berzelius noted that tartrate and para-tartrate have the same number of elements, the same chemical composition, but have a difference in solubility: he called them isomers. Mitscherlich brought an essential complementary difference: “tartrate turns the plane of polarized light and para-tartrate is indifferent”. Mitscherlich claimed that tartrate and para-tartrate crystals were identical. The young Pasteur took exception to this. There must be a difference in structure since the rotatory properties of their solutions are different, he thought!
The astonishment combined with a keen sense of observation incited the young Pasteur to observe the shape of the crystals more carefully than Mitscherlich had done. And he discovered that the optically active tartrate crystals were asymmetrical: one side was more elongated than the other and only one was affected by a particular small truncation. If there is a relationship between hemihedrality and rotatory power, then what about para-tartrate? Pasteur, with his characteristic taste for effort, examined dozens of crystals obtained under multiple conditions to discover that para-tartrate is not homogeneous. It is a mixture of two crystalline forms, not superimposable on each other, left and right, like each of the two hands (from where the term of chiral originates). Moreover one of them is identical to the shape of the tartrate crystal. Under the microscope, he separated the two kinds of crystals manually, and put them in solution. He observed them with the polarimeter and noticed a rotation effect of the plane of polarization of the light in an opposite direction for each sample. Their mixture no longer “rotated” the plane of polarization of light, it cancelled their effect, which explained why, at the beginning, the para-tartrate, or racemate, is inactive. Pasteur communicated his discovery directly to Biot, but Biot remained doubtful. He summoned Pasteur to his laboratory at the Collège de France where he asked Pasteur to repeat the experiment, but reserved the right to put into solution and examine himself, with a polarimeter, the two populations of crystals separated by Pasteur and put into solution. He confirmed Pasteur’s discovery. With emotion, the older Biot took the younger researcher in his arms and declared his admiration. However, before the publication in the Compte Rendus of his Note [5] entitled “Mémoire sur la relation qui peut exister entre la forme cristalline, la composition chimique et sur la cause de la polarisation rotative”, the discovery had to be validated by a commission of the Academy which included its most eminent members. On May 15, 1848, Pasteur repeated his experiment once again before this distinguished panel. He further enhanced the value of his discovery by illustrating a brilliant and well-argued speech with cork models of the “left” and “right” crystals of tartrate that he had made with his hands (Figure 1). He convinced his audience. As Grimoult [4] notes, Pasteur always knew how to accompany his scientific discoveries with an effective media promotion ….
Models in cork of “left” and “right” tartrate crystals realized by the young Louis Pasteur with his own hands.
Initiating a tireless race for honors that he would carry on until the end of his life, Pasteur married the daughter of the rector of the University of Strasbourg in 1849, received the prize of the Paris Pharmaceutical Society (1853), the Legion of Honor (1853) and then the Rumford Medal (1856) … and the Academy was in his sight. This incited him to pursue his research with an uncommon relentlessness. He tried to understand the origin of this dissymmetry that he had discovered with tartrate, explored other chemical combinations, tried to inter-convert right and left forms, to create dissymmetry from symmetrical materials …. He wondered “if the mysterious influence to which the dissymmetry of natural products is due were to change direction … perhaps a new world would open up to us”.
In his excellent biography Pasteur: histoire d’un Esprit, Duclaux [1] reports (on page 43) that in his quest to “separate right and left bodies” Pasteur made a crucial observation that would reorient his research. It was in 1853. Pasteur noticed that a bottle containing a solution of para-tartrate on a shelf in his laboratory became cloudy over time. A living organism developed in it, probably a species of Penicillium. Banal: fermentation occurs. But instead of throwing the contents down the sink, Pasteur wondered. He put the solution to the polarimeter and noticed that at the end of fermentation the right salt had disappeared and that “the left salt had been respected”. The living being that contaminated the bottle was able to distinguish between the right and left forms of tartrate and used only the right form to multiply. There is a strong relationship between asymmetry and living beings. We can then exclaim YES “asymmetry is life”! This realization—chemical—of Pasteur would be the foundation of his later works on fermentation and even more of his important microbiological career.
Following this observation, he took an additional step that is of special interest to us. He wondered about the difference in taste between the two forms of asparagine and wrote (1886) that “the active dissymmetrical body which would play a role in the nervous impression, translated by a sweet taste in one case and almost insipid in the other, would be nothing else, according to me, than the nervous matter itself, a dissymmetrical matter like all the primordial substances of life”. Louis Pasteur was not simply a man of microbes; through a visionary intuition, he already conceived the scope of his ideas on the chemistry of living organisms in general and even on the brain.
Pasteur became a professor in Lille in 1854 and changed his intellectual environment. From then on, he became more directly interested in the process of fermentation. He approached this problem in a very applied manner at the request of the industrialists of the Lille region. He would do it with the methods of the chemist. If he recognized the conceptual role of the researcher “without theory, practice is only a routine given by habit”, Pasteur also knew how to make his theoretical reflection benefit from the practical questions asked by the industry of the time. Pasteur spontaneously abandoned the work he had begun on asymmetry. He did not provide an answer to the fundamental question of its origin.
Twenty years later, in 1874, Jacobus van’t Hoff and Joseph Le Bel made a major breakthrough with the discovery of the asymmetry of the carbon atom and the demonstration that optical activity results from the spatial arrangement of the different substituents of a tetrahedral carbon. The two isomers of the tartaric acid molecule are—in space—images of each other in a mirror. Stereochemistry was born. In 1884 Emil Fischer—who studied in Strasbourg, then under German occupation—carried out exceptional work on sugars in Berlin, which led him to establish the stereochemical nature and isomerism of all known sugars. He synthesized 16 isomers of glucose and showed that only four of them are fermentable and have an unambiguous stereochemical relationship. “The enzyme and the glucoside,” he wrote, “must fit together like a key to a lock in order to perform a chemical action on each other” [6]. These “locks” are now known at the atomic level, with the X-ray crystallographic work of Perutz [7], Kendrew [8], and Phillips [9]. The entry point of the ligand-key into the lock—the binding site on the protein molecule—is typically “dissymmetric”. It is carried by the three-dimensional folding of the polypeptide chain, which has no obvious properties of symmetry (see below the exception of allosteric proteins). The “dissymmetrical matter” which, according to Pasteur, characterizes living organisms is, without ambiguity, determined by the spatial organization of their constituent proteins.
Diverted from his fundamental chemistry research by microbiology, Pasteur did not fail to recall his own chemistry work. Of course, the immune response is part of it. However, the chemistry of antibodies was not yet known. There is also the world of bacterial toxins (such as diphtheria toxin) but these are not chemically identified either. In 1889 he presented a note to the Academy on a treatment with an antiseptic “substance” produced by the septic vibrio itself. But it would not be followed up. He did not directly address the chemistry of medicine in microbiology. However, during his last years he surrounded himself with chemists and at his death in 1895 it was an eminent chemist, Emile Duclaux, who took over the direction of the Pasteur Institute (from 1895 to 1904). In 1898, Duclaux created a new building which was to be called the Institute of Biological Chemistry. In 1910 Ernest Fourneau, a specialist in “pure or biological” chemical synthesis, who had established a working relationship with the Poulenc company, was recruited. His laboratory developed very actively with a budget that became one of the most important of the Pasteur Institute (8.6%). In 1929, a young biologist from a Calvinist family in Geneva, Daniel Bovet [10], joined his laboratory (Figure 2). Although his thesis was in zoology and comparative anatomy, Bovet immediately followed in the intellectual tradition of Louis Pasteur in structural chemistry and, very specifically, in steric recognition, “of the dissymmetry of the primordial substances of life”. Like Pasteur, he had the constant desire to apply chemical science to human health through “the verification of the clinician”. Bovet was also inspired by Paul Ehrlich’s chemotherapy project with its four magic G’s: geld–silver, geduld–patience, geschick–competence and gluck–chance, which he would constantly test. He was naturally interested in antibacterial agents and especially in Pontosil, a dye synthesized in Ehrlich’s environment. He tried to understand its mode of action and was surprised that the product was active on streptococcus in vivo, in animals, but not in vitro. With Tréfouël, another student of Fourneau, Bovet showed that in vivo Pontosil is actually transformed into a colorless substance, which is the active principle. It is the para-amino-phenyl sulfamide already synthesized in the laboratory of Fourneau. The product acted as an anti-vitamin and thus as a bacteriostatic. It took the place—acting as a competitive inhibitor—of para-amino-benzoic acid, a natural precursor of folic acid, an essential metabolite of the living cell. Bovet discovered the first antibiotic [10].
Portrait of Daniel Bovet.
On this basis, Bovet enriched the Pastorian concept of molecular dissymmetry by creating a rigorous causal link between the steric structure of a molecule and its physiological action. He proposed a “relationship between isosterism and competitive phenomena in the field of pharmacotherapy” (this is the title of his 1957 Nobel lecture [10]). There is a structural analogy—mimicry—between synthetic pharmacological agents and endogenous physiological signals. Bovet, using Pasteur’s term, laid the foundations of therapeutic chemistry.
In the 1930s, Bovet and Fourneau set out to find an anti-malarial agent, a program that is still relevant today. They found among the many compounds synthesized (by chance?) a dioxane F883 compound which produces sympatholytic effects and thus antagonizes adrenalin and noradrenalin. Others have the opposite action and produce sympathomimetic effects. Unexpectedly—a first at the Pasteur Institute—Bovet directed his research towards the pharmacology of the nervous system. This was followed in 1937, with Anne-Marie Staub, by the discovery of the first synthetic antihistamine, thymoxy-ethyl-diethyl-amine. Finally, following in Claude Bernard’s footsteps, he became interested in curare, the paralyzing poison of the Amazonian Indians’ arrows. Bovet succeeded where Claude Bernard had failed by linking the chemistry of curare to its toxic effects. In 1946 he synthesized the first product whose blocking activity on the neuromuscular junction in vivo is similar to that of curare. It is a compound of two quinoline nuclei with one quaternary ammonium each, then he produced the homologue with three quaternary ammoniums—the now famous flaxedil or gallamine (Figure 3). In 1946 with France Tazieff-Depierre and Courvoisier, he introduced flaxedil into the clinic, which had been used by generations of anesthetists as a muscle relaxant. Finally, they synthesized a bis-quaternary, succinyl-choline, which acted as a depolarizing curare. For these discoveries and many others, he received the Nobel Prize in 1957 [10] … after leaving the Pasteur Institute …, which had not known—or wanted—to retain him!
The molecule of flaxedil.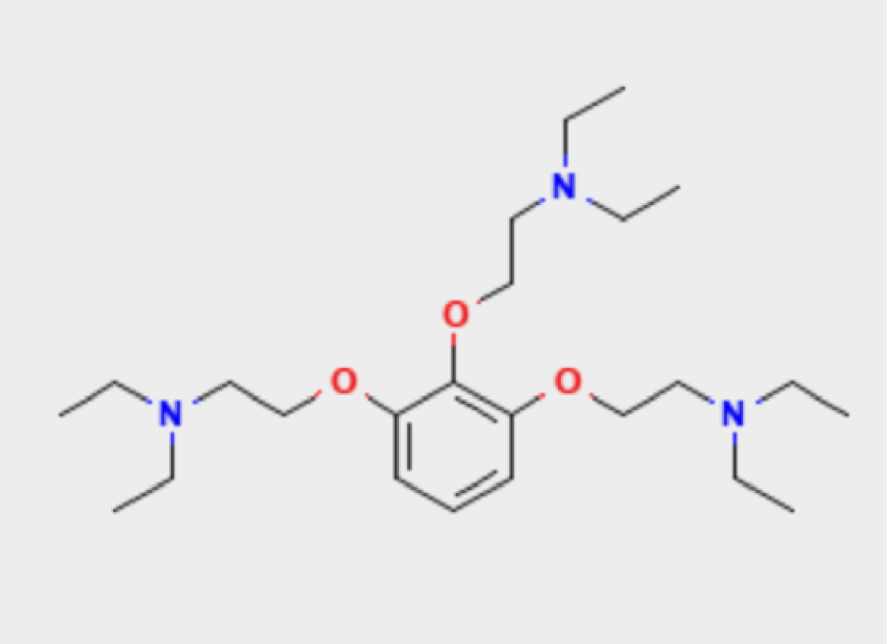
Even though he is recognized as one of the founding fathers of therapeutic chemistry, Bovet was also a committed scientist. With Feldberg and Nachmansohn, he lead a fierce fight against certain electro-physiologists—like Eccles—to defend the intervention of chemical neurotransmission in the central nervous system. He struck hard. With Longo, as early as in 1954, he recorded EEGs in rabbits that indicate wakefulness and sleep states. He showed that atropine blocks the desynchronization states caused by eserine and that diethazine antagonizes the convulsive states caused by nicotine in curarized rabbits. There is no doubt that the neurons of our brain are organized in an immense network of chemical communications, which takes over and modulates the electrical signaling [10]. Bovet mentions in this regard “special receptors for adrenalin, acetylcholine and histamine, which could be specific proteins whose configuration is complementary to that of the transmitter itself,” [10]. With 50 years of advance, he anticipated the intervention of pharmacological receptors in the control of states of consciousness (see [11]). Bovet created, at the Pasteur Institute, neuropharmacology, a discipline that would later be enriched in France by the discovery of psychotropic agents such as chlorpromazine by Laborit and then Delay and Deniker at the Hôpital Sainte Anne.
The birth and development of molecular biology at the Pasteur Institute in the 1960s with the work of Monod, Jacob and Lwoff and their teams gave a new impetus to the Pasteur–Bovet chemotherapeutic approach. I had the privilege of contributing to this in a somewhat unexpected way. In 1959 Jacques Monod recruited me as a thesis student in his laboratory. Among the many possible themes that he put forward with François Jacob, and which, for the most part, concerned the regulation of biosynthesis in the colibacillus, one of them caught my attention, precisely because it was an odd man out. It was about understanding the mechanism of feedback inhibition of the first enzyme of a bacterial biosynthetic pathway by its final product, a discovery made independently by Umbarger [12] and by Yates and Pardee [13]. Monod considered the interest of this intracellular regulation to be less than that of the operon on which he was working intensively with Jacob. On the other hand, the problem seemed fundamental to me and I was passionate about it: to understand how the inhibitor molecule blocks the action of the enzyme on its substrate despite obvious differences in structure. There are two models: the interaction is direct with steric competition for the same site—à la Bovet [10], or indirect and involves two categories of topographically distinct and non-overlapping sites—described as “no-overlapping” by Changeux [14]. The first data on threonine deaminase [14] as well as those on aspartate trans-carbamylase [15] argue in favor of the second mechanism. It would be widely confirmed later with other systems. Monod then coined the term allosteric (from the Greek αλλo𝜍, allos: other and , stereós: solid) to designate it. My dissertation work continued with the analysis of the cooperative effects already noted by Umbarger and concluded with the proposal of a model (cited 9822 times) of a molecular switch (switch) between discrete and symmetric conformational states (active vs. resting), which assigns binding cooperativity to the structural cooperativity of the regulatory protein (Monod–Wyman–Changeux [16]). The molecule is postulated to result from the assembly of several individually asymmetric subunits (or protomers) into a symmetric cooperative oligomer (as Perutz had shown with hemoglobin [7]). This does not interfere in any way with the Pastorian concept of asymmetry since the binding sites are located either within each protomer or at the interface between protomers, and are thus intrinsically lacking in symmetry. Only the oligomer is cooperative and symmetric.
Changeux extended the allosteric model to intercellular communications present in eukaryotic organisms and especially in the brain at the level of neurotransmitter receptors [17]. The first neurotransmitter receptor was identified at the Pasteur Institute [18] and shown to behave like an authentic allosteric protein, although with features of its own [19]. The acetylcholine receptor site(s) is topographically distinct from the ion channel (60 Å away) and several allosteric modulator binding sites identified in the synaptic and transmembrane domains of the receptor molecule. A new pharmacology will develop in the “allosteric” mode. The torch was passed on by France Tazieff-Depierre who was a close collaborator of Daniel Bovet and whom I met by chance, at Pasteur, at the end of my thesis, during the last months of my military service (1965). Combat gases, such as sarin, are powerful inhibitors of acetylcholinesterase—the enzyme that destroys acetylcholine at the synapse—and the search for antidotes was (and still is) an important research topic for the national defense. On this occasion she offered me a rich collection of cholinergic derivatives synthesized by Fourneau, including the famous flaxedil, which I tested in vitro both on acetylcholinesterase [20] and on the newly identified nicotinic receptor [18]. She also introduced me to Professor Chen Yuan Lee from Taiwan who gave me the precious snake venom toxin bungarotoxin which allowed the isolation of the nicotinic receptor.
Since then, allosteric pharmacology has developed considerably. It includes benzodiazepines, the most prescribed psychoactive drugs, which are powerful positive allosteric modulators of the GABAA receptor [21, 22]. About 80 allosteric modulators are used clinically [23, 24]. These are, for example, Aniracetam, Cinacalcet, Maraviroc and especially anti-receptor monoclonal antibodies [25]. The allosteric database lists 82,070 substances as potential modulators and 538 as effective allosteric drugs. The introduction of the concept of allosteric modulation has a major impact on our understanding of the mode of action of drugs on the brain and on rational drug design. But it also opened the way to a deeper understanding of higher brain functions [11].
In 1972, Jacques Monod created a Molecular Neurobiology Unit at the Pasteur Institute, followed by the creation of the Department of Neuroscience in 2002. Molecular biology of the brain and its pathologies has become one of the main priorities of the Pasteur Institute. The tradition of Pasteur as a chemist continues. As Pasteur himself wrote, “It is only by remaining for a long time in the same studies that one can hope to see a little better than his predecessors.
Conflicts of interest
The author has no conflict of interest to declare.
Version française
Louis Pasteur est célébré par la communauté scientifique et par le grand public comme le père fondateur de la microbiologie. Mais qu’est-ce que la microbiologie sinon la science des organismes vivants qui ont en commun d’avoir « une petite taille » ?…Ils sont vivants mais on ne les voit qu’au microscope ou … pas du tout. De manière très singulière, Pasteur s’est intéressé à ces organismes microscopiques — microbes ou « germes » — non pas du fait de leur taille mais, dès l’origine, du point de vue du chimiste et même du physicien. Sa constante préoccupation a toujours été d’appliquer la méthode et les stratégies des sciences fondamentales aux processus vivants, quelle que soit l’échelle de l’organisme concerné : on dirait aujourd’hui « de la molécule au cerveau ». Sa visée fondamentale fut, à travers toute son œuvre, au-delà de la biologie des microbes, la chimie de la vie. Dans ce bref article, je souhaiterais montrer que cette disposition et expérience de chimiste signe l’originalité de l’ensemble de l’œuvre de Pasteur (voir également Duclaux [1], Debré [2]; Raichvarg [3], Grimoult [4]). Surtout elle donne lieu à un aspect moins connu de sa descendance scientifique : l’origine et le développement de la chimie thérapeutique — que ses successeurs, et tout particulièrement Daniel Bovet — ont brillamment illustré à l’Institut Pasteur et, plus inattendu, de la chimie thérapeutique du système nerveux ou « neuro-pharmacologie ».
Le jeune Pasteur reçoit de sa famille jurassienne de marchands tanneurs un solide bon sens et le goût du travail, ainsi que, de sa mère, l’intérêt pour l’art. Il suit ses études primaires et secondaires à Arbois. En dépit de plusieurs échecs, son environnement familial l’encourage à poursuivre des études supérieures. Il n’a pas encore choisi sa voie. Il réalise de nombreux portraits au pastel des membres de sa famille tous empreints de réalisme et de vérité psychologique et qui montrent déjà un sens aigu de l’observation. En 1840, il obtient le baccalauréat en lettres puis, en 1842, après un nouvel échec, le baccalauréat en sciences avec une note médiocre … en chimie ! Il réussit au concours d’entrée à l’Ecole Normale Supérieure mais juge son rang insuffisant (15/22), trait qui dénote une ambition intellectuelle qui l’animera jusqu’à sa mort. Conscient de ses limites, le jeune Pasteur décide de poursuivre sa formation au Lycée Saint Louis à Paris. Il assiste en 1843 aux cours donnés à la Sorbonne par le chimiste Jean-Baptiste Dumas qui l’impressionnent et est finalement admis — quatrième — à l’École Normale Supérieure. C’est alors qu’il demande à Dumas de le recevoir dans son laboratoire pour des leçons particulières … le dimanche après-midi ! Doué d’une imagination audacieuse, il sait allier rigueur et concentration et aime travailler de ses mains. Inspiré par Dumas, le jeune Pasteur se passionne pour la chimie. Ses premiers maitres reconnaissent son talent précoce pour une discipline qui le marquera pour la vie. Il devient agrégé-préparateur de chimie, dans le laboratoire d’Antoine-Jérôme Balard à l’Ecole Normale Supérieure et se consacre désormais à la recherche. Il soutiendra en 1847 ses thèses pour le doctorat en sciences à la faculté des sciences de Paris (https://fr.wikipedia.org/wiki/Louis_Pasteur-cite_note-10).
A l’époque deux thèses étaient nécessaires pour accéder au doctorat : l’une en chimie l’autre en physique. Débutant, le jeune Pasteur s’exerce à la manipulation de produits du laboratoire et aux réactions auxquelles ils contribuent. Il choisit la réaction banale de mise en contact du gaz ammoniac avec le chlorure d’arsenic qu’il suit à diverses températures et en proportions variables. Il examine les produits obtenus et les confronte aux équations chimiques concernées. Ce faisant, encouragé par l’environnement du laboratoire, il examine les formes cristallines de l’acide arsénieux présent parmi ces produits et note une diversité de formes cristallines — ou dimorphisme — sans toutefois s’y attarder. Ce sera sa thèse de chimie. Celle de physique portera sur une propriété physique que le jeune chercheur va pouvoir mesurer avec un appareil — le polarimètre — mis au point par son éminent voisin du Collège de France : le professeur Jean-Baptiste Biot. Il s’agit de l’activité optique de certaines solutions acides, et leur capacité de dévier le plan de polarisation de la lumière réfléchie par un cristal, en d’autres termes, leur pouvoir rotatoire. Il montre que des réactifs ayant la même forme cristalline possèdent le même pouvoir rotatoire : une conclusion assez banale. Dans le contexte du laboratoire, diversité cristalline et pouvoir rotatoire sont constamment débattus. Mais le jeune Pasteur n’a pas compris le lien entre les deux. Le cadre intellectuel de la première contribution du jeune Pasteur se trouve mis en place. Son exceptionnelle capacité d’étonnement et son pouvoir de synthèse feront la suite.
Le contexte scientifique du laboratoire de chimie d’Antoine-Jérôme Ballard à l’Ecole Normale Supérieure va susciter la curiosité enthousiaste du jeune Pasteur. Selon Grimoult [4] le laboratoire aurait bénéficié en 1847 d’une courte visite de Auguste Laurent professeur à la faculté de Bordeaux qui s’intéressait à la relation entre la composition atomique d’un cristal et sa forme en trois dimensions. Pasteur reprend, dans ce cadre, l’examen du dimorphisme et note que le soufre cristallise sous plusieurs formes cristallines distinctes, en particulier en prismes rectangulaires droits et obliques qu’il interprète sur la base d’équilibres chimiques stables. Une note présentée quatre ans plus tôt à l’Académie par le physicien Jean-Baptiste Biot (le 14 octobre 1844) va créer chez Pasteur, selon ses termes « un premier mouvement de l’esprit vers la découverte ». L’auteur est un chercheur allemand Eilhard Mitscherlich et porte sur l’acide tartrique découvert en 1770 dans le tartre des tonneaux de vin et l’acide paratartriques (appelé aussi racémique par Gay Lussac) qui vient d’être isolé et fait l’objet d’un vif débat avec le célèbre chimiste suédois Jöns Jacob Berzélius. Berzelius note que tartrate et paratartrate ont le même nombre d’éléments, la même composition chimique, mais possèdent une différence de solubilité : il les qualifie d’isomères. Mitscherlich apporte une différence complémentaire essentielle: « le tartrate tourne le plan de la lumière polarisée et le paratartrate est indifférent ». Mitscherlich prétend que les cristaux de tartrate et de para-tartrate sont identiques. Le jeune Pasteur s’insurge. Il faut qu’il y ait une différence de structure puisque les propriétés rotatoires de leurs solutions sont différentes pense-t-il !
L’étonnement joint à un sens aigu de l’observation incitent le jeune Pasteur à observer la forme des cristaux plus attentivement que Mitscherlich ne l’avait fait. Et il découvre que les cristaux de tartrate — optiquement actif — sont asymétriques : un de leurs côtés est plus allongé que l’autre et un seul est affecté par une petite troncature particulière. S’il existe une relation entre hémihédrie et pouvoir rotatoire, alors qu’en est-il du paratartrate ? Pasteur, avec le goût de l’effort qui le caractérise, examine des dizaines de cristaux obtenus dans de multiples conditions pour découvrir que le paratartrate n’est pas homogène. Il est un mélange de deux formes cristallines, non superposables l’une de l’autre, gauche et droite, comme chacune des deux mains (d’où le terme de formes chirales). De plus l’une d’elles est identique à la forme du cristal de tartrate. Sous le microscope, il sépare manuellement les deux sortes de cristaux, et les met en solutions. Il les observe avec le polarimètre et constate un effet de rotation du plan de polarisation de la lumière dans un sens opposé pour chaque échantillon. Leur mélange ne « tourne » plus le plan de polarisation de la lumière, il annule leur effet, ce qui explique que, au départ, le para-tartrate, ou racémate, soit inactif. Pasteur communique directement sa découverte à Biot mais celui-ci reste dubitatif. Il convoque Pasteur dans son laboratoire au Collège de France où il demande à Pasteur de refaire l’expérience, mais se réserve de mettre en solution et d’examiner lui-même, au polarimètre, les deux populations de cristaux séparés par Pasteur et mis en solution. Il confirme la découverte de Pasteur. Avec émotion, le vieux Biot prend dans ses bras le jeune chercheur et lui confirme son admiration. Toutefois, avant la publication aux Compte Rendus de sa Note [5] titrée Mémoire sur la relation qui peut exister entre la forme cristalline, la composition chimique et sur la cause de la polarisation rotative, la découverte doit être validée par une commission de l’Académie qui inclut ses membres les plus éminents. Le 15 mai 1848 Pasteur répète une fois de plus son expérience devant ce distingué aréopage. Mieux, il valorise sa découverte en illustrant un discours brillant et très argumenté avec des modèles en liège des cristaux « gauche » et « droit » de tartrate qu’il a fait de ses mains (Figure 1). Il convainc son auditoire. Comme le note Grimoult [4], Pasteur a toujours su accompagner ses découvertes scientifiques d’une promotion médiatique efficace ….
Modèles en liège des cristaux « gauche » et « droit » de tartrate réalisés de ses mains par le jeune Louis Pasteur.
Initiant une inlassable course aux honneurs qu’il mènera jusqu’à la fin de sa vie, Pasteur se marie en 1849 avec la fille du recteur de l’Université de Strasbourg, reçoit le prix de la société de Pharmacie de Paris (1853), la Légion d’honneur (1853) puis la médaille Rumford (1856) … et l’Académie est en ligne de mire. Ce qui l’incite à poursuivre sa recherche avec un acharnement hors du commun. Il s’efforce de comprendre l’origine de cette dissymétrie qu’il a découverte avec le tartrate, explore d’autres combinaisons chimiques, tente d’interconvertir forme droite et forme gauche, de créer la dissymétrie à partir de matériaux symétriques … Il s’interroge « si l’influence mystérieuse à laquelle est due la dissymétrie des produits naturels venait à changer de sens ou de direction … peut-être un monde nouveau s’offrirait à nous ».
Dans son excellente biographie Pasteur : histoire d’un Esprit, Duclaux [1] rapporte (à la page 43) que dans sa quête de « séparer les corps droits et gauches » Pasteur fait une observation capitale qui va réorienter sa recherche. Nous sommes en 1853. Pasteur a remarqué que sur une étagère de son laboratoire un flacon contenant une solution de paratartrate se trouble avec le temps. Un organisme vivant s’y développe, vraisemblablement une espèce de Penicillium. Banal : une fermentation se produit. Mais au lieu d’en jeter le contenu dans l’évier, Pasteur s’interroge. Il passe la solution au polarimètre et constate qu’en fin de fermentation le sel droit a disparu et que « le sel gauche a été respecté ». L’être vivant qui contamine le flacon est capable de distinguer entre la forme droite et la forme gauche du tartrate et n’utilise que la forme droite pour se multiplier. Il existe une relation forte entre dissymétrie et être vivant. On peut alors s’exclamer OUI « la dissymétrie c’est la vie » ! Cette prise de conscience — chimique — de Pasteur sera fondatrice de ses travaux ultérieurs sur les fermentations et plus encore de son importante carrière microbiologique.
A la suite de cette observation, il franchit une étape supplémentaire qui nous intéresse spécialement. Il s’interroge sur la différence de goût entre les deux formes droite-gauche de l’asparagine et écrit (1886) que « le corps dissymétrique actif qui jouerait un rôle dans l’impression nerveuse, traduite par un goût sucré dans un cas et presque insipide dans l’autre, ne serait autre chose, selon moi, que la matière nerveuse elle-même, une matière dissymétrique comme toute les substances primordiales de la vie ». Louis Pasteur n’est pas simplement l’homme des microbes, par une intuition visionnaire, il conçoit déjà la portée de ses idées sur la chimie du vivant en général et même sur celle du cerveau.
Pasteur devient professeur à Lille en 1854, il change d’environnement intellectuel. Désormais il va s’intéresser plus directement au processus de la fermentation. Il aborde cette problématique de manière très appliquée sur la sollicitation des industriels de la région Lilloise. Il le fera avec la méthode du chimiste. S’il reconnait le rôle conceptuel du chercheur « sans la théorie, la pratique n’est que la routine donnée par l’habitude », Pasteur sait également faire bénéficier sa réflexion théorique des questions pratiques qui lui sont posées par l’industrie de l’époque. Pasteur abandonne spontanément les travaux qu’il avait engagés sur la dissymétrie. Il n’apportera pas de réponse à la question fondamentale de son origine.
Vingt ans plus tard, en 1874, Jacobus van ’t Hoff et Joseph Le Bel réalisent un progrès majeur avec la découverte de l’asymétrie de l’atome de carbone et la démonstration que l’activité optique résulte de l’arrangement spatial des différents substituants d’un carbone tétraédrique. Les deux isomères de la molécule d’acide tartrique sont — dans l’espace — images l’une de l’autre dans un miroir. La stéréochimie est née. En 1884 Emil Fischer — qui a fait ses études à Strasbourg alors sous occupation allemande — réalise à Berlin un travail exceptionnel sur les sucres qui l’amène à établir la nature stéréochimique et l’isomérie de tous les sucres connus. Il synthétise seize isomères du glucose et montre que seuls quatre d’entre eux sont fermentescibles et présentent une parenté stéréochimique non ambiguë. « L’enzyme et le glucoside, écrit-il, doivent s’adapter l’un à l’autre comme une clé à une serrure pour pouvoir effectuer une action chimique l’une sur l’autre » [6]. Ces « serrures » sont désormais connues au niveau atomique, avec les travaux de cristallographie aux rayons X de Perutz [7] Kendrew [8] et de Phillips [9] … Le point d’entrée de la clé-ligand dans la serrure — le site de liaison sur la molécule protéique — est typiquement « dissymétrique ». Il est porté par le repliement tridimensionnel de la chaine polypeptidique qui ne présente aucune propriété évidente de symétrie (voir ci-après l’exception des protéines allostériques). La « matière dissymétrique » qui selon Pasteur caractérise les organismes vivants est, sans ambigüité, déterminée par l’organisation spatiale de leurs protéines constitutives.
Détourné de ses recherches de chimie fondamentale par la microbiologie, Pasteur ne manquera pas par la suite de rappeler ses propres travaux de chimie. Bien entendu la réponse immunitaire en fait partie. Toutefois la chimie des anticorps n’est pas encore connue. Il y a aussi le monde des toxines bactériennes (comme la toxine diphtérique) mais celles-ci ne sont pas non plus identifiées chimiquement. En 1889 il présente une note à l’Académie sur un traitement par une « substance » antiseptique produite par le vibrion septique lui-même. Mais ce sera sans suite. Il n’abordera pas directement la chimie du médicament en microbiologie. Cependant au cours de ses dernières années il s’entoure de chimistes et à sa mort en 1895 c’est un chimiste éminent Emile Duclaux qui prend la direction de l’Institut Pasteur (de 1895 à 1904). Il créé en 1898 un nouveau bâtiment qui portera le nom d’Institut de Chimie Biologique. En 1910 Ernest Fourneau spécialiste de la synthèse chimique « pure ou biologique », et qui a établi des relations de travail avec la firme Poulenc, est recruté. Son laboratoire se développe très activement avec un budget qui devient l’un des plus importants de l’Institut Pasteur (8.6%). En 1929 entre dans son laboratoire un jeune biologiste issu d’une famille calviniste genevoise et particulièrement dynamique : Daniel Bovet [10] (Figure 2). Même si sa thèse est en zoologie et anatomie comparée, Bovet s’inscrit immédiatement dans la tradition intellectuelle de Louis Pasteur en chimie structurale et, très spécifiquement, de la reconnaissance stérique, « de la dissymétrie des substances primordiales de la vie ». Il a, comme Pasteur, le constant désir d’appliquer la science chimique à la santé des hommes par la « vérification du clinicien ». Bovet s’inspire également du projet de chimiothérapie de Paul Ehrlich avec ses quatre G magiques: geld–argent, geduld–patience, geschick–compétence et gluck–chance qu’il mettra constamment à l’épreuve. Il s’intéresse tout naturellement aux agents antibactériens et spécialement au Pontosil, colorant synthétisé dans l’entourage de Ehrlich. Il tente de comprendre son mode d’action et s’étonne que le produit est actif sur le streptocoque in vivo, chez l’animal, mais pas in vitro. Avec Tréfouël, autre élève de Fourneau, Bovet montre que in vivo le Pontosil est en réalité transformé en une substance incolore qui est le principe actif. Il s’agit du para-amino-phenyl sulfamide déjà synthétisé dans le laboratoire de Fourneau. Le produit agit comme un anti-vitamine et intervient de ce fait comme bactério-statique. Il prend la place — il agit comme inhibiteur compétitif — de l’acide para-amino-benzoique précurseur naturel de l’acide folique, métabolite essentiel de la cellule vivante. Bovet découvre le premier antibiotique [10].
Portrait of Daniel Bovet.
Sur cette base, Bovet enrichit le concept pastorien de dissymétrie moléculaire en créant un lien rigoureux de causalité entre la structure stérique d’une molécule et son action physiologique. Il propose une « relation entre isostérisme et phénomènes compétitifs dans le champ de la pharmacothérapie » (c’est le titre de sa conférence Nobel de 1957 [10]). Il y a analogie structurale — mimétisme — entre les agents pharmacologiques de synthèse et les signaux physiologiques endogènes. Bovet en reprenant le terme même de Pasteur jette les bases de la chimie thérapeutique.
Dans les années 30, Bovet et Fourneau partent à la recherche d’un agent anti-malaria, un programme toujours d’actualité. Ils trouvent parmi les multiples composés synthétisés (par hasard ?) un composé du dioxane F883 qui produit des effets sympatho-lytiques et donc antagonise l’adrénaline et la noradrenaline. D’autres ont l’action opposée et produisent des effets sympatho-mimétiques. Circonstance inattendue — une première à l’Institut Pasteur — Bovet oriente sa recherche vers la pharmacologie du système nerveux. S’ensuit, en 1937, avec Anne-Marie Staub, la découverte du premier antihistaminique de synthèse le thymoxy-ethyl-diethyl-amine. Enfin, emboitant le pas de Claude Bernard, il s’intéresse au curare, le poison paralysant des flèches des Indiens d’Amazonie. Bovet réussit là où Claude Bernard a échoué en reliant la chimie du curare à ses effets toxiques. En 1946 il synthétise le premier produit dont l’activité bloquante sur la jonction neuromusculaire in vivo est semblable à celle du curare. C’est un composé de 2 noyaux quinoléique avec chacun un ammonium quaternaire, puis il produit l’homologue à trois ammoniums quaternaires — le désormais célèbre flaxedil ou gallamine (Figure 3). En 1946 avec France Tazieff-Depierre et Courvoisier, il introduit en clinique le flaxedil qui est utilisé depuis par des générations d’anesthésistes comme myorelaxant. Enfin ils synthétisent un bisquaternaire la succinyl-choline qui agit comme curare dépolarisant. Pour ces découvertes et bien d’autres, il reçoit le prix Nobel en 1957 [10] … après avoir quitté l’Institut Pasteur … qui n’avait pas su — ou voulu — le retenir !
La molécule de flaxédil.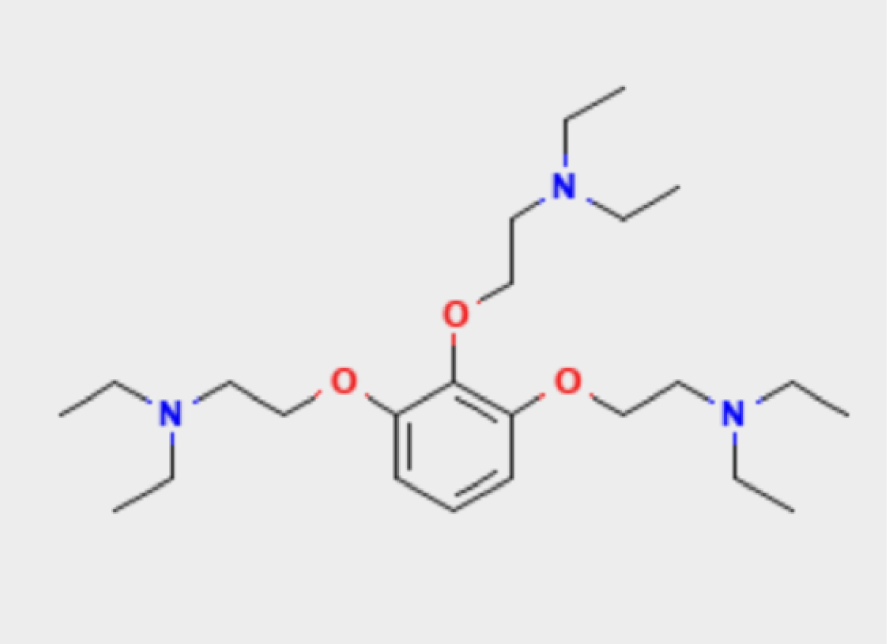
Même s’il est reconnu comme un des pères fondateurs de la chimie thérapeutique, Bovet est aussi un scientifique engagé. Avec Feldberg et Nachmansohn, il mène un combat acharné contre certains électrophysiologistes — comme Eccles — pour défendre l’intervention de la neurotransmission chimique dans le système nerveux central. Il frappe fort. Avec Longo, dès 1954, il enregistre chez le lapin les EEG qui signent les états de veille et de sommeil. Il montre que l’atropine bloque les états de désynchronisation causés par l’ésérine et que la diéthazine antagonise les états convulsifs provoqués par la nicotine chez le lapin curarisé. Il n’y pas de doute, les neurones de notre cerveau s’organisent en un immense réseau de communications chimiques qui prennent le relais et modulent la signalisation électrique [10]. Bovet mentionne à ce propos des « récepteurs spéciaux pour l’adrénaline, l’acétylcholine et l’histamine qui pourraient être des protéines spécifiques dont la configuration est complémentaire de celle du transmetteur lui-même » [10]. Avec 50 ans d’avance il anticipe l’intervention des récepteurs pharmacologique dans le contrôle des états de conscience (voir [11]). Bovet crée, à l’Institut Pasteur, la neuropharmacologie une discipline qui s’enrichira, par la suite, en France, de la découverte des agents psychotropes comme la chlorpromazine par Laborit puis Delay et Deniker à l’Hôpital Sainte Anne.
La naissance et l’épanouissement dans les années 60 de la biologie moléculaire à l’Institut Pasteur avec les travaux de Monod, Jacob et Lwoff et de leurs équipes vont donner un nouvel essor à l’approche chimiothérapeutique de Pasteur–Bovet. J’ai eu le privilège d’y contribuer de manière quelque peu inattendue. En 1959 Jacques Monod me recrute comme étudiant en thèse dans son laboratoire. Parmi les nombreux thèmes possibles qu’il avance avec François Jacob, et qui, pour la plupart, portent sur la régulation de la biosynthèse chez le colibacille, l’un d’entr’eux retient mon attention, précisément parce qu’il n’en fait pas partie. Il s’agit de comprendre le mécanisme de la rétro-inhibition ou « feed-back inhibition » du premier enzyme d’une voie de biosynthèse bactérienne par son produit final, découverte faite indépendamment par Umbarger [12] et par Yates and Pardee [13]. Monod juge l’intérêt de cette régulation intra cellulaire moindre que celui de l’opéron sur lequel il travaille intensément avec Jacob. Par contre le problème me parait fondamental et me passionne : comprendre comment la molécule inhibitrice bloque l’action de l’enzyme sur son substrat en dépit de différences de structure évidentes. Deux modèles se présentent : l’interaction est directe avec compétition stérique pour un même site — à la Bovet [10], ou indirecte et engage deux catégories de sites topographiquement distincts et non chevauchants — qualifiés de « no-overlapping » par Changeux [14]. Les premières données sur la thréonine désaminase [14] comme celles sur l’aspartate transcarbamylase [15] plaident en faveur du second mécanisme. Il sera largement confirmé par la suite avec d’autres systèmes. Monod forge alors le terme allostérique (du grec αλλo𝜍, allos : autre et , stereós : solide) pour le désigner. Mon travail de thèse se poursuit avec l’analyse des effets coopératifs déjà notés par Umbarger et se conclut avec la proposition d’un modèle (cité 9822 fois) de commutateur moléculaire (switch) entre états conformationnels discrets et symétriques (actif vs repos), qui assigne la coopérativité de liaison à la coopérativité de structure de la protéine régulatrice (Monod–Wyman–Changeux [16]). La molécule est postulée résulter de l’assemblage de plusieurs sous-unités individuellement asymétriques (ou protomères) en oligomère coopératif symétrique (comme l’avait montré Perutz avec l’hémoglobine [7]). Cela n’interfère en aucune manière avec de concept pastorien de dissymétrie puisque les sites de liaison sont situés soit au sein de chaque protomère, soit à l’interface entre protomères, et sont donc intrinsèquement dépourvus de symétrie. Seul l’oligomère est coopératif et symétrique.
Le modèle allostérique est étendu par Changeux aux communications intercellulaires présentes dans les organismes eucaryotes et spécialement dans le cerveau au niveau des récepteurs de neurotransmetteurs [17]. Le premier récepteur de neurotransmetteur est identifié à l’Institut Pasteur [18] et montré se comporter comme une authentique protéine allostérique, bien qu’avec des traits qui lui sont propres (rev [19]). Le(s) site(s) récepteur(s) de l’acétylcholine est(sont) topographiquement distinct(s) du canal ionique (à 60A de distance) et plusieurs sites liant des modulateurs allostériques identifiés dans les domaines synaptique et transmembranaire de la molécule de récepteur. Une nouvelle pharmacologie va se développer sur le mode « allostérique ». Le passage du flambeau aura été réalisé par France Tazieff-Depierre qui fut une proche collaboratrice de Daniel Bovet et que je rencontrais par chance, à Pasteur, à la fin de ma thèse, à l’occasion des derniers mois de mon service militaire (1965). Les gaz de combats, du type sarin, sont des inhibiteurs puissants de l’acétylcholinesterase — l’enzyme qui détruit l’acétylcholine à la synapse — et la recherche d’antidotes était (est toujours) un sujet de recherche important pour la défense nationale. A cette occasion elle m’offre une riche collection de dérivés cholinergiques synthétisés par Fourneau, incluant le fameux flaxédil, que j’essayais in vitro tant sur l’acétylcholinesterase [20] que sur le nouvellement identifié récepteur nicotinique [18]. C’est elle aussi qui me fit rencontrer le Pr Chen Yuan Lee de Taiwan qui me confia la précieuse toxine de venin de serpent la bungarotoxine qui permit l’isolement du récepteur nicotinique.
Depuis une pharmacologie allostérique s’est considérablement développée. Elle inclut les benzodiazépines, les drogues psychoactives les plus prescrites, puissants modulateurs allostériques positifs du récepteur GABAA [21, 22]. Environ 80 modulateurs allostériques sont utilisés en clinique (rev [23, 24]). Ce sont par exemple, Aniracetam, Cinacalcet, Maraviroc et surtout des anticorps monoclonaux anti-récepteurs [25]. L’allosteric database mentionne 82 070 substances comme modulateurs potentiels et 538 comme drogues allostériques efficaces. L’introduction du concept de modulation allostérique a un impact majeur dans notre compréhension du mode d’action des drogues sur le cerveau et la conception rationnelle de médicaments. Mais elle a aussi ouvert la voie à une compréhension plus approfondie des fonctions supérieures du cerveau [11].
En 1972 une Unité de Neurobiologie Moléculaire est créée à l’Institut Pasteur par Jacques Monod suivie en 2002 de la mise en place du Département de Neuroscience. La biologie moléculaire du cerveau et de ses pathologies est devenue une des principales priorités de l’Institut Pasteur. La tradition de Pasteur chimiste se perpétue. Comme l’écrivait Pasteur lui-même « C’est seulement en demeurant longtemps dans les mêmes études que l’on peut espérer voir un peu mieux que ses devanciers ».
Conflit d’intérêt
L’auteur n’a aucun conflit d’intérêt à déclarer.




 CC-BY 4.0
CC-BY 4.0