1 Introduction
Les procédures dites mini-invasives (Fig. 1) réduisent les incisions nécessaires à l’accomplissement du geste chirurgical. Malheureusement, elles imposent de nouvelles contraintes aux chirurgiens : les mouvements sont limités par la petitesse des incisions et la vision se fait à travers le champ restreint de l’endoscope.

Intervention à cœur ouvert ou mini-invasive.
L’introduction de robots télé-opérés dans les salles d’opérations a été motivée par ces différentes limitations. La liberté d’action à l’intérieur du corps peut être considérablement augmentée en utilisant une tête robotisée. Ainsi, il est possible de balayer un espace opératoire plus complexe, en prenant des directions arbitraires pour réaliser des gestes délicats, comme le prélèvement de la mammaire. Celle-ci améliore également la précision et la stabilité du geste opératoire. Le robot télé-opéré daVinciTM, d’Intuitive Surgical, muni du système EndoWristTM (cf. Fig. 2 et 〚1〛 pour une description du système) en est un exemple.
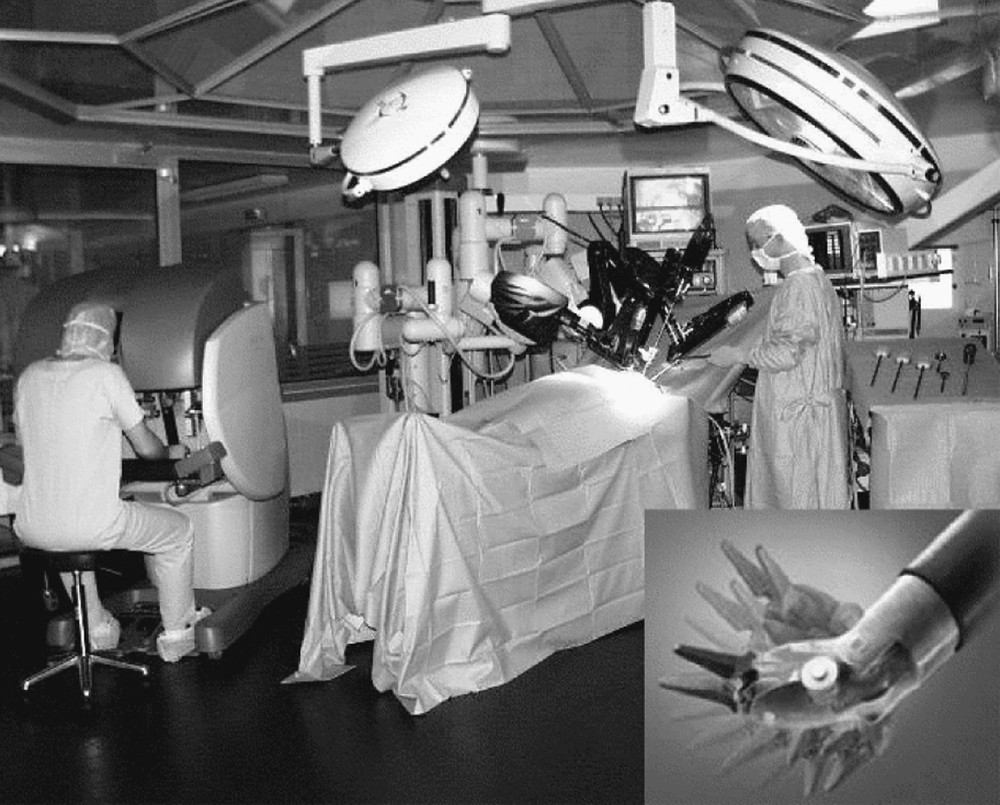
Le robot télé-opéré daVinciTM, composé d’une console maître, commandée par le chirurgien, et d’un manipulateur esclave, qui reproduit le geste chirurgical (hôpital européen Georges-Pompidou, Paris et Inria).
Cependant, cette innovation ne permet pas de résoudre complètement les problèmes liés à la restriction de l’accès aux organes. Ainsi, les points d’entrée des instruments doivent être soigneusement choisis en fonction de l’anatomie de chaque patient et des conditions de l’intervention, afin d’éviter les configurations limites des articulations du robot. Dans ces positions, les forces exercées deviennent trop faibles pour permettre une bonne réalisation du geste opératoire. Ce choix est d’autant plus important que la structure du robot est encombrante, ce qui pourrait entraîner des collisions entre les bras manipulateurs. Il faut donc assurer un positionnement du robot (possédant un large nombre de degrés de liberté) qui permette d’atteindre les zones d’intérêts opératoires sans collision des bras entre eux ou avec d’autres entités, comme la table opératoire par exemple.
Malgré l’existence de consignes établies par des chirurgiens pionniers (voir, par exemple, 〚2, 3〛), un aussi grand nombre de contraintes qualitatives ne peut être intégré pour chaque patient. Cette problématique est nouvelle ; il n’existe pas encore de travaux aboutis sur ce sujet. Une formalisation mathématique du problème se révèle donc nécessaire. L’anatomie du patient ainsi que les caractéristiques du robot et les conditions de l’intervention doivent être traduites en critères mathématiques permettant une optimisation de l’efficacité d’utilisation du robot. Le résultat de cette optimisation doit bien sûr être validé avant l’intervention par un système de simulation précis et réaliste. Il importe de préciser que cette optimisation est très sensible à l’anatomie du patient, ce qui oblige à la reprendre pour chaque patient et non à se contenter d’une solution « générique ».
D’un autre coté, cette nouvelle technologie, bien qu’elle se veuille « intuitive », nécessitera un temps d’adaptation avant de voir son potentiel exploité au mieux. Cette adaptation peut être accélérée par ce même système de simulation, qui facilite l’apprentissage du geste et sert un but éducatif important.
L’objectif de cet article est de présenter une interface intégrée permettant de planifier, vérifier, simuler et archiver les procédures robotisées de chirurgie endoscopique. Une description de chacune des étapes y est présentée. L’exemple d’une intervention de pontage coronarien, réalisée en utilisant le robot daVinciTM sur un fantôme, illustrera notre approche.
2 Matériels et méthodes
Nous décrivons dans cette section l’utilisation de notre système intégré de planification et de simulation d’interventions chirurgicales robotisées. Les différentes étapes sont illustrées par une application à la chirurgie cardiaque avec le robot daVinciTM : le pontage coronarien à l’aide de l’artère mammaire gauche. Celle-ci est prélevée et utilisée comme voie d’irrigation alternative afin de remédier à une obstruction de la coronaire inter-ventriculaire gauche. Les deux bras et l’endoscope du robot sont introduits par des trocarts dans la cage thoracique du patient.
La chaîne complète nécessite une coopération entre le radiologue, le cardiologue, le chirurgien et les chercheurs en robotique, images et informatique. La première étape consiste à fournir une modélisation du patient et du robot adaptée à une utilisation informatique. Ensuite, de manière interactive, le chirurgien décrira sur ces modèles les buts de l’intervention afin de les traduire en critères mathématiques. Enfin, une optimisation de ces critères aboutira à l’emplacement « idéal » des points d’incision et à la position du robot. Ces résultats, fournis et vérifiés automatiquement, sont validés par le chirurgien en répétant virtuellement l’intervention. Toutes les étapes de l’approche détaillée ci-dessous sont intégrées dans un même système, accessible par une interface unique.
2.1 Modélisation
La première étape consiste à représenter l’environnement de travail, puisque le positionnement du robot, et donc le succès de l’intervention, en dépendent. Il s’agit de fournir des modèles géométriques (qui soient adaptés à une utilisation informatique) des organes du patient et du robot, ainsi que leur relation géométrique au bloc opératoire.
2.1.1 Données du patient
Une acquisition scanner avec injection d’un produit de contraste, synchronisée avec l’électrocardiogramme, permet d’obtenir une vue globale du thorax du patient. Les données sont traitées avec des méthodes d’analyse d’image pour extraire des modèles surfaciques correspondant aux différentes entités anatomiques concernées : cœur, cage thoracique, artère mammaire gauche. Conjointement, l’arbre coronaire gauche peut être modélisé en 3D à partir d’un examen de coronarographie et pourra être par la suite fusionné avec le modèle surfacique du cœur pour enrichir le contexte opératoire (cf. 〚4〛).
2.1.2 Modélisation du robot
Une reproduction suffisamment réaliste des mouvements du robot est obtenue en utilisant le modèle géométrique du support et des instruments enrichi de certaines données caractéristiques, comme les butées articulaires du robot. De plus, un algorithme de détection de collisions prévoit les contacts entre les bras manipulateurs.
2.2 Choix du site opératoire
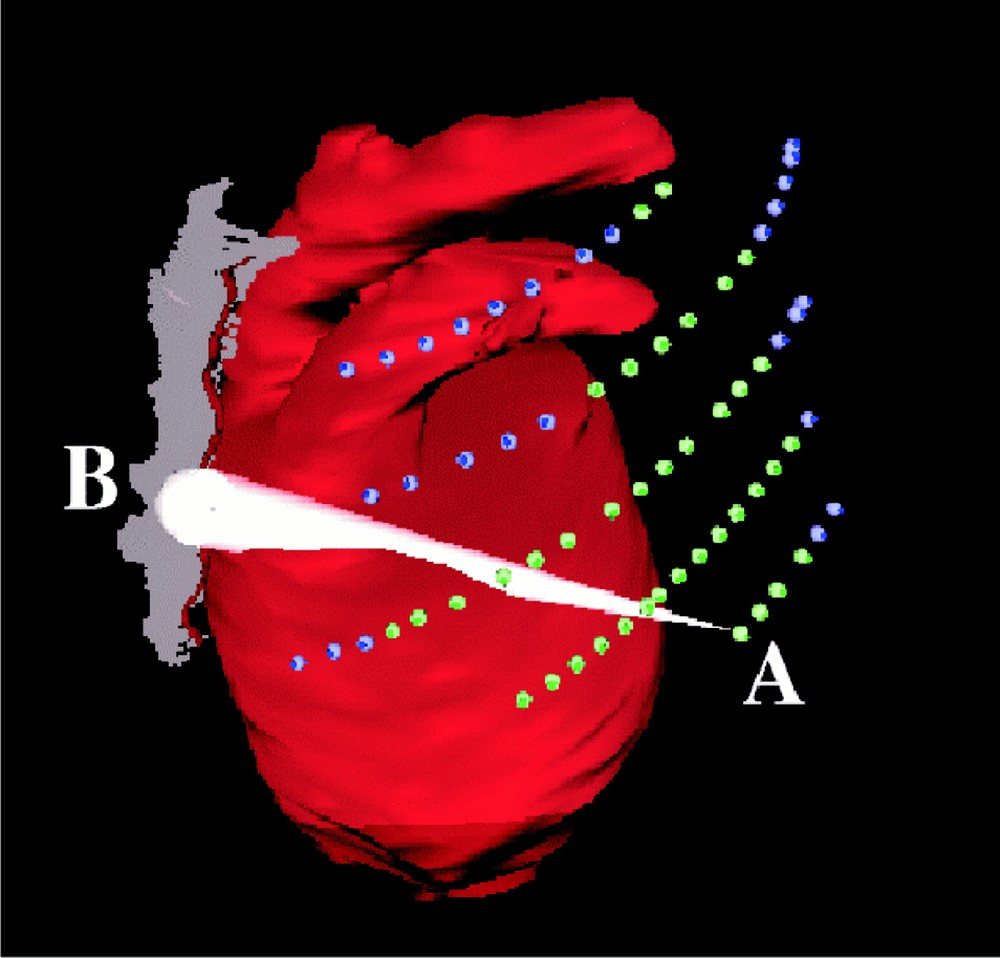
Afin d’optimiser l’emplacement des incisions, le chirurgien indique sur les modèles anatomiques reconstruits du patient les zones sur lesquelles il souhaite opérer, ainsi qu’une direction privilégiée. Ces zones cibles sont représentées dans le simulateur par des cônes indiquant surface opératoire et direction privilégiée, comme illustré sur la Fig. 3.
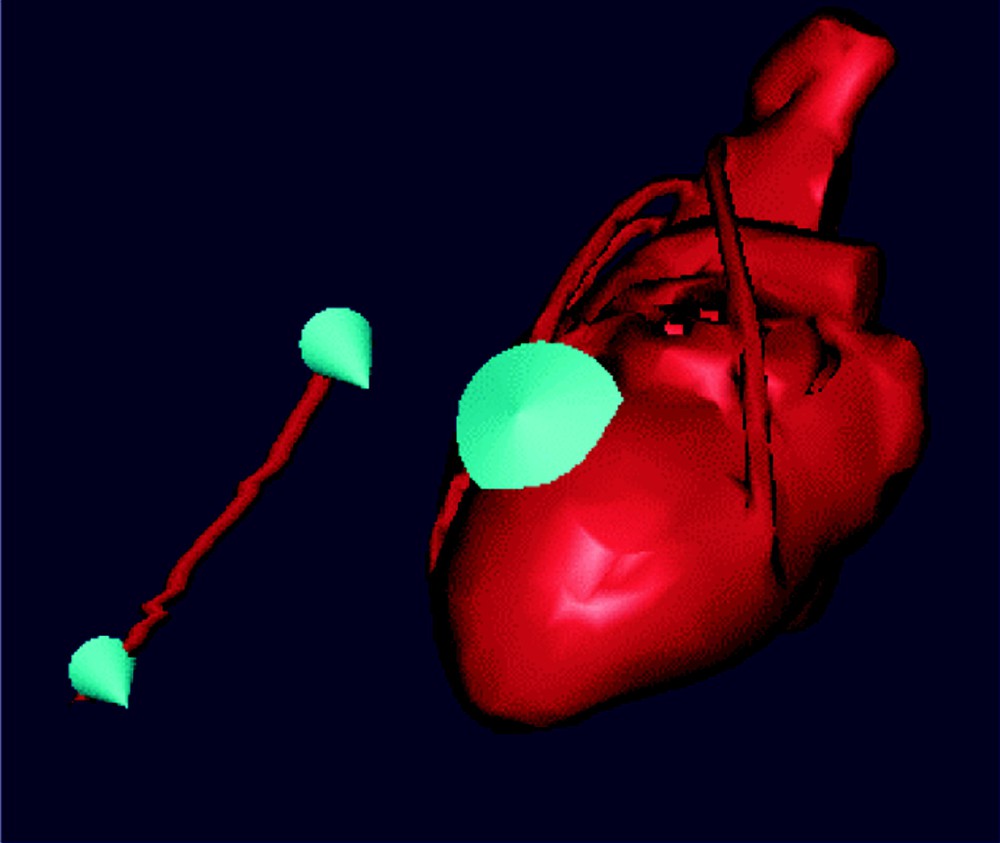
Le chirurgien choisit les zones sur lesquelles il veut intervenir à l’aide d’une interface adaptée (cf. Fig. 7).
Il s’agit ensuite de délimiter les parties sur lesquelles des incisions peuvent être effectuées. Dans le cas d’un pontage coronarien, cette zone est limitée aux espaces intercostaux (cf. Fig. 4), où en chaque point est calculé la normale à la surface de la peau.
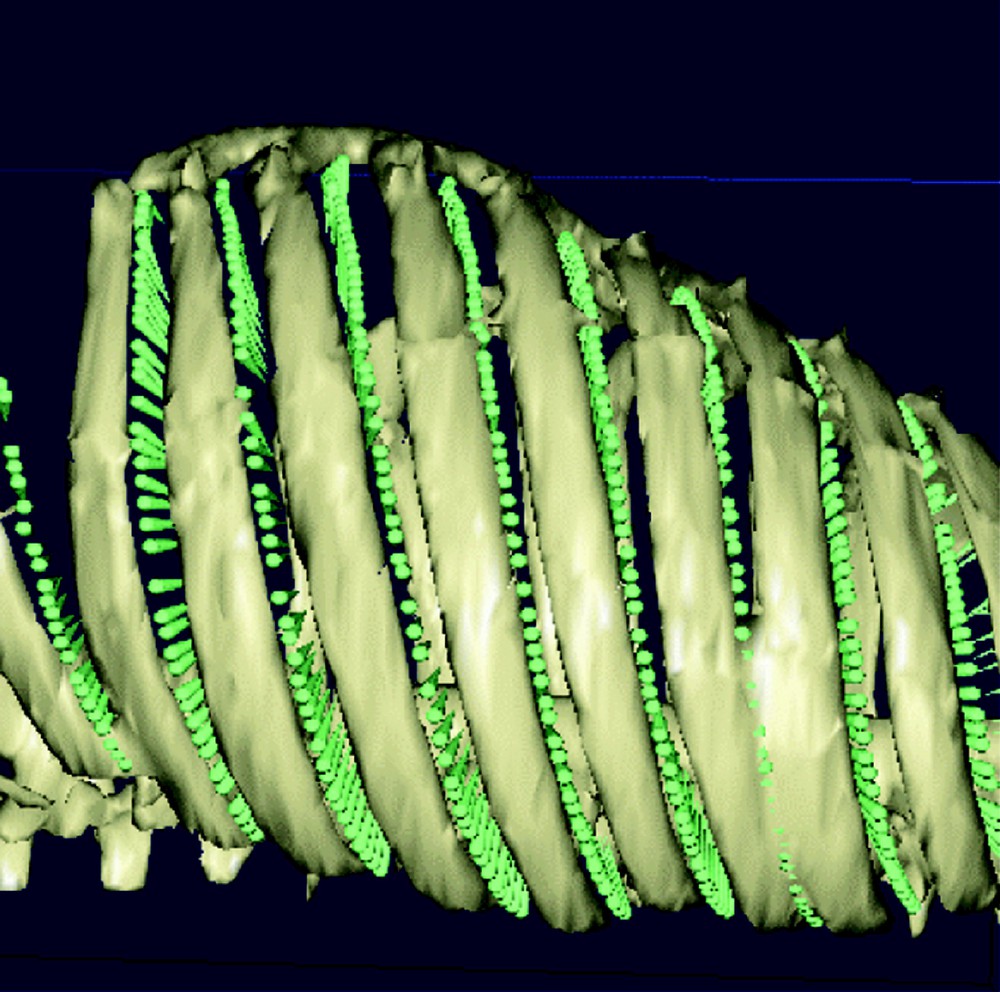
Les espaces intercostaux représentent les points d’entrée potentiels des instruments.
2.2.1 Emplacement des incisions
Parmi les points de la Fig. 4, certains seront retenus comme candidats pour une incision ; on les appelle points admissibles. Ces points doivent vérifier les propriétés suivantes :
- • la distance entre le point d’entrée et le point cible (d sur la Fig. 5) doit être comprise dans un intervalle caractéristique du bras manipulateur ;
- • l’angle entre la droite joignant un point cible au candidat admissible et la normale à la cible (α sur la Fig. 5) doit être le plus petit possible afin de faciliter le geste chirurgical ;
- • l’angle entre la droite joignant un point cible au candidat admissible et la normale à la peau (β sur la Fig. 5) doit être suffisamment petit pour ne pas endommager les côtes ;
- • aucun obstacle ne doit gêner l’accès aux cibles, comme c’est par exemple le cas sur la Fig. 6 ; la méthode utilisée pour détecter ces collisions s’inspire de la référence 〚5〛.
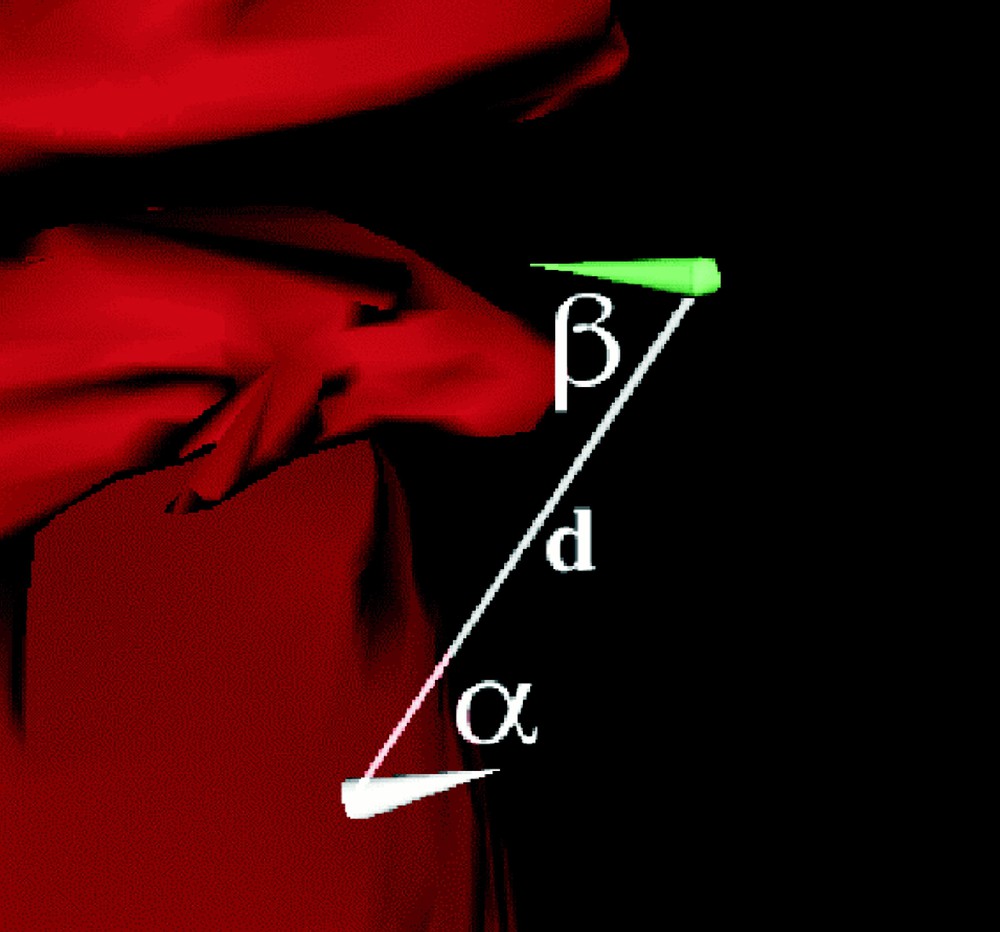
Différentes mesures utilisées pour définir les points admissibles.
Un des tests d’admissibilité.
Parmi les points admissibles, le triplet de points qui offre la meilleure dextérité et un maximum de confort au chirurgien est recherché. Ce triplet ne doit en aucun cas entraîner une situation de collision ou de mise en butée. Pour ce faire, à chaque point admissible est affectée une mesure de dextérité, qui correspond à l’angle α sur la Fig. 5, valable à la fois pour les outils manipulateurs et pour l’endoscope. L’emplacement optimal de l’endoscope est d’abord déterminé sur cette base. Le triplet est ensuite complété par la paire de points admissibles de meilleure dextérité qui respecte la symétrie des bras droit et gauche du chirurgien.
2.2.2 Positionnement du robot
Le problème du positionnement du robot consiste à trouver une configuration initiale des bras manipulateurs qui permette d’atteindre toutes les cibles et de réaliser toutes les trajectoires nécessaires à l’accomplissement du geste opératoire, sans causer de collisions (entre les bras ou avec une autre entité anatomique telle que l’épaule). Cette position devrait bien sûr correspondre à l’emplacement de la section précédente.
Pour ce faire, ces contraintes sont formalisées et associées à une fonction de coût, le coût d’une collision étant infini. Certaines contraintes sont plus difficiles à exprimer que d’autres ; c’est le cas par exemple des collisions avec l’environnement opératoire, qui varie en fonction des salles. Ensuite, cette fonction est appliquée à des configurations choisies aléatoirement dans l’espace des configurations du robot. Un algorithme de gradient caché est utilisé pour affiner le choix des configurations et aboutir à celle qui minimise la fonction de coût et correspond donc au meilleur positionnement du robot selon les contraintes données. Cette méthode est décrite avec plus de détails dans 〚6〛.
2.3 Vérification automatique
Une fois le robot positionné, le bon déroulement de l’intervention est vérifié automatiquement en reproduisant les gestes simplifiés du chirurgien et en s’assurant qu’aucune collision externe, mise en butée ou condition indésirable non explicitement prise en compte précédemment ne se produira. Naturellement, plus l’environnement de simulation et les gestes reproduits sont réalistes, meilleure est la validation de la solution obtenue. Ainsi, les trajectoires entre points cibles définis ne sont pas modélisées de manière rectiligne, mais contournent les organes vitaux en utilisant une méthode de suivi basée sur les fonctions implicites 〚7〛, ce qui augmente le réalisme du geste reproduit.
2.4 Simulation
La validation ultime du positionnement proposé est obtenue par simulation (cf. Fig. 7). À l’aide d’un dispositif de navigation en trois dimensions (souris 3D ou console maître du robot reliée au simulateur), l’utilisateur a la possibilité de déplacer virtuellement le robot dans les modèles anatomiques du patient. Durant cette phase, le chirurgien peut également expérimenter différentes stratégies opératoires et « répéter » son geste en se familiarisant avec l’anatomie du patient et les outils robotisés. Cette fonctionnalité sera également très utile pour l’apprentissage du geste.

L’interface en mode simulation ; l’illustration montre la vue externe ainsi que la vue endoscopique, seule disponible pendant l’intervention
2.5 Recalage et surveillance
Au bloc opératoire, le robot doit être positionné par rapport au patient comme le suggèrent les résultats de la planification. Ce recalage est effectué en appariant des points reconnaissables sur le patient et dans le simulateur. Grâce à une interface de connexion au robot, nous pouvons utiliser le robot pour pointer ces zones et déterminer leur position exacte (voir 〚6〛). Nous pouvons donc situer le patient par rapport au robot et le positionner conformément aux résultats planifiés. La précision de ce recalage est égale à la précision des capteurs de position du robot. Considérer une marge d’erreur lors de la planification permet de procéder en toute sécurité.
De plus, l’intervention est enregistrée et peut être rejouée ultérieurement dans le simulateur. Cet enregistrement s’utilise pour l’évaluation et l’archivage de l’intervention.
2.6 Interface
Toutes les étapes décrites précédemment sont intégrées dans un même système avec une interface utilisateur unique (cf. Fig. 7), qui sera utilisée à la fois par le radiologue, le cardiologue et le chirurgien. Cette unification des outils informatiques simplifie leur utilisation et donne plus de rigueur à l’approche suivie.
3 Résultats
Notre approche a été testée sur un fantôme en plastique du torse et du cœur, préalablement scanné, avec les artères coronaires et mammaires représentées par un matériel radio-opaque. Des emplacements types ont été choisi sur le cœur et la mammaire afin de définir les cibles de l’intervention et d’obtenir le meilleur positionnement du robot. Ce positionnement a été vérifié automatiquement et validé avec succès en simulation.
La position planifiée a été reproduite dans le bloc opératoire comme décrit dans le § 2.5. Ensuite, les étapes clés de l’intervention, à savoir la dissection de l’artère mammaire et le pontage sur la coronaire, ont été effectuées par le chirurgien à partir de la console maître sur le modèle en plastique. L’évaluation du positionnement par le chirurgien était très satisfaisante, et aucune collision ni autre problème n’ont été observés. Les Figs. 8 et 9 montrent l’emplacement des incisions et le positionnement correspondant du robot en mode virtuel et sur le fantôme.

Résultat de l’emplacement des ports et positionnement du robot.

Application des résultats de la planification au fantôme.
Ces résultats sont très proches de ceux obtenus par un placement empirique réalisé par le chirurgien. Cependant, il ne faut pas oublier que, dans le cas de cette expérience, le chirurgien travaille sur un fantôme transparent et malléable, sur lequel il pourrait tester et adapter le positionnement du robot. Ceci ne sera pas le cas avec un patient, car le but sera alors de ne faire que trois incisions. Il s’agit donc de garantir que toute la procédure sera possible à travers ces incisions sans que le robot ne se trouve en situation de collision ou de butée.
4 Discussion
Bien que la dextérité obtenue soit très encourageante, il faut noter que cette expérience a été réalisée sur un fantôme simple (torse sans épaule ni diaphragme). Il reste donc à complexifier le fantôme pour prendre en compte d’éventuelles limitations quant au choix des points admissibles, ce qui rend l’optimisation plus délicate. Le fantôme est en cours d’amélioration pour devenir plus réaliste, ce qui permettra une validation plus complète de notre approche. Il importe aussi de noter que la procédure de recalage reste à affiner et à simplifier.
5 Conclusion
La méthode décrite s’inscrit dans le cadre d’interventions chirurgicales robotisées mini-invasives. Aujourd’hui, ces interventions ne sont appliquées qu’aux cas les plus adaptés à la structure du robot et aux compétences des chirurgiens. Notre méthode offre une systématisation de la planification, en intégrant un savoir-faire pluridisciplinaire de radiologie, cardiologie, chirurgie, robotique et image–vision. Elle permet aussi la simulation ainsi que l’archivage des interventions et sert d’outil d’apprentissage et de validation préopératoire.
Nous espérons que ce travail permettra à terme une généralisation du système à des interventions plus délicates et réduira le taux de conversion à une chirurgie classique des procédures qui se trouvent bloquées à cause d’un mauvais placement ou d’une collision. Ce système intégré devrait également permettre de tester de nouveaux types de procédures.
Remerciements
Les auteurs remercient Fabien Mourgues et Laetitia Grimaldi pour leur relecture et les corrections qu’ils ont apportées à cet article.



