Abridged English version
For a long time, the Mediterranean Sea has been known as an area with lower nutrient concentrations and higher nitrate/phosphate ratio (N/P) than the world ocean. While ocean waters show N/P close to the Redfield's ratio of 16:1, Mediterranean values are recognized higher than 20:1 in the western basin and higher than 25:1 in the eastern basin. In the whole western basin and on several seasons, the vertical distribution of the N/P ratio can exhibit very high values, often higher than 30. Extensive nitrogen fixation in the Mediterranean Sea has been inferred from nutrient budgets and elevated N/P ratio in deep waters. While any direct nitrogen fixation data are still unavailable, δ15N data in fossil chlorophyll provide geochemical evidence for extensive nitrogen fixation in the eastern Mediterranean. In the same way, δ15N data in settling particles suggest that dissolved atmospheric nitrogen may act as a significant new nitrogen source.
To test this hypothesis, nitrogen fixation experiments were carried out during 12 cruises in the northwestern Mediterranean Sea at one station named DYFAMED (DYnamique des Flux Atmosphériques en MÉDiterranée – 43°25′N, 7°52′E). Nitrogen uptake rates and primary production rates were simultaneously determined at six levels between surface and 60 m using the dual labelling 13C/15N procedure, where both 15N and 13C were added into the same bottle. Experiments were performed from dawn to dusk, and then incubation time is noted as the diurnal period, dd.
The seasonal hydrological regime varies from winter mixing (January–February) to strong thermal stratification in summer and fall. Winter period is characterized by high nutrient concentrations in surface due to intense vertical mixing. During spring, nitrate concentrations decreased to due biological consumption and a nitracline appeared around 20–30 m. The nitracline becomes deeper during summer until autumn. In autumn and winter, primary production rates were weak and variable, while nitrogen fixation was often close to the detection limit along the water column (<2 nmol N l−1 d−1d). During the spring period, in parallel with the phytoplancktonic bloom, primary production increased up to 60 mg C m−3 d−1d in surface. Nitrogen fixation increased concurrently, reaching 17 nmol N l−1 d−1d in March 2003 and 4 nmol N l−1 d−1d in April 2004. In summer, rates of primary production were low (<10 mg C m−3 d−1d), close to those measured in winter. Nitrogen fixation seemed to be more variable with some high rates (>4 nmol N l−1 d−1d) measured in surface in July and August.
Areal nitrogen fixation rates were around 40 to 100 μmol N m−2 d−1d along the year, but reached 400 μmol N m−2 d−1d in spring. Nitrate uptake show higher integrated rates, especially during the spring period, where nitrogen fixation represented less than 5% of new production. Nevertheless, under summer oligotrophic conditions, nitrogen fixation contributed significantly to new production, up to 40%. It would be noted, that applying a C/N ratio of 6.6, the carbon assimilation sustained by nitrogen fixation was very low, always less than 5% of the biological demand. Nevertheless, nitrogen fixation rates measured in the Mediterranean Sea are quite equivalent to those found in other oceanic systems and often higher than rates given for Trichodesmium populations. Moreover, the annual fixation rate (34 mmol N m−2 yr−1) could balance the nitrogen budget for the whole Mediterranean Sea, and this new nitrogen input could explain the high nitrate/phosphate ratio observed in deep waters.
Historically, marine diazotrophs have not been considered to be either diverse or abundant, with Trichodesmium, a genus of filamentous cyanobacteria without heterocysts, as the only globally significant oceanic photosynthetic diazotroph. The genus Trichodesmium has been rarely observed in the western Mediterranean Sea, and never reported in the Ligurian Sea. In absence of detectable Trichodesmium populations in our samples, some nanoplanktonic or picoplanktonic organisms could be responsible of the Mediterranean diazotrophy. The pronounced variability in nitrogen fixation, especially observed during summer, could have been caused either by patchiness of the diazotrophic biomass or by variability in their nitrogen fixing capacity. The reason of this variability is not easy to judge with the present available information, and it will be necessary to conduct studies on a broader and more systematic basis in order to record new data on nitrogen fixation, which make it possible to work out a reliable budget for nitrogen input into the Mediterranean Sea.
1 Introduction
La mer Méditerranée est connue depuis longtemps comme une mer oligotrophe possédant une faible charge nutritive [1] et présentant une anomalie dans le rapport entre les deux composés nutritifs majeurs que sont le nitrate et le phosphate. En effet, alors que ces composés se distribuent dans l'océan mondial dans un rapport proche de la valeur 16/1, dit rapport de Redfield [2], le rapport nitrate/phosphate des eaux profondes de Méditerranée est supérieur à dans le bassin occidental, et à dans le bassin oriental [3]. Des valeurs très élevées, supérieures à 30, sont parfois trouvées dans les eaux superficielles, siège de l'activité biologique [4,5]. Bien que le nitrate soit considéré comme l'élément limitant de la productivité dans la plupart des océans [6], le déficit en phosphate des eaux méditerranéennes, observé depuis longtemps [7], a amené certains auteurs à considérer cet élément comme le facteur nutritif limitant la production primaire [8] dans cette région. Ceci est particulièrement vrai dans certains milieux confinés, où l'apport d'un excès azote d'origine atmosphérique entraînerait à long terme un déficit en phosphore [9]. La fixation de diazote par voie biologique, ou diazotrophie, a souvent été proposée comme source d'azote externe [10–12] pour expliquer ces particularités méditerranéennes. Bien que ce processus n'ait jamais été mesuré directement en Méditerranée, des indices de son importance ont été récemment mis en évidence. Sachs et Repeta [13] ont montré à partir des enrichissements naturels en azote (δ15N), à la fois dans le phytoplancton et le nitrate, que la diazotrophie devait être un processus majeur d'apport d'azote en Méditerranée orientale. De même, la faible valeur du δ15N mesuré sur la matière particulaire qui sédimente dans le golfe du Lion (Méditerranée nord-occidentale) ne peut s'expliquer que par une source d'azote atmosphérique apportée au milieu marin par l'activité d'organismes diazotrophes [14].
Dans le cadre des opérations MELISSA (MÉditerranée LImitationS Saisonnières) et PECHE (Production et Exportation du Carbone : contrôle par les organismes HÉtérotrophes à petite échelle de temps) du programme Ocean Flux (PROOF), des mesures de fixation de diazote ont été réalisées pour la première fois en Méditerranée, dans le but d'estimer le rôle de ce processus dans le système productif et son importance dans le bilan biogéochimique.
2 Matériels et méthodes
Les expériences ont été réalisées en Méditerranée nord-occidentale dans la zone centrale de la mer Ligure au site DYFAMED (DYnamique des Flux Atmosphériques en MÉDiterranée – 43°25′N, 7°52′E), en 2003, au cours de trois campagnes dans le cadre du programme PECHE, et en 2004, au cours de neuf campagnes dans le cadre des programmes MELISSA et PECHE. Les échantillons d'eau ont été récoltés avant le lever du jour à l'aide d'une rosette de bouteilles Niskin de 12 l à six niveaux de profondeur, entre 3 et 60 m. Des flacons de 20 ml en polyéthylène ont été immédiatement remplis après trois rinçages et empoisonnés au chlorure mercurique (HgCl2 = 1 μg ml−1) selon la procédure de Kirkwood [15]. Ces échantillons sont conservés au frais jusqu'à l'analyse au laboratoire des teneurs en nitrate et phosphate, selon une procédure colorimétrique automatique [16]. Les assimilations de trois formes inorganiques d'azote (nitrate, ammonium, diazote), et la fixation de carbone (production primaire) ont été mesurées simultanément par la méthode isotopique au double marquage 13C/15N [17]. Trois flacons NALGENE de 600 ml en polycarbonate sont remplis avec l'eau de prélèvement pour chaque niveau de profondeur. Le traceur 13C (0,5 ml NaH13CO3 à 6 g 250 ml−1) est immédiatement ajouté dans chacun des flacons. Deux flacons sont également enrichis en nitrate (50 μl de solution à 1 μmol ml−1 ; 99% 15N–NO3 EURISOTOP) ou en ammonium (100 μl d'une solution à 1 μmol ml−1 ; 99% 15N–NH4 EURISOTOP). Le dernier flacon de la série est hermétiquement fermé après l'ajout du traceur 13C avec un bouchon muni d'un septum en téflon. Le traceur 15N, sous forme de gaz, est alors injecté à l'aide d'une seringue à travers le septum (1 ml 15N2 EURISOTOP, enrichi à 99% 15N2) selon le protocole défini par Montoya et al. [18]. La concentration initiale de diazote n'a pas été mesurée, mais est considérée comme étant à saturation dans ces eaux de surface. L'enrichissement en 15N est calculé à l'aide de la valeur de solubilité définie par Weiss [19], en estimant un équilibre entre la phase gazeuse et la phase dissoute. Ainsi, les enrichissements en 15N des différentes expériences varient entre 11 et 14%.
Ensuite, les bouteilles sont immédiatement placées dans des incubateurs, équipés d'écrans reproduisant l'intensité lumineuse entre 50% et 1% de l'éclairement de surface. La température des bacs est maintenue constante par une circulation permanente d'eau de surface. L'incubation est arrêtée après le coucher du soleil et les échantillons sont immédiatement filtrés sur un filtre en fibre de verre GF/F WHATMAN de diamètre 25 mm préalablement calciné à 450 °C pendant 24 h. Les filtres sont ensuite placés dans un tube en verre préalablement calciné (450 °C pendant 24 h), et mis à sécher à 60 °C pendant 24 h. Après ce délai, les tubes sont fermés et les échantillons sont conservés au sec jusqu'à l'analyse.
La détermination des concentrations en azote et carbone particulaires et des enrichissements en 15N et 13C est réalisée simultanément sur un spectromètre de masse INTEGRA-CN PDZ Europa. L'abondance naturelle a été estimée à () et (), respectivement pour l'azote et le carbone. Seules les valeurs d'enrichissement en excès supérieures à deux fois la valeur de l'écart-type sont considérées comme significatives. Les calculs d'assimilation d'azote sont effectués à partir de l'équation suivante [20] :
| ρN = taux d'assimilation d'azote en nmol N l−1 |
| enrichissement en excès de l'échantillon en 15N |
| NOP = azote organique particulaire en fin d'incubation en nmol N l−1 |
| RDIN = enrichissement initial de l'azote minéral en 15N |
| t= durée d'incubation (en h), correspondant ici à la période diurne, du lever au coucher du soleil, symbolisée par jd. |
La limite de détection calculée à partir de la plus faible valeur d'azote mesurable par le spectromètre de masse (0,2 μmol N) et pour un enrichissement en excès significatif de 0,014% (deux fois l'écart-type de la précision analytique) est de 0,3 nmol l−1. La précision de l'ensemble de la procédure de mesure de fixation de diazote n'a pas été testée au cours de cette étude, mais le coefficient de variation maximum obtenu à partir de 17 triplicats réalisés au cours d'une campagne dans le Pacifique est de 20% [21]. L'assimilation de l'azote sous forme de nitrate et de diazote est considérée comme de la production nouvelle, alors que l'assimilation de l'ammonium correspond à la production régénérée, au sens de Dugdale et Goering [22]. Dans cet article, seuls les résultats de production nouvelle seront présentés.
La production primaire est calculée selon la procédure de Slawyk et al. [17] et les résultats sont fournis en mg C m−3 j−1d. Pour la production primaire, non active la nuit, les taux mesurés sur la période diurne peuvent être assimilés à des taux journaliers bruts, ne prenant pas en compte la respiration nocturne. En revanche, la fixation de diazote et l'assimilation de nitrate peuvent être des processus actifs au cours de la période nocturne, et les taux mesurés ici pourraient en fait être inférieurs aux taux journaliers.
3 Résultats et discussion
La Fig. 1a–c présente l'évolution annuelle des distributions verticales de nitrate, observée à partir des mesures mensuelles. La période hivernale (janvier et février 2004) est caractérisée par d'intenses mélanges verticaux entraînant une homogénéisation de la colonne d'eau et la présence de teneurs élevées de nitrate en surface (2 à 4 μmol N l−1). Dès le mois de mars, le nitrate s'épuise dans la couche 0–20 m (Fig. 1b) et une nitracline marquée entre 30 et 60 m apparaît. Cette dernière s'enfonce au cours de la période estivale (Fig. 1c), établissant une épaisseur d'eau entièrement dépourvue en nitrate atteignant 30–40 m. Ce déficit s'accentue en fin d'été (septembre–octobre, Fig. 1a), intensifiant le degré d'oligotrophie du site d'étude. Il est à noter la remontée de la nitracline observé le 31 août, entraînant la présence de nitrate détectable dès 20 m de profondeur. Le phosphate (données non montrées ici) présente une distribution verticale et une évolution saisonnière tout à fait identiques à celles du nitrate.
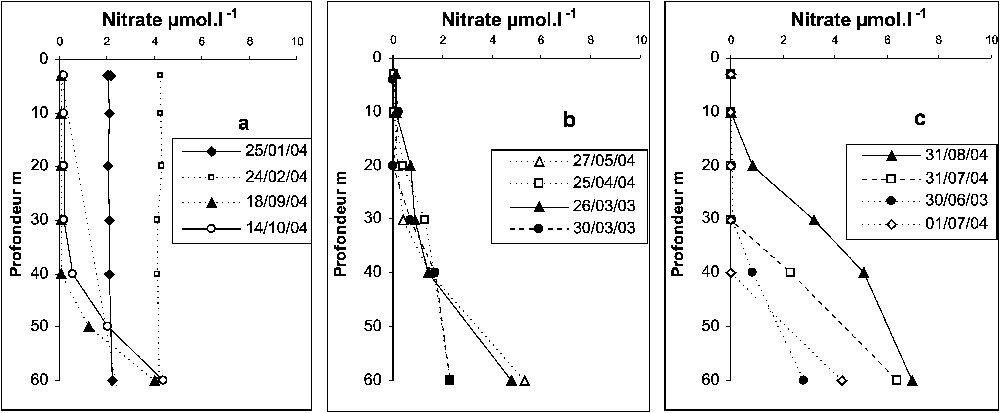
Profils verticaux de nitrate dans la couche 0–60 m.
La Fig. 2 montre l'évolution des profils de production primaire (moyenne de trois réplicats à chaque profondeur) et de fixation de diazote obtenus à différentes saisons au site Dyfamed dans la couche 0–60 m. En automne et en hiver (Fig. 2a), la production primaire est faible (<10 mg C m−3 j−1d) et présente des profils très variables en ces périodes d'absence de stratification (hiver) ou de déstratification (automne) de la colonne d'eau. La fixation de diazote (Fig. 2b) est souvent proche de la limite de détection à toutes les profondeurs (<2 nmol N j−1d), sans apparition d'un niveau maximum. La période printanière est marquée par une nette intensification de la production primaire (Fig. 2c). Il apparaît un maximum marqué entre la surface et 20 m, où les taux de fixation de carbone atteignent 60 mg C m−3 j−1d en mars 2003 et en avril 2004. Le taux de production primaire diminue de manière importante dès le mois de mai, avec des valeurs ne dépassant pas 10 mg C m−3 j−1d. La fixation de diazote (Fig. 2d) montre également un maximum marqué en surface au début du printemps, notamment au cours du mois de mars 2003, où les taux atteignent 17 nmol N l−1 j−1d. Ces valeurs se maintiennent jusqu'à 30 m de profondeur, niveau au-delà duquel la diazotrophie devient négligeable. En avril 2004, bien que la distribution verticale soit similaire, avec un maximum entre 0 et 20 m de profondeur, les taux observés sont beaucoup plus faibles, ne dépassant pas 5 nmol N l−1 j−1d. Dès le mois de mai, les taux de fixation de diazote sont très faibles sur l'ensemble de la colonne d'eau. Au cours de l'été, alors que la zone est caractérisée par une structure hydrologique stratifiée et une couche de surface dépourvue d'éléments nutritifs (nitrate et phosphate), la production primaire est à peu près homogène entre 0 et 40 m (Fig. 2e). Les taux d'assimilation de carbone sont faibles (<5 mg C m−3 j−1d), équivalents à ceux mesurés en hiver. Seul le profil de juin 2004 montre un maximum significatif en surface, atteignant 8 mg C m−3 j−1d. La fixation de diazote (Fig. 2f) révèle une plus grande variabilité. Alors que les profils obtenus en juin 2003 et fin juillet 2004 montrent des valeurs faibles, proches de celles mesurées en hiver (<2 nmol N l−1 j−1d), ceux obtenus début juillet et fin août se caractérisent par des valeurs élevées sur l'ensemble de la colonne d'eau échantillonnée. Contrairement aux observations faites au printemps, ces fortes valeurs de fixation de diazote ne sont pas associées à une augmentation de la production primaire. L'importante variabilité des taux de fixation de diazote observée en période estivale pourrait être due, soit à une hétérogénéité dans la distribution des organismes concernés, soit à une évolution rapide de leurs capacités physiologiques.
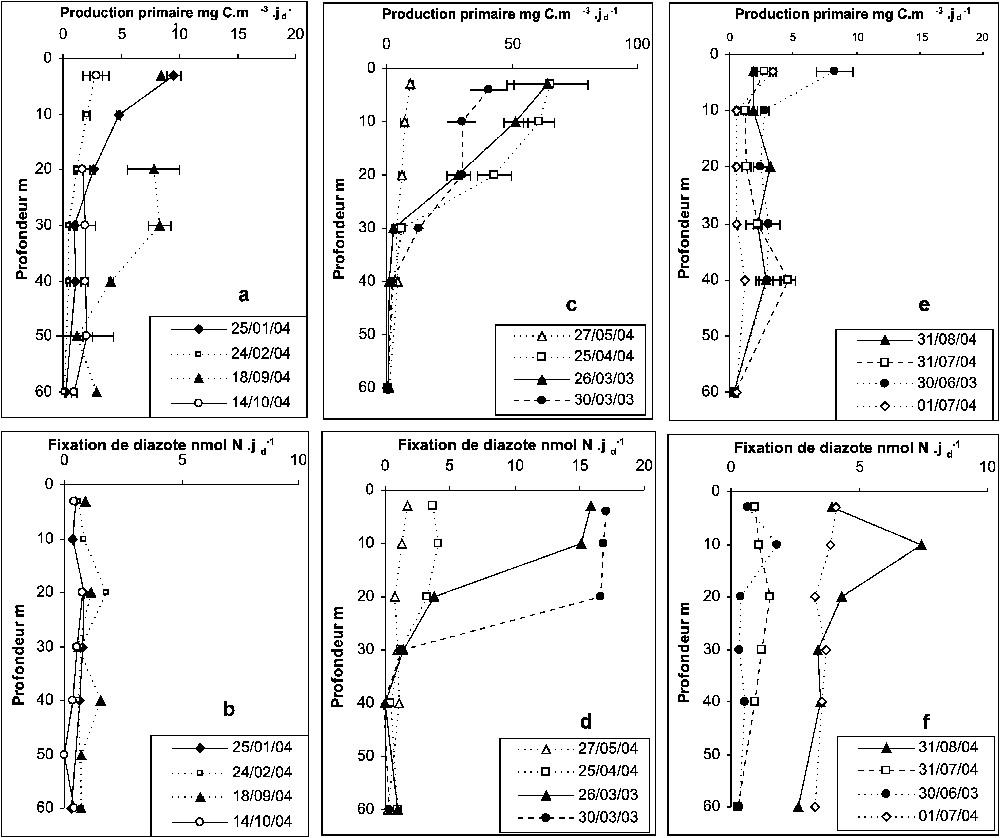
Profils verticaux de production primaire (a, c, e) et de fixation de diazote (b, d, f) entre 0 et 60 m. Les données de production primaire correspondent à la moyenne de trois réplicats à chaque niveau. Les taux de fixation de carbone et de diazote sont mesurés sur l'ensemble de la période diurne, symbolisée par jd.
L'évolution temporelle des valeurs intégrées (Fig. 3) confirme la variation saisonnière précédemment observée. Inférieure à 50 μmol N m−2 j−1d en hiver et en automne, la fixation de diazote est maximale au printemps (>100 et atteignant 400 μmol N m−2 j−1d). Il faut noter la grande variabilité de la période estivale, marquée par deux valeurs intégrées supérieures à 200 μmol N m−2 j−1d.
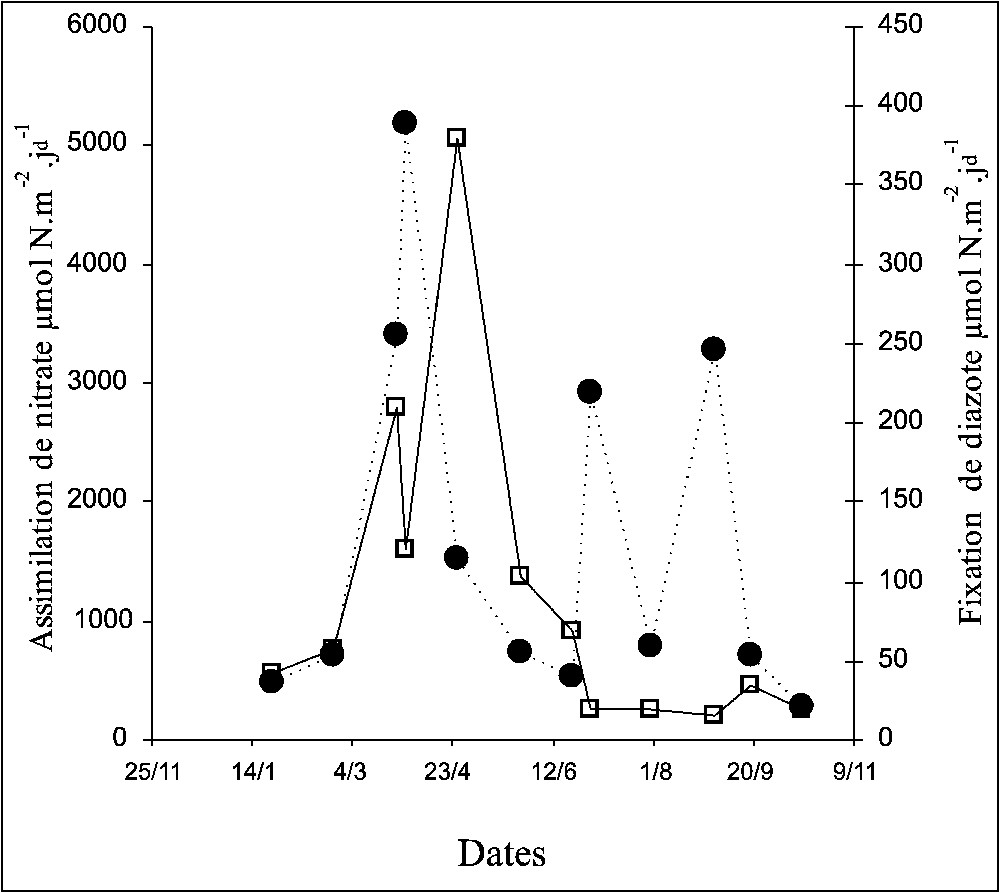
Évolution temporelle des valeurs intégrées de la fixation de diazote (•) et de l'assimilation du nitrate (□).
Les valeurs intégrées d'assimilation de nitrate sont toujours supérieures à celles de la fixation de diazote, notamment en hiver et au printemps, où elle atteint 5000 μmol N m−2 j−1d. La fixation de diazote ne représente alors que en moyenne de la production nouvelle. Lors de la période estivale, de juin à octobre, l'écart entre les deux processus diminue, la fixation de diazote pouvant alors représenter jusqu'à 55% de la production nouvelle ( en moyenne). Les taux journaliers intégrés, mesurés ici pour la première fois en Méditerranée, sont tout à fait comparables, notamment au printemps, à ceux observés en différentes régions océaniques (Tableau 1).
Synthèse des taux de fixation de diazote en milieu pélagique océanique
| Site d'étude | Fixation de diazote | Références | |
| (nmol N l−1 h−1) | Valeur intégrée (μmol N m−2 j−1d) | ||
| Mer Méditerranée (Dyfamed) | 95±82 | Cette étude | |
| Par Trichodesmium sp. | |||
| Atlantique | 62±21 | [23] | |
| Atlantique sud-est | 41–108 | [24] | |
| Mer des Caraïbes | 161±20 | [25] | |
| Bermudes | 41–93 | [26] | |
| Pacifique nord (HOT) | 84±43 | [27] | |
| Mer d'Arabie | 35±7,4 | [28] | |
| Pacifique sud-ouest | 6–474 | [21] | |
| Par le nanoplancton unicellulaire | |||
| Atlantique | 37–47 | [23] | |
| Pacifique nord | 0,016 | 92 | [29] |
| Pacifique nord | 0,01–0,15 | 66±19 | [30] |
| Pacifique nord-est | 0,72±0,20 | 520±160 | [30] |
| Côtes australiennes | 20–62 | 126 | [30] |
| Pacifique sud-ouest | 40–300 | [21] | |
| Par calcul de bilan biogéochimique | |||
| Atlantique nord | 197 | [12] | |
| Océan Atlantique | 48 | [31] | |
| Océan Pacifique | 137 | [31] | |
| Océan Pacifique | 97 | [32] | |
| Pacifique nord (HOT) | 93 | [27] | |
| Pacifique nord (HOT) | 135 | [33] | |
| Mer Méditerranée | 23–78 | [34] |
La production primaire intégrée est inférieure à 200 mg C m−2 j−1d pendant la majeure partie de l'année, sauf durant la période printanière, où elle est multipliée par un facteur 7 (Fig. 4). En appliquant un rapport d'assimilation C/N de 6,6, on note que la part de production primaire soutenue par la diazotrophie est très faible, bien inférieure à celle soutenue par l'autre forme d'azote « nouveau » qu'est le nitrate (Fig. 4). Elle ne représente jamais plus de 5% de la demande biologique, sauf en juillet (38%) et en août (18%). Le nitrate lui soutient 15 à 20% de la demande biologique tout au long de l'année et jusqu'à 50% au printemps.
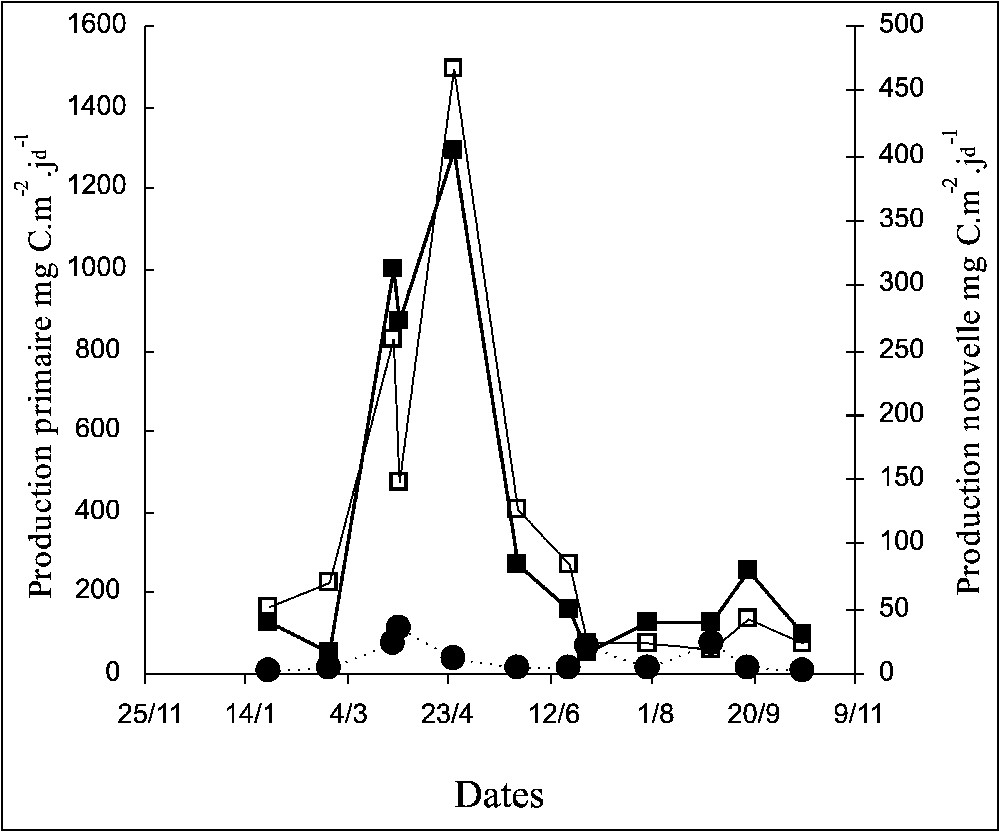
Évolution temporelle des valeurs intégrées de la production primaire estimée par la méthode au 13C (▪), et des taux soutenus par la fixation de diazote (•) et l'assimilation du nitrate (□) en utilisant la valeur de 6,6 pour le rapport C/N.
Le bilan annuel de fixation de carbone (obtenu en sommant les valeurs intégrées moyennes calculées entre chaque sortie successive) est de l'ordre de 100 g C m−2 an−1, valeur située dans la gamme inférieure des estimations récentes obtenues sur la période 1993–1999 au site Dyfamed (86–232 g C m−2 an−1) [35]. La part de production nouvelle soutenue par le nitrate atteint 32 g C m−2 an−1, alors que celle due à la fixation de diazote est dix fois plus faible (3 g C m−2⋅an−1). La production nouvelle ainsi mesurée sur la période 2003–2004 est légèrement inférieure à la moyenne estimée sur la période 1993–1999 au site Dyfamed : 42 g C m−2 an−1 [35]. Il faut souligner que les taux mesurés ici représentent uniquement l'activité au cours de la période diurne. Si la fixation nocturne, connue chez certaines espèces en culture [36], se vérifiait en milieu naturel, la part de la production nouvelle annoncée ici serait alors sous-estimée.
Dans cette étude, le bilan de fixation du diazote (calculé de la même manière que le bilan de fixation de carbone) est estimé à 34 mmol N m−2 an−1 et permet de couvrir une grande partie du déficit, estimé à 28 mmol N m−2 an−1 pour l'ensemble de la Méditerranée [10] et à 44 mmol N m−2 an−1 pour le bassin occidental [34]. Nos résultats confortent l'hypothèse selon laquelle la fixation de diazote serait bien un processus primordial dans les cycles biogéochimiques des éléments nutritifs en Méditerranée, jusqu'à présent estimé à partir de mesures indirectes [10,13,14,37]. Ainsi, le rapport N/P élevé d'environ en Méditerranée occidentale pourrait être le reflet d'un apport important d'azote via la diazotrophie [10].
Les présents résultats ne permettent pas de déterminer les organismes responsables de cette fixation de diazote. Historiquement, les organismes diazotrophes marins étaient considérés comme peu nombreux et peu diversifiés. Des cyanobactéries diazotrophes, symbiontes de diatomées du genre Hemiaulus, ont été mises en évidence [38], mais c'est la cyanobactérie du genre Trichodesmium qui semble jouer un rôle prépondérant en milieu océanique [28,39] depuis la découverte de la fixation biologique du diazote en milieu pélagique [40]. Le genre Trichodesmium a été signalé une seule fois en Méditerranée occidentale [41], mais à des concentrations ne pouvant pas soutenir les taux de diazotrophie notés ici [10]. Cet organisme n'a jamais été observé en mer Ligure [42], et aucun filament (trichome), généralement bien visible en flottaison dans les flacons ou déposé sur les filtres après filtration, n'a été détecté dans nos expérimentations.
Depuis peu, la découverte de cyanobactéries unicellulaires aussi efficaces que Trichodesmium ouvre de nouvelles voies dans l'étude du cycle de l'azote en milieu pélagique [36,43–46]. Des mesures obtenues dans le Pacifique [21,29,30] ont montré que des cyanobactéries nanoplanctoniques présentes à très faible concentration [29] assurent un taux de fixation du diazote important, souvent égal à celui mesuré avec les Trichodesmium (Tableau 1). En Méditerranée nord-occidentale, les cyanobactéries du type Synechococcus et Prochlorococcus sont présentes en permanence [47,48] et dominent la communauté phytoplanctonique estivale en mer Ligure [42]. Si leur capacité à fixer l'azote moléculaire était démontrée, elles pourraient alors contribuer substantiellement à l'apport d'azote « nouveau » dans les milieux oligotrophes. La boucle microbienne qui domine le système productif en période d'oligotrophie [49] ne serait plus seulement le siège privilégié de la régénération de l'azote, mais également celui d'une partie de la production nouvelle au sens de Dugdale et Goering [22]. À l'avenir, il semble nécessaire de mener des études plus approfondies sur la reconnaissance des organismes responsables de cette fixation de diazote, si l'on veut préciser quantitativement le rôle de la diazotrophie au sein de l'écosystème méditerranéen.
Remerciements
Cette étude a été réalisée dans le cadre des opérations Melissa et Propeche, financées par le programme national PROOF du CNRS–Insu. Les auteurs remercient les responsables de ces opérations et l'équipage du navire Téthys II pour l'aide apportée aux prélèvements en mer, ainsi que le correcteur, dont les suggestions ont permis d'améliorer la présentation de ces résultats.


