1 Introduction
La nanofiltration membranaire est un procédé placé entre l’osmose inverse et l’ultrafiltration. Elle s’est développée grâce à l’amélioration des matériaux membranaires [1–4]. En effet, elle permet de travailler sous des pressions modérées de 5 à 15 bar [5, 6] et de séparer des solutés de masses molaires comprises entre 300 et 1000 Da [4, 6], correspondant à des dimensions de l’ordre du nanomètre. Actuellement, la nanofiltration connaît une application considérable pour le traitement des eaux usées, des eaux potables, des eaux colorées et des eaux saumâtres [6–13].
Le mécanisme de séparation en nanofiltration du soluté peut être exprimé en fonction de la charge et/ou de l’effet de la taille [14–16]. Le transport des solutés neutres à travers la membrane se fait par convection, en fonction de la différence de pression et par diffusion en fonction d’un gradient de concentration [13].
Le but principal de ce travail est d’étudier le mécanisme de transfert en nanofiltration, la rétention des sels monovalents et bivalents par la membrane organique NF-45 et de suivre l’influence de différents facteurs, tels que la pression, le taux de conversion et la concentration initiale en soluté, sur la sélectivité de la membrane.
2 Matériels et méthodes
Le pilote de nanofiltration fournit par l’Entreprise européenne de traitement des eaux (ETE) est constitué d’un bac d’alimentation, d’une pompe et d’un module spiralé (Fig. 1). Ce pilote est constitué d’une membrane Filmtec NF-45, de DOW Chemical. Les caractéristiques principales de cette membrane sont données dans le Tableau 1.

Schéma du pilote de nanofiltration. B : bac d’alimentation; P : pompe ; M : module spiralé de nanofiltration ; V1 : vanne qui régule la recirculation et permet de faire varier la pression appliquée à la membrane ; V2 vanne qui régule le débit de rétention et permet de fixer le taux de conversion ; D1 et D2 : débitmètres ; M1 et M2 : manomètres.
Caractéristiques de la membrane de nanofiltration
| FILMTEC NF-45 | |
| Matériau : | |
| – membrane | polyamide composite (film) |
| – support | polysulfone |
| Géométrie | spirale (Sc = 200 Da) |
| Pression maximale | 43 bar |
| Température maximale | 45 °C |
| pH de fonctionnement | 2 à 10 |
| pH de nettoyage | 2 à 11 |
| Tolérance au chlore | 500 mg l–1 h–1 |
| Taux de rejet MgSO4 | > 99% |
| Débit de l'eau (10 bar) | 95 l h–1 |
| Surface de filtration | 2,1 m2 |
Le support macroporeux de la membrane possède une résistance mécanique à la pression allant jusqu’à 17 bar et assurant un flux de solvant élevé. Ainsi, la couche microporeuse, de faible épaisseur, qui comporte des pores de faibles diamètres (≈ 1 nm) bien distribués permet d’assurer un flux élevé et une bonne sélectivité. Cette forme spiralée offre également une grande surface de membrane pour un faible volume.
Les essais ont donc été réalisés avec des solutions de NaCl, NaF, NaI, CaCl2, MgCl2, BaCl2 et (NH4)2SO4, de marque Prolabo, à la même concentration (0,02 mol l–1). Nous avons également poursuivi notre étude en choisissant (NH4)2SO4 comme modèle des sels pour étudier l’effet de la concentration sur les performances de rétention du pilote.
Notre étude permet de suivre l’évolution de la rétention des sels en fonction des paramètres opératoires tels que la pression et le taux de conversion (éq. (1)), selon :
| 1 |
Le taux de conversion Y est contrôlé à l’aide de débitmètres placés sur la sortie du rétentat et du perméat (éq. (2)).
| 2 |
Le suivi des rétentats au cours des manipulations est réalisé par prise d’échantillons.
Les analyses et étalonnages, pour chaque sel pris isolement, ont été faits avec un conductimètre de marque Crison 525. Pour une meilleure fiabilité dans la comparaison des résultats, toutes les valeurs obtenues sont converties à une température de 20 °C.
3 Résultats et discussion
3.1 Mécanisme de transfert en nanofiltration
La nanofiltration, qui se trouve à la transition entre deux techniques de séparation (osmose inverse et ultrafiltration), implique deux mécanismes différents de transfert de soluté ; tous deux agissent séparément, mais de façon additive, sur le transfert. Le premier mécanisme, semblable à celui de l’osmose inverse, est de type diffusionnel ; il est indépendant du débit de solvant et de la pression ; il ne dépend que du gradient de concentration de part et d’autre de la membrane. Dans ce cas, la sélectivité de la membrane est davantage liée au coefficient de partage (fonction de l’énergie de solvatation et l’énergie d’hydratation du soluté) [17] entre la membrane et la solution, qu’au coefficient de transfert [17–19]. Le second mécanisme correspond à un entraînement sélectif des solutés par le solvant à travers la membrane : la convection [6, 20, 21].
Le flux total de soluté peut alors être considéré comme la somme des flux diffusif et convectif (eq. (3)) :
| 3 |
On obtient alors : j = jdiff + A (P – Δπ) Cconv
La concentration du soluté dans le perméat est obtenue après avoir multiplié l’éq. (3) par 1/J (éq. (4)).
| 4 |
La courbe expérimentale représentant la concentration du perméat Cp = f(1/J) en fonction de l’inverse du débit est une droite d’ordonnée à l’origine Cconv et de pente jdiff. La Fig. 2 représente la concentration du perméat des sels en fonction de l’inverse du flux de solvant.
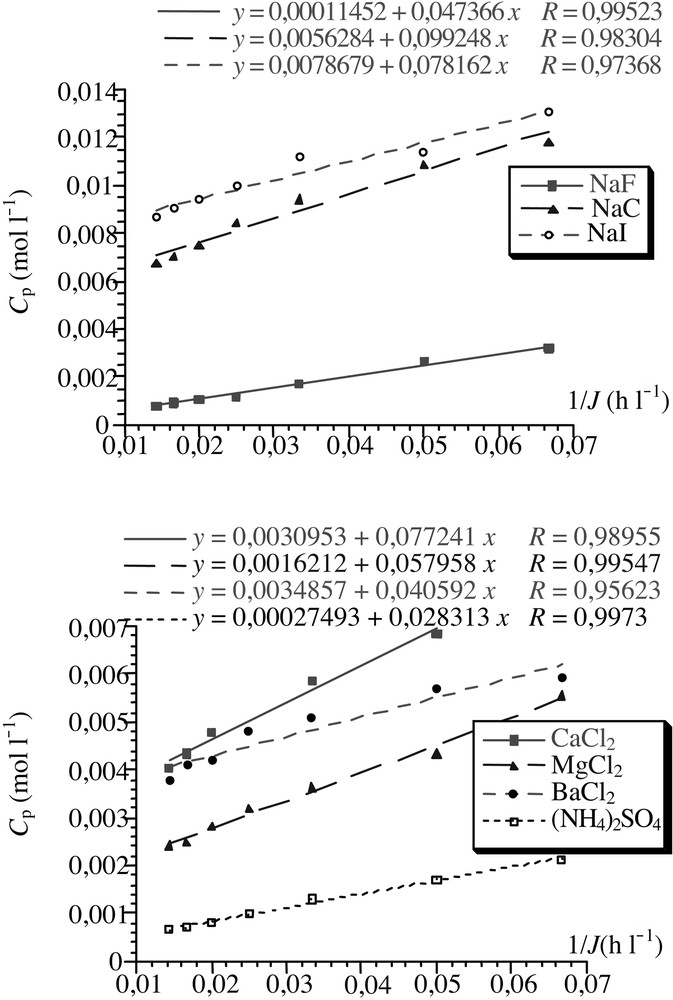
Évolution de la concentration du perméat en fonction de l’inverse du flux de solvant pour les différents sels pris isolement (C = 0,02 mol l–1 ; taux de conversion à 33%).
Ces courbes vérifient bien la théorie et l’on obtient des droites qui permettent de déterminer expérimentalement les valeurs du flux de diffusion jdiff et de la concentration de soluté Cconv entraînée sélectivement par convection [20] (Tableau 2).
Valeurs expérimentales du flux de diffusion et de la concentration due à la convection
| Sels (2 × 10–2 mol l–1) | Cconv (10–4 mol l–1) | Jdiff (10–2 mol m–2s–1) |
| NaF | 1,15 | 4,73 |
| NaCl | 65,3 | 9,92 |
| NaI | 78,68 | 7,82 |
| CaCl2 | 30,95 | 7,72 |
| MgCl2 | 16,21 | 5,79 |
| BaCl2 | 34,86 | 4,06 |
| (NH4)2SO4 | 2,75 | 2,83 |
Le flux diffusif est fonction du coefficient de transfert global, qui dépend de l’énergie de solvatation et de l’énergie d’hydratation.
L’énergie de solvatation par la membrane est difficile à évaluer pour les différents solutés. L’énergie d’hydratation, qui est très forte pour les sels, peut être facilement évaluée à partir du rayon et de la charge des ions ; cette énergie est fonction du carré de la charge et de l’inverse du rayon (ou racine cubique de la masse molaire) [20] (éq. (5)).
| 5 |
Le diamètre du soluté peut être évalué à partir de sa masse molaire [22] (éq. (6)).
| 6 |
À partir des valeurs connues de l’énergie d’hydratation [23], on peut alors tracer la courbe Ehyd = f(q2/M1/3) (Fig. 3).

Énergie d’hydratation des ions et/ou des sels en fonction de leur charge et de leur masse molaire [24].
On obtient une parabole, selon l’éq. (7) :
| 7 |
Cette relation est empirique, mais permet d’évaluer, avec une assez bonne approximation, les énergies d’hydratation des solutés, à partir des seules masses molaires et des charges des différents ions.
3.2 La sélectivité de la séparation des sels par nanofiltration
Dans le but de comprendre la sélectivité de la séparation des sels en nanofiltration, nous avons étudié la rétention des sels de sodium anions (F–, I–, Cl–, SO42–) et des chlorures des cations (Ca2+, Mg2+ et Ba2+), dans les mêmes conditions opératoires, avec un taux de conversion faible (30%) et à fort flux tangentiel, pour qu’on puisse négliger les facteurs de polarisation et minimiser les résistances aux transferts dans les solutions. Les résultats de ces essais sont présentés sur les Figs. 4 et 5.

Évolution du taux de rétention en fonction de la pression en nanofiltration pour les sels NaF, NaCl, NaI et (NH4)2SO4 pris isolement (C = 0,02 mol l–1 ; taux de conversion à 33%).
On observe que les ions monovalents sont moins bien retenus que les ions bivalents [6, 18, 25]. Les ions polyvalents, d’énergie d’hydratation plus élevée, sont mieux retenus que les ions monovalents moins hydratés, conformément au mécanisme de solubilisation–diffusion, comme cela est le cas pour les ions sulfate par rapport aux ions fluorure et chlorure. La rétention des anions se fait dans l’ordre suivant : SO42– > F– > Cl– > I–. Cet ordre suit l’ordre des énergies d’hydratation [5, 20]. On observe aussi que les petits ions, tels que les fluorures, sont mieux retenus que les gros ions.
Ceci est d’autant plus vrai que la pression est plus faible. Le passage des sels et la sélectivité sont donc plus importants à faible pression, où les paramètres chimiques sont prédominants. De même, on observe qu’en général, la rétention est plus importante à forte pression. Ceci correspond au cas où le phénomène de convection l’emporte sur celui de diffusion, tandis que cette dernière est prédominante à faible pression [5, 6, 21, 26].
En ce qui concerne les cations, l’ordre de sélectivité de séparation est le suivant : Mg2+ > Ba2+ > Ca2+. La comparaison des rétentions des deux paires d’ions (Mg2+, Ba2+) et (Mg2+, Ca2+) suit l’ordre des énergies d’hydratation et de la taille de ces ions (Fig. 5) [27]. En revanche, la rétention des ions Ba2+ et Ca2+ ne suit pas cette règle, car Ba2+ est mieux retenu que Ca2+ ; cela est dû à l’effet de la pression.
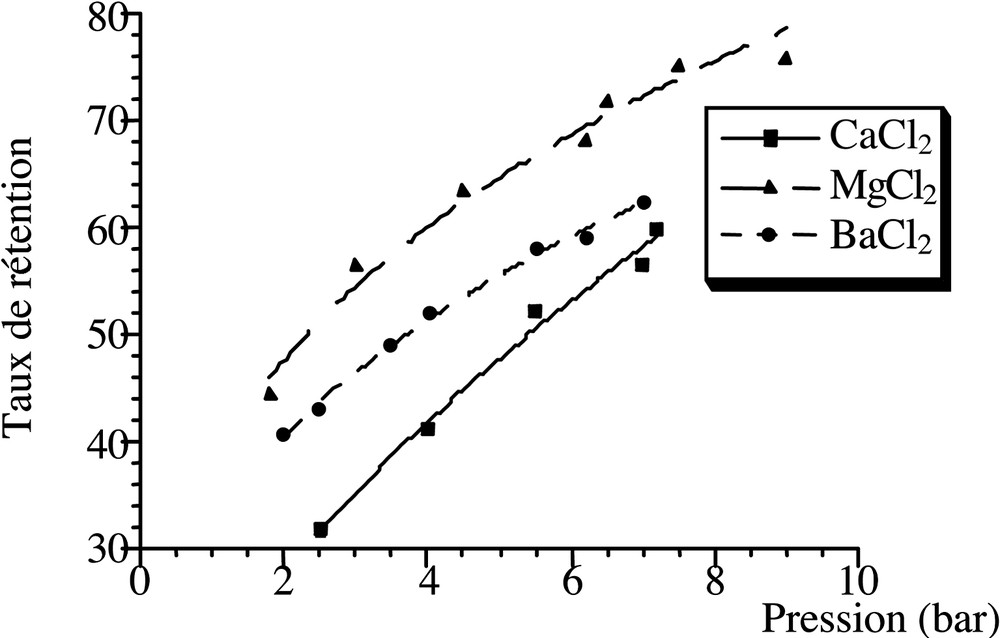
Évolution du taux de rétention en fonction de la pression, en nanofiltration, pour les sels CaCl2, MgCl2 et BaCl2 pris isolement (C = 0,02 mol l–1 ; taux de conversion à 33%).
La Fig. 4 montre que la rétention des fluorures n’est pratiquement pas influencée par la pression. En revanche, la rétention des ions Cl–, I–, Mg2+, Ba2+, Ca2+ et SO42– est beaucoup plus influencée par la pression (Figs. 4 et 5), car la nature du passage de ces sels est d’origine plus physique que chimique. En effet, la diffusion globale est gouvernée par des paramètres chimiques, comme le coefficient de partage P, tandis que la convection est liée à des propriétés physiques, c’est-à-dire à la taille des ions [5, 6, 18, 21].
3.3 Influence de la concentration sur la rétention de (NH4)2SO4
La Fig. 6 représente la rétention du sel (NH4)2SO4 en fonction de la pression, pour différentes concentrations initiales de l’électrolyte dans l’alimentation.
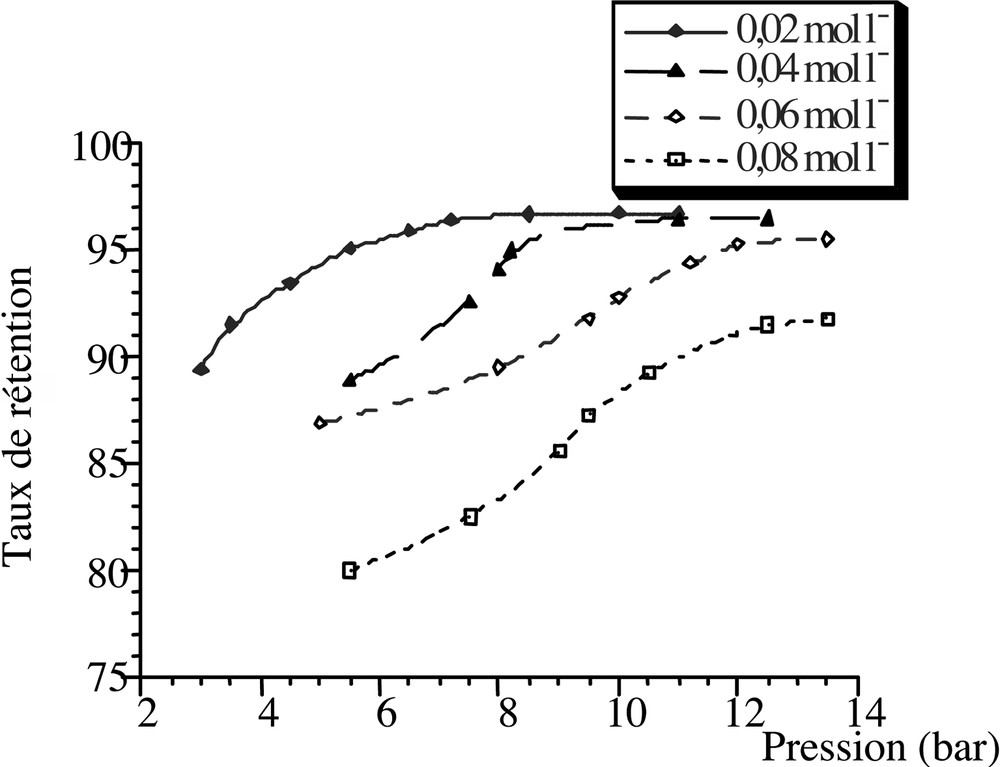
Évolution de la rétention (NH4)2SO4 en fonction de la pression appliquée en nanofiltration, à un taux de conversion de 33%.
Les résultats montrent que les taux de rétention en électrolyte diminuent lorsque la concentration du sel augmente, car l’énergie d’hydratation diminue. En effet, les charges fixes de la couche active sont inhibées partiellement par les contre-ions de l’électrolyte situés à leur voisinage. Cet écrantage est d’autant plus marqué que ces contre-ions sont nombreux. Par suite, l’intensité des interactions électrostatiques entre les ions et les sites actifs membranaires, et donc leur rétention, diminuent lorsque la concentration du sel dissout augmente [14, 25].
3.4 Effet du taux de conversion sur la rétention (NH4)2SO4
Une étude du taux de rétention en fonction du taux de conversion a été réalisée (Fig. 7).
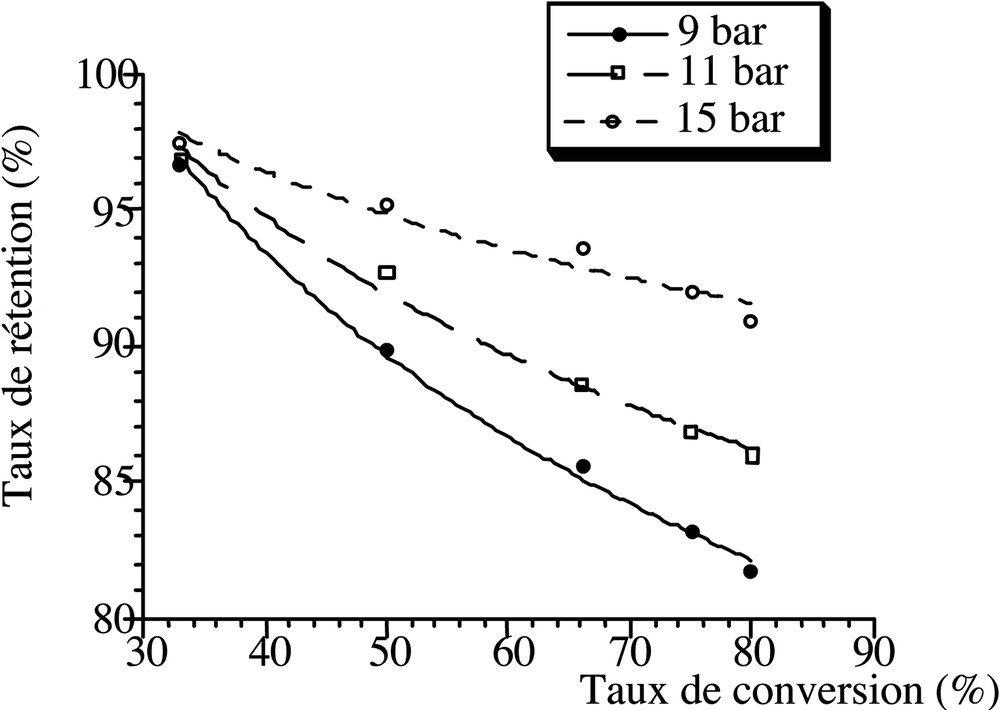
Évolution de la rétention de (NH4)2SO4 en fonction du taux de conversion en nanofiltration (C = 0,02 mol l–1).
Les résultats montrent que pour une même pression et pour le même ion SO42–, une augmentation du taux de conversion entraîne une diminution du taux de rétention du sel (Fig. 7). Ceci est la conséquence de la diminution de la vitesse de circulation tangentielle et de l’apparition d’une couche de polarisation aux forts taux de conversion [6, 28].
4 Conclusion
Cette étude ouvre la possibilité de séparer sélectivement, par nanofiltration, les ions monovalents des bivalents ainsi que les ions de même valence, en jouant sur les conditions opératoires.
La sélectivité de la membrane vis-à-vis des ions, qui est d’origine chimique, est donc meilleure à faible pression.
Cette étude nous permet d’affirmer que les ions les plus petits et les ions bivalents sont mieux retenus, surtout à faible pression, où la sélectivité chimique est prédominante. Ceci provient de l’énergie de solvatation des ions par l’eau, l’augmentation de leur concentration en solution et du taux de conversion faisant diminuer la rétention du sel par la membrane.
Un dessalement sélectif des eaux est donc possible par nanofiltration, afin de produire de l’eau potable à partir d’eaux saumâtres comportant des ions indésirables comme, par exemple, les fluorures.



