1 Introduction
Les anthocyanes sont des composés naturels de la famille des flavonoïdes. Leurs propriétés pharmacologiques, notamment antioxydantes, sont nombreuses et bien décrites dans la littérature [1].
La présente étude fait partie d'un vaste programme de recherche sur les composés anthocyaniques d'origine végétale. Elle porte sur trois plantes, Adenium obesum, Jatropha integerrima et Hibiscus sabdariffa. Si les deux premières sont ornementales, la troisième, encore connue sous le nom d'oseille de Guinée, est très largement consommées en Afrique [2].
Cette étude décrit pour la première fois les anthocyanes des fleurs d'Adenium obesum et Jatropha integerrima et fournit des données spectrales des anthocyanes des calices des fleurs de Hibiscus sabdariffa, jusque-là décrites par des méthodes chimiques [3,4]. Elle compare entre elles les propriétés antioxydantes de certaines des molécules isolées.
2 Méthodologie
Le matériel végétal étudié est décrit dans le Tableau 1.
Matériel végétal étudié
| Plante | Famille | Partie étudiée |
| Adenium obesum | Apocynaceae | Pétales des fleurs |
| Jatropha integuerrima | Euphorbiaceae | Pétales des fleurs |
| Hibiscus sabdariffa | Malvaceae | Calices des fleurs |
Le matériel végétal fraîchement récolté est congelé, puis lyophilisé, broyé et conservé à l'abri de la lumière, de l'humidité et de la chaleur.
Les extraits totaux d'anthocyanes ont été obtenus par macération du matériel végétal dans un mélange éthanol–acide trifluoroacétique (TFA) 99:1, v/v.
Après filtration et concentration, la purification des extraits a été effectuée à l'aide des méthodes CCM, CP, CC et CLHP [4–7]. Les composés majoritaires isolés ont été caractérisés à l'aide des spectrométries UV–visible, masse, RMN, et de la CLHP [5–9].
L'activité anti-oxydante des composés a été mesurée par la méthode au 2,2-diphényl-1-pycrylhydrazyl (DPPH) décrite par Chang et al. [10,11]. Six solutions d'échantillons (de 500 μl) de concentrations différentes sont préparées et 6 ml de solution de DPPH (9,85 mg/250 ml MeOH) y sont additionnés. La densité optique est lue au bout de 10 min au spectrophotomètre à 517 nm contre le méthanol comme blanc. La droite de régression « absorbance en fonction de la concentration » est ensuite établie et la détermination de la concentration correspondant à une variation d'absorbance de 50% par rapport à l'ordonnée à l'origine donne l'IC50. La comparaison de cette valeur à celle de l'acide ascorbique, pris comme référence, mesure l'activité anti-radicalaire de l'échantillon.
3 Résultats
3.1 Identification
Au total douze composés anthocyaniques ont été détectés par screening à l'aide de la CLHP (Fig. 1) et neuf (Fig. 2) ont été isolés et identifiés.
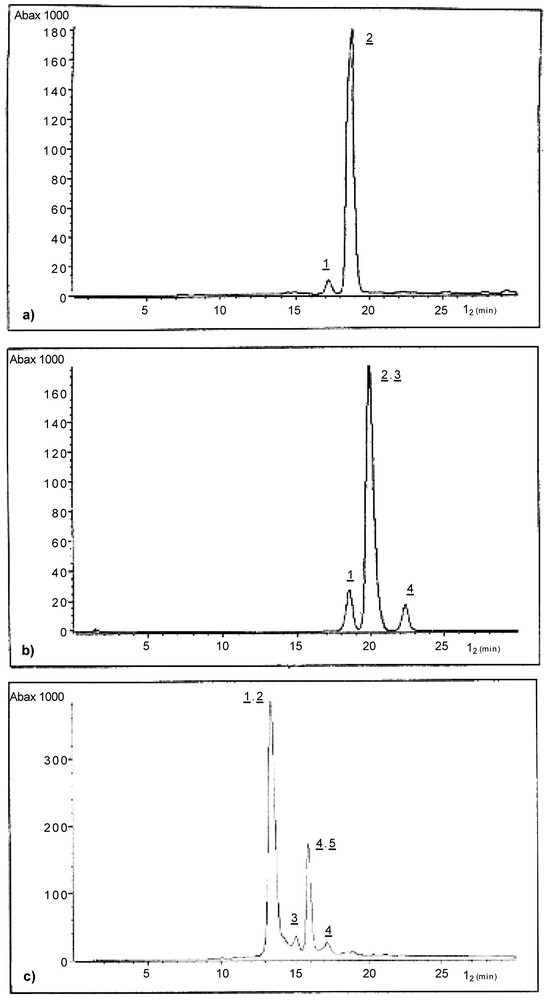
Chromatogramme CLHP d'un extrait méthanolique des fleurs de A. obesium (a), J. integuerrima (b) et H. sabdariffa (c).
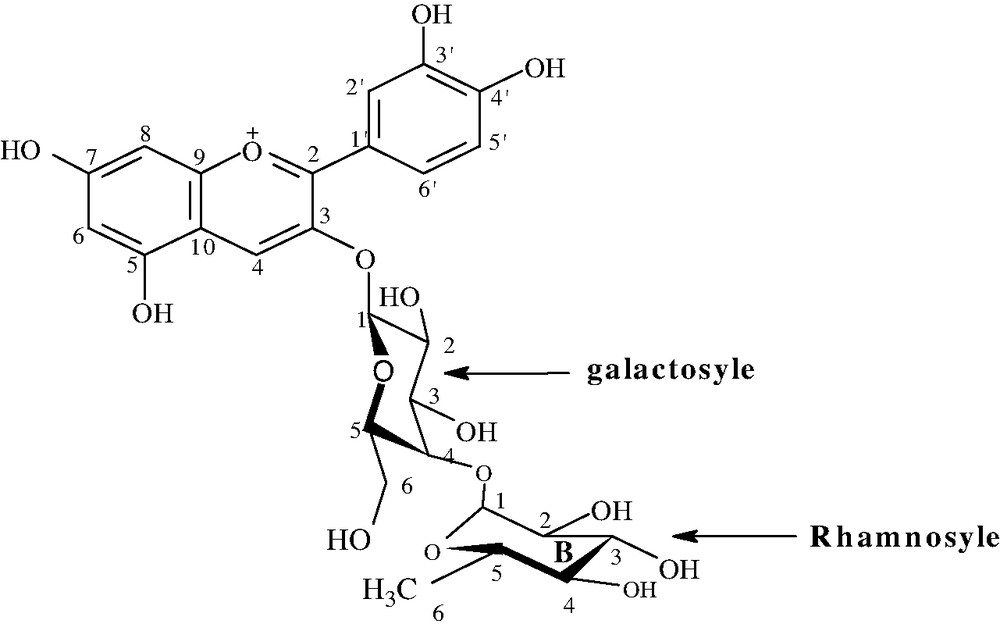


(a) Structure complète du composé 2, cyanidine 3-O-(4-O-α-l-rhamnosyl)-β-d-galactopyranoside isolé des fleurs d'Adenium obesum. (b) Structure complète des composés 1, 2, 3, et 4 isolés des fleurs de J. integuerrima : cyanidine 3-O-β-d-glucopyranoside (1), cyanidine 3-O-(6-O-α-l-rhamnopyranosyl)-β-d-glucopyranoside (2), pélargonidine 3-O-β-d-glucopyranoside (3), pélargonidine 3-O-(6-O-α-l-rhamnopyranosyl)-β-d-glucopyranoside (4). (c). Structure complète des composés 1 (delphinidine 3-O-β-d-glucopyranoside), 2 (delphinidine 3-O-(2-O-β-d-xylopyranosyl)-β-d-glucopyranoside), 4(cyanidine 3-O-β-d-glucopyranoside) et 5 (cyanidine 3-O-(2-O-β-d-xylopyranosyl)-β-d-glucopyranoside) isolés des calices des fleurs de H. sabdariffa. Masquer
(a) Structure complète du composé 2, cyanidine 3-O-(4-O-α-l-rhamnosyl)-β-d-galactopyranoside isolé des fleurs d'Adenium obesum. (b) Structure complète des composés 1, 2, 3, et 4 isolés des fleurs de J. integuerrima : cyanidine 3-Lire la suite
Pour la CLHP, un gradient linéaire de système binaire de solvants d'élution à été appliqué : de 20 à 50% de B (MeOH–H2O–HCO2H, 75:24,5:0,5) dans A (H2O–HCO2H, 60:1) pendant 20 min, puis ces conditions finales d'élution ont été maintenues isocratiquement pendant 10 min [5,6].
Après purification, les Rf en CCM standard, les données du spectre électronique, les temps de rétention en CLHP et CPG ainsi que les produits de l'hydrolyse totale des composés sont obtenus et consignés dans les Tableaux 2–4, entre lesquels l'on peut observer une parfaite concordance.
Données spectrales et chromatographiques de l'anthocyanoside majoritaire 2 des fleurs d'Adenium obesum
| Rf en CCM (× 100) | CLHP | CPG tR (min) | Données des spectres électroniques (0,1% MeOH–HCl) | SIMS | |||||||
| BAWa | BuHCla | HCl 1% a | AcHW a | EAFW b | tR (min) | α | β | sucres correspondants | λmax [log ε] en nm | E440/Emax (%) [+AlCl3]c | m/z |
| 27 | 12 | 13 | 32 | 33 | 18,70 | 12,90 | 14,42 | rhsamnose | 282 [4,13] | 20 [+] | [M]+ 595 [M–146] 449 ; [M–308] 287 |
| 18,31 | 19,25 | galactose | 531 [4,42] |
a Adsorbant = cellulose microcristalline F254 (0,1 mm ; Merck), BAW = butan-1-ol–acide acétique–eau (4:1:5), phase supérieure, BuHCl = butan-1-ol–2 N acide chlorhydrique (1:1), phase supérieure, HCl 1% = acide chlorhydrique conc.–eau (3:97), AcHW = Acide acétique–eau (15:85).
b Adsorbant = silice 60 (0,1 mm ; Merck), EFW = acétate d'éthyle–acide formique–acide acétique–eau (100:11:11:26).
c Addition de 2–3 gouttes de chlorure d'aluminium : + = effet bathochrome ; 0 = aucun d'effet.
Données spectrales et chromatographiques des anthocyanosides des fleurs de J. integuerrima
| Anthocyanosides | Rf en CCM (× 100) | CLHP | CPG tR (min) | Données des spectres électroniques (0,1% MeOH–HCl) | SIMS | |||||||
| BAW a | BuHCl a | HCl 1% a | AcHW a | EAFW b | TR (mn) | α | β | sucres correspon-dants | λmax [log ε] (nm) | E440/Emax (%) [+AlCl3]c | m/z | |
| 1 | 29 | 12 | 05 | 17 | 43 | 18,50 | 19,01 | 21,00 | glucose | 281 [4,33] | 20 [+] | [M]+ 449 ; [M–162] 287 |
| 528 [4,61] | ||||||||||||
| 2 | 29 | 14 | 14 | 34 | 33 | 20,00 | 12,96 | 14,45 | rhamnose | 282 [4,16] | 20 [+] | [M]+ 595 ; [M–146] 449 |
| 19,00 | 20,97 | glucose | 530 [4,43] | [M–308] 287 | ||||||||
| 3 | 40 | 22 | 12 | 29 | 48 | 20,00 | 18,97 | 20,94 | glucose | 269 — | 37 [0] | [M]+ 433 ; [M-162] 271 |
| 433 — | ||||||||||||
| 510 — | ||||||||||||
| 4 | 38 | 22 | 21 | 45 | 46 | 22,30 | 13,00 | 14,50 | rhamnose | 270 [4,16] | 37 [0] | [M]+579 ; [M-146]433 [M-308]287 |
| 19,03 | 21,01 | glucose | 433 [3,94] | |||||||||
| 511 [4,37] |
a Adsorbant = cellulose microcrystalline F254 (0,1 mm ; Merck), BAW = butan-1-ol–acide acétique–eau (4:1:5), phase supérieure, BuHCl = butan-1-ol–2 N acide chlorhydrique (1:1), phase supérieure ; HCl 1% = acide chlorhydrique conc.–eau (3:97), AcHW = acide acétique–eau (15:85);
b Adsorbant = silice 60 (0,1 mm ; Merck), EFW = acétate d'éthyle–acide formique–acide acétique–eau (100:11:11:26).
c Addition de 2–3 gouttes de chlorure d'aluminium : + = effet bathochrome ; 0 = aucun effet.
Données spectrales et chromatographiques des anthocyanosides du calice des fleurs de H. sabdariffa
| Anthocyanosides | Rf en CCM (× 100) | CLHP | CPG tR (min) | Données des spectres électroniques (0,1% MeOH–HCl) | SIMS | |||||||
| BAW a | BuHCl a | HCl 1% a | AcHW a | EAFW b | tR (min) | α | β | sucres correspondants | λmax [log ε] (nm) | E440/Emax (%) [+ AlCl3]c | m/z | |
| 1 | 20 | 07 | 03 | 10 | 37 | 13,70 | 19,07 | 20,95 | glucose | 278 [4,15] | 16 [+] | [M]+465 ; |
| 540 [4,49] | [M-162]303 | |||||||||||
| 2 | 27 | 13 | 23 | 44 | 23 | 13,70 | 14,73 | 15,96 | xylose | 278 [4,16] | 16 [+] | [M]+597 ; [M-132]465 |
| 19,07 | 20,95 | glucose | 541 [4,46] | [M-294]+303 | ||||||||
| 4 | 29 | 12 | 06 | 19 | 43 | 16,10 | 18,97 | 20,93 | glucose | 282 [4,31] | 20 [+] | [M]+449 ; |
| 528 [4,59] | [M-162]287 | |||||||||||
| 5 | 29 | 16 | 17 | 44 | 28 | 16,10 | 14,84 | 16,07 | xylose | 282 [4,23] | 20 [+] | [M]+581 ; [M-132]449 |
| 19,10 | 21,05 | glucose | 528 [4,51] | [M-294]287 |
a Adsorbant = cellulose microcrystalline F254 (0,1 mm ; Merck), BAW = butan-1-ol–acide acétique–eau (4:1:5), phase supérieure, BuHCl = butan-1-ol–2 N acide chlorhydrique (1:1), phase supérieure, HCl 1% = acide chlorhydrique conc.–eau (3:97), AcHW = acide acétique–eau (15:85).
b Adsorbant = silice 60 (0,1 mm ; Merck), EFW = acétate d'éthyle–acide formique–acide acétique–eau (100:11:11:26).
c Addition de 2–3 gouttes de chlorure d'aluminium : + = effet bathochrome ; 0 = aucun effet.
Les données des spectres électroniques et RMN-1H (Tableaux 2–7) indiquent que les composés sont des anthocyandines glycosylés. En effet, l'observation des déplacements chimiques des protons anomériques et des rapports ε440/εmax.vis. suggère des sucres liés en position 3 des anthocyanidines [12,13]. Les valeurs élevées des constantes de couplage observées pour les signaux des protons anomériques des sucres (J ~ 7–8 Hz) suggèrent que ces derniers sont sous la forme β-d-glycopyranose, à l'exception du rhamnosyle (composés 2 et 4 de J. integuerima, Tableau 5), pour lequel on observe de faibles valeurs de constantes de couplage des protons apparaissant vers 4,7 ppm. Ceci indique que ce sucre est sous la forme α-l-glucopyranose.
Données RMN-1H de l'anthocyanoside majoritaire (2) des fleurs d'Adenium obesum
| 2 δ (ppm) ; J (Hz) | |
| Aglycones | cyanidine |
| H4 | 8,89 ; s |
| H6 | 6,85 ; d 1,3 |
| H8 | 6,67 ; d 1,9 |
| H2' | 8,04, d 2,3 |
| H5' | 6,99 ; d 8,8 |
| H6' | 8,18 ; dd 2,3 ; 8,8 |
| Sucre Aa | β-d-galactopyranosyle |
| H1 | 5,26 ; d 7,7 |
| H2 | 4,07 ; d 7,7 |
| H3, H4, H5, H6a et H6b | 3,36 ~ 4,05 |
| Sucre Ba | α-l-rhamnopyranosyle |
| H1 | 4,71 ; d 1,3 |
| H2, H3, H4, H5 | 3,36 ~ 4,05 |
| CH3 | 1,28 ; d 6,2 |
a Attribution faite d'après les constantes de couplage et les données de la littérature [5,6,8,9,17].
Données RMN-1H des anthocyanosides des fleurs de J. integuerrima
| 1 δ (ppm) J (Hz) | 2 δ (ppm) J (Hz) | 3 δ (ppm) J (Hz) | 4 δ (ppm) J (Hz) | |
| Aglycones | cyanidine | cyanidine | pélargonidine | pélargonidine |
| H4 | 9,01 ; s | 8,91 ; s | 9,10 ; s | 9,01 ; s |
| H6 | 6,88 ; d 1,3 | 6,80 ; d 1,3 | 6,93 ; d 1,3 | 6,93 ; d 1,3 |
| H8 | 6,68 ; d 1,9 | 6,70 ; d 1,9 | 6,71 ; d 1,9 | 6,72 ; d 1,9 |
| H2' | 8,06 ; d 2,3 | 8,03 ; d 2,2 | 8,61 ; d 9,1 | 8,60 ; d 9,0 |
| H3' | 7,01 ; d 9,1 | 7,08 ; d 9,0 | ||
| H5' | 7,02 ; d 8,7 | 7,02 ; d 8,7 | 7,01 ; d 9,1 | 7,08 ; d 9,0 |
| H6' | 8,21 ; dd 2,3 ; 8,7 | 8,21 dd 2,2 ; 8,7 | 8,61 ; d 9,1 | 8,60 ; d 9,0 |
| Sucre Aa | β-d-glucopyranosyle | |||
| H1 | 5,31 ; d 7,6 | 5.28 ; d 7,5 | 5,29 ; d 7,6 | 5,27 ; d 7,6 |
| H2, H3, H4, H5, H6b | 3,4 ~ 3,8 | 3,40 ~ 4,00 | 3,40 ~ 3,80 | 3,40 ~ 3,80 |
| H6a | 3,98 ; d 10,4 | 4,10 ; 10,35 | 3,95 ; 12,4 | 4,10 ; d 10,00 |
| Sucre Ba | α-l-rhamnopyranosyle | |||
| H1 | 4,71 ; d 1,0 | 4,70 ; d 1,2 | ||
| H2, H3, H4, H5 | 3,50 ~ 4,00 | 3,50 ~ 4,00 | ||
| CH3 | 1,2 ; d 6,2 | 1,2 ; d 6,2 |
a Attribution faite d'après les constantes de couplage et les données de la littérature [5,6,8,9,17].
Données RMN-1H des anthocyanosides du calice des fleurs de H. sabdariffa
| 1 δ (ppm) J (Hz) | 2 δ (ppm) J (Hz) | 5 δ (ppm) J (Hz) | |
| Aglycone | delphinidine | delphinidine | cyanidine |
| H4 | 8,92 s | 8,88 s | 8,96 s |
| H6 | 6,81 d 1,3 | 6,84 d 1,6 | 6,90 d 1,6 |
| H8 | 6,62 d 1,8 | 6,65 d 1,9 | 6,68 d 1,9 |
| H2' | 7,71 s | 7,74 s | 8,05 d 2,27 |
| H5' | 7,03 d 8,7 | ||
| H6' | 7,71 s | 7,74 s | 8,26 dd 2,3 ; 8,7 |
| Sucre Aa | β-d-glucopyranosyle | β-d-glucopyranosyle | β-d-glucopyranosyle |
| H1 | 5,29 d 7,8 | 5,47 ; d 7,8 | 5,41 d 7,8 |
| H2 | 3,44–3,80 | 4,04 ; dd 7,8 ; 8,4 | 3,98 ; dd 7,8 ; 9,0 |
| H3 | " | 3,85 ; dd 8,4 ; 9,6 | 3,80 ; dd 9,0 ; 9,6 |
| H4 | " | 3,60 ; t 9,6 | 3,55 ; t 9,6 |
| H5 | " | 3,66 ; dd 5,4 ; 9,6 | 3,60 ; dd 5,4 ; 9,6 |
| H6a | 3,94 dd 1,3 ; 10,4 | 3,83 ; dd 5,4 ; 12,0 | 3,78 ; dd 5,4 ; 12,0 |
| H6b | 3,78 d 10,4 | 3,99 ; d 10,2 | 3,94 ; d 11,0 |
| Sucre Ba | β-d-xylopyranosyle | β-d-xylopyranosyle | |
| H1 | 4,75 ; d 7,8 | 4,77 d 7,8 | |
| H2 | 3,26 ; dd 7,8 ; 9,0 | 3,24 ; dd 7,8 ; 9,0 | |
| H3 | 3,36 ; t 9,0 | 3,33 ; t 9,0 | |
| H4 | 3,43 ; m | 3,42 ; m | |
| H5a | 3,66 ; dd 5,4 ; 11,4 | 3,60 ; dd 5,4 ; 12,0 | |
| H5b | 3,04 ; dd 10,8 ; 11,4 | 3,02 ; d 11,6 ; 12,0 |
a Attribution faite d'après la technique TOCSY 1D, les constantes de couplage et les données de la littérature [5,6,8,9,17].
Pour les anthocyanidines diglycosylées, lorsqu'un déplacement du signal des protons H-2 des glycosyle A vers des champs plus faibles est observé, cela suggère que les glycosyles B sont pas liés en position 2 des glycosyles A. C'est ce qui est observé pour les composé de H. sabdariffa.
Une légère augmentation des déplacements chimiques des protons H6a des sucres A par rapport à leurs homologues libres indiquerait que les sucres B soient liés en position 6 des sucres A [5,6,8,9,14,15]. Ce cas correspond aux anthocyanosides de J. integuerrima. Ceci semble être exceptionnel, puisque la littérature indique que le rhamnosyle est presque toujours lié en position 4 du sucre qui le précède [16]. En effet, pour le composé de A. obesium, rien n'a été observé pour le signal des protons H-2 et H-6 du sucre A, ce qui suggère un rhamnosyle lié en position 4.
Ainsi, les structures complètes des neuf composés isolés sont données sur la Fig. 2.
3.2 Mesure des activités anti-radicalaires mesurées
Pour H. sabdariffa, les extraits totaux ont été testés, car c'est sous cette forme que sont consommés les calices de ses fleurs. Des travaux sont en cours pour la détermination des activités anti-radicalaires des anthocyanosides isolés et caractérisés.
Ainsi, les données du Tableau 8 indiquent que les extraits totaux de H. sabdariffa et le composé 1 de J. integuerrima possèdent des activités anti-radicalaires très voisines de celle de l'acide ascorbique. Cependant, les activités anti-radicalaires des composés 2 de A. obesium et J. integuerrima, dans lesquels on note la présence en position terminale d'un rhamnosyle, sont faibles.
Ensemble des activités anti-radicalaires mesurées
| Matériel végétal | Composés | IC50 (en ppm) | Teneur a (%) |
| Hibiscus sabdariffa | extraits totaux | 20,00 | 1,50 |
| Adenium obesium | 2 : cyanidine 3-O-(4-O-α-l-rhamnosyl)-β-d-galactopyranoside | 38,80 | 0,60 |
| Jatropha integuerrima | 1 : cyanidine 3-O-β-d-glucopyranoside | 23,60 | 2,40 |
| 2 : la cyanidine 3-O-(6-O-α-l-rhamnopyranosyl)-β-d-glucopyranoside, | 27,50 | ||
| Référence | acide ascorbique [10] | 22,00 |
a Teneur estimée en anthocyanes totales pour 100 g de matière sèche
4 Conclusion
Neuf anthocyanosides ont été isolés dans les trois plantes récoltées au Burkina Faso (cf. Fig. 2). La mesure des activités anti-radicalaires a été effectuée sur les composés majoritaires ou les extraits totaux dans le cas des calices de H. sabdariffa. Ces derniers et le composé 1 de J. integuerrima présentent des activités anti-radicalaires voisines de celle de l'acide ascorbique, que nous avons pris comme référence.
Presque tous les extraits végétaux présentent des teneurs en anthocyanes totales comprises entre 0,5 et 2,5 g pour 100 g de matière sèche. Ce sont donc des sources potentielles d'anthocyanes à usages divers.
Il apparaît que l'activité anti-radicalaire des composés 2 de A. obesium et J. integuerrima, dans lesquels un rhamnosyle est présent en position terminale, est plus faible (IC50 plus élevée) que celle de l'acide ascorbique. Nos travaux en cours permettront de préciser l'influence de la structure sur l'activité anti-radicalaire de ces composés.
Remerciements
Ces travaux ont été financés par la Fondation internationale pour la science (FIS), Stockolm, Suède.


