Introduction
Est-il utile de rappeler l’importance considérable des substances naturelles dans l’histoire de la pharmacie et la pharmacie actuelle ? L’attribution du prix Nobel de Médecine en 2015 aux découvreurs de l’artémisinine et de l’ivermectine [1] en témoigne. La « matière médicale », devenue « pharmacognosie » à la fin des années 1970 (cf. note1 ), est une discipline majeure dans la formation des pharmaciens : pour preuve les plus de 1100 définitions continuellement actualisées estampillées « pharmacognosie » dans le dictionnaire en ligne de l’Académie nationale de Pharmacie [2]. La place des substances naturelles dans l’arsenal thérapeutique actuel est également analysée régulièrement de façon exhaustive par Cragg et Newman dans des articles auxquels le lecteur intéressé pourra se reporter avec le plus grand intérêt [3, 4]. De plus des ouvrages de référence, pour des publics plus ou moins spécialistes sauront satisfaire la curiosité du lecteur (cf. note2 ). Nous tentons, dans ce travail, de dresser un état des lieux, avec des aspects nationaux, et d’analyser les enjeux liés aux substances naturelles comme source de principes actifs pour la pharmacie. Cet article développe et complète un encadré récent publié dans la lettre L’Observatoire de l’Académie nationale de Pharmacie [5].
1. Les sources de substances naturelles et les principes actifs d’origine naturelle
1.1. Les sources « historiques » de principes actifs naturels
Historiquement, ce sont les substances naturelles (cf. note3 ) d’origine végétale qui ont constitué l’arsenal majeur des principes actifs d’origine naturelle, d’abord sous forme de « drogues », plantes ou partie de plantes plus ou moins mises en forme, puis dès le début du XIXe siècle avec l’isolement des molécules pures (1806 : Sertürner et la morphine, le principium morphinum du pavot somnifère ; 1820 : Pelletier et Caventou et la quinine des quinquinas ; 1832 : Robiquet et la codéine du pavot somnifère, 1884 : Houdé et la colchicine du colchique et beaucoup d’autres découvertes majeures, souvent françaises, aujourd’hui tombées dans l’oubli, Figure 1) signant le début d’une véritable « industrie pharmaceutique » concomitamment au développement de la chimie de synthèse. Si aujourd’hui les « médicaments à base de plantes » constitués d’extraits standardisés de végétaux sont de plus en plus rares (citons les extraits titrés de Ginkgo biloba) du fait de contraintes de standardisation, législatives et d’efficacité thérapeutique relative (note4 ), beaucoup des principes actifs découverts depuis deux siècles restent d’une importance considérable (morphine, codéine, anticancéreux d’origine végétale : vincristine et vinblastine de la pervenche tropicale, paclitaxel de l’if du Pacifique et autres espèces de Taxus et analogues dont le docétaxel découvert au CNRS, analogues hémisynthétiques plus solubles de la camptothécine comme le topotécan, Figure 1). Les principes actifs extraits d’animaux ont, quant à eux, quasiment tous disparu des pharmacopées occidentales modernes, les poudres d’opothérapie les avaient précédés (la bioprospection marine apportera plus loin dans le texte quelques nuances …). Les problèmes d’approvisionnement, de contamination par différents agents pathogènes (maladies à prions p. ex.) et surtout la possibilité de produire les principes actifs par synthèse biologique utilisant les techniques du génie génétique (hormones telles que l’insuline et analogues qui ont révolutionné la prise en charge des diabètes à partir du début des années 1980, hormone de croissance, etc.) quand ils sont de nature peptidique ou par hémisynthèse à partir de sources plus abondantes (industrie des stéroïdes par exemple) ont eu raison de l’extraction de ces molécules à partir des ressources animales (cf. note5 ). Après la Seconde Guerre mondiale, c’est l’avènement des produits obtenus par voie fermentaire (bactéries dont les Actinomycétales, champignons dont le genre Penicillium, etc.) qui sera notoire et les antibiotiques antibactériens (« l’âge d’or des antibiotiques » naturels ou hémisynthétiques avec les pénicillines, les céphalosporines, les « macrolides », les tétracyclines ou encore les glycopeptides et bien d’autres — voir exemples Figure 2), antifongiques (de l’amphothéricine B aux échinocandines des années 2000 — Figure 2) et anticancéreux (anthracyclines telles que doxorubicine — Figure 2) découverts durant cette période sauvent tous les jours des vies même si les problèmes de résistance sont de plus en plus criants. Toujours avec les produits d’origine fermentaire, comment ne pas évoquer, à partir des années 1970 et la découverte de la ciclosporine (Figure 3), les succès remarquables des immunosuppresseurs d’origine naturelle (tacrolimus, sirolimus — alias rapamycine — à l’histoire passionnante [6] et ses dérivés d’hémisynthèse tels que l’évérolimus ou le temsirolimus ou encore l’acide mycophénolique, Figure 3). Les démarches expérimentales classiques qui ont conduit à ces succès notoires de la pharmacie, avec une part importante du « hasard heureux » (« sérendipité » — serendipity) [7] ont été décrites notamment par Bruno David [8] et sont, en général, rappelées dans tous les ouvrages dédiés (cf. notes 1 et 2). Du criblage de quelques extraits jusqu’au criblage à haut débit « d’extractothèques » (en France l’extractothèque de l’Institut de Chimie des Substances Naturelles du CNRS est une référence [9]) et de molécules purifiées (historiquement par bioguidage), la nouvelle molécule active subit ensuite le parcours classique de la chimie pharmaceutique pour — si besoin — améliorer son profil d’activité par hémisynthèse puis, évidemment ensuite, le long parcours semé d’échecs du cycle de vie du médicament. N’oublions jamais non plus que les substances naturelles bioactives ont souvent constitué une source d’inspiration pour le pharmacochimiste et là encore les exemples sont trop nombreux pour être énumérés ici (cf. note6 ).
Exemples de principes actifs historiques majeurs d’origine végétale.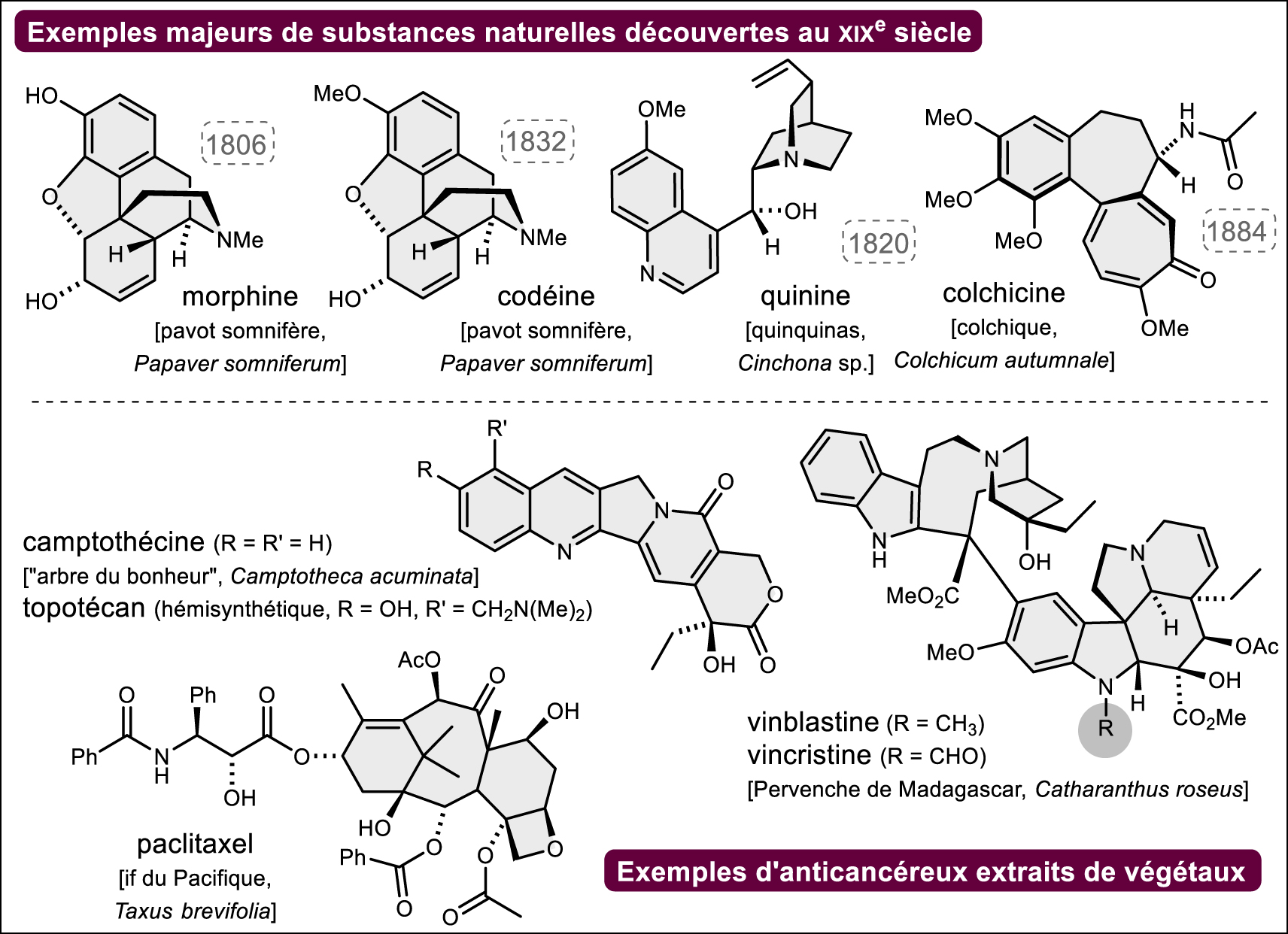
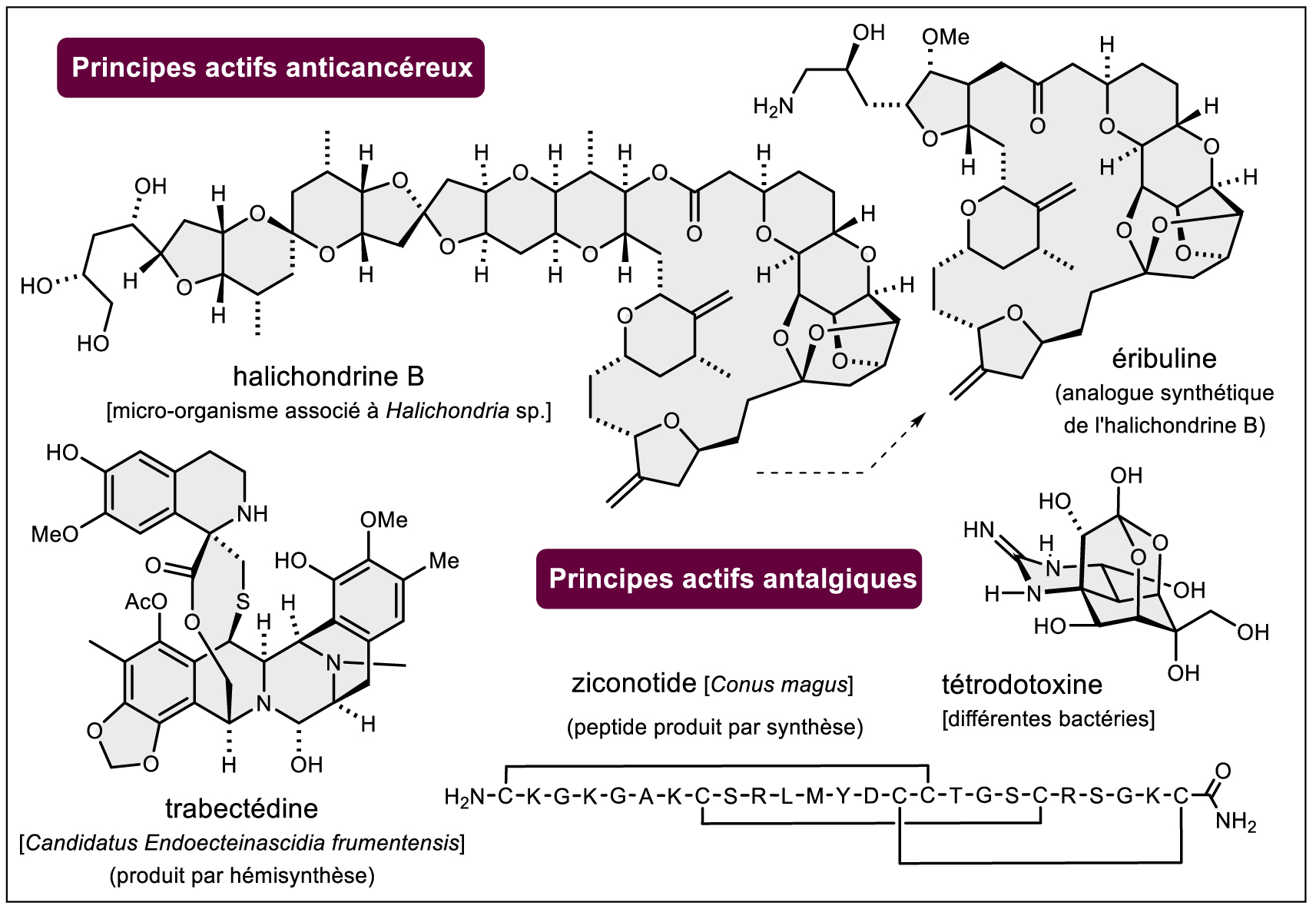
Exemples de principes actifs d’origine microbienne.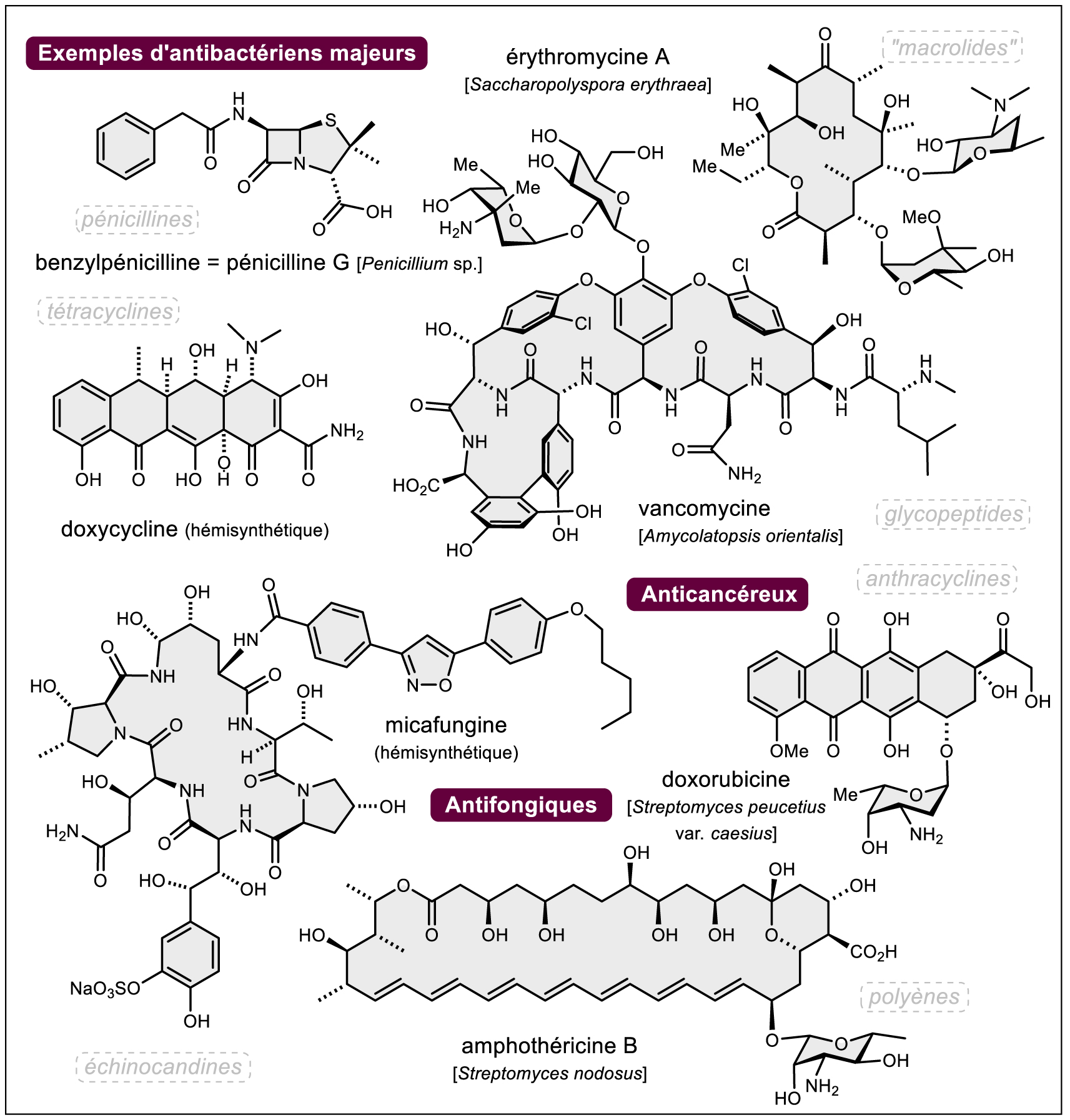
Exemples de principes actifs immunosuppresseurs d’origine fermentaire en fonction de leur cible pharmacologique.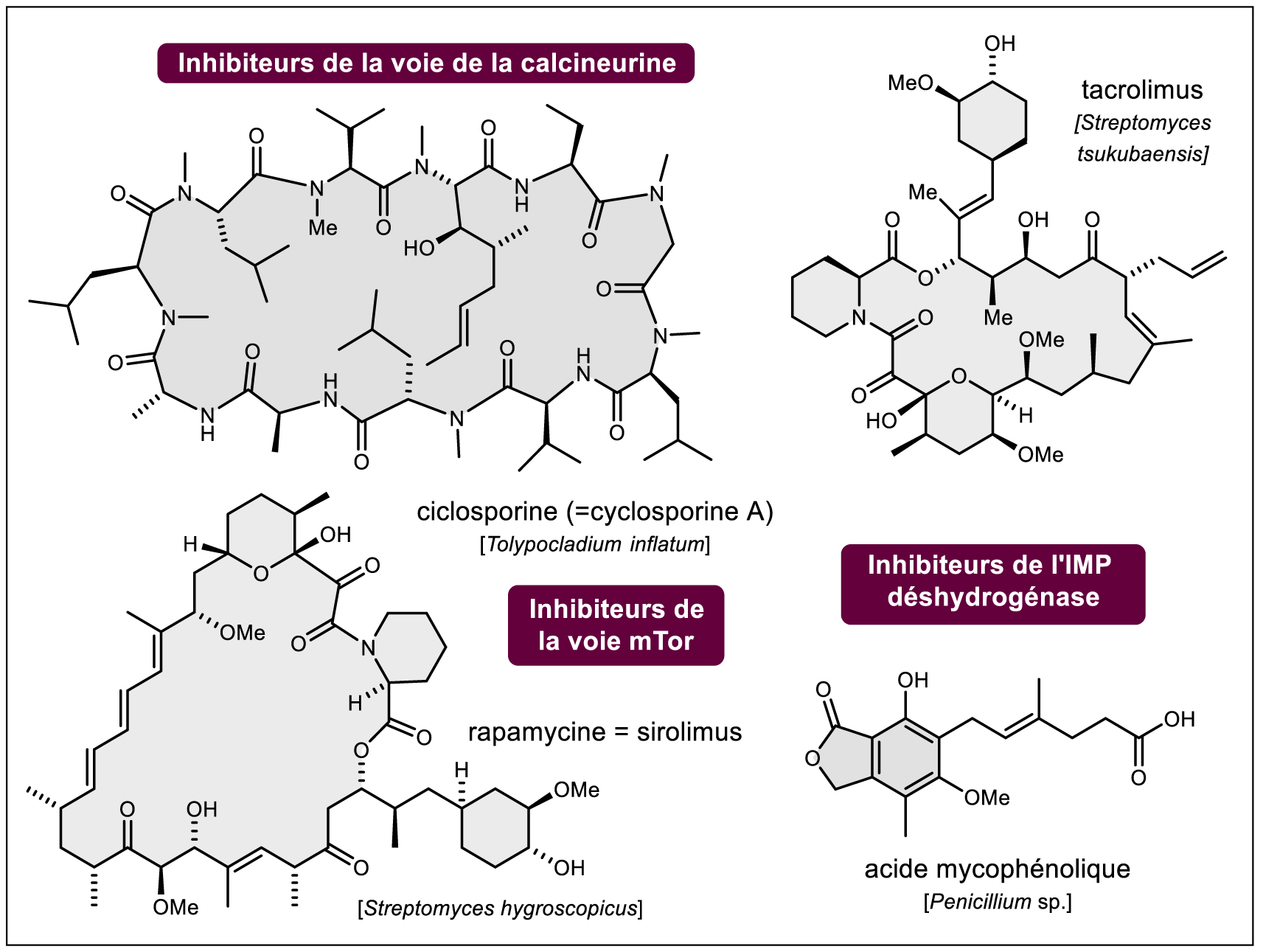
1.2. L’avenir des substances naturelles issues de végétaux est-il derrière elles ?
Avec plus de 80 % des près de 400 000 espèces de plantes vasculaires non étudiées d’un point de vue chimique, il serait hasardeux de l’affirmer même si depuis une vingtaine d’années seules quelques molécules ont atteint le stade de l’autorisation de mise sur le marché avec des succès cliniques mitigés (p. ex. la galantamine (Figure 4, cf. note7 ), le mébutate d’ingénol (Figure 4, cf. note8 ), le mépésuccinate d’omacétaxine aux États-Unis (Figure 4, cf. note9 ). Plus accessoirement, c’est même la capsaïcine (Figure 4), le principe actif « piquant » des piments, qui est aujourd’hui commercialisé pour le traitement des douleurs neuropathiques et dont la découverte du mécanisme d’action dans les années 1990 a été couronnée par un prix Nobel [13]. Et nous n’évoquerons pas les débats et prises de position liés, à l’heure actuelle, à l’utilisation du « cannabis thérapeutique » (tétrahydrocannabinol — THC, cannabidiol — CBD, etc.) qui nécessiteraient un article à part entière (tout comme le panel impressionnant de substances naturelles toxicomanogènes : morphine et dérivés, cocaïne, nicotine, éthanol, etc.).
Exemples de principes actifs mis sur le marché depuis 2000.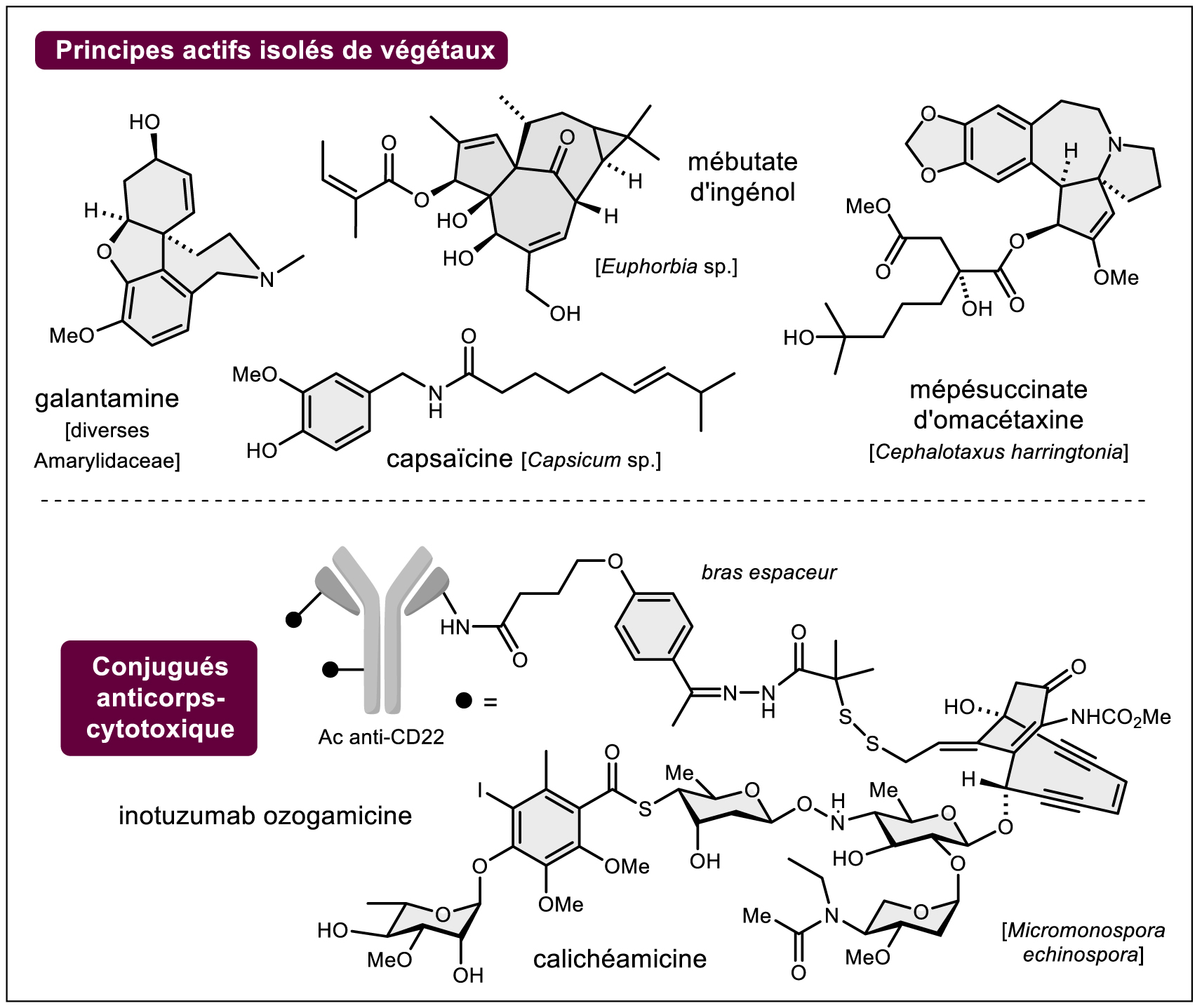
1.3. Bioprospection de nouveaux biotopes
De nouvelles frontières terrestres restent donc clairement à franchir en termes de bioprospection (cf. note10 ). Il en est de même pour le monde marin qui a constitué une source incroyable de chimiodiversité depuis les cinquante dernières années. La pharmacoprospection des organismes marins (essentiellement des invertébrés) commence logiquement à fournir des médicaments « au lit du malade » [14] (on citera le ziconotide (Figure 5, cf. note11 ), la trabectédine (Figure 5, cf. note12 ), le mésylate d’éribuline (Figure 5, cf. note13 ). Bien d’autres sont en essais cliniques dont la tétrodotoxine, la fulgurante « toxine du fugu » [15]). Curieusement, le monde des champignons macromycètes (les « champignons » de la langue courante) est peu exploité et mérite d’être totalement revisité à l’aune des nouvelles technologies (voir partie suivante) (cf. note14 ) comme le sont, depuis quelques années, les lichens notamment étudiés par des équipes françaises [16]. La chimie des insectes n’a pour l’instant pas fourni de principes actifs mis sur le marché (on citera historiquement la célèbre cantharidine des cantharides) mais l’étude des molécules produites par ces organismes fait l’objet de très nombreux travaux en écologie chimique. Pour clore ce tour d’horizon rapide, c’est finalement avec les stratégies d’association de molécules anticancéreuses à des anticorps monoclonaux (ADC : antibody drug conjugate) que les substances naturelles ont, à l’heure actuelle, une belle revanche. En effet, ce sont essentiellement des substances naturelles (ou des analogues proches) « hypercytotoxiques » qui sont couplées à des anticorps pour être délivrées aux cellules cancéreuses ciblées [17, 18, 19] Un cas particulièrement impressionnant est le couplage d’une calichéamycine, une des structures naturelles les plus fascinantes, à un anticorps « anti-CD22 » pour le traitement de certaines leucémies (Figure 4, cf. note15 ).
2. C’est la chimie des substances naturelles d’aujourd’hui qui fera la pharmacognosie de demain !
En quelques lignes, nous ne donnerons ici que quelques-uns des défis et des frontières de la connaissance actuelle en chimie des substances naturelles. Le cœur de métier, l’isolement et la détermination structurale de nouvelles substances naturelles, demeurent évidemment fondamentaux, mais se trouvent aujourd’hui à la confluence de nombreux domaines de recherche dans lesquels les progrès sont fulgurants. Le continuum biomoléculaire chez les êtres vivants nous aide à entrevoir l’impérieuse nécessité d’une démarche intégrée pour la découverte de nouvelles substances naturelles pouvant présenter un intérêt thérapeutique et donc susceptibles de devenir des médicaments. C’est donc aussi par les « -omiques » (-omics), l’enzymologie, la chimie bio-organique, la modélisation moléculaire, etc., que la science des substances naturelles se trouve révolutionnée, nécessitant des niveaux de compétences nouvelles importants. De notre expérience et parmi les disciplines de la chimie moléculaire étudiées en facultés de Pharmacie, la recherche en chimie des substances naturelles dans un cadre académique a été une des disciplines les plus bouleversées par de nouveaux défis technologiques. Il faut évidemment exploiter ces nouvelles technologies comme une source majeure d’innovations pour de nouvelles découvertes comme l’épistémologie nous l’a enseigné.
2.1. Inscrire la chimie des substances naturelles pharmaceutiques au cœur des sciences « omiques »
La génomique, la métagénomique sont devenues des techniques très communes au service d’une exploration de biotopes de plus en plus exotiques et complexes (communautés symbiotiques des invertébrés marins p. ex). Pour preuve, la notion « d’holobionte » (et de « microbiote ») est maintenant d’usage courant. En aval, comprendre le rôle — si elles en ont un — des substances naturelles dans l’environnement de l’organisme producteur dans un contexte évolutif constitue le défi de l’écologie chimique. C’est peut-être la séparation des champs disciplinaires dans la seconde moitié du XIXe siècle entre d’une part la biochimie (le métabolisme dit « primaire ») et la chimie des substances naturelles qui explique en partie que les aspects évolutifs ont été finalement moins pris en compte que dans d’autres sciences du vivant. La biologie évolutive et la phylogénie sont à intégrer dans les démarches de recherche de nouvelles molécules pour éviter tout raisonnement « anthropocentré » et « panglossien ». Au plan national français, des initiatives très bienvenues ont donné l’opportunité aux laboratoires universitaires de se rapprocher en communautés pluridisciplinaires et de pouvoir collaborer efficacement (cf. note16 ).
Au niveau international, certaines équipes de recherche (le groupe du professeur Jon Clardy p. ex.) se sont distinguées dans des travaux autour de l’écologie chimique avec l’objectif de découvrir des substances antibiotiques ou antifongiques [20]. Les modèles d’étude explorés par ces équipes sont souvent représentés par des systèmes symbiotiques multipartites (insectes — champignons — bactéries) (cf. note17 ). Ce sont notamment les mécanismes de défense qui ont attiré l’attention des chercheurs et qui ont conduit à la découverte de nouvelles substances bioactives telles que la dentigérumycine [21] (cf. note18 ) ou la mycangimycine [22] (cf. note19 ).
2.2. L’élucidation des voies de biosynthèse
- Décrypter les voies de biosynthèse (c’est-à-dire comprendre au niveau moléculaire et biomoléculaire les différentes étapes conduisant à la formation des substances naturelles) reste un autre défi majeur et est indissociable des notions du paragraphe précédent. Si les grandes voies universelles de biosynthèse des substances naturelles sont maintenant connues et sont les « classiques » enseignés et décrits dans les livres de chevet du chimiste des substances naturelles (polyacétates, shikimates, terpènes, etc., cf. note20 ), le décryptage des voies particulières menant à des familles entières de substances naturelles va maintenant devenir la norme. Le marquage isotopique, ici encore les « -omiques », l’ingénierie des protéines et la chimie bio-organique sont appelées pour apporter des réponses à la diversité et la complexité moléculaires des petites molécules de la nature.
- Dans le règne des microorganismes, l’exploration du génome (genome mining) pour repérer les gènes et les groupes de gènes (clusters) bénéficie de la chute vertigineuse du coût des séquençages de génomes depuis vingt ans. Le réveil des gènes silencieux et cryptiques (ici aussi l’épigénétique et la co-culture viennent bouleverser les certitudes), la compréhension des niveaux de régulation des complexes enzymatiques sont devenus autant d’enjeux de biologie moléculaire. Dans ce domaine, c’est le décryptage de la biosynthèse de l’érythromycine A en 1991 qui marque un tournant majeur et donne le la des décennies qui suivront. L’ingénierie vient également ébranler les certitudes de l’adage du « 1 % cultivable » [24] : cultiver l’incultivable est parfois possible et la découverte d’un nouvel antibactérien au mécanisme d’action nouveau, la teixobactine (Figure 6) par la technologie i-chip, en est un exemple particulièrement intéressant pour la pharmacie [25, 26].
- Le monde végétal (et demain sans nul doute le monde des invertébrés marins) n’est pas en reste : près d’un millier de génomes de plantes vasculaires sont maintenant assemblés dont des exemples emblématiques pour la pharmacie (pavot somnifère [27], if [28], etc.). Dans cette course mondiale à l’accumulation de connaissances dominée par les États-Unis et la Chine, l’Europe tire son épingle du jeu [29, 30]. Les exemples récents d’élucidation de voies de biosynthèse chez les plantes montrent qu’elles sont potentiellement toutes à portée de main. La biosynthèse de la strychnine, l’alcaloïde historique de la noix vomique (Strychnos nux-vomica, Loganiaceae, Figure 7) a livré tous ses secrets en 2022 [31]. En 2023, c’est la biosynthèse d’un saponoside complexe : le QS7 du « bois de Panama » (Quillaja saponaria, Quillajaceae) qui a été élucidée, ouvrant la voie à l’élucidation de celle du QS21 (Figure 7), un adjuvant de certains vaccins [32]. En 2024, c’est au tour du paclitaxel de livrer ses secrets de biosynthèse (de la biosynthèse du cœur terpénique aux fonctionnalisations complexes) [33, 34]. La notion de « cluster de gènes », essentielle dans la biosynthèse des polyacétates et des peptides non ribosomaux chez les microorganismes s’étend maintenant aux végétaux [35] et à d’autres classes de substances naturelles telles que les terpènes [36].
- Dans la même veine, l’élucidation complète de la biosynthèse du salinosporamide en 2022 (Figure 7) est tout aussi remarquable [37]. Ce candidat-médicament inhibiteur du protéasome est emblématique de la recherche des deux dernières décennies en chimie marine et essentiellement tournée vers l’étude des microorganismes (Salinospora tropica dans ce cas) et des microorganismes associés aux invertébrés marins. Sortant de ce « dogme » auquel beaucoup de chercheurs ont cependant résisté (« les substances naturelles marines sont essentiellement issues du microbiote associé ») des résultats récents dans la chimie des terpènes ouvrent la voie pour la compréhension fine des voies de biosynthèse chez les invertébrés marins [38, 39].
- Les chemins réactionnels évalués par modélisation moléculaire (en particulier par calcul utilisant la méthode DFT [40, 41], density functional theory) et éventuellement confrontés aux données expérimentales d’études de synthèse organique bien pensées permettent de faire entrer la chimie des substances naturelles dans le monde fascinant du biomimétisme et de la bio-inspiration à l’échelle moléculaire. D’ailleurs, à ce titre, si c’est grâce à des technologies « omiques » que l’élucidation de la biosynthèse de la strychnine a pu être faite [29], les auteurs ont précisé que sans l’ensemble des travaux des chimistes organiciens (formulation d’hypothèses, études de mécanismes réactionnels, etc.) au fil des années, le travail n’aurait pas pu être mené à bien. La chimie organique reste bel et bien le socle fondamental de la chimie des substances naturelles !
Structure de la teixobactine.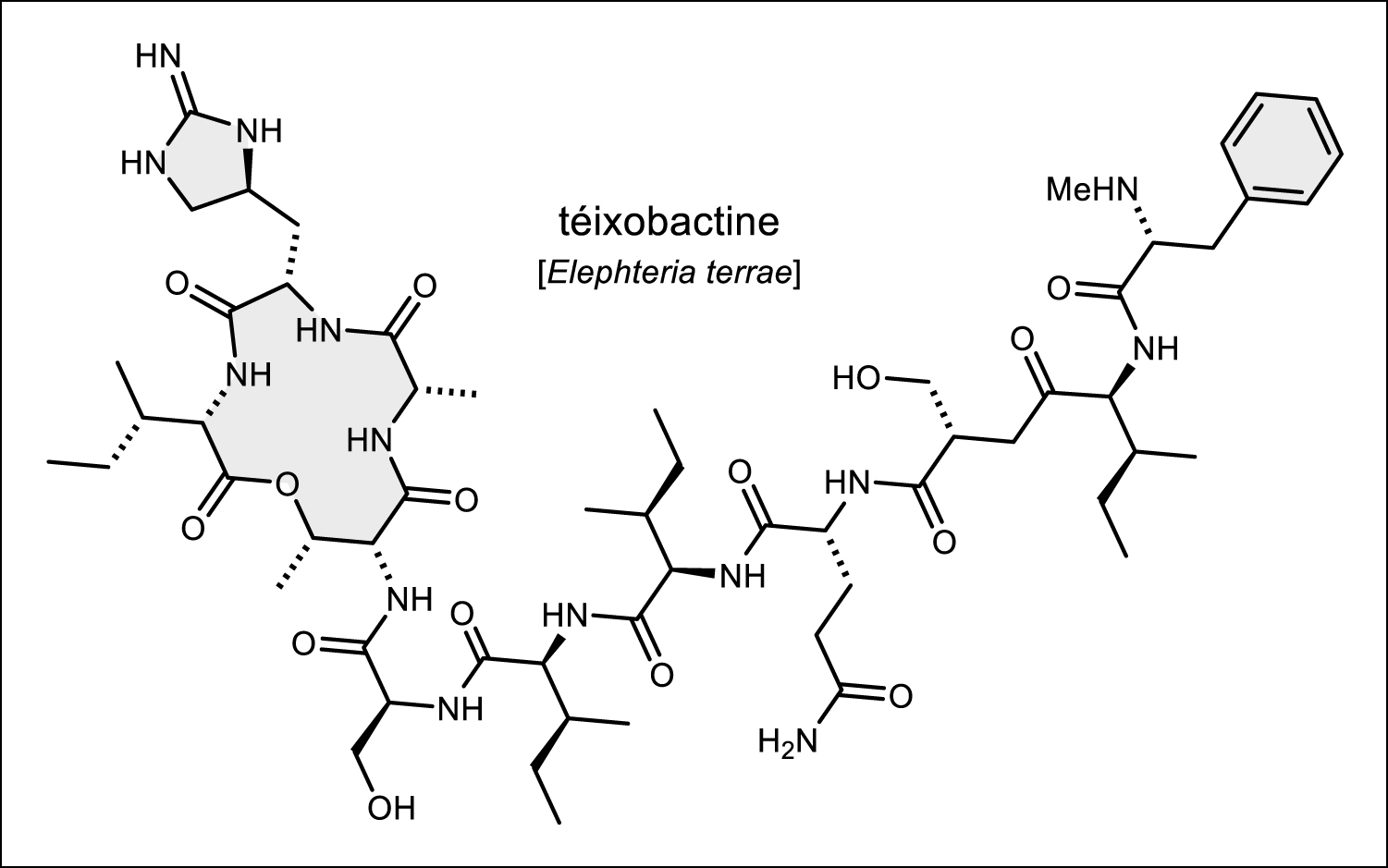
Les défis de l’élucidation des voies de biosynthèses et de la biologie synthétique (voir les références dans le texte).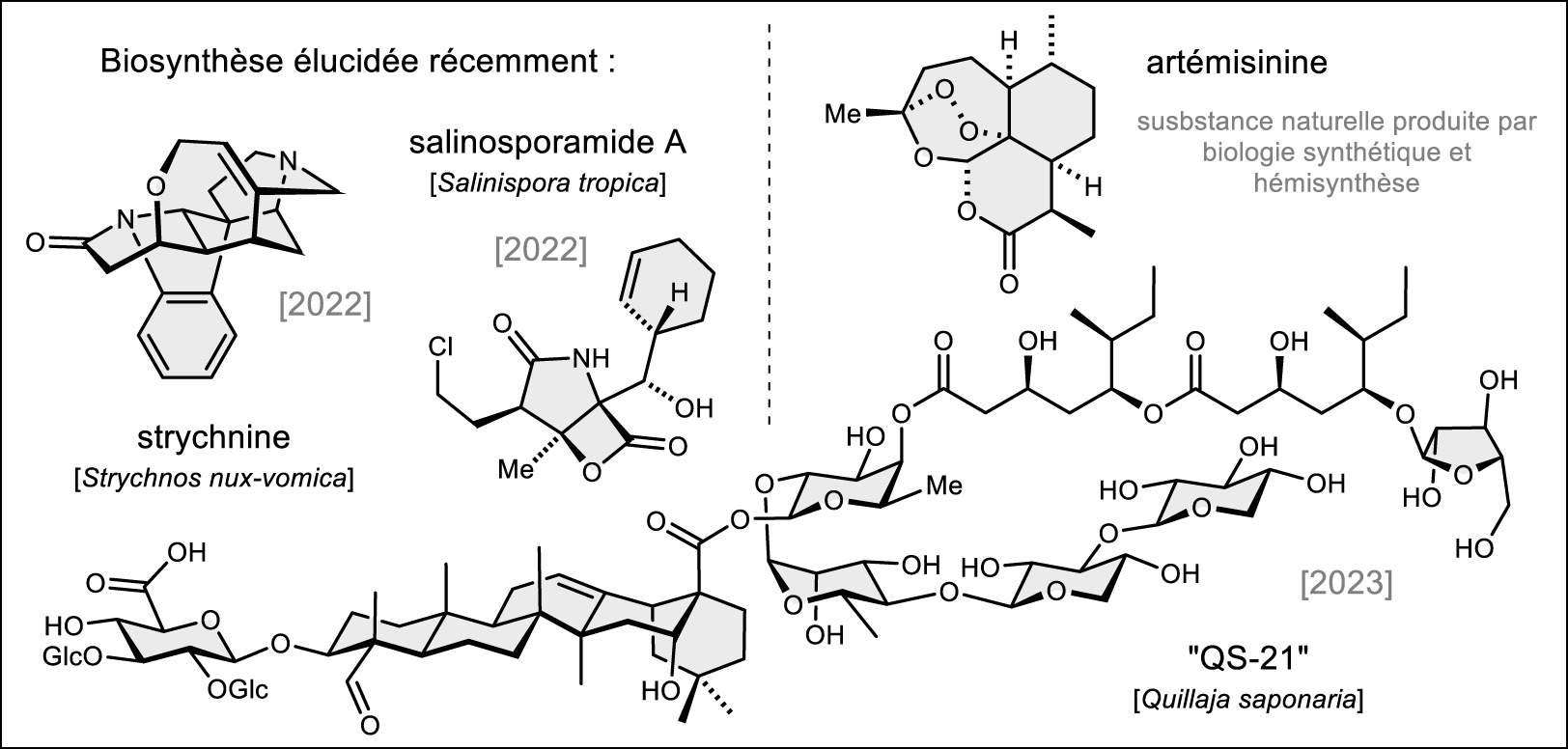
2.3. De l’élucidation des voies de biosynthèse à la biologie synthétique
C’est finalement vers la biologie synthétique que l’ensemble des découvertes peuvent magnifiquement converger pour de futures voies de production par biotechnologie. Les résultats récents sont passionnants et le cercle vertueux de la démarche DBTL (Design, Build, Test, and Learn) [42] est maintenant bien connu dans la communauté scientifique et doit être enseigné. Le succès très médiatisé de l’industrialisation de la production d’artémisinine par biologie synthétique (Figure 7) et hémisynthèse au début des années 2010 a laissé entrevoir de réels espoirs dans le domaine [43]. La biosynthèse d’alcaloïdes proches de la morphine programmée dans une levure est également un fait marquant en 2016 même si les quantités produites (quelques mg par litre de culture) ne permettent pas une exploitation industrielle à ce jour [44]. Depuis, d’autres principes actifs ont été étudiés : la biosynthèse de la vincristine a pu être encodée dans un microorganisme en 2022, ouvrant là encore la voie à de futures voies de production industrielle (voir paragraphe 4) [45].
2.4. La chimie des substances naturelles doit trouver sa place à l’ère des données FAIR (FAIR data)
Après des décennies d’efforts isolés dans les différents laboratoires à travers la planète, qui ont conduit à l’isolement et à l’identification de plus de 300 000 substances naturelles, les chimistes des substances naturelles ont petit à petit compris l’intérêt d’inscrire leur discipline dans l’ère des données FAIR [46]. L’acronyme FAIR (Findable, Accessible, Interoperable, Reusable) implique que les données publiées répondent aux principes de la science ouverte suivants : (i) Faciles à retrouver par des humains ou des machines (notion d’un identificateur pérenne et unique machine-readable : DOI p. ex.) (ii) Accessibles et disponibles à des conditions connues, grâce à des licences identifiées (Creative Commons p. ex.) (iii) Interopérables et respectant les standards internationaux (ISA p. ex. [47]) et enfin (iv) Réutilisables (sous conditions) par un stockage en base de données rassemblant des métadonnées claires et vérifiées (Dataverse [48], FigShare [49], Zenodo [50] p. ex.). Cette prise de conscience a permis la mise en place de plateformes et de logiciels bio- et chimio-informatiques collaboratifs (GNPS [51], SMART [52], NP-MRD [53], MIBiG 3.0 [54], LOTUS [55] p. ex.), qui s’améliorent de jour en jour et révolutionnent déjà la pratique courante de la « déréplication » et du genome mining en permettant de cibler et d’élucider efficacement des molécules nouvelles. Le partage des données brutes accompagné des métadonnées doit se faire afin de pouvoir éviter toute redondance dans les recherches, de faciliter l’interprétation des résultats des travaux, voire de prédire ces résultats.
Grâce à cet effort permettant de constituer des métadonnées vérifiées et enrichies (données spectrales (spectres de masse en tandem, de RMN mono- et bi-dimensionnels), clusters de gènes p. ex.), les communautés de cette discipline fournissent de véritables jeux de données permettant d’entraîner et d’améliorer des algorithmes de l’intelligence artificielle et de l’apprentissage machine (machine learning). Il est ainsi possible aujourd’hui de prédire des données spectrales (CFM-ID 4.0 p. ex. pour la spectrométrie de masse en tandem [56]), une activité biologique à partir de clusters de gène biosynthétique (DeepBGC [57]), des classes chimiques au départ d’un spectre de masse en tandem (CANOPUS [58]) ou d’une structure chimique (NPClassifier [59]).
C’est dans cet esprit que les chercheurs en chimie des substances naturelles voient leurs efforts s’inscrire dans un véritable cercle vertueux [60] allant d’une numérisation altruiste de la connaissance à des découvertes utiles pour la société.
2.5. Accéder aux ressources et partager les avantages de façon équitable
Il faut aussi rappeler que ces recherches s’inscrivent dans un cadre strict d’accès aux ressources génétiques et de partage des avantages (APA) découlant de leur utilisation, règlementé par le protocole de Nagoya de 2010 [61, 62] Grâce au recueil du consentement préalable pour l’accès à ces ressources, l’APA contribue à promouvoir des conditions d’accès et d’utilisation respectueuses de la biodiversité. Le dispositif APA permet également l’amélioration de la sécurité juridique entre fournisseur et utilisateur, le renforcement de la traçabilité sur les ressources et la transparence sur les utilisations. Les états signataires de ce protocole ont la responsabilité de traduire l’APA dans leur droit national, et de désigner un correspondant national en charge d’informer les demandeurs d’accès sur le cadre juridique d’APA. En France, le ministère de la Transition écologique et de la Cohésion des territoires est le point focal pour l’APA. Deux autorités compétentes ont été définies pour assister le point focal : le ministère de la Recherche et le ministère de l’Écologie [63].
Depuis le 17 novembre 2022, une plateforme européenne (DECLARE) permet de déclarer les « déclarations de diligence » (DDD) au stade du financement d’un projet ou de la mise sur le marché d’un produit. De ce fait, les déclarations, qu’elles concernent la recherche ou le développement final d’un produit, devront être effectuées exclusivement sur cette plateforme.
3. Le défi du criblage, l’évaluation des propriétés biologiques et la pharmacochimie des substances naturelles
- Le criblage des milliers de molécules isolées de la nature est sans nul doute un des problèmes majeurs à surmonter dans l’avenir (la rencontre de la « bonne molécule » et du « bon test biologique » et la différence entre une « fonction » et une « activité biologique »). Combien de substances naturelles dorment littéralement dans les tiroirs des laboratoires académiques après n’avoir jamais été évaluées biologiquement ou uniquement dans des campagnes de criblages généraux (souvent des essais de cytotoxicité sur un panel de cellules in vitro) ? Il faut cependant toujours avoir un esprit critique sur les résultats de tests préliminaires. Les faux positifs (particulièrement avec les molécules polyphénoliques) sont nombreux et doivent être discriminés précocement (« composés interférents », PAINS : pan-assay interference compounds) [64]. Les concentrations auxquelles les activités sont détectées doivent être « réalistes » pour affirmer avoir trouvé une cible et les problèmes de biodisponibilité doivent être rapidement anticipés (la plupart des polyphénols ont, par exemple, des biodisponibilités très faibles à nulles). Rappelons également que l’activité biologique puissante est rare dans le monde des substances naturelles et que ces dernières sont le fruit de processus évolutifs particuliers (ces aspects seront développés prochainement ailleurs) comme évoqué précédemment.
- Des pistes de réflexion … Les molécules issues des microorganismes vont probablement largement contribuer à assurer l’avenir des substances naturelles à visée thérapeutique. La nécessité impérieuse de découvrir de nouveaux antibactériens (ou de redécouvrir des antibactériens « oubliés ») passe de facto par l’étude de la biodiversité microbienne cinquante ans après l’âge d’or de la découverte des grandes classes d’antibiotiques. Moins médiatisé, le problème est encore plus criant avec les infections fongiques multirésistantes. Un deuxième point est plus fondamental et il relève naturellement un défi des pharmacochimistes. Les substances naturelles, essentiellement issues de microorganismes et souvent de structure complexe, peuvent couvrir un espace chimique bien particulier, celui des molécules de masses moléculaires intermédiaires (macrolides, peptides cycliques, etc.) entre celles des principes actifs issus de la chimie de synthèse et celles des peptides et protéines thérapeutiques. Ce type de molécules permet de disposer de structures tridimensionnelles pouvant perturber les interactions protéine/protéine (à l’instar des immunosuppresseurs d’origine naturelle tels que la cyclosporine A ou la rapamycine) [65]. Ces « colles moléculaires » (molecular glues) [66] d’origine naturelle sont encore loin d’être égalées par la pharmacochimie de synthèse et montrent tout l’intérêt des substances naturelles comme, aussi, outils moléculaires pour la compréhension du vivant. Par ailleurs, et ça n’est pas le moindre de leurs intérêts, loin des règles classiques de pharmacopotentialité (druggability, règles de Lipinski p. ex.), de nombreuses substances naturelles macrocycliques présentent une biodisponibilité par voie orale.
4. Aucune fatalité pour la production des médicaments à l’échelle industrielle
Il est logique de finir cet aperçu en évoquant plus en détail les aspects liés à la production industrielle des principes actifs naturels. Le paragraphe consacré à la biologie synthétique (vide supra) et encore plus l’histoire de la chimie des substances naturelles depuis le début du xixe siècle montrent que les problèmes de production industrielle ont pu être surmontés pour pallier les problèmes inhérents aux aléas liés aux ressources vivantes et à la présence, parfois en très faibles quantités dans des ressources naturelles parfois elles-mêmes fragiles d’un point de vue écologique. Les techniques extractives à partir de plantes de culture restent totalement d’actualité (morphine, thébaïne, codéine, mais aussi des antitumoraux tels que la vincristine et la vinblastine malgré des rendements d’extraction très faibles). L’hémisynthèse à partir de molécules déjà complexes, mais disponibles sans difficultés majeures, est aussi une méthode de choix (production de la trabectédine à partir de la cyanosafracine B d’origine fermentaire, Figure 5 et note 12) [67]. La synthèse totale peut être un dernier recours et l’exemple de la production industrielle de l’éribuline (Figure 5 et note 13) est un magnifique exemple qui demeure à ce jour une des molécules les plus complexes produites par l’industrie de la chimie fine [68]. Pour finir, la fermentation de cellules végétales est aujourd’hui possible à l’échelle industrielle [69]. Elle permet par exemple la production de taxanes à partir de cellules d’espèces du genre Taxus, convertis ensuite en paclitaxel ou docétaxel par hémisynthèse [70]. La maîtrise de ces technologies de la biologie des plantes pourra permettre de supplanter peut-être à l’avenir les aléas liés à la culture en champs des plantes en question. Il est ainsi raisonnable de penser que, quels que soient la source vivante et la quantité effectivement disponible à l’état naturel, l’industrie saura pallier d’une façon ou d’une autre (comme elle l’a toujours fait) le problème de l’approvisionnement. À l’autre extrémité de la chaîne de production du médicament, la formulation des principes actifs est capitale. Des progrès majeurs ont ainsi contribué à améliorer le devenir in vivo de principes actifs d’origine naturelle : les formes liposomales sont aujourd’hui nombreuses (ciclosporine p. ex.), les formulations nanoparticulaires commencent à se développer (paclitaxel p. ex.) pour la voie orale. Des formes galéniques nouvelles « à dissuasion d’abus » se développent également (notamment pour les principes actifs opiacés proche de la morphine : hydrocodone, association buprénorphine/naloxone, etc.) pour ne citer que quelques exemples d’innovations en pharmacie galénique. Dans les efforts de vectorisation de principes actifs notamment d’origine naturelle, les résultats précliniques de travaux d’équipes françaises sont de premier plan [71].
Conclusion
Dans un contexte en pleine évolution, la recherche en chimie des substances naturelles en France est à la croisée des chemins faute d’avoir su prendre, souvent, les tournants technologiques qui s’imposaient à l’heure de la révolution des « -omiques ». Les technologies et outils évoqués dans ce texte ne constituent pas des « modes », mais sont maintenant pour beaucoup d’entre eux des impératifs pour atteindre les standards d’une concurrence internationale qui ne nous attend pas. Fort heureusement de jeunes générations de chercheurs non seulement utilisent, mais aussi inventent et développent ces outils. Ici encore, comme dans beaucoup de domaines, ce sont des compétences en codages informatiques, en chimio- et bio-informatique et en traitement de données qui vont cruellement manquer. La nécessité de projets multidisciplinaires ambitieux aux compétences nécessaires multiples et par conséquent onéreux est incontestablement un frein au dynamisme de la pharmacognosie française dans un contexte difficile de financement de la recherche publique et d’attractivité des carrières de la recherche publique (note21 ). Plus généralement, le déclin de l’intérêt de l’industrie pharmaceutique pour les principes actifs d’origine naturelle — notamment des grandes multinationales (big pharma) — a été analysé et commenté et date, globalement des années 1990 [72, 73, 74, 75]. Mais à l’heure d’un désengagement de ces mêmes firmes pour la recherche à un stade précoce et le passage de relais de la découverte de nouvelles molécules actives à un tissu d’entreprises innovantes (« biotechs » souvent issues du monde universitaire), tous les espoirs sont permis et les exemples sont encourageants. En France, les partenariats du monde universitaire avec le secteur privé ou la création d’entreprises sont aujourd’hui facilités par la mise en place sur tout le territoire d’un réseau dynamique de Sociétés d’Accélération du Transfert Technologique. L’avenir des substances naturelles en France est dans nos mains !
Déclaration d’intérêts
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne rec˛oivent pas de fonds d’une organisation qui pourrait tirer profit de cet article, et n’ont déclaré aucune autre affiliation que leurs organismes de recherche.
Remerciements
Les auteurs remercient l’Université Paris-Saclay et le CNRS pour leur soutien. Ils remercient également les deux lecteurs de l’article pour leur analyse et leurs remarques avisées.
1 Materia medica, une des disciplines fondatrices de la profession de pharmacien au xviiie siècle (Déclaration royale de 1777). Elle se nomme désormais pharmacognosie et a pris, au fil des années et sous l’influence d’éminents collègues visionnaires, un tournant moléculaire qui la place aujourd’hui à l’interface de multiples disciplines (sciences du vivant et de la biodiversité, chimie organique, chimie analytique, biologie structurale, pharmacologie, microbiologie, etc.). Le musée de la Matière Médicale François Tillequin à la Faculté de Pharmacie de l’Université Paris-Cité ravira de plus les visiteurs. Pour ce qui est des ouvrages de référence dans la discipline, citons le travail titanesque de Jean Bruneton au fil des années (J. Bruneton, Pharmacognosie — Phytochimie — Plantes médicinales 5e édition, Lavoisier Tec & Doc, Paris, France, 2016 — 9782743021658) ; et un ouvrage collectif récent : S. Boutefnouchet (éd.), Pharmacognosie — Obtention et propriétés des substances actives médicamenteuses d’origine naturelle, Masson Elsevier, Paris, 2020 — 9782294743108). Citons encore un ouvrage incontournable par Paul M. Dewick, malheureusement non mis à jour depuis 2009 (P. M. Dewick, Medicinal Natural Products, a Biosynthetic Approach, 3rd edition, Wiley, Chichester, Royaume-Uni, 2009 — 9780470741672), mais complété par l’ouvrage de Christopher Walsh et Yi Tang, cependant beaucoup plus tourné vers les biosynthèses (C. T. Walsh, Y. Tang, Natural Product Biosynthesis, Chemical Logic and Enzymatic Machinery, 2nd edition, Royal Society of Chemistry Publishing, Londres, Royaume-Uni, 2022 — 9781839165641).
2 En langue française et traçant l’histoire d’une carrière dédiée à la chimie des substances naturelles, nous pouvons citer l’ouvrage de Pierre Potier avec François Chast (P. Potier, F. Chast, Le magasin du bon Dieu : les extraordinaires richesses médicinales des plantes et des animaux, J.-C. Lattès, Paris, 2001, 9782709621106). Un article historique sera également du plus grand intérêt : B. Bodo, Des plantes médicinales … aux substances naturelles, Actualité Chimique 462 (2021), page 4. Sur un ton humoristique enfin, mais avec des bases scientifiques de haut niveau, vous trouverez plaisir à lire Guy Lewin (G. Lewin, Drôles d’histoires de médicaments d’origine naturelle, Éditions BoD, Paris, France, 2019 — 9782322019526 ; G. Lewin, Nouvelles Drôles d’Histoires de Médicaments d’Origine Naturelle, Éditions BoD, Paris, France, 2021 — 97823221174386). Des ouvrages anglo-saxons sont aussi d’accès facile et passionnants dans le domaine, voir avec intérêt : K. C. Nicolaou, T. Montagnon, Molecules that Changed the World, Wiley-VCH, Weinheim, Allemagne, 2007, ou encore, dédiés aux plantes : E. A. Dauncey, M.-J. R. Howes, Plants that Cure, Plant as a Source of Medicines — from Pharmaceuticals to Herbal Remedies, Kew Royal Botanical Gardens Publishing, London, Royaume-Uni, 2020 — 9781842467008 ; E. A. Dauncey, S. Larsson, Plants that Kill, a Natural History of the World’s most Poisonous Plants, Kew Royal Botanical Gardens Publishing, London, Royaume-Uni, 2018 — 9781842466575.
3 Le terme « substance naturelle » — natural products, natural substances —, assez propre au monde de la pharmacognosie francophone, correspond ici aux petites molécules (alias « métabolites secondaires » — secondary metabolites — tels que définis à la fin du XIXe siècle ou mieux « métabolites spécialisés » — specialized metabolites — terme consacré aujourd’hui dans le domaine de l’écologie chimique) produites par les êtres vivants et pouvant contribuer à leur adaptation à l’environnement.
4 La phytothérapie et le domaine des compléments alimentaires (aux exigences de qualité et aux finalités différentes des médicaments) sont aujourd’hui importants (notamment d’un point de vue économique avec des filières dédiées), mais ne sont pas évoqués dans cet article consacré aux principes actifs isolés. L’analyse critique de ces produits est nécessaire et le lecteur intéressé devra se référer à des sources documentaires de bonne qualité (on pense au domaine de l’aromathérapie p. ex.).
5
À l’exception des héparines, mélanges complexes de glycosaminoglycanes, qui sont des antithrombotiques majeurs et toujours produits par extraction à partir d’intestins de porcs (et qui sont d’ailleurs un rare exemple de principes actifs totalement osidiques). Les héparines de basses masses moléculaires (HBMM), alias de bas poids moléculaires (HBPM) — les plus largement prescrites —, sont elles obtenues par hémisynthèse à partir des héparines dites « non fractionnées » (HNF). Une héparine synthétique correspondant aux motifs structuraux porteurs de l’activité pharmacologique (voir structure du motif ci-dessous), le fondaparinux analogue du pentasaccharide pharmacophore, est même commercialisée depuis vingt ans. 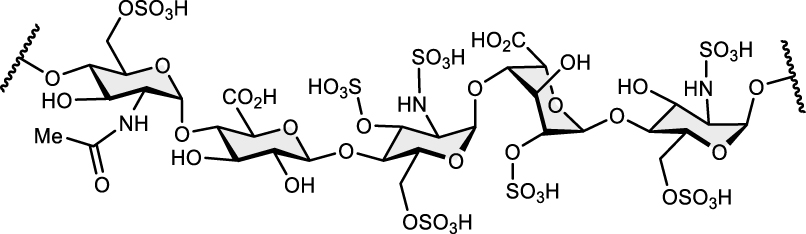
6 Pensons aux simplifications successives du squelette morphinane de la morphine pour la conception d’opioïdes de synthèse, au développement des anesthésiques locaux au départ de la structure de la cocaïne et combien d’autres. Récemment par exemple, une nouvelle classe d’antidiabétiques, les glifozines (en France : dapagliflozine, empagliflozine), est directement inspirée de la phlorizine, un inhibiteur naturel non sélectif de la protéine SGLT2 (sodium/glucose cotransporteur 2, une protéine permettant la réabsorption du glucose au niveau du tubule rénal) et que l’on trouve dans l’écorce et les fruits de certains arbres fruitiers de la famille des Rosaceae (pommiers, poiriers, etc.) [10]. Pour donner un dernier exemple récent, c’est sur la base de la structure de la myriocine, un immunomodulateur produit par Isaria sinclairii, forme anamorphe de Cordyceps sinclairii, un champignon entomopathogène, et présentant des propriétés immunosuppressives par inhibition d’une enzyme (la sérine palmitoyltransférase) impliquée dans la biosynthèse des sphingolipides, que le fingolimod et d’autres analogues (ozanimod, ponesimod etc.) ont été conçus. Un changement de mécanisme d’action est alors observé et ce sont des propriétés modulatrices de certains récepteurs à la sphingosine 1-phosphate qui expliquent l’activité pharmacologique puissante [11]. Ces molécules, cas d’école des stratégies de conception rationnelle de principes actifs (drug design), sont les premiers représentants d’une nouvelle classe de médicaments ayant, par voie orale, des indications dans le traitement de la sclérose en plaques.
7 Un alcaloïde extrait de divers perce-neige (Galanthus sp. et autres espèces d’Amaryllidaceae) inhibiteur puissant de l’acétylcholinestérase indiqué dans le traitement symptomatique de la maladie d’Alzheimer, mais au rapport bénéfice/risque défavorable au même titre malheureusement que tous les autres principes actifs proposé dans cette pathologie (voir : https://www.prescrire.org/Fr/202/1841/56000/0/PositionDetails.aspx).
8 Un ester de diterpène présent dans l’euphorbe des jardins (Euphorbia peplus, Euphorbiaceae) et présentant des propriétés pro-inflammatoires puissantes. Un temps utilisé en application cutanée dans le traitement des kératoses actiniques, il a été retiré du marché en 2020 quelques années seulement après sa commercialisation pour des risques accrus de tumeurs (https://www.ema.europa.eu/en/news/ema-review-picato-concludes-medicines-risks-outweigh-its-benefits).
9 Un alcaloïde (aussi appelé homoharringtonine) extrait du « pin à queue de vache » (Cephalotaxus harringtonii, Taxaceae) et présentant un mécanisme original ciblant les ribosomes, a un effet anticancéreux et est utilisé pour traiter certaines leucémies myéloïdes [12].
10 L’Institut National de l’Écologie et de l’Environnement du CNRS organise régulièrement des rencontres prospectives desquelles des rapports émergent et sont diffusés.
11 Un peptide de 25 acides aminés comportant trois ponts disulfure (également désigné par ω-conotoxine MVIIA 70), isolé du venin du cône mage du Pacifique (Conus magus, Conidae) et présentant un effet antalgique par inhibition des canaux calciques voltage-dépendants présynaptiques de type N.
12 Un alcaloïde tétrahydroisoquinoléique, isolé du tunicier marin (Ecteinascidia turbinata, Perophoridae) et présentant des propriétés antitumorales dues à son intercalation covalente dans le petit sillon de l’ADN. C’est en fait un microorganisme associé qui produit la substance toxique.
13 Analogue synthétique de l’halichondrine B, une substance naturelle isolée d’une éponge marine (Halichondria okadai, Halichondriidae) et présentant des propriétés antitumorales par l’action d’inhibition de la croissance des microtubules. C’est probablement, ici encore, un microorganisme associé qui produit la substance naturelle.
14 Les alcaloïdes de l’ergot de seigle (ergotamine, etc.), à la pharmacologie très riche et complexe, ont été utilisés pendant plus d’un siècle dans différentes indications (migraine, maladie de Parkinson, etc.). Ils ne sont quasiment plus utilisés aujourd’hui à l’exception de la bromocriptine.
15 Des substances naturelles à la toxicité connue, qui n’ont jamais pu atteindre le stade de la mise sur le marché « seules », ressortent ainsi des laboratoires pour trouver des applications majeures : dolastatines, maytansines, etc.
16 Les initiatives des grandes institutions de recherche telles que les ex-Groupements de Recherche du CNRS dédiés à la chimie marine (« BioChiMar ») et à l’écologie chimique (« MediatEC ») et d’autres ont permis à la communauté de la pharmacognosie de s’ouvrir à de nouveaux domaines scientifiques et d’apporter une expertise de chimistes moléculaires (voir : ouvrage collectif, Écologie chimique, le langage de la Nature, éditions CNRS/Cherche Midi, Paris, France, 2012 — 9782749127729). Ce type d’initiative est capital. Dans ce contexte, le CNRS finance depuis une dizaine d’années le réseau international de recherche IRN i-NPChem : Integrative Natural Product Chemistry: New Frontiers for New Discoveries. Cette initiative vise à rassembler les compétences de laboratoires européens (Allemagne, Irlande, Pays-Bas, Suisse, Royaume-Uni) en chimie des substances naturelles pour faire émerger des partenariats de recherche autour de questions fondamentales à fort potentiel de valorisation pour la société humaine. C’est parfois localement que la structuration de la chimie des substances naturelles se fait (Projet interdisciplinaire « Metabiodivex » à l’Université Paris-Saclay p. ex.).
17 Par exemple, la symbiose entre l’actinobactérie Pseudonocardia spp., un champignon basidiomycète nourricier, et une « fourmi champignonniste » (Apterostigma dentigerum, Formicidae).
18 Depsipeptide cyclique produit par Pseudonocardia spp., ayant montré un fort pouvoir antifongique sélectif envers l’Ascomycète Escovopsis sp.
19 Un peroxyde polyénique produit par Streptomyces sp., une actinobactérie associée au coléoptère Dendroctonus frontalis. Ce composé a montré une activité antifongique sélective envers l’Ascomycète Ophiostoma minus.
20 La découverte de la voie alternative du méthylérythritol phosphate dans la biosynthèse des briques élémentaires de la biosynthèse des terpènes par Michel Rohmer et ses collaborateurs restant un fait éminemment marquant de la recherche française de la fin du xxe siècle [23].
21 À ceci s’ajoute le déclin catastrophique des disciplines de la chimie dans les études de pharmacie, problème analysé récemment par un groupe de travail de l’Académie nationale de Pharmacie (https://www.acadpharm.org/dos_public/RAPPORT_CHIMIE_POUR_LE_MEDICAMENT_VF1.PDF). Voir aussi : https://www.acadpharm.org/divers/page.php?rb1=80&id_doc=5537, https://www.lefigaro.fr/sciences/au-pays-de-pasteur-et-curie-la-recherche-doit-retrouver-son-rang-20230521.




 CC-BY 4.0
CC-BY 4.0