1 Introduction
La carence en vitamine A (VA) concerne plus de 250 millions d'enfants âgés de moins de cinq ans dans le monde. Cette carence et ses conséquences sanitaires sont surtout ressenties dans les pays en voie de développement [1,2]. Le continent africain, et plus particulièrement les régions situées au sud du Sahara, est le plus touché. En effet, sur les 34 pays dans le monde où la carence en VA est considérée par l'OMS comme un problème de santé publique, 18 sont en Afrique de l'Ouest [1]. En Afrique occidentale francophone, on estime que la carence en vitamine A contribue à 57 000 décès par an chez les enfants de 6 à 59 mois [3].
Au Burkina Faso, on manque de données à couverture nationale sur la carence en vitamine A (CVA) ; cependant, diverses études, limitées à certaines régions, montrent que l'avitaminose A constitue un véritable problème de santé publique. En effet, une enquête réalisée en 1986 donne des prévalences d'héméralopie de 3 % à 4,5 % chez les enfants de un à cinq ans des provinces du Yatenga, Passoré et du Sourou. Dans le département de Kaya, une récente étude a rapporté un taux de prévalence de faible teneur en rétinol sérique de 85 % et de 64 %, respectivement chez les enfants de 12 à 36 mois et leurs mères [4]. Les statistiques du ministère de la Santé et le rapport de l'OMS/MDIS rapportent en 1995 une prévalence de cécité nocturne de 1,7 % chez les enfants de deux à dix ans dans six provinces du Nord du pays et une prévalence de cécité nocturne déclarée de 1,2 à 7,9 % dans l'ensemble des provinces du Sanguié, du Passoré et du Bam [5].
Pour combattre ce problème, qui constitue un réel frein au développement de certains pays, trois approches complémentaires sont préconisées. Il s'agit de la supplémentation prophylactique en vitamine A [6], l'enrichissement des aliments en vitamine A et la diversification alimentaire [3,7] par la consommation d'aliments riches en caroténoïdes provitaminiques A.
Les caroténoïdes provitaminiques A sont des substances ubiquitaires dans le règne végétal, qui donne au règne animal sa source de vitamine A [8,9]. Le rôle bénéfique des caroténoïdes, du fait de leur activité antioxydante, a été établi dans différentes pathologies comme le cancer [10–12], les maladies cardiovasculaires [13,14]. L'action de la vitamine A dans la vision est bien établie [6,15] et la vitamine A et les caroténoïdes seraient également impliquées dans la diminution de la sévérité des infections aux virus de l'immunodéficience humaine (HIV) [16–19].
La littérature scientifique présente un ensemble de méthodes pour le dosage des caroténoïdes : la méthode la plus utilisée est la chromatographie liquide haute performance [20,21]. Cette méthode est utilisée avec différentes variantes d'extraction des caroténoïdes des matrices biologiques [21,22] ou alimentaires [22,23]. Les méthodes de détection sont les spectroscopies dans l'ultraviolet et le visible à longueur d'onde fixe [20,21] ou avec des détecteurs à barrettes de diode [22,24], l'électrochimie [21] et la détection de masse [25,26]. Une intéressante revue de la littérature sur le dosage des caroténoïdes dans les milieux biologiques et leurs interprétations en termes de santé publique est donnée par Oliviera et collaborateurs [23].
Si nombre de ces publications sont relatives à la détermination des caroténoïdes dans les milieux biologiques, peu s'intéressent à leur quantification dans les fruits et les légumes [22]. En Afrique occidentale, très peu de laboratoires effectuent le dosage des caroténoïdes et du rétinol dans les aliments ou les milieux biologiques.
Au Burkina, l'organisation Helen Keller International (HKI) s'est énormément investie, avec les autres institutions nationales ou internationales, dans la lutte contre la carence en VA. À ce titre, elle a entrepris la production pilote de variétés de patates douces à chair orange dans la région de Fada. La patate douce (Ipomea batata) est un tubercule de consommation courante. La promotion d'une variété donnée suppose des connaissances correctes sur les teneurs en caroténoïdes provitaminiques A.
Le but de ce travail est donc de valider une méthode de dosage des caroténoïdes par chromatographie liquide haute performance. Cette méthode est utilisée pour la détermination de la composition qualitative et quantitative en provitamine A de diverses espèces de patates douces cultivées en vue de la vulgarisation de leur consommation dans le cadre de la lutte contre l'avitaminose A.
2 Matériel et méthode
2.1 Matériel
Les échantillons de patates douces nous ont été apportés par l'ONG Hellen Keller International dans des sachets en plastiques noirs. Il s'agit des variétés Caromex Niger (CA), Jewel (JE), Karma 98 Niger (KA), Lantaogo 2 (LA), Lantaogo BF (LB), CN1442-59 (CN), Ming Shu (MS), Taning 64 Niger (TA), Narumintang Niger (NA) et Kolokohogo BF (KO). Ces échantillons ont été conservés à 4° à l'abri de la lumière dans leur contenant avant analyse. Ces échantillons ont été analysés au plus tard deux semaines après leur réception au laboratoire.
Les standards analytiques de lycopène (LYCO), de zéaxanthine (ZEA), de cryptoxanthine (CRYP), d'échinénone (ECHI) d'α-carotène (ACAR) et de β-carotène (BCAR) ont été obtenus, soit auprès de Sigma (Allemagne), soit au travers de dons gracieux de Hoffmann-La Roche (Bâle, Suisse). Le méthanol (Carlo Erba, Italie), l'acétonitrile (Carlo Erba, Italie), le dichlorométhane (Sigma, France) et l'hexane (ACROS, France) sont de qualité CLHP.
Les analyses sont effectuées à l'aide de chaîne de chromatographie liquide haute performance constituée d'une pompe de type Jasco PU-980 (Tokyo, Japon) équipée d'une boucle d'injection de 20 μl, d'une colonne chromatographique Supelco LC-18 (Bellefonte, USA) de 25 cm de longueur et 4,6 mm de diamètre, la taille particulaire étant de 5 μm.
La méthode utilisée dans le travail est celle décrite par Epler et al. [27]. La phase mobile est un mélange ternaire constitué d'acétonitrile (70 %), de méthanol (20 %) et de dichlorométhane (10 %) à un débit de 2 ml par minute. La détection est réalisée à 450 nm avec un détecteur Jasco UV 975 (Tokyo, Japon). L'acquisition des données est réalisée à l'aide d'un ordinateur muni d'un logiciel de traitement des données de type Borwin (JMBS, France).
2.2 Méthodes d'analyse
Toutes les analyses sont effectuées sous lumière jaune et les contenants des échantillons sont protégés de la lumière par du papier aluminium.
2.2.1 Préparation des solutions standard
Pour chaque caroténoïde, une petite quantité (quelques milligrammes) est dissoute dans 3 ml d'hexane. Des dilutions au 1/10, 1/100, 1/1000 de cette solution sont effectuées. Les densités optiques respectives sont mesurées à 450 nm. La solution dont la densité optique est comprise entre 0,1 et 0,9 est retenue. Sa concentration est alors calculée selon la formule :
| C = (DO/ε) × 10–3(µg ml–1) | (1) |
2.2.2 Préparation du mélange de calibration
À partir de la solution standard ainsi préparée, dont la concentration a été déterminée, les volumes précis de chaque solution de caroténoïdes sont prélevés de manière à obtenir une solution de concentration finale après reprise de 15 pmol dans 20 μl pour chaque caroténoïde dans le mélange de calibration, sauf pour la β-carotène, dont la concentration finale est 30 pmol/20 μl. Les volumes ainsi prélevés sont réunis, évaporés sous azote, et le résidu est repris par 500 μl d'acétonitrile pour obtenir les concentrations indiquées ci-dessus.
2.2.3 Préparation des mélanges de validation dans l'hexane
Les mélanges à injecter sont réalisés de la même manière que les mélanges de calibration et ce, à partir des standards purs. Les calculs des concentrations de chaque solution se font également selon la méthode décrite précédemment. Des dilutions indépendantes sont alors effectuées afin d'obtenir les concentrations requises par la gamme de concentrations étudiée. Le mélange final, pour chaque niveau de concentration, est obtenu en prélevant les volumes requis. Une fois le mélange réalisé, on procède à une évaporation du mélange sous pression d'azote. Le résidu obtenu est ensuite récupéré dans de l'acétonitrile pour constituer le mélange d'injection.
2.2.4 Extraction des caroténoïdes à partir de la patate douce
Après un broyage de la patate de manière à obtenir une pâte homogène (broyeur de type Moulinex, France), une prise d'essai de 1 à 2 g environ de pâte sont prélevés dans un tube. Les caroténoïdes sont extraits par agitation au vortex par 2 × 2 ml d'hexane en présence d'échinénone (standard interne), à une concentration de 0,6 pmol μl–1. Après agitation vigoureuse, on centrifuge le mélange à 3000 tr min–1 pendant 5 min à –5 °C. Après centrifugation, les phases hexaniques sont réunies et évaporées sous flux d'azote. Le résidu ainsi obtenu est repris dans 800 μl d'acétonitrile pour obtenir une solution contenant 15 pmol/20 μl du standard interne ; 20 μl sont alors injectés.
2.2.5 Calcul de la concentration de chaque type de caroténoïde dans les patates
2.2.5.1 Mélange de calibration
Après injection du mélange de calibration, de concentration définie, et comprenant le standard interne, on calcule, pour chaque pic, un facteur de calibration relatif :
| (2) |
La concentration Cxi d'un caroténoïdes dans un liment est donnée par :
| (3) |
2.3 Méthode de validation
La méthode de validation utilisée dans ce travail est celle décrite par Caporal-Gauthier et al. [28] et a consisté à déterminer les critères de performance d'une méthode de dosage des caroténoïdes sur trois jours, chaque jour représentant une expérience indépendante. L'α-carotène n'a pu être validé entièrement à cause du manque de standard au moment de la validation. Toutefois, une validation sommaire a permis de l'inclure dans les caroténoïdes dont les concentrations ont été mesurées dans les variétés de patates douces.
3 Résultats et discussion
En nutrition, l'estimation des teneurs en micronutriments dans les divers aliments revêt une grande importance. Elle permet de connaître la valeur nutritive des aliments consommés et oriente ainsi le choix des aliments à promouvoir. Ainsi, des méthodes de dosage entièrement validées comme à même de fournir des données fiables sont nécessaires. Au cours de notre travail, nous avons entrepris la validation du dosage de cinq caroténoïdes par chromatographie liquide haute performance. Dans le cadre de la promotion de la consommation de patates douces à chair orange comme source de vitamine A, un projet de sélection de variétés de patates douces est entrepris au Burkina Faso par Hellen Keller International. Dans le but d'accompagner ce projet sur le plan national, une série de validation de méthode analytique et de contrôle de la production est menée en vue de garantir et d'orienter les choix. Les caroténoïdes provitamine A que sont la zéaxanthine (ZEA), l'échinénone (ECHI), le lycopène (LYCO), l'α-carotène (ACAR) et le β-carotène (BCAR) ont été analysés. Dans les conditions chromatographiques déjà définies, les temps de rétention après injection du mélange de calibration sont respectivement de 1,88 min pour la zéaxanthine (ZEA), de 3,53 min pour l'échinénone (ECHI), de 3,97 min pour le lycopène (LYCO), de 5,71 min pour l'α-carotène (ACAR) et de 5,97 min pour le β-carotène (BCAR). Ces même temps de rétention ont été préalablement obtenus à l'aide des standards purs injectés seuls. L'α-carotène n'a pu être validé entièrement, à cause du manque d'un standard au moment de la validation. Son temps de rétention, proche de celui de la β-carotène, rend toujours difficile sa quantification lorsque ces deux composés sont dosés simultanément.
3.1 Paramètres de la courbe de régression
Le Tableau 1 résume les paramètres de régression de l'analyse des cinq caroténoïdes. Ces paramètres sont issus des données de validation réunies sur trois jours. Ils représentent les valeurs issues du traitement statistique d'ensemble de ces données et donnent une estimation réelle de la variabilité des dosages de plusieurs séries indépendantes, faits sur les trois jours de validation. On peut remarquer qu'une excellente linéarité est obtenue sur la gamme des concentrations analysées pour les cinq caroténoïdes dans une gamme de concentration allant de 0,25 à 1,5 pmol μl–1. Les coefficients de détermination sont proches de l'unité et les analyses statistiques faites sur les paramètres montrent que les pentes mesurées sont hautement significatives (p < 0,005). Les ordonnées à l'origine ne sont pas significativement différentes de zéro, ainsi que l'attestent les valeurs des écarts types d'estimation paramétrique.
Paramètres de régression obtenus lors de la validation des cinq caroténoïdes a
| Caroténoïdes | Paramètres de régression | |||
| Gamme de concentration (pmol μl–1) | Pente moyenne estimée (ET)b | Ordonnée moyenne estimée à l'origine (ET) | Coefficient de détermination | |
| Zéazanthine | 0,25–1,50 | 2892 (107) | 641 (2098) | 0,997 |
| β-Cryptoxanthine | 0,25–1,50 | 3808 (119) | –277 (2319) | 0,996 |
| Échinénone | 0,25–1,50 | 2644 (93) | 991 (1807) | 0,995 |
| Lycopène | 0,25–1,50 | 4370 (262) | –660 (5105) | 0,986 |
| β-carotène | 0,25–1,50 | 3217 (121) | 1233 (2367) | 0,994 |
a Les chiffres entre parenthèses sont les écart types d'estimation paramétrique (n = 3).
b Équation de la forme : y = a x + b.
3.2 Exactitude de la méthode
L'exactitude de la méthode est estimée en calculant les valeurs de recouvrement des différentes concentrations utilisées pour établir la droite de régression par rapport à cette dernière. Nous avons, d'une part, effectué ce calcul pour chaque jour de validation et, d'autre part, traité l'ensemble des données par rapport à la droite de régression moyenne. Les résultats sont donnés dans le Tableau 2. Les chiffres entre parenthèses représentent les écarts types de recouvrement sur l'ensemble des trois jours. Pour toutes les concentrations, les taux de recouvrement sont effectivement dans l'intervalle 100 ± 10 % [28]. Ces taux de recouvrement sont couramment rencontrés dans la littérature. Ainsi des taux de 97,7 ± 3 % pour le β-carotène ont été mesurés par Hosotani [24], tandis qu'Oliveira et Watson ont trouvé 87 % pour le β-carotène et 97 % pour la β-cryptoxhanthine [23]. Ces résultats montrent que l'on peut effectuer les dosages avec une exactitude suffisante.
Taux de recouvrement (en pourcentages) aux différentes concentrations, mesurés par rapport à la droite de régression
| Caroténoïdes | Concentration (pmol μl–1) | |||||
| 0,25 | 0,50 | 0,75 | 1,00 | 1,25 | 1,5 | |
| ZEA | 98,33 (4,66) | 100,07 (6,24) | 104,37 (4,33) | 96,20 (4,79) | 99,28 (9,87) | 101,87 (0,46) |
| CRYP | 97,50 (350) | 103,98 (2,45) | 97,57 (4,44) | 102,74 (2,86) | 102,07 (2,03) | 98,41 (1,52) |
| ECHI | 101,16 (8,88) | 101,06 (4,61) | 93,55 (5,89) | 102,16 (2,90 | 101,93 (2,69) | 98,06 (0,86) |
| LYCO | 100,59 (3,60) | 107,69 (3,45) | 87,01 (7,30) | 104,32 (1,27) | 103,56 (1,42) | 97,97 (2,25) |
| BCAR | 96,73 (1,25) | 101,04 (9,46) | 101,30 (8,73) | 94,24 (1,60 | 100,06 (11,68) | 104,67 (2,12) |
3.3 Fidélité de la méthode
La fidélité de la méthode est estimée en effectuant, pour chaque jour, trois dilutions indépendantes pour les concentrations intermédiaires (0,75, 1,00 et 1,25 pmol μl–1). Les résultats présentés dans le Tableau 3 représentent les variabilités sur les trois jours de validation. Ils montrent une reproductibilité acceptable pour la méthode et permettent d'envisager l'utilisation d'une telle méthode à des fins de dosage précis. Ces coefficients de variation sont meilleurs que ceux obtenus par certains auteurs [24,26]. Ces valeurs sont similaires à celles rapportées par d'autres auteurs pour ces caroténoïdes. Il faut toutefois souligner que ces taux ont été obtenus à partir de milieux biologiques. Les valeurs des coefficients de variation sont toutefois inférieures à 10 %, seuil en deçà duquel, pour les niveaux de concentrations mesurées, on peut considérer que la fidélité est bonne [28].
Coefficients de variation inter-jours du dosage des caroténoïdes par HLPC
| Caroténoïdes | Concentration (pmol μl–1) | ||
| 0,75 | 1,00 | 1,25 | |
| ZEA | 2,10 | 2,18 | 2,25 |
| CRYP | 3,78 | 2,34 | 1,23 |
| ECHI | 2,72 | 1,66 | 3,08 |
| LYCO | 3,23 | 2,43 | 4,00 |
| BCAR | 2,65 | 1,67 | 1,11 |
3.4 Limite de détection et de quantification
Les limites de quantification ont été déterminées en tenant compte des paramètres de l'étude de linéarité, en considérant les données de l'analyse de concentrations de plus en plus faibles de chaque caroténoïde et des précisions et exactitudes sur ces concentrations. Un seuil d'exactitude de 100 ± 20 % a été retenu pour la fixation de cette limite.
Les limites de quantification sont de 0,05 pmol μl–1 pour la zéaxhathine, de 0,04 pmol μl–1 pour la β-cryptoxhanthine, de 0,05 pmol μl–1 pour de l'échinénone, de 0,04 pmol μl–1 pour le lycopène et de 0,04 pmol μl–1 pour le β-carotène. Les limites de détection calculées sont respectivement de 0,02 pmol μl–1 pour la zéaxhathine, de 0,01 pmol μl–1 pour la β-cryptoxhanthine, de 0,02 pmol μl–1 pour l'échinénone, de 0,01 pmol μl–1 pour le lycopène et enfin de 0,01 pmol μl–1 pour le β-carotène. Avec également un détecteur UV–visible, certains auteurs trouvent des limites de détection de 0,2 pmol pour la lutéine, la β-cryptoxhanthine, les α- et la β-carotènes, alors que d'autres trouvent 0,019 pmol μl–1 pour la β-cryptoxhanthine et 0,028 pmol μl–1 pour l'α-carotène, le lycopène et le β-carotène [23]. De meilleures limites de détection sont obtenues par les détecteurs de masse [26].
La composition qualitative et quantitative en caroténoïdes de dix variétés de patates douces a été déterminée par cette méthode de chromatographie liquide haute performance. Au cours de ce dosage, l'échinénone est utilisée comme standard interne. Pour chaque variété, six déterminations ont été effectuées. Les caroténoïdes recherchés sont ceux ayant une activité provitaminique A ou antioxydante et de grande fréquence. Les résultats sont présentés dans le Tableau 4. Seules quatre variétés (Karma 98 Niger, Caromex Niger, Jewel et Narumintang Niger) contiennent l'ensemble des caroténoïdes à teneurs variables. Dans toutes ces variétés, le β-carotène est prédominant. On notera l'absence d'α-carotène dans la variété Taining 64 Niger et l'absence de lycopène de d'α-carotène dans la variété Lantaogo BF. La variété Kolokohogo BF ne contient pratiquement pas de caroténoïdes parmi ceux recherchés. Le β-carotène domine dans toutes les variétés, sauf chez Ming Shu Niger et Kolokohogo.
Composition qualitative et quantitative des différentes variétés de patates douces analysées
| Variétés de patate douce | Caroténoïdes (μg/100g) | ||||
| ZEA | CRYP | LYCO | ACAR | BCAR | |
| CN | 17,2 | 9,9 | (–) | (–) | 95 |
| (11,2) | (11,1) | (83,5) | |||
| MS | 19,5 | 13,5 | (–) | (–) | 6,66 |
| (1,1) | (1,6) | (1,60) | |||
| LA | 3,17 | (–) | (–) | (–) | 38 |
| (1,51) | –8 | ||||
| KA | 17,2 | 5,1 | 17,8 | 89,8 | 429 |
| –4 | (2,2) | (0,3) | (0,01) | –525 | |
| CA | 43,9 | 16,9 | 24,2 | 202 | 2046 |
| (15,2) | (2,2) | (18,4) | –114 | –1192 | |
| JE | 38 | 15,7 | 9,6 | 136 | 1911 |
| (3,1) | (1,2) | (1,03) | –11 | –148 | |
| TAI | 12,32 | 12,6 | 5,9 | (–) | 774 |
| (3,6) | (2,7) | (2,9) | –357 | ||
| NA | 28,4 | 17,2 | 10,4 | 151 | 2348 |
| (3,5) | (2,4) | (2,7) | –17 | –210 | |
| KO | 6,71 | (–) | (–) | (–) | 4,59 |
| (2,48) | (1,05) | ||||
| LB | 72,1 | 10,6 | (–) | (–) | 170 |
| (24,8) | (6,7) | -50 |
Les variétés Caromex Niger, Jewel et Narumintang Niger ont une teneur élevée en caroténoïdes, avec des dispersions d'estimation différentes. Ainsi, la variété Caromex Niger, bien que riche en β-carotène, présente une grande variabilité d'une gousse à l'autre. Seules les variétés Jewel et Narumintang Niger ont des teneurs en caroténoïdes homogènes quel que soit l'échantillonnage.
La comparaison de la teneur en β-carotène par rapport aux autres caroténoïdes dans chaque variété est présentée dans le Tableau 5, dont la représentation graphique est donnée par la Fig. 1. Les trois variétés Caromex Niger, Jewel et Narumintang Niger ont les plus riches potentialités en caroténoïdes totaux, avec de meilleures teneurs pour la variété Caromex Niger. Une variabilité assez grande et des teneurs plus homogènes aussi bien en β-carotène qu'en caroténoïdes totaux sont établies chez les variétés Jewel et Narumintang Niger.
Composition en β-carotènes et en caroténoïdes totaux (μg/100g) des différentes variétés de patates douces
| Variétés de patate | β carotènes (μg/100 g) | Autres caroténoïdes (μg/100 g) | Caroténoïdes totaux (μg/100 g) |
| CN | 95 (83,5) | 27,1 (15,8) | 122,1 (85) |
| MS | 6,66 (1,60) | 33(1,9) | 39,66 (2,5) |
| LA | 38 (8) | 3,2 (1,5) | 41,2 (7,9) |
| KA | 429 (525) | 130 (4,6) | 559 (525,4) |
| CA | 2045 (1192) | 286,6 (116,5) | 2331,6 (1198) |
| JE | 1911(148) | 199,1 (11,7) | 2110,1 (148,5) |
| TA | 774 (356) | 30,9 (5,4) | 804,9(356,9) |
| NA | 2348 (210) | 207 (6,4) | 2555 (108,2) |
| KO | 4,59 (1,05) | 6,7 (2,5) | 11,29 (2,70) |
| LB | 169 (50) | 82,8 (25,7) | 251,8 (56,4) |
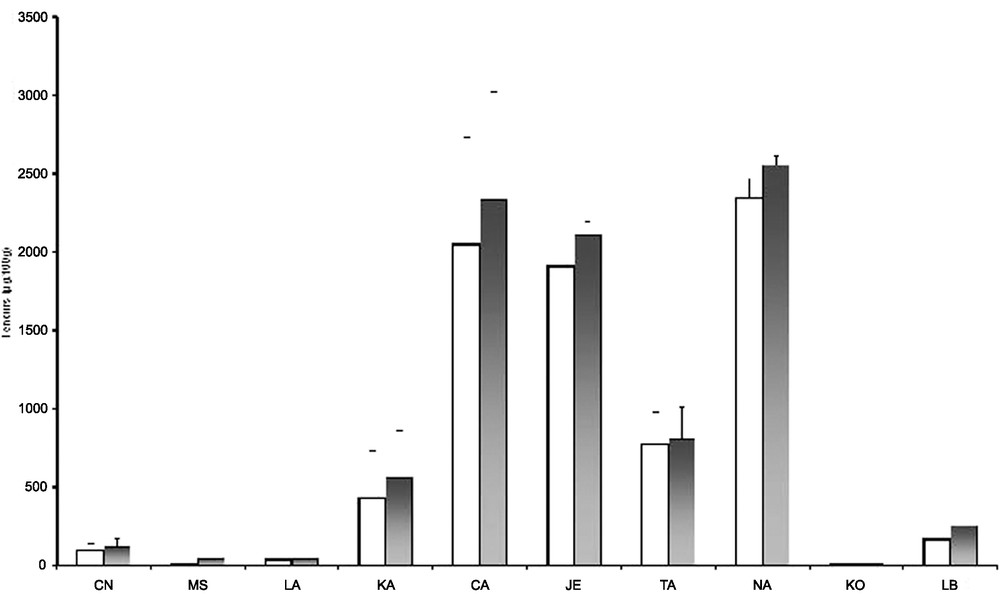
Teneurs comparatives en β-carotène et en caroténoïdes totaux dans différentes véariétés de patates douces (Ipomea batata).
Sur le plan de la valeur vitaminique A, les variétés de patates douces Caromex Niger, Jewel, Narumintang Niger, Karma 98 Niger et Taining 94 Niger représentent toutes de bonnes sources de provitamines A et le développement de leur production mérite une plus grande promotion. En effet, la valeur vitaminique A d'un aliment est appréciée par trois facteurs, qui sont la teneur en VA, l'efficacité biologique des carotènes et, enfin, la taille de la portion habituellement consommée. Leurs teneurs en β-carotène, principal caroténoïde provitamine A et le plus actif, sont très élevées, ainsi que le montre le Tableau 4, à l'exception des variétés Karma98 Niger et Taining 64 Niger. Les teneurs trouvées sont du même ordre de grandeur que celles rapportées d'autres pays selon la même méthode [29]. En effet, ces auteurs ont rapporté des teneurs de 2960 μg/100 g au Guatemala, de 1050 μg/100 g en Thaïlande, de 6418 μg/100 g en Égypte et de 736 μg/100 g en Indonésie. Ces analyses des caroténoïdes dans les patates douces sont, à notre connaissance, les toutes premières à avoir été réalisées au Burkina Faso par CLHP. Même si les valeurs trouvées doivent être considérées en tenant compte du délai et des conditions de conservation avant analyse, de même que des conditions de production et du stade du développement des tubercules au moment de la récolte, il n'en reste pas moins qu'elles confirment et soutiennent l'intérêt de cet aliment comme source potentielle de VA pour les enfants. Sa teneur est inférieure à celle de l'huile de palme rouge [30], dont la promotion dans le Centre-Nord du pays a permis une réduction significative de la carence chez les enfants en bas âge, mais elle est comparable à celle des mangues récoltées au Burkina. En effet, des analyses réalisées en utilisant la même méthode ont donné des teneurs en β-carotène de 1260 ± 90 et 1290 ± 220 μg/100 g pour les variétés Amélie et Brooks mûres, respectivement, et 700 ± 70 et 930 ± 110 μg/100 g pour les mêmes variétés de mangues semi-mûres [31].
Ces données sur la patate douce offrent ainsi des arguments pour orienter le choix des variétés à promouvoir. La situation de la CVA dans les PED devrait encourager les acteurs à associer de façon plus engagée des stratégies de diversification alimentaire à celles de supplémentation et d'enrichissement, afin de résoudre les problèmes alimentaires par des solutions alimentaires [7].
4 Conclusion
Nous présentons dans ce travail les résultats de la validation complète d'une méthode de dosage des caroténoïdes par chromatographie liquide haute performance. La méthode présente une bonne linéarité, une bonne exactitude et une bonne précision. Cette méthode validée est utilisée pour la détermination des teneurs en caroténoïdes de dix variétés de patates douces. Les variétés Jewel, Narumintang Niger sont les plus riches et les plus homogènes en β-carotène et en caroténoïdes totaux et leur production donnerait des aliments riches indiqués pour la promotion comme source de provitamine A dans l'alimentation des populations. Certaines variétés, comme Kolokohogo BF Lantaogo 2 et Ming Shu Niger, sont plutôt des sources de glucides et ne constituent pas une alternative dans ce domaine. Il faut noter que ce sont les teneurs en β-carotène, jointes à un bon rendement cultural, qui constituent les arguments permettant la vulgarisation d'une variété donnée.
Remerciements
Les auteurs remercient HKI-Burkina pour le financement d'une partie de ce travail et MM. B. Savadogo, O. Ouedraogo et R. Kaboré pour leur excellente assistance technique. Nos remerciements vont également à Hoffmann-La Roche (Suisse) pour le don à titre gracieux des standards de caroténoïdes.


