Abridged version
1 Introduction
Estuaries are heterotrophic ecosystems [12], where large quantities of organic material carried by rivers are mineralised. Most of this mineralisation occurs in the maximum turbidity zone (MTZ) of estuaries: on the one hand, high turbidities favour the installation of a large population of particle-attached bacteria [7] and, on the other hand, low light penetration limits photosynthesis [17]. This is the case in the Gironde Estuary, where bacterial production is maximal in the highly concentrated MTZ (up to at the surface [20]) and where primary production is restricted to the river and the estuarine mouth [13].
Pigments and carotenoids measured by liquid chromatography (HPLC) have been mostly used to characterise phytoplanktonic dynamics and grazing activities in oceanic and coastal environments [6,14,18,21,25]. Very few studies have attempted to use phytoplanktonic and plant pigments as tracers of degradation processes [2–5]. In this study, we use pigment measurements during in vitro experiments to investigate how freshwater phytoplankton materials (two Chlorophytes) are mineralised when they enter into the MTZ of the Gironde Estuary. In particular, we focused on the effect of high turbidities on the kinetics of pigment degradation.
2 Methods
In a first experiment, material from a freshwater chlorophytes (Scenedesmus suspicatus Chaudat) culture was mixed with water from the Gironde MTZ at different turbidities: (filtrated through 0.7 μm filters (GF/F); ‘RC’ incubation), (partially filtrated; ‘R1’ incubation) and (non-filtrated; ‘R2’ incubation). Five litres of each mixture were incubated during 28 days, at in situ temperature (20 °C), in the dark and gently stirred to maintain oxygenation. In a second experiment, material from another freshwater chlorophytes (Chlamydomonas sp.), cultivated in axenic conditions, was mixed with a water sample from the Gironde MTZ at a turbidity of . In the first incubation (‘RS’), the MTZ water sample was autoclaved before mixing the algae, in order to kill all bacteria, and the incubation was performed in a closed chamber oxygenated by bubbling sterile air (filtrated through a 0.2 μm filter). In the second incubation (‘RNS’), the MTZ water sample was not autoclaved and the incubation was carried out as for the first experiment. Pigments and Particulate Organic Carbon (POC) were measured on aliquots sampled throughout the time course of the incubations. For the sterile incubation, sampling was performed aseptically. Sub-samples were filtrated through GF/F glass fibre filters (0.7 μm). One was dried for POC determination and one was frozen for pigment determination. POC was measured with a LECO C/S 125 analyser after acidification [23]. Pigments were measured by HPLC, after extraction in 90% acetone. The HPLC elution protocol [19] is given in Table 1, whereas an example of chromatogram is displayed in Fig. 1.
Protocole d'élution du système CLHP.
Elution protocol for the HPLC system.
| Temps (min) | Débit (ml min−1) | % A | % B | Conditions |
| 0 | 0,6 | 100 | 0 | injection |
| 10 | 0,6 | 100 | 0 | phase isocratique |
| 50 | 0,6 | 0 | 100 | gradient linéaire |
| 55 | 0,6 | 0 | 100 | phase isocratique |
| 60 | 0,6 | 100 | 0 | gradient linéaire |
| 65 | 0,6 | 100 | 0 | équilibration |
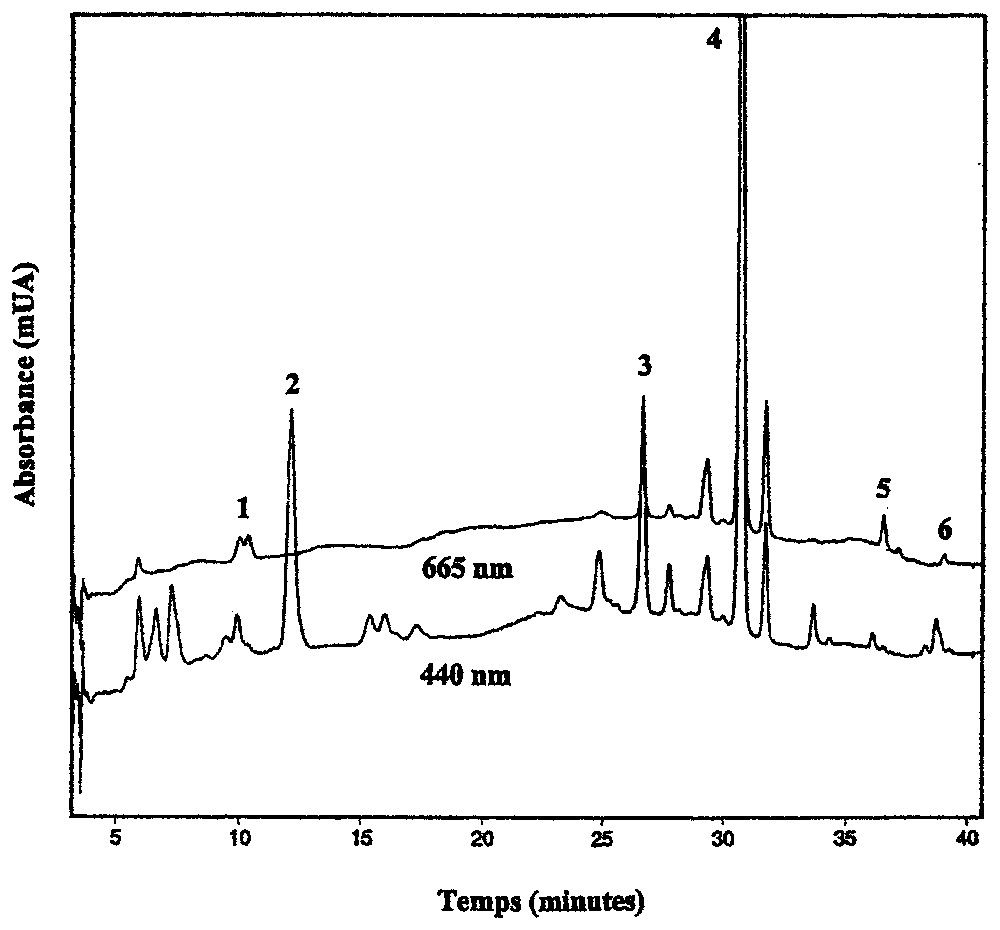
Exemple de chromatogramme obtenu avec le dispositif CLHP d'un échantillon à 440 et 665 nm, réacteur RC à 7 j. 1 : Phaeophorbides a ; 2 : lutéine ; 3 : chlorophylle b ; 4 : chlorophylle a ; 5 : phaeophytine a ; 6 : pyrophaeophytine a.
Example of chromatogram at 440 and 665 nm, RC at day 7. 1: Pheophorbides a; 2: lutein; 3: chlorophyll b; 4: chlorophyll a; 5: pheophytin a; 6: pyropheophytin a.
3 Results and discussion
Chlorophyll a, chlorophyll b and lutein concentrations rapidly decreased during the first 15 days (Fig. 2). The degradation was faster with increasing turbidities. Degradation products of chlorophyll a peaked around days 8–13 and decreased afterwards. The proportions of pheophytin a and pyropheophytin a increased with increasing turbidity, but this parameter had no effect on the phaeophorbide a. This confirms the role of the bacteria attached to the particles, since pheophytin a and pyropheophytin a are mostly produced by bacterial exoenzymatic activities [6,18], whereas pheophorbide a is mostly produced by grazing activities [14]. The role of particle-attached bacteria is also confirmed by the second experiment (Fig. 3): the decrease of pigments was not significant (except for chlorophyll b) in the incubation with sterilised particles (RS).
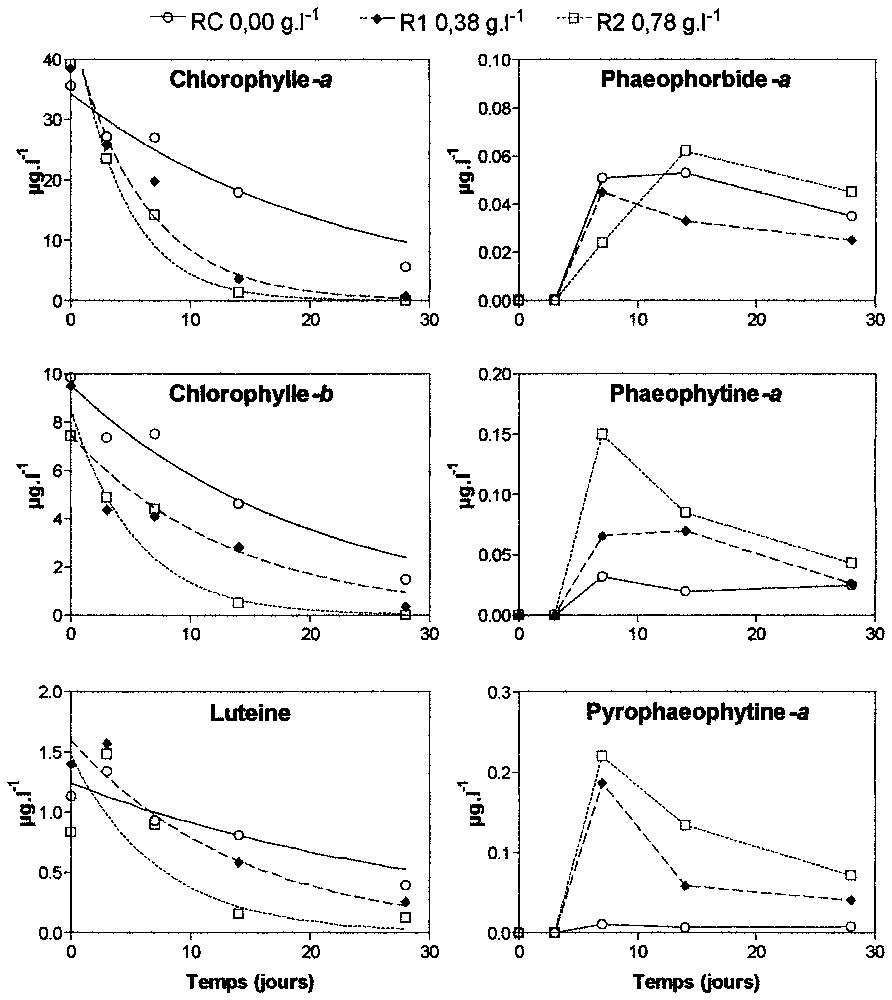
Évolution au cours du temps des pigments et des produits de dégradation de la chlorophylle a dans les trois réacteurs de l'expérience 1. RC : sans particules ; R1 : de concentration en MES de ; R2 de concentration en MES . Courbes des cinétiques de dégradation des chlorophylles et de la lutéine.
Time-course of pigments and degradation products during the three incubations from experiment 1. RC: without particles; R1: at ; R2 at . Curves of the degradation kinetics of the chlorophylls and lutein.
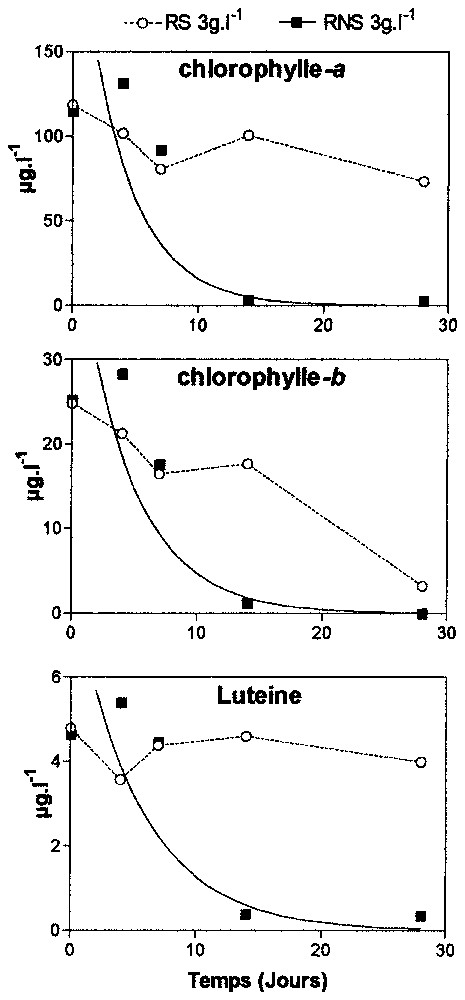
Évolution au cours du temps des pigments dans les deux réacteurs de l'expérience 2, à une concentration en MES de . RS : stérilisé ; RNS : non stérilisé.
Time-course of pigments during the two incubations from experiment 2, at SPM concentration of . RS: sterilised; RNS: non-sterilised.
Regarding the first order kinetics (K1) of pigments decay (Table 2) for incubations RC, R1, R2 and RNS, lutein appeared more resistant to bacterial attack. This is consistent with findings from Bianchi et al. [2,4] in the Hudson estuary. We have plotted the K1 values and the half-life time as a function of the ratio between suspended particulate matter and chlorophyll a (Fig. 4). This ratio represents the availability of fresh phytoplanktonic material for the number of bacteria present on the particles. K1 values increased when this ratio increased, showing that phytoplanktonic material constituted a preferential substrate for bacteria compared to soil detritus that dominate in the Gironde MTZ [23].
Cinétiques de disparition (dégradation) d'ordre 1 (en j−1) des pigments dans le réacteur sans particules (RC) et dans les réacteurs avec particules (R1, R2 et RNS) calculées sur la période 0–15 j (calculs réalisés sur quatre points).
First order decay constants (d−1) of the pigments in the incubator without particle (RC) and in the incubators with particles (R1, R2 and RNS) calculated over the period 0–15 d (calculations performed on four points).
| MES | ||||
| Chlorophylle | −0,04 | −0,17 | −0,22 | −0,27 |
| (R2=0,93) | (R2=0,94) | (R2=0,92) | (R2=0,80) | |
| Chlorophylle | −0,05 | −0,07 | −0,19 | −0,23 |
| (R2=0,91) | (R2=0,79) | (R2=0,87) | (R2=0,83) | |
| Lutéine | −0,03 | −0,07 | −0,14 | −0,19 |
| (R2=0,70) | (R2=0,90) | (R2=0,71) | (R2=0,77) |
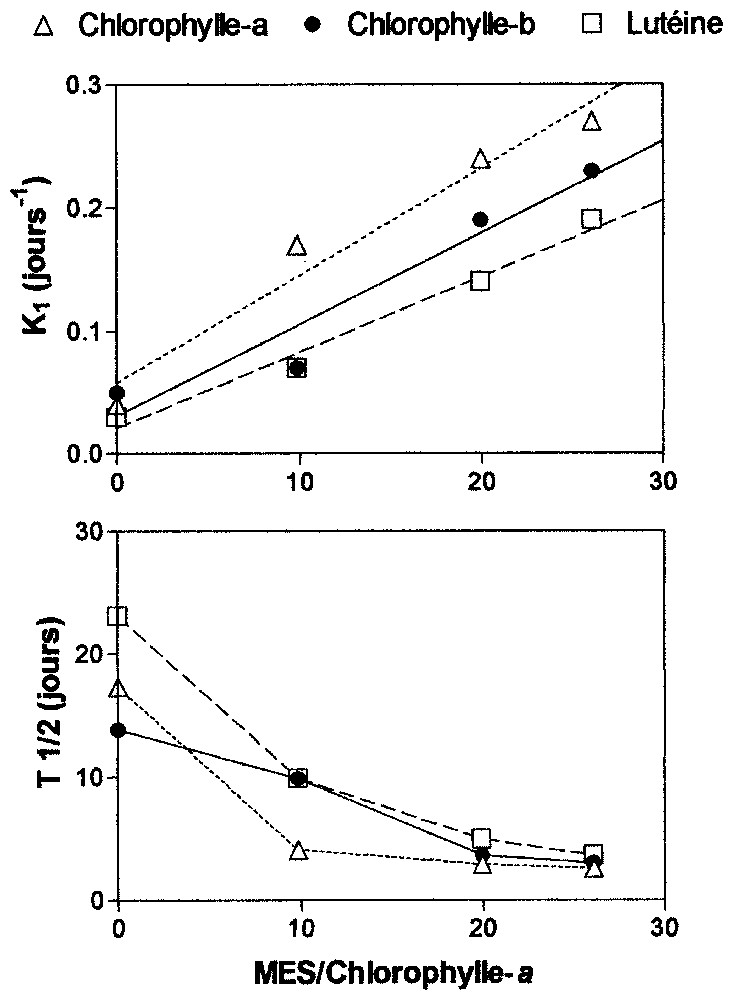
Constantes de dégradation d'ordre 1 (K1) et temps de demi-vie (t1/2) des pigments en fonction du rapport initial MES/chlorophylle a (×10−3).
First order decay constants (K1) and half-life times (t1/2) of pigments as a function of SPM/Chlorophyll a initial ratio (×10−3).
In the incubation RC without particles (), we observed a first order decrease of POC (not shown) with a K1 value of 0.03 d−1 (R2=0.90). This value was close to the corresponding value for lutein in the same incubation. Thus, we concluded that this pigment was representative for the degradation of the overall algal material. In the incubations with particles (R1 or R2), it was not possible to observe a significant decrease of POC concentrations because the high background of detrital refractory POC on the MTZ particles masked the phytoplanktonic POC. However, we can expect that the degradation of the phytoplanktonic material was affected by suspended matter concentrations in a similar way as lutein, i.e., the first order constant increased to 0.14 and 0.19 d−1 in R2 and RNS, respectively (Table 2). Thus half-life times of this material in the Gironde MTZ are in the range of 3.5–5 days (Fig. 4).
With these experiments, we obtained the first order decay constant for a specific material in the Gironde MTZ. However, in order to develop a biogeochemical model able to reproduce the organic matter degradation processes and the resulting oxygen deficits in the Gironde Estuary, the degradation kinetics of the other sources of organic matter must be determined. Veyssy et al. [23] showed that the major part of organic matter decomposed in the Gironde MTZ was derived from litters eroded from the surface of soils during autumn. This material would probably have slower degradation rates than the algae studied here. Bianchi et al. [2] have determined the kinetics of pigment degradations for four macrophytes in water from the Hudson estuary (USA). They obtained K1 values between 0.02 and 0.07 d−1 for chlorophyll a and b and between 0.01 and 0.04 d−1 for lutein. This is similar to what we found in incubation without particles (RC) but 5 to 10 times lower to what we obtained at in situ turbidities. Indeed, in macrophytes as well as in leaves detritus, pigments are protected by structural compounds (lignins, chitine, cellulose). Pigment decays in the aquatic system are strongly dependent on the material in which they are contained. This makes them good tracers for the overall material decomposition.
1 Introduction
Dans les estuaires macrotidaux, par suite du processus d'érosion sur les bassins versants et sous l'action des courants de marées, un bouchon vaseux (BV) se forme dans la zone de mélange et s'étend sur plusieurs dizaines de kilomètres, la plupart du temps dans la zone de faible salinité [20]. La pénétration de la lumière dans ce BV étant très faible, la photosynthèse y est limitée [17]. Au contraire, ce BV constitue un lieu particulièrement propice à l'installation d'une abondante communauté de bactéries hétérotrophes (de l'ordre de 107 bactéries ml−1 dans la Gironde [15]) qui se fixent sur les particules [7]. Pour ces raisons, les activités autotrophes et hétérotrophes sont faiblement couplées en milieu estuarien macrotidal [10]. La production primaire est maximale dans le fleuve en amont du BV et aux plus hautes salinités en aval du BV, tandis que la respiration et la production bactérienne sont maximales dans le BV [13]. Globalement, la respiration excède la production primaire [12], qui constitue une source de CO2 pour l'atmosphère [11]. La Gironde, dans le Sud-Ouest de la France, est un exemple type d'estuaire macrotidal turbide et hétérotrophe, avec un bouchon vaseux très concentré (jusqu'à de MES en surface) et étendu sur plus de 50 km [1,17,20]. Environ la moitié de la MOP transportée par la Garonne et la Dordogne y est minéralisée [23].
L'analyse des pigments par chromatographie en phase liquide (CLHP, chromatographie liquide haute pression) est aujourd'hui largement répandue en océanographie. En océan ouvert, elle permet, d'une part, de quantifier l'importance relative des différents groupes phytoplanctoniques à l'aide de leur signature pigmentaire [6,18] et, d'autre part, de suivre les voies de dégradation de ce matériel sous l'action du broutage zooplanctonique et/ou de l'activité bactérienne à l'aide des produits de dégradation des chlorophylles [6,14]. Ces deux types d'information ont aussi été obtenues en milieu côtier et estuarien peu turbide où le phytoplancton est la principale source de pigments [19,21]. Au contraire, dans les estuaires macrotidaux turbides, la matière organique particulaire (MOP) allochtone est souvent majoritaire et contribue de manière significative au signal pigmentaire des eaux [5,19]. Cette MOP allochtone provient des litières lessivées sur le bassin versant et des macrophytes installées sur les berges, qui contiennent, entre autres, tout comme les chlorophytes, de la chlorophylle b et de la lutéine. De plus, chez les végétaux supérieurs, les pigments sont protégés par des composés structurels (lignine, cires et cellulose) et ont des durées de vie prolongées dans le BV, comparées à celles des mêmes pigments d'origine phytoplanctonique [2,4]. Cette propriété confère aux mesures de pigments un intérêt en tant que traceur de la dégradation de MOP d'origines diverses.
Dans cette étude, nous avons suivi la dégradation de matériel phytoplanctonique dans le BV par une approche in vitro. L'objectif était double : évaluer l'impact de la turbidité sur la dégradation du matériel phytoplanctonique et déterminer les cinétiques de dégradation des pigments marqueurs du phytoplancton.
2 Méthodes
Nous avons choisi de suivre la dégradation des chlorophytes dans le BV de la Gironde, ce groupe étant bien représenté en milieu fluvial amont [9]. Le matériel algal obtenu par culture a été incorporé et mélangé avec des échantillons d'eau du BV, tandis que l'évolution temporelle de trois pigments marqueurs (chlorophylle a, chlorophylle b et lutéine) et des produits de dégradation de la chlorophylle a (phaeophorbide a, phaeophytine a et pyrophaeophytine a) a été suivie au cours de deux expériences différentes.
2.1 Expérience 1 : influence de la turbidité
La chlorophyte utilisée est Scenedesmus suspicatus Chaudat (collection du Leesa, Arcachon), espèce bien représentée dans la Garonne [9]. Elle a été cultivée pendant 8 j sur milieu Dauta [16] jusqu'à sa phase exponentielle de croissance. Plusieurs aliquotes de cette culture ont chacune été mélangées à 5 l d'un échantillon d'eau de l'estuaire, prélevé dans le BV de salinité 0,6 et de concentration en MES , ayant préalablement subi trois traitements différents : (1) filtration à travers des filtres (GF/F) de 0,7 μm, afin de retenir toutes les particules et les bactéries attachées à celles-ci (réacteur contrôle : RC), (2) dilution de moitié avec de l'eau filtrée afin d'obtenir une concentration en MES de (réacteur 1 : R1) et (3) absence de filtration et de dilution, utilisé à la concentration in situ en MES de (réacteur 2 : R2). Des quantités identiques d'algues ont été introduites vivantes dans les trois réacteurs, à raison de 25 et 50 μg de chlorophylle a par gramme de particules dans le réacteur R1 et R2 respectivement, ce qui correspond aux apports fluviatiles totaux de phytoplancton dans le bouchon vaseux pendant toute la période estivale [23]. La concentration en chlorophylle a était de dans le BV avant introduction de l'algue et de après inoculation.
La pénétration lumineuse étant de l'ordre de 20–30 cm dans le bouchon vaseux de la Gironde (coefficient d'atténuation Kd=20–50 m−1) [17], les trois réacteurs de 5 l ont été incubés pendant 28 j à l'obscurité, de manière à éviter tout processus photochimique. La température était de 20 °C (± 0,5) et une agitation continue à 100 tr min−1 a été appliquée aux réacteurs pour conserver une bonne oxygénation de l'eau et éviter l'adsorption de particules sur les parois. Des aliquotes de 50 à 200 ml ont été prélevées (leurs volumes cumulés en fin d'incubation allaient de 5 à 15 % du volume initial) à intervalles de 1, 3, 7, 14 et 28 j, puis filtrées sur des filtres GF/F pour analyse du carbone organique particulaire (COP), des pigments et des produits de dégradation de la chlorophylle a.
2.2 Expérience 2 : rôle des bactéries attachées aux particules
Des incubations de même type ont été réalisées en comparant, pour une même turbidité, l'évolution des teneurs en pigments dans un échantillon de BV stérilisé (réacteur stérile RS), d'une part, et un échantillon BV sans traitement (réacteur non stérile RNS), d'autre part. Une souche axénique (fournisseur : Culture Collection of Algae and Protozoa (CCAP), UK) d'une chlorophycée d'eau douce (Chlamydomonas sp.) a été cultivée sur un milieu de Jaworsky [8]. Un nouvel échantillon du bouchon vaseux de la Gironde (concentration en MES = 3 g l−1) a été prélevé, dont une partie a été stérilisée deux fois pendant 40 min à 121 °C, afin d'éliminer toutes les bactéries, même sporulantes. La culture d'algues vivantes a ensuite été mélangée dans 5 l du bouchon vaseux stérilisé et non stérilisé, dans la proportion de 50 μg de chlorophylle a par gramme de particules, puis incubé comme décrit précédemment. Le réacteur stérile a cependant été modifié : il s'agit d'une enceinte fermée, où de l'air filtré (0,2 μm) est propulsé pour assurer l'oxygénation et dans lequel les aliquotes ont été prélevées de manière stérile à la flamme. En fin d'incubation, le niveau de contamination bactérienne a été déterminé et les populations bactériennes des deux réacteurs ont été comparées. Pour cela, un isolement sur milieu solide (gélose nutritive), suivi d'une observation par microscopie photonique à immersion (×100) ont été réalisés. Afin de connaı̂tre l'ampleur de la contamination, un dénombrement classique sur milieu solide des micro-organismes revivifiables a été réalisé pour des dilutions allant de 100 à 10−4 (NF T90–402 et 403).
2.3 Analyses
Le COP est mesuré à l'aide d'un analyseur Leco C/S 125, après décarbonatation par HCl 2 N [23]. Le matériel pigmentaire retenu sur les filtres est extrait dans de l'acétone à 100 % et soumis aux ultrasons [19]. Des tests de rendement ont montré qu'une double extraction était suffisante sur des échantillons riches en MES pour recouvrir 80 à 95 % des pigments, les pigments les plus polaires étant plus facilement extraits. L'extrait acétonique est ensuite méthylé par du diazométhane, permettant une meilleure séparation des molécules possédant un groupe acide, puis concentré à sec. Le culot de pigment est ensuite repris juste avant l'analyse dans le solvant A du système CLHP. Ce système consiste en une pompe binaire TSP100 couplée à un spectrophotomètre TSP UV6000 à barrettes de diodes, qui permet une analyse en temps réel de tout le spectre UV–visible compris entre 300 et 800 nm de longueur d'onde. Le bruit de fond est inférieur à 5 10−5 unité d'absorbance. Les extraits sont injectés par un passeur automatique TSP AS100 à boucle de 100 μl réfrigéré à 4 °C. La séparation est faite sur une colonne C18 greffée (CIL-Cluseau) de dimensions 250×4 mm et de taille de particules 5 μm. Nous avons modifié la méthode de Wright et al. [25] pour l'utilisation d'une pompe binaire. Le solvant A est constitué de méthanol, d'acétonitrile, de 0,05 M d'acétate d'ammonium (50/45/5 v/v et pH 7,2) et le solvant B d'acétate d'éthyle, de méthanol et d'acétonitrile (80/19/1 v/v). Le gradient des solvants d'analyse est décrit dans le Tableau 1. Un exemple de chromatogramme à 440 nm est donné dans la Fig. 1. L'identification des pigments est faite en comparant les temps de rétention des pics et les spectres d'absorption obtenus avec des standards (VKI, International Agency for 14C Determination). Pour les phaeophytines, des standards ont été fabriqués au laboratoire selon la méthode de Bianchi et al. [4]. L'intervalle de confiance pour la quantification des pigments va de 0,8 % pour la fucoxanthine à 2,2 % pour la chlorophylle a.
3 Résultats
3.1 Expérience 1
Les concentrations des trois pigments (chlorophylle a, chlorophylle b et lutéine) décroissent rapidement lors des 15 premiers jours d'incubation (Fig. 2). La lutéine augmente au début de l'incubation. Ce phénomène peut être attribué à une adaptation pigmentaire de l'algue aux récentes conditions d'obscurité [18]. On observe très nettement, pour les trois pigments, une dégradation plus rapide en présence de particules du BV (R1 et R2) qu'en l'absence de particules (RC). Les produits de dégradation de la chlorophylle a (phaeophorbide, phaeophytine et pyrophaeophytine) montrent une double cinétique : ils sont produits pendant la deuxième semaine (entre 8 et 13 j), puis sont dégradés. La présence de MES favorise la production de phaeophytine a et de pyrophaeophytine a, mais ne semble pas avoir d'influence sur la phaeophorbide a.
3.2 Expérience 2
On constate une augmentation de la concentration des pigments dans le réacteur RNS entre 0 et 3 j (Fig. 3), qui affecte tous les pigments et est par conséquent attribuable plutôt à une mauvaise homogénéisation des particules lors des prélèvements d'aliquotes qu'à des phénomènes de photoadaptation. Cependant, dans le réacteur RS, on n'observe pas de décroissance de la chlorophylle a et de la lutéine, tandis qu'on enregistre une décroissance de la chlorophylle b nettement plus lente que dans le réacteur RNS. Dans le réacteur RNS, les trois pigments sont dégradés de la même manière que dans l'expérience 1. Les dénombrements totaux mènent à une teneur de 106 UFC (unités formant colonie) par litre dans les deux réacteurs, ce qui indique une contamination du réacteur RS. Cependant, l'isolation de souches bactériennes montre la présence d'un consortium dans le réacteur RNS, tandis qu'une seule souche a été isolée dans le réacteur RS. L'observation au microscope révèle qu'il s'agit d'un bacille gram négatif de type vibrio, non sporulant, provenant d'une contamination lors de la mise en culture de l'algue ou de l'incubation.
3.3 Cinétiques de dégradation
Nous avons calculé les cinétiques d'ordre 1 () de dégradation des trois pigments dans des conditions de concentrations croissantes en MES (réacteurs RC, R1, R2 et RNS), ainsi que leurs temps de demi-vie (t1/2=ln2/K1) (Tableau 2). Seule la période 0–15 j est considérée dans le calcul car, au-delà, les teneurs de certains pigments sont en dessous du seuil de détection. K1 augmente avec la turbidité (0,03 à 0,2 j−1 pour la lutéine), tandis que t1/2 diminue (23 à 3,6 pour la lutéine). Pour les trois pigments, K1 augmente fortement entre 0 et (0,04 à 0,22 j−1 pour la chlorophylle a), puis se stabilise dans l'incubation RNS à (). Quelle que soit la teneur en MES, la vitesse de dégradation de la lutéine est plus lente que celles des chlorophylles, d'environ un facteur 1,5–2.
Au cours de ces incubations, une décroissance significative du COP n'a pu être observée que pour le réacteur RC sans particules, la valeur de K1 étant (R2=0,91). En effet, dès lors qu'on mélange le matériel phytoplanctonique avec les particules du BV, la présence en grande quantité de COP détritique contenu dans le BV masque les variations du COP phytoplanctonique au cours de l'incubation.
4 Discussion
4.1 Le bouchon vaseux comme réacteur de dégradation du matériel phytoplanctonique
Ces deux expériences montrent le rôle des bactéries attachées aux particules du BV dans la dégradation du matériel phytoplanctonique. Dans la Fig. 4, les constantes K1 et les temps de demi-vie t1/2 des pigments sont présentés en fonction du rapport MES/chlorophylle a. Si l'on considère que les bactéries sont uniformément réparties sur les particules, ce rapport représente le nombre de bactéries potentiellement actives par rapport au substrat phytoplanctonique disponible. Les constantes K1 augmentent linéairement avec ce rapport, tandis que les temps de demi-vie (t1/2=ln2/K1) décroissent de manière hyperbolique, confirmant le rôle des bactéries attachées [7]. De plus, le fait que les constantes K1 augmentent avec le rapport MES/chlorophylle a sans atteindre de plateau, pour la gamme étudiée, suggère que le matériel phytoplanctonique constitue un substrat préférentiel pour la population de bactéries hétérotrophes du BV par rapport à la MO, majoritairement d'origine continentale et plus réfractaire ; en effet, lorsque ce rapport augmente, la disponibilité en substrat phytoplanctonique fortement labile diminue par rapport au nombre total de bactéries attachées ; pourtant, la vitesse de dégradation augmente. L'effet du nombre de bactéries potentiellement actives semble donc l'emporter sur l'effet du substrat disponible.
La prédominance des bactéries comme acteurs de cette dégradation est aussi confirmée par les produits de dégradation de la chlorophylle a. Dans l'expérience 1, la présence de particules du BV augmente les proportions de phaeophytine a et pyrophaeophytine a produites, mais n'influence pas la phaeophorbide a (Fig. 2). Dans l'océan, la présence de phaeophorbide a, en fortes concentrations, indique une intense activité de broutage zooplanctonique, tandis que celle des phaeophytines indique préférentiellement une activité ectoenzymatique bactérienne [14,18]. Une autre voie de formation des phæophorbides consiste en l'action des chlorophyllases des diatomées, qui produisent dans un premier temps de la chlorophyllide, stade initiateur de la phaeophorbide [24]. Dans des expériences avec des sédiments de la rivière Hudson (États-Unis), Bianchi et al. [3] ont observé une production de phaeophorbides jusqu'à 10 fois supérieure en présence d'amphipodes, aussi due à l'activation des chlorophyllases. Dans le BV utilisé pour cette expérience, nous avions une faible concentration initiale en diatomées, et peu ou pas de zooplancton. La présence de phaeophytines peut donc être rattachée à l'action majoritaire de la dégradation bactérienne. Enfin, la cinétique de disparition de la chlorophylle a étant 27 fois plus rapide dans le réacteur RNS (expérience 2) que dans le réacteur RS, c'est bien le consortium bactérien présent dans le BV qui est à l'origine de la dégradation des pigments, la souche isolée en fin d'incubation dans le réacteur RS n'étant pas efficace pour dégrader le matériel phytoplanctonique.
Le Tableau 2 et la Fig. 4 montrent aussi que les trois pigments étudiés ne se dégradent pas à la même vitesse. Dans le BV de l'estuaire de la Gironde, les particules sont maintenues en suspension dans la colonne d'eau par les courants de marée en condition oxique [1] et la lutéine est tout de même dégradée, en dépit de son caractère réfractaire dû à l'absence de groupe époxyde [5], mais moins rapidement que les chlorophylles.
4.2 Les pigments comme marqueurs de dégradation de la matière organique estuarienne
Veyssy et al. [23] ont calculé que les apports fluviaux de MOP à l'estuaire de la Gironde provenaient pour plus de 90 % des sols, dont environ la moitié était constituée de litières (débris de feuilles partiellement dégradées) lessivées par les premières crues d'automne. Le matériel phytoplanctonique représente environ 10 % des apports totaux de MOP. Dans le BV, ces différents matériels se mélangent et sont dégradés à des vitesses variables selon leur nature biochimique [9]. Modéliser les processus biogéochimiques estuariens et les niveaux d'oxygénation de l'estuaire, en réponse aux perturbations anthropiques sur les bassins versants (eutrophisation et érosion), est aujourd'hui une priorité [22]. Or, une telle démarche passe par une bonne connaissance des cinétiques de dégradation des différents pools de MOP par la population bactérienne du BV. Nous avons ici mesuré la dégradation de chlorophytes à différentes turbidités. Les cinétiques obtenues sur les pigments peuvent servir de modèle pour la totalité du matériel de la chlorophycée. Ainsi, la lutéine est-elle dégradée à la même vitesse que le COP par les bactéries libres du réacteur RC (K1=0,03). L'effet de la turbidité ne pouvant être obtenu directement sur la totalité du COP du fait de la dilution avec le COP du BV, nous le déterminons ici à partir des pigments et nous pouvons supposer qu'il est le même pour tout le matériel algal. Pour confirmer cette hypothèse, les cinétiques de dégradation d'autres matériels organiques provenant notamment de litières et d'autres souches phytoplanctoniques seront établies.
Bianchi et Findlay [2] ont déterminé les cinétiques de dégradation dans le BV de l'estuaire de l'Hudson de ces mêmes pigments, mais issues de quatre macrophytes. Ils obtiennent des constantes de dégradation d'ordre 1 (K1) comprises entre 0,02 et 0,07 j−1 pour les chlorophylles a et b et entre 0,01 et 0,04 j−1 pour la lutéine. Ces valeurs sont similaires à celles que nous obtenons dans le réacteur RC, où seules les bactéries libres sont présentes, et de 5 à 10 fois inférieures à ce que nous obtenons en présence de particules du BV (Tableau 2). Toutefois, il est fort probable que nous obtiendrions aussi des cinétiques de dégradation plus lentes pour des pigments issus de litières qui, comme pour les macrophytes, sont protégés par des tissus plus résistants à la biodégradation.



