1 Introduction
Des études récentes montrent que le transport des contaminants à travers des sols et des eaux souterraines peut être facilité par la présence de colloı̈des mobiles, qui agissent comme des transporteurs de contaminants [9,15]. Dans la nature, les surfaces de particules minérales sont souvent recouvertes de matières organiques naturelles et notamment de substances humiques. Les groupements carboxyliques et phénoliques sont les groupements fonctionnels prédominants dans les substances humiques [10]. Ces groupements sont responsables de la formation de complexes avec les ions métalliques et les surfaces chargées des particules. Il est bien connu que les substances humiques forment des complexes extrêmement stables avec certains métaux présents en trace dans l'environnement, ce qui a pour effet de diminuer la charge globale de ces substances [3,5]. En revanche, peu d'études sont consacrées à l'effet des ions métalliques sur la stabilité des colloı̈des en présence de substances humiques [11]. L'adsorption des métaux en trace à la surface colloı̈des–substances humiques peut entraı̂ner, après réduction de la charge de surface, l'agrégation puis le dépôt de la suspension dans le milieu poreux. Le transport de colloı̈des, en tant que vecteurs de contaminants, peut donc être limité par l'agrégation que peuvent induire ces métaux.
2 Matériel et méthodes
2.1 Matériels
L'argile utilisée dans ce travail, est la kaolinite des Charentes, de type GZA IV. Ses principales caractéristiques ont été identifiées par Nabzar [13]. Le point de charge nulle (PCN), déterminé à l'aide d'un titrage potentiométrique, est de 7,2 environ [1,13]. Cette valeur est supérieure à celle obtenue généralement (entre 3 et 4) pour une kaolinite pure [6,14]. Ce résultat est probablement dû aux impuretés dans la kaolinite. La surface spécifique obtenue par BET (N2) est de l'ordre de [7]. L'acide humique utilisé est un acide commercial fourni par Aldrich Chimie sous forme de humate de sodium. Quelques caractéristiques de cet acide ont été identifiées [8]. Sa précipitation commence à des pH inférieurs à 2. La présence d'acides fulviques à des concentrations ne dépassant pas 8 % a été mise en évidence. Le milieu poreux est constitué d'un sable de quartz d'origine naturelle fourni par la société Quartz d'Alsace (Kaltenhouse, Bas-Rhin, France). Il est composé de 99 % de quartz, 0,1 % d'argile (kaolinite, illite et chlorite) et de traces d'oxyhydroxydes de Fe, Mn et Al [4]. Pour des pH>2, sa charge de surface est négative [12] et sa surface spécifique est estimée à . Tous les réactifs utilisés dans cette étude sont de qualité « pour analyse » (p.a.). Les solutions sont préparées en utilisant de l'eau bidistillée, préalablement bouillie et conservée sous atmosphère d'azote.
2.2 Étude de spéciation
Un calcul de spéciation des éléments plomb et cuivre a été réalisé à l'aide du logiciel MINTEQA2/PRODEFA2 [2], dans les mêmes conditions de concentrations et de pH que celles utilisées dans l'expérimentation. Dans ce calcul, nous avons introduit, en outre, une concentration en carbonates totale égale à 10−5 M (concentration correspondant à peu près à celle du système ouvert d'une eau en équilibre avec le CO2), afin de tenir compte d'éventuelles précipitations de ces éléments, même si toutes les précautions ont été prises pour minimiser la présence de CO2 dans les solutions et au cours de l'expérimentation. Les résultats de ce calcul ont montré que le plomb est à 99,6 % sous forme de Pb2+ et à 0,4 % sous forme de PbOH+ ; le cuivre est totalement sous forme de Cu2+. Aucune précipitation de ces métaux n'a été mise en évidence par ce calcul.
2.3 Expériences en colonne
Après le remplissage de la colonne par le sable, le milieu est tiré sous vide, puis saturé par de l'eau bidistillée, préalablement dégazée. Le lavage du sable de la colonne est réalisé par l'injection en continu de cette même eau, jusqu'à l'obtention du même pH à l'entrée et à la sortie de la colonne. Le traçage est effectué par l'injection de 2 ml de traceur (KI, ) ; il est suivi par UV–visible à 234 nm. Pour l'ensemble des expériences, le volume poreux, Vp, est de 18±1 ml, la porosité cinématique est trouvée égale à 0,40±0,02. Le nombre de Péclet, Pe, reste toujours supérieur à 100. Toutes les expériences ont été réalisées à la température ambiante à pH=4 et avec un débit d'injection de .
Les expériences sur le transport/dépôt de la kaolinite en présence d'acide humique sont effectuées en injectant 2 ml (environ à pH=4. L'effluent est suivi par UV–visible à 280 nm. Toutes les expériences ont été répétées au moins deux fois. Pour plus de clarté, seuls les résultats d'une expérience sont représentés sur les figures. Pour chaque expérience, il a été vérifié que tous les points expérimentaux (en symboles sur les figures) suivent la distribution de Gauss (en trait continu), avec un coefficient de corrélation R2>0,98 et une déviation standard moyenne inférieure à 0,01. La fraction de colloı̈des recueillie dans l'effluent est déterminée par l'intégration numérique du pic de restitution en coordonnées réduites C/C0=f(V/Vp). La quantité totale de colloı̈des injectée est déterminée avec le même dispositif expérimental, mais sans colonne.
2.4 Stabilité et potentiel électrocinétique de colloı̈des
La stabilité d'une suspension constituée de de kaolinite et de d'acide humique à différentes concentrations en CaCl2, Cu(NO3)2 ou en Pb(NO3)2 a été évaluée, après un temps de repos de 20 h, par la mesure de la densité optique au moyen d'un spectrophotomètre UV–visible (Type HP 8453) à 280 nm. L'évaluation de l'influence des ions divalents sur la charge de surface de la kaolinite recouverte d'acide humique a été réalisée afin de déterminer le potentiel zêta (ζ). Les mesures ont été effectuées à l'aide de l'appareil Zetasizer 4000 (Malvern Instruments), dans les mêmes conditions que lors de l'étude de la stabilité.
3 Résultats et discussion
L'influence de la concentration en ions divalents Me2+ (Ca2+, Cu2+ et Pb2+) sur la stabilité d'une suspension de de la kaolinite et d'AH, conservée au repos pendant 20 h, est représentée sur la Fig. 1. Dans cette étude, les résultats montrent que l'évolution de la stabilité dépend à la fois de la concentration et de la nature du cation. Pour des concentrations supérieures à en Me2+, la suspension s'agrège, puis sédimente plus ou moins rapidement, suivant la nature de l'ion.
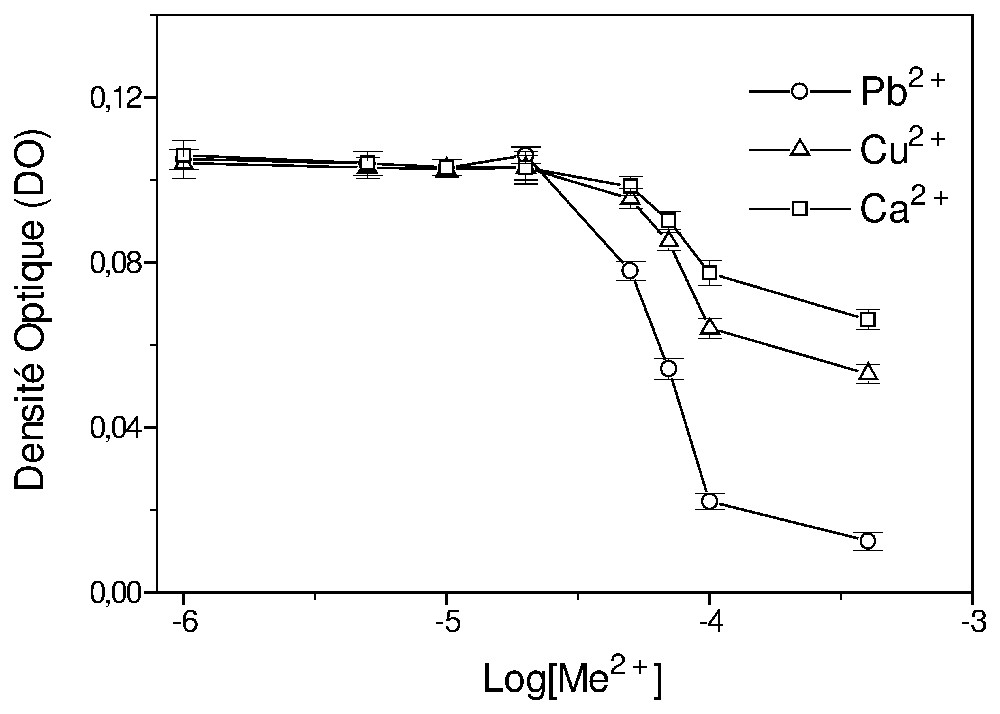
L'influence de la concentration en Ca2+, Cu2+ et Pb2+ sur la stabilité, après 20 h de repos, d'une suspension de de kaolinite et de de AH à pH=4.
Influence of Ca2+, Cu2+, and Pb2+ concentrations on the stability of suspension after 20 h. The suspensions contain kaolinite and humic acid at pH=4.
Le plomb est l'élément qui provoque la sédimentation la plus rapide, suivi du cuivre, puis du calcium. Nous supposons que Pb2+ favorise des agrégats relativement volumineux ou denses, qui sédimentent plus facilement que ceux produits par les autres éléments. Cette différence d'agrégation peut influencer le transport de colloı̈des à travers le milieu poreux.
Les valeurs du potentiel électrocinétique de la même suspension sont données dans le Tableau 1. D'une façon générale, l'augmentation de la concentration en cations divalents conduit à une diminution de la valeur négative de ζ. Cette diminution s'explique par la combinaison de deux facteurs : (i) l'augmentation de la force ionique, due à l'introduction du cation, a pour effet de réduire l'épaisseur de la double couche de diffusion et la diminution du potentiel électrique au plan de cisaillement ; (ii) l'augmentation de la concentration en ions divalents entraı̂ne, par complexation avec les groupements fonctionnels d'AH, l'accroissement du nombre de sites complexés et, par conséquent, une diminution globale de la charge négative du polyélectrolyte [3]. Pour une concentration donnée, les trois cations divalents ont presque la même influence sur la charge de surface des colloı̈des.
Influence de la concentration en Me2+ (Ca2+, Cu2+ et Pb2+) sur le potentiel zêta (ζ) de la kaolinite recouverte d'acide humique ( kaolinite, AH à pH=4).
Influence of Me2+ (Ca2+, Cu2+ and Pb2+) concentration on the zeta potential (ζ) of humic-coated kaolinite colloids ( kaolinite, AH at pH=4).
| Me2+ | Concentration | ζ |
| Ca2+ | 0 | −27,1 |
| 10−6 | −26,7 | |
| 5×10−5 | −16,7 | |
| Cu2+ | 0 | −26,9 |
| 10−6 | −26,4 | |
| 5×10−5 | −16,4 | |
| Pb2+ | 0 | −27,7 |
| 10−6 | −25,9 | |
| 5×10−5 | −16,1 |
Pour illustrer l'influence des phénomènes d'agrégation sur le transport de colloı̈des, deux études comparatives mettant en jeu les trois ions divalents (Ca2+, Cu2+ et Pb2+) ont été réalisées. La première concerne une suspension de de kaolinite et de AH, en présence de de Me2+. La seconde fait intervenir la même suspension à en Me2+. Avant l'injection des suspensions, la colonne garnie de sable naturel est préalablement saturée avec une solution de CaCl2, de même concentration que celle de Me2+ dans les suspensions. La Fig. 2 présente les pics de restitution consécutifs à l'injection–impulsion des différentes suspensions.

Courbes de restitution démontrant l'effet de l'agrégation sur le transport de colloı̈des, à travers une colonne de sable de quartz naturel, en fonction de la nature et la concentration du cation divalent Me2+ (Ca2+, Cu2+ et Pb2+) : (a) pics de restitution du traceur (KI) et des suspensions contenant kaolinite, de AH et de Me2+ à pH=4 ; (b) mêmes conditions que précédemment, la concentration en Me2+ étant de .
Breakthrough curves demonstrating the aggregation effects on the deposition of humic-coated kaolinite colloids in columns packed with natural quartz sand as a function of both nature and concentration of divalent cations Me2+ (Ca2+, Cu2+ and Pb2+): (a) breakthrough curves for a conservative solute tracer (KI), and the suspensions containing kaolinite, AH and Me2+ at pH=4; (b) same conditions than above, with as Me2+ concentrations.
Dans toutes les expériences, les colloı̈des traversent plus rapidement la colonne que le traceur.
Le volume poreux traversé par les particules colloı̈dales ne représente que 85 % du volume poreux total. Cette différence est attribuée à l'exclusion chromatographique (ou exclusion volumique). Ce phénomène est dû au fait que, en raison de leurs tailles, les particules colloı̈dales ne peuvent pas traverser les pores de dimensions plus petites. Dans ce travail, le volume d'exclusion est estimé à 15 % du volume total de pores.
À des concentrations de cations de 10−6 mol/l, les taux de dépôt de colloı̈des sont relativement faibles, seulement 47, 48 et 50 % de colloı̈des étant retenus en présence respectivement de Pb2+, Cu2+ et Ca2+. Ces taux, pratiquement identiques, sont considérés comme indépendants ; ils ne dépendent pas non plus de la nature du cation. Pour des concentrations de en ions divalents, les taux de rétention sont beaucoup plus élevés : 97, 89 et 77 % de colloı̈des déposés respectivement en présence de Pb2+, Cu2+ et Ca2+. Ces taux sont suffisamment différents pour qu'on puisse supposer qu'ils dépendent du cation divalent mis en jeu.
La différence de comportement observée en fonction de la concentration en Me2+ ne peut être interprétée uniquement en termes d'interactions électrostatiques (théorie de Derjaguin, Landau, Verwey et Overbeek (DLVO)) et/ou spécifique (présence de Ca2+ en tant qu'électrolyte de fond), mais aussi en terme d'agrégation. En effet, on avait observé (Fig. 1) qu'à des concentrations supérieures à en Me2+, les suspensions s'agrègeaient plus ou moins rapidement, suivant la nature du cation. Pour des concentrations inférieures à en Me2+, les suspensions sont stables et leur transport à travers une colonne de sable est régi principalement par les forces électrostatiques entre la charge de surface du collecteur et celle de colloı̈des et par la présence du sel de fond. Or, la charge de surface de la kaolinite en présence de AH et de de Me2+ (estimée par la mesure du potentiel zêta, Tableau 1) est pratiquement identique, quelle que soit la nature de l'ion divalent. Il en résulte que les taux de dépôt, lors de l'injection de ces suspensions dans la colonne, sont comparables et indépendants de la nature du cation. Lorsque la concentration en Me2+ dans la suspension est supérieure à , les phénomènes d'agrégation prédominent sur les interactions électrostatiques. Les taux de dépôt varient en fonction de l'importance des agrégats induits par les cations divalents. Le plomb est l'élément le plus déstabilisant, suivi du cuivre et du calcium. Il s'ensuit un taux de dépôt plus important pour Pb2+ que pour Cu2+ et Ca2+.
4 Conclusion
Ce travail, essentiellement expérimental, a permis de mettre en évidence le rôle important de l'agrégation dans le transport de colloı̈des à travers un milieu poreux. En présence de faibles concentrations en cations divalents ( dans notre cas), la suspension est stable et la mobilité des colloı̈des est favorisée. En effet, dans ces conditions, les interactions répulsives entre la surface du sable et celle de la kaolinite recouverte d'acide humique sont suffisamment importantes pour empêcher le dépôt de colloı̈des, ce qui est parfaitement conforme à la théorie de DLVO. À des concentrations plus élevées () en sel divalent, la suspension s'agrège et les taux de dépôt sont élevés. Ces taux dépendent de la nature et du pouvoir déstabilisant du cation, ce que la théorie de DLVO ne peut expliquer à elle seule.
Remerciements
Nous remercions E. Pefferkorn de nous avoir fourni gracieusement la kaolinite, C. Zarcone pour son aide, ainsi que le personnel du laboratoire de génie chimique de Toulouse, où les mesures électrophorétiques ont été réalisées. Ce travail a bénéficié du soutien du Programme thématique d'appui à la recherche scientifique (Protars n° P2T3/04).



