1 Introduction
La Corse, avec une superficie de 8 680 km2 et une densité de population de 30 habitants au km2 (pour une moyenne française de 106) est considérée comme « une montagne dans la mer », avec un relief compartimenté, qui oppose le Nord-Est et le Sud-Ouest de part et d’autre d’une ligne de crête culminant au Monte Cinto (2 710 m).
Selon le dernier recensement, la population corse s’élève à 256 000 habitants (dont 40% dans les agglomérations d’Ajaccio et de Bastia). Le maximum de sa population a été atteint vers 1891 (avec environ 280 000 personnes) et le minimum—au XXe siècle—avec environ 165 000 dans les années 1950. L’évolution de la population a été marquée depuis la IIIe République par l’exode rural et l’émigration, qui ont vidé l’intérieur (en particulier la Châtaigneraie); la population s’est progressivement urbanisée et littoralisée, comme dans d’autres régions du Midi de la France. À partir des années 1960, la situation s’est inversée, d’abord avec l’arrivée des rapatriés des anciennes colonies. La Corse ayant toujours importé sa main d’œuvre (Sardes et Toscans au XIXe siècle), les immigrés–principalement maghrébins–constituent environ 10% de la population.
La culture préhistorique de l’île montre des affinités ligures et sardes. Dans les temps historiques 〚1〛, on assiste à une suite d’invasions et d’occupations de l’île par les puissances maritimes du moment. En 565 av. J.-C., les Grecs fondèrent leurs premières colonies commerciales ; jusqu’au IVe siècle av. J.-C., les Étrusques ont dominé la moitié est de l’île ; puis ce fut le tour des Carthaginois. En 231 av. J.-C. les Romains ont créé la province Sardinia–Corsica, les deux îles n’ayant été séparées par Auguste qu’en 6 ap. J-C (et la Corsica devint alors une province à part entière). Au cours du VIIIe siècle, l’île fut envahie à plusieurs reprises par les Sarrasins d’Afrique du Nord et d’Ibérie. Placée sous une vague suzeraineté du Saint-Siège dans les premiers siècles du Moyen Âge, la Corse fut confiée en 1077 aux Pisans par le pape Grégoire VII ; ils en furent peu à peu chassés par leurs rivaux Génois, Gênes ayant mis plus d’un siècle à établir son contrôle (effectif après 1288). La longue domination génoise durera jusqu’à l’intervention française, en 1768 (traité de Versailles).
L’étude séro-anthropologique du peuplement corse a été abordée à plusieurs reprises dans le passé 〚8, 24, 29〛. La première étude synthétique sur le sujet 〚3〛 a consisté à comparer les relations gènes-langage, en utilisant huit fréquences alléliques à trois systèmes érythrocytaires (Sermet en 1974 〚36〛). Le travail de ce type le plus récent et le plus complet 〚19〛 concerne la distribution de neuf systèmes d’enzymes érythrocytaires et de sept systèmes de protéines plasmatiques, analysés pour 273 Corses non apparentés d’Ajaccio (comparée à celle d’une population de Corte 〚21〛) ; l’analyse des résultats de cette étude a démontré l’existence d’un certain degré de différenciation à l’intérieur de la Corse, qui a pu être comparé à celui existant entre la Corse et la Sardaigne (ainsi qu’avec d’autres populations du Bassin méditerranéen).
Ce n’est que très récemment 〚22〛 que l’étude des marqueurs ADN a été abordée en Corse, par comparaison des haplotypes de l’ADN mitochondrial entre 56 Corses de Corte et deux populations du Nord et du Centre de la Sardaigne. À l’époque de l’anthropologie moléculaire, basée sur les marqueurs ADN, il nous a semblé judicieux de reprendre les anciennes problématiques, et ce tout spécialement par les marqueurs ADN spécifiques à la lignée paternelle. De façon à réaliser sur les Corses une étude symétrique (par rapport à celle déjà publiée sur l’ADN mitochondrial maternel) de marqueurs ADN monoparental, nous avons utilisé des polymorphismes de restriction spécifiques du chromosome Y révélés par les sondes moléculaires p49a,f du locus DYS1 〚9〛, localisé dans la partie non recombinante de l’Y en Yq11.2 〚27〛. Le séquençage de p49a 〚11〛 a été à la base de la description du motif répété caractéristique du gène DAZ 〚30, 33〛, qui intervient lors de la spermatogenèse 〚20〛. La répartition du polymorphisme des fragments de restriction TaqI dans un groupe d’individus de sexe masculin vivant à Paris avait précédemment permis d’établir seize haplotypes Y principaux 〚23〛. Dans la présente étude, nous rapportons la répartition des principaux haplotypes Y chez un total de 328 hommes corses, natifs des régions d’Ajaccio, de Bastia et de Corte, de façon à la comparer à celles des autres marqueurs génétiques dans les mêmes régions géographiques corses. La répartition des haplotypes Y 49a, f TaqI en Corse a aussi été comparée à celles de ces mêmes haplotypes, déjà étudiés 〚25〛 en Italie et en Sardaigne.
2 Matériel et méthodes
2.1 Populations
Les prélèvements ont porté sur un total de 328 individus corses d’origine, non apparentés, adultes et de sexe masculin. Le choix de ces personnes a été basé sur leurs patronymes, leurs ascendances ayant été remontées sur au moins trois générations dans tous les cas. Un consentement éclairé a été obtenu pour chaque individu avant de procéder aux prises de sang.
La Fig. 1 précise l’origine géographique de ces 328 individus. Le groupe A (Ajaccio), représentatif du Sud-Ouest, est constitué de 111 habitants de cette ville. Le groupe B (Bastia), représentatif du Nord-Est, est composé de 128 habitants de cette ville et des alentours. Le groupe C (Corte), de la région montagneuse du Centre, comporte un total de 89 natifs de Corte et des cinq villages de cette région (les effectifs dans chaque village étant reportés sur la carte).
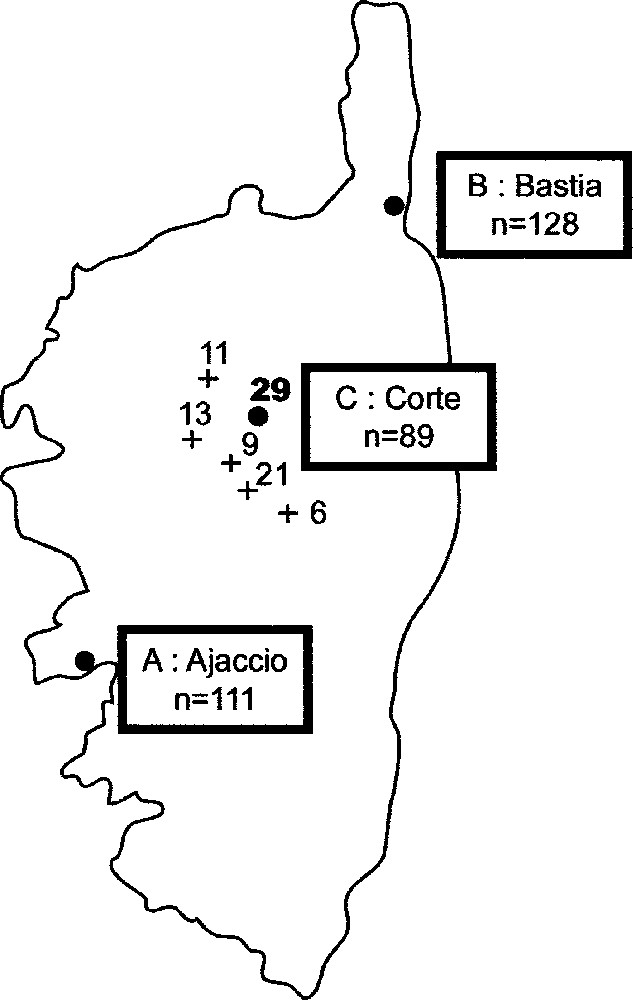
Carte de la Corse, donnant les effectifs étudiés pour Ajaccio, Bastia, Corte et cinq villages de cette troisième région.
2.2 Méthodes moléculaires
L’ADN génomique a été obtenu à partir du sang veineux, après digestion à la protéinase K et extractions protéiques au phénol–chloroforme 〚5〛.
De l’ordre de 10 μg d’ADN génomique par échantillon ont été digérés par l’enzyme de restriction TaqI ; les fragments obtenus ont été séparés par électrophorèse sur gel d’agarose à 1,5%. L’ADN digéré a été ensuite transféré sur des membranes de nylon Hybond N+ par la méthode de Southern 〚37〛. Puis les filtres ont été préhybridés pendant 2 h dans une solution 5 × Denhardt, 50 mM Tris-HCl (pH = 7,5), 1 M NaCl, SDS à 1% et 10% d’ADN de sperme de saumon soniqué et dénaturé. Les sondes employées successivement sont le fragment EcoRI de 2,8 kb du plasmide p49f, et le fragment XbaI-BamHI de 0,9 kb de p49a, tous deux oligomarqués au 32P-dCTP 〚4〛 et utilisés à une concentration de 106 cpm ml–1. Les filtres sont ensuite hybridés à 65 °C pendant une nuit, puis lavés deux fois (30 min), tout d’abord dans 2 × SSC à la température de la pièce, et ensuite dans une solution 2 × SSC et 1% SDS à 65 °C. Après une semaine d’exposition à –80 °C, les fragments TaqI correspondants à chaque échantillon sont enfin visualisés par autoradiographie sur films Kodak XAR, en présence de deux écrans intensificateurs Dupont Cronex.
2.3 Détection des génotypes et des haplotypes
La sonde p49f permet d’identifier 18 fragments TaqI (nommés alphabétiquement de A à R selon leur ordre de taille décroissante) et, à l’exception des bandes K et L (qui sont présentes à partir de l’ADN féminin et correspondent donc à des séquences autosomiques), tous les autres fragments sont mâle-spécifiques. Les fragments A, C (7,8 kb), D, F (4,3 kb) et I (2,8 kb) peuvent être présents, ou absents (variants A0, C0, D0 F0 et I0) ; les fragments A (variants A1, A2, A3 et A4) et D (variants D1 et D2) peuvent être de tailles variables, selon les individus 〚23〛.
Seize haplotypes principaux (numérotés de I à XVI), résultant de la combinatoire entre les variants A, C, D, F et I 〚7〛, ont été initialement décrits dans la population parisienne 〚23〛 ; la répartition des fréquences de ces haplotypes avait été étudiée par la suite dans huit populations différentes de l’Ouest de l’Europe continentale 〚16〛.
3 Résultats
Nous rapportons l’ensemble des résultats obtenus pour les seize haplotypes Y en Corse et, pour les six haplotypes les plus fréquents, leurs fréquences dans les trois régions.
Le Tableau 1 donne la fréquence des seize haplotypes pour l’ensemble des 328 Corses étudiés. L’haplotype XV (A3 C1 D2 F1 I1) est le plus fréquent en Corse, représentant 24,1% de l’effectif total. Les cinq autres haplotypes dont la fréquence est supérieure à 5% en Corse sont, par ordre d’importance décroissante : l’haplotype XII (A3 C0 D1 F1 I0) à 17,4%, l’haplotype V (A2 C0 D0 F1 I1) à 13,4%, l’haplotype VIII (A2 C0 D1 F1 I1) à 12,5%, l’haplotype VII (A2 C0 D1 F1 I0) à 8,2%, et l’haplotype XI (A3 C0 D0 F1 I1) à 6,7%.
Fréquences des seize haplotypes Y observés en Corse, sur un total de 328 hommes.
| Haplotypes | Génotypes | Nombres | % | ||||
| I | A 0 | C 0 | D 0 | F 1 | I 1 | 1 | 0,3 |
| II | A 0 | C 0 | D 1 | F 1 | I 1 | 4 | 1,2 |
| III | A 1 | C 0 | D 0 | F 1 | I 0 | 7 | 2,1 |
| IV | A 1 | C 0 | D 0 | F 1 | I 1 | 11 | 3,4 |
| V | A 2 | C 0 | D 0 | F 1 | I 1 | 44 | 13,4 |
| VI | A 2 | C 0 | D 1 | F 0 | I 1 | 3 | 0,9 |
| VII | A 2 | C 0 | D 1 | F 1 | I 0 | 27 | 8,2 |
| VIII | A 2 | C 0 | D 1 | F 1 | I 1 | 41 | 12,5 |
| IX | A 2 | C 1 | D 0 | F 1 | I 1 | 3 | 0,9 |
| X | A 3 | C 0 | D 0 | F 1 | I 0 | 7 | 2,1 |
| XI | A 3 | C 0 | D 0 | F 1 | I 1 | 22 | 6,7 |
| XII | A 3 | C 0 | D 1 | F 1 | I 0 | 57 | 17,4 |
| XIII | A 3 | C 0 | D 1 | F 1 | I 1 | 2 | 0,6 |
| XIV | A 3 | C 1 | D 1 | F 1 | I 1 | 7 | 2,2 |
| XV | A 3 | C 1 | D 2 | F 1 | I 1 | 79 | 24,1 |
| XVI | A 4 | C 0 | D 1 | F 1 | I 0 | 13 | 3,9 |
Le Tableau 2 donne la fréquence des six haplotypes les plus fréquents dans les trois régions d’Ajaccio (sur 111 Corses), de Bastia (sur 128 Corses) et de Corte (sur 89 Corses). Le test global d’hétérogénéité donne pour ces six haplotypes dans les trois régions un χ2 = 76,37 très supérieur au χ2 de 18,31, pour α = 5% et pour un nombre de degrés de liberté = 10 ; les trois populations sont donc génétiquement très significativement hétérogènes pour les six haplotypes considérés.
Fréquences des six haplotypes Y les plus fréquents dans les trois régions.
| Régions | |||||
| Haplotypes | A : Ajaccio n = 111 | B : Bastia n = 128 | C : Corte n = 89 | χ 2 | Significativité |
| XV | 21 = 18,9% | 44 = 34,4% | 13 = 14,6% | 13,51 | p < 0,01 |
| XII | 9 = 8,1% | 12 = 9,4% | 36 = 40,4% | 45,35 | p < 0,001 |
| V | 29 = 26,1% | 4 = 3,1% | 11 = 12,4% | 27,20 | p < 0,001 |
| VIII | 15 = 13,5% | 16 = 12,5% | 10 = 11,2% | 0,23 | n.s. |
| VII | 11 = 9,9% | 11 = 8,6% | 5 = 5,6% | 1,24 | n.s. |
| XI | 5 = 4,5% | 13 = 10,2% | 4 = 4,5% | 3,99 | n.s. |
L’haplotype XII est réparti de façon significativement différentielle (χ2 = 45,35 >> 5,99, p < 0,001) selon les trois régions, avec une valeur plus élevée pour la région de Corte. L’haplotype V est aussi réparti de façon significativement différentielle selon la région (χ2 = 27,20, p < 0,001), avec une valeur plus élevée pour la région d’Ajaccio. L’haplotype XV est également réparti de façon significativement différentielle selon la région (χ2 = 13,51, p < 0,01), mais prend sa valeur la plus élevée pour la région de Bastia. Les trois autres haplotypes les plus fréquents (XI, VII et VIII) sont uniformément répartis dans les trois régions.
4 Discussion
Après sa découverte initiale, le polymorphisme p49a,f TaqI et ses haplotypes associés ont été utilisés en anthropologie moléculaire par nous-mêmes 〚2, 6, 10〛, ainsi que par d’autres équipes de recherche (voir la référence 〚26〛 pour une synthèse de ces travaux jusqu’à la fin de 1995). Nous rapportons ici l’utilisation de ces fréquences d’haplotypes Y-spécifiques à la compréhension de l’histoire et de la géographie du peuplement corse. De façon à permettre les comparaisons entre les populations, le Tableau 3 résume les caractéristiques de répartition géographique de sept haplotypes informatifs étudiés, basées sur l’examen exhaustif de l’ensemble de la littérature publiée sur le sujet.
Répartitions géographiques principales des sept haplotypes Y étudiés, d’après les données de l’ensemble de la littérature déjà publiée.
| Haplotypes | Répartitions géographiques prépondérantes | Références principales |
| IV | Afrique subsaharienne | 〚14〛 |
| V | Afrique du Nord | 〚18〛 |
| VIII | Juifs sépharades | 〚15〛 |
| VII | Méditerranée et Moyen-Orient | 〚13〛 |
| XV | Europe de l’Ouest | 〚17〛 |
| XI | Europe centrale | 〚35〛 |
| XII | Sardaigne | 〚25〛 |
Ainsi, l’haplotype IV (A1 C0 D0 F1 I1) est caractéristique des populations subsahariennes 〚14, 38, 39〛. En Afrique centrale, à titre d’exemple 〚14〛, la fréquence de l’haplotype IV est de 55,2% au Cameroun et atteint 80,3% au Zaïre, et jusqu’à 83,9% en République centrafricaine ; il s’agit donc de l’haplotype Y majoritaire en Afrique, où sa répartition géographique est indicatrice de l’expansion Bantoue. En Corse (Tableau 1) l’haplotype IV est rare (3,4%), ce qui témoigne du faible apport correspondant dû aux hommes d’origine africaine du Sud du Sahara.
Nous venons de montrer, par ailleurs 〚18〛, que l’haplotype V (A2 C0 D0 F1 I1), le troisième haplotype par ordre d’importance en Corse (13,4%), est caractéristique des populations arabes et berbères d’Afrique du Nord : alors qu’il n’est que faiblement représenté en Afrique subsaharienne et en Europe, la fréquence de l’haplotype V est de 53,4% en Tunisie, de 56,7% en Algérie, de 57,86 au Maroc, pour atteindre 68,9% chez les Berbères marocains (où il est très largement majoritaire). Dans le cadre de la présente étude il est intéressant de constater (Tableau 2) que cet haplotype est statistiquement mieux représenté en Corse du Sud, ce qui y traduit les apports arabes et berbères, surtout dans cette partie de l’île.
L’haplotype VIII (A2 C0 D1 F1 I1), quant à lui, est caractéristique des populations Sémites originaires du Proche-Orient 〚12, 13, 15, 31, 32〛 : par exemple, la fréquence de l’haplotype VIII et de 26,2% chez les Juifs ashkénazes 〚13〛, où il représente l’haplotype majoritaire, et de 77,5% chez les Juifs de Djerba 〚15〛, pour atteindre 85,1% chez les Juifs orientaux. Cet haplotype particulier, le quatrième (12,5%) par ordre d’importance en Corse, semble répandu uniformément sur toute l’île. Il en est de même pour l’haplotype VII (A2 C0 D1 F1 I0), représenté en Corse à 8,2% sur l’ensemble de l’île. Bien qu’ayant une distribution géographique générale assez voisine de celle du VIII, qu’il accompagne souvent à titre d’haplotype secondaire, l’haplotype VII s’en distingue par une prépondérance accrue en Orient, au nord de la Méditerranée et en Europe de l’Est 〚12, 13, 32〛.
L’haplotype XV (A3 C1 D2 F1 I1) est l’haplotype majoritaire en Corse (24,1%). C’est également l’haplotype le plus répandu en Europe de l’Ouest 〚16〛, où sa fréquence décroît d’ouest en est 〚17, 28, 34〛 : il atteint sa valeur maximale (72,2 %) chez les Basques 〚17〛, et sa fréquence est de 41,5% en Belgique, de 38,8% à Paris, de 34,1% à Grasse et de 29,6% dans le Sud de l’Espagne. En Corse, sa répartition est statistiquement augmentée dans le Nord de l’île (Tableau 2) et est évidemment à mettre en parallèle avec celle—de même ordre—en Italie continentale 〚17, 25, 39〛. Il semble remarquable que cette proximité géographique s’accompagne d’une histoire du peuplement du Nord de l’île par Pise et Gênes, dont l’élévation de la fréquence de l’haplotype XV en est vraisemblablement le témoin.
Pour ce qui concerne l’haplotype XI (A3 C0 D0 F1 I1), présent à 6,7% en Corse, il est majoritaire en Europe de l’Est 〚13, 32〛, où sa répartition est grandement symétrique par rapport à celle du XV 〚35〛, qu’il remplace d’est en ouest.
L’haplotype XII (A3 C0 D1 F1 I0), le second par ordre d’importance en Corse après le XV (17,4%), est statistiquement prépondérant dans le Centre de l’île (Tableau 2). Or, il n’a été répertorié de façon importante jusqu’ici en Europe que dans le Nord et le Centre de la Sardaigne 〚25〛. L’haplotype XII est aussi le troisième par ordre d’importance en Afrique du Nord 〚18〛 et est en particulier présent à 26% en Tunisie.
5 Conclusion
En conclusion, l’étude de la répartition des haplotypes du chromosome Y en Corse est indicatrice de la géographie et de l’histoire de cette île, car elle permet de contraster le Nord de l’île—où l’apport italien a été prépondérant (haplotype XV)—avec le Sud—dans lequel les influences arabes (haplotype V) sont les plus marquées. Dans le Centre montagneux de l’île, l’haplotype XII, très largement majoritaire, témoigne d’un substrat historique, probablement plus ancien, qui est partagé avec la Sardaigne.
Remerciements
Les extractions d’ADN génomique, qui ont été effectuées à l’occasion d’un programme de recherche débuté depuis plus de quinze ans, ont été réalisées successivement par S. Berriche, F. David, P. Guérin, A. Aouizérate et C. Bathelier. P. Guérin, F. David et N. Gérard ont procédé aux génotypages des polymorphismes Y par la technique d’hybridation moléculaire.
Abridged version
We report the results obtained for the sixteen main European haplotypes of the Y chromosome in a sample of 328 adult males of unrelated origin living in the French island Corsica.
These haplotypes were deduced from TaqI restriction polymorphisms using p49a,f probes, by the classical Southern blot procedure.
The Corsican males comprises unrelated individuals, divided in three groups: group A (Ajaccio), representing the Southwest of the island, is made up of 111 inhabitants of this city; group B (Bastia), representing the Northeast, consists of 128 inhabitants of the surroundings of this city; group C (Corte), of the central mountainous region of Corsica, includes a total of 89 natives of Corte and five villages of that region.
Haplotype XV (A3 C1 D2 F1 I1) is the most frequent in Corsica, representing 24.1% of the total number. The five other haplotypes whose frequency is superior to 5% in Corsica are, in order of decreasing importance: haplotype XII (A3 C0 D1 F1 I0) with 17.4%, haplotype V (A2 C0 D0 F1 I1) with 13.4%, haplotype VIII (A2 C0 D1 F1 I1) with 12.5%, haplotype VII (A2 C0 D1 F1 I0) with 8.2%, and haplotype XI (A3 C0 D0 F1 I1) with 6.7%.
The global test of heterogeneity shows for the most common haplotypes in the three regions in Corsica a χ2 value of 76.37, much higher than 18.31 (for α = 5% and d. f. = 10); thus the three populations are significantly heterogeneous for the haplotypes studied.
Haplotype XII is differentially distributed among the three regions (χ2 = 43.35, p < 0.001), with a more elevated value for the Corte region. Haplotype V is also differentially distributed from region to region (χ2 = 27.20, p < 0.01), but with a more elevated value for the Ajaccio region. Haplotype XV is again differentially distributed (χ2 = 13.51, p < 0.01), but in this case with a more elevated value for the Bastia region.
Haplotype XV is also the most widespread haplotype in Western Europe, where its frequency decreases from west to east. In Corsica its distribution increases significantly in the North of the island, and it is obviously to be placed parallel in continental Italy. This geographical proximity goes along with the history of the population development of the North of the island by Pisa and Genoa, of which the high frequency of haplotype is a probable evidence.
Haplotype V is characteristic of Arab and Berber populations of North Africa. As this haplotype is statistically better represented in southern Corsica, this indicates the importance of the corresponding Arab and Berber contributions, especially in the South of the island.
Haplotype XII, the second in order of importance in Corsica after the XV, is significantly preponderant in the centre of the island. In fact, until now in Europe, this haplotype had been significantly recorded only in the north and the centre of Sardinia. Haplotype XII is also the third in importance in North Africa, and is particularly represented (26%) in Tunisia.
The study of the distribution of the Y chromosome haplotypes in Corsica is an indication of its geography and history. Of its geography, because in the mountainous centre of the island, haplotype XII bears witness of an ancient substratum shared with Sardinia (and probably much earlier, because haplotype XII is also of importance in Tunisia).
Of its history also, because the North of Corsica (where haplotype XV is the most common) has been the place of a larger Italian continental immigration, whereas the South (where haplotype V is significantly more represented) has been more concerned by North-African contributions.



