1 Introduction
La biologie de la reproduction, chez les Isopodes terrestres, a fait l’objet de plusieurs travaux, qui ont mis en évidence, soit une période de reproduction suivie d’un repos sexuel, soit une reproduction continue tout au long de l’année. Le premier cas caractérise plusieurs espèces, telles que Porcellio dilatatus Brandt, 1833 〚1〛, Porcellio laevis Latreille, 1804 〚2〛, Armadillidium vulgare (Latreille, 1804) 〚3, 4〛 ; Armadillo officinalis Duméril, 1816 〚5〛, Porcellio ficulneus Verhoeff 〚6〛, alors que la reproduction continue a été mentionnée chez les deux populations, togolaise et française de Porcellionides pruinosus (Brandt, 1833) 〚7〛. D’autres travaux, limités à Ligia oceanica Linné 1767 〚8〛 et Porcellionides pruinosus 〚9〛, ont porté sur la dynamique de population, dans le but d’identifier les cohortes, d’estimer la croissance et l’âge à la maturité sexuelle.
En Tunisie, les Isopodes terrestres sont peu étudiés ; les quelques travaux publiés récemment sur la biologie de la reproduction ont porté sur Hemilepistus reaumuri (Audouin et Savigny, 1826) 〚10〛, Porcellio variabilis Lucas, 1846 〚11〛 et Porcellionides pruinosus 〚12〛. L’étude du cycle biologique chez cette dernière espèce a mis en évidence l’existence d’une variabilité intraspécifique dans le comportement reproducteur 〚12〛, signalée également chez Armadillidium vulgare 〚4〛. Pour fournir plus d’informations sur la biologie et la dynamique d’une population tunisienne de Porcellionides sexfasciatus (Budde–Lund, 1879), qui a fait l’objet que d’une étude morphologique 〚13〛, nous envisageons d’étudier le cycle biologique de cette espèce, afin de déterminer les périodes de reproduction et de repos sexuel, de les comparer avec d’autres populations de la même espèce ainsi qu’avec d’autres Oniscidea déjà étudiés, d’analyser les fréquences de taille pour identifier les cohortes, d’estimer l’âge à la maturité sexuelle et de déterminer la longévité, la fécondité et la fertilité ainsi que le sex ratio.
2 Matériels et méthodes
2.1 Station de récolte et d’échantillonnage
Notre échantillonnage consiste en des prélèvements mensuels effectués, soit à la main, soit à l’aide de pinces molles, de spécimens de P. sexfasciatus rencontrés dans les composts et sous les pierres au niveau de la station de Garat Nâam située dans le gouvernorat de Kasserine (Fig. 1) à 38°91’N et 6°82’E et à une altitude de 866 m. Cette station appartient à l’étage bioclimatique aride supérieur à hiver froid, qui se caractérise par de grandes variations des températures journalières et annuelles ainsi que de la pluviométrie, avec une moyenne annuelle de 150 à 500 mm.
Localisation de la station d’échantillonnage.
2.2 Analyse au laboratoire
Au laboratoire, les animaux, ramenés vivants, sont fixés dans l’alcool à 70%, puis triés sous la loupe binoculaire, et séparés sur la base de certains critères, la taille, les caractères sexuels secondaires, tels que l’apophyse génitale et le stylet copulateur chez les mâles et le marsupium chez les femelles. Nous avons ainsi identifié les catégories suivantes :
- • les indifférenciés, dont la taille est inférieure à 3 mm, appartiennent aux deux espèces sympatriques de Porcellionides ; ces individus sont maintenus vivants entre une ou deux semaines au laboratoire jusqu’à l’apparition de la pigmentation, puis séparés en fonction de leur appartenance à l’une des deux espèces, sexfasciatus et pruinosus ;
- •
les mâles, répartis en deux sous-groupes :
- ◦ les mâles jeunes munis d’une apophyse génitale et d’un stylet copulateur ;
- ◦ les mâles adultes dont la taille est supérieure à 4,8 mm ; cette valeur correspond à la taille de la plus petite femelle reproductrice rencontrée ; elle est considérée comme étant la taille de maturité sexuelle des mâles ;
- •
les femelles, également séparées en deux sous-groupes :
- ◦ les femelles non reproductrices, dépourvues de marsupium, peuvent être, soit jeunes (leur taille n’excède pas 4,8 mm), soit adultes, mais ayant perdu leur poche incubatrice ou marsupium ;
- ◦ les femelles reproductrices munies d’un marsupium sont subdivisées en trois catégories (femelles à marsupium rempli d’œufs, femelles à marsupium rempli d’embryons et femelles à marsupium vide).
La taille des animaux est mesurée à 0,1 mm sous la loupe binoculaire entre le bord frontal de la tête et l’extrémité postérieure du pléotelson. L’estimation de la fécondité et de la fertilité, basée sur le dénombrement des œufs ou des embryons du marsupium, se fait sous la loupe binoculaire après avoir vidé délicatement le marsupium dans une boîte de Pétri contenant de l’alcool à 70%.
2.3 Élevage
Des femelles ovigères, au nombre de 43, ont été élevées et suivies au laboratoire dans le but :
- • de vérifier la nature des mues après la libération des pullis ;
- • de vérifier également si elles sont capables d’effectuer une nouvelle ponte sans se ré-accoupler, mais en stockant les spermatozoïdes,
- • de dénombrer et de sexer les descendants une fois la maturité sexuelle atteinte pour s’assurer que ces femelles sont amphogènes.
2.4 Analyses statistiques
Pour étudier la structure de la population, les animaux sont regroupés en 86 classes de 0,1 mm, variant de 3,00 à 11,80 mm. Les méthodes employées dans la détermination des sous-populations et des cohortes ainsi que leurs caractéristiques (mode, écart type et pourcentage), sont celles de 〚14–16〛. La fiabilité de ces méthodes est testée par les tests de Khi-Deux (χ2) et G (P ≥ 0,05), en utilisant les méthodes proposées dans les références 〚17, 18〛. Les distributions des classes de taille sont obtenues par l’utilisation du logiciel Anamod de 〚19〛.
Les droites de régression, relatives à la fécondité et à la fertilité, ont été comparées par l’utilisation des tests de comparaison des pentes (Tpe) et celui des positions (Tpo) par l’application du logiciel Excel, version 2000.
Le sex ratio, correspondant à l’effectif des mâles sur celui des femelles, a été testé au moyen du test χ2, qui permet de comparer la distribution expérimentale obtenue à la distribution théorique.
3 Résultats
3.1 Évolution des différentes catégories
Le suivi du cycle biologique de P. sexfasciatus nous a permis de distinguer six catégories : les indifférenciés, les mâles jeunes et adultes, les femelles jeunes immatures, les femelles matures pubères, aussi bien reproductrices que non reproductrices. La fréquence relative mensuelle de chacune de ces catégories est consignée dans le Tableau 1.
Répartition des différents groupes de Porcellionides sexfasciatus par échantillon mensuel. Nt, nombre total des animaux récoltés ; Ni, effectif des indifférenciés ; N♂j, effectif des mâles jeunes ; N♂a, effectif des mâles adultes ; N♀j, effectif des femelles jeunes ; N♀mno, effectif des femelles matures non ovigères ; Nfo, effectif des femelles ovigères.
| Mois | N t | N i | N ♂j | N ♂a | N ♀j | N ♀mno | N ♀o | sex ratio |
| Juillet 1996 | 86 | 23 | 9 | 20 | 15 | 4 | 15 | 0,85 |
| Août 1996 | 103 | 20 | 13 | 25 | 21 | 12 | 12 | 0,84 |
| Septembre 1996 | 76 | 17 | 11 | 14 | 13 | 8 | 13 | 0,96 |
| Octobre 1996 | 79 | 14 | 9 | 20 | 17 | 12 | 7 | 0,80 |
| Novembre 1996 | 61 | 0 | 4 | 20 | 16 | 21 | 0 | 0,64 |
| Décembre 1996 | 76 | 0 | 8 | 28 | 16 | 24 | 0 | 0,89 |
| Janvier 1997 | 75 | 0 | 10 | 24 | 17 | 24 | 0 | 0,82 |
| Février 1997 | 76 | 0 | 3 | 34 | 9 | 30 | 0 | 0,94 |
| Mars 1997 | 78 | 0 | 0 | 38 | 4 | 14 | 22 | 0,94 |
| Avril 1997 | 100 | 30 | 4 | 25 | 5 | 18 | 18 | 0,70 |
| Mai 1997 | 96 | 17 | 11 | 25 | 14 | 13 | 16 | 0,83 |
| Juin 1997 | 96 | 20 | 13 | 24 | 14 | 12 | 13 | 0,90 |
| Juillet 1997 | 104 | 22 | 12 | 23 | 32 | 0 | 15 | 0,73 |
| Août 1997 | 94 | 17 | 7 | 23 | 18 | 10 | 19 | 0,64 |
| Septembre 1997 | 106 | 20 | 5 | 29 | 12 | 25 | 15 | 0,65 |
| Octobre 1997 | 99 | 18 | 7 | 30 | 11 | 33 | 0 | 0,84 |
| Novembre 1997 | 106 | 10 | 11 | 32 | 28 | 25 | 0 | 0,80 |
| Décembre 1997 | 69 | 0 | 1 | 26 | 22 | 20 | 0 | 0,64 |
| Janvier 1998 | 85 | 0 | 5 | 35 | 14 | 31 | 0 | 0,88 |
| Février 1998 | 85 | 0 | 8 | 32 | 25 | 20 | 0 | 0,88 |
| Mars 1998 | 93 | 0 | 1 | 42 | 8 | 0 | 42 | 0,85 |
| Avril 1998 | 139 | 40 | 0 | 35 | 21 | 3 | 40 | 0,54* |
| Mai 1998 | 115 | 30 | 8 | 24 | 20 | 9 | 24 | 0,60* |
| Juin 1998 | 92 | 20 | 13 | 17 | 11 | 17 | 14 | 0,71 |
* Différences significatives au seuil 5%.
3.1.1 Évolution des indifférenciés
Les indifférenciés constituent un ensemble hétérogène, car ils groupent les individus des deux espèces sympatriques, P. sexfasciatus et P. pruinosus. Cependant, la pigmentation caractéristique de P. sexfasciatus à six bandes blanches au niveau du péréion et à trois au niveau du pléon, visible au bout d’une semaine de leur expulsion de la poche marsupiale, permet de séparer les indifférenciés de P. sexfasciatus de ceux de P. pruinosus.
Les indifférenciés (Fig. 2), apparaissent dans la population à partir de mois d’avril et persistent jusqu’au mois de novembre avec des effectifs élevés oscillant entre 28,77% et 30%. La courbe d’évolution des indifférenciés présente trois pics principaux : un premier observé en juillet 1996 (26,74%), un deuxième, plus important, noté en avril 1997 (30%) et un troisième s’étalant sur les deux mois d’avril et mai 1998 (respectivement 28,77% et 26,08%). Les indifférenciés sont absents à partir de novembre et ne réapparaissent que cinq mois plus tard.

Évolution des différentes catégories de Porcellionides sexfasciatus.
Un parallélisme est observé entre les courbes des indifférenciés et des femelles reproductrices, avec un décalage d’un mois (Fig. 2).
3.1.2 Évolution des femelles
Les femelles jeunes non pubères, dont la taille est inférieure à 4,8 mm, sont toujours présentes dans la population, avec des effectifs variables de 5 à 31,88%. Les plus faibles effectifs (5, 5,12 et 8,61%) sont observés généralement au début de la période de reproduction, alors que les taux les plus importants (28,84, 31,88 et 29,41%), sont présents respectivement en juillet et en décembre 1997 ainsi qu’en février 1998 (Fig. 2). Cette variation est due, soit à l’évolution des indifférenciés en jeunes femelles, soit à l’acquisition de la maturité sexuelle chez les prépubères.
Les femelles ovigères, à marsupium remplis d’œufs de couleur brune ou jaune-verdâtre ou d’embryons associés à quelques œufs bruns dont le nombre ne dépasse guère quatre, apparaissent dans la population à partir du mois de mars et persistent jusqu’en septembre/octobre.
L’analyse de la courbe de ces femelles (Fig. 2) montre que, pendant cette période et au cours des deux années, le pic le plus important s’observe en mars (28,2%), avec une valeur nettement plus élevée au cours de la seconde année (45,16%). Deux autres pics, plus réduits, ont été enregistrés en août 1997 (21,27%) et en avril 1998 (28,77%).
Ainsi, le cycle reproducteur de P. sexfasciatus de Garat Nâam est caractérisé par deux phases distinctes, une phase de reproduction, qui débute au mois de mars et se termine en octobre, et une phase de repos sexuel, qui s’étale de novembre à février.
Les résultats obtenus, lors d’un suivi de 43 femelles ovigères au laboratoire, montrent que celles-ci sont capables d’effectuer une seconde ponte sans nouvel accouplement. Cependant, nous avons relevé que la majorité des femelles effectuent des mues normales au nombre d’une ou de deux avant la mue parturielle suivante (Tableau 2), ce qui permet d’estimer :
Nombre et nature des mues effectuées par les femelles en élevage.
| Effectif ♀ | 5 | 20 | 11 | 3 | 4 |
| Pourcentages | 11,62 | 46,9% | 24,39% | 7,33% | 9,75% |
| Nombre et nature des mues | 1M.P | 1M.N + 1M.P | 2M.N + 1M.P | 1 ou 2 M.N | ♀ mortes |
| IPP | 14,78 ± 3,45 (35 ♀) | IP | 30,92 ± 6,37 (17 ♀) |
- • les intermues préparturielles et parturielles, évaluées respectivement à 14,78 ± 3,45 et 30,92 ± 6,37 j ;
- • le nombre de pontes effectuées par une femelle pendant la période de reproduction, égal à deux ou trois, soit environ une ponte tous les deux mois et demi à trois mois ;
- • le nombre de descendants mâles et femelles correspondant pour l’amphogénie ;
- • le sex ratio total qui semble légèrement biaisé en faveur des femelles.
3.1.3 Évolution des mâles
Les mâles sont répartis en deux groupes, jeunes et adultes ; leurs fréquences présentent des fluctuations importantes dues, d’une part, à l’évolution des indifférenciés en mâles jeunes et, d’autre part, à la disparition des mâles âgés.
Les effectifs des mâles jeunes sont faibles par rapport à l’ensemble de la population. Ils oscillent entre 0 et 14,13%. Le graphique de la Fig. 2 présente trois légers pics :
- • un premier, étalé sur deux mois, août et septembre 1996, avec des valeurs respectives de 12,62% et 13,15%, correspondant à la différenciation des indifférenciés recrutés aux mois de mai, juin et juillet précédents ;
- • un deuxième pic en janvier 1997 (13,34%), dû à l’évolution des indifférenciés nés en août, septembre et octobre ;
- • un troisième pic, légèrement plus important que les précédents, observé en juin 1998 (14,13%).
Les mâles adultes sont toujours présents dans la population. Sur la Fig. 2, on note la présence d’un pic principal, aux mois de février–mars 1997 (44,73 et 48,71%), dû à l’acquisition de la maturité sexuelle des mâles jeunes de décembre–janvier. Un deuxième pic, plus faible que le premier, étalé sur quatre mois de décembre à mars, est lié à l’acquisition tardive de la maturité sexuelle des indifférenciées et des mâles jeunes de la période automnale. La décroissance du taux des mâles adultes, après le mois de mars, s’expliquerait par la disparition des mâles âgés ayant contribué à la reproduction.
3.2 Identification des cohortes et longévité
Les distributions des fréquences de taille sont analysées pour identifier les cohortes et suivre leur évolution pendant la période d’échantillonnage (Fig. 3).


a. Répartition des classes de taille et identification des cohortes durant la première année (juillet 1996–juin 1997). b. Répartition des classes de taille et identification des cohortes au cours de la deuxième année (juillet 1997–juin 1998).
L’application du logiciel software Anamod 〚19〛 a permis de mettre en évidence la présence de six cohortes (C1, C2, C3, C4, C5 et C6) dans le premier échantillon de juillet 1996. D’autres nouvelles cohortes sont apparues en octobre 1996 (C7), en avril 1997 (C8), en mai 1997 (C9), en juin 1997 (C10), en septembre 1997 (C11), en avril 1998 (C12), en mai 1998 (C13) et en juin 1998 (C14). La taille minimale moyenne des nouvelles cohortes varie de 3,07 ± 0,35 mm à 3,47 ± 0,2 mm. La taille maximale moyenne est de 10,42 mm. La plus grande femelle observée a une taille de 11,33 mm et la plus petite est de 3,03 mm, tandis que le plus grand mâle fait 11,21 mm et le plus petit 3,05 mm.
De juillet 1996 à juin 1998, on a pu suivre l’évolution de trois cohortes, C6, C7 et C8, depuis leur naissance jusqu’à leur disparition. La longévité est estimée entre 13 et 16 mois. Les cohortes C6 et C7, nées à la fin de la période de reproduction, vivent plus longtemps (15 et 16 mois) que la cohorte C8, née au début de cette période et qui ne vit que 13 mois (Fig. 4). Les cohortes C6 et C7 atteignent la maturité sexuelle de cinq à six mois après leur expulsion du marsupium, alors que certains individus de la cohorte printanière (C8) deviennent matures au bout de trois mois et arrivent à se reproduire la même année et durant l’année suivante. Les cohortes, estivale et automnale, ne se reproduisent que l’année suivante.
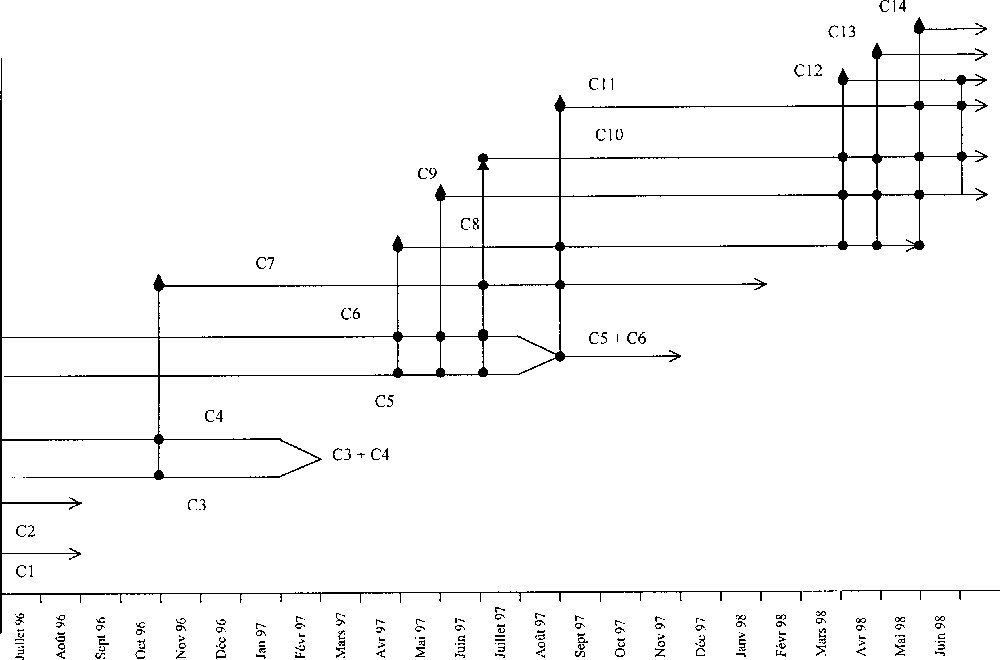
Estimation du cycle de vie de Porcellionides sexfasciatus.
3.3 Cycle de vie
Les divers échantillons ont été analysés à partir de leurs caractéristiques, moyennes, écart type, pourcentage et des informations obtenues quant à la biologie de l’espèce. Cette analyse a permis de déterminer la contribution des femelles ovigères dans le recrutement des nouvelles générations (Fig. 4). Il en résulte que C7 est issue des femelles ovigères des cohortes C3 et C4 et que la cohorte C8 apparaît au début de la seconde période de reproduction et est issue des cohortes C5 et C6. Les cohortes C9, C10 et C11 sont les progénitures des cohortes C5, C6 ainsi que celles de C7 et C8. Les cohortes C5 et C6 fusionnent en août 1997 pour disparaître en décembre de la même année. Les cohortes C12 et C13, issues des femelles reproductrices des cohortes C8, C9 et C10, représentent avec C14 la nouvelle génération de l’année 1998. Les femelles d’une cohorte sont capables d’effectuer entre deux et trois pontes par an ; ce même nombre est obtenu chez des femelles élevées au laboratoire. P. sexfasciatus est une espèce bivoltine tant que la population produit deux générations par an.
Au cours de ce cycle, les juvéniles d’une nouvelle cohorte peuvent, dans certains cas, provenir de femelles de deux cohortes distinctes ou même davantage, mais ayant une activité reproductrice simultanée.
3.4 Fécondité et fertilité instantanée
Chez P. sexfasciatus, le nombre d’œufs produits par femelle varie de 7 à 45. La valeur la plus faible est rencontrée chez une femelle de 5,22 mm, alors que la valeur la plus élevée caractérise une femelle de 11,53 mm.
Dans le but de déterminer s’il existe une relation entre la taille de la femelle et le nombre d’œufs produits par ponte, on a dénombré le contenu marsupial de 72 femelles ovigères de taille différente. Les données obtenues ont permis de tracer une droite de régression (Fig. 5a) d’équation :
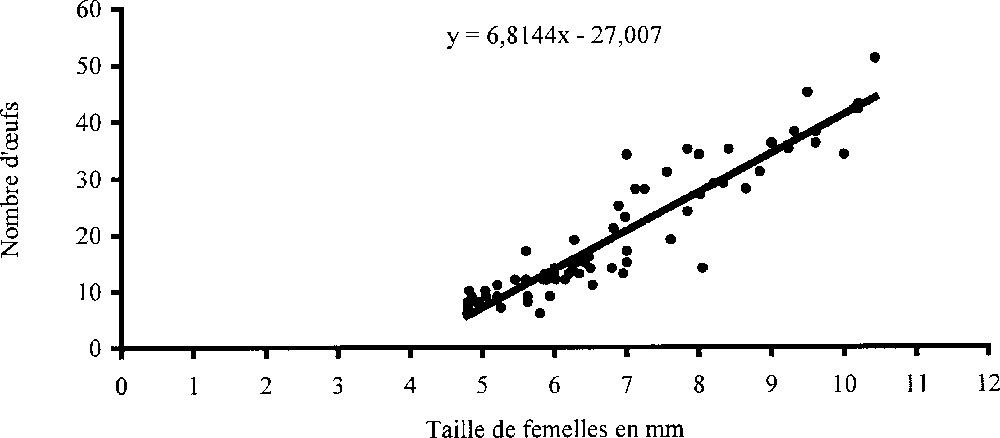
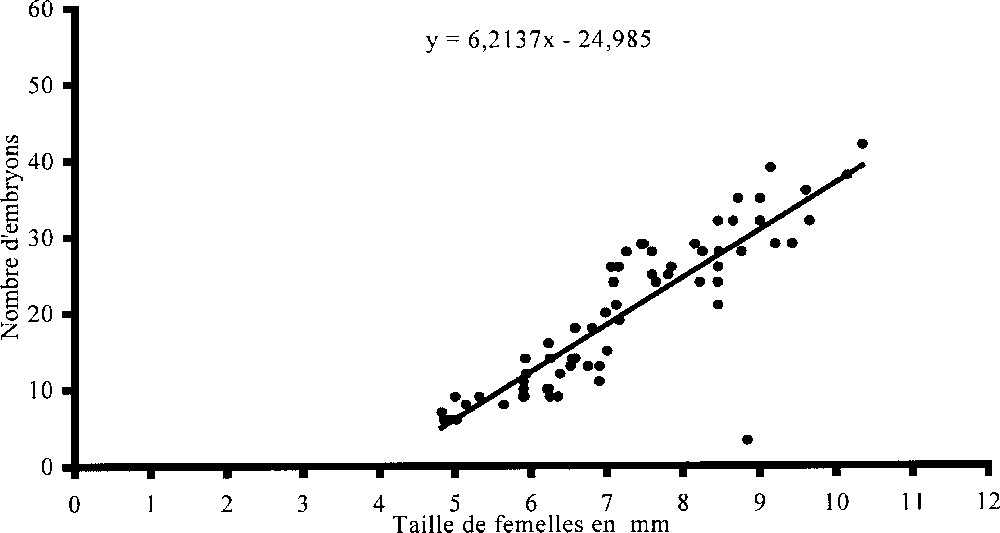
a. Fécondité : nombre d’œufs en fonction de la taille des femelles ovigères. b. Fertilité : nombre d’embryons en fonction de la taille des femelles ovigères.
Le coefficient de corrélation r, estimé à 0,93 pour un nombre de degrés de liberté égal à 70, est hautement significatif. Ceci indique une corrélation positive entre la taille et la fécondité : plus la taille est grande, plus le nombre d’œufs contenus dans le marsupium est élevé et inversement.
La fertilité (ou nombre d’embryons émis par portée) est estimée par le dénombrement des embryons contenus dans le marsupium. Afin de confirmer la relation déjà analysée entre la taille et le nombre d’œufs, les portées de 67 femelles ovigères, récoltées durant la période de reproduction et de tailles différentes, sont dénombrées. Le nombre le plus élevé d’embryons (55) est noté chez une femelle de 11,32 mm ; les femelles dont la taille est supérieure à 10 mm sont généralement rares dans la population, alors que le nombre le plus faible (5) caractérise une femelle de 5,21 mm. Le nuage de points (Fig. 5b) peut être représenté par une droite de régression d’équation :
Le coefficient de corrélation r est estimé à 0,87 pour un nombre de degrés de liberté égal à 65. Le test statistique montre que ce dernier est hautement significatif et qu’il existe une proportionnalité entre la taille de la femelle et sa fertilité.
La différence remarquée entre la fécondité et la fertilité est liée, d’une part, à la présence d’œufs incapables d’accomplir l’embryogenèse et d’évoluer en embryons et, d’autre part, à la résorption de certains œufs au cours du développement embryonnaire. La comparaison des droites de régression de la fertilité et de la fécondité par les deux tests statistiques Tpe et Tpo montre une différence non significative (Tableau 3).
Comparaison de la fécondité et de la fertilité.
| Taille moyenne | ♀ à œufs | ♀ à embryons | Tpe = 0,328 pour ddl = 131 |
| 6,97 ± 1,64 mm | 7,2 ± 1,4 mm | ||
| Nombre d’œufs et d’embryons | 15 ± 11,98 | 19 ± 10,03 | Tpo = 1,04 pour ddl = 133 |
3.5 Sex ratio
L’analyse des portées de 43 femelles, élevées au laboratoire, montre que leur progéniture est composée de 44% de mâles et de 56% de femelles. Le sex ratio primaire estimé pour les individus sexuellement différenciés, mais n’ayant pas encore atteint la maturité sexuelle, est de l’ordre de 0,78.
Dans la population naturelle, le sex ratio secondaire subit des fluctuations tout au long de l’année et oscille entre 0,54 en avril 1998 et 0,97 en septembre 1996. L’analyse statistique, par l’application du test χ2 des données consignées dans le Tableau 1, montre que la différence est non significative, aussi bien pour le sex ratio primaire que secondaire ; le sex ratio est toujours proche de l’unité dans la majorité des échantillons, à l’exception de ceux de septembre 1997 et d’avril–mai 1998. Ceci serait tributaire de la disparition des mâles adultes après l’accouplement.
4 Discussion et conclusion
Le cycle biologique de P. sexfasciatus de Garat Nâam, étudié à partir d’un échantillonnage mensuel effectué pendant deux années successives, montre que cette espèce présente, à l’instar de la majorité des Isopodes, une activité reproductrice saisonnière qui s’étale de février/mars à septembre/octobre, suivie d’un repos sexuel de quatre à cinq mois. Les mêmes résultats ont été observés chez une population de la même espèce caractérisée par une reproduction saisonnière, de mars à octobre 〚20〛. En revanche, Verhoeff (1942) in 〚21〛 signale que la population de l’île d’Ischia se reproduit aussi bien pendant l’hiver que pendant l’été ; ceci est également confirmé chez une population d’Italie par 〚22〛. Les variations de la durée de la période de reproduction d’une population à une autre au sein de la même espèce ne caractérisent pas uniquement P. sexfasciatus. Elles ont été également mentionnées chez d’autres Oniscidea, notamment Armadillidium vulgare 〚4〛 et P. pruinosus, pour lesquels la reproduction est continue chez les deux populations togolaise et française 〚7〛, alors qu’elle est saisonnière chez la population tunisienne de Garat Nâam 〚12〛.
Chez les Porcellionidae de Tunisie, étudiés jusqu’à présent, la reproduction est toujours saisonnière; mais sa durée varie selon les espèces. Ainsi pour P. pruinosus de la même localité, la reproduction s’étale de mars à octobre, avec un repos sexuel de novembre à février 〚12〛. Pour Hemilepistus reaumuri 〚10〛, la période de reproduction est réduite ; elle commence à la mi-mai et se termine pour les femelles tardives au mois de juillet, avec un maximum au mois de juin. Porcellio variabilis de Béja 〚11〛 présente une période de reproduction, légèrement plus longue, s’étalant de février à octobre, avec un repos sexuel de novembre à janvier.
Chez Porcellio dilatatus 〚1〛, ainsi que chez Armadillo officinalis de Benghazi 〚5〛, la période de reproduction, légèrement plus courte, s’étend d’avril à septembre. Cependant, la dernière espèce présente un second arrêt en juin–juillet. Chez Porcellio laevis de Delhi, la reproduction saisonnière est aussi étalée de mars à août, avec un premier repos sexuel de septembre à février et un second arrêt en mai–juin 〚2〛. Dans la faune de France, 〚21〛 a rassemblé de nombreuses données sur l’époque de reproduction des Oniscidea. En effet, chez les Porcellionidae, l’auteur a défini une durée de reproduction maximale, qui s’étale de mars à octobre, avec des variations interspécifiques importantes.
L’analyse de la répartition des femelles ovigères montre qu’elles sont capables de produire deux à trois poussées reproductives par an ; ceci prouve que P. sexfasciatus est une espèce semi-annuelle. Il s’agit également d’une espèce itéropare, puisque les femelles sont capables de se reproduire deux fois ou plus durant leur vie et de contribuer à deux périodes de reproduction successives.
Nous avons constaté que les femelles ovigères suivies au laboratoire sont capables d’effectuer des pontes successives sans s’accoupler ; on en déduit qu’un seul accouplement peut donner lieu à plusieurs pontes successives, la fécondité étant assurée par les spermatozoïdes stockés dans les voies génitales femelles. P. sexfasciatus présente un comportement reproducteur similaire à celui de Porcellio variabilis 〚11〛 et d’Armadillidium vulgare 〚23〛 : les femelles, élevées isolément et en l’absence de mâles, sont toujours capables d’effectuer des mues parturielles successives ou séparées par des mues normales.
Les femelles produisent des individus de deux sexes au cours de la même ponte ; il s’agit donc d’une espèce amphogène.
L’identification des cohortes nous révèle un nombre relativement élevé (14 cohortes) et un rythme rapide dans l’évolution de la population. Ceci n’est pas spécifique à cette espèce. En effet, pour la population tunisienne de P. pruinosus de Garat Nâam, 14 cohortes ont été identifiées pendant deux années successives et trois à six cohortes par mois 〚9〛. Chez une population française de P. pruinosus de Saint-Martin-du-Fouilloux, la représentation de Bhattacharya a permis de mettre en évidence l’existence de nombreuses cohortes pour un seul mois printanier, pendant lequel cinq cohortes pour les mâles et quatre pour les femelles ont été relevées 〚24〛.
Cependant, le suivi des cohortes C6, C7 et C8 montre que la longévité est de l’ordre de 13 à 16 mois et qu’elle est plus élevée chez les cohortes nées à la fin de la période de reproduction. Les cohortes printanières sont capables de participer à deux périodes de reproduction de deux années successives, alors que celles nées à la fin de cette période de reproduction ne se reproduisent que pendant l’année suivante. Les cohortes printanières entrent en reproduction dans des délais précoces par rapport aux cohortes automnales. Ces dernières vont subir le froid hivernal et arrivent à maturité sexuelle tardivement.
L’étude de la fécondité et la fertilité montre une corrélation positive entre le nombre d’œufs ou d’embryons et la taille des femelles ovigères. C’est le cas de P. pruinosus de Garat Nâam 〚12〛, de Porcellio laevis de Delhi, où le nombre d’œufs varie entre 10 pour des femelles de taille inférieure à 10 mm et 68 pour des femelles de taille dépassant 10 mm 〚2〛, de Porcellio variabilis de Béja 〚11〛, pour lequel ce nombre varie entre 31 pour une femelle de 9 mm et 297 pour une femelle de 20 mm. Cette relation a été également démontrée chez Armadillo officinalis de Benghazi 〚5〛 et chez Armadillidium vulgare 〚25〛.
L’étude du sex ratio est intéressante pour comprendre les relations et la reproduction potentielle des organismes. Chez la population de P. sexfasciatus de Garat Nâam, la proportion globale des mâles est de 43,87%, ce qui indique un sex ratio statistiquement équilibré. Chez d’autres populations de la même espèce, le sex ratio paraît biaisé en faveur des femelles. En effet, 〚21〛 souligne une proportion de mâles égale à 33,5%, tandis que 〚22〛 indique une proportion de 36,5%. C’est le cas de P. pruinosus de la même localité, pour lequel le nombre de mâles est nettement inférieur à celui de femelles (34,6% contre 65,4%) 〚12〛. Il a été également remarqué que les femelles sont plus nombreuses chez Armadillidium vulgare et Porcellio laevis 〚26〛. Dans une collection de 380 Armadillidium vulgare, 〚27〛 a trouvé 273 femelles (71%) et 107 mâles (29%). Chez Porcellio laevis de Delhi, 〚2〛 a mentionné 40% de mâles et 60% de femelles. Une distorsion du sex ratio en faveur des femelles est très fréquente chez les isopodes terrestres.
Par ailleurs, il a été démontré que la symbiose d’une bactérie féminisante intracellulaire du genre Wolbachia aux insectes et aux crustacés 〚28〛, est capable de biaiser le sex ratio en faveur des femelles. En effet, chez les 40% d’isopodes terrestres et chez les quelques 20% d’insectes qui hébergent cette bactérie, il a été noté que le nombre des femelles est plus élevé que celui des mâles 〚29, 30〛.
Chez P. pruinosus d’élevage, un sex ratio en faveur des femelles a été attribué non seulement à la présence de la bactérie féminisante, mais également à la température 〚31〛.
Chez plusieurs populations d’Armadillidium vulgare, la même bactérie endosymbiotique change les mâles chromosomiques (ZZ) en femelles fonctionnelles 〚32〛. Ce changement peut également être dû à un facteur féminisant, d’origine non bactérienne, capable de transformer les mâles d’Armadillidium vulgare en phénotypes femelles fonctionnelles 〚33〛.
Abridged version
The biology and the population dynamic of Porcellionides sexfasciatus were studied based on a field survey carried out at Garat Nâam (Kasserine, Tunisia), from July 1996 to June 1998. The reproduction exhibited a seasonal pattern, extending from February/March to October/November. The recruitment period occurred from April to November.
The population structure was analysed and the number of cohorts was identified. Six cohorts could be identified at the first sampling, and eight new ones were recognised and tracked during the period of study. Minimum average length of new cohorts ranged from 3.07 ± 0.35 mm to 3.47 ± 0.2 mm due to the length period. Maximum average length of cohorts was 10.42 mm. Only three cohorts, C6, C7, and C8 could be recognised and tracked from their detection up to their extinction. Taking into consideration the period from when they were born to when they disappeared, life span varied from 13 to 16 months. It is possible to recognise that cohorts C6 and C7, born close to the end of the reproductive period, lived more (15 to 16 months) than cohorts C8, born in spring (13 months). Cohorts born in the beginning of the reproduction period will be able to contribute to the reproductive effort in the same period, and also in the next one. Otherwise, cohorts born at the end of the reproduction period overwintered as immature and will reproduce on the next reproduction period. The characteristics of the life cycle of P. sexfasciatus at Garat Nâam may therefore be summarised as follows: (a) semi-annual species, since each female is able to produce two or three broods per year; (b) iteroparous females, since each female seems to reproduce twice or more in its life, and may even contribute to the reproductive effort in two consecutive reproduction periods; (c) amphogenes females, since each female produces both males and females in the same brood; (d) bivoltine life cycle, since the population produces two generations per year.
Fecundity (number of eggs per brood) and fertility (number of embryos per brood) appeared positively correlated with females’ size. The sex ratio oscillated throughout the year and seemed in equilibrium.


