1 Introduction
Lorsque le physiologiste allemand Hoppe-Seyler a créé en 1862 le mot « hémoglobine » pour désigner le pigment respiratoire contenu dans les globules rouges 〚1〛, la communauté scientifique d’alors était loin d’imaginer les multiples hémoprotéines aux fonctions différentes qui, 140 ans plus tard, seraient regroupées sous ce terme. Ce pigment est appelé myoglobine quand il est contenu dans des cellules non circulantes, comme celles des muscles.
Dans les années 1960, les mieux connues de ces molécules étaient les hémoglobines et myoglobines de vertébrés. Leurs fonctions étaient respectivement le transport de l’oxygène de la périphérie aux tissus et son stockage au voisinage des mitochondries. En 1962, Perutz et Kendrew ont été récompensés par le prix Nobel de chimie pour avoir élucidé, par diffraction des rayons X, la structure spatiale de ces deux molécules 〚2, 3〛. La myoglobine utilisée dans ces études a été extraite du muscle de cachalot, où elle est présente en quantité abondante. Elle apparaissait comme formée d’une chaîne polypeptidique, appelée globine, constituée de huit segments hélicoïdaux, repliés autour d’un groupement prosthétique, l’hème. Ce dernier est une protoporphyrine IX, centrée par un atome de fer. Dans cette structure, appelée dans la littérature anglo-saxonne globin fold ou three-on-three structure, la molécule d’hème est prise en sandwich, avec, sur chacune de ses deux faces (proximale et distale), un groupe de trois hélices α (Fig. 1). L’hémoglobine de cheval, alors définie à plus faible résolution que la myoglobine, s’avérait être un tétramère hétérologue, constitué de deux types de chaînes de globine, appelées α et β, dont la structure spatiale était identique à celle de la myoglobine. L’hémoglobine des vertébrés n’est en fait que le descendant d’une très ancienne famille de protéines présente dans tout le monde vivant, végétal et animal, de la bactérie à l’homme 〚4〛. Le caractère commun à toutes ces molécules, affirmant leur appartenance à la famille des hémoglobines est leur structure tridimensionnelle, constituée par six à huit hélices enroulées selon le motif vu plus haut.

Représentation tridimensionnelle de la myoglobine de cachalot. La protéine est formée par le repliement de huit hélices (désignées de A à H de l’extrémité N- vers l’extrémité C-terminale). Les seuls résidus constants dans toutes les familles de globines sont l’histidine proximale F8 et la phénylalanine CD1.
La fonction des hémoglobines n’est sans doute devenue le transport et le stockage de l’oxygène que chez les organismes complexes pluricellulaires. Chez les êtres unicellulaires et les invertébrés les plus primitifs, le transport et la diffusion d’oxygène semblent physiologiquement moins importants que ne l’est la protection contre l’effet toxique de l’O2, du CO et du NO• 〚5–8〛. La preuve en est la très forte affinité pour l’oxygène de leurs hémoglobines, phénomène qui rend ces molécules moins aptes à jouer un rôle de transporteur que de dépolluant. Un rôle physiologique dans la protection contre le NO• vient d’être récemment reconnu à la myoglobine humaine 〚9〛. L’élimination du NO• met en jeu une réaction bimoléculaire entre l’O2 lié à l’hème et le NO•, qui aboutit à l’oxydation du fer et la production de nitrate. Cette réaction est, à des degrés divers, commune à la majorité des hémoglobines. Ailleurs, les hémoglobines pourraient servir de sonde à oxygène, fournissant les informations nécessaires à l’adaptation des métabolismes et des biosynthèses en réponse à l’anoxie, ou encore être les accepteurs finaux d’électrons des chaînes respiratoires 〚8〛. Il faut également signaler des évolutions surprenantes, comme le transport d’H2S chez des invertébrés vivant à proximité des sources sulfureuses des fonds marins 〚10, 11〛 ou un rôle dans le phototropisme d’un ver parasite des sauterelles 〚12〛. On retrouve parfois dans un même organisme des molécules à la fois de structures très différentes et de fonctions éloignées. Ainsi, tout récemment, deux nouvelles sous-familles d’hémoglobines ont été décrites chez les vertébrés : les neuroglobines 〚13〛 et les cytoglobines 〚14, 15〛. Chez l’homme, la cytoglobine présente une séquence allongée dans sa partie C-terminale, alors que la neuroglobine a la même taille que la myoglobine. Les neuroglobines, situées au voisinage des tissus nerveux, pourraient servir de réservoir d’oxygène, agir comme agents de détoxication ou encore intervenir dans des réactions de transfert d’électrons après liaison de l’O2. Les cytoglobines, qui ont une distribution plus ubiquitaire, pourraient quant à elles avoir une fonction de peroxydase ou de superoxyde dismutase. Ces deux types de molécules, de par leur structure, se rapprochent plus des hémoglobines primitives que des autres hémoglobines de vertébrés.
2 Brève histoire des gènes de globine chez l’homme
Toutes les hémoglobines circulantes de vertébrés sont des tétramères hétérologues. Chez les vertébrés supérieurs, les gènes codants pour les chaînes de type α ou β sont portés par deux chromosomes différents, sur lesquels existe en réalité une série de gènes de globine de séquence voisine, voire identique, résultant de duplications relativement récentes (quelques dizaines de millions d’années) et groupés en clusters. Au sein d’un cluster, les gènes sont activés successivement aux différentes périodes de la vie, sous le contrôle d’un locus régulateur. Chez l’homme, le cluster des gènes de β globine, porté par le chromosome 11, est sous le contrôle d’une région appelée LCR (locus control region) et le cluster α, situé sur le chromosome 16, sous le contrôle de l’HS40 (hypersensitive-40kb region) 〚16–19〛. Chez les amphibiens, comme le Xenopus, ou chez des poissons, comme Danio rerio (zebra fish), ces deux types de gènes sont localisés sur un même chromosome, ce qui fait de ces espèces des outils d’étude particulièrement intéressants pour l’expression coordonnée des gènes de globine.
Chez l’homme, les gènes des hémoglobines tissulaires que sont la myoglobine, la neuroglobine et la cytoglobine, sont portés respectivement par les chromosomes 22, 14 et 17 〚13–14〛.
Quelle que soit l’espèce de vertébrés considérée, l’homologie de séquence entre chaînes α et β n’est que d’environ 50%, ce qui suggère une divergence à partir d’un ancêtre commun remontant à environ 500 millions d’années 〚20〛. De même, ces deux types de chaînes sont à peu près également éloignées de la myoglobine, ce qui laisse supposer que myoglobine et chaînes d’hémoglobine se sont séparées il y a 750 millions d’années. Le décryptage du génome de multiples espèces nous permet aujourd’hui de faire remonter l’arbre généalogique des globines à 1,8 milliards d’années, à l’époque où l’oxygène commençait à s’accumuler dans l’atmosphère terrestre.
Les comparaisons des séquences en acides aminés des chaînes de globine et des séquences en nucléotides de leurs gènes étaient classiquement utilisées pour déterminer la filiation des espèces. À cette approche s’ajoutent aujourd’hui le nombre et la localisation des introns dans ces gènes, la disposition des zones régulatrices et enfin l’organisation des gènes sur le chromosome. Dans le cas des hémoglobines de micro-organismes, le nombre et la disposition des introns sont variables : aucun n’existe chez les bactéries, un seul chez la paramécie et trois chez le chlamydomonas, mais localisés à des endroits différents de ceux où on les trouve dans les espèces plus évoluées. Le gène ancestral de globine qui a précédé la dichotomie entre règne végétal et animal a sans doute comporté trois introns. Le premier intron s’insère habituellement entre le second nucléotide du codon, correspondant au 12e résidu de l’hélice B et le dernier nucléotide de ce codon (B12.2). Le dernier intron s’insère entre les codons correspondant à G6 et G7 (G7.0). Le troisième intron, observé chez les plantes et chez certains trématodes, coupe l’hélice E, mais à une position différente 〚5〛. Dans le règne animal, ce troisième intron a été perdu il y a 670 millions d’années. Aussi bien chez les arthropodes que chez les annélides ou les vertébrés, hémoglobines et myoglobines n’ont conservé que les introns B12.2 et G7.0. Il faut toutefois signaler que la neuroglobine humaine comporte également trois introns ; le dernier en position E11.0 n’existe que dans ce gène 〚13〛. Les autres caractéristiques structurelles et fonctionnelles de cette hémoglobine la rapprochent des hémoglobines primitives. La cytoglobine possède également un troisième intron, mais situé près de la partie C-terminale de la chaîne, en HC11.2, ce qui conduit, chez l’homme, à une chaîne allongée comportant 190 résidus. Les caractéristiques de cette hémoglobine suggèrent une duplication du gène de la myoglobine, survenue il y a environ 800 millions d’années 〚14〛. L’histoire des hémoglobines humaines est résumée dans la Fig. 2.

Généalogie, structure intron/exon et localisation chromosomique des gènes de globine chez l’homme.
3 Les hémoglobines des micro-organismes : des hémoglobines ancestrales ?
Les hémoglobines ancestrales remontent sans doute à 1,8 milliards d’années, soit 0,5 milliard d’années après l’apparition des algues bleues. À cette époque, l’oxygène commençait à s’accumuler dans l’atmosphère et apportait, par la réaction de dioxygénation, un moyen de lutter contre l’effet toxique du NO•. Nombre de micro-organismes sont encore aujourd’hui confrontés à ces mêmes agents oxydants et leurs hémoglobines pourraient bien être des vestiges, témoins de cette époque.
Ces hémoglobines sont trouvées aussi bien chez les bactéries que chez les protozoaires et les algues unicellulaires. D’après leur structure, elles peuvent être classées en trois sous-familles.
3.1 Flavohémoglobines
Les flavohémoglobines forment peut-être l’une des plus anciennes familles d’hémoglobines. Elles ont été étudiées dans plus d’une quinzaine d’espèces, dont la levure Saccharomyces cerevisiae 〚21〛 et de très nombreuses bactéries saprophytes ou pathogènes comme Escherichia coli 〚22–23〛, Salmonella typhimurium, Mycobacterium tuberculosis, Listeria monocytogenes, Klebsiella pneumoniae ou Alcaligenes eutrophus 〚7〛. Il s’agit d’une protéine chimérique d’environ 43 kDa, constituée d’un domaine N-terminal à structure de globine et d’un domaine C-terminal, dont la structure s’apparente à celle des oxydoréductases FAD-dépendantes. La Fig. 3 représente la flavohémoglobine d’Alcaligenes eutrophus 〚24〛, avec ses deux domaines distincts. La réaction de dioxygénation permettant de transformer le NO• en nitrate est détaillée dans la Fig. 4. Une molécule de NAD(P)H cède un électron au FAD le transformant en FADH2. Ce dernier réduit le Fe3+ de l’hème, proche de lui dans l’espace, permettant ainsi à l’oxygène de se fixer sur le Fe2+. Une faible fraction de l’oxygène lié au fer de l’hème est sous forme réactive et va pouvoir dioxygéner le NO•, le transformant en nitrate (NO3–). Cette réaction a été particulièrement étudiée chez E. coli, où la synthèse de cette protéine est stimulée par la présence de NO• 〚6, 25〛.

Flavohémoglobine d’Alcaligenes eutrophus. On reconnaît le domaine flavoprotéine, dans la partie supérieure de la figure, et le domaine globine en dessous.

Détail des réactions catalysées par une flavohémoglobine lors de la transformation du NO en nitrate.
Les deux seuls résidus considérés comme invariants à travers toute la série des globines sont la Phe CD1 et l’His F8. Ils sont effectivement retrouvés dans les flavohémoglobines. Dans ces hémoglobines, comme habituellement dans les autres hémoglobines bactériennes, qui, de par leur très forte affinité pour l’oxygène, assurent une fonction de détoxication, on trouve sur la face distale de l’hème une Tyr en position B10, une Gln en E7 et une Leu en E11 〚8, 26〛. La comparaison des séquences en acides aminés des flavohémoglobines montre qu’elles forment un groupe phylogénique distinct au sein de la famille des hémoglobines 〚5〛. Elles sont codées par des gènes ne comportant pas d’introns.
Il est par ailleurs intéressant de noter que le domaine FAD présente une homologie de structure avec le cytochrome b5 réductase 〚24〛, enzyme qui réduit la méthémoglobine au fur et à mesure de sa formation dans les globules rouges des vertébrés, ce qui témoignerait, à travers l’évolution, d’une défense anti-oxydante coordonnée de ces deux domaines ou des protéines qui en sont issues.
3.2 Hémoglobines tronquées
Ces molécules, de 20 à 40 résidus plus courtes que les hémoglobines des autres groupes, forment une autre branche, très ancienne, de la superfamille des hémoglobines 〚27〛. Plus d’une quarantaine d’hémoglobines tronquées ont été décrites à ce jour. Elles ont été trouvées dans une grande variété de microorganismes : cyanobactéries capables de fixer l’azote (Nostoc commune, Synechocystis), bactéries pathogènes (Mycobacterium tuberculosis, Corynebacterium diphterae, Bordella pertussis, Staphylococcus aureus...), protozoaires (Paramecium caudatum, Tetrahymena pyriformis), algues vertes unicellulaires (Chlamydomonas eugametos) et même certains végétaux 〚28–29〛. La famille des hémoglobines tronquées se subdivise en trois groupes distincts (I, II, et III). L’homologie de séquence, faible entre les trois groupes, est forte à l’intérieur de chacun d’eux. Un même organisme peut posséder deux hémoglobines tronquées, appartenant à deux groupes différents : l’exemple en est Mycobacterium tuberculosis, où s’expriment trHbO (groupe II) et trHbN (groupe I), qui n’ont que 18% d’homologie de séquence, alors que chacune de ces hémoglobines présente environ 80% d’homologie, avec des hémoglobines du même groupe, mais appartenant à des espèces différentes 〚27〛.
Comme on peut le voir sur la Fig. 5, qui représente l’une des hémoglobines de Paramécium, leur structure diffère légèrement du schéma globinique classique : elle correspond à un arrangement original, appelé 2-on-2, des chaînes hélicoïdales assuré par les couples B/E et G/H 〚29, 30〛. On retrouve deux des résidus clés : une His équivalente à F8, sur la face proximale de l’hème, et une Tyr en B10, sur la face distale. Cette Tyr est pratiquement constante dans les hémoglobines de microorganismes, à l’exception de N. commune, où elle est remplacée par une His, et habituelle dans les hémoglobines à très forte affinité pour l’oxygène des invertébrés que nous verrons plus loin. En revanche, la Phe CD1, invariable dans la structure globinique classique, est parfois absente, du fait de la réorganisation de l’angle CD ; toutefois, dans une position qui pourrait lui être similaire, on retrouve une Phe, une Tyr ou une His. Le résidu E7, en interaction avec la Tyr B10, est ici une Gln, mais varie selon les espèces. Cette structure de la poche de l’hème a pour conséquence une très forte affinité pour l’oxygène, avec un atome de fer en équilibre entre une forme hexacoordonnée et une forme pentacoordonnée, aussi bien dans la structure désoxygénée que ligandée, comme nous le verrons en détail à propos de l’hémoglobine de riz. Ces formes se distinguent par leurs propriétés spectrales. Dans la forme hexacoordonnée, la sixième valence du fer se lierait chez Synechocystis à une His de la face distale formant ainsi un hémichrome 〚31, 32〛, mais ailleurs, un autre résidu, comme la Tyr B10, pourrait jouer un rôle similaire 〚29〛. La transition entre forme oxygénée et désoxygénée s’accompagne d’un réarrangement de la face distale. Il faut également signaler dans la structure de ces hémoglobines tronquées l’existence d’un conduit hydrophobe facilitant l’accès de l’oxygène à l’hème 〚33〛.

Hémoglobine de Paramecium : un exemple d’hémoglobine tronquée. L’hème est entouré sur sa face distale par le couple d’hélices B et E et sur sa face proximale par le couple F et G. Une histidine localisée sur l’hélice F, en position analogue à F8, se lie à la face proximale de l’hème. La partie distale de la poche de l’hème abrite une glutamine en position E7 et une tyrosine en B10. Ce dernier résidu est souvent présent dans les hémoglobines à très forte affinité pour l’oxygène.
On s’est interrogé sur l’origine de ces hémoglobines tronquées. Se sont-elles séparées très tôt des flavohémoglobines, avec lesquelles elles peuvent coexister dans un même organisme, et des autres hémoglobines de structure 3-on-3, ou proviennent-elles d’une évolution convergente ? Certains auteurs ont proposé un transfert horizontal d’un gène ancestral d’un protozoaire vers les bactéries 〚34〛. Les hémoglobines tronquées n’ont jusqu’à présent jamais été rencontrées dans les génomes de champignons ou d’animaux.
Le rôle précis de ces hémoglobines tronquées demande encore à être précisé. Chez la cyanobactérie N. commune, où le gène codant pour cette molécule est situé entre deux gènes intervenant dans le métabolisme azoté, cette hémoglobine pourrait participer à la fixation d’azote, peut-être en piégeant l’oxygène. De même, chez Mycobacterium tuberculosis, elle pourrait protéger la bactérie des agents oxydants azotés produits par les macrophages de l’hôte 〚35, 36〛.
La structure des gènes codant pour ces hémoglobines tronquées varie d’une espèce à l’autre : Tetrahymena n’a pas d’intron, alors que Paramecium en a un, mais dont la position ne coïncide avec celle d’aucun de ceux observés dans les gènes classiques de globine ; Chlamydomonas en a trois, également distincts dans leurs positions 〚37〛.
3.3 Hémoglobines bactériennes
L’hémoglobine de Vitreoscilla, qui réalise un autre modèle d’hémoglobine ancestrale, a été particulièrement étudiée 〚26, 38〛. Vitreoscilla est une bactérie aérobie Gram négative se développant dans les flaques d’eau mal oxygénées où pourrissent des végétaux, Lorsque les conditions d’oxygénation deviennent mauvaises, elle peut multiplier par un facteur de 50 la synthèse de son hémoglobine, ce qui facilite la diffusion de l’oxygène de la périphérie de la cellule vers les oxydases terminales des chaînes respiratoires 〚39, 40〛. Cette hémoglobine comporte 146 résidus, formant une chaîne polypeptidique de sept hélices α, repliées selon une structure analogue à celle des domaines globine des flavohémoglobines ou des hémoglobines végétales, voire animales. Sur la face distale de l’hème, où existent une Phe en CD1, une Pro en E8 et une Leu en E11, la liaison des ligands ferait intervenir la Tyr B10. Le fer de l’hème est ici pentacoordonné, même sous sa forme ferrique.
Dans le cristal analysé par diffraction de rayons X, les chaînes d’hémoglobine s’assemblent par une zone de contact hydrophobe pour former des homodimères. Cette aire de contact, constituée par les hélices F et H, n’existe dans aucune autre hémoglobine (Fig. 6) et a conduit à de nombreuses spéculations sur une possible fixation coopérative de l’oxygène. Des études plus récentes effectuées à des concentrations physiologiques paraissent au contraire indiquer que cette hémoglobine serait en réalité monomérique 〚41〛.
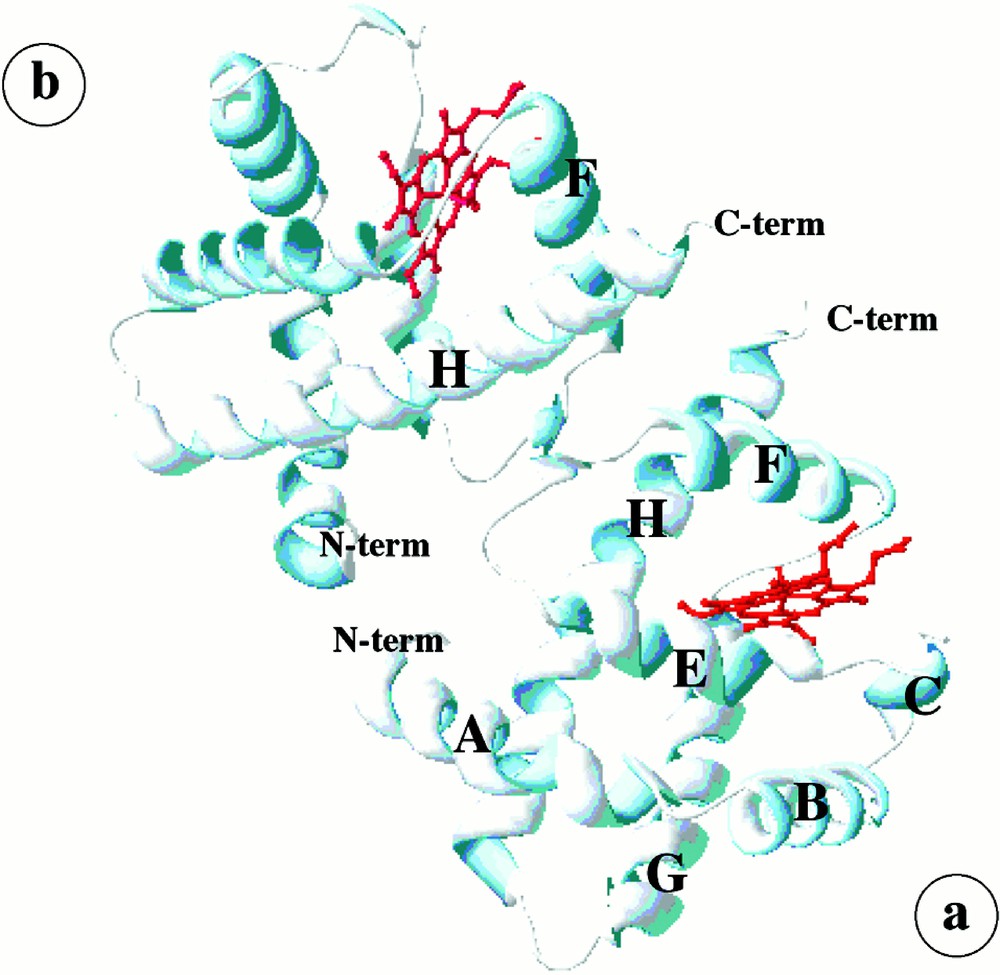
Hémoglobine bactérienne : aspect en dimères de l’Hb de Vitreoscilla obtenu dans les cristaux analysés par diffraction de rayons X. L’interaction entre sous-unités implique de façon inusuelle les hélices H et F.
3.4 Phycocyanines et globines
L’hémoglobine ancestrale dérive sans doute elle-même d’une protéine encore plus ancienne. La structure globinique est en effet retrouvée dans d’autres familles de molécules très éloignées, qui sont également classées comme globines par les structuralistes (Protein Data Bank de Brookhaven). Les phycocyanines en sont un exemple. Ce sont des chromoprotéines participant à la photosynthèse chez les cyanobactéries et algues rouges. Elles sont assemblées en hexamères formés par l’association de trois dimères hétérologues, constitués chacun d’une sous-unité α et β. Chacune de ces sous-unités est formée par un repliement d’hélices α, aboutissant à un motif voisin de la structure globinique, mais elles en sont fonctionnellement très distantes. Leur groupe prosthétique est un dérivé tetrapyrrolique ouvert. On peut s’interroger sur une dérive à partir d’un très ancien ancêtre commun avec les hémoglobines ou sur la possibilité d’une évolution convergente 〚42, 43〛.
4 Hémoglobines du monde végétal
Le monde animal s’est séparé du monde végétal il y a 1,5 milliards d’années. Dans le monde végétal, les gènes de globine ont conservé la structure ancestrale comportant trois introns et quatre exons Les hémoglobines végétales sont de deux types : non symbiotiques et symbiotiques. Les premières sont vraisemblablement les plus anciennes. Elles sont peu abondantes et localisées dans les tissus à besoins énergétiques élevés. Les secondes sont, au contraire, présentes à une concentration élevée (mM) et se rencontrent essentiellement dans les nodules des rhizomes des légumineuses. Il est probable que les deux types d’hémoglobines proviennent de la duplication d’un gène végétal ancestral, qui se serait effectuée il y a plus de 150 millions d’années, avant la séparation entre monocotylédones et dicotylédones.
4.1 Hémoglobines symbiotiques (leghémoglobines)
Le groupe des hémoglobines végétales symbiotiques, ou leghémoglobines, est connu depuis longtemps et a été particulièrement bien étudié 〚44, 45〛. Dans les nodules des rhizomes des légumineuses, les leghémoglobines permettent à des bactéries de réduire l’azote atmosphérique (N2 → NH3) en une forme utilisable pour la biosynthèse des constituants cellulaires. Cette réaction chimique consistant en la rupture d’une triple liaison demande un apport important d’énergie (940 kJ mol–1). Elle nécessite également un milieu strictement anaérobie, qui serait obtenu grâce aux leghémoglobines synthétisées par la plante et dont l’affinité pour l’oxygène se caractérise par une constante d’association très rapide et une constante de dissociation lente. On a donc longtemps pensé que la seule fonction de cette molécule était de piéger, avec une très forte affinité, toute trace d’oxygène qui aurait pu pénétrer dans le nodule, protégeant ainsi les nitrogénases de son effet toxique. En fait, elle assure également l’apport d’oxygène aux oxydases situées en fin de la chaîne d’oxydoréduction des bactéroïdes 〚45〛. Bien que leur séquence en acides aminés offre moins de 20% d’analogie avec les hémoglobines des vertébrés, leur structure tridimensionnelle est typique de celle des globines. Les structures spatiales des leghémoglobines du lupin (Fig. 7) et du soja ont été déterminées 〚46, 47〛. Ces molécules, formées de huit hélices, ont toutes une His en F8, une Phe en CD1 et, comme dans la plupart des hémoglobines animales, une His en position distale, mais qui semble y jouer un rôle moindre dans la fixation des ligands 〚47〛. Ces hémoglobines s’auto-oxydent rapidement et ont tendance à perdre facilement leur molécule d’hème.

Leghémoglobine de lupin: sa structure tridimensionnelle est très proche de celle de la myoglobine de vertébrés (cf. Fig. 1).
Dans chaque espèce, les léghémoglobines sont codées par une famille de gènes en nombre variable : on en compte ainsi huit chez le soja et cinq chez le pois de senteur 〚48〛. Ces isomères, exprimés parfois à des stades différents du nodule, semblent avoir des propriétés oxyphoriques légèrement différentes.
4.2 Hémoglobines non symbiotiques
Les hémoglobines végétales non symbiotiques ont été mises en évidence plus tardivement. Elles sont présentes en faible concentration (10–100 nM), dans des tissus variés, surtout dans ceux qui ont une croissance rapide et des besoins métaboliques élevés (plantules, feuilles, bourgeons...) 〚49〛. Elles paraissent ubiquitaires dans le règne végétal, on les y trouve aussi bien chez les monocotylédones que les dicotylédones. Ces hémoglobines présentent souvent une forte affinité pour l’oxygène. Comme dans les hémoglobines tronquées des microorganismes, l’hème reste hexacoordonné dans la forme désoxygénée ferreuse. Leur fonction est encore loin d’être clairement comprise. Elles pourraient se comporter comme des sondes mesurant la pression en oxygène, ou pourraient assurer un transport d’oxygène vers les mitochondries et ainsi stimuler l’activité métabolique. Elles pourraient aussi jouer un rôle protecteur contre les effets toxiques de l’oxygène, participer à des transferts d’électrons en interagissant avec des flavoprotéines, intervenir dans le transport de petites molécules organiques ou, enfin, avoir une activité enzymatique (peut-être comme oxygénase) dans la glycolyse. Plusieurs hémoglobines coexistent habituellement dans un même végétal 〚50〛 : deux classes d’hémoglobines ont été distinguées, selon le mode d’induction de leur biosynthèse ; la classe I pourrait correspondre à une protéine de stress, puisque synthétisée dans les tissus des racines lorsque la concentration en oxygène du milieu ambiant devient faible. Leurs fonctions pourraient être différentes, et pourquoi pas multiples 〚51, 52〛. L’hémoglobine non symbiotique de riz a été récemment étudiée par diffraction des rayons X : elle s’assemble dans le cristal sous forme d’homodimères, dont les sous-unités sont similaires aux leghémoglobines. L’interface fait intervenir l’angle CD et l’hélice G 〚53〛. Comme dans le cas de l’hémoglobine de Vitreoscilla, elle serait plutôt en monomères aux concentrations physiologiques. L’interface de dimérisation pourrait, à l’intérieur de la cellule, être une zone d’interaction avec d’autres protéines. La fixation d’un ligand sur l’hémoglobine, en modifiant la structure de cette région, permettrait alors de transmettre à une autre protéine une information sur le niveau d’oxygénation. Un tel mécanisme expliquerait comment l’hémoglobine pourrait fonctionner comme une sonde moléculaire. La Fig. 8 montre les modifications de la structure au voisinage de l’hème lors de la fixation d’oxygène dans l’hémoglobine de riz. Cette molécule peut servir d’exemple pour les autres hémoglobines hexacoordonnées, comme les neuroglobines et cytoglobines, que nous verrons plus loin.

Fixation d’oxygène sur l’hémoglobine non symbiotique de riz : il s’agit d’une hémoglobine hexacordonnée, où une structure His–Fe–His existe aussi bien dans sa forme ligandée que non ligandée. A : Vue de la structure tridimensionnelle de la poche de l’hème ; B : détail des réactions ; C : bilan global.
5 De multiples scénarios chez les invertébrés
L’étude d’un nombre croissant de génomes d’invertébrés a révélé la présence d’hémoglobines dans à peu près tous les phylums 〚7–8〛. Elles peuvent être monomériques, dimériques ou polymériques, avec un facteur commun, la même structure tridimensionnelle de la chaîne de globine. Leur fonction est tout aussi variée, allant de la protection contre les agents oxydants au transport de l’oxygène, avec parfois des évolutions surprenantes, comme le transport l’H2S chez des animaux des sources sulfureuses des fonds marins ou encore un rôle dans le phototropisme.
Certaines de ces hémoglobines sont intracellulaires. Dans quelques lignées d’invertébrés autres que les arthropodes, elles sont à l’intérieur des globules rouges nucléés du fluide cœlomique. De telles hémoglobines peuvent également exister dans des organes particulièrement sensibles à l’anoxie ou, au contraire, aux agents oxydants. Ces hémoglobines intracellulaires sont monomériques ou oligomériques. Dans les espèces où les hémoglobines ne jouent qu’un rôle local, le transport d’oxygène dans l’organisme est souvent assuré par l’hémocyanine.
D’autres hémoglobines, bien étudiées chez certains insectes, vers et mollusques, sont extracellulaires et forment des polymères de très grande taille, dans lesquels la densité en hème est comparable à celle trouvée à l’intérieur des érythrocytes 〚7–8〛.
La liste non exhaustive des quelques exemples qui suivent illustre cette diversité structurale et fonctionnelle.
5.1 L’hémoglobine d’ascaris : un piège à oxygène ?
L’ascaris, nématode parasite vivant dans le tube digestif des mammifères, est l’un des invertébrés les plus primitifs. Il possède deux hémoglobines différentes, qui ont été abondamment étudiées.
La première, extracellulaire, circule dans le milieu périentérique sous forme d’un octamère de 328 kDa. Chacune de ses huit sous-unités est formée par une chaîne polypeptidique de 39,5 kDa, où l’on reconnaît deux domaines globiniques, D1 et D2, liés de façon covalente. À ce jour, seule la structure spatiale de D1 est connue. Une séquence « His–Lys–Glu–Glu » est répétée quatre fois en tandem à l’extrémité C-terminale du domaine D2 et jouerait un rôle dans l’association en octamère, en permettant la réalisation d’une structure en fermeture éclair 〚53〛. Les images de microscopie électronique montrent que les octamères résultent de l’assemblage de deux couches parallèles de quatre sous-unités. Cette hémoglobine, avec une P50 de l’ordre de 0,004 mm de Hg, soit 25 000 fois supérieure à celle d’une hémoglobine de mammifère (Fig. 9), est l’une des celles qui ont les plus fortes affinités pour l’oxygène 〚54–56〛. Ce phénomène s’explique sans doute par une diminution considérable de la constante de dissociation pour l’oxygène, qui rend pratiquement impossible la libération de tout oxygène fixé. Le rôle physiologique de cette hémoglobine peut difficilement être celui d’un transporteur d’oxygène. Sa fonction pourrait, tout au plus, consister à stocker l’oxygène pour en assurer un apport basal lorsque le parasite a infesté l’hôte et se trouve alors dans un environnement anaérobique. À l’inverse, il a été proposé récemment que cette hémoglobine pourrait être un chélateur d’oxygène, permettant sa destruction par la voie du NO•〚57〛. Comme on peut le constater, les fonctions assurées par les hémoglobines sont variées et ont pu évoluer d’une fonction enzymatique, qui métabolise l’oxygène et le NO•, vers le transport de l’oxygène. Comprendre leurs rôles physiologiques reste aujourd’hui encore, dans certains cas, un défi difficile. Nos connaissances s’arrêtent donc, bien souvent, aux relations structure–fonction de ces protéines, et il est parfois bien spéculatif de proposer une fonction plausible in vivo. C’est le cas, en particulier, de l’hémoglobine d’Ascaris, dont on ne connaît avec certitude que les déterminants moléculaires qui lui confèrent son avidité pour l’oxygène : un réseau de liaisons hydrogène présent dans la poche de l’hème entre la Gln en position distale E7 et la Tyr B10, stabilisant la liaison dipolaire Fe(δ+)–O2(δ–) 〚54–56〛 (Fig. 10).

Échelle comparative des P50 de différentes hémoglobines. L’hémoglobine humaine adulte (HbA) en présence d’un excès d’inositol hexaphosphate (IHP) et de bezafibrate (Bzf) est donnée comme exemple de très faible affinité pour l’oxygène (P50 élevée). Ces deux ligands allostériques expérimentaux bloquent sa structure en configuration désoxygénée. Dans ces conditions, son affinité est proche de celle de l’hémoprotéine de Bradyrhizobium japonicum (FixL), qui n’appartient pas à la famille des globines et qui aurait une fonction de sonde à oxygène. Les plus fortes affinités pour l’oxygène ont été observées chez les nématodes et trématodes.

Organisation de la poche de l’hème chez l’ascaris (forme oxydée). La liaison de l’oxygène à l’hème fait intervenir un réseau de liaisons hydrogène, responsable de la forte affinité de cette hémoglobine pour ce ligand.
La seconde hémoglobine se trouve dans les cellules de la paroi de l’animal. Il s’agit d’un homodimère de 40,6 kDa, stabilisé par des ponts SH. La sous-unité a 38% d’homologie de structure avec le domaine D1. Sa P50 est de l’ordre de 0,1 mm Hg, ce qui lui permettrait peut-être d’assurer un rôle de réserve d’oxygène pour les muscles.
Une autre hémoglobine trouvée chez un trématode parasite (Paramphistomum epiclitum) se présente sous forme de monomères en solution. Elle possède deux tyrosines, en position E7 et B10, susceptibles également de former chacune une liaison hydrogène avec la molécule d’oxygène. L’affinité pour l’O2 qui en résulte est encore plus forte que celle de l’hémoglobine d’Ascaris 〚58〛.
Les hémoglobines de nématodes sont, à l’exception des neuroglobines et cytoglobines, les seules actuellement connues du monde animal dont le gène comporte trois introns.
5.2 L’hémoglobine fournit le soufre nécessaire à la synthèse des sucres
Certains invertébrés marins ont leur habitat près de sources géologiques d’hydrogène sulfuré ou de sédiments riches en dérivés soufrés. Leur métabolisme est assuré par une symbiose avec des bactéries particulières (chémo-autotrophes), qui utilisent le soufre comme accepteur final d’électrons, pour transformer le CO2 dissous en glucides. Ces invertébrés dépourvus de tube digestif dépendent entièrement de ces bactéries pour leur apport en carbone.
Un exemple est fourni par Lucina pectinata, un mollusque bivalve, qui abrite les bactéries dans un tissu spécialisé (bactériocytes) de ses branchies, où il produit une hémoglobine à très forte affinité pour le soufre. Lucina pectinata possède deux hémoglobines 〚59, 60〛. La première est un tétramère hétérologue, formé de deux types de chaînes de structure très proche, appelées HbII et HbIII, et dont la fonction se résume au transport d’oxygène. La seconde, monomérique, est appelée HbI. Elle fixe, en présence de traces d’oxygène, l’H2S formant ainsi un complexe Fe3+–H2S qui, sous l’action d’une réductase bactérienne, cède l’H2S à la bactérie.
Comme il suffit parfois d’un très petit nombre de substitutions d’acides aminés dans des régions critiques de la protéine pour faire apparaître une fonction, des expériences de mutagenèse dirigée ont été effectuées pour tenter de donner à la myoglobine de cachalot une forte affinité pour l’H2S 〚61〛. L’introduction d’une Gln en E7 et de Phe en B10 et E11, comme on l’observe sur la paroi distale de la poche de l’hème de HbI de Lucina pectinata, ont permis d’augmenter l’affinité pour le soufre de la myoglobine de cachalot, mais avec un ordre de magnitude inférieur à celui du mollusque. En fait, ce sont des différences de structure bien plus complexes que celles induites par la mutagenèse dirigée qui aboutissent à un agrandissement de la cavité où se fixe le ligand et à sa sept fois plus forte affinité pour les thiols.
Un exemple similaire d’utilisation du soufre est apporté par un ver des profondeurs marines, Riftia pachyptila, de la famille des vestimentifères, où les bactéries sont abondantes dans le trophosome de l’hôte. Le ver capture, par l’hémoglobine circulant dans ses plumes, le CO2, l’oxygène, l’H2S et autres petites molécules du milieu ambiant et les transfère aux bactéries du trophosome. Ces animaux ont trois hémoglobines, deux sont extracellulaires présentes dans les vaisseaux sanguins (V1 et V2) et la troisième dans le fluide cœlomique (C1). Toutes trois fixent l’oxygène et l’H2S. La capacité de transport d’H2S est particulièrement élevée, 1–6 mmol l–1 dans le fluide cœlomique, et le double dans les vaisseaux, en fonction de la richesse du milieu ambiant 〚62〛. Les hémoglobines de Riftia pachyptila sont des polymères de très grande taille, dont la structure élémentaire est constituée par quatre chaînes de globine, ayant un groupe thiol libre, reliées par des linkers polypeptidiques 〚63–66〛. Ainsi, V1 a une masse moléculaire d’environ 3500 kDa et comporte quelque 150 chaînes de globine et une quarantaine de linkers. V2 et C1, de masse égale à 400 kDa, sont, quant à elles, formées seulement d’environ 24 chaînes de globine. Elles totalisent donc un nombre considérable de groupes SH libres. Contrairement à l’hémoglobine de Lucina pectinata, elles lient donc oxygène et H2S en des sites différents.
5.3 Hémoglobine et phototropisme
Chez un nématode, Mermis nigrescens, parasite de certaines sauterelles, deux hémoglobines structurellement proches existent, l’une très faiblement exprimée dans tous les tissus (Mn–glb–b) pourrait avoir une fonction plus « classique ». L’autre (Mn–glb–e) sert à obturer un récepteur photosensible. 〚67〛. Ce ver, lors de son ultime étape larvaire, quitte son hôte et s’enterre pour effectuer sa mue finale. Au bout de un à deux ans, la femelle adulte gravide, dirigée par phototropisme, remonte à la surface du sol pour déposer ses œufs dans l’herbe. Durant toute sa vie souterraine, l’ocelle de l’animal est en effet sensible à la lumière et l’animal l’évitant reste enfoui. Lorsque la femelle est prête à déposer ses œufs à la surface, l’ocelle est occulté par une hémoglobine qui s’y accumule à une concentration très élevée (10 mM) et y forme des cristaux intracellulaires.
5.4 Une mini-hémoglobine pour protéger le tissu nerveux
Dans le tissu nerveux d’un vers némertéen, Cerebratulus lacteus, une mini-hémoglobine a été mise en évidence : elle le protégerait de l’anoxie. Cette protéine, qui n’est longue que de 109 résidus a une structure tertiaire unique chez les globines. Bien que l’hélice A manque, que le coude GH soit allongé et l’hélice H très courte, la structure obtenue se superpose au repliement globinique classique 〚68〛. Sur la face distale, où se fixe l’oxygène, on reconnaît les classiques Tyr B10 et Gln E7 et un canal hydrophobe permettant le trajet du ligand du milieu externe vers l’hème. S’agit-il d’un précurseur des neuroglobines ?
5.5 Quelques autres exemples
De nombreux autres exemples de structures et de fonctions originales mériteraient sans doute être détaillés.
Parmi les modèles classiquement connus, citons le ver polychaete Glycera dibranchiata, dont les hémoglobines intracellulaires se caractérisent par une grande hétérogénéité de structure. En effet, chez cet animal, coexistent une multitude de monomères, dimères et tétramères différents 〚69–71〛. De même, les hémoglobines extracellulaires de l’hémolymphe des larves de chironomidés sont hautement hétérogènes. Dès les années 1980, Braunitzer en avait déjà identifié une douzaine chez Chironomus thummi thummi : cinq sous forme de monomères, six sous forme d’homodimères et une en équilibre monomère–dimère 〚72〛. Les mesures effectuées, aujourd’hui, par spectrométrie de masse permettent d’en reconnaître plus d’une vingtaine 〚73〛. L’orientation particulière de la molécule d’hème, tournée de 180° par rapport à sa position habituelle, dans l’une des hémoglobines de chironome (Hb CTT-III), a également été à l’origine de plusieurs travaux 〚74–76〛.
Il faut sans doute aussi rappeler le modèle particulier du fonctionnement allostérique de l’hémoglobine dimérique du mollusque bivalve Scapharca inaequivalvis, où les hélices E et F des deux unités se font face 〚77, 78〛.
Enfin nous avons déjà cité les hémoglobines extracellulaires de Riftia pachyptila 〚62, 63〛 qui réalisent, tout comme celles du Lumbricus terrestris 〚79–80〛, peut être encore plus étudiées, un modèle de macromolécules géantes avec une structure en bicouche (hexagonal bilayer haemoglobin, HBL Hb) 〚81–83〛. Des images de diffraction de rayons X ont été obtenues avec une résolution de 5,5 Å sur des cristaux d’hémoglobine de lombric, montrant l’organisation des 144 sous-unités de globine et des 36 sous-unités de linkers qui la constituent. On observe un arrangement hiérarchiquement organisé de structures symétriques complexes 〚83〛. Dans cette molécule géante, l’unité structurale est un duodécamère de globines, où les sous-unités sont en contact par leurs hélices E et F. Cette structure explique l’indice de coopérativité très élevé de ces hémoglobines : sa valeur est voisine de 7,5, alors qu’elle est légèrement inférieure à 3,0 pour l’hémoglobine humaine 〚83〛.
6 Vertébrés
Ce n’est que chez les vertébrés que l’on retrouve des hémoglobines dont la fonction est conforme à l’idée que l’on s’en fait classiquement. Chez tous les vertébrés, à l’exception des poissons agnathes, témoins des espèces les plus anciennes, l’hémoglobine est sous forme de tétramère hétérologue. Elle est présente dans les globules rouges à une concentration élevée, variable selon les espèces, et sa fonction essentielle est d’assurer le transport d’oxygène vers les tissus. Chez les poissons agnathes, groupe représenté par les lamproies et myxines, il n’existe qu’un seul type de chaînes d’hémoglobines. Cette hémoglobine, sous forme monomérique dans sa structure oxygénée, s’associe en dimères lorsqu’elle est désoxygénée. Des études récentes ont donné un regain d’intérêt à la régulation de leur fonction 〚84, 85〛.
Dans les muscles des vertébrés, la myoglobine est présente sous forme de monomères : elle sert au stockage d’oxygène et à son transfert vers la mitochondrie. Comme nous l’avons déjà mentionné, elle y joue sans doute également un rôle protecteur contre le NO• 〚9, 86〛.
Il existe, bien entendu, de multiples différences fonctionnelles entre espèces correspondant à des adaptations au milieu permettant une occupation optimale des niches écologiques. Ces variations sont en fait relativement limitées, comme l'illustre par l’exemple des mammifères, où quelques différences dans les mécanismes de régulation de la fonction oxyphorique permettent de mieux répondre aux exigences de l’environnement, telles que températures polaires, vie en atmosphère confinée et aux spécificités anatomiques ou physiologiques de l’espèce 〚87–89〛.
Tout récemment, deux familles supplémentaires d’hémoglobines ont été décrites chez les vertébrés : la neuroglobine et la cytoglobine (ou histoglobine) 〚13–15〛. Il s’agit de molécules hexacoordonnées et à forte affinité pour l’oxygène. Comme nous l’avons vu plus haut, l’origine de la neuroglobine est très ancienne, et remonterait à environ 0,8 milliards d’années. Des neuroglobines étaient déjà connues dans le tube neural d’invertébrés de diverses espèces dans des phylums différents, sans toutefois être retrouvées de façon systématique. Chez les mollusques et les annélides, elles sont également présentes à concentration millimolaire dans les cellules gliales, où elles jouent un rôle de réserve d’oxygène favorable à l’activité nerveuse. Leur découverte chez les vertébrés est le résultat de l’analyse des génomes à la recherche de séquences consensus. Chez l’homme et la souris, la neuroglobine est une protéine longue de 151 résidus. Dans le cerveau humain, la neuroglobine est essentiellement localisée dans le noyau sub-thalamique, dans le thalamus et dans le lobe frontal. On la retrouve également, à plus faible concentration, dans d’autres tissus comme l’hypophyse, l’appendice, le colon ou le poumon 〚13〛. Quelle est sa fonction ? S’agit-il d’un transporteur d’oxygène au niveau de structures particulièrement sensibles à l’anoxie, ou plutôt d’une molécule assurant un rôle protecteur contre les agents oxydants 〚90–91〛 ? La cytoglobine est d’apparition plus récente, puisqu’elle semble avoir divergé de la myoglobine. Elle est distribuée dans une grande variété de tissus, à l’exception du cerveau, où elle exerce une fonction encore mal connue 〚14, 15〛.
Dans ces hémoglobines hexacoordonnées, où une structure « His–Fe–His » existe en l’absence de tout ligand externe, les liaisons hydrogène, situées du côté distal de l’hème, pourraient également jouer un rôle essentiel dans la modulation de l’affinité pour l’oxygène. Une fois l’oxygène lié à l’hème, l’histidine distale pourrait stabiliser la liaison Fe–oxygène, comme dans la myoglobine. Dans les neuroglobines et cytoglobines, la liaison de l’oxygène à l’hème résulte d’une compétition entre le ligand externe et l’histidine distale E7. Il s’agit d’un mode « archaïque » de régulation que nous avons déjà évoqué à propos d’espèces plus primitives, comme le riz (Fig. 8). Cette dernière peut en effet former une liaison de coordinence avec le fer, lui-même déjà lié à l’His F8. C’est grâce à la compétition entre His et oxygène que ces globines peuvent ajuster leur affinité pour l’oxygène dans une gamme comprise entre 0,1 et 10 mm Hg. Si la liaison de l’His E7 à l’hème n’était pas favorisée, l’affinité pour l’oxygène serait environ 100 fois plus élevée 〚13–15, 92–93〛. D’autres déterminants moléculaires, tels que la conformation de l’hème, la liaison entre le fer et l’His proximale F8 ou encore l’accessibilité du site actif aux ligands contribuent à ajuster avec encore plus de précision l’affinité de ces globines pour l’oxygène.
7 Conclusions
Ce survol de toutes les molécules dérivées de la globine à travers le monde vivant nous montre comment un même motif structural s’est adapté à un nombre varié de fonctions. Comme cela est schématisé sur la Fig. 11, certaines fonctions de détoxication et d’activités enzymatiques sont vraisemblablement les plus anciennes. Il existe également un ensemble de fonctions liées à la fixation réversible de ligands gazeux. L’hémoglobine peut également servir au transport de petites molécules variées. Enfin, un quatrième groupe rassemble des fonctions inhabituelles et, pourquoi pas, des fonctions que l’on ignore encore.

Les multiples fonctions des diverses hémoglobines (liste non exhaustive...).
Entre molécules appartenant à des espèces différentes, alors que la structure tridimensionnelle est très proche, la divergence entre les séquences primaires est souvent considérable. Ceci prouve le danger qu'il y a à vouloir affirmer la fonction d’une protéine à partir de la seule lecture d’une séquence d’ADN. L’étude des quelques 800 mutants de l’hémoglobine humaine aujourd’hui connus nous montre que le changement d’un seul résidu suffit souvent à changer drastiquement la fonction de la molécule 〚94〛. Parfois, des modifications post-traductionnelles inattendues viennent encore compliquer le tableau. L’étude de la protéine, de sa structure, de sa fonction et de son expression phénotype sont donc autant d’étapes incontournables dans la compréhension de cette protéine aux multiples facettes. L’expression de ses gènes par les techniques de la biologie moléculaire, la création de variants par mutagenèse dirigée et leur expression en systèmes acellulaires et cellulaires vont sans doute être les outils de demain pour encore mieux connaître ce chapitre de l’évolution dans un domaine essentiel de la physiologie.


