Abridged English version
In the Poitou-Charentes district, the root holoparasite Orobanche ramosa L. (broomrape) attacks winter rape fields. During these past years, this infestation caused important decreases in yield. In France, winter rape has become one of the largest scale-farming plant, after wheat and maize. Therefore, it was important to study the infestation ways of this parasite and the role the rape weeds could play in the propagation of the infestation.
The Cetiom weed database was used as a starting point to establish a first list of weeds of oily plants in two French regions, ‘Centre’ and Poitou-Charentes. During two campaigns (1992–2001 and in 1998 and 2001), a more restricted list of the Poitou-Charentes rape weeds was proposed, taking into account their affinity towards rape. Moreover, at the time of rape blooming, the weeds the most frequently seen were noted with an asterisk (∗) and those, whose distribution and ecology were most closely related to rape, with the sign (+). A scale of parasitic attack intensity was established according to the root infestation level. These joined approaches lead to a list of 82 rape weeds in Poitou-Charentes. Among them, 22 species [affinity note ⩾2; (∗) or (+) sign], Orobanche ramosa included, showed a high affinity for rape. In fields, 11 of these species were parasitized by Orobanche ramosa, four of them (Aphanes arvensis, Crepis foetida, Geranium dissectum and Picris echioides) being most severely attacked. These weeds are host plants that increase the seed bank of Orobanche ramosa after fructification. Thus, billions of seeds, present in the soil, can infest rape when sown again.
Greenhouse co-cultures (weed/Orobanche ramosa) were carried out to compare the weed susceptibility under two conditions (greenhouse and fields). Aphanes arvensis, Crepis foetida and Geranium dissectum, strongly parasitized in fields (susceptibility note = 3) were less attacked by the parasite in greenhouse co-cultures (susceptibility note = 1 or 1−). On the contrary, for Picris echioides and Sonchus oleraceus, the susceptibility towards the broomrape was higher in greenhouse co-cultures than in fields. For all other species, the susceptibility was similar or lower in greenhouse than in fields. However, all species parasitized in fields were also parasitized in greenhouse co-cultures, but at various degrees.
The weeds showing the highest degree of affinity to rape but not found parasitized in fields (Capsella bursa-pastoris, Polygonum aviculare, Raphanus raphanistrum) were also grown in greenhouse co-cultures conditions to test their ability to induce broomrape attack. In the three cases studied, a parasitic attack was observed. With Raphanus raphanistrum, broomrape emergence and flowering were obtained. With Capsella bursa-pastoris, broomrape tubercles developed but did not grow further. With Polygonum aviculare, Orobanche ramosa only reached the bud stage. Greenhouse experimental conditions seem to be essential for the induction of broomrape attachment on weeds not parasitized in fields.
In vitro co-cultures (weed/Orobanche ramosa) were also carried out with species never parasitized in fields or in greenhouse co-cultures, to check if root exudates could induce broomrape seed germination. Almost all seeds of Orobanche ramosa germinated when located in the vicinity of the root system of Sinapis arvensis or Reseda lutea, but after eight days and three weeks, respectively. Three weeks of contact with the root system of Anthriscus caucalis were necessary to obtain approximately 50% of broomrape seed germination. Only 1% of broomrape seeds germinated after three days of contact with Tordylium maximum root system. In the same experimental conditions, the efficiency of weed root exudates was very variable. In any case, the attachment of broomrape was never obtained on these weeds.
During germination, broomrape seeds developed swollen procaulomes, with no positive chimiotropism towards the weed root system. The procaulomes did not lengthen, never attached and finally starved. Then, these weeds could play the role of false hosts in rape fields. They induce ‘suicidal germinations’ of Orobanche ramosa, decreasing the parasite soil seed bank and consequently the damaging power of broomrape.
The discussion deals with the weeds of the winter rape as host plants, the way of extension of Orobanche ramosa in Poitou-Charentes and the fight against Orobanche ramosa using false hosts. It is suggested that some contradictory results concerning some weeds as host plants could be due either to different experimental conditions used in greenhouse co-cultures or to the existence of hypothetical physiological races of broomrape or of different weed ecotypes.
1 Introduction
Les plantes adventices regroupent toutes les espèces qui croissent sur un terrain cultivé sans y avoir été semées et s'y multiplient momentanément. Elles sont gênantes pour la culture en place, en détournant, à leur profit, l'eau et la lumière. Elles peuvent aussi héberger de nombreux ravageurs et transmettre des maladies nuisibles aux cultures. L'impact économique de cette concurrence se manifeste, à court terme, par une diminution des rendements et, à long terme, par l'augmentation du stock semencier du sol. De plus, le coût du désherbage représente l'une des principales dépenses pour l'agriculteur, en particulier dans le cas du colza. Parmi les ennemis des grandes cultures, les mauvaises herbes occupent une place importante [1].
Les orobanches (Orobanchacées) sont des Phanérogames holoparasites des racines de Dicotylédones des zones tempérées et subtropicales du monde. Elles deviennent de véritables fléaux socio-économiques lorsqu'elles s'attaquent à des cultures maraı̂chères et à des cultures industrielles qui dominent l'économie mondiale. Une dizaine d'espèces ont une grande importance en agriculture dont O. aegyptiaca, O. cernua, O. crenata, O. minor et O. ramosa [2].
Orobanche ramosa se rencontre principalement dans les pays du bassin méditerranéen, Espagne [3], Italie [4], Turquie [5], Chypre [6], Grèce et Crète [7], Syrie [8], Liban [9], Israël [10] et Egypte [11]. Elle est également présente en Afrique de l'Est, Éthiopie [12] et Soudan [7], mais aussi en Afrique du Nord, Algérie [13], Maroc [7] et Tunisie [14]. On la trouve en Asie (Afghanistan, Pakistan, Chine [7] et Inde [4]). Elle est très présente en Jordanie [8] et signalée en Irak et au Yémen [7]. En Europe, O. ramosa est répandue en France [15], Allemagne et Bulgarie [16], Hongrie et Pologne [4]. Elle a également été introduite accidentellement aux États-Unis [17], à Cuba [18], au Chili [19] et en Australie [7].
Les cultures de grande importance économique qui sont attaquées par O. ramosa appartiennent surtout à la famille des Solanacées, principalement l'aubergine [8], la pomme de terre [9], le tabac [16] et la tomate [5]. Mais O. ramosa parasite aussi des Crucifères [11] et des Légumineuses [10]. D'autres familles peuvent d'ailleurs être parasitées (Cucurbitacées, Ombellifères...) [8]. À l'exception de l'oignon, les Monocotylédones ont jusqu'ici été considérées comme immunes au parasite [2].
Avec une production annuelle de l'ordre de 5,5 millions de tonnes, la France est le premier producteur d'oléagineux en Europe. Colza, tournesol, soja et lin oléagineux font partie des cultures-clés pour le maintien de rotations équilibrées. En ce qui concerne le colza, l'augmentation des surfaces cultivées en France (828 000 ha en 1988, 1 176 000 ha en 2000) fait de cet oléagineux l'une des principales grandes cultures après le blé et le maı̈s, ainsi que la principale tête de rotation des systèmes céréaliers [20]. Cependant, depuis le début des années 90, la culture du colza d'hiver (Brassica napus L. Crucifères), en région Poitou-Charentes, est menacée par Orobanche ramosa qui exerce une pression de plus en plus forte dans le secteur de Saint-Jean-d'Angély (Charente-Maritime) [21]. Cette infestation entraı̂ne une diminution des rendements, qui chutent de 30–35 q ha−1 en moyenne pour les parcelles de colza saines à 5–10 q ha−1 pour les parcelles fortement infestées.
Le suivi de parcelles de colza, très infestées par l'orobanche, a permis d'établir l'inventaire des plantes adventices présentes dans la culture de colza lors de sa fructification. Mais on ne sait pas quel est le rôle joué, dans la culture ou à proximité (bordures, fossés, jachères), par chacune d'entre elles. Certaines de ces adventices, parasitées par l'orobanche, pourraient présenter une nuisibilité indirecte pour le colza, en assurant le relais de l'infestation en absence de colza, augmentant ainsi le stock semencier du parasite dans le sol. D'autres pourraient, éventuellement, jouer le rôle de faux-hôtes vis-à-vis de l'orobanche, c'est-à-dire faire germer ses graines sans pour autant permettre le déroulement du cycle du parasite.
Notre objectif a donc été pour la région Poitou-Charentes d'établir, par des méthodes appropriées : (1) la fréquence des adventices dans les cultures de colza, par conséquent leur affinité vis-à-vis du colza et (2) leur sensibilité à l'orobanche ; (3) de savoir ainsi quelles sont les adventices du colza qui pourraient prendre le relais dans l'infestation par Orobanche ramosa en l'absence de la culture de colza ou amplifier le phénomène en présence de cette culture si le désherbage n'a pas été réalisé de façon satisfaisante et (4) de déterminer celles qui permettraient de lutter éventuellement contre ce parasite en tant que faux-hôtes. On notera qu'un nombre restreint de chercheurs s'est préoccupé de ces problèmes, pourtant si vitaux pour l'économie agricole de la région Poitou-Charentes.
2 Matériel et méthodes
2.1 Base de données désherbage du Cetiom
Lors d'essais de désherbage des oléagineux (colza, lin, ricin, soja et tournesol) en régions Centre et Poitou-Charentes, mis en place par le Centre technique interprofessionnel des oléagineux métropolitains (Cetiom) selon un dispositif en blocs randomisés à trois répétitions avec témoins adjacents, les 96 principales adventices de ces cultures ont été identifiées sur des parcelles témoins non traitées par les herbicides. Ces résultats ont été regroupés dans une base de données indiquant, pour chaque essai, l'espèce cultivée, l'adventice observée, le peuplement par mètre carré, le lieu et le type de sol. Ces parcelles témoins, par comparaison aux peuplements mesurés sur les parcelles traitées de l'essai, permettent de déterminer l'efficacité de l'herbicide testé.
À partir de cette base de données, la liste des adventices observées dans une centaine de parcelles de colza en région Poitou-Charentes, de 1992 à 2001, a été établie. Une échelle d'affinité des adventices vis-à-vis du colza a ensuite été proposée en fonction du nombre de relevés floristiques (fréquence) où l'adventice a été signalée dans la culture de colza durant cette période : 0 = adventice signalée de 1 à 4 fois ; 1 = de 5 à 9 fois ; 2 = de 10 à 14 fois ; 3 = 15 fois et plus.
2.2 Relevés floristiques des parcelles expérimentales
Depuis 1998, des contrôles de l'intensité de l'attaque de l'orobanche ont été effectués, durant le cycle de développement du colza, dans cinq parcelles expérimentales mises en place par le Cetiom dans le secteur de Saint-Jean-d'Angély et non traitées par des herbicides. En 1998 et en 2001 (deux années très différentes du point de vue climatique), alors que le colza et l'orobanche étaient respectivement aux stades fructification et floraison, des relevés floristiques y ont été effectués. Parmi les adventices du colza présentes dans les parcelles, celles observées le plus fréquemment par le Cetiom ont été marquées par un astérisque (∗). Les adventices ont été déterrées et leur système racinaire observé sous loupe binoculaire (Carl Zeiss) afin d'y rechercher la présence d'orobanche. Ainsi, les adventices du colza, parasitées par l'orobanche rameuse, ont été recensées. À partir du niveau de l'intensité d'attaque parasitaire, une note de sensibilité vis-à-vis de l'orobanche leur a été attribuée : 1 = présence d'une dizaine d'orobanches par système racinaire ; 2 = présence d'une vingtaine ; 3 = présence d'une trentaine.
2.3 Étude bibliographique des adventices du colza
Pour chaque adventice du colza identifiée, les observations effectuées sur le terrain ont été complétées par des données écologiques fournies par la littérature [22–26]. Pour chaque espèce, la distribution en France, le type biologique, les dates de germination et de floraison, la nuisibilité vis-à-vis des cultures, les types de sols colonisés, les exigences climatiques et les types de communautés végétales où on les rencontre ont été précisés. Un signe + a été affecté aux adventices dont la distribution et l'écologie étaient proches de celles du colza cultivé en région Poitou-Charentes.
2.4 Confrontation des données issues des trois approches précédentes
La base de données des essais désherbage du Cetiom, établie d'après les résultats obtenus de 1992 à 2001, et les relevés floristiques effectués en 1998 et en 2001, ont permis d'établir une liste des 82 adventices du colza en Poitou-Charentes (Tableau 1). À partir de cette liste, les espèces ayant été signalées au moins dix fois dans les cultures de colza (note d'affinité ⩾ à 2), ou celles marquées d'un astérisque (observées le plus fréquemment) et/ou d'un signe + (distribution et écologie proches du colza) ont été considérées comme très affines du colza, soit 22 espèces (Tableau 1, espèces en gras).
Les 82 adventices du colza en région Poitou-Charentes et les 22 espèces les plus affines du colza (en gras)
| Boraginacées | |
| Myosotis arvensis (L.) Hill | 0 |
| Caryophyllacées | |
| Arenaria serpyllifolia L. | 0 |
| Cerastium glomeratum L. | 0 |
| Silene latifolia Poiret | 0 |
| Silene vulgaris (Moench) Garke | 0 |
| Stellaria media (L.) Villars | 1 |
| Chénopodiacées | |
| Chenopodium album L. | 1 |
| Chenopodium hybridum L. | 0 |
| Composées | |
| Carduus nutans L. | 0 |
| Carduus tenuiflorus Curtis | 0 |
| Cirsium arvense (L.) Scopoli | 0∗ |
| Crepis foetida L. | 0∗ |
| Lapsana communis L. | 0 |
| Leucanthemum vulgare Lam. | 0 |
| Matricaria cf. maritima L. | 0 |
| Matricaria recutita L. | 0 |
| Picris echioides L. | 0+ |
| Picris hieracioides L. | 0 |
| Senecio vulgaris L. | 1 |
| Sonchus arvensis L. | 1 |
| Sonchus cf asper (L.) Hill | 0 |
| Sonchus oleraceus L. | 0∗+ |
| Convolvulacées | |
| Convolvulus arvensis L. | 0 |
| Crucifères | |
| Arabidopsis thaliana (L.) Heynhold | 0 |
| Calepina irregularis (Asso) Thellung | 0+ |
| Capsella bursa-pastoris (L.) | 2 |
| Erophila verna (L.) Chevallier | 0 |
| Raphanus raphanistrum L. | 2 |
| Rapistrum rugosum (L.) Allioni | 0 |
| Sinapis arvensis L. | 3 |
| Sisymbrium officinale (L.) Scopoli | 0 |
| Dipsacacées | |
| Knautia arvensis (L.) Coulter | 0 |
| Euphorbiacées | |
| Euphorbia helioscopia L. | 0∗+ |
| Mercurialis annua L. | 3 |
| Geraniacées | |
| Erodium cicutarium (L.) L'Heritier | 0 |
| Geranium columbinum L. | 0 |
| Geranium dissectum L. | 2 |
| Geranium molle L. | 0 |
| Graminées | |
| Alopecurus myosuroides Hudson | 0 |
| Avena sativa L. | 0 |
| Bromus diandrus Roth | 0 |
| Hordeum vulgare L. | 0 |
| Lolium multiflorum Lamarck | 0∗ |
| Triticum aestivum L. | 2 |
| Joncacées | |
| Juncus bufonius L. | 0 |
| Labiées | |
| Lamium purpureum L. | 0 |
| Stachys arvensis (L.) L. | 0 |
| Légumineuses | |
| Vicia cracca L. | 0 |
| Liliacées | |
| Ornithogalum pyrenaicum L. | 0 |
| Malvacées | |
| Althœa cannabina L. | 0 |
| Malva sylvestris L. | 0 |
| Ombellifères | |
| Ammi majus L. | 2 |
| Anthriscus caucalis M. Bieberstein | 0∗+ |
| Daucus carota L. | 0 |
| Falcaria vulgaris Bernhardi | 0 |
| Petroselinum segetum (L.) Koch | 0 |
| Scandix pecten veneris L. | 0 |
| Tordylium maximum L. | 0+ |
| Torilis arvensis (Hudson) Link | 0+ |
| Orobanchacées | |
| Orobanche sp. | 0 |
| Orobanche sp. | 0 |
| Orobanche ramosa L. | 0∗ |
| Papavéracées | |
| Papaver rhoeas L. | 0∗ |
| Plantaginacées | |
| Plantago lanceolata L. | 0 |
| Polygonacées | |
| Polygonum aviculare L. | 0∗ |
| Polygonum persicaria L. | 0 |
| Primulacées | |
| Anagallis arvensis L. à fleurs rouges | 0 |
| Anagallis arvensis L. à fleurs bleues | 0 |
| Renonculacées | |
| Adonis annua L. | 0 |
| Ranunculus arvensis L. | 0 |
| Ranunculus parviflorus L. | 0 |
| Résédacées | |
| Reseda lutea L. | 0∗ |
| Rosacées | |
| Aphanes arvensis L. | 2 |
| Rubiacées | |
| Galium aparine L. | 0 |
| Sherardia arvensis L. | 0 |
| Scrophulariacées | |
| Kickxia spuria (L.) Dumortier | 0 |
| Veronica arvensis L. | 0 |
| Veronica persica Poiret | 1 |
| Solanacées | |
| Solanum nigrum L. | 0 |
| Valérianacées | |
| Valerianella locusta (L.) Laterrade | 0 |
| Verbénacées | |
| Verbena officinalis L. | 0 |
| Violacées | |
| Viola tricolor L. | 1 |
2.5 Niveau de l'attaque parasitaire des adventices très affines du colza
2.5.1 Co-culture en serres
Parmi les 22 adventices très affines du colza (voir Tableau 1, espèces en gras), celles parasitées par l'orobanche aux champs (voir Tableau 2, 11 espèces) ou en serres (Capsella bursa-pastoris, Polygonum aviculare et Raphanus raphanistrum) [27] ont retenu notre attention. Afin de tester leur sensibilité à Orobanche ramosa en conditions contrôlées et de la comparer à celle observée en conditions naturelles, des co-cultures ont été effectuées en serres. Pour chacune des 14 espèces d'adventices testées, cinq graines ont été semées dans des pots en terre cuite (∅ 15 cm) remplis avec de la terre de groies provenant d'une parcelle de colza infestée par Orobanche ramosa (secteur de Saint-Jean-d'Angély). Cent quarante pots (dix pots par espèce) ont été placés en serres, sous lumière naturelle et artificielle (tubes Mazdafluor et Durolux Truelite fournissant 100 μmol m−2 s−1, photopériode 16 h). La température était de 23±1 °C le jour et de 18±1 °C la nuit et l'humidité relative de 55 %. Un arrosage quotidien a été réalisé. Le développement du parasite sur les différentes plantes a été suivi pendant 6 mois. Au deuxième mois, puis tous les mois suivants, les systèmes racinaires des adventices ont été déterrés et observés sous loupe binoculaire afin d'y rechercher la présence d'orobanche. Comme pour les relevés floristiques, après avoir estimé le niveau d'attaque, une note de sensibilité vis-à-vis du parasite a été attribuée à chaque adventice. Les stades ontogéniques de l'orobanche précédemment définis [21,28,29] ont été utilisés lors de chaque prélèvement selon la nomenclature suivante : germination de la graine, fixation, jeune tubercule, tubercule âgé, bourgeon, tige souterraine, émergence, floraison et fructification.
Comparaison de la sensibilité à l'orobanche des adventices très affines du colza parasitées aux champs par Orobanche ramosa, après observations aux champs et en co-culture en serres
| Espèce identifiée | Sensibilité aux champs | Sensibilité en serres |
| Aphanes arvensis L. | 3 | 1 − |
| Calepina irregularis (Asso) Thellung | 1 | 1 |
| Crepis foetida L. | 3 | 1 − |
| Euphorbia helioscopia L. | 1 | 1 |
| Geranium dissectum L. | 3 | 1 |
| Lolium multiflorum Lamarck | 1 | 1− |
| Mercurialis annua L. | 1 | 1− |
| Papaver rhoeas L. | 1 | – |
| Picris echioides L. | 2 | 3 |
| Sonchus oleraceus L. | 1 | 3 |
| Triticum aestivum L. | 1 | — |
2.5.2 Co-culture in vitro
Sept espèces d'adventices très affines du colza, non parasitées par Orobanche ramosa aux champs lors de nos relevés floristiques, et pour lesquelles aucune information n'était disponible dans la littérature sur leur sensibilité vis-à-vis de l'orobanche, ont été mises en co-culture in vitro avec l'orobanche. Ces adventices sont Ammi majus, Anthriscus caucalis, Cirsium arvense, Reseda lutea, Sinapis arvensis, Tordylium maximum et Torilis arvensis.
Cette technique en conditions stériles permet d'établir si les exsudats racinaires de ces adventices induisent la germination des graines de l'orobanche et éventuellement sa fixation sur leurs racines, alors que la co-culture en serres ne permet d'observer que des stades avancés du parasite.
Pour cela les graines d'orobanche, récoltées sur colza d'hiver en 2001 dans le secteur de Saint-Jean-d'Angély, ont été désinfectées pendant 5 min dans de l'éthanol 70° puis deux fois 5 min dans une solution d'hypochlorite de calcium (Ca(OCl)2) à 3 % (p/v) (15 % de chlore actif) additionnée de cinq gouttes de Tween 20 (0,1 %). Cinq lavages successifs dans de l'eau bidistillée stérile ont été pratiqués. Quinze à 25 graines d'orobanche, choisies au hasard, ont été disposées en conditions stériles sur des disques (∅12 mm) de papier Whatman® (glass microfibre filters GF/A). Huit disques ainsi préparés ont été déposés sur une feuille de ce même papier filtre (∅ 90 mm), au fond d'une boı̂te de Petri (∅ 90 mm). L'ensemble a été imbibé de 3 ml d'eau bidistillée stérile. Cinquante boı̂tes, contenant entre 120 et 200 graines chacune, ont été placées à l'obscurité, à l'étuve (20 °C), pendant 14 jours pour le préconditionnement des graines d'Orobanche ramosa.
Nous n'avons pu tester que cinq espèces d'adventices (Tableau 3), parmi les 7 qui ont retenu notre attention, les graines d'Ammi majus et de Torilis arvensis n'étant pas disponibles à la graineterie du Muséum national d'histoire naturelle, ni chez Arbiotech.
Conditions de désinfection et de germination des graines d'adventices utilisées pour la co-culture in vitro avec l'orobanche
| Espèce d'adventice | Désinfection des graines | Traitement de levée de dormance | Conditions de germination | |
| à 20 °C | ||||
| Éthanol 70 °C | Ca(OCl)2 | |||
| Anthriscus caucalis | 2 min | 3 min | aucun | obscurité |
| Cirsium arvense | 2 min | 2 min | aucun | obscurité |
| Reseda lutea | 3 min | 5 min | aucun | lumière |
| Sinapis arvensis | 2 min | 3 min | 8 jours à 7 °C à l'obscurité | obscurité |
| Tordylium maximum | 3 min | 5 min | aucun | obscurité |
Les graines de ces cinq adventices ont été désinfectées selon un procédé identique, mais avec des temps appropriés pour chacune d'entre elles (Tableau 3). Trois graines de chaque adventice ont ensuite été disposées dans des boı̂tes en plastique rectangulaires (Fischer®, réf. : A12.084.066), dans lesquelles a été coulée une solution nutritive gélosée (1 % d'agar) de Murashige et Skoog (MS ) [30]. Pour chaque adventice, dix boı̂tes ont ainsi été préparées. Ces boı̂tes ont été placées dans les conditions favorables pour la germination des graines (Tableau 3) [31].
Après germination des graines d'adventices, les boı̂tes ont été transférées dans une chambre climatisée à une température de 25±1 °C (jour) et de 21±1 °C (nuit), sous une photopériode de 16 h avec 70 μmol m−2 s−1 (tubes Sylvania Grolux F36W). Après développement du système racinaire des adventices, trois à quatre disques de papier Whatman® GF/A, portant les graines d'Orobanche ramosa préconditionnées, ont été disposés sous le système racinaire de chaque adventice. Le développement du parasite sur chacune des adventices a ensuite été suivi sous loupe binoculaire pendant 12 semaines. Deux répétitions ont été effectuées pour chaque espèce testée.
3 Résultats
3.1 Relevés floristiques
3.1.1 Adventices très affines du colza
Quatre vingt deux espèces d'adventices du colza, réparties dans 30 familles, ont été recensées en région Poitou-Charentes (Tableau 1). Quarante quatre d'entre elles se répartissent au sein de 26 familles de Dicotylédones. Parmi les 38 restantes, 14 sont des Composées que l'on observe principalement sur terres argilo-calcaires et peu sur limons. A elle seule, cette famille représente 17 % de la flore adventice du colza en Poitou-Charentes. Les 24 autres espèces appartiennent aux Crucifères, Graminées et Ombellifères.
Parmi ces adventices, 22 espèces, dont l'orobanche rameuse, présentent une grande affinité vis-à-vis du colza (Tableau 1, espèces en gras), soit 27 % des espèces recensées, les deux tiers d'entre elles faisant partie des quatre familles citées précédemment.
3.1.2 Adventices fortement attaquées par l'orobanche
Les observations faites sur le terrain montrent que, parmi les 22 adventices très affines du colza (Tableau 1, espèces en gras), 11 espèces sont parasitées par Orobanche ramosa (Tableau 2). Parmi celles-ci, trois appartiennent à la famille des Composées (Crepis foetida, Picris echioides et Sonchus oleraceus). Deux espèces sont des Monocotylédones (Lolium multiflorum et Triticum aestivum). Parmi ces adventices parasitées, quatre sont fortement attaquées par l'orobanche : Aphanes arvensis, Crepis foetida, Geranium dissectum et Picris echioides (Tableau 2, espèces en gras, note de sensibilité de 2 ou 3).
3.2 Co-cultures en serres
3.2.1 Adventices très affines du colza et parasitées aux champs
Parmi les 11 espèces très affines du colza et sensibles à Orobanche ramosa (Tableau 2), Triticum aestivum n'a pas été testé en serres, puisqu'il s'agit d'une plante cultivée. Papaver rhoeas ne s'est pas développé dans nos conditions de culture en serres (Tableau 2). Les neuf autres adventices du colza ont été plus ou moins parasitées par l'orobanche, bien qu'à des degrés divers.
Ainsi, Aphanes arvensis, Crepis foetida, Lolium multiflorum et Mercurialis annua sont très peu parasités par l'orobanche avec une à deux orobanches par système racinaire (note de sensibilité de 1−). Calepina irregularis, Euphorbia helioscopia et Geranium dissectum sont aussi peu attaqués par l'orobanche (note de 1) tandis que Picris echioides et Sonchus oleraceus sont très parasités par l'orobanche (note de 3).
Pour Picris echioides et Sonchus oleraceus, cette sensibilité s'est révélée (Tableau 2) supérieure en serres à celle observée aux champs ; pour les autres espèces, elle fut égale ou inférieure, en serres, à celle obtenue aux champs.
3.2.2 Adventices très affines du colza et non parasitées aux champs
En co-culture en serres, Orobanche ramosa a parasité Capsella bursa-pastoris, Polygonum aviculare et Raphanus raphanistrum, adventices très affines du colza, mais non parasitées aux champs. Pour Raphanus raphanistrum, l'émergence et la floraison du parasite (Fig. 1) ont été observées conformément aux résultats acquis précédemment [27]. En revanche, les tubercules âgés, présents sur les racines de Capsella bursa-pastoris, ne se sont pas développés alors que l'émergence du parasite avait été obtenue [27]. La Fig. 2 montre le couple Polygonum aviculare/Orobanche ramosa deux mois après le début de la co-culture en serres. La graine d'orobanche a construit un procaulôme allongé (flèche), qui s'est enroulé autour de la racine de l'adventice (r) en s'y fixant (têtes de flèche). Ce stade de développement précède d'un mois l'édification du bourgeon, alors qu'aucune fixation du parasite n'avait été signalée [27], ce qui suggérait une immunité de Polygonum aviculare.

Co-culture en serres de Raphanus raphanistrum/Orobanche ramosa. Après trois mois de co-culture, l'adventice, accrochée aux tuteurs (t) est en cours de fanaison (flèche) et l'orobanche, qui l'a parasitée, est bien parvenue au stade floraison (têtes de flèche). Deux graines d'orobanche, parasites du même système racinaire, n'ont cependant développé qu'un système reproducteur à une seule fleur au lieu d'une hampe florale ramifiée, caractéristique de l'espèce. Grossissement : ×1,5.
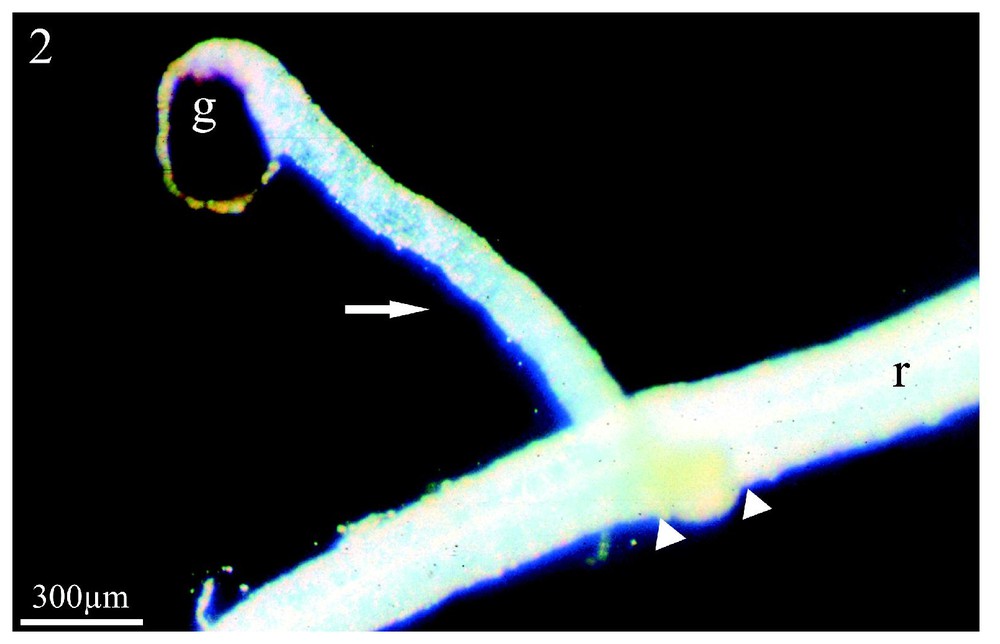
Co-culture en serres de Polygonum aviculare/Orobanche ramosa. Après deux mois de co-culture, le système racinaire de Polygonum aviculare a été déterré. L'orobanche a germé et a construit un long procaulôme (flèche) qui a entouré la racine (r) de l'adventice et s'y est fixé (têtes de flèche). (g) graine de l'orobanche. Grossissement : ×33.
3.3 Co-cultures in vitro
Afin de compléter les tests de comportement des adventices vis-à-vis de l'orobanche, les cinq dernières espèces (Anthriscus caucalis, Cirsium arvense, Reseda lutea, Sinapis arvensis et Tordylium maximum), très affines du colza et dont les graines étaient disponibles, ont été mises en co-culture in vitro avec l'orobanche. Les graines de Cirsium arvense n'ont pas germé ; les autres plantes adventices se sont développées normalement.
Le Tableau 4 montre le pourcentage maximum de germination des graines d'orobanche, obtenu au cours de deux répétitions (a et b), et le nombre de jours de contact nécessaire, avec le système racinaire de chaque adventice, pour l'atteindre. On notera la très grande homogénéité des pourcentages obtenus au cours des deux répétitions.
Comparaison, en co-culture in vitro, de la sensibilité des graines d'O. ramosa aux exsudats racinaires de quatre adventices très affines du colza et non parasitées aux champs
| Espèce d'adventice | Nombre de graines | Nombre de graines | Durée (en jours) | Pourcentage de |
| d'O. ramosa au contact | d'O. ramosa ayant | nécessaires à la | germination | |
| des racines de l'adventice | germé | germination des | ||
| graines | ||||
| Sinapis arvensis | a280 | 266 | 8 | 95% |
| b273 | 258 | 8 | 94,5% | |
| Reseda lutea | a 227 | 221 | 21 | 97,3% |
| b213 | 209 | 21 | 98,1% | |
| Anthriscus caucalis | a 262 | 123 | 21 | 46,9% |
| b276 | 138 | 21 | 50% | |
| Tordylium maximum | a 247 | 3 | 3 | 1,2% |
| b250 | 4 | 3 | 1,6% |
Sinapis arvensis est l'espèce dont les exsudats racinaires stimulent le plus fortement la germination des graines d'orobanche (95 %) (Fig. 3, flèches) situées à proximité de son système racinaire (rp) et ce, huit jours après la mise en co-culture des deux partenaires. Cependant, les germinations de l'orobanche présentent un aspect inhabituel : les procaulômes sont dilatés (Fig. 4, flèche) et ne se dirigent pas par chimiotropisme positif vers la racine de Sinapis arvensis (rp) afin de s'y fixer. Lorsqu'un contact plus étroit se réalise (Fig. 4, têtes de flèche) entre le procaulôme dilaté de l'orobanche et une racine de Sinapis arvensis (rp), ce contact fortuit n'est suivi d'aucune fixation. Dans les mêmes conditions de co-culture in vitro colza/Orobanche ramosa, les exsudats racinaires du colza ne font germer que 50 % des graines d'orobanche huit jours après la mise en culture des deux partenaires mais, au 11e jour, le pourcentage maximum de germination est alors de 95 % (communication personnelle).
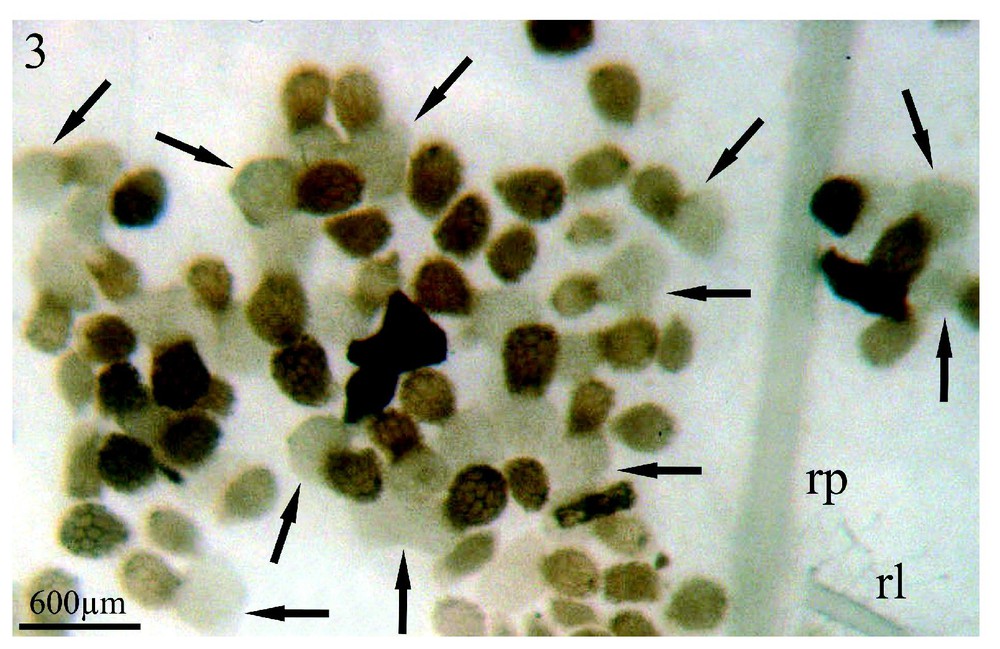
Co-cultures in vitro de graines d'Orobanche ramosa et du système racinaire de plantules de Sinapis arvensis, après huit jours de contact entre les deux partenaires: (rp) racine principale ; (rl) racine latérale de l'adventice. Les flèches soulignent la multitude des graines d'orobanche en cours de germination et leur procaulôme fortement dilaté. Grossissement : ×17.
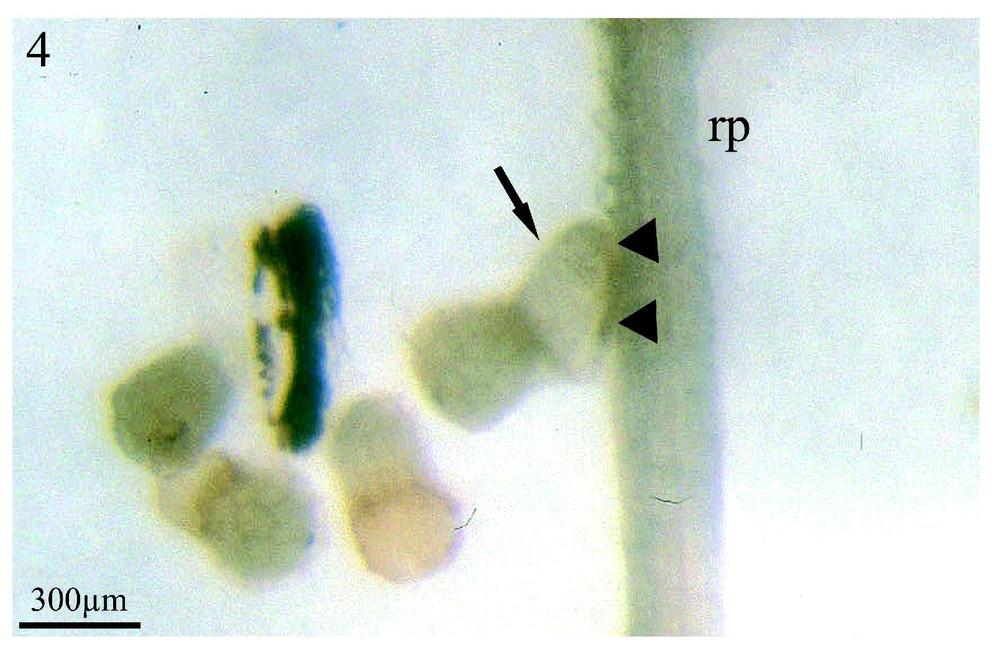
Co-cultures in vitro de graines d'Orobanche ramosa et du système racinaire de plantules de Sinapis arvensis, après huit jours de contact entre les deux partenaires. (rp) racine principale ; (rl) racine latérale de l'adventice. À un plus fort grossissement, un procaulôme d'orobanche (flèche) est visible au contact de la racine principale de Sinapis arvensis (rp). Malgré cet étroit contact en co-culture in vitro (têtes de flèche), aucune pénétration n'a été observée ultérieurement. La lisière sombre, le long de la ligne de contact entre les deux partenaires, témoigne du manchon de poils absorbants écrasés de Sinapis arvensis. Grossissement : ×33.
Les exsudats racinaires de Reseda lutea (Tableau 4) provoquent 98 % de germination des graines d'orobanche mais, plus tardivement, trois semaines après leur mise en contact avec les racines de l'adventice. La réponse de l'orobanche aux exsudats racinaires d'Anthriscus caucalis (Tableau 4) est beaucoup plus faible (50 % de germination) et elle est aussi tardive (trois semaines). En présence de ces deux espèces, les germinations d'orobanche ont le même aspect dilaté ; incapables d'allongement, elles ne se fixent jamais.
Tordylium maximum est l'espèce dont les exsudats racinaires stimulent le moins la germination des graines d'Orobanche ramosa. Bien que les graines d'orobanche germent très rapidement (Tableau 4, trois jours après leur mise en contact avec les racines de Tordylium maximum), la fréquence de germination n'est que de 1 %, et ce jusqu'à la 12e semaine.
Les Figs. 5 et 6 montrent à titre d'exemple, et pour comparaison, une co-culture in vitro du couple colza/Orobanche ramosa respectivement après trois semaines et deux mois de contact entre les deux partenaires. On y voit la formation de l'haustorium (Fig. 5, ha) et, plus tardivement (2 mois), celle d'un jeune tubercule (t) sur une racine latérale (rl) de colza. Pour le colza, comme pour les adventices étudiées en co-culture en serres, seules les racines latérales induisent la germination et permettent la fixation du parasite. En revanche, pour les adventices examinées en co-culture in vitro, l'ensemble du système racinaire induit la germination des graines d'orobanche sans permettre une fixation ultérieure.
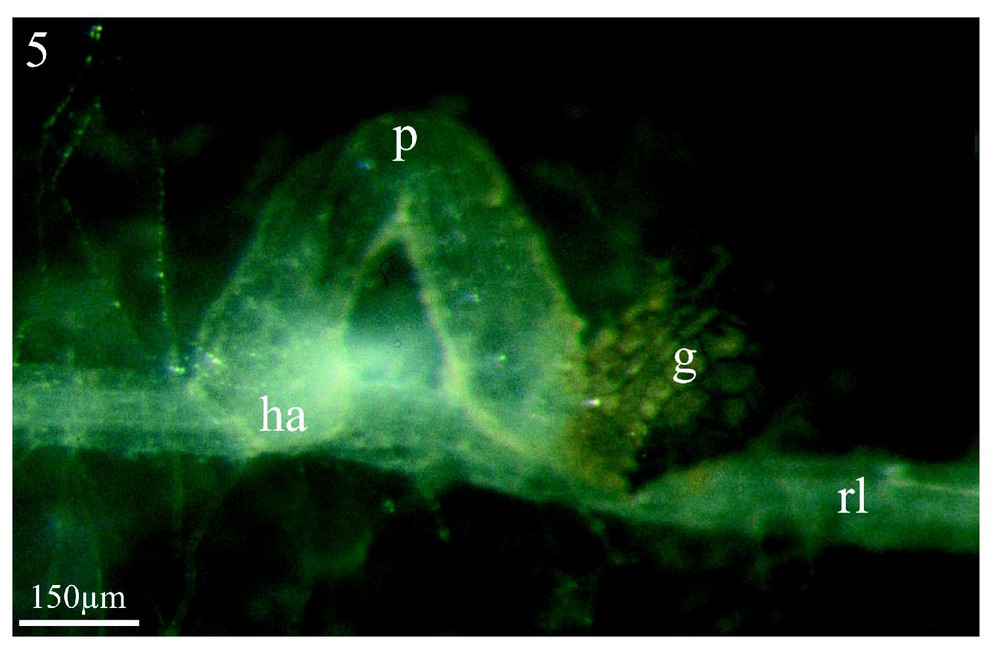
Co-culture in vitro de colza/Orobanche ramosa. Le procaulôme (p) sortant de la graine (g) s'est allongé et son extrémité s'est dirigée vers le système racinaire latéral du colza (rl), au niveau duquel est appliqué l'haustorium (ha). Grossissement : ×67.
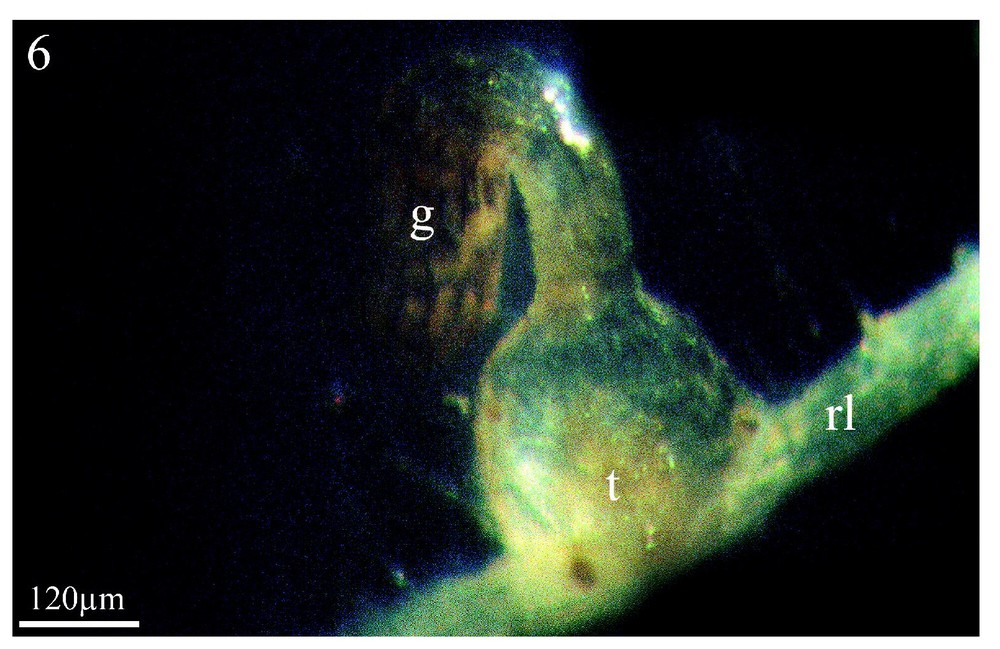
Dans les mêmes conditions de culture, stade plus avancé de l'orobanche : le jeune tubercule (t) s'est développé sur la racine latérale (rl) du colza. (g) Graine de l'orobanche. Grossissement : ×83.
4 Discussion
En Poitou-Charentes, les cultures de colza sont décimées par Orobanche ramosa ; un examen des modalités de l'infestation s'imposait. Nos résultats apportent des données originales dans quatre domaines.
4.1 La connaissance des adventices affines du colza et la détermination de celles jouant le rôle de plantes hôtes
La liste des espèces adventices du colza, en Poitou-Charentes, a été établie et les 22 espèces les plus affines ont été identifiées. 50 % (11 espèces sur 22) des adventices très affines du colza sont parasitées par Orobanche ramosa ; elles jouent donc le rôle de plantes hôtes. Deux des 11 espèces sont des Monocotylédones (Lolium multiflorum et Triticum aestivum), alors que l'on considère généralement que l'orobanche ne parasite que les Dicotylédones [2].
4.2 Les modes d'extension d'Orobanche ramosa
Dans les champs de colza, les orobanches fixées sur les adventices libèrent à l'issue de leur cycle biologique des milliards de graines, qui s'ajoutent au stock semencier du parasite déjà présent dans le sol. Même en l'absence de culture de colza dans l'année, ces adventices sont très nuisibles, puisqu'elles assurent l'augmentation dans le sol des graines d'orobanche, capables de parasiter ultérieurement une nouvelle culture de colza. De plus, lorsqu'une parcelle de colza est fortement infestée par l'orobanche, la couverture du sol par la culture diminue considérablement, ce qui favorise le développement d'adventices très affines, qui peuvent alors jouer le rôle de plantes hôtes.
En Poitou-Charentes, la culture du colza est associée, dans les rotations culturales, au tournesol, au blé et à l'orge, le colza étant la tête de la rotation.
Les quatre adventices très affines du colza et fortement attaquées par Orobanche ramosa (Aphanes arvensis, Crepis foetida, Geranium dissectum et Picris echioides) ne sont pas observées dans les champs de céréales et de tournesol (base de données du Cetiom et informations issues de l'Institut technique des céréales et des fourrages, aujourd'hui ARVALYS, Institut du Végétal). On notera qu'il s'agit de données régionales, car, dans certaines conditions culturales, Aphanes arvensis est abondante en céréales et Geranium dissectum abondant en tournesol. Dans le cas des céréales en Poitou-Charentes, les traitements herbicides antidicotylédones ne posent aucun problème de sélectivité vis-à-vis de la culture traitée. En revanche, pour le colza, la question de la sélectivité de l'herbicide antidicotylédone limite la gamme d'herbicides. Dans le cas des herbicides anticrucifères, cette gamme est encore plus réduite. Ceci explique pourquoi les herbicides antidicotylédones et anticrucifères ne peuvent être appliqués, car ils sont très nuisibles pour le colza, si bien que les quatre adventices précitées ne sont pas éradiquées. De plus, ces quatre adventices ont un cycle de développement en phase avec celui du colza d'hiver et en décalage avec celui du tournesol, qui est une culture de printemps. Elles ne sont donc plus présentes dans les champs de tournesol.
Pour les jachères où aucun traitement herbicide n'est généralement appliqué, les adventices sont abondantes. Si le sol est riche en graines d'orobanche, ces adventices peuvent assurer le relais dans l'extension du parasite. En terme de conseil agronomique, il conviendra donc de porter une attention toute particulière au désherbage des quatre adventices précitées sur l'ensemble de la rotation, ainsi qu'à l'entretien des jachères et des bordures, voire des intercultures, si elles durent suffisamment longtemps pour que le cycle de l'orobanche se déroule normalement.
4.3 La lutte contre l'orobanche par utilisation de faux hôtes
Nos résultats obtenus en co-culture in vitro montrent que trois espèces, très affines du colza (Anthriscus caucalis, Reseda lutea et Sinapis arvensis), pourraient être utilisées comme faux hôtes dans la lutte contre l'orobanche. Leurs exsudats racinaires induisent la germination des graines d'orobanche, mais, la fixation sur l'adventice n'étant pas assurée, le parasite dégénère et meurt. Il s'agit donc de germinations suicides, qui pourraient réduire le stock semencier du parasite dans le sol. Ces espèces pourraient être favorisées dans les jachères ou dans les intercultures. Dans le cadre de la gestion des adventices dans les cultures, on pourrait ne pas les éradiquer trop précocement, afin d'assurer la germination d'un maximum de graines d'orobanche sans aucun risque de parasitisme.
4.4 La nécessité de méthodes convergentes d'investigation pour déterminer la sensibilité des adventices à l'orobanche
Les résultats parfois contradictoires, obtenus dans la littérature, suggèrent que les conditions artificielles de culture (température, luminosité et hygrométrie) peuvent modifier le comportement de l'orobanche vis-à-vis de son partenaire, la co-culture en serres se rapprochant le plus des conditions naturelles. Ainsi, la co-culture en serres du couple Polygonum aviculare/Orobanche ramosa a révélé la sensibilité de l'adventice, alors qu'une « immunité » de celle-ci vis-à-vis de l'orobanche avait été signalée [27]. En revanche, dans les mêmes conditions de co-culture, nous avons pu confirmer la sensibilité à l'orobanche de Raphanus raphanistrum [27]. Cette plante peut donc représenter un risque d'extension de l'infestation dans les rotations culturales puisque l'orobanche y effectue alors complètement son cycle biologique. Ces différences de comportement pourraient aussi être dues à l'existence de races physiologiques d'Orobanche ramosa. La caractérisation de ces races est entreprise en réalisant des infestations croisées en serres. Pour ce faire, des graines d'Orobanche ramosa, récoltées la même année sur colza, chanvre et tabac, sont mises en contact avec les systèmes racinaires de chacune des trois cultures afin de voir si leur origine influe sur leur comportement ultérieur. Une variation génétique intraspécifique a, de plus, été mise en évidence, par l'utilisation de marqueurs moléculaires, pour deux populations d'O. ramosa provenant de deux lieux géographiques différents, et il en est de même pour d'autres espèces d'orobanches [32]. On notera également l'existence de nombreux écotypes d'adventices, notamment des crucifères sauvages, qui sont parfois auto-incompatibles. L'autofécondation, dans ce cas, étant alors impossible, la pollinisation se ferait entre plantes différentes de la même espèce, aboutissant à l'obtention d'un matériel génétique très varié. Dans les différentes populations d'adventices rencontrées en France, il existerait donc, pour une même espèce, une variabilité génétique parfois importante, qui pourrait se traduire par une sensibilité plus ou moins forte à l'orobanche. Des travaux de biologie moléculaire ont aussi montré l'existence de plusieurs gènes de résistance chez l'hôte, par exemple chez la fève parasitée par O. crenata [33] ou chez le tournesol parasité par O. cumana [34], mais, pour le couple colza/O. ramosa, aucune étude de ce type n'a encore été entreprise. De plus, des races nouvelles du pathogène émergent constamment, ce qui rend la tâche très difficile [35].
Nous avons vu que certaines adventices du colza émettent des exsudats racinaires, vraisemblablement de nature lactonique [36–38], capables d'induire la germination des graines d'orobanche situées à proximité, d'ailleurs plus ou moins rapidement et en proportions très variables (de 1 à 98 % de germination). Pourtant, aucune relation n'a pu être relevée entre cette induction première de germination et la capacité d'allongement et d'orientation du procaulôme d'orobanche vers l'adventice. Ceci suggère que les enzymes, normalement sécrétées par le procaulôme d'orobanche [36], ne sont pas émises dans ce système ou ne fonctionnent pas, si bien qu'une fixation ne pourra pas intervenir. Le dialogue moléculaire, sensé s'établir entre les deux partenaires [36,39–45], a été interrompu.


