Abridged English version
The electrical capacitance and resistance, elements of the impedance, of the first leaf of a maize plant grown in a culture room and aged 14 days was measured from 40 Hz to 100 kHz. The plants were cultivated on sand with humidity of 40 or 60% of the maximal retention capacity of the soil (CRM) and in hydroponics. A slightly modified Knop solution served as nourishing solution. Forty-eight hours before the measure of the electrical parameters, the plants were placed in a 0.55 × 0.55 × 0.35-m3 test chamber to be submitted to agitated air created by a domestic fan or to a relative air humidity created by evaporation. In the test chamber, light and temperature are constant. The data were collected by means of a personal computer each time a 1-V signal was delivered by the LCZ meter. The leaf complex impedance is modelled as a resistance in parallel with a capacitor and is given by:
- • real resistance:
- • imaginary resistance:
Two cases can be distinguished:
- • a culture in quiet air, without any external intervention;
- • a culture in modified hydroponic regime air.
Water supply and electrical impedance in calm air
The electrical impedance spectra of the plants cultivated on solid substrata are similar. They are different for the plants cultivated by hydroponics. The latter have the largest resistance (170 kΩ) and the smallest capacitance (5.67 nF) values.
Water supply, electrical impedance and water regime of the ambient atmosphere
For every level of soil humidity (40 and 60% of the CRM), we have two levels of humidity of the ambient air (agitated Air (AA) and elevated relative humidity (HRA)). The same treatment is made for the hydroponic grown plants. We can then make horizontal and vertical comparisons. We notice that:
- • the two factors AA and HRA have similar effects;
- •
the effect of these two factors depends on the level of humidity of the root medium:
- – with a low humidity rate, the two factors appear as being stimulant;
- – with a high humidity rate, there is an inversion of situation, the two factors becoming inhibiting.
The analysis of the values of the impedance parameters helps in our understanding.
The resistance decreases strongly in plants whose roots push in a medium that is diluted to greatly diluted in mineral elements (60% of the CRM and hydropony). The capacitance or accumulation of the electrical charge decreases in plants cultivated on solid substrata and increases strongly in those cultivated in hydroponics.
Maize reacts strongly to external stimulation by reduction of its ‘vigour index’ (IV) and by the internal structure of leaves, as revealed by electrical impedance measurements.
These data may help to distinguish between the various modes of adaptation of maize leaves, and may contribute to clarifying the complex reaction mechanisms in the plant.
1 Introduction
Lorsqu'on parle de propriétés électriques chez les végétaux, on pense surtout aux ions, aux charges électriques. Ces ions sont transportés, entre autres, par le courant hydroionique, qui dépend de l'organe végétal considéré, de sa faculté d'accumuler ces charges électriques et des conditions externes, tels que les mouvements de l'air, son humidité relative et l'humidité du sol. Ces facteurs influencent le phénomène physiologique de transpiration, phénomène par lequel la plante évapore une partie de l'eau absorbée. Cette absorption dépend aussi de la pression osmotique créée par la concentration des substances chimiques dans le milieu où poussent les racines. Avec des quantités proches en éléments nutritifs, la quantité d'eau et d'éléments minéraux absorbée n'est pas la même, selon que la plante pousse sur un substrat solide (du sable, par exemple) ou liquide (hydroponie) [1].
D'un autre côté, les plantes supérieures disposent d'une gamme d'adaptations biochimique, physiologique [2] et morphologique en réponse au stress hydrique, incluant l'accumulation de l'acide abscissique (ABA) [3]. Cet acide influence des phénomènes caractéristiques du stress hydrique, tels que la fermeture des stomates [4] et l'accumulation des solutés dans les racines [5].
Certaines plantes répondent à la baisse de l'humidité du sol ou de l'humidité relative de l'air par une accumulation d'inhibiteurs de la croissance de nature phénolique, acide [6].
El Kinani [7] a établi que l'humidité du sol et l'humidité relative de l'air (HRA) affectent les paramètres de la réaction bioélectrique enregistrée sous forme de potentiel d'action chez la première feuille de blé. L'augmentation naturelle de l'HRA inhibe cette réaction. Les mêmes plantes testées, soumises à une agitation de l'air par ventilation deviennent plus sensibles. La vitesse de montée du potentiel d'action devient plus importante, se corrélant avec la meilleure croissance, résultant d'un développement dans des conditions nutritionnelles optimales.
Travaillant sur le maïs, Fromm et Fei [8] ont constaté que, dans des conditions de sécheresse, l'absorption du CO2 et la transpiration ont diminué et que le stress hydrique créé autour des racines induit une propagation dépolarisante du potentiel électrique de surface.
Ces signaux électriques obtenus rapidement et, peut-être, de manière peu onéreuse, doivent être comparés à d'autres signaux, également électriques, et obtenus dans des conditions analogues. La comparaison des méthodes et peut-être la compréhension de certains problèmes théoriques seraient plus aisées.
Ainsi, dans un travail précédent [9], nous avons constaté que le maïs se distingue par des paramètres d'impédance électrique plus importants en comparaison d'autres plantes cultivées, en l'occurrence le tournesol et le potiron. Sur le plan méthodologique, la première feuille de cette plante peut contenir les électrodes dont nous disposons actuellement.
Dans le présent travail, nous continuons les mesures de l'impédance électrique in vivo de la première feuille de jeunes plants de maïs, soumis cette fois à des variations de la vitesse du courant hydroionique et cultivés à différents niveaux de l'humidité du sol. L'établissement rapide, viable et à moindres frais d'un diagnostic foliaire sur l'état physiologique – ou pathologique – d'une culture à un stade précoce de son développement est d'une importante portée agronomique.
2 Matériel et méthodes
2.1 Matériel végétal
Le matériel végétal qui fait l'objet de cette étude est le maïs (Zea mays L. var. Doukalia). C'est une variété locale marocaine, largement propagée et appréciée par les agriculteurs pour sa rusticité et son adaptation à des périodes de sécheresse plus ou moins longues durant le cycle végétatif.
2.2 Conditions de culture
2.2.1 Solution nutritive
La solution nutritive choisie est celle de Knop. Sa constitution, légèrement modifiée, est la suivante (g l−1) : KNO3 (0,134) ; KH2PO4 (0,143) ; MgSO4 (0,286) ; KCl (0,071) ; Ca (NO3)2 (0,286) ; H2BO3 (0,005) ; MnSO4 (0,001) ; ZnSO4 (0,001) ; CuSO4 (0,001) ; Na2EDTA (0,019) et FeSO4⋅7 H2O (0,014).
2.2.2 Salle de culture
Toutes les manipulations, depuis l'imbibition des graines jusqu'aux mesures sont effectuées dans une salle de culture. Les paramètres sont les suivants : photopériode : 12 h/12 h. Intensité lumineuse : 10 000 1x (≈125 μmol m−2 s−1) [10] ; humidité relative de l'air : 50 à 60 %. Température moyenne jour/nuit : 22/15 °C.
La salle est munie d'un climatiseur qui, tout en maintenant la température au niveau voulu, procède à un échange d'air entre l'intérieur et l'extérieur de la salle, générant ainsi un léger mouvement d'air.
2.3 Préparation du matériel végétal
Après un rinçage massif et une imbibition à l'eau du robinet pendant 1 h, les graines sont mises à germer dans une bassine de petite profondeur entre deux couches de papier filtre imbibé en permanence. La bassine est recouverte par une plaque de verre pour augmenter l'humidité.
2.3.1 Culture en hydroponie
Trois jours après la mise en germination, la plaque et la couche supérieure du papier filtre sont enlevées, pour laisser les plantes prendre un port droit.
Cinq jours après, les plantes identiques sont repiquées dans des pots munis de couvercles percés de six trous, dont l'un, central, sert à l'aération de la solution nutritive et des racines. Les cinq autres trous, disposés de façon isocentrique, servent à contenir les plantes qui y sont maintenus à l'aide du coton délicatement inséré entre l'épicotyle et la paroi de l'orifice. Ainsi, seules les racines sont plongées dans la solution nutritive hydroponique de Knop, légèrement modifiée.
2.3.2 Culture sur sable
Les graines ayant germé sont repiquées à raison de 10 graines par pot, lequel est rempli de sable, mélangé avec la solution nutritive et humecté en fonction de la capacité de rétention maximale. Quatre jours plus tard, cinq plantules montrant une croissance normale sont laissées se développer, tandis que les autres sont éliminées. L'humidité du sable est calculée sur la base de la capacité de rétention maximale (CRM). Au cours d'essais préliminaires, nous avons constaté que 20 et 80 % de la CRM étaient défavorables pour le développement des plantes. Nous avons retenu donc 40 et 60 %. Le niveau d'humidité est maintenu constant par pesée quotidienne de chaque pot et par apport d'eau distillée en quantités équivalentes aux pertes de poids mesurés. Avant d'être mis dans les pots, le sable est mélangé à la solution nutritive.
2.4 Application de conditions atmosphériques particulières
2.4.1 Variation de l'humidité relative de l'air (HRA)
Pour élever l'humidité relative de l'air, nous avons construit une enceinte hygrométrique. Les parois internes d'une chambre de test en bois de sont tapissées par une bande d'éponge synthétique de 1 cm d'épaisseur, recouverte par deux couches de gaze et alimentée continuellement par un filet d'eau du robinet. L'excès d'eau d'imbibition de cette bande est recueilli sur un fond métallique muni d'un orifice pour évacuation. La chambre de test est dépourvue de couvercle (voir Fig. 1). Les plantes qui s'y trouvent reçoivent ainsi le même éclairement que celles qui sont à l'extérieur et qui servent de témoin. La température à l'intérieur de l'enceinte ne subit pas non plus de changement. L'éponge et les deux couches de gaze permettant une notable évaporation, l'humidité relative de l'air augmente de 20 à 30 % par rapport à l'extérieur de l'enceinte en régime diurne. En lumière éteinte, l'humidité relative de l'air devient presque saturante. Dans notre étude, les plantes ont subit l'effet de l'élévation de l'humidité en régime continu (jour et nuit) pendant 48 h avant la mesure des paramètres de l'impédance électrique. Elles sont ensuite maintenues soumises à ce régime pour croître jusqu'à l'âge de 23 jours.

Vue d'ensemble d'un essai. (1) Chambre de test pour abriter les plantes soumises à un niveau élevé d'humidité relative de l'air (HRA) ou à une ventilation. (2) Plantes témoins. (3) Hygro-thermographe.
2.4.2 Variation de l'agitation de l'air (AA)
À l'aide d'un ventilateur placé à 10 cm de la paroi de la chambre de test décrite plus haut, nous avons crée un flux d'air qui atteint les feuilles des plantes en pots placés au milieu de la chambre de test. La paroi de cette chambre, qui se trouve devant le ventilateur, et celle qui lui est opposée sont percées de trous de 3,5 cm de diamètre, permettant une circulation dans un sens unique du courant éolien traversant la chambre de test (Fig. 2). Dans nos expériences, les plantes étaient soumises à la ventilation en régime continu (jour et nuit) pendant 48 h avant la mesure des paramètres de l'impédance électrique. Puis on les laisse poursuivre leur croissance dans ces conditions jusqu'à l'âge de 23 jours.

Dispositifs de culture des plantes et de mesure de leurs paramètres électriques. (1) Ventilateur. (2) Chambre de test. (3) Pot de culture. (4) Appareil de mesure de bioimpédance. (5) Ordinateur personnel pour l'acquisition et l'exploitation de données. (6) Orifices permettant le passage du flux éolien.
2.5 Mesure de l'impédance
2.5.1 Mesure sur la première feuille
Le jour de l'imbibition des graines est considéré comme premier jour de la vie de nos plants. Les mesures sont faites sur les plantes entières, âgées de 14 j. La partie apicale de la première feuille est placée, dans un plan parallèle aux lignes du courant, entre deux électrodes, dont l'une est placée sur la face supérieure et la deuxième au même endroit, mais sur la face inférieure (Fig. 3).
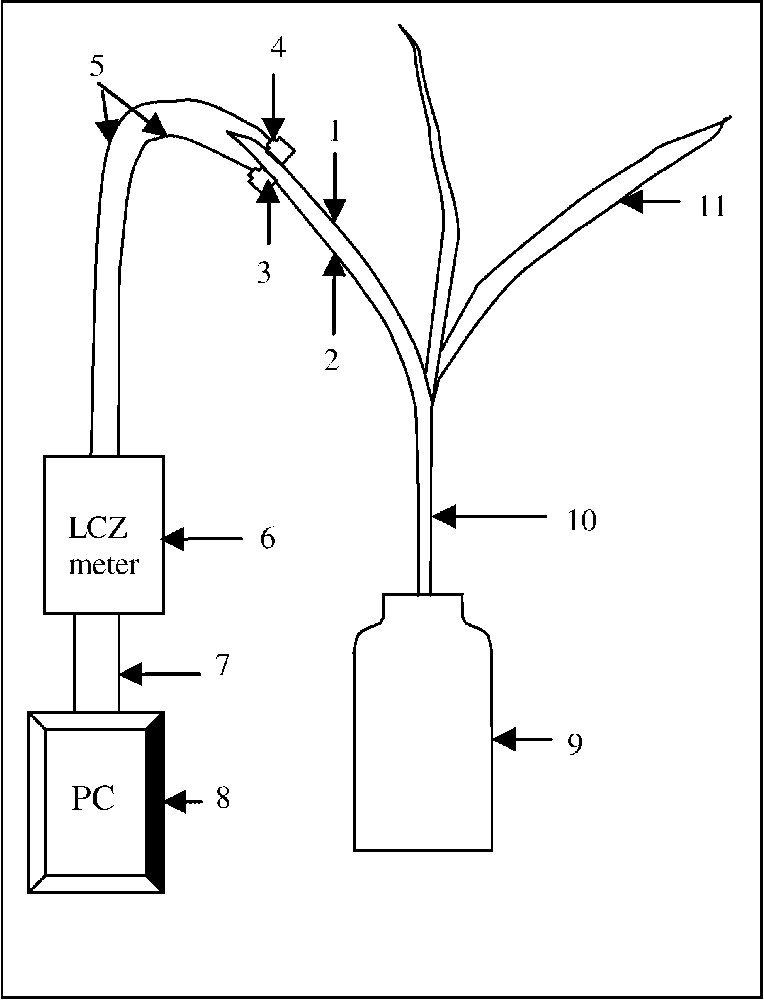
Schéma d'une feuille avec ses électrodes. (1) Face supérieure de la première feuille. (2) Face inférieure de la première feuille. (3) Partie autocollante de l'électrode. (4) Zone de connexion de l'électrode. (5) Fils reliant les deux électrodes à l'appareil de mesure. (6) LCZ meter. (7) Interface IEEE488. (8) Ordinateur personnel. (9) Pot de culture. (10) Épicotyle. (11) Deuxième feuille.
2.5.2 Appareillage, obtention et traitement des résultats
La plante est modélisée comme une résistance en série ou en parallèle avec un condensateur (Fig. 4). Ce modèle, appelé simple, donne des informations sur les changements que peut subir le système du fait des variations des valeurs des éléments constituant le schéma ; en revanche, le modèle appelé double, comprenant une capacité supplémentaire en série, caractérise des tissus morts et ceux ayant subi des dommages mineurs [11,12].

Schéma électrique équivalent à celui de la plante. Rs représente la résistance série de la plante, Rp la résistance parallèle et C la capacité.
Le système proposé comporte une injection électrique. La caractérisation de la zone ciblée se fait à l'aide de l'impédance complexe Z du circuit, qui comporte une résistance et une réactance. Ces composantes respectivement appelées aussi résistance réelle et résistance imaginaire dépendent de la fréquence du courant alternatif et sont fonction l'une de l'autre.
La fonction fait ressortir ce que l'on appelle une fréquence caractéristique (FC) marquant le sommet d'une parabole. Les parties réelle et imaginaire de l'impédance sont alors décrites par les formules suivantes :
- • résistance réelle :
- • résistance imaginaire :
Pour les faibles fréquences (), est négligeable devant et par conséquent , où et C sont la résistance et la capacité mesurées de la plante et ω la fréquence de mesure.
L'appareil de mesure est un LCZ-meter 2345. Il est calibré en utilisant la correction du circuit open/short pour éliminer l'impédance de polarisation de l'interface des électrodes. La capacité et la résistance sont mesurées dans une gamme de fréquences allant de 40 Hz à 100 KHz (34 fréquences). Les mesures sont saisies automatiquement par un microordinateur relié à l'appareil de mesure via une interface GBIP (IEEE 488), que nous avons programmé afin de balayer la gamme de fréquence lorsqu'on injecte le signal électrique de 1 V au moyen du LCZ-meter (un logiciel de commande et de traitement est développé pour cette étude). Pour capter le signal électrique émis par la plante, nous avons utilisé des électrodes autocollantes utilisées en électrocardiologie et jetables après première utilisation. Nous les avons découpées dans des électrodes de marque « Schiller Ag ». L'endroit servant à la connexion au LCZ-meter est laissé intact. L'électrode ainsi obtenue ressemble à une râpe à fromage de 1 cm2 de surface. La manche sert pour la connexion, par l'intermédiaire de fils livrés avec le LCZ-meter. Pour une feuille de graminée, par exemple, l'électrode est placée parallèlement à la nervure centrale. La manche et les fils de connexion vont vers le sommet de la feuille. La surface des premières feuilles de toutes les plantes testées et supérieure à 1 cm2. Ces feuilles ne présentent pas, à l'œil nu, de signes de vieillesse, qui se caractérise, comme on le sait, par un dessèchement.
2.6 Évaluation de la croissance
Les plantes qui ont servi aux mesures des paramètres électriques de l'impédance sous ces différentes conditions sont laissées se développer sous humidité élevée ou ventilation jusqu'à l'âge de 23 jours. À cet âge, nous avons mesuré la plus grande longueur (L) et la plus grande largeur (l) de la deuxième feuille, du fait de la forme ellipsoïdale de la feuille. Nous avons évalué la croissance de la plante sur la base de l'indice de vigueur (IV) de la deuxième feuille, que nous avons défini comme étant le produit des dimensions mesurées : IV (cm2).
3 Résultats
Nous mesurons donc l'impédance électrique de la première feuille d'un plant de maïs âgé de 14 jours, cultivé sous trois niveaux différents d'apport d'eau et soumis à trois types différents de conditions atmosphériques : un air calme, un air agité et un air fortement humide. L'humidité du sol constitue donc un fond commun pour les trois facteurs atmosphériques. Cependant, une première analyse des résultats nous a amenés à distinguer deux cas :
- • la culture en air calme, sans intervention externe ;
- • la culture en air à régime hydrique modifié.
Les résultats exposés ci-dessous représentent la moyenne des mesures faites sur trois plantes.
3.1 Apport d'eau et impédance électrique en air calme
Les résultats des mesures spectrométriques sont présentés sur la Fig. 5. On y remarque que si les courbes relatives aux plantes cultivées sur substrat solide se rapprochent, elles s'éloignent fortement de celles concernant les plantes cultivées en hydroponie. Le mode de culture (substrat solide ou liquide) qui donne de tels résultats serait, probablement, la cause de cette différence dans la représentation spectrométrique. Ceci résulte de la différence dans les valeurs des paramètres de l'impédance (Tableau 1). En effet, les plantes cultivées en hydroponie ont la plus grande résistance (170 kΩ) et la plus petite capacité ou accumulation de charges électriques (5,67 nF). Cet état de fait va changer totalement lorsqu'on introduit des éléments qui influencent la vitesse du courant hydroionique.

Effet du mode de culture sur l'impédance de la première feuille de maïs cultivé en hydroponie ou sur sable à 40 et 60% de la capacité de rétention maximale (CRM).
Variation des paramètres de l'impédance de la première feuille de maïs âgé de 14 jours et de l'indice de vigueur (IV) de la deuxième feuille des mêmes plantes âgées de 23 jours en fonction du mode de culture, de l'agitation de l'air ambiant et de son humidité relative. C, capacité électrique parallèle ; , résistance électrique parallèle, FC, fréquence caractéristique, CRM, capacité de rétention maximale, HRA, humidité relative de l'air élevée
| 40% CRM | 60% CRM | Hydroponie | |||||||
| (témoin) | (vent) | (HRA) | (témoin) | (vent) | (HRA) | (témoin) | (vent) | (HRA) | |
| IV (cm2) | 25,61 | 23,13 | 21,96 | 23,04 | 22,00 | 21,80 | 19,25 | 17,86 | 17,82 |
| C (nF) | 10,95 | 7,03 | 6,73 | 13,93 | 11,93 | 7,96 | 5,67 | 11,02 | 10,52 |
| (kΩ) | 97,67 | 92,27 | 167,33 | 116,20 | 13,57 | 34,00 | 170,00 | 60,27 | 29,77 |
| FC (Hz) | 600,00 | 800,00 | 600,00 | 400,00 | 2000,00 | 1000,00 | 500,00 | 1000,00 | 1000,00 |
3.2 Apport d'eau et impédance électrique en air agité ou fortement humide
En comparant l'effet de l'air agité (AA) à celui de l'air à humidité relative élevée (HRA), nous avons constaté une ressemblance dans l'aspect des spectres d'impédance. Aussi, nous regroupons sur la Fig. 6 et le Tableau 1 l'ensemble des résultats concernant ce chapitre. Il devient alors aisé de constater :
- • que les effets des deux facteurs – AA et HRA – sont similaires (comparaison horizontale) ;
- • que l'action de ces deux facteurs dépend du niveau d'humidité du milieu dans lequel poussent les racines (comparaison verticale) :
- – dans des conditions de basse humidité, les deux facteurs paraissent être des stimulants ;
- – sous humidité élevée, il y a renversement de situation, et les deux facteurs deviennent inhibiteurs.
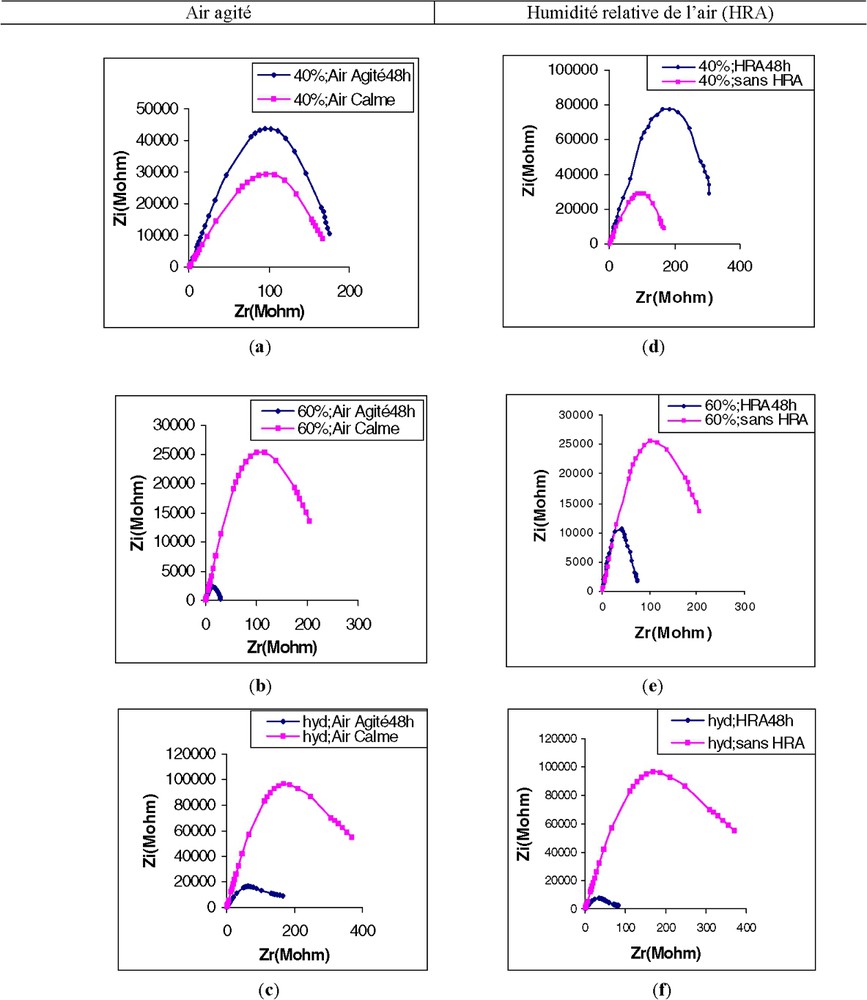
(a) Effet de l'air agité sur l'impédance de la première feuille d'un plant de maïs cultivé sur sable à 40% de la capacité de rétention maximale (CRM). (b) Effet de l'air agité sur l'impédance de la première feuille de maïs cultivé sur sable à 60% de la capacité de rétention maximale (CRM). (c) Effet de l'air agité sur l'impédance de la première feuille de maïs cultivé en hydroponie (hyd). (d) Effet d'une humidité relative de l'air élevée (HRA) sur l'impédance de la première feuille de maïs cultivé sur sable à 40% de la capacité de rétention maximale (CRM). (e) Effet d'une humidité relative de l'air élevée (HRA) sur l'impédance de la première feuille de maïs cultivé sur sable à 60% de la capacité de rétention maximale (CRM). (f) Effet d'une humidité relative de l'air élevée (HRA) sur l'impédance de la première feuille de maïs cultivé en hydroponie (hyd).
L'analyse détaillée des valeurs des paramètres de l'impédance va apporter quelques éclaircissements.
Les variations des paramètres de l'impédance, de la fréquence caractéristique et de l'indice de croissance foliaire sont reportées sur le Tableau 1 et la Fig. 7.

Relation entre les paramètres de l'impédance (capacité, résistance et fréquence) de la première feuille de maïs âgé de 14 jours et l'indice de vigueur (IV) de la deuxième feuille des mêmes plantes âgées de 23 jours en fonction du mode de culture (hydroponie, 60 et 40% de la capacité de rétention maximale – CRM –), de l'agitation de l'air ambiant (vent) et de son humidité relative (HRA).
Les données du Tableau 1 nous montrent que les facteurs atmosphériques testés inhibent la croissance et ce, quelle que soit l'humidité du « sol ». La capacité ou accumulation de charges électriques est inhibée chez les plantes cultivées sur substrat solide. Elle est, en revanche, stimulée chez les plantes cultivées en hydroponie et placées sous air agité ou soumises à une humidité relative élevée (Fig. 7). Les deux derniers facteurs, environnementaux, inhibent chez les plantes cultivées en hydroponie ou à une humidité équivalente à 60 % de la capacité de rétention maximale du sol (CRM). À 40 % et avec l'air agité est légèrement diminuée. Elle est fortement augmentée lorsque l'humidité relative de l'air est élevée. C'est ce paramètre, , qui est donc responsable de ce que nous avons appelé plus haut « un renversement de situation ». En effet, en air calme, chez les plantes cultivées en hydroponie, est de l'ordre de 170 kΩ. Elle est de 116,20 et de 97,67 kΩ chez les plantules cultivées respectivement à 60 et 40 % de la CRM du sable.
L'action du facteur « air ambiant » n'est pas la même en passant d'une humidité à l'autre. Ainsi en air agité, ce sont les plantes cultivées à 40 % de la CRM qui voient leur capacité chuter, tandis qu'en humidité relative élevée, ce sont celles cultivées à 60 % de la CRM. Ceci suppose que ce ne sont pas les mêmes structures, ni le même échange d'éléments chimiques qui sont mis en jeu dans chacun des cas. En matière de , ce sont les plantes dont le système racinaire pousse dans un milieu fortement dilué qui voient chuter leur résistance électrique foliaire. Ainsi, ces expériences nous ont permis de constater les faits suivants :
- • la résistance électrique du matériel végétal testé constitue le paramètre essentiel des coordonnées d'une courbe spectrométrique d'impédance ;
- • l'impédance capacitive augmente lorsque la culture est en hydroponie et menée dans des conditions stressantes de l'air ambiant ;
- • en air agité ou avec une humidité relative élevée, la courbe spectrométrique d'impédance est inhibée lorsque la concentration des éléments minéraux mis à la disposition de la plante est diluée ;
- • la réponse de la plante via C ou à une condition quelconque de culture ou à un stress donné est spécifique ; pour les deux stressants testés dans ce travail, la représentation spectrométrique tend à se généraliser et prend la même allure ; elle reflète l'inhibition ;
- • l'action prolongée de l'air agité ou d'une humidité relative élevée diminue la croissance foliaire du maïs, exprimée par l'indice de vigueur.
4 Discussion
Dans le présent travail, la mesure de l'indice de vigueur (IV) s'est avérée de grande utilité. Les plantes soumises à un air agité ou à une humidité relative de l'air élevée connaissent une chute de leur IV et aussi une baisse dans l'amplitude du spectre d'impédance. L'IV peut être considéré comme un indicateur de la croissance foliaire. Il est inhibé en même temps que la résistance électrique, élément essentiel du spectre d'impédance. Ceci nous a poussés à considérer que les deux facteurs d'air ambiant testés sont stressants et ont provoqué une réaction générale, rappelée par Polevoï [6], qui se traduit par une inhibition de la croissance et des propriétés électriques que nous avons mesurées. Ces propriétés sont affectées par la teneur en eau et par la propriété des espèces chimiques [13].
Polevoï [6] note, en effet, que les premières réactions des plantes aux stressants ont un caractère général et comprennent une augmentation de la perméabilité membranaire avec un flux de Ca2+, une acidification du cytoplasme, une forte dépense d'ATP, une activation des pompes à protons, une forte synthèse d'ABA et d'éthylène, un ralentissement des processus de division cellulaire et de croissance, etc.
Lorsque la plante est exposée à un air agité, elle procède à la fermeture des stomates pour diminuer les pertes d'eau. Les stomates se ferment aussi lorsque la teneur en eau de la feuille atteint la saturation. Dans ces deux cas un déficit dans les échanges gazeux a lieu et la photosynthèse se voit diminuer. Le transport des électrons est inhibé. Le rapport ATP/NADPH diminue aussi. La croissance est freinée [14–16].
En hydroponie, l'absorption des éléments minéraux et la croissance sont plus intenses que dans les cultures sur substrat solide, même si dans ce dernier cas la concentration en éléments minéraux est plus importante [1]. C'est ce qui explique, peut être, cette grande différence que nous observons dans la représentation spectrométrique d'impédance des différentes cultures en air calme (Fig. 5). Ceci explique aussi l'augmentation de la capacité ou accumulation des charges électriques, même lorsque l'humidité relative de l'air est élevée, c'est-à-dire lorsque la vitesse du courant hydroionique dans le système sol–plante–air est ralentie (Fig. 7), peut être aussi l'influence de la pression osmotique plus élevée dans le substrat solide. En effet, en hydroponie, le système racinaire est stimulé par la disponibilité en nutriments, les hormones ou la variation du pH. Ceci génère des signaux électriques à partir des racines jusqu'aux feuilles, qui font changer la transpiration et la photosynthèse [17,18].
Dans les conditions, où l'air ambiant devient plus hostile, sec ou fortement humide, l'action de chaque stressant dépend du régime hydrique précédant son avènement. Ainsi, chaque « semis » (40 ou 60 % de la CRM ou l'hydroponie) se distingue par une caractéristique :
- • l'IV le moins touché concerne les plantes cultivées à 60 % de la CRM ;
- • la valeur de la moins affectée se trouve chez les plantes cultivées à 40 % de la CRM ;
- • la valeur de C la plus spectaculaire est enregistrée chez les plantes cultivées en hydroponie.
Ceci est peut-être dû au fait que le métabolisme et les structures cellulaires sont fonction de la quantité d'eau que reçoit la plante [13]. En effet, les paramètres de l'impédance des feuilles suivent une variation saisonnière [19]. La résistance intracellulaire a diminué durant l'hiver comme résultat de l'augmentation du contenu électrolytique et de la diminution de la concentration du sucre cellulaire, alors que la résistance extracellulaire des feuilles a augmenté en automne et en hiver [20].
Cependant, dans les quatre cas de figures (Fig. 6b, c, e, f), c'est la similitude, ou l'aspect général de la représentation spectrométrique, qui est frappante. Cette similitude fait ressortir, surtout, l'agressivité de l'ambiance créée par l'air agité et l'humidité relative élevée.
5 Conclusion
Le métabolisme dépend du contenu en eau et de la quantité d'eau que peut potentiellement recevoir la plante. Ces premiers résultats sur la réaction des plantes aux conditions hydriques paraissent prometteurs. Nous suggérons l'approfondissement et la systématisation des recherches dans ce domaine, car ces techniques permettent probablement de dégager des concepts sur les mécanismes d'adaptation au stress. Il serait important de comprendre ces mécanismes pour améliorer la culture du maïs dans des conditions de stress hydrique.
Eu égard à nos données, la technique testée pourrait servir d'outil de sélection des espèces tolérantes à la sécheresse.
En cas de disponibilité d'eau pour l'irrigation, cette méthode pourrait servir aussi comme outil pour déterminer la quantité d'eau nécessaire à apporter afin d'assurer un meilleur développement des plantes.
Acknowledgments
Ce travail a été mené dans le cadre du Programme d'appui à la recherche scientifique (PARS Agro 106) du ministère de l'Enseignement supérieur du Maroc.


